DSCF6795 (2)

48
c, = y (kmol/I)
n,=
m,
M,
gdzie:
m — masa substancji rozpuszczonej (g),
M - masa molowa substancji rozpuszczonej (g/mol).
Jednostką stężenia molowego jest mol/1 lub mol/dm3. W praktyce analitycznej częściej używa się pierwszego zapisu, ze względu na jego prostotę. Litr, który jest definiowany:
1 litr =■ 1 dm3 = 10-3 m3
nie należy do podstawowych jednostek układu SI, ale jest dopuszczony do stosowania („Monitor Polski” 1976, nr 4). Do oznaczania stężenia molowego używa się symbolu „c” z indeksem wskazującym jednostkę elementarną substancji rozpuszczonej oraz wartość liczbową stężenia w jednostkach mol/1 lub mol/dm3, np. cNoOH = 0,1 mol/1 lub <^.a0H = 0,1 mol/dm3. Stosowanie używanego dawniej symbolu „M" jest nieprawidłowe, gdyż w ten sposób oznacza się masę molową substancji.
Stężenie molowe jest zależne od temperatury. W przypadkach, gdy przygotowane roztwory mogą podlegać takim zmianom, stosuje się stężenie molalne.
Stężenie molalne (mj składnika o wzorze (i) w danym roztworze jest to stosunek ilości moli tego składnika (n,) do masy rozpuszczalnika (mr) wyrażonej w kg:
m, = — (mol/kg) mr
W rozcieńczonych roztworach wodnych wartość stężenia molalnego praktycznie pokrywa się z wartością stężenia molowego ze względu na fakt, że gęstość wody jest równa ~ 1 g/cm3. Zależność ta nie jest oczywiście spełniona, gdy gęstość rozpuszczalnika wyraźnie różni się od jedności.
W obliczeniach analitycznych, szczególnie w alkacymetrii i redoksymetrii, często wygodnie jest posługiwać się stężeniem molowym wyrażonym za pomocą jednostek elementarnych odpowiadających jednemu protonowi lub jednemu elektronowi. Tego rodzaju cząstki jako równoważne sobie, nazywamy równoważnikami; np. równoważnikiem węglanu sodu w reakcji:
NajCOj + 2HC1 f* 2NaCl + HzO + C02
będzie 1/2 cząsteczki NajCOj. Stężenie molowe tej soli wyrażone w ilości moli równoważników (nl/łNłjCOj) w objętości roztworu vr zapiszemy w postaci:
“l/INl-CO, , ,
Cl/2N*,CO, — V (mol/1)
Równoważnikiem bromianu (V) w reakcji:
BrOj + 6H + + 6e Br"+3H20
będzie 1/6 cząsteczki KBr03, a stężenie molowe tego roztworu wyrazi się wzorem:
nl/6KBrO. . ,
C|,6KBrO, = y (molA)
gdzie:
ci/6kbk) “ ilość moli 1/6 cząsteczki KBr03.
Ten sposób wyrażania stężenia molowego jest analogiczny do stosowanego dawniej stężenia normalnego oznaczanego symbolem „n” lub „N”.
Sposobem wyrażania stężeń szczególnie dogodnym w pomiarach wielkości fizykochemicznych charakteryzujących substancję analizowaną, takich jak względne obniżenie temperatury topnienia, podwyższenie temperatury wrzenia, ciśnienie osmotyczne itp., jest ułamek molowy. Ułamek molowy składnika o wzorze i definiujemy jako stosunek liczby moli tego
k
składnika (nj do ogólnej ilości moli (Jjid k składników roztworu:
i-1
n,
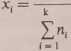
Suma ułamków molowych wszystkich składników roztworu równa jest jedności. W chemii analitycznej dość często spotyka się sposób wyrażania stężenia substancji w rozcieńczonych jej roztworach w postaci funkcji pX, która jest zdefiniowana jako ujemny logarytm (o podstawie 10) ze stężenia molowego tej substancji:
Wyszukiwarka
Podobne podstrony:
skanowanie0001 (72) Mol: jednostka liczebności substancji, to zbiór N elementów materii, gdzie N - 6
skanowanie0001 (72) Mol: jednostka liczebności substancji, to zbiór N elementów materii, gdzie N - 6
skanowanie0001 (72) Mol: jednostka liczebności substancji, to zbiór N elementów materii, gdzie N - 6
IMG 16 Pomiędzy masą i ilością substancji zachodzi związek: A/**V (2.1) gdzie p -
DSCF6776 10 gdzie: a - masa próbki (g), p - masa popiołu (g). 2. Oznaczenia, które polegają na całko
Slajd53 Natężenie pola zgodnie z piątym prawem Newtona wynosi gdzie: M - masa Ziemi, r - odległość o
Slajd7 3 Środek masy układu punktów materialnych gdzie m - masa całkowita układu:
materialylaborki�4 /tónik kształtu SI, gdy D<2d, oblicza się ze wzoru: SI = (M2/Mj)x100 gdzie: M
Prawo Newtona dla cząstki zawiesiny mdVs/dt =md2r/dt2= EFm+ZF,, gdzie: m-masa cząstki, Ys-wktor prom
m = k +1 +t 788,7
011 2 /
06 (87) •Pm. gdzie: m, - masa suchej sproszkowanej próbki do badania, w gramach; mi - masa wypełnion
(6.17) K — min CA: gdzie: C — masa jednostkowa kształtownika, k — koszt jednostkowy
metoda objętościowa: Gh = v-p-3,6. [kg/h] gdzie: m - masa dawki pomiarowej; lOOg, t - czas zużycia
1. Mol. Masa molowa. Mol substancji chemicznej jest to taka jej ilość, w której zawiera się tyle sam
gdzie: dx- gęstość związku badanego dy- gęstość wzorca Mx - masa molowa związku badanego M
więcej podobnych podstron