109493
W metodach magazynowania ciepła wykorzystuje się wiele związków lub pierwiastków, a właściwy ich dobór zależy od ich: toksyczności, palności, ceny, temperatury przemiany i trwałości. Tymi substancjami są np : woda, dowtlrerm, olej, parafina, beton, sód, aluminium, cegła, żelazo.
Materiały do magazynowania energii cieplnej dzieli się na nisko- i wysokotemperaturowe. Do materiałów niskotemperaturowych należą: sód, Ba(OH)2 8H20 (wodorotlenek baru). N2Os, n-oktazan, parafina, n-oktaden, gliceryna, LiNOj 3H20, LiCIOj 3H20 (chloran (V) litu w postaci soli trójwodnej).
Podczas reakcji chemicznych może wydzielać się ciepło (reakcje egzotermiczne) lub może być konieczne dopr owadzeni e ciepła (reakcje endotenniczne). Gdy reakcje te są odwracalne, mogą być one wykorzystane do magazynowania ciepła. Zmiany entalpii podczas reakcji są większe niż podczas przemian fazowych, stąd większe możliwości magazynowania ciepła.
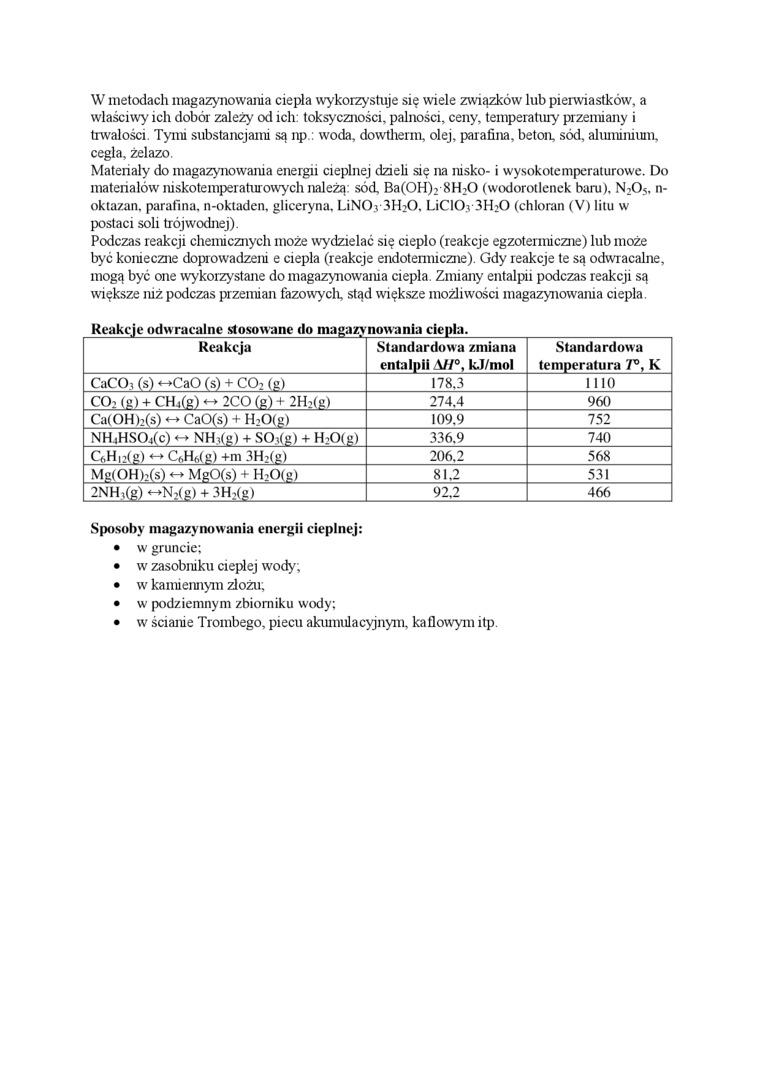
Reakcje odwracalne stosowane do magazynowania ciepłu.
|
Reakcja |
Standardowa /miana entalpii A//°, k.J/mol |
Standardowa temperatura K |
|
CaCOł (s) <-»CaO (s) + CO2 (g) |
178,3 |
ino |
|
C02 (g) + CHj(g) <-> 2CO (g) + 2H2(e) |
274,4 |
960 |
|
Ca(OH)2(s) <-> CaO(s) + H20(g) |
109.9 |
752 |
|
NHcHS04(c) <-> NH<(g) + SO,(g) + H20(g) |
336.9 |
740 |
|
C6H,2(g)«-» C„H,(e) +m 3H2(g) |
206.2 |
568 |
|
Me(OH)2(s) «-» MgO(s) + H20(e) |
81.2 |
531 |
|
2NH,(g) <->N2(g) + 3H2(g) |
92,2 |
466 |
Sposoby magazynowania energii cieplnej:
• w gruncie:
• w zasobniku cieplej wody;
• w kamiennym złożu;
• w podziemnym zbiorniku wody;
• w ścianie Trombego, piecu akumulacyjnym, kaflowym itp
Wyszukiwarka
Podobne podstrony:
skanuj0142 [1600x1200] Spektroskopia atomowaPodstawy teoretyczne W metodach spektroskopii atomowej w
Zdjęcie0554 Metoda ankietowa, którą wykorzystuje się do oceny sposobu Żywienia określonych grup 4 lu
Ekonomika i Organizacja Rolnictwa Projekt5 - metoda norm wynikowych - wykorzystu
W motywowaniu pracowników przedsiębiorstwa wykorzystuje się wiele instrumentów. Są one zbiorem metod
IMG?67 (2) 1.4.2. Plan pomiaru Na plan pomiaru składa się wiele decyzji, co do wielkości i ich miar,
których koncentruje się przewalająca część lub- rzadziej całość ich aktywności żydowej (wg. B. Fatyg
Klaudia, wiek: 16 lat » 1.Chemia kojarzy mi się ze związkami występującymi w przyrodzie. Dotyczy ich
HPIM9587 Metoda rnzci«s»w~.~- wykorzystuje się tutaj zjawisko hamowania wzrostu komo ~" drobnou
36 a nawet do 300 koron; zatakiż pokój, dalej położony, lub mniej wygodny, płaci się o wiele ta
img017 17 1. Wprowadzenie określaniu relacji wykorzystuje się - podobnie jak we wcześniej omówionych
0000019 (7) woreczki z piaskiem, sprężyny lub gumy, specjalne metalowe sandały lub też wykorzystuje
img017 17 1. Wprowadzenie określaniu relacji wykorzystuje się - podobnie jak we wcześniej omówionych
2.1 Badania metodą bąbelkową W metodzie tej wykorzystuje się dwa podstawowe zjawiska, jakimi są napi
IMGg75 wykorzystuje zatem cechy uczniów, żeby polepszyć skuteczność nauczania, i siar, się je zmieni
Konwekcja - rodzaj prostej wymiany ciepła związany z makroskopowym przemieszczaniem się mas cieczy l
więcej podobnych podstron