|
UNIWERSYTET ZIELONOGÓRSKI Wydział Inżynierii Lądowej i Środowiska Instytut Inżynierii Środowiska |
|
|
CHEMIA FIZYCZNA LABORATORIUM
|
|
III ROK INŻYNIERII ŚRODOWISKA STUDIA DZIENNE GRUPA 36 C
|
10.05.2002r.
|
|
Kinetyka chemiczna. Wyznaczenie stałej szybkości i rzędu reakcji.
TEMAT 5
AUTORZY OPRACOWANIA:
PAWEŁ BUGAŁA IZABELA JANKIEWICZ AGNIESZKA JASIŃSKA MONIKA KLECKA
|
||
CZĘŚĆ TEORETYCZNA
Szybkość reakcji definiujemy za pomocą pochodnych stężenia substratu lub produktu względem czasu:
![]()
= - ![]()
![]()
gdzie:
c - stężenie substratu,
x - stężenie produktu.
Znak minus przed pierwszą pochodną oznacza, że stężenie substratu maleje w czasie.
Szybkość reakcji jest funkcją stężenia poszczególnych reagentów A,B,C... i jeżeli reakcja jest jednokierunkowa:
![]()
![]()
= k[A]a[B]b[C]c...
![]()
to współczynniki potęgowe a,b,c są charakterystyczne dla danej reakcji i określają rząd reakcji względem danych reagentów. Suma współczynników potęgowych określa sumaryczny rząd reakcji.
Cząsteczkowość określa liczbę cząstek uczestniczących w elementarnej przemianie chemicznej, natomiast reakcja chemiczna zapisana w sposób sumaryczny za pomocą równania stechiometrycznego może przebiegać poprzez szereg przemian elementarnych. O kinetyce procesu decydują najpowolniejsze etapy, ale niekoniecznie jeden z nich, dlatego też równanie kinetyczne może przyjmować bardzo złożoną postać ze współczynnikami potęgowymi różniącymi się zasadniczo od współczynników stechiometrycznych. Tylko w przypadku prostych przemian, przebiegających, jednoetapowo, sumaryczny rząd reakcji, cząsteczkowość i suma współczynników stechiometrycznych pokrywa ją się.
Liczba cząstek biorącej udział w elementarnej przemianie jest z reguły mała, toteż i rzędy reakcji osiągają małe wartości.
Przyjmujemy, że w reakcji bierze udział tylko jeden substrat. Równanie kinetyczne dla reakcji rzędu pierwszego, drugiego i trzeciego mają wtedy postać:
- I rzędu: -![]()
k1C
- II rzędu: ![]()
k2 C2
- III rzędu:-![]()
k3 C3
Po scałkowaniu dla reakcji rzędu pierwszego:
ln![]()
gdzie ![]()
- stężenie początkowe.
Z powyższego równania można wyznaczyć czas połówkowy reakcji, tj. czas po upływie którego stężenie substratu spada do połowy wartości stężenia początkowego ![]()
:
![]()
Równania na szybkość reakcji:
- I rzędu ![]()
= k1(a-x);
- II rzędu![]()
= k2(a-x)(b-x);
- III rzędu![]()
= k3(a-x)(b-x)(c-x);
gdzie:
a,b,c - oznaczają stężenie początkowe substratów;
x - przyrost stężenia produktu;
Po scałkowaniu powyższych równań:
- I rzędu k1 = ![]()
- II rzędu k2 = ![]()
- III rzędu k3 = ![]()
W przypadku równania n-tego rzędu dla tych samych stężeń:
![]()
= kn (a-x)n.
Natomiast po scałkowaniu:
kn = 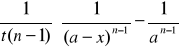
Rząd reakcji wyznacza się następująco:
⇒ Metoda graficzna
⇒ Metoda różniczkowa van't Hoffa.
⇒ Metoda całkowa
⇒ Metoda izolacyjna Ostwalda
CZĘŚĆ EKSPERYMENTALNA.
METODYKA.
Zadanie polegało na wyznaczeniu rzędu reakcji utleniania jonów Fe2+ jonami ClO3- w środowisku kwaśnym, zachodzącej według sumarycznego równania: ![]()
Etapem decydującym o kinetyce jest reakcja:
![]()
Stosowaliśmy metodę polegającą na określeniu czasu, w ciągu którego przereagował zadany ułamek substratów.
Przebieg reakcji śledziliśmy przez fotometryczny pomiar stężenia jonów Fe3+ pod postacią kompleksu rodankowego. Pomiar prowadziliśmy dla dwóch serii roztworów o różnym stężeniu początkowym , przy czym stężenia reagentów były takie same.
WYKONANIE ĆWICZENIA.
Sporządziliśmy roztwory reagentów w 0,1n HCl i umieściliśmy je w termostacie nastawionym na ustaloną z góry temperaturę. Bezpośrednio przed rozpoczęciem pomiarów zmieszaliśmy w stosunku 1:1 roztwory jonów ![]()
i ![]()
o stężeniach 0,002 mol/dm3. Z naczynia reakcyjnego pobraliśmy do kolbki 2 cm3 mieszaniny, rozcieńczyliśmy 18 cm3 0,1 n ![]()
i dodaliśmy 2 cm3 rodanku. Czas odczytu określiliśmy w momencie rozcieńczenia - następuje wtedy gwałtowne zahamowanie biegu reakcji. Dalsze pomiary wykonaliśmy przy tej samej długości fali w 10-cio minutowych odstępach. Ostatni pomiar wykonaliśmy po 20-sto minutowym odstępie. Podobnie postępowaliśmy z roztworem sporządzonym z mieszaniny ![]()
i ![]()
o stężeniach 0,004 mol/dm3. Z krzywej cechowania E( c ) dla jonów ![]()
przy λ=480nm odczytaliśmy wartości dla otrzymanych przez nas ekstynkcji.
PRZEDSTAWIENIE WYNIKÓW POMIARÓW I OBLICZENIA.
Wyniki odczytów ekstynkcji pobieranych próbek w miarę postępu reakcji i znalezionych z krzywej cechowania stężeń x jonów ![]()
przedstawiono odpowiednio w tabelach nr 1 i 2. Tabele te zawierają także wartości stężenia substratu c oraz liczby postępu reakcji x′, która jest stosunkiem x do stężenia początkowego substratu co.
Tabela 1. Wyniki pomiaru szybkości utleniania jonów ![]()
przy stężeniu początkowym co=0,004mol/dm3.
t[s]
|
0 |
600 |
1200 |
2400 |
3600 |
E
|
0,033 |
0,066 |
0,081 |
0,132 |
0,202 |
x • 105 (*) |
5,9
|
11,9 |
14,7 |
23,9 |
36,6 |
c • 104 |
39,41
|
38,86 |
38,64 |
37,61 |
36,34 |
(1/c) • 10-4 |
0,0254
|
0,0257 |
0,0259 |
0,0266 |
0,0272 |
x′ |
0,015
|
0,032 |
0,050 |
0,078 |
0,092 |
Z nachylenia prostej : k=0,286dm3 /mol x s
(*) Wartości znalezione /metodą najmniejszych kwadratów/ na podstawie zmierzonych ekstynkcji były mnożone przez 11, aby uwzględnić efekt rozcieńczenia, przy czym :
c = co- x
x′ = x/co
Tabela 2. Wyniki pomiaru szybkości utleniania jonów ![]()
przy stężeniu początkowym co=0,002mol/dm3.
T[s]
|
0 |
600 |
1200 |
2400 |
3600 |
E
|
0,017 |
0,032 |
0,050 |
0,068 |
0,079 |
x • 105 (*) |
3,09
|
5,81 |
9,08 |
12,34 |
14,34 |
c • 104 |
19,69
|
19,42 |
19,09 |
18,77 |
18,57 |
(1/c) • 10-4 |
0,0508
|
0,0515 |
0,0521 |
0,0533 |
0,0542 |
x′ |
0,015
|
0,029 |
0,045 |
0,062 |
0,072 |
Z nachylenia prostej k = 0,218dm3/mol x s
Na podstawie uzyskanych wyników sporządziliśmy wykres zależności 1/c od czasu dla obu stężeń (wykres nr1), w myśl równania reakcji II rzędu /dla równych ilości substratów, równanie [1]/
![]()
Do określenia rzędu reakcji zastosowaliśmy metodę całkową. W tym celu sporządziliśmy wykresy zależności liczby postępu reakcji od czasu. Przebiegi x′=f(t) dla obu stężeń początkowych przedstawiono na wykresie nr 2.
Z wykresu 2 odczytaliśmy wartości t1 i t2 dla dowolnej wartości liczby postępu reakcji i wstawiliśmy do poniższego równania [2]
![]()
gdzie:
a1, a2 - stężenie początkowe substratu; a1= 0,004; a2= 0,002
t1= 1780; t2 = 2700;
Stąd:
n = 1,61.
PODSUMOWANIE I WNIOSKI
Ze sporządzonego wykresu zależności [1/c] od [t] wynika, że jest spełniona liniowa zależność dla obu stężeń.
Niewielkie błędy pomiarowe mogą wynikać z niedokładnego pomiaru czasu między kolejnymi odczytami ekstynkcji.
Zauważyliśmy, iż wartość ekstynkcji kompleksu rodankowego wzrasta wraz z długością odstępu czasu (uzyskuje się większe wartości po np.50 minutach niż po np. 20 min).
Stosując metodę całkową wykorzystaliśmy pomiar czasu, w ciągu którego przereagował określony ułamek substratu. Wielkość wartości liczbowej n jest nieco mniejsza od 2 (taka wartość byłaby idealna), ale metoda ta pozwala tylko na oszacowanie rzędu reakcji, nie jest wartością rzeczywistą rzędu reakcji.
LITERATURA
Sobczyk l.,Kisza A.,Gatner K.,Koll A., „Eksperymentalna chemia fizyczna” PWN Warszawa;
2. Brdicka R., Podstawy chemii fizycznej, PWN Warszawa;
3. Danek A., Chemia fizyczna, PZWL Warszawa;
5
Wyszukiwarka
Podobne podstrony:
chem fiz kinetyka
chem fiz kinetyka
cwiczenie 4 inwertaza kinetyka reakcji enzymatycznych 05 05 2014
Ćwiczenie 10.Kinetyka reakcji, I rok, chemia
ĆWICZENIE 4 kinetyka reakcji enzymatycznej
06 Kinetyka reakcji enzymatycznych
4 Badanie kinetyki reakcji zmy Nieznany (2)
04 Kinetyka reakcji chemicznych i kataliza
chem fiz L Dok1
kinetyka reakcji enzymatycznych I
Noworyta, inżynieria bioreaktorów, równania kinetyczne reakcji
chem fiz 14 11 zad id 111352 Nieznany
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
kinetyka reakcji
15 Kinetyka reakcji 1 rzedu
więcej podobnych podstron
