1002889831
74 A. Pielesz i inni
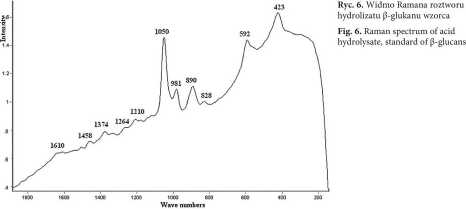
Na rycinie 6 przedstawiono analizę hydrolizatu wzorca (3-glukanów uzyskaną metodą spektroskopii Ramana.
Zgodnie z wiedzą autorów tej pracy, produktów reakcji Maillarda (hydroksyfurfurali - produktów hydrolizy kwaśnej P-glukanów) do tej pory nie identyfikowano metodą spektroskopii Ramana.
Z przeglądu literatury w zakresie polisacharydów wiadomo, że pasma Ramana występują w następujących obszarach: 1458-1464, 1363-1371, 1258-1267, 1118-1131, 1074-1084 i 1040-1048 cm"1 i przypisywane są obecności polisacharydów w analizowanych próbach [25]. Pasma w obszarze 1500-1200 cm1, a w szczególności pasma 1469, 1330 i 1285 cm"1, zgodnie z literaturą [26] dotyczą wibracji CH2, CO, COH, HCO i HCC identyfikowanych na widmie Ramana. Pasma 894-894 cm'1 oraz 865 cm*1 [26] lub wg innych autorów [27] pasma w rejonie 600-950 cm'1, dotyczą anomerycznej struktury wokół wiązań glikozydowych, w szczególności konfiguracji a i [5 głównych polisacharydów niniejszej frakcji. Obszary pomiędzy 423-425 cm'1 wskazują na obecność w próbce p-(l—>3)-glukanów, podczas gdy intensywne pasma przy częstościach 950 i 554 cm"1 dotyczą a-(l—>3)-glukanów. Identyfikowano także [28] obecność pasm amidowych białek, w tym 1667 cm'1 (amid I) oraz 1348-1354 cm'1 (amid III). Dla częstości 1657, 1417 i 940 cm-1 wskazano obecność pasm chi-tyny. Dla cukrów (1—»4)-D rozróżniono [29] izomery terminalne w pozycjach a-D i p-D przy częstościach 865-837 cm'1 a-D i 905-887 cm'1 P-D. Pasmo ok. 1605 cm'1 pochodzi od grup karboksylowych kwasów uranowych, tworzących także strukturę ściany komórkowej roślin i zbóż. Pasmo to wcześniej identyfikowano w ksylanach [30].
Na widmach Ramana w obszarze 1600-1660 cm'1 identyfikuje się (często pomiar uniemożliwia zbyt duża fluorescencja w obszarze NIR) drgania pierścieni aromatycznych [31]. Analizie polisacharydów izolowanych z materiału roślinnego towarzyszą pasma kwasów fenolowych, białek, pektyn i lignin. Pasma te uwidaczniają się w obszarze 1700-1500 cm-1 [30].
Kolejno, dokonano analizy rzeczywistych prób p-glukanów. Przedstawione na rycinie 7 próbki poddano hydrolizie w 80% H2SO4, w warunkach przedstawionych powyżej w części metodycznej.
Elektroferogramy próbek przedstawiają pojedyncze, intensywne pasma hydrolizatów p-glukanu wzorca, płatków owsianych i ziarna owsa, oraz znacznie mniej intensywne pasma boczniaka i pieczarki, świadczące o mniejszej zawartości P-glukanów w badanych próbkach. P-glukany podlegają wyraźnej migracji (wartości współczynnika retencji dla próbek płatków owsianych i ziarna owsa wynoszą Rf= 31% i są zgodne z wartością Rf wzorca p-glukanu). Obok (na ryc. 7) przedstawiono przykładową analizę półilo-ściową hydrolizatów, uzyskaną za pomocą programu GELSCAN. Obliczono powierzchnie pod pasmami hydrolizatów wzorca P-glukanu: 53%, zaś powierzchnia pod pasmem próbek płatków owsianych: 59%, co odpowiada zawartości p-glukanu ok. 8 pg w 1 pL roztworu. Jako porównanie z elektroforezą na rycinie 8 przedstawiono analizę hydrolizatów p-glukanów metodą spektroskopii Ramana.
Typowe widma hydrolizatów P-glukanów, z zachowaniem wszystkich charakterystycznych pasm hydrolizatu wzorca (przedstawione wcześniej na rycinie 6), obserwuje się dla próbek płatków owsianych i ziarna owsa. Można także stwierdzić, porównując intensywności pasm, że dostępność ściany komórkowej ziarna owsa dla kwasu siarkowego (VI) jest znacznie mniejsza, w porównaniu do możliwości penetracji kwasem płatków owsianych. Generalnie jednak profil pasm Ramana hydrolizatów p-glukanów jest podobny, co może być powodem uzyskania niejednoznacznych, dyskusyjnych wniosków.
Wyszukiwarka
Podobne podstrony:
skanuj0030 (Kopiowanie) szybkość jej transportu ma wartość stałą. Na rycinie 4.6 przedstawiono zależ
Farm1945 —----liStężenie leku jako wypadkowa procesów wchłaniania i eliminacji Na rycinie 2.7 przeds
CCF20150916�002 3. Zapoznaj się z rysunkiem i uzupełnij poniższy tekst Na rycinie przedstawiona
polega na ich wymieszaniu z popiołem elektorownianym (np. wapnem) uzyskanym metodą suchego odsiarcza
76 A. Pielesz i inni 76 A. Pielesz i inni Ryc. 9. Elektroferogram hydrolizatów (5-glukanów na płytka
PA270065 przecięcia się stycznych luków - 74%; d) pominięcie problemu-10%. Jak widać z przedstawione
skanuj0032 (Kopiowanie) V Na rycinie 4.12 przedstawiono przebieg zmian stężenia kwasu salicylowego w
152. Zjawisko archaizacji w literaturze. Przedstaw na wybranych przykładach, anali
Analiza gotowości pojazdów ciężarowych eksploatowanych w systemie ... Na rysunku 3 przedstawiono war
62 63 (16) 62 1. Spostrzeganie Na rycinie 1.13 przedstawiono schematycznie miejsce spostrzegania wśr
035 5 jest / = O oraz m = 0, chmura elektronowa ma kształt kulisty, przedstawiony na rycinie 2.5, pr
277 (25) ma. Właściwość ta nic obowiązuje w przypadku układów chaotycznych. Na rycinie 10.3 przedsta
Analiza wyników badan 50 Na rysunku 4.4 przedstawiono wartości średnich odkształceń betonu w funkcji
79 (139) OSTEOLOGIA 73 Ryc. 28. Wyrostek kruczy(processus coracoideus) Jak przedstawiono na rycinie
9 (1084) Ryc. 3. Kręgosłup szyjny Na rycinie obok badający przedstawia ogólną topografię kręgosłupa
51 (251) 46 OSTEOLOGIA Ryc. 51. Grzebień krzyżowy pośrodkowy (crista sacralis mediana) Jak przedstaw
Przedsiębiorstwo zamierza ustalić swój optymalny budżet inwestycyjny. Na podstawie odpowiednich anal
100!69 .93 T Przedstawiona na rycinie stawonóg to: j A, Felicola subrostrata I B Linognathus (sa
więcej podobnych podstron