1148442492
MIKR )©TES1
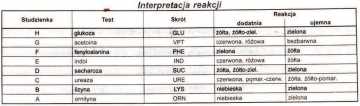
Tabela różnicująca
■ | d | - | Klebsieaa o»yloca
- -
32=z:G
aż
□ w.
1 - i - i - i -1 -1 * I
jb opóźnioną reakcję na LYS lut
Ćwiczenie 6. Wykorzystanie testu IMViC do identyfikacji rodzajowej szczepów z rodziny Enterobacteriaceae
I- wytwarzanie indolu - woda peptonowa z tryptofanem - badanie zdolności bakterii do rozkładu tryptofanu do indolu. Zawarty w podłożu tryptofan za pośrednictwem tryptofanazy przekształcany jest w indol, skatol, amoniak i kwas pirogronowy.
Przed odczytem na powierzchnię podłoża nawarstwić 1-2 krople odczynnika Ehrlicha lub Kovacsa. Powstanie ciemnoczerwonego pierścienia świadczy o rozkładzie tryptofanu.
M - próba MR - za pomocą tej próby określa się określanie typ fermentacji glukozy. Badane szczepy posiewa się na podłoże Clarka i inkubuje w 37°C przez 48-72 godzin. Po tym czasie do hodowli dodaje się kilka kropli czerwieni fenolowej. Hodowle w których bakterie zakwaszają hodowle do pH poniżej 4,5 przyjmują barwę czerwoną - wynik (+). Jeżeli hodowla ma pH wyższe niż 4,5 hodowla ma kolor żółty - wynik (-)
V- próba VP (Vogesa-Proskauera) - określanie typu fermentacji glukozy. Kwas pirogronowy powstający w komórkach bakterii w wyniku rozkładu glukozy może być przekształcony m.in. w acetoninę. Ta pod wpływem ługu, dostępie tlenu utlenia się do di acetylu, a związek ten w obecności a-naftolu daje karminowe zabarwienie. Badane szczepy posiewa się na podłoże Clarka i inkubuje w 37°C przez 48-72 godzin. Po tym czasie do hodowli dodaje się 0,5 ml 40% KOH i 0,2 ml 6% alkoholowego roztworu a-naftolu i odstawia na 15 minut. Powstanie karminowego zabarwienia świadczy o obecności acetoniny
Wyszukiwarka
Podobne podstrony:
MIKR )©TES1 Tabela różnicująca ■
skanuj0021 424 Mieczysław Malewski - Andragogika i jej metodologiczne dylematy jako dyscypliny r=; T
Tabela 1. Różnice pomiędzy marketingiem przemysłowym i konsumpcyjnym Marketing
45252 strona (283) Tabela 1.2. Różnice między reakcjami wywołanymi przez energie naturalne a zmianam
Untitled36 64__ 7. Port Tabela 7-4 różnica symetryczna instrukcje: zapis b
10POSTĘPY TECHNIKI PRZETWÓRSTWA SPOŻYWCZEGO 1/2004 Tabela 2. Różnice oznaczeń zawartości tłuszczu w
SZŻ ból w klatce piersiowej 3 Tabela 4.1. Różnicowanie ostrego bólu w klatce piersiowej (wg 3)
Tabela 2. Różnicowanie etiologii OZGM ETIOLOGIA BADANIE PODMIOTOWE BADANIE
rysunek6 W Microsoft Word - Dokumenl7 Plik Edycja Widok Wstaw Format Narzędzia Tabela Okno Pomoc
Różnicowanie śpiączek Tabela 3. Różnicowanie cukrzycowej śpiączki ketonowej i
Ciagi strV 57 Niech. ^a’ hędz e c 4g>em arytmetycznym o pierwszym wyrazie równym 3 i o różnicy ró
Tabela 1. Różnice w zastosowaniu zasady memoriałowej i kasowej [Źródło: opracowanie
0000040 (8) Tabela 0. Różnicowanie mukopolisacharydoz Nazwa schorzenia Wydalanie
więcej podobnych podstron