2906542897
(11] CYKL NUKLEOTYDOW PURYNOWYCH 179
nych preparatów. Dopiero niedawno udało się uzyskać preparat liazy adenylobursztynianowej z erytrocytów ludzkich oczyszczony 10 000 razy i stabilny podczas przechowywania przez 6 miesięcy w temperaturze 2°C w buforze zawierającym glicerol (44). Właściwości enzymów z drożdży i Neurospora crassa zostały opisane przez S. R a t n e r (47).
Najwyższą aktywność liazy adenylobursztynianowej obserwowano w mięśniach szkieletowych. Przyjmując aktywność w mięśniach szkieletowych za 100% — aktywność w mięśniu sercowym, wątrobie i mózgu wynosi 20—40%, a w erytrocytach 6% (44). Specyficzność enzymu w stosunku do adenylobursztynianu i rybonukleotydu 4-N-sukcynylokarbo-ksyamido-5-aminoimidazolowego jest dość znaczna. Prócz wyżej wymienionych substratów rozkłada on także — jakkolwiek wolniej — 2-dez-oksyadenylobursztynian i P-D-arabinozyloadenylobursztynian (48), natomiast nie rozszczepia sukcynyloadeniny i sukcynyloadenozyny (44). Reakcja katalizowana przez liazę adenylobursztynianową jest odwracalna; stała równowagi dla enzymu z drożdży w temp. 35°C, w pH 7,0 wynosi (39):
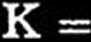
[Fumaran] [AMP] [Adenylobursztynian]
8 x 10~3 mola/1
Optimum pH obu reakcji katalizowanych przez tę liazę wynosi 7,6— 7,9 w buforze N-Tris (hydroksymetylo)metyloglicynowym i w buforze Tris/HCl (44). W tabeli 3 zestawiono wartości Km obu substratów i Ki niektórych inhibitorów tego enzymu. Jak wynika z tych danych powinowactwo enzymu do adenylobursztynianu i rybonukleotydu 4-N-sukcyny-
Tabela 3
Stałe kinetyczne liazy adenylobursztanianowej z erytrocytów człowieka (44)
|
Substancja |
K* x )0-sM |
K*x 10-5M |
|
Adenylobursztynian Rybonukleotyd 4-N-sukcynylokar- |
0,23 |
— |
|
boksyamido-5-aminoimidazolowy Rybonukleotyd 4-karboksy-5-amino- |
0,35 |
-— |
|
imidazolowy |
— |
1,0 kompet. |
|
5-AMP |
— |
0,6 kompet. |
|
Fumaran |
— |
16,0 niekompet. |
|
Sukcynyloadenina |
— |
2,7 kompet. |
|
HPO4- |
- |
48,0 kompet. |
|
Rybozo-5-fosforan |
300,0 kompet. | |
|
Asparaginian |
— |
200,0 kompet. |
|
Cytrynian |
— |
1000,0 kompet. |
|
Ryboza |
— |
nie hamuje 1 |
* Wartość pozorna.
Pomiary przeprowadzano w 0,05 M buforze N-Tris (hydroksymetylo)metyloglicynowym o pH 7.8 w temperaturze 37°C.
5*
Wyszukiwarka
Podobne podstrony:
13] CYKL NUKLEOTYDOW PURYNOWYCH 171 Dopiero w latach 70-tych Tornheim i Lowenstein uzyskali
Post. Błochem., 25, 1GS—195 (1979) WIESŁAW MAKAREWICZ *>Cykl nukleotydów purynowych The Purine
[5] CYKL NUKLEOTYDOW PURYNOWYCH 173 Tabela I Aktywność enzymów cyklu nukleotydów purynowych w
[7] CYKL NUKLEOTYD0W PURYNOWYCH 175 ność wartości Km enzymów z różnych gatunków i różnych tkane
[9J CYKL NUKLEOTYDOW PURYNOWYCH 177 Hipoksantyna + 5-fosforybozylopirofosfQran &nbs
[13] CYKL NUKLEOTYD0W PURYNOWYCH 181 Czas (mm.) Ryc. 3. Przebieg in vitro cyklu nukleotydów purynowy
[15] CYKL NUKLEOTYD0W PURYNOWYCH 183 0.5 0.4 Z 03 E "O O _D
[17) CYKL NUKLEOTYDOW PURYNOWYCH 185 V. Znaczenie metaboliczne cyklu nukleotydów purynowych Cyk
[19] CYKL NUKLEOTYDOW PURYNOWYCH 187 nacja asparaginianu (19, 26, 66). Tę drogę wytwarzania amo
[21] CYKL NUKLEOTYDOW PURYNOWYCH 189 i aminotransferazę asparaginianową. Zasadniczymi czynnikam
[23] CYKL NUKLEOTYDOW PURYNOWYCH 191 chronizowane z wahaniami stężeń NADII — co nasunęło
[25] CYKL NUKLEOTYDOW PURYNOWYCH 193 komą aktywację fosfofruktokinazy. Wzrost stężenia AMP do 2
[27] CYKL NUKLEOTYDOW PURYNOWYCH 195 60. Bodę J. C., Zelder O., Rumpelt H. J.
[5] CYKL NUKLEOTYDOW PURYNOWYCH 173 Tabela I Aktywność enzymów cyklu nukleotydów purynowych w
więcej podobnych podstron