2906543830
127



wytworzenie
pędu
kultura
komórek

wielokomórkowy kalus
pierwszy podział
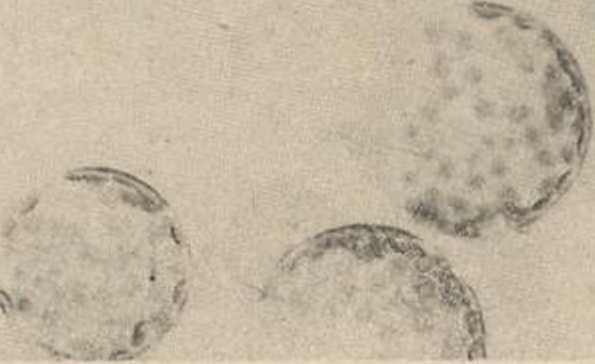
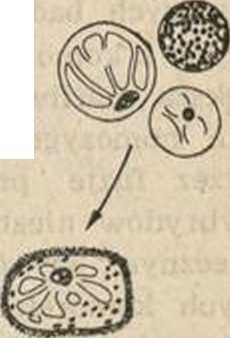
Hyc. 2. Świeżo wyizolowane protoplasty z mezofilu liści Nicotina tabacum v. Samsun
ko we. Pożywki dla protoplastów są zwykle wzorowane na tych, jakie stosuje się do hodowli in vitro komórek, wzbogacone o szereg witamin, hormonów roślinnych i jony Ca++. Natychmiast po izolacji protoplasty rozpoczynają resyntezę ściany komórkowej. Jej regenerację można łatwo obserwować po dodaniu do zawiesiny protoplastów kropli roztworu specjalnego barwnika fluorescencyjnego (Calcojluor W/iżte). Warstwa celulozy w tym środowisku fluoryzuje podczas naświetlania światłem UV przy 366 nm. Już w trakcie odbudowy ściany mogą zachodzić pierwsze podziały jądra, a pierwsze podziały komórek w ciągu jednego do kilku dni po izolacji. Początkowo procent dzielących się komórek jest niewielki, dopiero po przeniesieniu na bogatszą pożywkę wzrasta stopniowo, osiągając np. dla petunii 80—90%. Po pierwszych podziałach następują dalsze, aż w końcu powstaje wielokomórkowy kalus. Tę nieuorganizowaną masę komórek można pobudzić do wytworzenia pędów i korzeni. W 'indukowaniu organogenezy ważną rolę spełniają stężenia i proporcje określonych naturalnych . lub syntetycznych fitohormonów dodanych do pożywki. Kalus po osiągnięciu pewnej wielkości przesadza się na pożywkę zawierającą cytokininy (np. 6-benzylo-adeninę) pobudzające kaulogenezę. Gdy tylko utworzą się małe pędy, kalus przenosi się na nową pożywkę z odpowiednią ilością auksyny (np. a-NAA), hormonu wywołującego ryzogenezę, czyli powstanie korzeni. Kiedy (tą drogą utworzone rośliny zostaną przeniesione do ziemi, rozwijają się w normalne osobniki (ryc. 5).
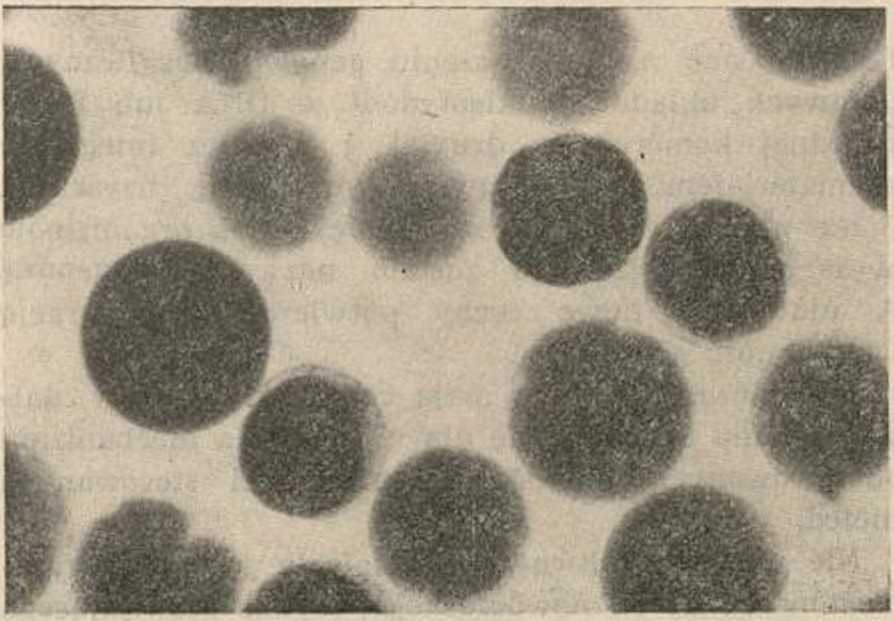
Ryc. 3. Protoplasty z płatków kwiatowych Viola tri-
color
Ryc. 4. Regeneracja mikrofibryl celulozowych ściany komórkowej na powierzchni protoplastu. Wg Grout
1975. Po w. około 64 000 X
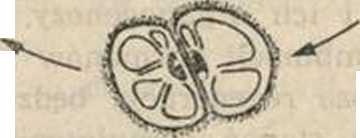
Wróćmy jednak do zagadnienia możliwości manipulacji genetycznej u protoplastów. W ostatnich kilku latach zrobiono znaczny postęp w udoskonaleniu technik in vttro dla badań transformacji genetycznej i produkcji gatunkowych hybrydów somatycznych (ryc. 6 przedstawia próbę uszeregowania tych doświadczeń). Badania nad przenoszeniem informacji genetycznej do somatycznych komórek roślinnych są prowadzone dwoma metodami: poprzez fuzje protoplastów i włączenie obcego DNA. W różnych pracach opisywane są metody izolacji i fuzji protoplastów tych samych lub różnych gatunków roślin. Pierwszym sygnałem dla głębszego zainteresowania się tym zjawiskiem było obserwowanie przez badaczy spontanicznych fuzji, zachodzących podczas izolacji protoplastów. Fuzje międzygatunkowe i międzyrodzajowe muszą być indukowane. Ryc. 7 przedstawia pobudzoną fuzję między Wicia i Pisum. Produkty takiego zespolenia nazywane są homokarionami, jeśli protoplasty pochodzą z tego samego gatunku lub heterokarionami, jeśli nastąpi zlanie protoplastów dwóch gatunków lub dwóch różnych rodzajów.
W zasadzie dla zajścia fuzji istotne jest, czy wolne protoplasty kontaktują się wystarczająco długo. Dla
ukorzenienie
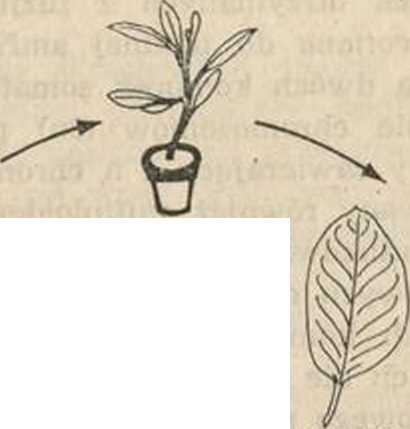
zregenerowana
roślina
odcięty liść
uwolnione
protoplasty
zregenerowana ściana komórkowa
Ryc. 5. Regeneracja protoplastów do całej rośliny
Wyszukiwarka
Podobne podstrony:
127 wytworzenie pędu kultura komórek wielokomórkowy kalus pierwszy podział Hyc. 2. Świeżo
Kultura Romów jako przedmiot badań 25 Wspominany już tutaj wielokrotnie L. Mróz pierwsze artykuły
skanuj0009 plantatu (zranieniu tkanki), co prowadzi do podziałów komórek somatycznych w kulturze&nbs
IMG400 (2) Korzystania / *wbfcl już wytworzonych (transport. kultura, oświata, usługi ’
page0368 364 się protoplazmą, przez co tworzy się ilość komórek odpowiednia jądrom. Z pierwszych jed
16164 IMGB02 (4) 96 ±Med a wytwormikraatorom współczesne/kultury ■ kulturowa uwarunkowania me^ uczuc
img067 STRUKTURY PRODUKCYJNE Wydział (oddział) produkcyjny to zbiór komórek produkcyjnych stopnia pi
IMGB11 (5) 114 Media wytworem Jwatoremwspółctesne/ kultury - kulturowe u*arUl nk0 " ai „MTV st
41962 P1200971 Północna peryferia kultury łużyckiej1 Wielokrotnie już próbowano wyznaczyć północną g
Instytut Historii, Zakład Kulturoznawstwa Grupa studencka „PIK - Pierwsze Inicjatywy
P1070503 resize
22 Michał Buchowski ków kultury z życiem społecznym. Wraz z pierwszymi tłumaczeniami publikacji zach
zdjęcie 1 Artefakty - sztuczne wytwory danej kultury organizacyjnej • komponenty i
16164 IMGB02 (4) 96 ±Med a wytwormikraatorom współczesne/kultury ■ kulturowa uwarunkowania me^ uczuc
DSC04140 414 Krzysztof Pilarczyk cedońskie (kulturowo hellenistyczne)^ Część Żydów w pierwszych lata
więcej podobnych podstron