
Elżbieta Jodkowska
Leopold Wagner
Wprowadzenie do
stomatologii
zachowawczej
2
Recenzja
prof. zw. dr hab. n. med. Jan Trykowski
Korekta
mgr Jadwiga Dobrosz, mgr Tomasz Hankiewicz
Opracowanie graficzne, DTP
mgr inż. Aleksandra Kardas
© Copyright by Bestom DENTOnet.pl 2009
Wydanie I
ISBN 978-83-927915-1-5
BESTOM DENTOnet.pl Sp. z o.o.
ul. Wigury 15a, 90-302 Łódź
tel. +48 42 637-02-77
fax +48 42 676-28-27
e-mail: bestom@bestom.pl
www.bestom.pl
3
RECENZJA
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
7
1
Przegląd współczesnych metod
oceny stanu tkanek zmineralizowanych
. . . . . . . . . . . . . . . . . . . . . . . .9
1 .1 .
Metaanaliza testów diagnostycznych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .10
1 .2 .
Inspekcja wizualna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .10
1 .2 .1 .
Międzynarodowy system wykrywania i oceny próchnicy (ICDAS) . . . . . . . . . . . . .11
1 .2 .2 .
Inspekcja wizualna wzmocniona systemem optycznym . . . . . . . . . . . . . . . . . . . . . .14
1 .3 .
Fibre Optic Trans Illumination (FOTI) i Digital Imaging Fibre Optic
Trans Illumination (DIFOTI). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .15
1 .4 .
Rentgenodiagnostyka (rtg). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .18
1 .4 .1 .
Radiografia cyfrowa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .20
1 .5 .
Badanie przewodnictwa elektrycznego (ECM) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .23
1 .6 .
Metoda impedancji spektroskopowej (EIS). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .24
1 .7 .
Tomografia komputerowa (CT). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .25
1 .8 .
Systemy wykorzystujące zjawisko fluorescencji . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .25
1 .8 .1 .
Quantitative Light Induced Fluorescence (QLF). . . . . . . . . . . . . . . . . . . . . . . . . . .25
1 .8 .2 .
Laser. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .29
1 .8 .3 .
Laserowo Indukowana Fluoroscencja (LIF). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .31
2
Etiologia i diagnostyka ubytków twardych tkanek zęba
niepróchnicowego pochodzenia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35
3
Testy ryzyka i aktywności próchnicy
. . . . . . . . . . . . . . . . . . . . . . .
49
4
Etiologia, diagnostyka i zapobieganie próchnicy wtórnej
. . . . . . . . . .
59
5
Izolacja pola zabiegu (koferdam)
. . . . . . . . . . . . . . . . . . . . . . . . .
65
6
Znieczulenia w stomatologii
. . . . . . . . . . . . . . . . . . . . . . . . . . . .
77
7
Techniki opracowywania ubytków
. . . . . . . . . . . . . . . . . . . . . . . .
89
7 .1 .
Metoda atraumatyczna ART . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .89
7 .2 .
Metoda chemo-mechaniczna. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .90
7 .3 .
Metody inwazyjne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .91

4
5
7 .3 .1 .
Metoda oscylacyjno-sonoabrazyjna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .92
7 .3 .2 .
Metoda kinetyczna-abrazja powietrzna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .92
7 .3 .3 .
Metoda hydro-kinetyczna. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .94
7 .4 .
Inne techniki opracowywania ubytków . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .94
7 .4 .1 .
Technika minimalnej ingerencji . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .95
7 .4 .2 .
Technika PRR . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .96
8
Techniki wypełniania ubytków
. . . . . . . . . . . . . . . . . . . . . . . . . . .
97
8 .1 .
Metody bezpośrednie. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .97
8 .1 .1 .
Techniki jednowarstwowe. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .97
8 .1 .2 .
Techniki warstwowe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .97
8 .1 .3 .
Techniki kanapkowe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .98
8 .1 .3 .1 .
Technika kanapkowa uproszczona (otwarta) . . . . . . . . . . . . . . . . . . . . . . . .99
8 .1 .4 .
Technika tunelowa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .101
8 .1 .5 .
Technika podwójnej gęstości. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .102
8 .2 .
Techniki pośrednie. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .103
8 .2 .1 .
Wkłady z materiałów złożonych. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .103
8 .2 .2 .
Licówka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .104
8 .2 .3 .
Korona kompozytowa. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .105
8 .2 .4 .
Most kompozytowy wzmocniony włóknem szklanym . . . . . . . . . . . . . . . . . . . . . .105
9
Metody oceny klinicznej i laboratoryjnej wypełnień
. . . . . . . . . . . .
107
11
Uwarunkowania trwałości wypełnień
. . . . . . . . . . . . . . . . . . . . .
113
11
Nadwrażliwość zębiny
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
117
12
Piśmiennictwo
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
129

6

7
Recenzja
N
ależy zwrócić uwagę na istotny fakt postępującego w ostatnich latach rozwoju
dziedzin dentystycznych w tym i stomatologii zachowawczej. Tyczy to zarówno
diagnostyki chorób twardych tkanek zęba jak i sposobów klinicznego postępowania
i leczenia. Ukazuje się szereg publikacji, które promują nowe rodzaje narzędzi oraz
nowe generacje materiałów wypełniających. Stale rosnąca zawartość zbioru aktualnych
informacji wymaga ich oceny oraz wskazań do właściwego klinicznego wykorzystywania,
przedstawionego w formie obiektywnego opracowania.
Zawarto w nim najnowsze dane o dokonującym się postępie w takich dziedzinach jak:
profilaktyka, testy diagnostyczne i terapeutyczne, testy ryzyka i aktywności próchnicy
zębów, z podkreśleniem oszczędnych sposobów opracowywania ubytków, w tym ART,
PPR, techniki tunelowej oraz tajników ich odbudowywania zapewniających właściwe
cechy estetyczne i wytrzymałościowe wypełnień. Stosowną uwagę Autorzy poświęcili
również zagadnieniom rozpoznania i leczenia ubytków nie próchnicowego pochodzenia
oraz nadwrażliwości zębów.
Autorzy poruszyli aktualne problemy oraz meritum stomatologii zachowawczej
w oparciu o najnowsze piśmiennictwo światowe oraz rodzime, w tym także o własne
wieloletnie doświadczenie kliniczne.
Zatem nowa pozycja wydawnicza stanowi cenne zródło dla środowiska akademickiego
oraz dla lekarzy praktyków, którym ułatwi podjęcie właściwego wyboru postępowania
w określonych przypadkach klinicznych. Przyjęta koncepcja zwięzłego podręcznika
pozwoliła Autorom na podkreślenie i szersze omówienie ważnych ich zdaniem zagadnień
z pozostawieniem w tle znanych i mniej istotnych.
Obecna pozycja została dobrze i logicznie zaplanowana, bez zbędnego natłoku danych.
Uważam, że nie było do tej pory podobnej w rodzimej literaturze.
Wydaje się szczególnie cenną dla studentów stomatologii oraz lekarzy dentystów
podnoszących swe kwalifikacje w ramach szkolenia podyplomowego.
Gratuluję zatem zarówno Autorom monografii jak i wydawcom.
prof. zw. dr hab. n. med. Jan Trykowski

8
Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
9
1
Przegląd współczesnych metod oceny
stanu tkanek zmineralizowanych
Podstawą diagnozowania i monitorowania procesu próchnicowego jest analiza złożonych
procesów patologicznych zachodzących w strukturze twardych tkanek zęba. W rozdziale
szczegółowo opisano metody stosowane w kariologii umożliwiające wykrycie próchnicy
we wczesnych stadiach jej rozwoju, w anatomicznych zagłębieniach i bruzdach na
powierzchniach stycznych i zmian wtórnych. Omówiono wady i zalety stosowanych
metod, ich czułość i specyficzność oraz przydatność w ocenie zmian próchnicowych.
Nowe metody diagnostyczne powinny być:
·
obiektywne,
·
ilościowe,
·
zdolne do wykrycia próchnicy w jak najwcześniejszym stadium rozwoju,
·
bardziej dokładne i precyzyjne niż obecnie stosowane metody (wyższa czułość,
specyficzność i powtarzalność).
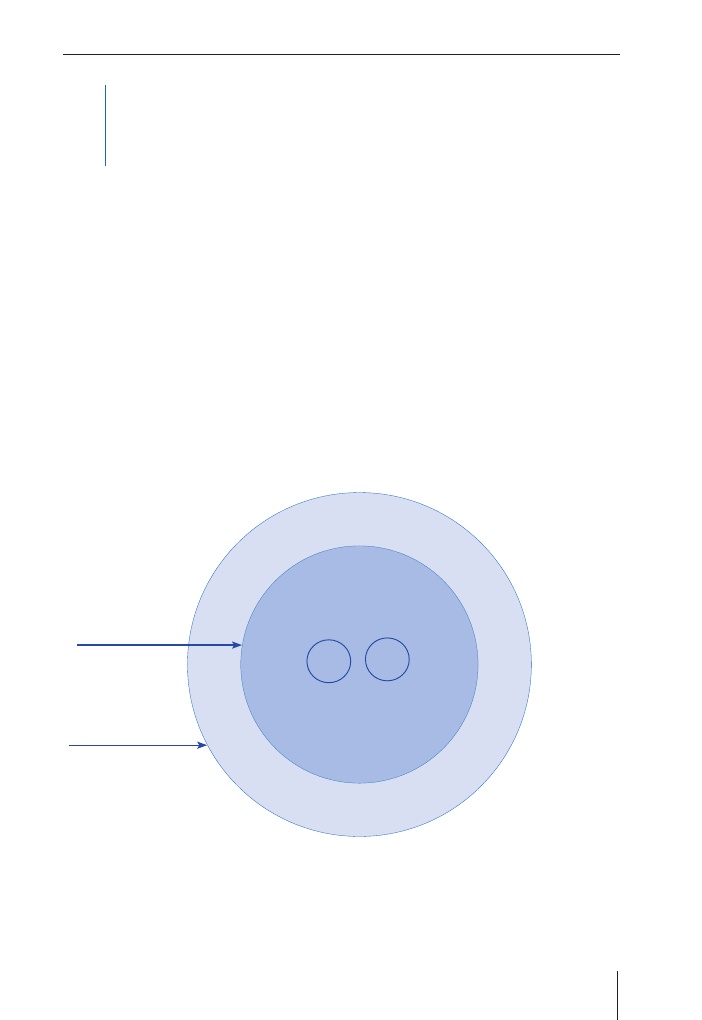
Biofilm
Ząb
Warstwa społeczna
Czynniki biologiczne
Czynniki socjoekonomiczne
Poziom wydzielania
Skład
Zdolności buforowe
Skład
Cukier
Częstość
Ślina
Drobno-
ustroje
Czas
Dieta
Uwarunkowania
genetyczne
Fluor
{
{
Dochód
Edukacja
Zachowanie
Świadomość
Poglądy
Ryc. 1.1. Schemat przedstawia współczesną wieloczynnikową koncepcję etiologii próchnicy – związek
pomiędzy czynnikami biologicznymi (wewnętrzny okrąg), a behawioralnymi i socjoekonomicznymi (lub
innymi), które wpływają na prawdopodobieństwo rozwoju ubytku na poziomie osobniczym lub populacji
(zmodyfikowane przez Fejerskov i Manji, 1990)

Rozdział 1
10
Metaanaliza testów diagnostycznych
1.1.
Testy subiektywne:
Testy obiektywne:
·
inspekcja wizualna,
·
badanie przewodnictwa elektrycznego (ECM),
·
badanie FOTI lub DIFOTI,
·
tomografia komputerowa,
·
rentgenodiagnostyka,
·
fluorescencja pod wpływem światła lasera,
·
radiografia cyfrowa.
·
QLF.
Inspekcja wizualna
1.2.
W celu prawidłowego rozpoznania zmian i ich rozmiaru posługujemy się różnymi testami
diagnostycznymi. Większość z nich to konwencjonalne badania o bardzo wysokiej
specyficzności i niskiej czułości. Skuteczność diagnostyczna jest niezadowalająca,
jesteśmy w stanie prawidłowo ocenić zdrowe tkanki twarde zęba w 87-93% przypadków,
za to prawidłowa ocena chorych tkanek nie jest jeszcze na odpowiednim poziomie.
Nadal najbardziej powszechnym testem diagnostycznym jest stosowanie lusterka
i zgłębnika, którymi oceniamy stan tkanek, rejestrując ich barwę, gładkość, przezierność
i opalizację. Są to testy subiektywne, stąd prawidłowa ocena chorych i zdrowych tkanek
zależą w dużej mierze od doświadczenia badającego, prawidłowo przeprowadzonej
metody, jak i jakości użytego sprzętu i instrumentarium.
Biorąc pod uwagę niedostateczną zdolność diagnostyczną tradycyjnego zgłębnikowania,
nawet przy niewielkim nacisku instrumentu, dochodziło do jatrogennego uszkodzenia
rozluźnionej, zdemineralizowanej powierzchni szkliwa. Jest to najszybszy sposób przejścia
zmiany całkowicie odwracalnej w nieodwracalną wskutek jatrogennego działania zgłębnika.
Badanie to jest krytycznie oceniane i nie zalecane. Podczas „zgłębnikowania” dochodzi
również do transferu mikroorganizmów z jednej badanej powierzchni na drugą. Obecnie
do badania wizualnego zaleca się użycie strzykawki wodno-powietrznej. Czułość testu
~12% przy zamkniętej powierzchni szkliwa wzrasta po powstaniu ubytku próchnicowego.
Ryc. 1.2. Uszkodzenie zdemineralizowanego szkliwa ostro
zakończonym zgłębnikiem – powstanie ubytku
(ze zbiorów Colgate Palmolive)

Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
11
Międzynarodowy system wykrywania i oceny próchnicy
1.2.1.
(ICDAS)
ICDAS przedstawia zmodyfikowane podejście do diagnozowania zmian widocznych
powierzchni zębów poprzez ocenę ich charakterystycznego wyglądu. Zdrowe szkliwo
jest translucentne i występują w nim mikropory. Po powtarzających się epizodach
demineralizacji, mikroporowatość podpowierzchownej warstwy szkliwa wzrasta, co
prowadzi do zmiany wartości refrakcji tej tkanki. Przyjmujemy, że jest to pierwsza oznaka
próchnicy, która jest widoczna po krótkim osuszeniu powierzchni zęba. Postępująca
demineralizacja powoduje dalsze zwiększanie mikroporowatości szkliwa, rozszerza
się jego ubytek i zmniejsza refrakcja. W rezultacie próchnica wczesna wygląda jak
powierzchnia pokryta śliną. Podstawowym warunkiem zastosowania systemu ICDAS jest
czysta powierzchnia zębów. Po wykonaniu pierwszej oceny, która nie wykazuje obecności
ubytku, zęby należy osuszyć sprężonym powietrzem przez 5 sekund i ponownie ocenić.
Badanie wizualne należy wspomagać użyciem okrągło zakończonej sondy.
Ekstrand i wsp. (1998) korelują nasilenie próchnicy z jej histologiczną głębokością. Biała
plama, której uwidocznienie wymaga osuszenia powierzchni zęba sprężonym powietrzem
jest najczęściej ograniczona do ½ zewnętrznej warstwy szkliwa. Głębokość białej lub
brązowej plamy, która jest widoczna bez osuszania powietrzem, jest umiejscowiona
pomiędzy ½ wewnętrzną warstwą szkliwa i ⅓ zewnętrzną zębiny. Umiejscowione
uszkodzenie szkliwa bez widocznej zębiny wskazuje na ubytek dochodzący do środkowej
⅓ warstwy zębiny. Także szary, brązowy lub niebieski odcień zębiny prześwitujący
poprzez pozornie nienaruszone szkliwo, wskazuje że ubytek rozciąga się do środkowej
⅓ warstwy zębiny.
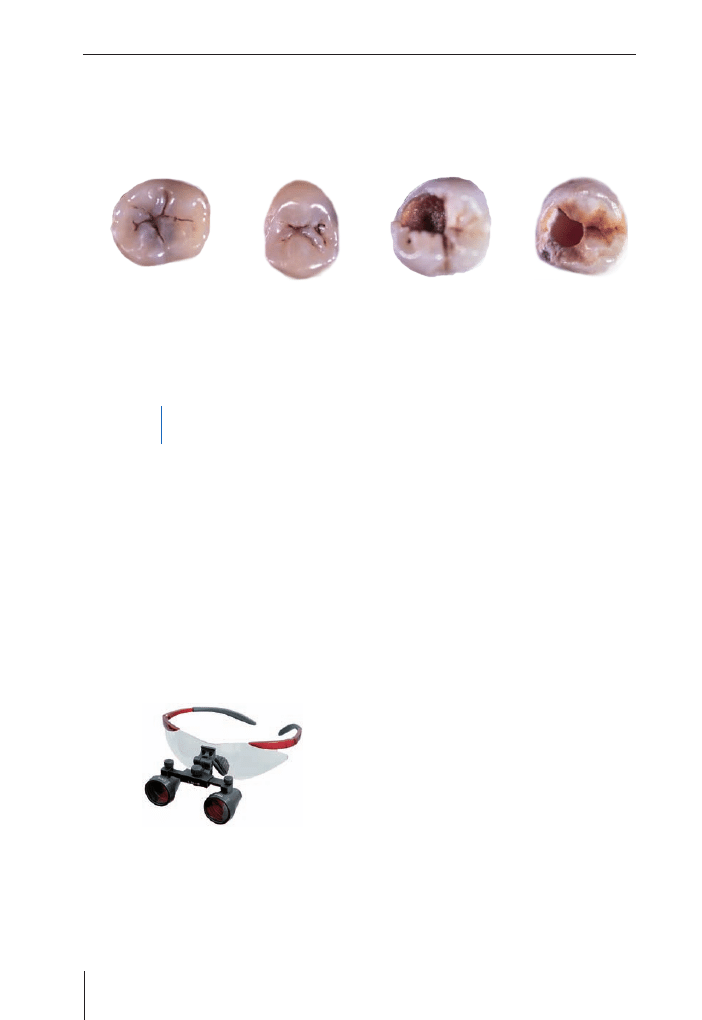
Podstawowe stopnie zaawansowania próchnicy używane
w ICDAS
Skala
0 – Brak ubytku
1 – Widoczny tylko osuszony ubytek
2 – Widoczny ubytek na wilgotnej powierzchni
3 – Umiejscowione uszkodzenie w szkliwie
4 – 3+ ściemniała zębina
5 – Wyraźny otwór + ściemniała zębina + ubytek
6 – Rozległy, wyraźny ubytek
Stopień 1
Stopień 2
Stopień 3
Stopień 4
Ryc. 1.3.
Zaawansowanie procesu próchnicowego według ICDAS (ze zbiorów Colgate Palmolive)

Rozdział 1
12
1.
Zdrowe szkliwo – stopień 0 (brak zmian lub wątpliwe zmiany w translucencji szkliwa
po 5 sekundowym osuszeniu powietrzem). Powierzchnie z obecnymi defektami szkliwa
niepróchnicowego pochodzenia takimi jak hipoplazja, fluoroza, starcie zębów (atrycja,
abrazja i erozja) oraz przebarwienia pochodzenia zewnętrznego i wewnętrznego, oznaczane
są jako zdrowe. Badający powinien też zapisać jako zdrowe powierzchnie z wieloma
przebarwionymi bruzdami i szczelinami, jeśli nie występują warunki sprzyjające próchnicy
(np. przy częstym piciu herbaty).
Ryc. 1.4. Zdrowe szkliwo – stopień 0 (ze zbiorów Colgate Palmolive)
2.
Pierwsze widoczne zmiany w szkliwie – stopień 1 – oznaczany jest dla następujących
bruzd i szczelin:
a)
Kiedy są wilgotne, brak jakichkolwiek widocznych zmian kolorystycznych charakte-
rystycznych dla aktywnej próchnicy, lecz po osuszeniu sprężonym powietrzem przez
około 5 sekund występuje ograniczenie przezierności lub przebarwienie niezgodne
z klinicznym wyglądem zdrowego szkliwa (biała lub brązowa plama).
b)
Kiedy zmiany koloru z powodu próchnicy widoczne są w suchych lub wilgotnych
bruzdach i szczelinach. Wygląd tych obszarów nie jest zgodny z przebarwionymi
bruzdami i szczelinami definiowanymi jako stopień 0.
3.
Wyraźne zmiany w szkliwie – stopień 2. Oglądany ząb musi być wilgotny. Jeżeli
obserwujemy ograniczoną przezierność (białą plamę) niezgodną z klinicznym
wyglądem zdrowego szkliwa i/lub brązowe próchnicowe przebarwienie, które jest
szersze niż naturalna bruzda/szczelina.
4.
Umiejscowione uszkodzenie szkliwa w wyniku próchnicy, bez widocznej zębiny lub
cienia pod jego powierzchnią – stopień 3. Wilgotne zęby mogą wykazywać wyraźny
brak przezroczystości (biała plama) i/lub brązowe próchnicowe przebarwienia, które
są szersze niż naturalne bruzdy lub szczeliny. Po osuszeniu przez około 5 sekund
widoczny jest ubytek próchnicowy struktury zęba z wejściem do szczeliny lub bruzdy.
Jest to oznaka demineralizacji (opakerowe, białe, brązowe lub ciemnobrązowe
ściany) u wejścia albo wewnątrz bruzdy lub szczeliny. Chociaż mogą one wyglądać

Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
13
nienaturalnie (mogą być znacznie szersze niż normalnie), zębina nie jest widoczna
na ściankach lub dnie ubytku. Jeśli mamy wątpliwości lub trzeba zweryfikować ocenę
wizualną, można delikatnie użyć zgłębnika WHO/CPI/PSR, tak aby wykryć obecność
ubytku ograniczonego tylko do szkliwa – zaokrąglony koniec sondy w obrębie bruzdy
lub szczeliny napotyka wtedy brak ciągłości tkanki.
Ryc. 1.5. Pierwsze widoczne
zmiany w szkliwie – stopień 1
(ze zbiorów Colgate Palmolive)
Ryc. 1.6. Wyraźne zmiany
w szkliwie – stopień 2
(ze zbiorów Colgate Palmolive)
Ryc. 1.7. Umiejscowione
uszkodzenie szkliwa, bez
widocznej zębiny – stopień 3
(ze zbiorów Colgate Palmolive)
5.
Podpowierzchniowy ciemny cień w zębinie z lub poza umiejscowionym
uszkodzeniem w szkliwie – stopień 4. O ubytku świadczy cień przebarwionej zębiny
widocznej poprzez pozornie nieuszkodzoną powierzchnię szkliwa, która ma, lub
nie wykazuje, umiejscowionego uszkodzenia (ubytek ciągłości powierzchni bez
uwidocznienia zębiny). Cień często jest łatwiej obserwowany, gdy ząb jest wilgotny,
może mieć kolor szary, niebieski lub brązowy. Cień oznacza próchnicę rozpoczynającą
się na ocenianej powierzchni zęba. Jeżeli w opinii badającego ubytek próchnicowy
rozpoczyna się na powierzchni przyległej, a na ocenianej nie ma objawów próchnicy,
to oznaczamy ją jako “0”. Stopnie 3 i 4 mogą histologicznie mieć zmienną głębokość,
jeden może być głębszy niż drugi i odwrotnie. Jest to uzależnione od danej populacji
i właściwości szkliwa.
6.
Ubytek z widoczną zębiną – stopień 5. Ubytek w matowym lub przebarwionym
szkliwie ujawnia leżącą poniżej ściemniałą zębinę. Po 5 sekundowym osuszeniu
wyraźnie widać utraconą strukturę zęba i otwarty ubytek wewnątrz bruzdy lub szczeliny.
Widoczna jest demineralizacja (biała, opakerowa, brązowa lub ciemnobrązowa) na
wejściu lub wewnątrz bruzdy albo szczeliny. Badający może ocenić widoczną zębinę.
Sonda WHO/CPI/PSR może być użyta do potwierdzenia obecności ubytku w zębinie.
Uwaga! przeprowadzone badania wskazują, że głęboki, drążący do miazgi ubytek nie
powinien być dotykany zgłębnikiem.
Rozdział 1
14
7.
Rozległy, wyraźny ubytek z widoczną zębiną – stopień 6. Ubytek struktury zęba jest
zarówno głęboki jak i szeroki oraz zębina jest dobrze widoczna na ścianach i na dnie.
Rozległy ubytek obejmuje co najmniej ½ struktury zęba lub sięga do miazgi.
Ryc. 1.8. Podpowierzchniowy ciemny cień w zębinie Ryc. 1.9. Ubytki stopnia 5 i 6
z lub poza umiejscowionym uszkodzeniem w szkliwie (ze zbiorów Colgate Palmolive)
– stopień 4 (ze zbiorów Colgate Palmolive)
Inspekcja wizualna wzmocniona systemem optycznym
1.2.2.
Inspekcję wzrokową można także przeprowadzić posługując się dodatkowo lupą
powiększającą, która zapewnia od 2 do 4,8-krotne powiększenie. W zależności od
rodzaju wyróżniamy lupy np.: typu Galilean (powiększenie: 2x; 2,5x; 2,6x i 3,25-krotne)
czy Prismatic (powiększenie: 3,3x; 3,8x; 4,3x; i 4,8-krotne).
Dzięki specjalnemu dwudzielnemu przegubowi istnieje możliwość dowolnych ustawień
tj. kąta nachylenia lupy względem pola zabiegowego i odległości teleskopów od szkła
okularów i ich rozstawu. Lupy typu Flip-up (uchylne) umieszczone są na plastikowej,
stalowej bądź tytanowej oprawce okularowej.
Lupy ze względu na poręczność ich
używania, dużą przydatność, poprawę
precyzji obrazu zabiegu i zwiększony
komfort pracy są sprzętem optycznym
coraz częściej wykorzystywanym przez
Ryc. 1.10. Lupa o powiększeniu 2,5 Dornwell
lekarzy dentystów.

Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
15
Fibre Optic Trans Illumination (FOTI) i Digital
1.3.
Imaging Fibre Optic Trans Illumination (DIFOTI)
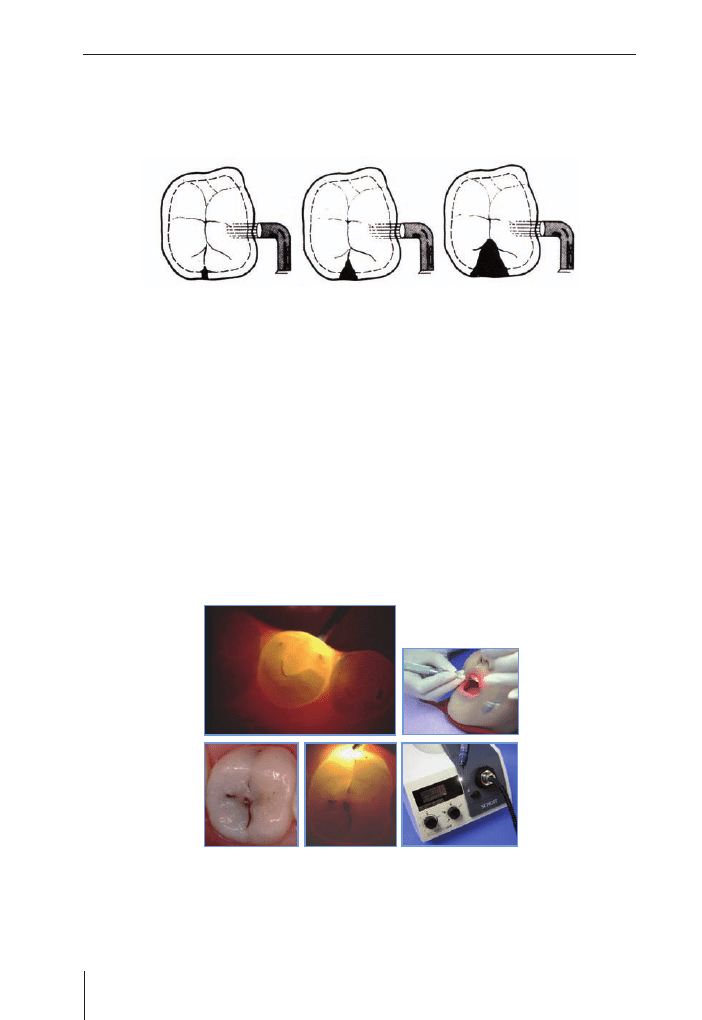
Ubytkom początkowym w postaci białej plamy towarzyszy utrata części mineralnej,
co powiększa rozproszenie światła. W starszych, przebarwionych ubytkach zwiększa
się natomiast absorpcja światła. Ząb jest oceniany poprzez widoczny od powierzchni
żującej stopień transmisji światła. Zdemineralizowana powierzchnia wygląda ciemniej
w porównaniu do otaczającej, zdrowej tkanki. Kontrast pomiędzy zdrową a próchnicową
tkanką pomaga w wykrywaniu ubytków. Wiele ostatnio przeprowadzonych badań
porównawczych FOTI, oceny wizualnej i radiologicznej wskazuje, że dentyści praktycy
są zdolni wykryć więcej ubytków na powierzchniach stycznych z FOTI niż samym
wzrokiem, z lub bez użycia aparatu rentgenowskiego.
W ocenie klinicznej transiluminacja jest rutynowo używana do:
•
identyfikacji ubytków próchnicowych we wczesnych i zaawansowanych stadiach
umiejscowionych na powierzchniach stycznych zębów przednich, trzonowych
i przedtrzonowych oraz bruzdach powierzchni żującej;
•
uwidocznienia pęknięć i innych uszkodzeń szkliwa trudnych do oceny przy bezpo-
średnim badaniu wzrokiem;
•
wykrywania i oceny rozległości kamienia nad- i poddziąsłowego;
•
oceny stanu wypełnień lub uzupełnień (obecność pęknięć lub innych defektów,
szczelności brzeżnej, jakości ostatecznego opracowania);
•
diagnostyki próchnicy wtórnej;
•
umiejscowienia komory miazgi i ujść kanałów korzeniowych;
•
wykrywania pozostawionych instrumentów w kanale korzeniowym;
•
oceny umiejscowienia połączenia szkliwno-zębinowego;
•
badania zmian patologicznych w obrębie tkanek miękkich jamy ustnej;
•
wykrywania i lokalizacji odprysków kości i odłamanych fragmentów korzeni;
•
oceny stanu higieny jamy ustnej z użyciem barwników fluoroscencyjnych (np.
Plaque-Test Vivadent).
Z uwagi na niezbyt szerokie upowszechnienie FOTI można ją traktować jako dodatkowy
test diagnostyczny. Jego czułość według Peersa nie przekracza 67%. Źródłem światła
w urządzeniach FOTI jest żarówka halogenowa o mocy 150 W. Światłowód o średnicy
2 mm na zakończeniu może być zredukowany do 0,5 mm. Zmniejszenie jego przekroju
pozwala na eliminacje tzw. poświaty utrudniającej obserwację szczegółów, jak również
ułatwia dotarcie do przestrzeni międzyzębowych. Światło padając na zdrowe tkanki
przechodzi przez nie (transmituje) dając wrażenie równego, jasnego zarysu. Natomiast
każda zmiana w tkankach lub w ich bliskim otoczeniu powoduje zaburzenie transmisji
światła, co ujawnia się w postaci cienia o różnym kształcie i wielkości. Widoczny cień
Rozdział 1
16
w kształcie małego prostokąta świadczy o próchnicy początkowej, trójkąta o rozszerzeniu
procesu, a trapezu o jego znacznym zaawansowaniu.
a
b
c
Ryc. 1.11. a, b i c – kolejne etapy rozwoju próchnicy oceniane za pomocą FOTI
Wykryte liniowe zmiany o różnej długości i szerokości świadczą o istnieniu uszkodzeń
szkliwa (pęknięcia, nadłamania), a w pobliżu brzegu dziąsłowego wskazują na obecność
kamienia nazębnego.
Sposób przeprowadzenia badania
Badanie wykonuje się przy zgaszonym reflektorze stomatologicznym, umieszczając
końcówkę światłowodu jak najbliżej ocenianej powierzchni zęba od strony przedsionka
lub jamy ustnej właściwej. Badane zęby powinny być czyste i suche. Przed badaniem
należy usunąć osady i złogi nazębne. Odczyt dokonywany jest bezpośrednio wzrokiem
lub z użyciem lusterka.
Ryc. 1.12. Badanie metodą FOTI lampą Schott KL 1800 LCD (ze zbiorów Colgate Palmolive)

Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
17
Ryc. 1.13. Transmisja światła przez tkanki zęba
Ryc. 1.14. Ustawienia lusterka i światłowodu
lampy podczas badania FOTI
• Zalety metody FOTI
W porównaniu z konwencjonalnym zdjęciem rentgenowskim jest to metoda 2-krotnie
bardziej czuła w ocenie powierzchni stycznych, 3-krotnie w ocenie powierzchni żujących
i 10-krotnie w przypadku diagnozowania powierzchni językowych i policzkowych.
Ponadto badanie jest łatwe i nieinwazyjne. Jest szczególnie przydatne u kobiet w ciąży
i przy ocenie stłoczonych zębów.
• Wady metody FOTI
Zanotowano niższą czułość metody w porównaniu ze zdjęciami skrzydłowo-zgryzowymi
(zgodność: wg Mitropoulos 98%, Sidi i wsp. 30-74%, Purdell-Lewis 34-71% oraz Stephen
i wsp. 17-22%).
• Przykładowe urządzenia stosowane w metodzie FOTI:
-
Coldite Supa Lite
-
Nova-Omnilite (Demetron)
-
Schott KL 1800 LCD
Udoskonaleniem metody transiluminacji jest metoda DIFOTI, gdzie wizualnie
obserwowane obrazy są przechwytywane przy użyciu cyfrowych urządzeń
przetwarzania obrazu (wewnątrzustna kamera CCD) i przesyłane do komputera do
analizy z dedykowanymi algorytmami. Urządzenia te są dopiero od niedawna dostępne
(np. Electro-Optical Sciences Inc, Irvington, NY) i wykonano tylko niewiele badań
oceniających ich zdolności i ograniczenia.

Rozdział 1
18
Ryc. 1.15. Kliniczne wykorzystanie metody DIFOTI (ze zbiorów Colgate Palmolive)
• Zalety metody DIFOTI
Spadek transmisji wiązki światła przez obszar zmieniony próchnicowo, prowadzi do
powstania cienia, który jest zarejestrowany i przekazany do analizy komputerowej.
Metoda ta jest zalecana do diagnozowania próchnicy powierzchni stycznych i żujących.
Skuteczność diagnostyczna DIFOTI: czułość 0,56-0,67, swoistość 0,76-0,87.
Rentgenodiagnostyka (rtg)
1.4.
Diagnozowanie próchnicy na podstawie klasycznych zdjęć rentgenowskich pozosta-
je wciąż podstawową metodą wykrywania próchnicy. Objawem próchnicy na zdjęciu
rtg jest obecność przejaśnienia w obrębie tkanek twardych zęba. Zmiana ta występuje
w kształcie nieregularnym z wyraźnie zaznaczonymi granicami. Utrata substancji mi-
neralnych o około 5% i na głębokości 0,5 mm powoduje zwiększenie przepuszczalno-
ści promieni rtg. Według Mloska i wsp. (1995) ubytki można zauważyć dopiero, gdy
demineralizacja przekroczy 40-50%. Demineralizacja tkanek twardych pozwala na wy-
krycie różnicy w gęstości optycznej zaciemnienia. Uzyskany obraz uzależniony jest od
wielu czynników, między innymi od indywidualnych cech osobniczych oraz metodyki
postępowania podczas wykonywania zdjęć radiologicznych. Inne ograniczenia wynikają
z przełożenia obrazu trójwymiarowego na dwuwymiarowy i wzajemnego nakładania się
struktur zęba i obecnych w nim procesów patologicznych, co często prowadzi do myl-
nych interpretacji.
Do diagnozowania zmian, które przekroczyły linię szkliwno-zębinową wykorzystywane
są wewnątrzustne zdjęcia zębowe, zdjęcia skrzydłowo-zgryzowe oraz zdjęcia pantomo-

Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
19
graficzne. Badanie radiologiczne mimo, że cechuje je wyższa czułość (około 45%) niż
inspekcji wizualnej, nie umożliwia jednak wykrycia wczesnych zmian próchnicowych.
Pozwala natomiast na wykrycie ubytków próchnicowych na powierzchniach stycznych
(zdjęcia skrzydłowo-zgryzowe) 4-krotnie częściej w porównaniu z badaniem wizualnym.
Swoistość tych badań sięga prawie 90%. Przydatność zdjęć rtg w diagnostyce próchnicy
powierzchni żujących budzi nadal kontrowersje. Jest to spowodowane nakładaniem się
cieni guzków przedsionkowych na językowe. Uniemożliwia to dokładne umiejscowienie
ubytku próchnicowego, ocenę jego rozległości w wymiarze przedsionkowo-językowym
oraz jego odległość od zachyłków miazgi.
Według Chłapowskiej i wsp. (1999) najwyższy odsetek ubytków na powierzchniach
stycznych od 27,1 do 96,5% wykrywa się na podstawie zdjęć skrzydłowo-zgryzowych.
O wiele mniej czuła okazała się w tych badaniach metoda transiluminacji dająca jedy-
nie 20,6% wykrywalności zmian próchnicowych, zaś badaniem wizualno-dotykowym,
zdiagnozowano tylko 17% ubytków na powierzchniach stycznych zębów trzonowych
i przedtrzonowych. Oglądanie zdjęć winno odbywać się w negatoskopie bez dostępu
światła dziennego lub sztucznego, należy zastosować co najmniej 2-krotne powiększenie
zdjęcia. Podczas interpretacji zdjęć rtg trzeba zwrócić uwagę na konieczność różnicowa-
nia zmian demineralizacyjnych z przejaśnieniem przyszyjkowym i zębiną wtórną, która
powoduje powstanie strefy mniej przepuszczalnej dla promieni rentgenowskich. Prze-
jaśnienie przyszyjkowe jest cieniem przepuszczalnym dla promieniowania i nie oznacza
patologii. Jest zlokalizowane przy szyjce zęba, ma kształt trójkątny i powstaje z powodu
różnic w przenikaniu promieni rtg przez struktury anatomiczne w tym rejonie. W oko-
licy szyjki promienie przechodzą jedynie poprzez cienką warstwę zębiny w odróżnieniu
od komory, gdzie przenikają poprzez pełną warstwę szkliwa i zębiny oraz korzenia, gdzie
przenikają przez warstwę zębiny, cementu i blaszkę kostną zębodołu. W związku z tym
w rejonie szyjki zęba jest „mniej” tkanek, przez które przechodzi wiązka promieniowa-
nia. Optycznie widoczne jest to w postaci cienia, który można pomylić z próchnicą.
Zębina wtórna charakteryzuje się mniejszą przepuszczalnością dla promieni rtg, niż zę-
bina prawidłowa. Jej obecność może sprawić, że zębina prawidłowa mająca większą prze-
puszczalność może wyglądać jak ubytek próchnicowy.
Tradycyjne zdjęcia rtg wymagają użycia:
-
kliszy,
-
aparatu rentgenowskiego,
-
wywoływarki,
-
odczynników chemicznych.
Rozdział 1
20
Istnieje wiele czynności w trakcie wykonywania tradycyjnego zdjęcia rtg, które mogą być
przeprowadzone nieprawidłowo, co doprowadza do otrzymania obrazu z artefaktami.
Jakość zdjęcia uzyskanego na kliszy zależy więc od wielu czynników.
Wady klasycznego zdjęcia rentgenowskiego:
-
koszt zakupu klisz i odczynników,
-
utylizacja odczynników chemicznych,
-
koszt wywoływania zdjęć,
-
przechowywanie i archiwizacja,
-
zorganizowanie miejsca do odczytywania zdjęć, negatoskop,
-
popełniane błędy przy wykonywaniu zdjęć w gabinecie (za długi lub za krótki
czas ekspozycji, zdjęcia prześwietlone lub niedoświetlone), nieprawidłowy proces
wywoływania zdjęć, starzenie się odczynników chemicznych, elastyczność kliszy i jej
wyginanie się podczas wywoływania prowadzą do zniekształcenia uzyskanego obrazu,
-
dawka promieniowania znacznie większa w porównaniu z systemami cyfrowymi,
-
brak możliwości wykrycia wczesnych zmian próchnicowych,
-
mało przejrzysty obraz zębów przednich,
-
trudności w ustawieniu prawidłowej projekcji,
-
niska czułość dostępnych klisz,
-
mała powtarzalność testu,
-
subiektywna ocena zdjęcia, uzależniona od doświadczenia lekarza (nie pozwala to na
jego zastosowanie do monitorowania pacjentów).
Innym rodzajem zdjęć wykonywanych w diagnostyce próchnicy są pantomogramy.
Większość autorów uważa, że skuteczność diagnostyczna zdjęć pantomograficznych
w diagnostyce próchnicy jest gorsza niż wewnątrzustnych. Możliwość rozpoznania próch-
nicy na powierzchniach stycznych zębów trzonowych i przedtrzonowych oraz siecznych
jest bardzo ograniczona, ale zaletą zdjęć pantomograficznych jest znaczne zmniejszenie
dawki promieniowania X pochłoniętej przez pacjenta w trakcie badania. Czułość testu wy-
nosi około 15-45% przy makroskopowo nienaruszonej powierzchni szkliwa.
Radiografia cyfrowa
1.4.1.
Zasadą działania systemów radiologicznych opartych na przetwarzaniu cyfrowym jest
przejście przez tkanki wiązki promieniowania, która następnie pada na receptor obrazu,
którym jest czujnik CCD (półprzewodnik krzemowy) lub płytka fosforowa. Cyfrowo
przetwarzana informacja jest następnie przedstawiana wizualnie na ekranie komputera.
Jakość obrazu jest porównywalna z otrzymanym na tradycyjnej kliszy rentgenowskiej.

Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
21
Uzyskano to dzięki:
-
zwiększeniu powierzchni aktywnej czujnika i poprawie jego rozdzielczości,
-
udoskonaleniu algorytmów przetwarzania obrazu za pomocą oprogramowania kom-
puterowego,
-
zwiększeniu sprawności działania kontrolera (urządzenia przetwarzającego sygnał
z czujnika).
Zalety systemów radiografii cyfrowej:
-
10-krotne zmniejszenie dawki promieniowania,
-
wyeliminowanie promieniowania miękkiego,
-
duża tolerancja na czas ekspozycji,
-
krótki czas otrzymywania zdjęcia (1-2 sekundy),
-
cyfrowy charakter zdjęć (przesyłanie przez Internet, programowa obróbka zdjęć,
możliwość pomiarów przestrzennych i gęstości tkanek),
-
doskonała możliwość archiwizacji i opisu zdjęć.
Zestaw do wykonywania cyfrowych zdjęć radiologicznych składa się z trzech
urządzeń:
1.
aparatu rentgenowskiego,
2.
komputera z monitorem,
3.
systemu radiologii cyfrowej (czujnik do odbioru promieni rentgenowskich
– CCD, CMOS lub płytka fosforowa, kontroler odczytujący sygnał z czujnika
lub skaner do przeniesienia informacji z detektora do komputera oraz specjalne
oprogramowanie).
Cyfrowe zdjęcie rtg otrzymane na monitorze komputera jest wynikiem współdziałania
wielu elementów. Tworzą one łańcuch. Każde ogniwo jest istotnym czynnikiem
wpływającym na jakość otrzymanego obrazu. Cyfrowe systemy radiologiczne ułatwiają
i przyspieszają prawidłową diagnozę, a krótki czas badania i bezpieczeństwo wykonywania
zdjęć, uzasadniają konieczność ich stosowania w codziennej praktyce stomatologicznej.
Obecnie dysponujemy systemami radiologii cyfrowej opartymi na różnorodnych
czujnikach promieniowania. Uzyskana jakość obrazu jest wypadkową dwóch
składowych: ostrości oraz tzw. „szumu”, zawierającego niepotrzebne dane pogarszające
odbiór diagnostyczny. W programach komputerowych przeznaczonych do radiografii
cyfrowej istnieją funkcje przetwarzania obrazu, takie jak np. wzmocnienie kontrastu
i wzmocnienie brzeżne oraz obracanie, powiększanie i zmniejszanie obrazu. Obraz
można dowolnie przetwarzać, co umożliwia wykorzystanie obrazów niedoskonałych
technicznie, które musiałyby być powtórzone przy wykonaniu tradycyjnego zdjęcia rtg.

Rozdział 1
22
Eliminuje się także błędy, jakie powstają podczas wywoływania i technicznej obróbki
kliszy. Wzmocnienie kontrastu jest funkcją, która przez zmianę poziomu skali szarości
umożliwia dostosowanie wykonanego badania do określonego celu klinicznego. Funkcja
wzmocnienia kontrastu skutecznie zwiększa wartość diagnostyczną badań w przypadku
wykrywania próchnicy początkowej na powierzchniach okluzyjnych. Funkcja ta jest
przydatna także w diagnostyce próchnicy na powierzchniach stycznych.
Funkcja pomiaru gęstości w tkankach zęba, w obrębie wypełnień i ognisk próchnicowych
pozwala na ustalenie wyraźnych granic pomiędzy tkanką zdrową, a objętą procesem
próchnicowym. Widoczne jest płynne przejście rozkładu gęstości od wysokiej do niższej,
a w ubytkach opracowanych, przejście jest skokowe.
Wzmocnienie brzeżne jest funkcją, która wyostrza obraz. Umożliwia to bardziej wyraźne
zaznaczenie granic pomiędzy ogniskiem chorobowym, a niezmienionymi strukturami
badanego zęba.
a
b
c
Ryc. 1.16. a. Skaner systemu Digora Optime (Soredex), b. Radiowizjograf Sopix (Satelec), c. Czujnik CCD
Visualix eHD (Gendex)
Badania in vivo porównujące skuteczność różnych wewnątrzustnych systemów
radiografii cyfrowej RVG, Sens-A-Ray, Visualix i systemu Digora w rozpoznawaniu
ognisk próchnicy nie wykazały statystycznie istotnych różnic. W przypadku RVG
około 5 do 10% badań może być fałszywie interpretowana przez lekarza. Współczynnik
korelacji pomiędzy mikroradiografią a radiologią cyfrową wynosi 0,6-0,8. Skuteczność
diagnostyczna wynosi: czułość 0,12-0,30; swoistość 0,90-0,96.
Szybki postęp technologiczny w tej dziedzinie pozwala mieć nadzieję na możliwość
zastosowania wymienionej metody w ocenie wczesnych zmian próchnicowych
w niedalekiej przyszłości.

Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
23
Badanie przewodnictwa elektrycznego (ECM)
1.5.
Opór elektryczny jest zjawiskiem fizycznym, które znalazło zastosowanie w diagno-
styce próchnicy. Zdrowe powierzchnie zębów nie przewodzą prądu lub przewodzą go
w sposób ograniczony. Przewodnictwo elektryczne tkanek twardych zębów zależy od ich
stopnia mineralizacji i tym samym demineralizacji. W tkankach, w których nastąpił pro-
ces demineralizacji, następuje zmniejszenie wartości oporu elektrycznego. Dzieje się to na
skutek wzrostu porowatości szkliwa i zwiększa się znacznie ilość wody w tkankach obję-
tych procesem demineralizacji. Urządzenia Electronic Caries Monitor (ECM) i Electrical
Resistance Monitor (ERM), w których stosowany jest prąd zmienny, odróżniają zmiany
początkowe od tych, które przekroczyły linię szkliwno-zębinową oraz zmiany obejmują-
ce zewnętrzną warstwę zębiny od wewnętrznej. Aparaty te mierzą stopień przewodnictwa
tkanek zmineralizowanych, których przewodnictwo wzrasta wraz ze wzrostem demine-
ralizacji. Przewodnictwo elektryczne mierzy się pomiędzy końcówką elektrody umiesz-
czoną np.: w bruździe powierzchni żującej, a elektrodą znajdującą się na podłożu o dużym
przewodnictwie np.: błonie śluzowej. Pomiar należy dokonywać w stałych warunkach
wilgotności i temperatury. Eliminacja wilgotności powierzchni zęba oraz redukcja prze-
wodnictwa dziąsła przez osuszenie, pozwala na uzyskanie bardziej powtarzalnych wyni-
ków. Procedura badania jest dość trudna i pracochłonna, ale czułość tej metody wynosi
93-96% przy swoistości testu na poziomie 71-77%. ECM zalicza się do jednego z najlep-
szych sposobów diagnozowania wczesnych zmian próchnicowych powierzchni żujących
w warunkach in vitro i in vivo oraz na powierzchniach stycznych w warunkach in vitro.
Problem diagnostyczny mogą stanowić zęby z obecnością wypełnień amalgamatowych.
Ryc. 1.17. Przykładowe urządzenie ECM i sposób pomiaru oporu elektrycznego na powierzchni żującej (ze
zbiorów Colgate Palmolive)

Rozdział 1
24
Metoda impedancji spektroskopowej (EIS)
1.6.
Obecnie trwają badania nad pomiarem oporności zębów podczas przepływu prądu
elektrycznego o zmiennej częstotliwości opierającej się na metodzie impedancji spek-
troskopowej (EIS – Electrical Impedance Spectroscopy). Oceny tej metody wskazują na
jej najwyższą skuteczność w diagnozowaniu i różnicowaniu zaawansowania procesu
próchnicowego na wszystkich powierzchniach zęba. Nie należy zapominać, że poziom
oporu elektrycznego tkanek zęba zależny jest od wielu czynników, dlatego interpretując
otrzymane wyniki, warto brać pod uwagę miejscowe i ogólne uwarunkowania pomia-
rów. Trzeba uwzględnić stopień dojrzałości i wiek badanego zęba, jego rodzaj, lokalizację
w łuku zębowym, porę roku, stopień uwodnienia czy temperaturę otoczenia. W związku
z powyższymi zależnościami uzyskane wyniki, zwłaszcza przy wykrywaniu początko-
wych zmian próchnicowych, należy interpretować ostrożnie. Stosując system EIS można
prowadzić długofalowe obserwacje zmian próchnicowych, gdyż poznawanie kierun-
ku rozwoju zmian patologicznych jest bardzo istotne w planowaniu dalszego leczenia,
a także można monitorować proces remineralizacji zmian próchnicowych po wdrożeniu
specjalnych programów profilaktycznych.
W badaniach przeprowadzonych przez Kaczmarek i wsp. (2001) ocenie poddano po-
wierzchnie gładkie usuniętych zębów trzonowych i przedtrzonowych zdrowych lub
z wczesnymi zmianami próchnicowymi. Zęby oceniano nieuzbrojonym okiem przy
3-krotnym powiększeniu oraz radiologicznie z wykorzystaniem systemu Digora. Doko-
nano także pomiarów impedancji określanej jako stosunek potencjału E-sygnału przy-
łożonego do układu (wartość znana) w odniesieniu do natężenia prądu elektrycznego
(I)-sygnału wychodzącego z układu stanowiącego wartość mierzoną. Zastosowano prąd
zmienny (o wartościach w granicach 0,5-900 000 Hz przy amplitudzie potencjału przyło-
żonego 10-50MV i amplitudzie prądu mierzonego 0,001-1µA). Dokonane pomiary wy-
kazały istnienie wyraźnych różnic pomiędzy parametrami uzyskanymi dla tkanek zdro-
wych w porównaniu do tkanek z wczesnymi zmianami próchnicowymi. Najbardziej czu-
łym i jednoznacznym wskaźnikiem zmiany próchnicowej był kąt fazowy, który dla tka-
nek zdrowych wahał się w granicach 0,82-0,96. W przypadku wczesnych zmian próch-
nicowych jego wartość obniżała się do 0,62 – co wskazuje na dużą czułość tej metody.
Z badań przeprowadzonych przez Longbottoma i wsp. (1999) wynika, że obniżanie
się oporności postępuje wraz z potwierdzonym histologicznie zaawansowaniem
procesu próchnicowego mierzonym w usuniętych zębach przedtrzonowych. Średnie
wartości impedancji mierzonej przy 300 Hz dla zdrowych powierzchni stycznych
zębów wynosiły 53,47±11 2 MΩ, dla wczesnej zmiany próchnicowej 3,72±2,58 MΩ,
a dla ubytku próchnicowego 0,31±0,18 MΩ. Przyczyną zmienności w powtarzanych

Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
25
pomiarach oporności elektrycznej zębów była temperatura i wilgotność. Wyniki badań
wskazują, że występuje zmniejszenie oporności szkliwa i zębiny zębów bydlęcych przy
wyższych temperaturach. Temperatura otoczenia podczas pomiarów stanowi istotny
czynnik, który należy uwzględniać przy porównywaniu wyników uzyskiwanych
w różnych doświadczeniach.
Współczynnik korelacji pomiędzy mikrografią a EIS w przypadku próchnicy powierzchni
żującej wynosi 0,8, a w przypadku próchnicy szkliwa od 0,65 do 0,73. Skuteczność
diagnostyczna metody wynosi: czułość 0,74-0,92, a swoistość 0,73-0,87.
Tomografia komputerowa (CT)
1.7.
Wykorzystuje zjawisko fizyczne polegające na pochłanianiu promieni rtg przez
obiekt znajdujący się na drodze promieniowania, pozwala na obrazowanie narządów
wewnętrznych pacjenta poprzez wykonywanie zdjęć warstwowych. Dzięki udoskonaleniu
techniki numerycznej opracowano systemy tomografów spiralnych i wielorzędowych.
Systemy spiralne charakteryzują się ciągłą rotacją zespołu lampy i detektorów
podczas pracy aparatu. Umożliwia to wprowadzenie objętościowej aktywacji sygnału.
Sygnał w systemie objętościowym zamiast z dwuwymiarowej warstwy zbierany jest
z bloku objętościowego, a następnie wtórnie przetwarzany na obrazy warstwowe lub
trójwymiarowe. Trójwymiarowe obrazowanie za pomocą oprogramowania Denta Scan
daje możliwość zobrazowania każdego przekroju. Urządzenia CT dostarczają obrazy
wykonane przez 1 mm warstwy struktury, z dokładnością do 0,1 mm przy wysokiej
rozdzielczości kontrastowej (około 0,2%). Bardziej zaawansowaną metodą, której zasada
działania oparta jest z kolei na zjawisku optycznym, jest polaryzacyjna, spójna tomografia
optyczna PS-OCT (ang. Polarization Sensitive Optical Coherence Tomography).
Systemy wykorzystujące zjawisko fluorescencji
1.8.
Quantitative Light Induced Fluorescence (QLF)
1.8.1.
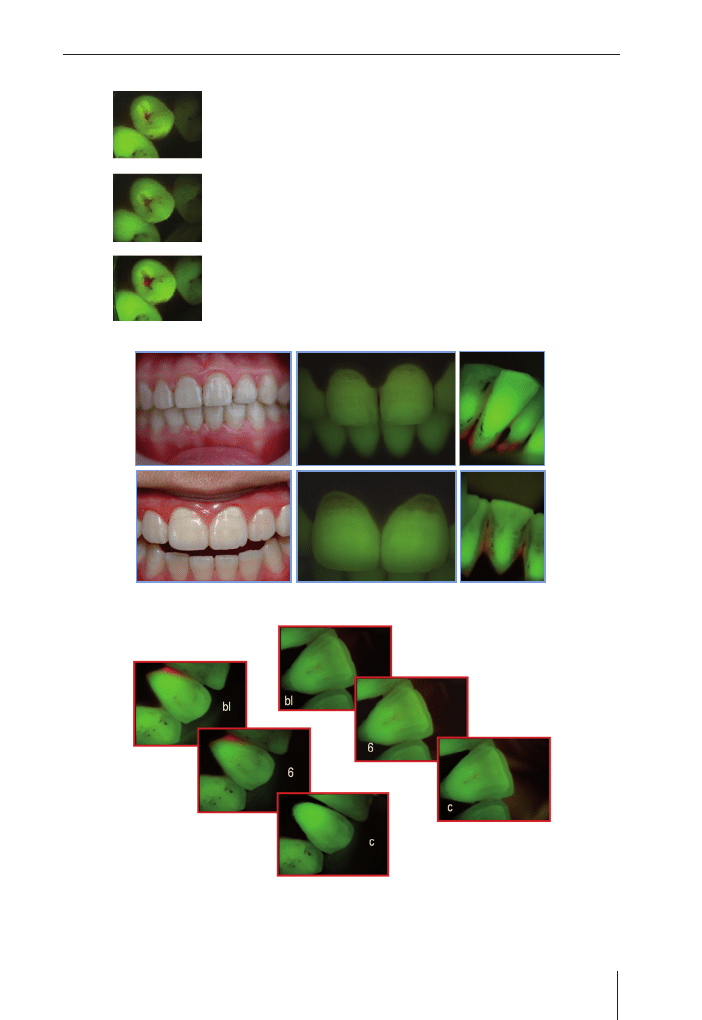
QLF – ilościowa indukowana światłem fluorescencja jest nową i bardzo czułą metodą do
określania krótkoczasowych zmian w ubytkach zębów w jamie ustnej. Metoda ta oparta
jest o zjawisko fluorescencji. Kiedy zęby są oświetlone światłem niebieskim o wysokiej
intensywności to zaczynają emitować światło w zielonej części widma. Fluorescencja
zęba ma bezpośredni związek z zawartością mineralną szkliwa. QLF emituje silną wiązkę
światła w zakresie niebieskim, która następnie przechodzi przez krótki przewód do jamy
ustnej. Kamera wewnątrzustna wyposażona w odpowiedni filtr przekazuje fluorescen-
cyjne obrazy do komputera. Ostatnia modyfikacja tej metody pozwala też na ilościo-

Rozdział 1
26
wą ocenę płytki, kamienia, przebarwień i stanu higieny jamy ustnej. QLF™ to doskonałe
narzędzie używane w zapobieganiu pojawienia się próchnicy. QLF™ może być używa-
ny jako produkt testowy, w praktyce klinicznej, edukacji i pracach badawczych. Jest to
stosunkowo prosty i efektywny sposób ujawnienia ubytku próchnicowego w zębie – na
długo przed potrzebą leczenia zachowawczego.
QLF™ – zestaw kliniczny jest przenośną kamerą wewnątrzustną podłączoną do kom-
putera. Dzięki temu zestawowi ubytki początkowe szkliwa na powierzchniach języ-
kowych, policzkowych i żujących mogą być ilościowo oceniane w warunkach in vivo
w określonym przedziale czasu, odnośnie ich głębokości i wielkości. Zęby są oświetlane
niebieskim światłem, a obraz jest uzyskiwany przy pomocy żółtego filtra. W ten spo-
sób rejestrowane są fluorescencyjne obrazy obszarów zęba. Fluorescencja pochodząca
od białej plamy wygląda jak ciemna plama. Wskazuje to, że różnica pomiędzy zdrowym,
a uszkodzonym szkliwem jest znacząco wyraźniejsza w obrazie fluorescencyjnym niż
w świetle białym, tym bardziej, że nie jest tu widoczne połyskujące światło odbite, co
czyni obliczenia wykonane przez komputer bardziej wiarygodnymi. Metoda ta była też
używana w mniej rozległych badaniach klinicznych, których wyniki wskazują, że jest
techniką bardzo czułą na małe zmiany w głębokości i wielkości ubytku. W skład zestawu
wchodzi sonda pomiarowa, jednostka sterująca i odpowiednio skonfigurowany kompu-
ter do wprowadzania i rejestracji kadrów. Jednostka sterująca składa się ze źródła światła
i układów elektronicznych do przetwarzania obrazu. Źródłem światła jest ksenonowa
lampa łukowa. Światło z tej lampy przechodzi przez niebieski filtr transmisyjny. Giętkie
włókno światłowodowe przewodzi niebieskie światło do jamy ustnej. Lusterko denty-
styczne zapewnia jednolite oświetlenie obszaru, który ma być zarejestrowany. Rejestracja
fluorescencyjnego obrazu odbywa się poprzez żółty filtr transmisyjny, umiejscowiony
przed czujnikiem-matrycą CCD. Kombinacja filtrów niebieskiego i żółtego optymalizuje
obraz video w taki sposób, że jest on zupełnie wolny od odblasków. Obraz po wprowa-
dzeniu i rejestracji kadrów jest przetwarzany cyfrowo oraz dostępny do analizy ilościo-
wej przy pomocy oprogramowania QLF.
Ryc. 1.18. Ząb w świetle sztucznym i jego obraz fluorescencyjny – widoczna demineralizacja
(ze zbiorów Colgate Palmolive)
Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
27
QLF – zasady
• Wykorzystanie zjawiska fluorescencji zębów wskazuje na
obecność próchnicy
• Utrata zielonej fluorescencji wskazuje na demineralizację
• Obecność czerwonej fluorescencji wskazuje na obecność bakterii
i może być wskaźnikiem aktywności
• Obrazy są nagrywane w celu dokonania późniejszych porównań
Ryc. 1.19. Obraz fluorescencyjny powierzchni żującej, zdjęcia
wykonano w różnych odstępach czasu (ze zbiorów Colgate Palmolive)
Ryc. 1.20. Fluorescencyjny obraz osadów nazębnych (ze zbiorów Colgate Palmolive)
Ryc. 1.21. Archiwizacja zapisanych cyfrowo obrazów i możliwość późniejszego ich porównania (ze zbiorów
Colgate Palmolive)

Rozdział 1
28
Oprogramowanie QLF™ umożliwia łatwe przeniesienie zarejestrowanych w warunkach
in vivo obrazów fragmentów zęba do komputera. Uzyskane obrazy są pokazywane
w czasie rzeczywistym na ekranie monitora komputera. Używanie zoptymalizowanego
zapisu sekwencji oraz ocena wszystkich powierzchni w jamie ustnej trwa kilka minut.
Ryc. 1.22. Demineralizacja i remineralizacja określonych obszarów zębów widoczna w świetle dziennym
i fluorescencyjnym (ze zbiorów Colgate Palmolive)
Półautomatyczna technika jest używana do określenia wielkości i głębokości ubytku na
podstawie obrazu zęba. Oprogramowanie jest zaopatrzone w kilka narzędzi, by zarządzać
bardzo dużymi bazami danych wielu pacjentów.
Najbardziej istotne parametry oprogramowania:
·
obszar ubytku (w mm
2
),
·
głębokość ubytku wyrażona w % utracie fluorescenecji (DF w %),
·
objętość ubytku (DQ w %).
Wyniki badań z zastosowaniem systemu QLF wykazały wysoką zależność pomiędzy
obrazem fluoroscencji rejestrowanej na powierzchniach gładkich ze zmianami
próchnicowymi, a stopniem demineralizacji tkanki. Średni spadek natężenia
fluoroscencji dla obszarów objętych próchnicą (sięgających 17 μm) wyniósł 17,6%
w porównaniu z tkanką prawidłową. System QLF może być stosowany nie tylko do
oceny stanu obserwowanych powierzchni, ale również w badaniach oceniających
skuteczność wdrażanych programów profilaktycznych np.: w przypadku monitorowania
tempa remineralizacji początkowych zmian próchnicowych powstałych pod zamkami
ortodontycznymi na gładkich powierzchniach zębów. Skuteczność diagnostyczna:
czułość 0,49-0,98; swoistość 0,67-1.

Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
29
Laser
1.8.2.
W diagnostyce laserowej wykorzystuje się zjawisko fluorescencji. Zasada pomiaru polega na
badaniu fluorescencji twardych tkanek zęba przy założeniu, że tkanki zdemineralizowane
w świetle czerwonym wykazują silniejszą fluorescencję w zakresie powyżej 680 nm.
Przyczyną zwiększonej fluorescencji są według Hibsta (1999) metabolity drobnoustrojów
np.: Bacteroides intermedius, syntetyzujące endogenne protoporfiryny, z których potem
następuje emisja promieniowania o wysokiej długości fali, widoczna jako fluorescencja
w kolorze różowym. Pod wpływem wiązki laserowej dochodzi do krótkotrwałego
pobudzenia i przejścia cząsteczek molekularnych na wyższy stan energetyczny. Przejście
do stanu podstawowego, czyli spoczynku, jest możliwe dopiero po oddaniu części energii
kinetycznej i ciepła do otaczającego środowiska. Część tej energii jest emitowana w postaci
fluorescencji, czyli promieniowania świetlnego. Po naświetleniu zęba światłem lasera
argonowego o długości fali 488 nm uzyskujemy fluorescencję tkanek zdrowych na poziomie
540 nm. Fluorescencja poniżej tej długości wskazuje na początkową demineralizację
powierzchni gładkich, bruzd lub szczelin. Wprowadzenie barwnika fluorescencyjnego oraz
filtrów pozwala na wykrycie demineralizacji na poziomie 5-6 μm.
W zależności od stopnia demineralizacji i zmian próchnicowych wyniki uzyskane
w toku analizy fluorescencji ulegają zmianie, co automatycznie jest podawane na ekranie
urządzenia. Źródłem światła jest dioda laserowa, natomiast do detekcji służy fotodioda
sprzężona z filtrem pasmowo-przepustowym. Prowadzone przez centralnie ułożone wiązki
światłowodu, światło laserowe, trafiając na tkanki, które uległy demineralizacji tzn. stały
się bardziej niejednorodne, ulega między innymi silniejszemu rozproszeniu w stosunku
do tkanek zdrowych. Powracające fale remisyjne są najpierw segregowane poprzez
filtr pasmowo-przepustowy, a związane z fluorescencją tkanek zdemineralizowanych
ulegają odpowiedniemu wzmocnieniu i modulacji. Natężenie fluoroscencji wzrasta
wraz ze stopniem demineralizacji. Im większe zmiany patologiczne, tym większa remisja
fluorescencji z powrotem do urządzenia poprzez odśrodkowe wiązki światłowodowe
umieszczone w rękawie DIAGNOdentu. Analiza natężenia pozwala na ustalenie zasięgu
toczącego się procesu patologicznego.
Ryc. 1.23. a. DIAGNOdent (KaVo), b. Końcówki diagnostyczne, c. Badanie powierzchni żującej

Rozdział 1
30
Oprócz danych cyfrowych wyświetlanych na ekranie DIAGNOdentu od 0 do 99 możemy
na różnych poziomach głośności ustawić sygnał akustyczny, przy czym 0 wskazuje
wartość minimalną, a 99 wartość maksymalną światła fluorescencyjnego. Poprzez zmianę
głośności sygnału zmieniającego się wraz z zaawansowaniem procesu patologicznego
możliwe jest szybkie i proste wykrycie minimalnych i maksymalnych zmian w strukturze
szkliwa i zębiny.
Wartość odczytu wskazuje na:
·
poniżej 10 – brak ubytku,
·
pomiędzy 10-20 – obecność przebarwień lub próchnicy szkliwa,
·
powyżej 35 – obecność próchnicy w zębinie,
·
99 – ubytek wewnątrz zębiny,
·
pomiędzy 20-35 istnieje konieczność indywidualnej oceny.
Zalety:
-
wysoka skuteczność i czułość wynosząca ~90%, powtarzalność testu (współczynnik
korelacji Spearmana = 0,97, dla porównania badanie: zgłębnikiem 12%, rtg 15-40%,
FOTI 35-70%, a ECM 83%;
-
dokonywane analizy nie uszkadzają tkanek;
-
możliwość oceny zmiany ilościowej i jakościowej (pozwala na stwierdzenie czy zmiana
jest odwracalna czy nie);
-
kontrola miejsc trudno dostępnych. Korzyści np. w inspekcji bruzd na powierzchni
żującej, ewentualne inwazyjne leczenie może być tylko punktowe, bez potrzeby
włączania całej powierzchni);
-
sprawdzenie szczelności brzeżnej wypełnień;
-
nieobciążanie pacjenta szkodliwym promieniowaniem rtg.
Skuteczność diagnostyczna: czułość 0,46-0,87; swoistość 0,72-0,98.
Korelacja między odczytami DIAGNOdentu, a określoną histologicznie głębokością
zmiany wynosi 0,85. Badania zmian na powierzchni zgryzowej wykazały wyższość po-
miaru laserowego nad zdjęciami skrzydłowo-zgryzowymi, niosącymi ryzyko postawie-
nia diagnozy fałszywie pozytywnej, która może skutkować niepotrzebnym leczeniem
zęba (Shi i wsp. 1999 i 2001). Jednak dane uzyskane za pomocą DIAGNOdentu, tak jak
i zdjęć rtg, należy zawsze rozpatrywać łącznie z oceną kliniczną, ponieważ same odczyty
urządzenia nie są wystarczające do postawienia diagnozy – musi istnieć korelacja z sytu-
acją kliniczną i dopasowaniem ryzyka pacjenta.
W ostatnich latach przeprowadzono wiele badań w warunkach in vitro i kilka in vivo
w celu oceny DIAGNOdentu. Ich wyniki wskazują, że urządzenie jest zdolne do wy-
krywania względnie zaawansowanych ubytków próchnicowych z bardzo silną korelacją
pomiędzy jego odczytami i histologicznymi oznakami próchnicy, lecz nie dotyczy to głę-

Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
31
bokich ubytków wewnątrz zębiny. Badania te wykazały także doskonałą powtarzalność
i dobrą, do wręcz znakomitej, czułość DIAGNOdentu. Stwierdzono jednak, że odczyty
urządzenia mogą być zakłócane przez wiele czynników np.: stopień odwodnienia ubyt-
ku, obecność płytki nazębnej oraz różnych rodzajów przebarwień w bruzdach i szcze-
linach na powierzchni żującej. Uzyskane w warunkach klinicznych wyniki wskazują
także na znaczące różnice w odczytach pomiędzy różnymi urządzeniami DIAGNOdent
w ocenie próchnicy powierzchni żującej. Rodzi to pytanie – czy wartość odczytu 20 lub
25 wskazuje na obecność próchnicy? Odczyty DIAGNOdentu wzrastają liniowo, ade-
kwatnie do stanu histologicznego, zatem urządzenie jest w stanie z dobrą czułością od-
różnić pomiędzy zdrową strukturą zęba, a płytką próchnicą szkliwa, głębokim ubytkiem
próchnicowym w szkliwie, a ubytkiem rozciągającym się do zębiny. Jednak ostatnio
przeprowadzone badania nie potwierdziły odczytów relatywnych do wartości zasięgu
ubytku wcześniej obserwowanego. Eakle i wsp. (1996) stwierdzili, że urządzenie jest bar-
dzo dobre do wskazywania obecności głębokiego ubytku w szkliwie lub zębinie, nawet
jeszcze niewidocznego na zdjęciach rtg, lecz jest niezdolne do wiarygodnych wskazań
w głębokich ubytkach w zębinie.
Urządzenie DIAGNOdent jest szczególnie użyteczne do wykrywania próchnicy na po-
wierzchniach żujących. Po użyciu „tępego” zgłębnika do usunięcia zanieczyszczeń z bruzd
i szczelin powierzchni żującej, DIAGNOdent jest zdolny do potwierdzenia obecności lub
braku próchnicy w podejrzanych obszarach. Odczytuje ponad 20-25 odbić prawdopo-
dobnej obecności próchnicy oraz więcej odczytów ogólnie odzwierciedlających bardziej
zaawansowany postęp ubytku, chociaż, nie wykazuje liniowej zależności pomiędzy od-
czytem, a zasięgiem ubytku. Należy zaznaczyć, że jest on użyteczny do identyfikacji ubyt-
ków wczesnych, które powinny być raczej rozważane do postępowania zapobiegawczego
niż zabiegowego (Eakle WS – Early detection of Dental Caries 3
rd
edition).
1.8.3.
Laserowo Indukowana Fluoroscencja (LIF)
LIF umożliwia wykrywanie próchnicy początkowej na powierzchniach gładkich
i w bruzdach w bardzo wczesnym stadium (np. lampa DLS-1405, która składa się z bez-
przewodowej rękojeści i stacjonarnej ładowarki). Czułość urządzenia jest bardzo duża,
wykrywa zmiany w szkliwie na poziomie 8μm (metoda radiologiczna dopiero rzędu
50μm). Lampa wykrywa także mikroprzenikanie bakterii (mikroprzeciek) wokół nie-
szczelnych wypełnień. Jest urządzeniem bardzo przydatnym przy opracowaniu ubyt-
ków, ułatwiając ocenę stanu usunięcia próchnicy. Daje także możliwość oceny ognisk
demineralizacji w miejscach po usunięciu zamków ortodontycznych.
W badaniach przeprowadzonych przez Pużyńskiego i wsp. (2005) (119 dzieci – 2562 zę-
bów) metodą tradycyjną stwierdzono próchnicę w 457 zębach tj. 17,8%, a wykorzystując
lampę DLS-1405, w 34,9% (893 zęby objęte próchnicą).

Rozdział 1
32
Tab. 1. Zdolność rozpoznawania zębów zdrowych (specyficzność) i czułość różnych metod diagnozowania
próchnicy na powierzchni okluzyjnej (za Lussi i wsp. 2003)
Zęby bez zmian próchnicowych lub z próchnicą szkliwa
Specyficzność (%)
Wzrokowo
93
Wzrokowo i przy użyciu zgłębnika
93
Wzrokowo i przy użyciu lupy
89
Zdjęcia skrzydłowo-zgryzowe
83
Wzrokowo i zdjęcia skrzydłowo-zgryzowe
87
Zęby ze zmianami próchnicowymi w obrębie zębiny
Czułość (%)
bez ubytku
z ubytkiem
Wzrokowo
12
62
Wzrokowo i przy użyciu zgłębnika
14
82
Wzrokowo i przy użyciu lupy
20
75
Zdjęcia skrzydłowo-zgryzowe
45
79
Wzrokowo i zdjęcia skrzydłowo-zgryzowe
49
90
Tab. 2. Powtarzalność systemu laserowego i pomiar oporu elektrycznego w porównaniu z tradycyjną metodą
diagnozowania próchnicy na powierzchni okluzyjnej. Kappa > 0,75 – bardzo dobra zgodność; a < 0,75:
wystarczająca/dobra zgodność (za Lussi i wsp. 2003)
Inspekcja (praktyk, in vitro)
wartość Kappa
0,49
Skrzydłowo-zgryzowe rtg (praktyk, in vitro)
wartość Kappa
0,55
DIAGNOdent (badacz, in vitro)
wartość Kappa
0,90
DIAGNOdent (praktyk, in vivo)
wartość Kappa
0,93
DIAGNOdent (epidemiolog, in vivo)
korelacja Spearmana
0,89
Opór elektryczny (ECM)
wartość Kappa
0,85

Przegląd współczesnych metod oceny stanu tkanek zmineralizowanych
33
Tab. 3. Czułość i specyficzność urządzenia DIAGNOdent do rozpoznawania próchnicy zębiny na powierzchni
okluzyjnej (za Lussi i wsp. 2003)
Specyficzność
Czułość
N
Standard
Uwagi
0,78-0,87
0,76-0,92
105
Histologia
in vitro
0,98
0,19
230
Histologia
in vitro
1
0,82
76
Mikroradiografia
in vitro
0,86
0,92
332
Klinicznie po otwarciu ubytku
in vivo
0,84
0,79
58
Histologia
in vitro, zęby mleczne
0,85
0,82
95
Histologia
in vitro, zęby mleczne
Tab. 4. Wskazówki odnośnie terapii w zależności od wartości odczytu urządzenia DIAGNOdent (za Lussi i wsp.
2003)
Wartość odczytu
Terapia
0-13
Tradycyjne zabiegi profilaktyczne
14-20
Bardziej intensywna profilaktyka
21-30
Bardziej intensywna profilaktyka lub wypełnienie ubytku.
Wskazanie uzależnione jest od:
- aktywności próchnicy,
- ryzyka wystąpienia próchnicy,
- kontroli przeprowadzonej po upływie określonego czasu.
≥ ponad ~30
Wykonanie wypełnienia i intensywna profilaktyka

34

Etiologia i diagnostyka ubytków twardych tkanek zęba niepróchnicowego pochodzenia
35
2
Etiologia i diagnostyka ubytków twardych
tkanek zęba niepróchnicowego
pochodzenia
W ostatnich dekadach wzrosła częstość występowania tego rodzaju patologii. Postęp
wiedzy o niepróchnicowych ubytkach twardych tkanek zęba spowodował, że zamiast
ubytków klinowych wymienia się nadżerki (erosio), uszkodzenia związane z działaniem
czynnika abrazyjnego (abrasio) oraz starcia patologiczne wynikające z parafunkcji
zwarciowych
(attritio). Zmiany patologiczne w obrębie szkliwa zębów stałych mogą być
wrodzone lub nabyte w okresie rozwojowym, jak również po zakończonej mineralizacji
twardych tkanek zęba. W przypadku zmian dziedzicznych – amelogenesis imperfecta,
zmiany dotyczą całego uzębienia. Termin ubytki niepróchnicowego pochodzenia
(non caries cervical lesions – NCCL) obejmuje procesy, w których wskutek działania
czynników chemicznych i/lub mechanicznych, dochodzi do destrukcji tkanek
zmineralizowanych zębów, bez udziału drobnoustrojów. Mają one charakter przewlekły
i nieodwracalny. Mogą też być określane procesami zużywania się zębów i są w pewnym
zakresie fizjologiczne. Jeśli ich zaawansowanie jest nieadekwatne do wieku i powoduje
znaczne defekty estetyczne lub jest powodem subiektywnych dolegliwości, to traktujemy
je jako zjawisko patologiczne.
Niepróchnicowe ubytki przyszyjkowe charakteryzują się brakiem twardej tkanki na
połączeniu szkliwa z cementem przy nieobecności próchnicy. Są jednymi z najczęściej
spotykanych patologii w stomatologii. W większości przypadków obserwacje wskazują
na wzrost ich występowania wraz z wiekiem, ale mogą pojawić się już u osób poniżej
35. roku życia.
Etiologia i mechanizm powstawania ubytków niepróchnicowego pochodzenia nie
są do końca wyjaśnione. Uważa się, że przyczyną ich powstawania jest połączone
działanie czynników mechanicznych i chemicznych. Infeld zaproponował ujednolicenie
nazewnictwa i zdefiniował następujące postacie kliniczne:
-
abrazję,
-
demastykację,
-
atrycję,
-
abfrakcję,
-
resorbcję,
-
erozję.

Rozdział 2
36
W zależności od tego, który z tych czynników dominuje, mówimy o abrazji lub erozji. Za
głównego winowajcę ubytków abrazyjnych uważa się, niewłaściwe, zbyt intensywne
czyszczenie zębów twardą szczoteczką i pastami o znacznej ścieralności. Wprawdzie
szczotkowanie zębów jest korzystne dla jamy ustnej, ale tylko w przypadku użycia
szczoteczek o odpowiedniej twardości i zaokrąglonym włosiu, co powoduje nieznaczną
abrazję szkliwa, w wyniku której tracimy jedynie l mm tkanek twardych przez 100 lat.
Utrata tkanek w wyniku szczotkowaniem zależna jest od częstości, czasu trwania i siły
przyłożenia szczoteczki.
Abrazja
Abrazja spowodowana niewłaściwym użyciem szczoteczki przyczynia się do powstania
recesji dziąsłowych i obnażenia zębiny, która w konsekwencji jest wrażliwa na
nieprawidłowe stosowanie pasty do zębów. Może to dotyczyć każdej powierzchni zęba,
niezależnie od rodzaju szczoteczki i tym różni się abrazja wywołana nieprawidłowym
szczotkowaniem od niewłaściwego stosowania pasty do zębów. Powstałe ubytki
abrazyjne mają kształt poziomych rowków o owalnym zarysie dna i gładkiej powierzchni.
W etiologii ubytków abrazyjnych zwraca się uwagę na niezrównoważone siły działające
w okolicy szyjek zębów, bowiem ustawienie i anatomia zęba mogą odgrywać znaczną
rolę w podatności na naprężenia. Czynnikiem predysponującym do powstania ubytków
abrazyjnych jest niekorzystne ułożenie szkliwa i cementu w obrębie szyjki zęba oraz
fakt, że w okolicy szyjki zarówno warstwa szkliwa jak i cementu są najcieńsze.
Stopień nasilenia zmian destrukcyjnych zależy od:
-
stopnia zmineralizowania twardych tkanek zęba,
-
wydolności aparatu zawieszeniowego zęba,
-
zdolności adaptacyjnych stawu skroniowo-żuchwowego,
-
aktywności i siły mięśni żucia.
Za najważniejszą przyczynę powstawania ubytków abrazyjnych należy uznać
naprężenie powstające w szyjce zęba podczas patologicznych jego obciążeń. Siły
działające na ząb powodują jego zginanie w kierunku policzkowym i językowym. Skutkuje
to występowaniem naprzemiennych naprężeń rozciągających i ściskających w okolicy
szyjki zęba. Skośnie działające siły zwarcia wywołują niesymetryczne naprężenia,
odpowiedzialne za powstawanie ubytków o asymetrycznych kształtach i lokalizacji.
Bardziej podatne na działanie czynników abrazyjnych jest szkliwo poddane działaniu
substancji o niskim pH. Pod ich wpływem w powierzchownej warstwie szkliwa (3-5
mikrometrów) dochodzi do rozmiękczania struktury i trybochemicznego starcia
podczas szczotkowania, przeżuwania kęsów pokarmowych, a nawet ruchów języka
i policzków. Niektórzy autorzy kwestionują znaczenie czynników mechanicznych

Etiologia i diagnostyka ubytków twardych tkanek zęba niepróchnicowego pochodzenia
37
w zainicjowaniu abrazji. Ograniczają ich rolę do wpływu na rozległość ubytku
i dynamikę procesu. Podstawowe znaczenie przypisują czynnikom erozyjnym lub
urazowi zgryzowemu i zwiększonej podatności zęba.
Obraz kliniczny abrazji
W pierwszych fazach ubytek abrazyjny ma postać rysy widocznej dopiero po osuszeniu
i odpowiednim oświetleniu. W bardziej zaawansowanych stanach powstaje klin utwo-
rzony przez dwie płaszczyzny zbiegające się pod kątem ostrym od 45
o
do 67°. Stąd
dawniej ubytki te określano mianem „klinowych”. Płaszczyzna bliższa brzegu siecz-
nego jest ustawiona prostopadle do długiej osi zęba. Druga przebiega bardziej ukośnie.
Ubytek ulega stopniowemu pogłębieniu, a w bardzo zaawansowanych stadiach może
spowodować złamanie korony. Jego ściany mają w badaniu klinicznym twardą, gład-
ką i lśniącą powierzchnię. Badania morfologii powierzchni ubytku abrazyjnego w SEM
wykazały jednak, że nie jest ona gładka. Obserwowano równolegle ułożone poziome
i ukośne zarysowania o głębokości 5-250 mikrometrów, rozciągające się nawet przez
całą szerokość ubytku. W sztucznie wyhodowanym ubytku abrazyjnym głębokość
rowków była wyraźnie większa niż w naturalnie powstałych uszkodzeniach. Sugero-
wano, że działają ochronnie składniki środowiska jamy ustnej i procesy remineralizujące,
które wygładzają powierzchnię ubytku. Wypełnienia amalgamatowe poddane działaniu
czynników abrazyjnych są wygładzone i świecące. Na wszystkich materiałach, z któ-
rych są wykonane wypełnienia widać ślady zużycia i zmianę konturów.
Piątowska (2002) wyróżnia dwie fazy rozwoju ubytku abrazyjnego:
1.
aktywną – następuje szybka utrata tkanki i duża wrażliwość na bodźce, zwłaszcza
mechaniczne;
2.
pasywną – z powolnym pogłębieniem ubytku, bez dolegliwości bólowych, co
wiąże się z powstaniem zębiny wtórnej.
Na podstawie lokalizacji wyróżnia się:
-
abrazję poziomą – starcie powierzchni żujących lub brzegów siecznych,
-
abrazję pionową – starcie powierzchni językowych siekaczy górnych i przedsionkowych
dolnych.
Możliwe są postacie mieszane. Objawy subiektywne abrazji to nadwrażliwość zębów,
pojawiająca się w fazach początkowych lub przy dużej dynamice procesu. Przy
zaawansowaniu procesu dolegliwości związane są z powikłaniami ze strony miazgi.
Atrycja
(łac. attritio dentium)
Atrycja polega na ścieraniu się twardych tkanek zębów wskutek ich wzajemnego oddzia-
ływania (ang. two body wear) bez ingerencji substancji obcych. Zmiana ma charakter fi-
zjologicznego zużycia zębów na powierzchniach aktywnych czynnościowo w proce-

Rozdział 2
38
sie żucia – starcia zgryzowe. Utrata tkanek jest wtedy stopniowa i systematyczna w mia-
rę starzenia się organizmu. Dotyczy głównie szkliwa zębów. Starciu ulegają powierzchnie
podniebienne zębów przednich górnych i wargowe zębów przednich dolnych. W zębach
trzonowych i przedtrzonowych górnych starciu fizjologicznemu ulegają guzki podnie-
bienne, a w dolnych policzkowe.
W miarę wydłużania się średniej długości życia i chęci utrzymania własnego
uzębienia, utrata tkanek twardych na drodze atrycji przestała być marginalnym
problemem w stomatologii. Uzębienie współczesnego człowieka ściera się
w warunkach fizjologicznych około 15 µm na rok na powierzchni okluzyjnej i około
7 µm na podniebiennej. Jak wynika z ostatnio przeprowadzonych w Polsce badań
epidemiologicznych, atrycje są najczęstszym rodzajem ubytków niepróchnicowego
pochodzenia u ludzi w średnim i podeszłym wieku. Barwińska i wsp. (2007) badając
populacje 55-81 letnich pacjentów, u 98,3% spostrzegła tę patologię w obrębie
zachowanych zębów. Aż 16,4% zębów wykazało atrycje 3. stopnia, według Martina 47,2%
atrycji było zlokalizowanych na zębach siecznych, 24,3% na kłach, 23,1% na zębach
przedtrzonowych i tylko 5,4% na zębach trzonowych. W świetle badań zużycie tkanek
twardych nasila się wraz z wiekiem badanych, przy czym stopień zaawansowania zmian
jest największy w siekaczach i kłach.
Starcie występujące w zakresie fizjologicznym pełni wiele korzystnych dla układu
stomatognatycznego funkcji:
-
sprzyja procesowi samo wyrównywania się zgryzu,
-
zapobiega przeciążeniom,
-
eliminuje węzły urazowe,
-
umożliwia w uzębieniu mlecznym wędrówkę żuchwy ku przodowi i procesów dostoso-
wawczych w stawie skroniowo-żuchwowym.
Starciu fizjologicznemu ulegają np. guzki na brzegach siecznych zębów stałych. Starcie
patologiczne pojawia się, gdy czynnik mechaniczny przekracza wytrzymałość tkanek
twardych zęba. Dotyczy szkliwa lub zębiny. Występuje w obrębie jednego zęba lub całej
grupy zębów. Najczęstszą przyczyną są:
-
parafunkcje,
-
wady zgryzu,
-
braki w uzębieniu,
-
mechaniczne uszkodzenia spowodowane przez klamry uzupełnień protetycznych lub
aparatów ortodontycznych,
-
zwiększona intensywność żucia, duża twardość spożywanych pokarmów,
-
zmniejszona odporność tkanek twardych zęba np. zmniejszenie mikrotwardości
szkliwa wskutek erozji.

Etiologia i diagnostyka ubytków twardych tkanek zęba niepróchnicowego pochodzenia
39
Obraz kliniczny atrycji
Powierzchnie żujące i/lub brzegi sieczne są starte, wygładzone, twarde i lśniące. Jeśli doszło
do utraty całej grubości szkliwa, to w strefie środkowej zęba widoczna jest warstwa zębiny
o ciemniejszym zabarwieniu – od żółtego do ciemnobrązowego. Zależy to od wieku pacjen-
ta i składu diety. Na powierzchniach żujących i brzegach siecznych formują się kraterowa-
te zagłębienia – zębina ściera się szybciej niż obwodowo leżące szkliwo. Na zębach prze-
ciwstawnych występują tzw. „tarczki wyświechtania”. Konsekwencją starcia jest zmia-
na kształtu zębów, skrócenie wysokości korony zęba, obniżenie wysokości zwarciowej
i zmiana rysów twarzy. Starcie może dotyczyć powierzchni stycznych sąsiadujących zębów.
Punktem stycznym zostaje wtedy powierzchnia styczna.
Wskaźnik starcia zębów według Martina:
0
– brak oznak starcia tkanek zębowych,
1
– powierzchowne starcie szkliwa (guzki zębów są zachowane),
2
– znaczniejsze starcie guzków zębowych (w niektórych miejscach widoczna zębina),
3
– starta cała powierzchnia szkliwa, odsłonięta zębina,
4
– korona zęba starta do okolicy szyjki zębowej,
5
– obnażenie miazgi zęba w wyniku starcia.
Demastykacja
(łac. mangere)
Demastykacja jest fizjologicznym procesem ścierania powierzchni zębów w czasie aktu
żucia. Zależy w dużej mierze od abrazyjności samego kęsa pokarmowego. Patologiczne
nasilenie procesu ma miejsce w przypadku spożywania nietypowych produktów np.
żucie orzecha betelu. Część autorów nie definiuje demastykacji jako odrębnego zjawiska
i określa ją jako wypadkową abrazji, atrycji oraz współistniejących czynników abrazyjnych.
Według ich opinii powierzchowna warstwa szkliwa o zmniejszonej wskutek ataku kwasów
mikrotwardości (surface microhardness – SMH) łatwiej ulega uszkodzeniom mechanicznym
i ścieraniu podczas żucia.
Abfrakcja
(łac. frangere)
Abfrakcja jest pojedyńczym ubytkiem na powierzchni przedsionkowej w kształcie klina,
częściowo lub w całości zlokalizowanym poddziąsłowo, powstałym na skutek urazu
zgryzowego. W warunkach zgryzu prawidłowego siły żucia powodują obciążenia
wzdłuż osi długiej zęba i pryzmaty tylko w niewielkim stopniu ulegają odkształceniu.
Przy nieprawidłowościach zgryzowych, podczas aktu żucia działają na ząb siły
ekscentryczne, wywołując jego boczne zgięcie. Po stronie, w którą jest on zginany,
przeważają siły powodujące ściskanie tkanek twardych. Szkliwo i zębina mają dużą
odporność na takie przeciążenia. Natomiast po przeciwnej stronie zęba występuje zjawisko
rozciągania, na które szkliwo ma 10-krotnie mniejszą odporność. Jako tkanka o dużej
twardości tylko w niewielkim stopniu może ulegać odkształceniu. Po przekroczeniu
wartości krytycznej dochodzi do mikropęknięć i złamań, zwłaszcza w obrębie

Rozdział 2
40
połączenia szkliwno-cementowego. Przerwane zostają wiązania między kryształami
hydroksyapatytu. W fazie naprężenia cząsteczki wody lub innych substancji wnikają
pomiędzy pryzmaty, co uniemożliwia odbudowę wiązań chemicznych między
nimi. Struktury te stają się bardziej podatne na działanie czynników chemicznych
i mechanicznych.
Obraz kliniczny abfrakcji
Tzw. ubytki stresowe zlokalizowane są na powierzchniach policzkowych, najczęściej
kłów i/lub zębów przedtrzonowych. W całości lub częściowo znajdują się poniżej brzegu
dziąsła. Powierzchnia ubytku jest początkowo chropowata, a brzegi ostre. W późniejszych
stadiach może on ulec wygładzeniu na skutek abrazji i erozji, a w minimalnym stopniu
procesów naprawczych. Ahmad (2007) podaje tzw. „przeskakiwanie pod paznokciem”
jako charakterystyczną cechę tego ubytku.
Resorbcje przyszyjkowe
Są to zewnętrzne, postępujące resorpcje pojawiające się zawsze w miejscu uszkodzenia
przyczepu nabłonkowego i powstania kieszonki przyzębnej. Etiologia procesu resorbcji
przyszyjkowej nie została do końca poznana. Wywołana jest urazami jatrogennymi natury
mechanicznej i chemicznej. Wśród przyczyn wyróżnia się leczenie ortodontyczne (21,2%
wszystkich pacjentów oraz 24,1% wszystkich zębów), urazy (15%), wewnątrzkomorowe
wybielanie zębów (3,9%), niewłaściwie wykonane zabiegi na przyzębiu (14,8%) oraz
kombinacja wszystkich powyższych czynników (21%). Na podstawie obrazu klinicznego
Heithersay (2004) dokonał podziału zewnętrznej resorbcji przyszyjkowej na cztery
klasy:
Klasa I – Proces resorbcyjny obejmuje swoim zasięgiem nieznaczną część zębiny koro-
nowej w okolicy przyszyjkowej.
Klasa II – Proces resorbcyjny penetruje w kierunku komory, rozprzestrzeniając się
w minimalnym stopniu w kierunku zębiny korzeniowej.
Klasa III – Rozległy ubytek resorbcyjny penetrujący do zębiny koronowej i do ⅓ zębiny
korzeniowej.
Klasa IV – bardzo rozległy ubytek resorbcyjny penetrujący do zębiny koronowej i do
ponad ⅓ zębiny korzeniowej.
Postępowanie terapeutyczne w zewnętrznej resorbcji przyszyjkowej zaliczanej do I i II
klasy nie wymaga wdrożenia leczenia endodontycznego. Jest ono natomiast konieczne
przy rozpoznaniu resorbcji III i IV klasy, gdyż proces chorobowy dotyczy miazgi,
która jest w stanie ostrego lub przewlekłego zapalenia. Przed rozpoczęciem leczenia
endodontycznego należy usunąć ziarninę.
Ubytki tego rodzaju zlokalizowane są w okolicy szyjki zęba poniżej przyczepu
nabłonkowego. W trakcie trwania procesu dochodzi do resorbcji szkliwa i zębiny, która

Etiologia i diagnostyka ubytków twardych tkanek zęba niepróchnicowego pochodzenia
41
rozprzestrzenia się w sposób nieregularny i w końcowym etapie może swoim zasięgiem
objąć również miazgę. Resorbcja przyszyjkowa przebiega zwykle bezobjawowo
i wykrywana jest najczęściej podczas rutynowego badania radiologicznego. W przypadku
gdy dojdzie do obnażenia miazgi, pacjent może zgłaszać objawy bólowe pochodzenia
miazgowego. Obraz kliniczny w początkowym etapie może przypominać „różowy ząb”,
gdyż silnie unaczyniona tkanka resorbcyjna staje się widoczna. Rozważając metody
leczenia najlepsze rezultaty osiąga się po chirurgicznym odsłonięciu powierzchni korzenia
i usunięciu tkanki ziarninowej. Ubytek korzenia po opracowaniu mechanicznym,
nadaniu kształtu retencyjnego zaleca się wypełnić techniką adhezyjną. W zębach,
w których doszło do perforacji kanału korzeniowego należy przeprowadzić leczenie
endodontyczne. Alternatywną metodą do leczenia chirurgicznego jest eliminacja
tkanki resorbcyjnej na drodze chemicznej poprzez aplikację 90% wodnego roztworu
kwasu trójchlorooctowego. Związek ten powoduje martwicę ziarniny, niszczy
naczynia krwionośne i chorobowo zmienione tkanki. Po zakończonym leczeniu należy
przeprowadzać badania kontrolne celem upewnienia się, czy proces resorbcji został
zatrzymany. W niektórych przypadkach może nastąpić nawrót choroby. Opisywano
przypadki z okresami obserwacji wahającymi się od kilku miesięcy do maksimum 10 lat.
Inną możliwą drogą leczenia jest technika sterowanej regeneracji tkanek z zastosowaniem
Emdogainu i Bioosu lub aplikacja biofosfonatów, czynników antyklastycznych
stosowanych w leczeniu osteoporozy.
Erozja
Erozja jest najczęściej spotykaną niepróchnicową formą utraty tkanek twardych zęba
pod wpływem działania kwasów pochodzących z pożywienia i napojów. Znaczenie
tego problemu rośnie w związku ze wzrostem spożycia kwaśnych napojów, szczególnie
gazowanych. Z raportu „The Oral Health 2000” opublikowanego w Wielkiej Brytanii
wynika, że u połowy osób w wieku 4-18 lat stwierdzono zmiany erozyjne. W grupie dzieci
4-6 lat, aż u 12% obserwowano zmiany dotyczące szkliwa i zębiny. U podłoża erozji leży
demineralizacja tkanek twardych zęba w warunkach obecności roztworu nienasyconego
w stosunku do poziomu ich mineralizacji. W pierwszej fazie erozji ulega szkliwo,
a w bardziej zaawansowanych stanach także zębina. Demineralizacja szkliwa przebiega
według schematu: 8H
+
+ Ca
10
(PO
4
)
6
(OH)
2
= 6 (HPO
4
)
2-
+ 10Ca
2+
+ 2H
2
O.
Następuje atak jonów wodorowych na kryształy apatytów lub/i proces chelatowania
jonów wapnia. Najpierw destrukcji ulega osłonka pryzmatu, a następnie sam pryzmat.
Daje to obraz plastra miodu w SEM. Część hydroksyapatytów może zawierać jony
(fluorkowe, fosforanowe, wapniowe i magnezowe) modyfikujące ich podatność na
działanie czynników chemicznych. Fluoroapatyty zwiększają odporność szkliwa
i przeciwdziałają destrukcji chemicznej obniżając krytyczną dla niego wartość pH.
Wynosi ona dla szkliwa zawierającego hydroksyapatyty 5,5, a dla zębiny 6,5. Szkliwo
wzmocnione obecnością fluoroapatytów ulega erozji dopiero przy wartościach

Rozdział 2
42
pH < 4,5. Procesom erozyjnym sprzyja z kolei obecność ubogich w wapń karboksylowych
apatytów. Ze względu na dużą zawartość jonów sodu, magnezu, potasu i węglanowych
oraz mniej korzystny stosunek powierzchni do wagi kryształu najłatwiej poddają się
one destrukcji chemicznej spośród wszystkich form apatytów szkliwa. Występowanie
dużej liczby zanieczyszczeń węglanowo-magnezowych jest charakterystyczne dla zębów
świeżo wyrzniętych, dlatego łatwiej ulegają one procesom erozyjnym. W procesie
posterupcyjnego dojrzewania szkliwa następuje krystalizacja apatytu z wbudowaniem
fluoru w miejsce grupy hydroksylowej i wytworzenie fluoroapatytów oraz dyfuzja ze
śliny jonów wapnia i fosforanowych. Zwiększa się procentowy udział hydroksyapatytu
w szkliwie oraz mineralizacja substancji międzypryzmatycznej. Powierzchnia dojrzałych
zębów wykazuje większą twardość i ograniczoną przepuszczalność, jest bardziej odporna
na działanie kwasów. W zębinie erozja przebiega nieco inaczej. Jej apatyty zawierają więcej
jonów w porównaniu ze szkliwem, a stosunek powierzchni do wagi kryształu jest większy,
co ułatwia rozpuszczanie składników mineralnych. Najpierw rozpuszczaniu ulega zębina
międzykanalikowa i okołokanalikowa, potem wewnątrzkanalikowa. Światło kanalików
poszerza się, powstaje warstwa zdemineralizowanego kolagenu chroniąca głębiej leżące
tkanki. Jest ona jednak mało odporna na działanie czynników mechanicznych i procesy
proteolityczne. Duża zawartość składników organicznych w substancji podstawowej
zębiny zapewnia wysoką zdolność buforowania i hamuje penetrację kwasów w jej głąb.
Demineralizacja podpowierzchniowej zębiny nie przekracza 100 µm. Postępująca przy
kolejnych ekspozycjach na działanie kwasów demineralizacja pobudza powstawanie
zębiny obronnej i reparacyjnej, powodując obturację jej kanalików. Procesy erozji
zachodzą tylko w warunkach bezpośredniego kontaktu z substancją pochodzenia
zewnątrzpochodnego lub/i wewnątrzpochodnego. Powstanie i nasilenie zmian zależy od
czasu działania i częstości ich występowania oraz podatności tkanek.
Do czynników zewnątrzpochodnych należą: dieta, środowisko, stosowanie leków i styl
życia. Często ilość i jakość spożywanych posiłków w znacznym stopniu stanowią o ry-
zyku występowania ubytków erozyjnych. Każdy produkt o pH niższym od krytycznego
dla szkliwa może spowodować uszkodzenie. Zdolność roztworu do wywołania erozji
określa potencjał erozyjny. Decyduje o nim kwasowość miareczkowa, czyli ilość zasady
potrzebna do zneutralizowania kwasu do odczynu obojętnego. Potencjał erozyjny wy-
znacza zatem wartość pH, pojemność buforowa i rodzaj kwasu, dostępność i adhezja
do powierzchni zęba, właściwości chelatujące oraz stężenie jonów wapnia, fosforanów
i fluoru w środowisku. Mocne kwasy uwalniają duże ilości jonów wodorowych, zdolnych
do inicjacji erozji. Słabsze natomiast ustalają pewną równowagę jonową w środowisku.
Niektóre z nich mają ponadto zdolność wiązania jonów wapnia, co znacznie zwiększa
prawdopodobieństwo erozji szkliwa. Aktualny najwyższy poziom jonów wodorowych,
zależny od wszystkich zawartych w diecie kwasów, decyduje o powstaniu erozji. Najczę-
ściej występujące w produktach żywnościowych kwasy o wysokim potencjale erozyjnym

Etiologia i diagnostyka ubytków twardych tkanek zęba niepróchnicowego pochodzenia
43
to: cytrynowy (pH 1,8),
jabłkowy (pH 2,3), winowy (pH 1,6) i bursztynowy (pH 2,7).
Grupy produktów żywnościowych mających wpływ na powstanie erozji to: soki i napoje
owocowe, słodkie napoje gazowane, owoce i warzywa, coca-cola, herbaty ziołowe i owo-
cowe oraz wino. Kiedy pH w jamie ustnej spada poniżej 7 (odczyn kwaśny) składniki
mineralne tkanek zęba ulegają zniszczeniu. Mogą być jednak chronione przez ślinę i jej
działanie buforujące. Przy pH poniżej 5,5 pojemność buforowa śliny jest niewystarczająca
i dochodzi do rozpuszczania tkanek zęba. Wartość pH popularnych napojów gazowa-
nych wynosi często tylko 2,5-3,5, nie da się więc uniknąć utraty składników mineral-
nych zębów. Powstaniu erozji sprzyja zawodowe narażenie na wdychanie gazów i ae-
rozoli kwasu siarkowego, chlorowodorowego i azotowego. Silne kwasy nieorganiczne
o pH < 3 powodują rozpuszczanie całej powierzchni szkliwa: hydroksy- i fluooroapa-
tytów oraz matrycy organicznej. Leki o niskim pH zalicza się także do grupy czynni-
ków potencjalnie powodujących erozję. Największe znaczenie mają kwas askorbinowy,
aspiryna i związki żelaza. Na zwiększenie ryzyka erozji mają też wpływ skutki uboczne
zażywanych leków w postaci zmniejszonego wydalania śliny. Do czynników wewnątrz-
pochodnych zwiększających ryzyko wystąpienia erozji należą: choroba refluksowa i za-
burzenia jedzenia (anoreksja i bulimia).
Choroba refluksowa i wymioty
Sok żołądkowy cofający się do przełyku i jamy ustnej podczas odbijania, refluksu żołąd-
kowego i wymiotów zawiera kwas solny o pH około 1,0-1,5. Choroba refleksowa wystę-
puje u 7% dorosłych. Odpowiednio długa ekspozycja treści żołądkowych i przekroczenie
barier ochronnych prowadzi do powstania ubytków erozyjnych. W pierwszej kolejności
powstają nadżerki na powierzchniach podniebiennych zębów szczęki i żujących żuchwy.
Tego rodzaju patologię stwierdzono u około 20% pacjentów z anoreksją restrykcyjną
i 90% z bulimiczną oraz bulimią. Pacjenci z anoreksją drastycznie ograniczają ilość spo-
żywanych produktów, a te które jedzą charakteryzują się najczęściej wysokim potencja-
łem erozyjnym. Bulimię cechują napady obżarstwa, kompensowane wymiotami.
Objawy kliniczne erozji
Wczesne zmiany erozyjne powodują nieznaczne wygładzenie makrostruktury zęba
i zwiększenie połysku powierzchni. Zaawansowane ubytki erozyjne mają postać pła-
skich, nieckowatych lub półkolistych zagłębień, rozszerzających się ku obwodowi. Za-
wsze obecne jest pasmo nieuszkodzonego szkliwa wzdłuż brzegu dziąsłowego, gdzie
uwidacznia się działanie ochronne, prawie zawsze obecnej w tym miejscu płytki nazęb-
nej oraz płynu z kieszonki dziąsłowej o pH 7,5-8,0. Erozje nie obejmują nigdy brzegu
siecznego i powierzchni stycznej. Umiejscowienie ubytków jest bezpośrednio związane
z rodzajem czynnika przyczynowego. Czynniki zewnątrzpochodne powodują ubytki na
powierzchniach policzkowych zębów górnych, rzadziej dolnych. Wewnątrzpochodny
kwas solny przyczynia się do utraty tkanek na powierzchniach podniebiennych, a na-

Rozdział 2
44
stępnie żujących zębów górnych oraz policzkowych i żujących w zębach żuchwy. Erozje
pochodzenia przemysłowego nie powstają w okolicy przyszyjkowej. Na powierzchniach
żujących zębów powstają uszkodzenia w postaci zagłębień i rowków, ich guzki ulegają
zaokrągleniu, a w zaawansowanych stadiach tworzą się w nich wgłębienia. Zmienia się
kształt powierzchni okluzyjnej i korony, a wysokość zwarciowa ulega obniżeniu. Cha-
rakterystycznym objawem są tzw. wystające wypełnienia, które wolniej niż tkanki zęba
poddają się destrukcyjnemu działaniu kwasów.
Na podstawie obrazu klinicznego ubytki erozyjne dzieli się na trzy klasy:
1.
powierzchowne – ograniczone tylko do szkliwa,
2.
umiejscowione – obejmujące < ⅓ grubości zębiny,
3.
uogólnione – obejmujące > ⅓ grubości zębiny.
Jednym z początkowych objawów subiektywnych jest nadwrażliwość zębiny, która
pojawia się w pierwszych stadiach choroby, przy dużej aktywności procesu, zanim
powstanie zębina sklerotyczna. Ubytki erozyjne mogą być powikłane współistnieniem
czynników abrazyjnych i urazami mechanicznymi osłabionych tkanek.
Diagnostyka ubytków twardych tkanek zęba pochodzenia niepróchnicowego powinna
się opierać na:
-
szczegółowym badaniu jamy ustnej,
-
wywiadzie ogólnym i stomatologicznym,
-
zwyczajach dietetycznych pacjenta (rejestracja wszystkich przyjmowanych pokarmów
w ciągu kolejnych dni),
-
wywiadzie dotyczącym stylu życia i pracy,
-
testach ślinowych (ilość wydzielania śliny i jej właściwości buforujących),
-
badaniu radiologicznym,
-
wnikliwej analizie modeli łuków zębowych,
-
konsultacji ogólnomedycznej.
Dokładne badanie kliniczne nie zawsze jasno wykaże czynnik sprawczy erozji. W celu
ustalenia przyczyny i czynników ryzyka należy przeprowadzić szczegółową ankietę,
która powinna zawierać pytania dotyczące zewnątrz- i wewnątrzpochodnych czynników
ryzyka takich jak: częstość i ilość spożywanych produktów o niskim pH, ilość kwaśnych
przekąsek, napojów, zabiegów higienicznych w obrębie jamy ustnej – szczotkowanie
zębów, częstość i czas trwania zabiegu, czy przeprowadzany jest bezpośrednio po
kwaśnych posiłkach lub wymiotach, rodzaj szczoteczki, pasty do zębów, stosowanie
płynów do płukania jamy ustnej i innych dodatkowych zabiegów higienicznych
(wykałaczki, szczoteczki międzyzębowe), stosowanie domowych środków do wybielania
zębów (najczęściej o dużej abrazyjności), leków i suplementów diety, witamin, specjalnej

Etiologia i diagnostyka ubytków twardych tkanek zęba niepróchnicowego pochodzenia
45
diety, odchudzanie się, uzależnienia, nawyków i parafunkcji.
Diagnostykę należy uzupełnić testami śliny: wskaźnikiem pH, Dentobuff czy pomiarami
ilości śliny stymulowanej. Do określenia zmian erozyjnych powinien być zastosowany
wskaźnik według Lussi (2004).
Tab. 5. Wskaźnik zmian erozyjnych według Lussi
Stopień Powierzchnia przedsionkowa – kryteria
Powierzchnia podniebienna/językowa
– kryteria
0
Brak zmian erozyjnych, obecność delikatnych,
gładkich miejsc.
Brak zmian erozyjnych, obecność gładkich,
szklistych miejsc.
1
Ubytek powierzchni szkliwa o falistych brzegach
z nienaruszoną częścią przy szyjce zęba, której
szerokość podkreśla głębokość ubytku, odróżnia-
jący go od abrazji.
Delikatna erozja, rowki na powierzchni okluzyj-
nej, zaokrąglone guzki zęba, brzegi wypełnień
sięgające powyżej przylegającej powierzchni
zęba, utrata powierzchni szkliwa, zębina nie-
naruszona.
2
Zmiana erozyjna obejmująca zębinę w mniej niż
½ powierzchni zęba.
Erozja bardziej zaznaczona niż w stopniu 1,
zmiana obejmująca zębinę.
3
Zmiana erozyjna obejmująca zębinę w ponad
½ powierzchni.
Zasięg i stopień zaawansowania atrycji określa się przy pomocy opisanego wyżej
wskaźnika starcia według Martina lub Thomy:
1
– starcie guzków bez obnażenia zębiny,
2
– obnażenie powierzchni zębiny,
3
– widoczny pierścień zębiny na powierzchni starcia,
4
– obnażenie miazgi.
Dokładniejszą ocenę zasięgu i głębokości ubytków niepróchnicowego pochodzenia
zapewnia wskaźnik TWI (Tooth Wear Index) według Smitha i Knighta:
0
– prawidłowa powierzchnia szkliwa, brak zmian konturu zęba,
1
– brak charakterystycznej powierzchni szkliwa, minimalny brak konturu zęba,
2
– odsłonięcie zębiny na mniej niż ⅓ powierzchni i głębokości poniżej l mm,
3
– odsłonięcie zębiny na więcej niż ⅓ powierzchni i głębokość l-2 mm,
4
– brak szkliwa na głębokość > 2 mm, obnażenie miazgi lub odsłonięcie zębiny
wtórnej.

Rozdział 2
46
Nie ma określonych standardów w praktyce stomatologicznej odnośnie decyzji kiedy
i jak leczyć niepróchnicowe ubytki przyszyjkowe. Wydaje się że pierwszym krokiem win-
no być rozpoznanie przyczyny, wdrożenie profilaktyki mającej na celu zatrzymanie dal-
szego niszczenia zębów, opanowanie złej higieny jamy ustnej, zmiana nawyków żywie-
niowych, wyeliminowanie zaburzeń zgryzowych, a dopiero potem, jeżeli jest konieczne,
leczenie i wypełnienie ubytków. Należy je naprawić, aby zapobiegać dalszej utracie tka-
nek zęba. Obecnie dysponujemy dużą różnorodnością materiałów do wypełnień, sys-
temów wiązania zębinowego, a także różnymi technikami wypełniającymi. Ważne jest,
aby przed podjęciem decyzji o leczeniu odtwórczym kierować się rozległością utraco-
nych tkanek, postępować zgodnie z zasadą minimalnej interwencji, by zachować jak naj-
większą ilość tkanek i tak już zniszczonych zębów oraz wybrać materiał o wysokim mo-
dule elastyczności z dużą ilością cząsteczek wypełniacza. Materiały stosowane do wypeł-
nień ubytków niepróchnicowego pochodzenia winny się charakteryzować: wysoką este-
tyką, właściwościami mechanicznymi zbliżonymi do tkanek zęba, trwałością i odporno-
ścią na czynniki chemiczne i/lub mechaniczne, mocnym wiązaniem ze szkliwem i zębi-
ną, powinna zapobiegać próchnicy wtórnej i cechować się prostą aplikacją. Wśród do-
stępnych materiałów należy wymienić cementy szkło-jonomerowe klasyczne i modyfi-
kowane, materiały złożone, kompomery, ormocery i giomery. Przeprowadzone bada-
nia kliniczne i laboratoryjne wykazały, że cementy sz-j nie wypadają najlepiej pod wzglę-
dem estetycznym. Wykazują słabszą wytrzymałość na zginanie i rozciąganie oraz małą
odporność na działanie kwasów. Zaleca się je zatem do wypełnienia ubytków abrazyj-
nych zlokalizowanych na powierzchniach przedsionkowych w rejonach o małym ob-
ciążeniu mechanicznym i dobrej kontroli czynników erozyjnych. Cementy (sz-j) utwar-
dzane światłem widzialnym cechują się przede wszystkim wytrzymałością, siłą adhezji
po wstępnym zastosowaniu specjalnego materiału przygotowującego (primera lub kon-
ditionera), walorami estetycznymi i odpornością na rozpuszczalność w wodzie. Jednak
nadal materiały te nie spełniają wymogów stawianych wypełnieniom ubytków przyszyj-
kowych. Z uwagi na wady cementów szkło-jonomerowych oraz niedoskonałości mate-
riałów złożonych, jedną z metod wypełniania ubytków jest łączne stosowanie obu tych
grup materiałowych. Materiały złożone ze względu na ich wysoką estetykę, dobre właści-
wości mechaniczne, minimalnie inwazyjną preparację polecane są do wypełniania ubyt-
ków erozyjnych i abrazyjnych w miejscach wymagających wysokiej estetyki. W ubyt-
kach abrazyjnych stosuje się materiały złożone odporne na ścieranie (mikrohybrydy albo
z mikrowypełniaczem) lub półpłynne o niskiej lepkości, które w porównaniu z kompozy-
tami mikrohybrydowymi charakteryzują się niższą odpornością na ścieranie i wyższym
skurczem polimeryzacyjnym, ale lepiej znoszą obciążenia ekscentryczne i rozciąganie.
Materiały mikrohybrydowe wykazują wyższą odporność na ściskanie (wzrasta liniowo
wraz ze wzrostem objętości wypełniacza) oraz twardość (55-80 kg/mm w skali Knoppa)
i odporność na ścieranie (utrata konturów nie powinna przekraczać 50 µm). Kompomery
polecane są do wypełniania wszystkich rodzajów ubytków niepróchnicowych. Materiały
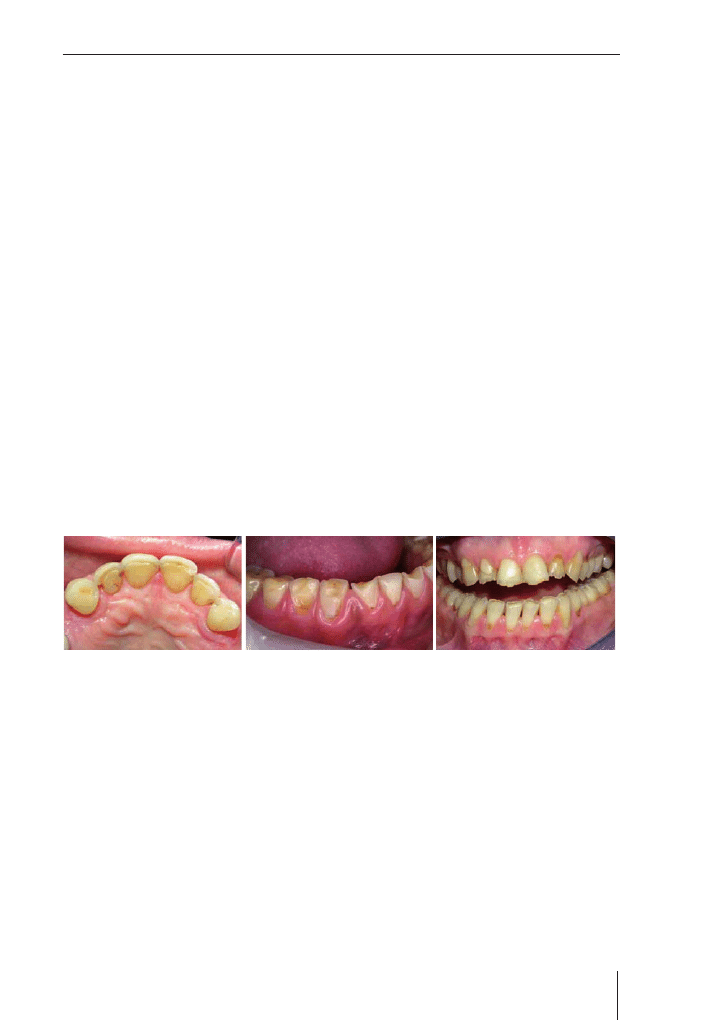
Etiologia i diagnostyka ubytków twardych tkanek zęba niepróchnicowego pochodzenia
47
te w obszarze przyszyjkowym zapewniają estetykę wypełnień i siłę adhezji do tkanek taką
jak materiały złożone. W porównaniu do cementów sz-j uwalniają znacznie mniejsze ilo-
ści jonów fluorkowych. W odbudowie ubytków pochodzenia niepróchnicowego ważna
jest technika przygotowania tkanek twardych. Odsłonięta zębina ma zamknięte kanali-
ki i silniej zmineralizowaną część międzykanalikową, dlatego powinna być opracowana
mechanicznie. W celu uzyskania adhezji oprócz zukośnienia brzegów szkliwa pod ką-
tem 45° na szerokości 0,5-1,0 mm, w obrębie cementu brzeg ubytku wymaga zukośnienia
o szerokości 2-3 mm (tzw. piórka). Na powierzchni dodziąsłowej można wykonać rowek
retencyjny, zwiększający retencję i zapobiegający przemieszczeniu się materiału podczas
polimeryzacji. Jeśli chodzi o materiały łączące można zastosować jednofazowe systemy
samoprzygotowujące należące do VI lub VII generacji, które są łatwe w aplikacji nawet
gdy trudno jest utrzymać suchość pola zabiegu w pobliżu brzegu dziąsła lub systemy „to-
tal etch”.
W sytuacjach gdy dochodzi do dużej utraty tkanek twardych i obniżenia wysokości zwar-
cia zalecane są licówki wykonane z materiałów złożonych. W niektórych przypadkach,
wskutek znacznej utraty tkanek lub ich przebarwienia, zniekształcenia czy obniżenia wy-
sokości zwarcia wskazane jest zastosowanie licówek ceramicznych lub korony osłaniają-
cej (pełnoceramicznej lub na podbudowie metalowej). Należy za wszelką cenę dążyć do
osiągnięcia podstawowych celów jakimi są przywrócenie funkcji i estetyki, a także winny
spełnić oczekiwania pacjenta.
Ryc. 2.1. a, b i c. Ubytki pochodzenia niepróchnicowego (ze zbiorów E. Rusyan)

48

Testy ryzyka i aktywności próchnicy
49
3
Testy ryzyka i aktywności próchnicy
Nowoczesne postępowanie dotyczące próchnicy zębów, składa się z 3 poziomów:
zapobiegania, kontroli i leczenia, a jego podstawą jest właściwa diagnoza choroby
i wykrywanie zmian próchnicowych we wczesnych stadiach. Właściwa ocena stopnia
ryzyka i aktywności próchnicy pozwala na monitoring pacjentów, zamiast ich doraźnego
leczenia. Lekarz za pomocą testu diagnostycznego może wykryć wczesną zmianę
w szkliwie oraz właściwie ją zinterpretować.
Czynniki ryzyka próchnicy, które mogą być ocenione w czasie badania
podstawowego to:
A. Stan próchnicy – na podstawie wskaźników PUW i PUWP dla zębów stałych
(odpowiednio puw i puwp dla zębów mlecznych).
PUW/PUWP = 0 oznacza zęby/powierzchnie bez próchnicy;
l – średnie nasilenie; 2 – wysokie nasilenie.
B. Obecność aktywnych ognisk próchnicy początkowej – za które przyjmujemy
zmiany na powierzchniach zębów o charakterze plam o zabawieniu kredowo-białym
i żółtawym, (0 – nie występuje; 1 – 1 powierzchnia; 2 – > 2 powierzchnie).
C. Przyrost ubytków próchnicowych – oceniamy pojawienie się nowych zmian podczas
badania kontrolnego (po roku obserwacji). Pacjenta zaliczamy do grupy wysokiego
ryzyka próchnicy jeżeli w ciągu roku obserwacji wystąpił przyrost co najmniej
2 nowych ubytków (0 – nie występuje; 1 – 1 ubytek/rok; 2 – > 2 ubytki/rok).
D. Obecność próchnicy wczesnej – występowanie w uzębieniu mlecznym u dziecka poniżej
3. roku życia zmian próchnicowych (pacjent z grupy wysokiego ryzyka) (Nie, Tak).
E. Obecność płytki bakteryjnej. Wybarwiamy 4 powierzchnie zębów i stwierdzamy
obecność lub brak płytki. Wynik > 20% powierzchni z płytką oznacza wysokie ryzyko
próchnicy (0 – nie występuje; l – umiarkowana, 2 – obfita).
F. Krwawienie z dziąseł – oceniamy za pomocą wskaźnika Gingival Bleeding
Index (GBI): 0 – brak krwawienia, 1 – oznacza < 15% jednostek dziąsłowych
z objawami krwawienia i wskazuje na konieczność podjęcia dodatkowych zabiegów
profilaktyczno-leczniczych; 2 – oznacza obecność > 15% jednostek dziąsłowych
z objawami krwawienia (pacjent z grupy wysokiego ryzyka), (skala 0 – nie występuje;
l – umiarkowane; 2 – znaczne).
G. Obniżone wydzielanie śliny o różnej etiologii – ocena poziomu wydzielania śliny,
upośledzone wydzielanie śliny: zespół Sjögrena, choroby układu krążenia, stawów,
cukrzyca, astma, przewlekłe przyjmowanie leków obniżających ciśnienie krwi,
cytostatyków po radioterapii, antyhistaminowych, psychotropów (0 – prawidłowe;
l – niskie; 2 – bardzo niskie).
Rozdział 3
50
Główne czynniki warunkujące powstawanie próchnicy działają w środowisku śliny. Tak
więc zarówno jej ilość jak i cechy fizykochemiczne wpływają na przebieg próchnicy. Właści-
wości buforowe śliny mogą ograniczać próchnicotwórcze działanie kwasów wytwarzanych
przez bakterie w trakcie przemian metabolicznych węglowodanów. Obecność płytki na-
zębnej utrudnia, a nawet uniemożliwia zachowanie równowagi jonowej między szkliwem
a śliną. Jej metabolizm, przy braku odpowiednich właściwości buforowych śliny powoduje,
że pH spada do poziomu przy którym rozpuszczanie szkliwa jest nieuniknione. Pacjenci
o bardzo niskiej zdolności buforowej śliny (pH < 4,0) zaliczani są do grupy wysokiego ryzy-
ka próchnicy. Zdolność buforową śliny można ocenić przy pomocy testu biochemicznego
Dentobuff. Na jego podstawie można ocenić narażenie pacjenta na próchnicę i opracować
dla niego indywidualny plan postępowania.
Uzyskane wyniki należy interpretować następująco:
-
zabarwienie paska niebieskie – pH > 6 (słaby odczyn kwaśny);
-
zabarwienie paska zielone – pH = 4,5-5,5 (średni odczyn kwaśny);
-
zabarwienie paska żółte – pH < 4 (silny odczyn kwaśny);
Uzyskane wyniki pojemności buforowej śliny oraz pomiar jej sekrecji stanowią jeden
z elementów diagnostycznych próchnicy.
Tab. 6. Zestawienie pomocnicze do klinicznej oceny ryzyka próchnicy
Wydzielanie śliny
Brak ubytków próchnico-
wych
Pojedyncze ubytki próchnicowe
Kilka ubytków próchnicowych
Wydzielanie śliny > 0,7 ml/min
Nie sugeruje się
stymulacji
Nie sugeruje się stymulacji
Nie sugeruje się stymulacji
Wydzielanie śliny < 0,7 ml/min
Podwyższone ryzyko
Podwyższone ryzyko
Wysokie ryzyko
Poinformować pacjenta
Poinformować pacjenta
Poinformować pacjenta
Sprawdzić, czy stosowane
leki nie hamują sekrecji
Zmienić leki
Zmienić leki
Zastosować stymulację
wydzielania śliny
Zastosować stymulację wydziela-
nia śliny
Zastosować stymulację wydzielania
śliny
Wykonać test Dentocult
SM i LB
Wykonać test Dentocult SM i LB
Wykonać test Dentocult SM i LB
Skontrolować dietę
Skontrolować dietę
Częściej stosować lakiery fluorowe

Testy ryzyka i aktywności próchnicy
51
Tab. 7. Zestawienie pomocnicze do klinicznej oceny ryzyka próchnicy
Własności buforowe śliny
Brak ubytków próchnicowych
Pojedyncze ubytki próchnicowe Kilka ubytków próchnicowych
Silne właściwości buforowe
Nie sugeruje się leczenia
Nie sugeruje się leczenia
Nie sugeruje się leczenia
Słabe właściwości buforowe
Sprawdzić tempo sekrecji
Stymulować sekrecję
Stymulować sekrecję
Sprawdzić sekrecję spoczynkową
Zastosować lakiery fluorowe
Częściej stosować lakiery fluorowe
Działanie śliny jest różnokierunkowe i zależne od jej właściwości. Większe wydzielanie
i mniejsza gęstość są czynnikami powodującymi wypłukiwanie płytki nazębnej wraz
z drobnoustrojami. Natomiast zawarte w ślinie związki chemiczne mają zdolność zobo-
jętniania kwaśnych produktów metabolizmu bakterii, jest to tzw. działanie buforowe.
Oprócz wymienionych dwu głównych mechanizmów obronnych ślina wykazuje także,
dzięki zawartym w niej enzymom, działanie bakteriolityczne, a obecność immunoglobu-
lin warunkuje działanie odpornościowe.
Do badania mikrobiologicznego śliny można użyć testów Dentocult SM i LB, które są
bardzo proste i łatwe do wykonania. Od pacjenta na czczo pobiera się próbki śliny sty-
mulowanej żuciem parafiny. Liczebność kolonii bakterii SM ocenia się paskami testo-
wymi, które wprowadza się do jamy ustnej, 10-krotnie obracając je na powierzchni ję-
zyka. Następnie pasek umieszcza się w bulionie i inkubuje przez 48 godzin w tempera-
turze 35-37°C.
Wyhodowane kolonie bakterii porównujemy ze wzorcem, przyjmując następującą
ocenę:
·
0 i l – mała liczebność wyhodowanych kolonii – CFU < 10
5
/ml śliny do 100 tys.
·
2 – średnia liczebność wyhodowanych kolonii – CFU pomiędzy 10
5
, a 10
6
/ml śliny
(od 100 tys. do miliona)
·
3 – duża liczebność wyhodowanych kolonii CFU > 10
6
/ml śliny (powyżej l miliona)
Badanie pH śliny przy użyciu testu Dentobuff Strip.

Rozdział 3
52
Tab. 8. Zestawienie pomocnicze do klinicznej oceny ryzyka próchnicy
Streptococcus mutans
Brak ubytków próchnicowych
Pojedyncze ubytki próchnicowe
Kilka ubytków próchnicowych
Niskie miano drobnoustrojów
Nie sugeruje się leczenia
Nie sugeruje się leczenia
Sprawdzić, czy pacjent bierze antybiotyki
Sprawdzić miano drobnoustrojów
Sprawdzić uprzednią aktywność próchnicy
Wysokie miano drobnoustrojów
Podwyższone ryzyko
Podwyższone ryzyko
Wysokie ryzyko
Poinformować pacjenta
Poinformować pacjenta
Leczenie chlorheksydyną w postaci la-
kieru lub żelu
Rozważyć możliwość po-
krycia bruzd i szczelin
Rozważyć możliwość profesjonalnego
oczyszczenia zębów
Profesjonalne oczyszczenie zębów
Sprawdzić miano drobno-
ustrojów
Rozważyć możliwość pokrycia bruzd
i szczelin
Pokrycie bruzd i szczelin
Sprawdzić miano drobnoustrojów
Sprawdzić miano drobnoustrojów
Tab. 9. Zestawienie pomocnicze do klinicznej oceny ryzyka próchnicy
Lactobacillus acidophilus
Brak ubytków próchnicowych
Pojedyncze ubytki próchnicowe
Kilka ubytków próchnicowych
Niskie miano drobnoustrojów
Nie sugeruje się leczenia
Nie sugeruje się leczenia
Sprawdzić uprzednią aktywność
próchnicy
Wysokie miano drobnoustrojów
Podwyższone ryzyko
Podwyższone ryzyko
Wysokie ryzyko
Poinformować pacjenta
Poinformować pacjenta
Poinformować pacjenta
Wykonać zdjęcie rtg
(skrzydłowo-zgryzowe)
Wykonać zdjęcie rtg
(skrzydłowo-zgryzowe)
Wykonać zdjęcie rtg
(skrzydłowo-zgryzowe)
Rozważyć możliwość
zmiany diety
Wypełnić ubytki próchnicowe, wypo-
lerować stare wypełnienia, usunąć
miejsca retencyjne i płytkę nazębną
Wypełnić ubytki próchnicowe, wypo-
lerować stałe wypełnienia, usunąć
miejsca retencyjne i płytkę nazębną
Rozważyć możliwość
pokrycia bruzd i szkliwa
Skontrolować dietę
Skontrolować dietę
Rozważyć możliwość pokrycia bruzd
i szczelin
Pokryć bruzdy i szczeliny
Sprawdzić miano drobnoustrojów
Sprawdzić miano drobnoustrojów

Testy ryzyka i aktywności próchnicy
53
Omówione powyżej testy pomagają w ustaleniu stopnia narażenia pacjenta na próchnicę
oraz są pomocne w planowaniu indywidualnej profilaktyki i leczenia. Należy jednak pa-
miętać, iż na wyniki przeprowadzonych testów ma wpływ wiele czynników np.: sposób
i rodzaj odżywiania, pora dnia, stosowanie związków fluoru czy płukanek bakteriobój-
czych. Wszystkie te czynniki mogą oddziaływać na uzyskany pomiar. Powtórzenie testu
nawet w ciągu minuty może dać inny rezultat. Jest to jednak ważna informacja, która po-
zwala lekarzowi na szersze możliwości diagnostyczne, a pacjentowi uświadamia w jakim
stopniu profilaktyka, leczenie, higiena i odżywianie może oddziaływać na toczący się w
jego uzębieniu proces próchnicowy.
Do oceny efektywności przeprowadzonych zabiegów higienicznych zaleca się stoso-
wanie następujących testów:
1.
Aproxymalny wskaźnik płytki według Langego (API). Po zastosowaniu tabletek wybar-
wiających ocenia się płytkę nazębną w 4 kwadrantach. W l. (szczęka po stronie prawej)
i 3. (żuchwa po stronie lewej) – badanie przeprowadza się od strony jamy ustnej wła-
ściwej i w kwadrantach 2. (szczęka po stronie lewej) i 4. (żuchwa po stronie prawej)
od strony przedsionkowej. Wartość wskaźnika stanowi sumę przestrzeni międzyzę-
bowych z płytką pomnożoną przez 100 i podzieloną przez sumę wszystkich ocenia-
nych przestrzeni.
Wielkość wskaźnika API:
100-70% – niedostateczna higiena jamy ustnej;
70-40% – higiena dostateczna;
39-25% – higiena dość dobra;
poniżej 25% – higiena optymalna.
2. Fuksynowy wskaźnik higieny jamy ustnej. Stosujemy roztwór fuksyny zasadowej
(5 kropli) rozpuszczonej w 10 ml wody, którym płuczemy jamę ustną przez 30 se-
kund. Na powierzchniach zębów pokrytych nalotem występuje intensywne zabarwie-
nie na kolor różowy. Bada się 3 zęby w szczęce i żuchwie.
Ocena wskaźników:
0 – brak zabarwienia;
1 – zabarwienie ⅓ wysokości korony;
2 – zabarwienie od ⅓ do ⅔ wysokości korony;
3 – zabarwienie ponad ⅔wysokości korony.
W ocenie ryzyka próchnicy można stosować wskaźnik poziomu kwasu mlekowego
Clinpro™ Cario L-Pop™ (Dybiżbiańska i wsp. 2003). Na podstawie przeprowadzonych
badań oceniających skuteczność tego wskaźnika można stwierdzić, że jego zaletą jest
szybkość i łatwość wykonywania, zaś wadą niewiele różniąca się między sobą skala barw
w grupie poziomu kwasu mlekowego.

Rozdział 3
54
Nowy test do oceny ryzyka próchnicy Clinpro Caries L-Pop
Test wykonuje się 30-45 minut po zakończeniu zabiegów higienicznych. Aplikatorem,
który obraca się czterokrotnie (prawo-lewo), pobiera się wymaz z języka, następnie
nasącza się płynem diagnostycznym i pozostawia na 2 minuty.
Kolor porównuje się z tabelą barw kontrolnych (skala 1-9):
•
1-3 – mały poziom kwasu mlekowego,
•
4-6 – umiarkowany poziom kwasu mlekowego, co świadczy o niewystarczającej
kontroli procesu próchnicowego,
•
7-9 – wysoki poziom wytwarzania kwasu mlekowego, wskazuje na konieczność
podjęcia wielokierunkowej profilaktyki.
Clinpro™ Cario L-Pop™, wskaźnik obecności kwasu mlekowego
Test umożliwia określenie podatności na próchnicę i ryzyka powstania próchnicy. Po-
zwala on ocenić obecność kwasu mlekowego wytwarzanego przez bakterie próchni-
cotwórcze tworzące część flory bakteryjnej języka. Uwalnianie kwasu mlekowego jest
wskaźnikiem aktywności metabolicznej tych drobnoustrojów. Wyższa aktywność me-
taboliczna bakterii próchnicotwórczych w jamie ustnej pacjenta stwarza wysokie ryzyko
rozwoju próchnicy.
Clinpro Cario L-Pop można stosować do wczesnego określenia potencjalnego zagrożenia
próchnicą wywołanego przez drobnoustroje w jamie ustnej. Ma to szczególne znaczenie,
gdyż bakterie wytwarzające kwas mlekowy mają różny poziom aktywności metabolicz-
nej u różnych pacjentów. Wyniki testu umożliwiają wczesne wprowadzenie i utrzymanie
niezbędnej profilaktyki oraz szybką ocenę zmian w podatności na próchnicę.
Czynniki ryzyka oceniane podczas wywiadu takie jak:
1.
nawyki higieniczne (0 – optymalne; l – dostateczne; 2 – niedostateczne),
2.
ekspozycja na związki fluoru (0 – optymalna; l – średnia; 2 – niedostateczna),
3.
częstotliwość spożycia cukru (0 – mała; l – średnia; 2 – duża),
4.
skład diety (0 – prawidłowy; l – częściowo prawidłowy; 2 – nieprawidłowy),
5.
współistniejące choroby ogólne (Nie, Tak),
6.
stosowanie leków upośledzających wydzielanie śliny (Nie, Tak),
7.
status społeczno-ekonomiczny (wykształcenie, wywiad rodzinny, poziom socjalny,
sytuacja materialna).
Podsumowując wyniki uzyskane w czasie badania przedmiotowego oraz z wywiadu
możemy określić profil ryzyka próchnicy.

Testy ryzyka i aktywności próchnicy
55
„Cariogram” w ocenie ryzyka próchnicy
Jest programem komputerowym (Bratthall 1996, Petersson i Bratthall 2000) umożliwia-
jącym graficzne przedstawienie (wykres kołowy) interakcji między czynnikami sprzyja-
jącymi powstawaniu próchnicy zębów, określenie szansy na jej uniknięcie oraz wskazuje
na potrzebę wykonania określonych zabiegów profilaktycznych w konkretnych przypad-
kach klinicznych. Może być pomocny w ocenie ryzyka próchnicy, porównaniu stanu
pacjentów na podstawie danych uzyskanych z badań epidemiologicznych, a także dla
celów edukacyjnych. Czynniki od l do 6 zwiększają ryzyko powstawania próchnicy, zaś
od 7 do 9 obniżają je. Czynnik 10 zależny jest od stosunku pacjenta do proponowanych
przez lekarza zabiegów profilaktycznych.
W programie do oceny ryzyka próchnicy wykorzystano następujące czynniki wpły-
wające na przebieg próchnicy:
1.
występowanie objawów próchnicy,
2.
choroby ogólnoustrojowe mogące mieć na nią wpływ,
3.
skład diety,
4.
częstotliwość spożywania posiłków,
5.
obecność płytki nazębnej,
6.
występowanie bakterii Streptococcus mutans,
7.
fluoryzacja kontaktowa,
8.
ilość buforowa śliny,
9.
zdolność buforowa śliny,
10.
kliniczna ocena ryzyka dokonana przez lekarza.
W programie wykorzystano wykres kołowy podzielony na 5 różnokolorowych stref
przy czym oznaczenie kolorem:
-
zielonym (w %) wyraża „aktualną szansę na uniknięcie próchnicy”;
-
ciemnoniebieskim, odpowiada diecie;
-
czerwonym, wskazuje na obecność bakterii w jamie ustnej (płytka nazębna i bakterie
Streptococcus mutans w ślinie);
-
jasnoniebieskim – podatność zębów na próchnicę (fluoryzacja, wydzielanie śliny i jej
zdolności buforowe);
-
żółtym – uwarunkowania (przedstawienie wcześniejszego występowania próchnicy
i chorób ogólnoustrojowych mających wpływ na jej przebieg).
Najważniejsza jest strefa zielona, im jest ona większa (większy odsetek) tym mniejsze jest
ryzyko powstania nowych ubytków próchnicowych.
Porównanie wyników badania kontrolnego pacjenta z wcześniej przeprowadzonymi
pozwala na ocenę skuteczności postępowania leczniczego i profilaktycznego.

Rozdział 3
56
Wskaźniki barwne
Jednym z polecanych sposobów diagnozowania próchnicy jest zastosowanie barwników.
Są to związki chemiczne wybarwiające zębinę, w której doszło do uszkodzenia organicz-
nej matrycy kolagenowej. Zasada działania barwników do wykrywania próchnicy opiera
się na uproszczonym podziale zębiny próchnicowej na dwie różniące się między sobą
warstwy. W pierwszej, zwaną martwicą stwierdzono rozpad włókien kolagenowych,
obecność nieregularnie rozmieszczonych granulek soli mineralnych i licznych bakterii.
W warstwie tej nie znaleziono wypustek odontoblastów, a po zastosowaniu 0,5% roz-
tworu fuksyny zasadowej w glikolu propylenowym dochodzi do jej trwałego wybar-
wienia, którego nie da się wypłukać. Natomiast w drugiej spostrzeżono zdrowe włókna
kolagenowe z przyczepionymi do nich igiełkowatymi kształtami apatytu oraz wypustki
odontoblastów. Warstwa ta nie jest zasiedlona przez bakterie i nie wybarwia się trwa-
le. Oprócz budowy morfologicznej obie warstwy różnią się funkcjami czynnościowymi.
Pierwsza nie jest zdolna do remineralizacji, natomiast leżąca pod nią (też odwapniona)
zawiera nieuszkodzoną matrycę kolagenową oraz są w niej wypustki odontoblastów, co
sprawia, że może ulegać ponownej mineralizacji od strony miazgi.
Do identyfikowania próchnicowo zmienionej zębiny klinicznie stosujemy następu-
jące roztwory:
-
0,5% fuksyny zasadowej w glikolu polietylenowym,
-
1% czerwieni kwaśnej lub metalicznego błękitu (nie zyskał akceptacji ze względu na
swą toksyczność).
Natomiast do uwidocznienia płytki nazębnej zalecane są:
-
3% wodny roztwór erytrozyny (płytka wybarwia się na kolor jasnoczerwony);
-
fluoresceina, promienie nadfioletowe (Aparat Broxo Test) – płytka wybarwia się na
kolor żółty;
-
lampa fluoroscencyjna – płytka i kamień wybarwiają się na kolor pomarańczowy;
-
Carie test (płyn zawierający zielony sulfan i żółtą tartrazynę) – płytka wybarwia się
na kolor zielony.
Wskaźnik OHI według Green’a i Vemilliona
Ocenia się 6 zębów, po jednym z każdej grupy położonej przeciwstawnie np. prawy gór-
ny siekacz centralny, pierwszy przedtrzonowy oraz analogiczne zęby po stronie lewej żu-
chwy, oddzielnie bada się powierzchnie policzkowe i językowe. Uzyskane wyniki sumu-
je się i dzieli przez liczbę badanych zębów. Otrzymane dane są oddzielne dla kamienia
i osadu.

Testy ryzyka i aktywności próchnicy
57
Kryteria oceny miękkiego osadu:
0
– brak;
1 – występuje na 1/3 powierzchni zęba;
2 – występuje na 1/3 do 2/3 powierzchni zęba;
3 – występuje na ponad 2/3 powierzchni zęba.
Kryteria oceny kamienia:
0
– brak;
1
– pokrywa nie więcej niż 1/3 powierzchni korony zęba;
2
– pokrywa od 1/3 do 2/3 powierzchni korony zęba;
3 – pokrywa ponad 2/3 powierzchni korony zęba.
Caries Indicator Sable Seek
(Ultradent) (czerwony barwnik, wodny roztwór fuksyny)
Materiał został m.in. oceniony w Zakładzie Stomatologii Zachowawczej IS WUM, gdzie
okazał się szczególnie przydatny do uwidocznienia pozostawionej zębiny próchnicowej
w okolicy połączenia szkliwno-zębinowego (Rusyan i wsp. 2005). Ocena kliniczna doko-
nana przy użyciu metod konwencjonalnych: zgłębnikowania i oglądania, nie pokrywała
się z wynikami uzyskanymi przy wybarwieniu próchnicy tym barwnikiem. Zdaniem
autorów może to być powodem nieuzasadnionego, nadmiernego usuwania twardych
tkanek zęba, podczas preparacji ubytku, co w konsekwencji osłabia strukturę zęba.
W zakresie oceny zębiny próchnicowej większość badaczy jest zdania że twardość i ko-
lor zębiny w obrębie połączenia szkliwno-zębinowego są wystarczającym kryterium do
oceny stopnia opracowania zmian próchnicowych. Stosowanie wskaźników barwnych
nie zawsze prowadzi do usunięcia całej zakażonej zębiny. Zastosowanie preparatu Sable
Seek w procesie edukacji klinicznej w grupach studenckich rozpoczynających zajęcia ze
stomatologii zachowawczej znacznie poprawiło ich komfort pracy oraz zmniejszyło stres
związany z leczeniem pacjentów.
Barwniki próbowano także zastosować do diagnozowania wczesnych stadiów uszkodzeń
szkliwa. Dostają się one jednak w mikropory odwapnienia powodując trwałe zabarwie-
nie tej tkanki. Wprowadzono więc takie, które uwidaczniają się dopiero po zastosowaniu
promienio wania UV lub lampy fluoroscencyjnej. Badania nad bezpiecznymi w stoso-
waniu wskaźnikami barwnymi pozwalającymi określić obecność aktywnej próchnicy na
powierzchni szkliwa bez trwałego przebarwienia tkanki trwają nadal i należy mieć na-
dzieję, że zakończą się sukcesem. Podsumowując dane uzyskane w czasie badania przed-
miotowego oraz z wywiadu możemy określić profil ryzyka próchnicy.

Rozdział 3
58

Etiologia, diagnostyka i zapobieganie próchnicy wtórnej
59
4
Etiologia, diagnostyka i zapobieganie
próchnicy wtórnej
Próchnicą wtórną (caries secundaria) określa się zmianę patologiczną rozwijającą się wo-
kół odbudowy twardych tkanek zęba. Może się ona pojawić wokół wypełnień wykonanych
z materiałów plastycznych lub nieplastycznych oraz stałego uzupełniania protetycznego.
Ma charakter pierwotny – próchnica nawracająca, bądź częściej występujący charakter
wtórny – próchnica przetrwała. Badania mikroskopowe wykazały, że próchnica wtórna
może występować w dwóch odmianach – zewnętrznej i wewnętrznej. Postać zewnętrzna
przypomina próchnicę pierwotną, a więc najpierw dochodzi do demineralizacji podpo-
wierzchniowej warstwy szkliwa lub cementu korzeniowego, powstaje „hiperzminerali-
zowana” warstwa powierzchowna, a następnie dochodzi do kawitacji ogniska próchni-
cowego i dalszego postępu choroby. Natomiast postać wewnętrzna charakteryzuje się
przebiegiem zmian wzdłuż ścian wypełnienia umiejscowionych w szkliwie, zębinie lub
cemencie korzeniowym. W obrębie szkliwa dochodzi do demineralizacji podpowierzch-
niowej lub postępującej do powierzchni zęba. Gdy próchnica wtórna wewnętrzna obej-
muje zębinę to przyjmuje postać podminowującej dochodzącej do połączenia szkliwno-
zębinowego. W obrębie zębiny dochodzi do demineralizacji: powierzchniowej, podpo-
wierzchniowej, z nie zmienioną jej powierzchnią lub z hipermineralizacją powierzchni.
W warstwie cementu korzeniowego spostrzega się warstwę hipermineralizacji tkanki tuż
pod powierzchnią ogniska próchnicowego.
Objawy próchnicy wtórnej to:
-
rozmiękły brzeg wypełnienia wyczuwalny przy delikatnej penetracji sondą
stomatologiczną,
-
wyraźne uszkodzenie wypełnienia (0,4 mm) z odsłonięciem miękkiego dna ubytku.
Z pojawieniem się objawów próchnicy wtórnej zewnętrznej wiązane są bakterie płytki
nazębnej, głównie Streptococcus mutans oraz z rodzaju Lactobacillus. Streptococcus
mutans odpowiedzialny jest za zapoczątkowanie procesu próchnicowego, natomiast
Lactobacillus, związany jest z dalszym jej rozwojem.
W przypadku próchnicy wtórnej wewnętrznej pozostaje wiele pytań, nadal nie
znajdujących odpowiedzi:
•
Czy zębina próchnicowa pozostawiona pod szczelnym wypełnieniem może rozwi-
jać się samoistnie?

Rozdział 4
60
•
Czy do rozwoju pozostawionej próchnicy, czy też powstaniu „nowej wtórnej we-
wnętrznej”, niezbędne jest przenikanie drobnoustrojów?
•
Czy konieczna jest stała podaż węglowodanów ze środowiska jamy ustnej?
•
Czy istnieje związek pomiędzy bakteriami płytki nazębnej, a znajdującymi się
w szczelinie brzeżnej?
•
Czy dla dalszego rozwoju próchnicy, czy też powstania „nowej” konieczne są
„nowe” bakterie pochodzące z płytki nazębnej?
•
Czy bakterie znajdujące się w szczelinie brzeżnej są wrażliwe na stosowanie związ-
ków fluoru?
Objawy towarzyszące próchnicy wtórnej:
1.
Obecność plamy próchnicowej przy wypełnieniu lub uzupełnieniu.
2.
Ubytek w szkliwie.
3.
Ubytek w szkliwie z odsłonięciem zębiny.
4.
Przebarwienie krawędzi wypełnienia.
5.
Obecność szczeliny brzeżnej.
6.
Szczelina brzeżna > 250 μm.
Trudności w diagnostyce próchnicy wtórnej
Diagnostyka próchnicy wtórnej jest równie trudna jak pierwotnej. Należy przeprowadzić
badania przedmiotowe i podmiotowe.
W badaniu przedmiotowym należy ustalić czy towarzyszy jej nadwrażliwość zębiny na
bodźce termiczne i osmotyczne. Badanie należy przeprowadzić przy dobrym oświe-
tleniu na oczyszczonym i osuszonym zębie z użyciem okrągło zakończonego zgłębni-
ka lub sondy periodontologicznej. Następnie należy np.: wykonać zdjęcie skrzydłowo-
zgryzowe lub pantomogram N, wykorzystać transiluminację lub urządzenie DIAGNO-
dent oraz przeprowadzić badania mikrobiologiczne pod kątem obecności paciorkowców
z grupy Streptococcus mutans i pałeczek kwasu mlekowego. Badanie bakteriologiczne
umożliwia ocenę stopnia zakażenia zębiny, stężenia bakterii zwłaszcza kwasotwórczych,
a w przypadku próchnicy korzenia Actinomyces naeslundi. Pomiędzy ogólnym byto-
waniem drobnoustrojów w jamie ustnej, a zasiedleniem krawędzi wypełnienia istnie-
je jasna, pozytywna korelacja. Wykrycie próchnicy zewnętrznej czy występuje tylko nie-
szczelność na granicy wypełnienie/ząb, czy już rozwija się proces próchnicowy. Odróż-
nić „nową” próchnicę wtórną od pozostawionej pod wypełnieniem zębiny próchnico-
wej, odróżnić próchnicę wtórną aktywną od zatrzymanej.
Wykrycie próchnicy wewnętrznej jest trudniejsze niż zewnętrznej
-
obecność przebarwienia brzegu wypełnienia (rozwój zębiny próchnicowej),
-
otwarty ubytek w pobliżu wypełnienia z obnażona zębiną,
-
badania histopatologiczne z oczywistych względów nie mogą być polecane.

Etiologia, diagnostyka i zapobieganie próchnicy wtórnej
61
Tab. 10. Rodzaje próchnicy wtórnej według Halsa i wsp. (1974)
Rodzaj próchnicy wtórnej
częstość występowania w %
Zewnętrzna i wewnętrzna
59,5
Zewnętrzna
21,4
Wewnętrzna
11,9
Brak próchnicy
7,2
Tab. 11. Czynniki wpływające na aktywność próchnicotwórczą bakterii wnikających w mikroszczelinę według
Pashleya (1990)
1
Liczba
2
Zjadliwość
3
Podaż węglowodanów w pożywieniu
4
Właściwości kariostatyczne śliny
5
Czas trwania mikroprzecieku
6
Szerokość mikroszczeliny
7
Lokalizacja mikroszczeliny z biofilmem względem powierzchni zęba
Wieloczynnikowe ryzyko wystąpienia próchnicy wtórnej według Noacka i wsp. (2005)
jest wypadkową równowagi pomiędzy demineralizacją związaną z bakteriami i mechani-
zmami działającymi przeciwko odkładaniu płytki nazębnej i demineralizacji.
Biofilm (wirulencja, dieta, czas)
Mechanizmy zapobiegawcze
Dokładność dopasowania
Antybakteryjne właściwości materiałów wypełniających
Kontrola płytki nazębnej w warunkach domowych
Profesjonalne zabiegi zapobiegawcze
Próchnica wtórna =
Przyleganie brzeżne wypełnień do ścian ubytku (nieszczelność brzeżne) według
Gajdzik-Pluteckiej i wsp. (1997):
A. Mikroprzeciek wzdłuż wypełnienia,
B. Otwarta szczelina,
C. Płytkie rowkowate zagłębienie (nie związane z mikroprzeciekiem),

Rozdział 4
62
D. Pęknięcie w obrębie szkliwa,
E. Pęknięcie w obrębie wypełnienia.
Skala oceny szczelności brzeżnej wypełnienia (penetracja barwnika – 0,5% fuksyna
zasadowa):
0
– brak,
1
– do połowy wypełnienia,
2
– do dna ubytku,
3
– widoczna wokół całego ubytku,
4
– dochodząca przez zębinę do komory miazgi.
Przebarwienie brzeżne nie jest kryterium występowania aktywnej próchnicy wtórnej.
Przebarwienie brzeżne według Van Dijkena (1999):
0
– brak,
1
– nieznaczne przebarwienie, możliwość usunięcia przez wypolerowanie,
2
– widoczne przebarwienie niemożliwe do usunięcia przez wypolerowanie,
3
– znaczne przebarwienie.
Zapobieganie i leczenie próchnicy wtórnej
Przeprowadzone badania wskazują, że mamy do czynienia z infekcją wieloczynni-
kową, więc leczenie przyczynowe musi być ukierunkowane na czynniki etiologiczne,
na które można wywierać jakikolwiek wpływ. Miejscowe zastosowanie związków flu-
oru lub chlorheksydyny stanowi sensowne uzupełnienie metod zapobiegawczych.
Szczególnie w przypadku pacjentów starszych, których higiena jamy ustnej w warun-
kach domowych jest nieco ograniczona. W badaniu klinicznym wykazano, że miej-
scowa aplikacja 1% żelu chlorheksydyny umożliwia obniżenie liczby paciorkowców
z grupy Streptococcus mutans poniżej granicy wykrywalności, nawet w obszarze krawę-
dzi wypełnień. Efekt ten utrzymywał się przez 2-3 miesiące.
Ogólne zalecenia praktyczne
Z klinicznego punktu widzenia głównym problemem jest widoczność pola zabiegowego
i niebezpieczeństwo pozostawienia ogniska próchnicowej zębiny.
-
Zaleca się otwarcie ubytku aż do uzyskania pełnej widoczności pola zabiegu; w tym
celu należy usunąć części wypełnienia podminowane próchnicą.
-
Poszerzenie dna ubytku aż do uzyskania jednoznacznie przebarwionego próchnicą
dojścia do istniejącego wypełnienia. W przeciwnym razie można odbudować
krawędź wypełnienia z zastosowaniem techniki adhezyjnej (np. półpłynny materiał
wypełniający i system łączący).
-
Ubytek szkliwa lub rozmiękczenie zębiny na krawędzi wypełnienia świadczą
o aktywnej próchnicy wtórnej.

Etiologia, diagnostyka i zapobieganie próchnicy wtórnej
63
-
Przebarwienia krawędzi i jej nieszczelności są wyłącznie symptomami klinicznymi
i nie mają nic wspólnego z obecnością próchnicy wtórnej.
-
W przypadkach wątpliwych jest to ostatni moment do podjęcia decyzji, czy jednak
nie należy usunąć całego wypełnienia.
-
Przed całkowitą wymianą wypełnień należy sprawdzić, czy możliwa jest naprawa
uszkodzenia krawędzi wypełnienia.
-
Przebarwienia wokół wypełnienia amalgamatowego przy klinicznie nienaruszonym
brzegu ubytku nie powodują konieczności jego wymiany.
-
Próchniczy ubytek tkanek, który nie może być oczyszczony stanowi wskazanie do
naprawy lub wymiany wypełnienia.
-
Przebarwienia i zmiana barwy w wypełnieniach wykonanych z materiałów złożonych
lub innych w kolorze zęba, nie są widocznym wskaźnikiem obecności miękkiej
zainfekowanej zębiny pod wypełnieniem, ale mogą świadczyć o mikroprzecieku
i próchnicy wtórnej wewnętrznej. Czasem wystarczy odświeżenie brzegów
wypełnienia, zaś w przypadku obecności widocznej szczeliny należy wypełnienie
naprawić lub wymienić.
-
Demineralizacja zębiny traktowana jest jako punkt krytyczny zaawansowania
i wymagane jest wtedy leczenie inwazyjne, aby zatrzymać dalszy rozwój próchnicy.
Na obecnym etapie wiedzy nie został jednoznacznie określony:
·
związek pomiędzy próchnicą wtórną wewnętrzną, a płytką nazębną,
·
wpływ pozostawionej podczas opracowania ubytku zębiny próchnicowej na dalszy
rozwój choroby oraz możliwość zahamowania próchnicy przez jej pokrycie
wypełnieniem adhezyjnym.
Nie udało się jak dotąd, wyprodukować materiału idealnie przylegającego do tkanek
zęba, co powoduje, że zębina próchnicowa powinna być doszczętnie usuwana. Brak
idealnej szczelności wypełnień skłania również do zwrócenia szczególnej uwagi na
zabiegi higieniczne w aspekcie zapobiegania próchnicy wtórnej.

64

Izolacja pola zabiegu (koferdam)
65
5
Izolacja pola zabiegu (koferdam)
Współczesne leczenie stomatologiczne wymaga właściwego przygotowania i zabezpie-
czenia pola zabiegu. Używanie wałków z ligniny i ślinociągu (ewentualnie ssaka) w dobie
coraz powszechniejszego stosowania technik adhezyjnych w stomatologii odtwórczej
oraz we współczesnym postępowaniu aseptycznym podczas leczenia endodontycznego
jest niewystarczające. Nie zabezpiecza przed możliwością zanieczyszczenia opracowane-
go ubytku przez ślinę, krew czy inne płyny, co zasadniczo wpływa na jakość wypełnienia.
Tkanki miękkie jamy ustnej nie są też chronione przed działaniem związków chemicz-
nych – kwasów, zasad, monomerów, niespolimeryzowanych materiałów łączących lub
wypełniających, czy środków stosowanych w leczeniu endodontycznym. Ten sposób izo-
lacji nie zabezpiecza przed możliwością aspiracji do układu oddechowego, połknięciem
lub zjedzeniem resztek z preparowanych tkanek twardych czy obcych przedmiotów (np.
narzędzi endodontycznych). Wałki z ligniny nie chronią także przed możliwością infek-
cji. Historycznie, poza wałkami proponowanych było oczywiście wiele sposobów zabez-
pieczenia pola pracy w stomatologii np.: folia ze złota (do II połowy XIX wieku), wosk
(Hoffmann-Axthelm 1981) oraz gumowy koferdam opracowany w 1864 r. przez Barnu-
ma (Abrams i wsp. 1982). Wprowadzenie koferdamu rozpoczęło erę właściwej ochrony
pola zabiegu. Początkowo był on stosowany w USA, natomiast od 1900 r. zaczęto zakła-
dać go także w Europie. Pierwsze elementy stabilizujące koferdam, klamry, opracowano
w USA w 1870 r., a arkusze z lateksu wprowadzono w 1943 r.
Ryc. 5.1.
Pierwsze arkusze koferdamu dostępne w Europie
Założony koferdam stanowi prostą i skuteczną metodę ochrony pola operacyjnego przed
zakażeniem drobnoustrojami znajdującymi się w ślinie. Jego użycie niesie zarówno

Rozdział 5
66
komfort dla pacjenta jak i lekarza. Skraca czas wykonania zabiegu oraz ogranicza jego
bezproduktywną utratę wynikającą z konieczności zmiany wałków.
Koferdam powinno się zakładać:
·
W endodoncji (izolacja zęba, ułatwienie dostępu, polepszenie widoczności poprzez
odsunięcie języka, warg, policzków i dziąsła, ułatwiona pracy z systemami
optycznymi, zabezpieczenie pacjenta przed substancjami żrącymi takimi jak:
podchloryn sodu, woda utleniona, kwas cytrynowy, etc), ochrona pacjenta przed
połknięciem lub aspiracją resztek materiałów, drobnych narzędzi endodontycznych
do gardła lub co gorsza do tchawicy, aseptyka (izolacja pola zabiegowego przed
dostępem drobnoustrojów znajdujących się w ślinie), oszczędność czasu lekarza
oraz znaczne skrócenie czasu wykonywania zabiegu.
·
Przy stosowaniu polimerów (wypełnienia ubytków próchnicowych wszystkich klas,
pochodzenia niepróchnicowego lub po urazie) zapewnienie suchości pola zabiegu
– poprawa adhezji, a więc zwiększoną szczelność wypełnień.
·
Przy profesjonalnym wybielaniu zębów środkami o wysokim stężeniu nadtlenku
wodoru i mocznika, gdyż chroni tkanki miękkie przed działaniem nadtlenków
i podniesioną w czasie reakcji utleniania temperaturą.
W zależności od rodzaju wykonywanego zabiegu zastosowanie koferdamu niesie
następujące korzyści:
-
zapewnia optymalny zasięg pola zabiegu i wygodę pracy;
-
chroni pacjenta przed ubocznymi efektami mechanicznej lub chemicznej obróbki
zębów oraz wypełnień np. opiłkami amalgamatu zawierającymi rtęć;
-
chroni przed zanieczyszczeniem;
-
nie dopuszcza do bezpośredniego kontaktu błony śluzowej z niespolimeryzowaną
żywicą;
-
skraca czas zabiegu (nie ma konieczności zmiany wałków ligniny) – standardowy
czas zakładania koferdamu wynosi 90-150 sekund.
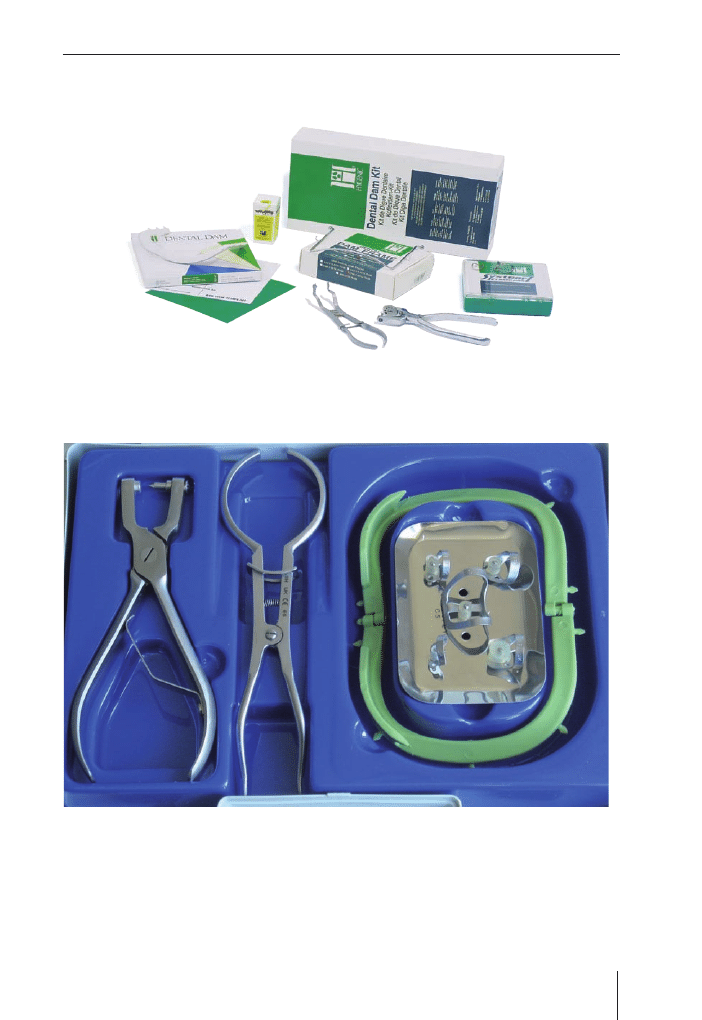
Izolacja pola zabiegu (koferdam)
67
Ryc. 5.2. Zestaw koferdamu (Hygenic)
Ryc. 5.3. Zestaw do koferdamu (Ash).
W skład standardowego zestawu koferdamu wchodzą najczęściej: arkusze gumy, ramka,
klamry stabilizujące, kleszcze do klamer i perforacji koferdamu.

Rozdział 5
68
• Arkusze gumy
Arkusze gumy występują przeważnie w 2 rodzajach (lateksowy i bezlateksowy) oraz róż-
nych grubościach i kolorach. Koferdam bezlateksowy w porównaniu do lateksowego jest
nieznacznie bardziej elastyczny, nie powoduje alergii, nie jest posypany pudrem oraz
nie ma charakterystycznego zapachu gumy. Rozpuszcza się jednak pod wpływem eteru.
Gumy spotykamy w dwu rozmiarach – uniwersalnym 6” x 6” oraz 5”x 5” do stosowania
w pedodoncji. Kolory jasne arkuszy stosowane są głównie w endodoncji, ponieważ
zwiększają przenikanie światła, natomiast ciemne redukują oślepianie światłem i stano-
wią dobry kontrast przy pracy. Najczęściej stosujemy gumę cienką lub o średniej gru-
bości, produkowane są także grube, bardzo grube i specjalne. Cienki koferdam z uwagi
na bardzo prosty sposób zakładania wykorzystywany jest głównie w endodoncji. Należy
jednak uważać, ponieważ jest stosunkowo delikatny i może łatwo ulec rozerwaniu. Śred-
ni (0,25 mm) jest najbardziej uniwersalny w zakładaniu. Gruby (0,30 mm), jest bardziej
odporny na rozerwanie i ułatwia retrakcję dziąsła. Bardzo gruby najdalej odsuwa tkanki
miękkie i jest najbardziej wytrzymały. Natomiast specjalny posiada zastosowanie tylko
w wybranych przypadkach. Każdy arkusz gumy może być nasycony substancjami sma-
kowymi i zapachowymi.
Ryc. 5.4. Arkusze gumy lateksowej i bezlateksowej o średniej grubości
Ryc. 5.5. Guma bezlateksowa z ramką (Hygenic)
Ryc. 5.6. Optra Dam (Ivoclar-Vivadent)

Izolacja pola zabiegu (koferdam)
69
• Ramki
Służą do napinania arkuszy gumy. Występują w 2 rozmiarach – duże i małe (stosowane
w pedodoncji). Produkowane są ze stali nierdzewnej lub tworzywa sztucznego (zwykłe
lub zawiasowe). Zaletą tych ostatnich jest przepuszczalność dla promieni rtg, dzięki cze-
mu nie zaciemniają obrazu zębów na zdjęciach, ponadto dzięki zawiasowi znajdującemu
się w linii środkowej możliwe jest robienie zdjęć w trakcie leczenia bez potrzeby zdejmo-
wania koferdamu.
Ryc. 5.7. Ramki: a. metalowa duża, b. plastykowa zwykła i c. zawiasowa
Ryc. 5.8. Opti Dam (Kerr) anterior i posterior oraz plastykowa ramka

Rozdział 5
70
• Klamry
Służą do stabilizacji arkuszy gumy na zębach. Produkowane są one w różnych kształtach
i rozmiarach, które dobiera się w zależności od wielkości i budowy zęba oraz rodzaju
wykonywanego zabiegu. Klamry zbudowane są z jednego lub dwóch łuków oraz szczęk,
które obejmują ząb w dwu punktach – od strony języka i przedsionka oraz z dwóch
otworów służących do zakładania mocowania i zdejmowania szczypiec. Ze względu
na kształt szczęk, klamry dzielimy na bezskrzydłowe i skrzydłowe. Skrzydła klamer
umożliwiają równoczesne zakładanie gumy i klamry na dany ząb. Większość klamer
posiada jeden łuk, dwa łuki posiadają klamry do zębów przednich i specjalne klamry
przyszyjkowe przeznaczone do izolowania zębów z ubytkami klasy V. Klamry występują
w zestawach lub pojedynczo np.: Ash w zestawie standardowym dostarcza 5 klamer
osadzonych w pojemniku do sterylizacji, Hygenic proponuje zestaw 9 na metalowej
podkładce, a Roeko 6 w plastykowym pudełku. Od niedawna pojawiły się także klamry
polimerowe jednorazowe (Zirc) i wielokrotnego użytku (Kerr).
Ryc. 5.9. Zestaw klamer skrzydełkowych oraz pojedyncze klamry bezskrzydełkowe (Hygenic)
Ryc. 5.10. Insti-Dam i jednorazowe klamry
polimerowe (Zirc)
Ryc. 5.11. Klamra polimerowa wielokrotnego
użytku (Kerr)

Izolacja pola zabiegu (koferdam)
71
• Kleszcze
Kleszcze do perforacji służą do wycinania otworów, dla poszczególnych grup zębowych.
Produkowane są w dwóch rodzajach – jednootworowe i uniwersalne wielootworowe
(np. 5 lub 7).
Ryc. 5.12. Kleszcze do perforacji jednootworowe i uniwersalne
• Kleszcze do klamer
Służą do chwytania, mocowania i zdejmowania klamer. Istnieje możliwość dowolnego
rozwarcia kleszczy po naciśnięcia ich rękojeści.
Ryc. 5.13. Kleszcze do klamer

Rozdział 5
72
• Akcesoria dodatkowe
1.
Szablon do zaznaczania na arkuszu gumy miejsc do wycięcia otworów
Ryc. 5.14. Szablony do wykonania otworów w koferdamie lateksowym i bezlateksowym
2.
Guma Wedjet do stabilizacji koferdamu. Produkowana jest w 3 grubościach.
Ryc. 5.15. Nici gumowe Wedjets (Hygenic)
3.
Kliny drewniane, nici i taśmy międzyzębowe do stabilizacji koferdamu.
Ryc. 5.16. Woskowane nici międzyzębowe (P&G Oral-B)
4.
Narzędzia pomocnicze np. nakładacz, upychadło kulkowe, nożyczki.
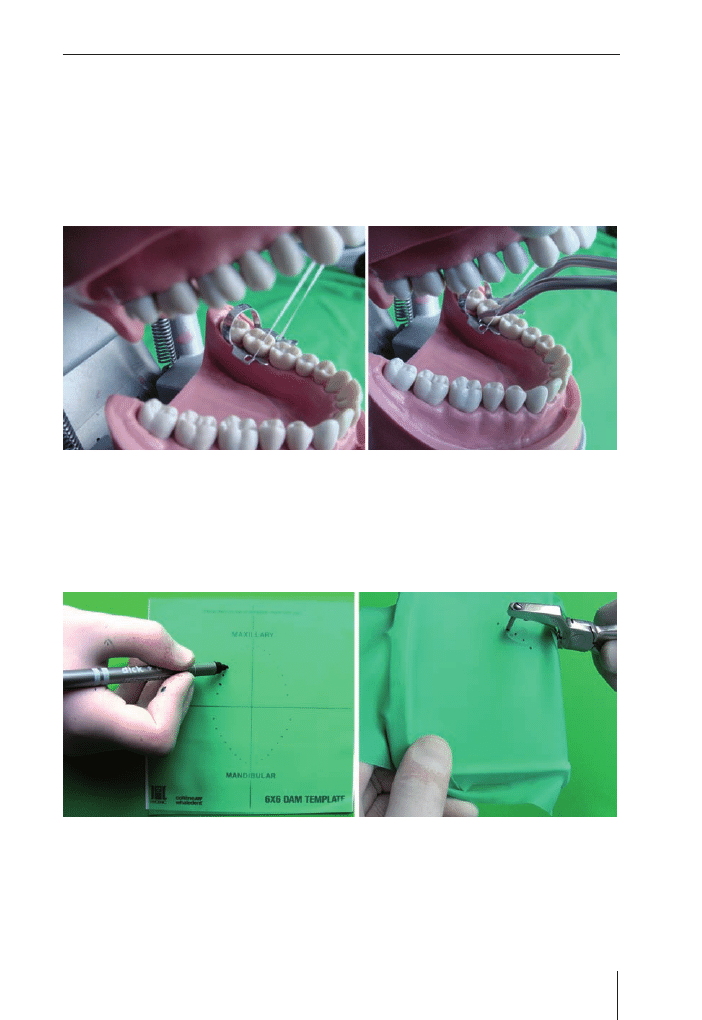
Izolacja pola zabiegu (koferdam)
73
Technika zakładania koferdamu:
·
Wybór klamry w zależności od kształtu, wielkości zęba i zębów sąsiednich,
·
Przymiarka klamry z przeciągniętą nicią międzyzębową przez otwory w jej szczękach.
Uchwycenie nici ręką zabezpiecza przed przypadkowym wypadnięciem klamry.
Ryc. 5.17. Przymiarka klamry i kontrola czy szczęki dobrze obejmują ząb
·
Zaznaczenie na arkuszu gumy miejsc, w których wycinamy otwory na zęby.
·
Perforacja koferdamu przy pomocy kleszczy.
Ryc. 5.18. Zaznaczanie miejsc na otwory przy
pomocy szablonu
Ryc. 5.19. Perforacja koferdamu kleszczami
uniwersalnymi
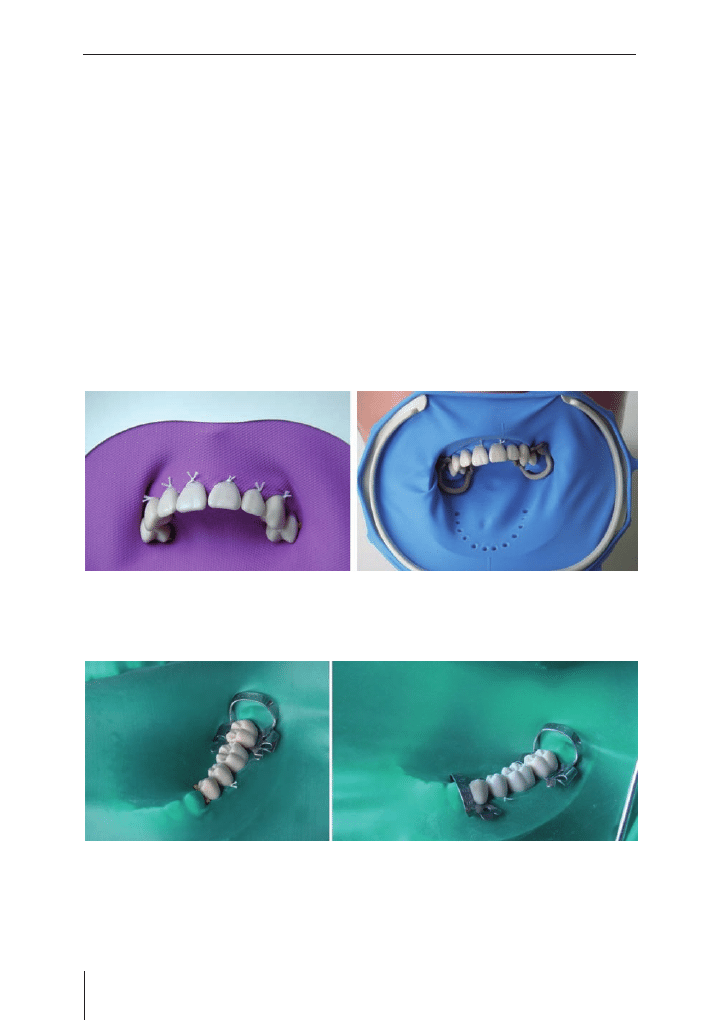
Rozdział 5
74
• Sposoby zakładania klamer
1.
Klamra bez skrzydełek – przeciągnięcie łuku klamry przez otwór w koferdamie,
nałożenie jej na ząb i przełożenie koferdamu pod szczęki klamry obejmującej koronę
zęba. Alternatywnym sposobem jest założenie klamry na ząb i przeciągnięcie przez
nią gumy.
2.
Klamra ze skrzydełkami – założenie koferdamu na skrzydełka klamry, a następnie
założenie ramki. Montaż poszczególnych elementów odbywa się poza ustami pacjenta.
Tak zamontowaną klamrę z koferdamem i ramką można jednym ruchem założyć na
ząb przeznaczony do leczenia. Na koniec ściągamy gumę ze skrzydełek.
Podstawowe sposoby zakładania koferdamu:
-
założenie rozpiętej na ramce gumy z nałożoną klamrą,
-
założenie najpierw klamry, a potem przeciągnięcie gumy,
-
założenia gumy, a następnie klamry.
Ryc. 5.20. Stabilizacja koferdamu nicią gumową
Wedjets i ligaturami z nici miedzyzębowych
Ryc. 5.21. Założony Opti Dam w odcinku przednim
stabilizacja klamrami i ligaturami
Ryc. 5.22. Stabilizacja koferdamu przy pomocy klamer, nici miedzyzębowych i Wedjets
Im dalej od opracowywanego zęba znajduje się klamra utrzymująca, tym korzystniej
rozkładają się naprężenia i uzyskujemy bardziej odpowiedni zasięg pola pracy. W obrębie

Izolacja pola zabiegu (koferdam)
75
zębów trzonowych i przedtrzonowych klamrę zakłada się przynajmniej jeden ząb dalej
od opracowywanego, a pracując w odcinku przednim najlepiej jest zastosować klamry na
zęby pierwsze przedtrzonowe.
Stosowanie koferdamu przynosi nie tylko korzyści w postępowaniu klinicznym, ale
również pozytywnie przekłada się na aspekty ekonomiczne.
Ryc. 5.23. Założony koferdam tradycyjny i Zirca przy leczeniu endodontycznym

Rozdział 5
76

Znieczulenia w stomatologii
77
6
Znieczulenia w stomatologii
Zdecydowana większość zabiegów stomatologicznych powinna być wykonywana
w znieczuleniu miejscowym lub przewodowym, aby zapewnić pacjentom pełny komfort
polegający na wyeliminowaniu bólu, a także zmniejszeniu lęku i stresu związanego
z wizytą u stomatologa. Ponadto należy pamiętać, że znieczulenie, które przeprowadza się
u większości pacjentów, jego efekt i sposób wykonywania skutkuje w znacznym stopniu
na zaufaniu jakim pacjent obdarza lekarza podczas dalszego leczenia.
Warunkiem skutecznego działania środków znieczulających miejscowo jest bezpośrednia
penetracja oraz zdolność przenikania przez różne bariery biologiczne, w tym przez osłonkę
nerwową (właściwości hydrofilowe i lipofilowe). Mechanizm ich działania polega na
blokowaniu odczuwania bólu poprzez wpływ na rozchodzenie się impulsów w nerwach
obwodowych. Hamowana jest możliwość powstawania impulsów jak i ich przewodzenie.
Działanie miejscowe środków znieczulających prowadzi do osłabienia napięcia mięśni
prążkowanych i odruchów wegetatywnych w miejscu iniekcji. Po przedostaniu się
do układu krążenia zanika ich działanie miejscowe, a może wystąpić ogólne – na
poszczególne narządy lub układy np. na ośrodkowy układ nerwowy, mięśnie gładkie
i prążkowane lub połączenia nerwowo-mięśniowe. Działanie ogólne może objawiać się
lekkim podrażnienia skóry, pokrzywką, aż do wystąpienia wstrząsu anafilaktycznego, ze
wszystkimi jego konsekwencjami. Czas utrzymywania się znieczulenia zależy również od
rodzaju środka znieczulającego. Niektóre z nich np. chloroprokaina odznaczają się bardzo
krótkim działaniem, podczas gdy inne np. bupiwakaina działają stosunkowo długo.
Działanie środków miejscowo znieczulających można przedłużyć stosując równocześnie
z nimi leki zwężające naczynia krwionośne takie jak: adrenalina, noradrenalina, kobefryna
i inne. Powodują one anemizację tkanek w miejscu zastosowania środka znieczulającego,
utrudniając jego wchłanianie.
Instrumentarium
W skład systemów deponowania znieczuleń miejscowych wchodzą:
-
igły,
-
ampułki,
-
strzykawki lub pompy.
Ampułka (karpula)
Karpula jest to nazwa ampułki dentystycznej ze środkiem znieczulającym firmy Cook-
Weite Laboratories Inc. Nazwą tą zazwyczaj określamy ampułki innych producentów,

Rozdział 6
78
a także powszechnie stosowany rodzaj strzykawki. Ampułka składa się z głowicy,
cylindra i tłoczka. Głowica zbudowana jest z aluminiowego pierścienia otaczającego
półprzepuszczalną, gumową błonę, przez którą wnika igła i dociera do środka
znieczulającego. Cylinder wykonany jest ze szkła lub plastiku. Szklany znajduje
zastosowanie we wszystkich technikach znieczulenia miejscowego, zaś plastikowy nie
powinien być stosowany w strzykawkach śródwięzadłowych ze względu na wysokie
ciśnienie, które może spowodować jego pęknięcie lub złamanie. Tłoczek produkowany
jest najczęściej z gumy, którą pokrywa silikon (środek uszczelniający).
Strzykawki
Mogą występować jako:
-
konwencjonalne,
-
śródwięzadłowe,
-
skomputeryzowane,
-
ciśnieniowe.
Konwencjonalne strzykawki do znieczuleń wewnętrznych wykonane są z metalu lub
plastiku. Mogą być jedno- lub wielorazowego użytku. Strzykawki jednorazowe są wstępnie
sterylizowane przez producenta. Strzykawki przeznaczone do wielokrotnego użytku
składają się z:
-
lufy,
-
wizjera,
-
nagwintowanej głowicy,
-
drążka tłoka,
-
uchwytu na kciuk,
-
uchwytu palcowego.
Lufa jest elementem utrzymującym ampułkę i posiada wizjer umożliwiający podgląd jej
zawartości. Nagwintowana głowica lufy umożliwia nakręcenie nasadki igły na strzykawkę.
Drążek tłoka wyposażony jest w uchwyt dla kciuka, który przekazuje nacisk operatora na
tłok umożliwiając deponowanie środka znieczulającego.
Ryc. 6.1. Standardowa metalowa strzykawka nazywana „karpulą” oraz ampułka ze środkiem znieczulającym

Znieczulenia w stomatologii
79
Do znieczuleń śródwięzadłowych stosuje się specjalną strzykawkę lub przeznaczone
do tego urządzenie np. Sleeper One, Ergoject czy Miniject. Urządzenie to generuje
siłę odpowiadającą 25 kg, co gwarantuje łatwą penetrację anestetyku, a tym samym
skuteczność znieczulenia.
Ergoject, Miniject
Strzykawki te są bardzo trwałe i zapewniają bezpieczeństwo pracy dzięki możliwości
płynnego podawania dawki znieczulenia, systemowi ochrony przed pękaniem ampułki
poprzez prosty sposób jej wymiany oraz ściśle określone dawkowanie środka do
pojedynczego naciśnięcia (Ergoject 0,2 ml, Miniject 0,1 ml). Strzykawki te są przystosowane
do sterylizacji w autoklawie w temperaturze 135°C.
Urządzenie Sleeper One 3
Jest to elektroniczny system umożliwiający wykonanie wszystkich rodzajów znieczuleń
bez używania dodatkowych materiałów jednorazowych, gdyż dołączone do zestawu
akcesoria mogą być sterylizowane w autoklawie. Urządzenie jest kompatybilne ze
wszystkimi rodzajami ampułek (1,8 ml) i igieł, ponadto istnieje możliwość stosowania
dwóch prędkości iniekcji oraz dodatkowy tryb tzw. bardzo wolny (Ultra low)
przeznaczony dla szczególnie wrażliwych pacjentów. Urządzenie daje możliwość pełnej
kontroli podawanego środka znieczulającego oraz jest bardzo precyzyjne w wykonaniu
bezbolesnego znieczulenia dzięki zastosowaniu unikalnego systemu PAR (system stałej
kontroli oporu tkanek), który automatycznie dostosowuje moc silnika do napotykanego
oporu tkanek.
Komputerowe systemy znieczuleń
Strzykawka systemu Wand
Środek znieczulający podawany jest pod kontrolą mikroprocesora. Szybkość przepływu
płynu dostosowana jest do fizjologicznego tempa przyswajania, a jego ciśnienie mieści się
w granicach fizjologicznej tolerancji. Strzykawką typu Wand można wykonywać wszystkie
rodzaje znieczuleń. Aplikator strzykawki ma kształt pióra i połączony jest z elementem
sterującym. Uruchomienie systemu następuje po naciśnięciu nożnej pompy. Ampułkę
ze środkiem znieczulającym umieszcza się w aplikatorze i dociska, aby bolec znajdujący
się w pojemniku sperforował gumowy korek. Po nałożeniu igły na końcówkę aplikatora
i naciśnięciu nożnego pedału następuje włączenie urządzenia. Środek znieczulający
zaczyna wypływać, co jest sygnalizowane dźwiękiem. Po wkłuciu igłę należy wprowadzić
ruchami obrotowymi w zakresie 180° (zapobiega to zmianie kierunku i wygięciu igły).
Ilość środka potrzebna do znieczulenia wynosi 0,5-1 ampułki 2 ml. Czas podawania jest
stosunkowo długi, wynosi około 3,5 minuty, a efekt znieczulenia trwa od 60-90 minut po
iniekcji. Zaletą tego systemu jest:
-
mniejsza bolesność, gdyż znieczuleniu ulegają tkanki znajdujące się przed końcem igły,

Rozdział 6
80
podczas całego okresu aplikacji płynu,
-
dobry efekt znieczulający, przy niewielkiej ilości wprowadzonego środka oraz nie
występuje obrzęk tkanek miękkich.
Comfort Control
Urządzenie działa w oparciu o komputerowy system deponowania środka znieczulającego.
Posiada zaprogramowane szybkości iniekcji przy znieczuleniu nasiękowym 0,17 ml/sek.,
przewodowym 0,02 ml/sek., podniebiennym 0,008 ml/sek., śródwięzadłowym 0,007
ml/sek. i śródkostnym 0,02 ml/sek. Podczas pierwszych 10 sek. wartość ta jest zawsze
jednakowa dla wszystkich technik, później można zwiększyć prędkość podawania środka
poprzez naciśnięcie przycisku na rękojeści strzykawki.
Strzykawki ciśnieniowe bezigłowe – np. INJEX
Cechy charakterystyczne systemu to:
-
eliminacja stresu,
-
eliminacja bólu,
-
precyzyjne dawkowanie leku,
-
łatwe i bezpieczne użycie,
-
podwójny mechanizm bezpieczeństwa zapobiegający przypadkowemu uruchomieniu
-
wstrzykiwania.
Zasady iniekcji bezigłowej
Środek znieczulający wprowadzany jest pod wysokim ciśnieniem, wytworzonym
przez sprężynę znajdującą się we wstrzykiwaczu (3000 psi) do lub pod błonę śluzową,
co eliminuje konieczność użycia igły. Po uruchomieniu procedury iniekcji określona
ilość środka wyrzucana jest przez mikrootwór o średnicy 0,15 mm, znajdującym się na
szczycie końcówki. Ciśnienie i szybkość płynu iniekcyjnego są tak dobrane, że dociera on
dokładnie do tkanki podskórnej. Podwójny mechanizm bezpieczeństwa zapobiegający
przypadkowemu uruchomieniu wstrzykiwania działa tylko wówczas, gdy ampułka
jest dobrze dokręcona, a zewnętrzny pierścień bezpieczeństwa głowicy został ręcznie
przesunięty do pozycji „safe off”.
Środki stosowane do znieczuleń miejscowych:
Pochodne kwasu benzoesowego:
1.
estry kwasu p-aminobenzoesowego: prokaina, chloroprokaina, benzokaina, ortoform
i inne,
2.
pochodne kwasu p-aminobenzoesowego i b-aminobenzoesowego: tetrakaina, butaka-
ina dimetokaina, leucynokaina, amykaina, tolikaina,
3.
pochodne kwasu benzoesowego, p-hydroksybenzoesowego, acetylosalicylowego: pipe-

Znieczulenia w stomatologii
81
rokaina, oksybuprokaina, heksylokaina, peretoksykaina, cyklometykaina, proksyme-
takaina, edan,
4.
pochodne chinoliny: cinchokaina,
5.
amidy i inne związki – pochodne ksylidyny: lidokaina, artykaina, mepiwakaina, fena-
kaina, bupiwakaina, prilokaina, propriokaina, butanilikaina.
Obecnie do większości zastosowań dentystycznych zaleca się użycie artykainy.
Czas działania w/w środków zależy od zawartości adrenaliny. Bez jej dodatku wynosi
około 10 minut, natomiast przy zawartości adrenaliny w stosunku l:200 000 wydłuża się do
około 45 minut, a przy 1:100 000 do 75 minut. W przypadku użycia środka zawierającego
adrenalinę, uczucie drętwienia przekracza znacznie czas konieczny do przeprowadzenia
zabiegu. Środki znieczulające miejscowo oddziaływają w sposób wazodylatacyjny.
Z tego względu zastosowanie adrenaliny, zwłaszcza w przypadku dłuższych i bolesnych
zabiegów, staje się konieczne. Jej dodatkową zaletą jest ograniczenie krwawienia podczas
operacji chirurgicznych.
Do znieczuleń miejscowych dodawana jest także epinefryna, która sprzyja uzyskaniu
głębszego i dłuższego znieczulenia oraz umożliwia kontrolę nad krwawieniem.
W środkach znieczulających epinefryna występuje w stężeniach od 1:50 000 do 1:200 000
(5 µg/ml).
Zasadnicze przeciwwskazania do stosowania środków znieczulających miejscowo to:
-
alergia,
-
ciężkie zaburzenia rytmu pracy serca,
-
stany ostrej dekompensacji przy niewydolności pracy mięśnia sercowego,
-
znaczne niedociśnienie.
Nie należy ich także stosować w przypadku niektórych schorzeń układu krwionośnego
i serca (tachykardia napadowa, arytmia absolutna) oraz przy nadczynności tarczycy, fe-
ochromocytomie, nadciśnieniu tętniczym i jaskrze kąta zamkniętego. Środki znieczula-
jące z adrenaliną zawierają zawsze siarczyny. Należy pamiętać, że kontakt z nimi pacjenta
chorego na astmę może wywołać atak duszności. Ostrożność musi być także zachowana
przy uszkodzeniu miąższu wątroby czy niewydolności krążenia.
W stomatologii znalazła głównie zastosowanie ostatnia grupa z w/w środków ze wzglę-
du na swoje właściwości fizyko-chemiczne, które powodują, że są lepsze od estrowych,
a dodatkowo cechują się niskim potencjałem wywoływania reakcji alergicznych.
Z estrowych środków znieczulających tylko prokaina używana jest w formie iniekcyjnej,
natomiast pozostałe znajdują zastosowanie jako znieczulenia powierzchniowe w postaci
np. 20% żelu (np. benzokaina). Użycie pozostałych środków ze względu na ich znaczną
toksyczność i właściwości uzależniające np. ametokaina została znacznie ograniczone.

Rozdział 6
82
Środki amidowe produkowane w „czystej” postaci przeznaczone są dla pacjentów
z grupy ryzyka przy nadciśnieniu, jaskrze, niewyrównanej cukrzycy, współistniejących
chorobach serca, tarczycy, układu krążenia, leczonych inhibitorami MAO, środkami
przeciwdepresyjnymi oraz z dodatkiem leków obkurczających naczynia w postaci
adrenaliny lub noradrenaliny.
Tab. 12. Dawki i czas trwania znieczulenia miejscowego według Petersona i wsp. 2001
Nazwa środka znieczulającego
Maksymalna
dawka
w mg/kg m.c.
Liczba ampułek dla
pacjentów dorosłych
(o wadze 70 kg)
Czas trwania znieczulenia
miejscowego
zęby górne
zęby dolne
Lidokaina 2% z epinefryną
1:50 000 lub 1:1 00 000
5
8-10
50-60 min.
90-100 min.
Mepiwakaina 2%
z lewonorepinefryną 1:20 000
5
10-11
50-60 min.
90-100 min.
Mepiwakaina 3%
bez środka zwężającego naczynia
5
5-6
10-20 min.
40-60 min.
Bupiwakaina 0,5%
z epinefryną 1:200 000
8
15
1,5 h
3 h
Pilokaina 4%
5
6
10-20 min.
40-60 min.
Pilokaina 4% z epinefryną
1:200 000 i 1:400000
5
6
50-60 min.
90-100 min.
Rodzaje znieczuleń stomatologicznych:
-
powierzchniowe
-
nasiękowe i przewodowe
-
doprzegrodowe typu CIA
-
dokostne (transkortykalne)
-
śródwięzadłowe
-
domiazgowe
Znieczulenie powierzchniowe
Środek znieczulający przenika w miejscu nałożenia. Najczęściej używanym anestetykiem
jest lidokaina w postaci 4% roztworu wodnego i maści (Dyneksan) lub aerozolu (Xylocain
Spray, Lidokain-aerosol, Gingipain M spray). Maksymalna dawka 10% lidokainy
u dorosłych wynosi 200 mg, u dzieci 30-40 mg. Efekt znieczulający uzyskuje się po upływie
około 1-3 min. i trwa przez 5-6 min. od zastosowania środka.

Znieczulenia w stomatologii
83
Znieczulenie nasiękowe i przewodowe
Jest to podstawowy rodzaj znieczulenia wykonywany za pomocą strzykawek tradycyjnych
(jednorazowego użytku), karpul, specjalnych bezigłowych lub typu Wand.
Znieczulenie doprzegrodowe typu CIA (Crestal Intraosseans Anaesthesia)
Znieczulenie doprzegrodowe jest odmianą znieczulenia dokostnego. W pierwszej fazie
znieczulenie obejmuje niewielką powierzchnię w obrębie dziąsła brzeżnego, w pobliżu
wybranego miejsca penetracji. W drugiej fazie wprowadza się igłę 0,3 przez brodawkę
międzyzębową pod kątem 45° do płaszczyzny pionowej łączącej osie długie zębów
sąsiadujących. W końcowej fazie doprowadza się do kontaktu z przegrodą (wyczuwalny
opór) i wykonuje penetrację. Czynność tę można wykonać ruchem wkręcającym.
Znieczulenie doprzegrodowe jest alternatywą dla dokostnego u pacjentów, u których
iniekcja ta jest niemożliwa.
Zalety metody:
-
natychmiastowy efekt znieczulający,
-
mała dawka anestetyku,
-
znieczulenie obejmuje dwa sąsiadujące ze sobą zęby z niewielkim znieczuleniem tkanek
miękkich.
Ograniczenia:
Przeciwwskazane stosowanie anestetyka z dużym stężeniem środka zwężającego
naczynia (1:100 000 i większym) z powodu ryzyka martwicy brodawki i przegrody
miedzyzębowej.
Znieczulenia dokostne (transkortykalne)
W tej technice igła penetruje przez błonę zbitą do kości gąbczastej. Znieczulenie
przebiega trzyetapowo, rozpoczynając od znieczulenia dziąsła brzeżnego, które stanowi
strefę właściwą dla późniejszej perforacji blaszki zbitej. Należy pamiętać o zmianie kąta
ustawienia igły z 20° w fazie pierwszej do 90° podczas wkłuwania się. Przejście przez
blaszkę zbitą wymaga użycia specjalnych elementów perforacyjnych np. X-tip lub igły
0,4 za pomocą urządzenia Quick Sleeper III, w którym rotacja i iniekcja sterowana jest
mikroprocesorem. W ostatniej fazie następuje dyfuzja anestetyku do kości gąbczastej
z natychmiastowym efektem znieczulenia.
Zalety:
-
niewielka dawka anestetyku (¼ ampułki skutecznie znieczula dwa sąsiadujące zęby, nie
dotyczy to zębów trzonowych, które wymagają do znieczulenia min. ½ ampułki),
-
natychmiastowy efekt znieczulający i wysoka skuteczność,

Rozdział 6
84
-
możliwość podawania anestetyków w bardzo wysokim stężeniu – nawet l:80 000,
-
zastosowanie w szczęce i żuchwie,
-
większa ilość podawanego środka pozwala na zwiększenie obszaru znieczulenia do 6-7
zębów, przy braku znieczulenia tkanek miękkich,
-
przy długotrwałym zabiegu można połączyć tę technikę z inną np. znieczuleniem
nasiękowym lub przewodowym.
Znieczulenia śródwięzadłowe
Znieczulenie doozębnowe wykonuje się prowadząc igłę po powierzchni zęba aż do
uzyskania kontaktu z częścią grzbietową wyrostka, po czym następuje penetracja igły
do przestrzeni ozębnowej. Znieczulenie śródwięzadłowe (ZŚW) polega na tym, że płyn
znieczulający wstrzykiwany jest do szpary ozębnowej pod ciśnieniem od 0,345-4,127 MPa
i dyfunduje wzdłuż korzenia zęba poprzez włókna ozębnej do okołowierzchołkowych
włókien nerwowych miazgi i do kości zębodołu. Technika ta obejmuje także znieczulenie
dziąsła brzeżnego.
Technika iniekcji
Wykonuje się ją za pomocą specjalnych strzykawek ciśnieniowych krótkich (6-16 mm)
i cienkich (średnica 0,25-0,4 mm) igieł. Końcówka igły jest odpowiednio skośnie ścięta,
co ułatwia jej wprowadzenie do kieszonki równolegle z długą osią zęba, zmniejszając
tym samym traumatyzujący efekt działania na ząb, ozębną i cement. Podstawową cechą
strzykawek do znieczuleń śródwięzadłowych jest możliwość uzyskania odpowiedniego
ciśnienia płynu znieczulającego w czasie iniekcji. Zbyt duże ciśnienie może uszkodzić
części miękkie, natomiast zbyt małe uniemożliwia właściwe jego wnikanie do otaczających
tkanek, a tym samym obniża skuteczność znieczulenia. Istnieją dwa typy strzykawek
ciśnieniowych tj.: z uchwytem bagnetowym (Ligmaject) i w kształcie pióra (np.: Citoject,
Paroject i Aspiject). Podstawową częścią strzykawki jest komora na pojemnik ze
środkiem znieczulającym. Na jednym końcu komory znajduje się końcówka z gwintem
na igłę, a na drugim zaczep bagnetowy służący do jej połączenia z drugim elementem
składowym strzykawki tj. z uchwytem, w którym znajduje się dźwignia dozująca oraz
przycisk zwalniający tłok. Dźwignia dozująca pozwala na kontrolowane dawkowanie
środka znieczulającego. Jednorazowe jej naciśnięcie powoduje wytłoczenie 0,06 ml płynu.
Każdemu naciśnięciu dźwigni dozującej towarzyszy trzask, co pozwala na słuchową
kontrolę ilości zdeponowanego środka. Zapewnia to wprowadzenie właściwej ilości
środka znieczulającego do szpary ozębnowej. Średnia wielkość dawki przypadająca na
ząb jednokorzeniowy wynosi 0,12-0,18 ml (2-3 naciśnięcie dźwigni w jednym miejscu
wkłucia), dla zębów wielokorzeniowych dawkę należy zwiększyć proporcjonalnie do
liczby korzeni. Najwięcej środka znieczulającego aplikuje się do zębów trzonowych
żuchwy. Wymaga to wkłucia igły w 3-4 miejscach i około 0,72 ml płynu.

Znieczulenia w stomatologii
85
Podstawowe i dodatkowe punkty wkłucia igły przy wykonywaniu znieczuleń
śródwięzadłowych:
·
Siekacze i kły
– igłę wkłuwa się wyłącznie od przedsionka po stronie odśrodkowej
i ewentualnie przyśrodkowej zęba (wkłucie dodatkowe). Przy pozostałych zębach
wkłucie wykonuje się od strony przedsionkowej i podniebiennej/językowej.
·
Zęby przedtrzonowe
– wkłucie podstawowe od przedsionka po stronie odśrodkowej
zęba i ewentualnie drugie, dodatkowe od strony podniebiennej/językowej przy
powierzchni przyśrodkowej.
·
Zęby trzonowe górne
– dwa wkłucia od strony policzkowej (przyśrodkowo
i odśrodkowo) oraz jedno od podniebienno-przyśrodkowej.
·
Zęby trzonowe dolne
– wkłucie podstawowe od strony policzkowej oraz dwa
dodatkowe od językowej.
Według Ingla (2002) w przypadku zębów trzonowych górnych jak i dolnych powinno się
rutynowo wykonywać cztery wkłucia: 2 od strony językowej i 2 od przedsionkowej.
Wskazania:
-
zęby stałe i mleczne (z resorbcją obejmującą nie więcej niż ⅓ korzenia) jako
znieczulenie podstawowe u pacjentów, u których nie można wykonać nasiękowego
lub przewodowego np. pacjenci z hemofilią;
-
jako znieczulenie diagnostyczne – określenie zęba będącego przyczyną objawów
bólowych;
-
znieczulenie dodatkowe we wszystkich grupach zębów z nieodwracalnymi pulpopatiami
leczonymi metodą ekstyrpacji lub amputacji.
Zalety metody:
-
niewielka ilość środka znieczulającego,
-
szybki efekt znieczulający (kilkanaście-kilkadziesiąt sekund),
-
wystarczająco długi czas trwania znieczulenia,
-
bardzo rzadko występuje znieczulenie tkanek miękkich otaczających ząb.
Niedogodności:
-
trudność wykonania znieczulenia (trudna penetracja igły),
-
trudność wstrzyknięcia anestetyku i jego częsty wyciek, a tym samym zmniejszona
skuteczność znieczulenia,
-
możliwość wystąpienia powikłań tkankowych w obrębie przyzębia (stany zapalne,
martwica).

Rozdział 6
86
Przeciwwskazania:
-
zły stan higieny jamy ustnej,
-
stany zapalne przyzębia brzeżnego, głębokie kieszonki,
-
ostre ropne zapalenie tkanek okołowierzchołkowych,
-
zęby z nieuformowanymi korzeniami,
-
zęby z odwracalnymi zapaleniami miazgi przeznaczone do leczenia biologicznego,
-
nie stosować anestetyku z dużym stężeniem środka zwężającego naczynia (l:100 000
i większym).
Powikłania:
-
objaw „wydłużonego zęba”, wrażliwość na nagryzanie i opukiwanie,
-
dolegliwości bólowe (od kilku do kilkunastu godzin),
-
przekrwienie i obrzęk brodawki międzyzębowej, rzadko martwica brodawki i ropnie
w tkankach przyzębia.
Znieczulenia domiazgowe
Powinny być wykonywane po znieczuleniu podstawowym, aby można było bezboleśnie
wykonać zabiegi leczenia biologicznego miazgi, ekstyrpację częściową oraz całkowitą lub
udzielenie pierwszej pomocy w ostrych zapaleniach miazgi.
Korzyści wynikające z tego rodzaju znieczulenia:
-
całkowite zniesienie bólu,
-
uzyskanie szybkiego efektu znieczulającego,
-
zapewnienie odpowiednio długiego czasu potrzebnego do wykonania zabiegu,
-
nie powoduje dodatkowych dolegliwości bólowych w trakcie iniekcji oraz powikłań
poiniekcyjnych,
-
nie powoduje zmian w ozębnej, cemencie oraz miazdze.
Technika wykonywania iniekcji domiazgowych.
l. Trepanacja komory zęba. Otwór na tyle mały aby igła iniekcyjna (nr 3 lub 27)
dokładnie wypełniła światło, pozwoli to na uzyskanie odpowiedniego ciśnienia do
zdeponowania płynu znieczulającego.
2.
Znieczulenie wykonać lignokainą z dodatkiem środków zwężających strzykawką
ciśnieniową o bardzo cienkiej igle.
3.
Płyn znieczulający wprowadzić natychmiast po wkłuciu, a następnie w sposób ciągły
deponować powoli jego małe ilości.
4.
W przypadku zabiegu ekstyrpacji znieczulić miazgę korzeniową. Po szerokim otwarciu
ubytku, usunąć sklepienie komory i wykonać amputację miazgi komorowej. Igłę
wprowadzić do ujść każdego kanału i zdeponować dodatkową ilość środka znieczulającego
(kolejność wprowadzania środka znieczulającego do kanałów jest następująca: kanał

Znieczulenia w stomatologii
87
najszerszy (podniebienny w trzonowcach górnych, odśrodkowy w zębach dolnych),
a następnie każdy kolejny). Czas trwania znieczulenia wynosi około 15 min.
Skuteczność tej metody oceniana przez różnych autorów, waha się w granicach 80-98%,
a niepowodzenia w uzyskaniu znieczulenia domiazgowego często polegają na tym, że
wcześniej nie wykonano znieczulenia podstawowego.
Przeciwwskazania:
-
pulpopatie leczone metodami biologicznymi: przykrycie bezpośrednie, amputacja
przyżyciowa.
W/w metody dążą do zachowania zdolności miazgi do procesów reparacyjnych, a więc
urazy jatrogenne wynikające ze stosowania do znieczulenia środków obkurczających
naczynia, czy mechaniczne uszkodzenie tkanki miazgowej spowodowane igłą iniekcyjną,
mogą doprowadzić do wykwitów krwawych, dyfuzji środka znieczulającego do miazgi
korzeniowej oraz wywołania chemotoksycznego wpływu na miazgę części korzeniowej.

88

Techniki opracowywania ubytków
89
7
Techniki opracowywania ubytków
7.1.
Metoda atraumatyczna ART
Ręczne opracowanie ubytku jest mniej destrukcyjne, gdyż użycie narzędzi ręcznych
zapobiega usunięciu zdrowych tkanek, a także ogranicza niekorzystny wpływ działania
ciepła podczas mechanicznej preparacji.
Czynniki od których w głównej mierze zależy wzrost temperatury w ubytku to:
-
silny nacisk,
-
duży rozmiar i brak ostrości wiertła,
-
wysoka liczba obrotów na minutę,
-
pierwsze sekundy używania wiertarki turbinowej, kiedy strumienie wody chłodzące
wiertło nie dochodzą jeszcze do tkanek,
-
długi czas opracowywania.
Wyniki badań wykazują że metoda ta jest skuteczną alternatywą dla tradycyjnego-me-
chanicznego opracowania ubytków próchnicowych szczególnie w krajach rozwijają-
cych się, gdzie utrudniony jest dostęp do opieki stomatologicznej. Za stosowaniem
tej metody przemawiają także dane z piśmiennictwa na temat szkodliwego wpływu
maszynowego opracowywania twardych tkanek na miazgę zębową. Wśród przyczyn
powodujących choroby miazgi, urazy jatrogenne związane z podniesieniem tempera-
tury w trakcie maszynowej preparacji tkanek zajmują trzecie miejsce po inwazji bak-
teryjnej i urazach. Badania doświadczalne wykazały, że wzrost temperatury wewnątrz
jamy zębowej o 5,5°C u zwierząt doświadczalnych powodował obumarcie miazgi
w 15% przypadków.
Wyniki badań nad skutecznością tej metody wskazują, że po 3 latach od zabiegu reten-
cja wypełnień w dobrym stanie utrzymuje się od 54 do 94% w zębach stałych oraz od
29 do 39% w mlecznych. Różnic w uzyskanych wynikach należy upatrywać w tym, że
zabiegi przeprowadzali doświadczeni lekarze, niewykwalifikowany personel i studenci
młodszych lat studiów oraz że we wcześniejszych badaniach wykorzystywano starsze
materiały wypełniające (Chemfil, Fuji II, Chemfil System), a w późniejszych nowsze
(Fuji IX czy Ketac Molar).

Rozdział 7
90
Ryc. 7.1. Wydrążacz obustronny (ze zbiorów Polorto)
Zaletą metody ART jest użycie narzędzi ręcznych (ekskawatory, dłuta szkliwne) bez
stosowania instrumentów rotacyjnych. Technika ta nie wymaga znieczulenia, gdyż
preparacja jest bezbolesna i można ją stosować w różnych typach ubytków. Tylko około
5-6% pacjentów odczuwa dyskomfort w trakcie zabiegu.
7.2.
Metoda chemo-mechaniczna
Technika polega na ręcznym usuwaniu zmienionej próchnicowej zębiny po wcześniejszym
rozmiękczeniu jej żelem Carisolv. Materiał ten, dzięki zawartości trzech aminokwasów
(lizyny, leucyny i kwasu glutaminowego) wiążących się z rozplecioną strukturą
kolagenu, działa tylko na zdemineralizowaną zębinę, powodując jej fragmentaryzację.
Zapobiega to uszkodzeniu i usunięciu zdrowej tkanki. Żel nie działa na szkliwo zęba,
zatem jeśli ta tkanka jest zaatakowana przez próchnicę lub istnieją nawisy szkliwne,
do ich usunięcia konieczne jest użycie wiertła. Po wymieszaniu płynów znajdujących
się w dwóch oddzielnych pojemnikach otrzymujemy gotowy do nałożenia materiał.
Carisolv aplikowany jest do przygotowanego ubytku i po odczekaniu zalecanych
przez producenta 30 sekund, zmiękczona nim próchnicowa zębina może być usuwana
narzędziami ręcznymi. Dzięki temu w przypadku próchnicy głębokiej można uniknąć
pracy narzędziami rotacyjnymi w pobliżu miazgi, a ponieważ żel jest selektywny
w działaniu, możliwe jest minimalnie inwazyjne opracowanie ubytku. Powierzchnia w ten
sposób opracowanej zębiny pozbawiona jest warstwy mazistej, ma nieregularną budowę
oraz odsłonięte kanaliki zębinowe, co sprzyja zakotwiczeniu materiału odbudowującego
utracone tkanki twarde zęba. Metoda jest dobrze akceptowana, zwłaszcza przez dzieci.
Ryc. 7.2. Narzędzia ręczne i ich części pracujące (ze zbiorów Polorto)

Techniki opracowywania ubytków
91
Do pracy z żelem Carisolv opracowano także specjalne bezprzewodowe motory
sterowane mikroprocesorem i wiertła (Carisolv Power Drive). Najnowszym tego rodzaju
urządzeniem jest EndoProphyCaries (EPC), które może pracować w trzech trybach:
1.
Endodontycznym, z narzędziami NiTi,
2.
Profilaktycznym (czyszczenie, polerowanie),
3.
Usuwania próchnicy z wykorzystaniem żelu Carisolv.
Ryc. 7.3. Bezprzewodowe urządzenia mechaniczne z mikroprocesorem i specjalne wiertła dedykowane do pracy
z żelem Carisolv
Ryc. 7.4. Wielofunkcyjne bezprzewodowe
urządzenie EndoProphyCaries (EPC)
Ryc. 7.5. Powierzchnia zębiny
opracowanej żelem Carisolv
(powiększenie 1000X)
(wg M. Raczyńskiej 2004)
7.3.
Metody inwazyjne
Metody inwazyjne to: rotacyjna (konwencjonalna), oscylacyjna (Sonic System),
kinetyczna (piaskarka wewnątrzustna) i hydro-kinetyczna (np. laser YAG:Er).
Tradycyjna technika opracowania ubytków próchnicowych prowadzi do osłabienia
pozostałej struktury zęba, uszkodzenia zębów sąsiadujących (~15% powstaje próchnica),
utraty wypełnienia lub konieczności jego wymiany, odłamania fragmentu zęba, martwicy
miazgi, zniszczenia korony zęba lub wczesnej jego utraty.

Rozdział 7
92
7.3.1.
Metoda oscylacyjno-sonoabrazyjna
W technice tej wykorzystuje się urządzenie, które montuje się do rękawa unitu za
pomocą specjalnej złączki. Jest to skaler powietrzny wytwarzający drgania o częstotliwości
< 6,5 KHz. Do opracowywania twardych tkanek zęba służą różnej wielkości i kształtu
specjalne końcówki pokryte podobnie jak wiertła nasypem diamentowym. System
Sonic został opracowany do bezpiecznej, minimalnie inwazyjnej preparacji ubytków
zlokalizowanych na powierzchniach stycznych. Końcówki z jedną stroną pracującą służą
do opracowania ubytków klasy II według Blacka. Strona bez nasypu nie narusza zdrowej
powierzchni sąsiedniego zęba, co często ma miejsce przy opracowaniu techniką rotacyjną
z użyciem wiertła. Urządzenie zaopatrzone jest w system chłodzenia wodą, co zabezpiecza
tkanki zęba przed przegrzaniem i wypłukuje opiłki opracowanej zębiny lub szkliwa.
Ryc. 7.6. System Sonic flex 2000 (KaVo) z końcówkami pokrytymi jednostronnie nasypem diamentowym
(ze zbiorów M. Aluchny)
Ryc. 7.7. Powierzchnia zębiny opracowana metodą oscylacyjno-sonoabrazyjną (powiększenie 1000X)
(wg M. Raczyńskiej 2004)
7.3.2.
Metoda kinetyczna-abrazja powietrzna
Zasada pracy urządzenia, polega na wyrzucaniu z dyszy pod dużym ciśnieniem mieszani-
ny wody, proszku (np. tlenku glinu o rozmiarach cząsteczek 5-50 µm) i powietrza. Wyżej
wymienione, wymieszane razem składniki stanowią jednolity strumień czyszczący, który
jest kierowany na opracowywaną powierzchnię zęba pod kątem 90° z odległości l mm.

Techniki opracowywania ubytków
93
Przy zastosowaniu abrazji powietrznej nie ma konieczności wywierania nacisku na
ząb, nie występuje efekt przegrzewania tkanek oraz brak jest wibracji jakie towarzyszą
opracowaniu wiertłem. Urządzenie nie generuje także nieprzyjemnego dźwięku. Dane
z piśmiennictwa wskazują, że po zastosowaniu piaskarki wewnątrzustnej nie występują
mikropęknięcia i uszkodzenia szkliwa, jakie mają miejsce podczas konwencjonalnego
opracowania ubytków, a uzyskana po preparacji powierzchnia zapewnia dobrą retencję dla
materiałów stosowanych do wypełnień. Należy jednak nadmienić, iż abrazji powietrznej
nie należy stosować do ubytków bezpośrednio sąsiadujących z tkankami przyzębia, a więc
w przypadku ubytków II i V klasy według Blacka, ponieważ istnieje ryzyko wtłoczenia
proszku abrazyjnego do kieszonki dziąsłowej i co za tym idzie uszkodzenia tkanek
przyzębia. Piasek niesiony wraz z wodą i powietrzem może też powodować zapylenie
oraz działać drażniąco na spojówki, błonę śluzową nosa i jamy ustnej. Podczas pracy
metodą abrazji powietrznej należy przestrzegać kilka zaleceń: zabieg należy wykonywać
w osłonie koferdamu, stosować okulary ochronne dla pacjenta, lekarza i asysty. Personel
dentystyczny powinien też pracować w maskach ochronnych. W trakcie zabiegu konieczne
jest użycie ssaka. Istnieją przeciwwskazania do stosowania abrazji powietrznej u pacjentów
z rozpoznaną astmą, niedrożnością górnych dróg oddechowych, przewlekłym zapaleniem
oskrzeli, w stanach zapalnych błony śluzowej jamy ustnej oraz u osób uczulonych na
proszek A1
2
O
3
.
Ryc. 7.8. a. Piaskarka zabiegowa Introduces Hydro-Jet™ Hydrobrasion System (AMT), b. Piaskarka zabiegowa
z końcówkami Rondoflex (KaVo)
Ryc. 7.9. Powierzchnia zębiny opracowana metodą abrazji powietrznej, powiększenie 1000X (wg M.
Raczyńskiej 2004)

Rozdział 7
94
7.3.3.
Metoda hydro-kinetyczna
Laser YAG:Er generuje impulsy o długości fali 2940 nm, która jest silnie absorbowana
w twardych tkankach zęba (szkliwie, cemencie i zębinie) zarówno zdrowych, jak i zmie-
nionych próchnicowo. W technice preparacji ubytków stosowane są krótkie, mikrose-
kundowe impulsy. Energia w pojedynczym impulsie jest precyzyjnie porcjowana i może
przyjmować wartość od 50 do 500 mJ, z regulacją co 10 mJ.
Impuls laserowy padając na powierzchnię twardej tkanki zęba, wywołuje fotonowe, nie-
termiczne rozerwanie łańcuchów składników organicznych. Zjawisko to nazywa się fo-
toablacją. W procesie tym zaabsorbowana w tkance energia zlokalizowana jest w bardzo
małych obszarach, co przy stosowaniu krótkich impulsów laserowych zapobiega uszko-
dzeniu lub nagrzewaniu się tkanek sąsiednich. Dzięki temu nie dochodzi do nadtapiania
szkliwa i zębiny. Opracowana powierzchnia jest czysta, pozbawiona warstwy mazistej
z odsłoniętymi kanalikami zębinowymi. Uzyskujemy powierzchnię o odpowiednim
wzorze retencyjnym, która bez potrzeby wytrawiania kwasem jest przygotowana do na-
łożenia zębinowych systemów łączących, a następnie materiału wypełniającego, gwaran-
tując jego dobre przyleganie (adhezję). Podczas preparacji wiązką promieniowania lasera
impulsowego YAG:Er nie występują towarzyszące tradycyjnemu opracowaniu naciski
na ząb, wibracje i nieprzyjemne dźwięki.
Ryc. 7.10. Powierzchnia zębiny opracowana metodą hydro-kinetyczną (powiększenie 1000X)
(wg M. Raczyńskiej 2004)
7.4.
Inne techniki opracowywania ubytków
Zasady opracowywania ubytków ulegają ciągłym zmianom w związku z różnymi
formami próchnicy oraz wprowadzaniem do lecznictwa stomatologicznego nowych
materiałów złożonych i cementów szkło-jonomerowych, oszczędzających twarde tkanki

Techniki opracowywania ubytków
95
zęba. Ubytkom nadaje się kształt owalny lub granulowaty bez konieczności usuwania
niepodpartego szkliwa i wykonania właściwego kształtu oporowego oraz retencyjnego.
Zasada „poszerzenia zapobiegawczego” zalecana przez Blacka też straciła swą aktualność.
Zdolność materiałów złożonych do adhezyjnego wiązania się z tkankami zęba pozwala
na zachowanie znacznej części zdrowych tkanek, a nawet na wzmocnienie osłabionej
struktury zęba.
7.4.1.
Technika minimalnej ingerencji
Zastosowanie techniki minimalnej ingerencji rozważa się głównie w odniesieniu do po-
czątkowej zmiany próchnicowej. Jednakże te same zasady zachowania naturalnych struk-
tur zębów można zastosować, gdy mamy do czynienia z rozległymi ubytkami lub
z wymianą wadliwych wypełnień. Zachowanie maksymalnej ilości tkanek własnych
zęba jest fundamentalną zasadą techniki minimalnej ingerencji. Postępowanie zabie-
gowe polega na eliminacji zmian chorobowych, po której następuje remineralizacja
i gojenie zdemineralizowanych stref. Modyfikacja istniejącego kształtu ubytku powin-
na być oparta na zachowaniu naturalnej struktury zęba i musi uwzględniać stosowanie
adhezyjnych biologicznie aktywnych materiałów wypełniających. Gdziekolwiek to
jest możliwe, zdemineralizowane szkliwo i zębina powinny podlegać gojeniu i utrzyma-
niu na drodze remineralizacji. W miarę pogłębiającej się destrukcji będą występować
oczywiste ograniczenia remineralizacji, ale obecnie dostępne adhezyjne materiały wy-
pełniające zdolne są do przywrócenia pewnej wytrzymałości twardych tkanek zęba.
Zaproponowana przez Simonsena w 1978 r. metoda minimalnego opracowania ubytku
i wypełnienia go materiałem złożonym z zapobiegawczym uszczelnieniem bruzd
międzyguzkowych (ang. preventive resin restoration) „poszerzone lakowanie”, stała
się początkiem rozwoju profilaktycznej odtwórczej stomatologii (prophylactic
restorative dentistry) zamiast dotychczasowej stomatologii odtwórczej (restorative
dentistry). Kilka lat później Elderton (1990 i 1993) zaproponował sposób preparacji
ubytków uzależniony od bezpośredniego dostępu do ogniska próchnicowego.
Wprowadzenie cementów szkło-jonomerowych i nowych instrumentów rotacyjnych
stworzyło możliwości zdefiniowania nowych technik opracowywania i wypełniania
ubytków (m.in. warstwowych, kanapkowych, tunelowych klasy II i szczelinowej
policzkowo-językowej klasy III). Nową klasyfikację ubytków sformułował Mount i Hume
(1997) uwzględniającą trzy miejsca na powierzchni zębów predysponowane do rozwoju
próchnicy z powodu zalegania płytki (zagłębienia anatomiczne, powierzchnie styczne
i rejony przyszyjkowe) oraz cztery stadia zaawansowania procesu próchnicy: miejsce/
stadium (Sites-Stopes – Si/Sta). Ma na celu ułatwienie podejmowania najbardziej
skutecznych decyzji leczniczych w konkretnej sytuacji klinicznej.

Rozdział 7
96
7.4.2.
Technika PRR
Wraz z pojawieniem się nowych polimerów o półpłynnej konsystencji oraz
uszczelniaczy z zawartością wypełniaczy pierwotny podział wypełnień oparty na
wyborze materiału w zależności od głębokości opracowania, uległ pewnej modyfikacji.
Obecnie, biorąc pod uwagę rozprzestrzenianie się w głąb tkanek zęba małego ogniska
próchnicowego, wyróżnia się dwa główne rodzaje wypełnień PRR, czyli oszczędnego
opracowywania ubytku. Pierwsze dotyczą przypadków, w których próchnicowy ubytek
ogranicza się do szkliwa. Rodzaj ten wymaga poszerzonego uszczelnienia bruzd
i usunięcia próchnicowo zmienionego szkliwa, ewentualnie minimalnego poszerzenia
bruzdy oraz wypełnienia powstałego ubytku i pozostałych bruzd odpowiednim materiałem
uszczelniającym. Rodzaj drugi dotyczy przypadków, w których ubytek próchnicowy
penetruje na małej przestrzeni do zębiny. Po opracowaniu twardych tkanek zęba, powstały
ubytek wypełnia się materiałem złożonym, a zdrowe bruzdy na powierzchni żującej
pokrywa się materiałem uszczelniającym. Metodą PRR wypełnia się małe ograniczone
ogniska próchnicy na powierzchni żującej, natomiast wielopowierzchniowe,
głębokie ubytki próchnicowe wymagają odbudowy tradycyjnymi metodami i są
przeciwwskazaniem do leczenia technika PRR.
Wypełnienia PRR zajmują od 5 do 19% powierzchni okluzyjnej zębów trzonowych, podczas
gdy małe wypełnienia amalgamatowe zajmują co najmniej 25% tej powierzchni.
Tab. 13. Porównanie efektywności różnych metod preparacji ubytków
.
Metoda
Zdrowe szkliwo
Zdrowa zębina
Próchnicowe szkliwo Próchnicowa zębina
Ekskawator
-
-
+
+ +
Wiertło
+ + +
+ + +
+ + +
+ + +
Abrazyjna
+ + +
+ + +
+ +
+
Ultradźwięki
+
+
+
_
Oscylacyjna
-
+
+
+ +
Chemomechaniczna
-
-
-
+ + +
Hydrokinetyczna
+
+
+
+
Enzymatyczna
-
-
-
+

Techniki wypełniania ubytków
97
8
Techniki wypełniania ubytków
8.1.
Metody bezpośrednie
8.1.1.
Techniki jednowarstwowe
Materiał wprowadza się w całości do ubytku instrumentami metalowymi, tytanowymi
lub plastykowymi (w zależności od rodzaju materiału wypełniającego). Kondensacja
materiału winna być przeprowadzona w minimalnie krótkim czasie tj. w 2-3 minuty
w uprzednio dopasowanej kształtce lub przy użyciu paska. Przy stosowaniu mate-
riałów chemoutwardzalnych krótki czas wiązania zmusza operatora do szybkiego
postępowania, co stwarza ryzyko wystąpienia niedokładności przylegania, zwłaszcza
w okolicy przydziąsłowej. Objawia się to zwykle nadwrażliwością na bodźce chemicz-
no-termiczne i stanowi dogodne miejsce do powstania próchnicy wtórnej.
8.1.2.
Techniki warstwowe
Aby ograniczyć niekorzystne zjawisko powstawania niedokładności brzeżnych zaleca się
stosowanie materiałów światłoutwardzalnych warstwami, wprowadzając je do ubytku
w kilku niewielkich porcjach nie przekraczających 2 mm grubości. Pierwszą warstwę wy-
pełnienia o grubości l-2 mm zakładamy od dna ubytku kierując się na ścianę policzkową
i rozprowadzamy ukośnie w kierunku ściany dokomorowej, następnie polimeryzujemy
światłem przez szkliwo od strony policzkowej np. lampą halogenową o mocy > 350 mW/
cm
2
przez 40 sekund (lub w czasie określonym przez producenta). Drugą warstwę nakła-
damy na ścianę językową lub podniebienną i rozprowadzamy ukośnie w kierunku strony
przeciwległej, utwardzając światłem przez 40 sekund poprzez szkliwo ściany językowej
lub podniebiennej. Trzecią warstwę nakładamy w środkowej części zęba i utwardzamy
przez 40 sekund od strony żującej. Jednak nawet taki sposób wypełniania nie eliminuje
skurczu materiału i jego właściwego przylegania w okolicy brzegu przydziąsłowego. Kur-
czenie się kolejnych nakładanych warstw polimeru ku powierzchni żującej (w kierunku
źródła światła) prowadzi do tworzenia się mikroprzestrzeni między pierwszą warstwą
wypełnienia, a dnem ubytku. Aby wyeliminować tę niepożądaną wadę, oprócz wieloeta-
powego wypełnienia zaleca się trójstronną technikę naświetlania. Po założeniu dokładnie
dopasowanej do dolnego brzegu ubytku formówki z przejrzystym paskiem, w przestrzeń
międzyzębową wprowadza się przezroczysty klin z rdzeniem odbijającym światło w kie-
runku dna. Zwykły przewodzący światło klin, podobnie jak odbijający, zapobiega także
odciągnięciu materiału od brzegu dodziąsłowego podczas wiązania materiału. Na dno
ubytku wprowadza się pierwszą warstwę materiału i postępuje jak opisano wyżej. Koniec
Rozdział 8
98
lampy polimeryzacyjnej dotyka podstawy klina, który przenosi w kierunku dna ubytku
około 90% natężenia światła emitowanego przez lampę. Technika ta ma minimalizo-
wać skurcz materiału i gwarantować dobre utwardzenie głębszych obszarów wypełnienia.
Tymczasem jak wykazały badania w wypełnieniu tworzą się warstwy o różnej twardości
oddzielone szczeliną widoczną w REM (powstałe wskutek inhibicji tlenowej) – brak po-
łączenia może wystąpić nawet na 30% powierzchni. Metoda ta także nie eliminuje wy-
stąpienia skurczu w całej objętości wypełnienia. Natychmiast po polimeryzacji światłem
skurcz sięga do 85%, po kolejnych 5 minutach wartość ta zwiększa się o około 10%. W
związku z tym w trakcie polimeryzowania ostatniej warstwy kompozytu nie jest w pełni
zakończony skurcz pierwszej warstwy. Zatem skurcz i tak występuje jednocześnie w ca-
łym założonym materiale.
8.1.3.
Techniki kanapkowe
Stosowanie przy wypełnianiu ubytku jednego rodzaju materiału jest czasem kłopotliwe.
Dlatego wprowadzono metodę określaną kanapkową (ang. sandwich), zwaną też po-
dwójnego wiązania (ang. dual bonding technique) wykorzystującą zastąpienie całej
lub części utraconej zębiny cementem szkło-jonomerowym (stanowi jej substytut). Za-
pewnia to dobre przyleganie brzeżne w części dodziąsłowej dzięki chemicznemu po-
łączeniu z zębiną i zapobiega rozwojowi próchnicy wtórnej poprzez uwalnianie jonów
F
-
. Natomiast utracone szkliwo odbudowujemy materiałem złożonym lub amalgamatem.
Obowiązują jednak bezwzględne wskazania zależne od rodzaju materiału. I tak minimal-
na warstwa amalgamatu powinna wynosić 3,0 mm, zaś materiału złożonego l,5-2,0 mm.
W przypadku metody kanapkowej w celu uzyskania właściwej szczelności wypełnie-
nia w okolicy przyszyjkowej dno ubytku wypełnia się cementem szkło-jonomerowym.
Dalsze postępowanie jest podobne do opisywanego w technikach warstwowych. Meto-
dę tę najczęściej poleca się do wypełniania rozległych ubytków w zębach trzonowych
i przedtrzonowych, gdyż zapewnia dobrą szczelność brzeżną przy brzegu dodziąsłowym,
zapobiega mikroprzenikaniu i próchnicy wtórnej.
Zasięg ubytku i położenie brzegu dodziąsłowego determinuje stosowanie dwu odmian
techniki kanapkowej: otwartej (ang. open sandwich), w której cement sz-j jest ekspono-
wany do środowiska jamy ustnej oraz zamkniętej (ang. closed sandwich), gdzie cement
jest w całości pokryty kompozytem lub innym materiałem wypełniającym np. amalga-
matem.
Jak wynika z badań własnych, technika kanapkowa zamknięta jest korzystniejszym roz-
wiązaniem przy odbudowie ubytków klasy II, w porównaniu z otwartą. Pokrycie całego
cementu szkło-jonomerowego odbudowującego utraconą zębinę materiałem złożonym

Techniki wypełniania ubytków
99
zapobiega przede wszystkim wypłukiwaniu cementu, utracie odtworzonego kształtu
anatomicznego, powstającej w czasie szorstkości powierzchni wypełnienia oraz wystę-
powaniu zauważalnych zmian koloru wypełnienia. Zastosowanie techniki kanapki
zamkniętej jest określane ograniczeniem dodziąsłowej części ubytku przez szkliwo,
gdyż tylko wówczas istnieją warunki dla uzyskania szczelnego połączenia z kompo-
zytem. W przypadku gdy brzeg dodziąsłowy znajduje się wierzchołkowo w stosunku
do połączenia szkliwno-cementowego, bardziej właściwym postępowaniem wydaje się
użycie techniki kanapkowej otwartej.
Ryc. 8.1. Schemat przedstawia technikę kanapkową otwartą i zamkniętą
8.1.3.1
Technika kanapkowa uproszczona (otwarta)
Opracowano ją w 1999 r. w Zakładzie Propedeutyki Stomatologii Zachowawczej CMUJ
celem skrócenia do jednej wizyty i uproszczenia całej procedury (postępowanie kliniczne
zależy od rodzaju stosowanego materiału łączącego). Technika polega na zastosowa-
niu czynnika wiążącego Fuji Bond LC (GC) do całego ubytki, założenia podkładu
z klasycznego cementu szkło-jonomerowego lub modyfikowanego żywicą i wypełnieniu
zewnętrznej powierzchni ubytku kompozytem. W metodzie tej występuje bezpośredni
kontakt materiału podkładowego ze środowiskiem jamy ustnej, nie zachodzi koniecz-
ność wytrawiania kwasem tkanek zęba i podkładu oraz nie ma potrzeby oczekiwać na
całkowite przereagowanie matrycy cementu sz-j, co umożliwia zakończeniu leczenia
w trakcie jednej wizyty. Podczas stosowania klasycznej metody kanapkowej, niezależnie
czy w wersji otwartej czy zamkniętej, wymagane są dwie wizyty, gdyż świeży konwencjo-
nalny cement sz-j nie powinien być narażony na uszkodzenia wynikające z konieczności
jego korekty przed nałożeniem warstwy zewnętrznej wypełnienia wykonanego z mate-
riału złożonego.
W przypadku zastosowania cementów modyfikowanych żywicą lub kondensowalnych,
nie ma konieczności odkładania opracowania wypełnień na kolejną wizytę. Jeszcze
więcej kontrowersji wzbudza konieczność wytrawienia szkliwa. Jest praktycznie
niemożliwe, aby przy okazji wytrawiania nie uszkodzić podkładu z cementu sz-j.

Rozdział 8
100
Zalety:
-
nie zachodzi konieczność dodatkowego wytrawiania szkliwa pod system wiążący
i materiał złożony;
-
skrócenie i uproszczenie całej procedury wykonania wypełnienia kanapkowego;
-
ograniczenie liczby etapów do 6.;
-
eliminacja osobnego nakładania systemu wiążącego dla materiału złożonego;
-
ograniczenie popełnienia błędu na poszczególnych etapach postępowania klinicznego.
Badania dowodzą, że tą metodą można uzyskać lepszą adaptację brzeżną w porówna-
niu z konwencjonalną metodą kanapkową. Obszarem w którym zaobserwowano istotne
zmiany była linia łączenia cementu podkładowego z materiałem złożonym. W przypad-
ku zastosowania modyfikowanego cementu szkło-jonomerowego nie stwierdzono wy-
stępowania szczelin między podkładem, a materiałem złożonym, podczas gdy w przy-
padku tradycyjnego cementu sz-j, zarówno w metodzie kanapki konwencjonalnej jak
i uproszczonej obserwowano liczne szczeliny i pęknięcia w tym obszarze jak również
w samym materiale podkładowym.
Tab. 14. Porównanie kolejnych etapów wykonania wypełnienia metodą kanapkową klasyczną otwartą
i uproszczoną według Gończowskiego i Krupińskiego (2003)
Kanapka klasyczna otwarta, 10-12 etapów
Kanapka uproszczona otwarta, 6 etapów
1. Conditioner
1. Cavity Conditioner (GC)
2. Płukanie i osuszenie
2. Płukanie i osuszenie
3. Cement klasyczny sz-j lub modyfikowany żywicą
3. Fuji Bond LC (GC) do całego ubytku
4. Odczekanie 5 minut lub polimeryzacja 40 sekund
4. Polimeryzacja 20 sekund
5. Opracowanie brzegów ubytku
5. Cement klasyczny sz-j lub modyfikowany żywicą
6. Wytrawienie
6. Nałożenie i polimeryzacja pierwszej warstwy kom-
pozytu
7. Płukanie i osuszenie
8. Primer
9. Rozprowadzenie powietrzem
10. Bond
11. Rozprowadzenie powietrzem i polimeryzacja
12. Nałożenie i polimeryzacja pierwszej warstwy
kompozytu

Techniki wypełniania ubytków
101
8.1.4.
Technika tunelowa
Znana jest od 1984 r. i została opisana przez Hunta i Knighta (1984) jako tzw. preparacja
wewnętrzna. Jest metodą alternatywną w stosunku do tradycyjnej w leczeniu próchnicy
zlokalizowanej na powierzchniach stycznych zębów trzonowych i przedtrzonowych.
Celem tej techniki jest mikrozachowawcze opracowanie ubytku klasy II przy zachowaniu
okluzyjnej listewki brzeżnej, z jednoczesnym oszczędzeniem tkanek twardych zęba,
co w istotny sposób zapobiega złamaniu zęba oraz zachowaniu punktów kontaktu na
powierzchniach stycznych. Otwarcie ubytku następuje od powierzchni żującej w bruździe
międzyguzkowej. Wiertło prowadzi się skośnie w kierunku powierzchni stycznej, aż do
ogniska próchnicowego w zębinie. Zębinę próchnicową usuwa się przez tunel od strony
powierzchni żującej. Po oczyszczeniu ubytku z mas próchnicowych, utraconą zębinę
uzupełnia się cementem szkło-jonomerowym, a utracone szkliwo amalgamatem lub
materiałem złożonym.
Zalety i wady techniki tunelowej:
Metoda godna polecenia z uwagi na dużą oszczędność tkanek zęba, choć bardzo trudna.
Wymaga dobrej znajomości topografii jam zębowych i odpowiednich warunków pracy,
a więc dobrego oświetlenia (podświetlane końcówki). Trzeba sobie zdać sprawę ze sła-
bej kontroli wizualnej wnętrza ubytku i równocześnie z następstw pozostawienia zębiny
próchnicowej lub obnażonej miazgi bez jej odpowiedniego zaopatrzenia. Zachowanie
listwy szkliwa brzeżnego zmniejsza ryzyko powstawania nawisu wypełnienia i nieprawi-
dłowych kontaktów międzyzębowych, a tym samym zapewnia ochronę przyzębia brzeż-
nego. Skuteczność metody tunelowej zależna jest od wielu czynników. Istotne wydaje się
doświadczenie i sprawność operatora. Decyzja o zastosowaniu tego modelu leczenia po-
winna być poprzedzona właściwą kwalifikacją ognisk próchnicowych, analizą głębokości
ubytku, warunków zwarciowych, oceną aktywności procesu próchnicowego i wyborem
odpowiedniego materiału wypełniającego.
Skuteczność omawianej metody warunkuje dostęp do badania radiologicznego o wyso-
kim poziomie zaawansowania technologicznego. Przy stosowaniu tej metody nie tylko
występuje oszczędność czasu pracy, ale także działanie kariostatyczne w przypadku sto-
sowania klasycznych cementów sz-j i cermetów uwalniających jony F
-
.
Według opinii różnych autorów trwałość zęba po tego rodzaju opracowaniu nie jest
jednoznaczna. Hill i Halasch (1988) twierdzą, że cement szkło-jonomerowy zwiększa
wytrzymałość zęba na złamanie prawie do takiej jak zdrowych jego tkanek na obciążenia
ściskające. Porównanie oceny sztywności guzków poddanych obciążeniom fizjologicz-
nym w wypełnieniach wykonanych metodą tradycyjną i tunelową wskazują jednak, że
wypełnienia tradycyjne są lepsze. Inne badania w warunkach in vitro wykazały, że odpor-

Rozdział 8
102
ność listewki brzeżnej na złamanie po zastosowaniu siły ściskającej spada wraz ze wzro-
stem rozmiaru wiertła, a tym samym przekroju tunelu. Wypełnienia z cementów szkło-
jonomerowych wzmacniały odporność listewki brzeżnej w przypadku wąskich tuneli.
materiał wypełniający
Ryc. 8.2. Schemat przedstawiający metodę tunelową
8.1.5.
Technika podwójnej gęstości
Założeniem tej metody jest wykorzystanie małego modułu elastyczności
wykazywanego przez materiały o niskiej gęstości, co ogranicza możliwość rozerwania
połączenia z tkankami zęba. Technika polega na nałożeniu na dno ubytku półpłynnego
(typu flow) kompozytu lub kompomeru jedną lub dwoma warstwami o grubości < l
mm, spolimeryzowaniu każdej z nich oddzielnie, a następnie zastosowaniu warstwy
materiału o konwencjonalnej gęstości. Podobnie jak w technice warstwowej skurcz
i tak występuje w całej masie polimeryzowanego materiału oraz może także nie
być pełnego połączenia pomiędzy kolejnymi warstwami. W 2009 roku zostały
opracowane dwie interesujące modyfikacje kompozytów o małej gęstości. Pierwsza
tzw. Smart Dentin Replacement (SDR) pozwoliła na wyprodukowanie materiału
SureFil SDR flow (Dentsply) o zmniejszonym <1,5% skurczu polimeryzacyjnym
oraz podniesionych właściwościach wytrzymałościowych. Materiał ten zalecany
jest do zastąpienia zębiny w ubytkach klasy I i II, włacznie z zastosowaniem techniki
„kanapki otwartej”. Według zaleceń producenta materiał ten można zakładać warstwą
o grubości 4 mm i polimeryzować światłem przez 20 sek. Technologia SDR polega na
wprowadzeniu specjalnego modulatora wolnorodnikowej polimeryzacji. Pozwala to nie
tylko na ograniczenie skurczu polimeryzacyjnego, ale także zwiększa stopień konwersji
kompozytu.
Drugą modyfikacją jest wprowadzenie samoprzygotowującego kompozytu typu „flow”,
nie wymagającego materiałów łączących. Kompozyt Fusio (Pentron Clinical) zawiera
w swoim składzie żywicę 4-META, która zapewnia właściwości hydrofilne oraz obniża
pH materiału. W kontakcie z powierzchnią zębiny aniony karboksylowe pochodzące
z kwaśnego monomeru łączą się z kationami uwalnianymi z tkanki i są buforowane.
Ostatecznie po polimeryzacji monomeru uzyskuje się stabilne połączenie z zębiną.

Techniki wypełniania ubytków
103
Materiał Fusio określany przez producenta nazwą „płynna zębina” przeznaczony jest
do stosowania w technice podwójnej gęstości, do blokowania podcieni, wypełniania
niewielkich ubytków klasy I oraz jako materiał profilaktyczny do uszczelniania bruzd
i szczelin. Z uwagi na swoje właściwości kompozyt ten może być nakładany warstwami
o grubości do 2 mm i polimeryzowany światłem przez 10 sek.
Ryc. 8.3. Fusio (Pentron Clinical)
Ryc. 8.4. SureFil SDR flow (Dentsply)
8.2.
Techniki pośrednie
-
Wkład i nakład: kompozyty laboratoryjne, kondensowalne, minifile, nanofile,
nanohybrydy.
-
Licówka: kompozyty laboratoryjne, minifile, nanofile, nanohybrydy.
-
Korona: kompozyty laboratoryjne, minifile, nanofile, nanohybrydy, włókno szklane.
-
Most: kompozyty laboratoryjne, minifile, nanofile, nanohybrydy, włókno szklane.
8.2.1.
Wkłady z materiałów złożonych
Stwierdzenie, że dodatkowa polimeryzacja utwardzonego materiału złożonego
korzystnie wpływa na jego właściwości fizyczne, powodując wzrost odporności na
ścieranie przyczyniło się do wypełniania zębów trzonowych lub przedtrzonowych
wkładami wykonanymi z kompozytów. Wkłady charakteryzują się wyraźnie lepszą
adaptacją brzeżną do ścian ubytku dzięki wyeliminowaniu objętościowego skurczu
polimeryzacyjnego.

Rozdział 8
104
Ujemną stroną odbudowy metodą pośrednią jest stosunkowo długi czas związany
z wykonywaniem uzupełnienia, gdyż większa część pracy odbywa się poza jama ustną.
Może to jednak stanowić zwiększenie komfortu dla pacjenta, ponieważ skraca się jego
przebywanie w gabinecie dentystycznym podczas wizyty (niewygodą jest konieczność
ponownego zgłoszenia). Pośrednia metoda wypełniania ubytków klasy II umożliwia także
prawie idealną odbudowę punktów stycznych, co w wielu przypadkach jest trudne przy
stosowaniu metody bezpośredniej. W ubytkach klasy I stosunkowo rzadko wykonywane
są wkłady, ponieważ uzupełnia się je przede wszystkim metodą bezpośrednią (kompozyt
lub amalgamat).
Wkłady lub nakłady (inlay, onlay i overlay) wykonuje się ze światłoutwardzalnych
materiałów złożonych (laboratoryjnych lub stosowanych w gabinecie dentystycznym).
Ze spotykanych w naszym kraju kompozytów technicznych należy wymienić: Belle Glass
HP, Cristobal +, Dialog, GC Gradia, Sculpture Plus, Sinfony, Solidex Shofu, SR Adoro, SR
Chromasit, SR Spectrasit czy Vita VM LC. Uzyskanie odpowiednich właściwości fizyko-
chemicznych materiału złożonego, uwarunkowane jest przeprowadzeniem właściwego
procesu polimeryzacji. W tym celu stosuje się urządzenia wykorzystujące się światło,
wysoką temperaturę i ciśnienie oraz próżnię. Stopniowa polimeryzacja poszczególnych
warstw kompozytu powoduje zmniejszenie skurczu i poprawę odporności materiału na
zużycie.
Najczęściej spotykane metody polimeryzacji to:
-
światło widzialne (np.: SR Spectrasit, Enamel Plus HRi, Cristobal +, Sinfony, GC
Gradia, Solidex Shofu);
-
wysoka temperatura i ciśnienie (np.: SR Chromasit, Belle Glass HP);
-
światło widzialne i próżnia (np.: Scuplture Plus);
-
światło widzialne i temperatura (np.: SR Adoro, Targis ).
Proces polimeryzacji przy zastosowaniu światła przeprowadzany jest w specjalnych
urządzeniach (Lightbox) wyposażonych w żarówkę halogenową. W zależności od
producenta i typu urządzania zalecane jest naświetlanie umieszczonego wewnątrz
urządzenia materiału według czasów podanych przez producenta. Dokładne przestrzeganie
instrukcji polimeryzacji zapewnia wykonanie pracy o prawidłowych parametrach.
Ciekawe rozwiązanie utwardzania kompozytów technicznych zaproponowała
amerykańska firma Pentron (obecnie wchodzi w skład Sybron Dental Specialities).
W urządzeniu tym polimeryzacja może być przeprowadzana w dwóch cyklach:
-
wstępnym (Build-Up) – ciśnienie aplikowane jest przed i podczas utwardzania,
-
ostatecznym (Final) – trwa 8 minut. Przez 5 minut przy wysokim ciśnieniu azotu (75
psi), a następnie 3 minuty przy dużym natężeniu światła.

Techniki wypełniania ubytków
105
Wkłady lub nakłady można także modelować bezpośrednio w jamie ustnej pacjenta
– metoda półpośrednia. Wymaga to jednak wyjęcia wstępnie spolimeryzowanego
uzupełnienia i jego dodatkowego utwardzenia np. w lampie technicznej.
8.2.2.
Licówka
Po wykonaniu, uwarunkowanej sytuacją kliniczną, odpowiedniej preparacji na
powierzchni:
1)
policzkowej,
2)
policzkowej z włączeniem brzegu siecznego,
3)
policzkowej z przejściem na językową (podniebienną) w rejonie brzegu siecznego,
4)
policzkowej z przejściem do ½ językowej (podniebiennej),
należy pobrać wycisk precyzyjną masą wyciskową (silikonową lub polieterem). Następnie
na modelu gipsowym samodzielnie (z kompozytu nakładanego techniką warstwową)
wykonać licówkę lub zlecić jej wykonanie technikowi (kompozyt techniczny lub stosowany
w gabinecie techniką warstwową). Po otrzymaniu licówki z pracowni technicznej należy
ją przymierzyć, a następnie zacementować cementem kompozytowym o dobranym
kolorze i przezierności.
8.2.3.
Korona kompozytowa
Filar należy opracować zgodnie z zaleceniami dotyczącymi preparacji pod
uzupełnienia adhezyjne wykonując na brzegu dodziąsłowym powierzchni policzkowej
i stycznych (co najmniej do ½) rowek (chamfer), a na podniebiennej (językowej)
i pozostałych obszarach stycznych stopień. Alternatywnie chamfer może obejmować
wszystkie powierzchnie w okolicy przydziąsłowej. Następnie pobrać wycisk precyzyjną
masą wyciskową (silikonową lub polieterem) i przekazać go do pracowni. W odcinku
przednim może być wykonana korona z samego kompozytu technicznego, natomiast
w obrębie zębów trzonowych i przedtrzonowych powinna być najpierw wykonana
czapeczka z siatki z włókna szklanego, którą następnie pokrywa się kompozytem. Po
otrzymaniu korony z pracowni należy ją najpierw przymierzyć, a następnie adhezyjnie
zacementować zgodnie z zaleceniami producenta cementu.
8.2.4.
Most kompozytowy wzmocniony włóknem szklanym
W odcinku przednim najlepiej jest wykonać ten rodzaj uzupełnienia metodą bezpo-
średnią, ponieważ jest mniej czasochłonna i pozwala uzyskać bardzo dobry efekt es-
tetyczny i funkcjonalny. Natomiast metoda pośrednia znacznie wydłuża czas zabiegu
(2 wizyty) bez istotnego wpływu na funkcjonalność i wygląd.

Rozdział 8
106
Odbudowując brakujący ząb (lub zęby) trzonowy albo przedtrzonowy możemy
posłużyć się zarówno metodą bezpośrednią jak i pośrednią. Z praktycznego punktu
widzenia metoda pośrednia pozwala na bardziej optymalne opracowanie powierzchni
dośluzowej, ponieważ jest do niej bezpośredni dostęp. Na modelu gipsowym most
kompozytowy wzmocniony włóknem szklanym może wykonać sam lekarz lub zlecić to
technikowi dentystycznemu.
Uzupełnienia wykonane techniką pośrednią lub półpośrednią mocuje się cementami
kompozytowymi posiadającymi inicjator chemiczny, podwójny (chemo-światło) lub
tylko światło (licówki).
Pewną modyfikacją techniki pośredniej jest wykorzystanie wcześniej spolimeryzowanych
bloczków – insertów (np. kulistych lub o innym kształcie) wykonanych z tego samego
rodzaju materiału co wypełnienie lub przygotowanych fabrycznie (np. system Beta
Quarz). Wprowadza się je w maksymalnej wielkości do ubytku, osadzając we
wcześniej założonym, nieutwardzonym materiale złożonym i polimeryzuje. Ten
sposób postępowania przyczynia się do zmniejszenia skurczu polimeryzacyjnego, który
występuje tylko w małej objętości kompozytu. Zaletą tej metody jest szybkość (jedna
wizyta) oraz uniwersalność, wynikająca z możliwości dostosowania liczby i wielkości
insertów w zależności od wymiarów przestrzennych ubytku.

Metody oceny klinicznej i laboratoryjnej wypełnień
107
9
Metody oceny klinicznej i laboratoryjnej
wypełnień
Jedna z najwcześniej proponowanych klasyfikacji została przedstawiona w 1971 r.
przez Cvara i Ryge’a. Opiera się ona na trzystopniowej skali:
* Alpha (A) – oznacza klinicznie doskonałe wypełnienie,
* Bravo (B) – klinicznie akceptowane,
* Charly (C) – klinicznie nie akceptowane.
W ocenie brano pod uwagę:
-
retencję wypełnienia;
-
dopasowanie koloru;
-
szczelność brzeżną;
-
przebarwienie brzegu wypełnienia;
-
kształt anatomiczny wypełnienia;
-
strukturę powierzchni.
W roku 1973 Rygea i Snyder oraz w 1980 r. Rygea zmodyfikowali klasyfikację wprowa-
dzając czterostopniową skalę od 0 do 3, przy czym wypełnienie z oceną 0 lub l uzna-
je się za akceptowane (0 – bardzo dobre, l – prawidłowe po korekcie), a wypełnienia
z oceną 2 i 3 są nieakceptowane (2 – do odroczonej wymiany, a 3 – do natychmiastowej
wymiany). Według tej klasyfikacji można ocenić wypełnienia założone we wszystkich
klasach ubytków według Blacka.
·
Struktura powierzchni:
0 – gładka, prawidłowo dobrany kolor wypełnienia, brak przebarwień;
1 – lekko porowata, istnieje możliwość przywrócenia gładkości poprzez polerowanie,
a przy nadmiarze materiału dokonanie korekty;
2 – mocno porowata, silnie przebarwiona, brak możliwości poprawy;
3 – uszkodzona, silnie przebarwiona, wypełnienie do wymiany.
Według Perry i Kugel (2002):
1 – gładka i błyszcząca;
2 – gładka i matowa;
3 – ziarnista i szorstka.
Kształt anatomiczny:
0 – odpowiedni, odtworzone guzki, zachowane brzegi sieczne, punkty styczne i kontakty

Rozdział 9
108
zwarciowe;
1 – wymaga niewielkiej korekty, wypełnienie z nieprawidłowo wymodelowanym brzegiem
siecznym, częściowe punkty kontaktu zwarciowego;
2 – potrzeba znacznej korekty, wypełnienie jest nieprawidłowo wymodelowane,
niedostateczna okluzja bez możliwości korekty;
3 – nieprawidłowe wypełnienie, zgryz urazowy.
·
Przyleganie brzeżne:
0-
brak uszkodzenia brzegu wypełnienia i szpary brzeżnej, mogą być widoczne
przebarwienia;
1-
widoczne powierzchowne uszkodzenie brzegu wypełnienia i przebarwienie
tkanek zęba;
2-
uszkodzenie brzegu wypełnienia, uwidacznia się zębina lub podkład, występuje
przebarwienie twardych tkanek zęba;
3-
próchnica wtórna brzeżna, przebarwienie tkanek zęba, wypełnienie jest luźne, odłamane
są ściany zęba, istnieje konieczność natychmiastowej wymiany wypełnienia.
·
Retencja wypełnienia:
0-
całkowite zachowanie retencji;
1-
częściowa, nieznaczna utrata wypełnienia;
2-
duża utrata wypełnienia;
3-
brak wypełnienia.
·
Barwa wypełnienia:
0-
bardzo dobra;
1-
niewielka różnica zabarwienia;
2-
znaczna różnica barwy – wymaga wymiany wypełnienia.
·
Próchnica wtórna: (l – obecna, 2 – brak).
·
Reakcja miazgi na bodźce termiczne lub prąd faradyczny: dodatnia,
ujemna.
·
Występowanie wrażliwości pozabiegowej: l – obecna,2 – brak.
·
Stan tkanek otaczających ząb:
1-
idealny bez objawów zapalnych;
2-
niewielki stan zapalny dziąseł;
3-
średnie do ciężkiego zapalenie dziąseł.
·
Zachowanie punktów stycznych według Perry i Kugel (2002)
1-
doskonałe – pasek papieru o grubości 0,075 mm nie przechodzi przez punkt styczny;

Metody oceny klinicznej i laboratoryjnej wypełnień
109
2-
słabe – pasek papieru o w/w grubości osiąga punkt styczny i przechodzi z oporem;
3-
złe – pasek papieru (grubość 0,075mm) łatwo przechodzi przez punkt styczny.
·
Przeciek brzeżny (mikroprzenikanie):
1-
zachowana idealna ciągłość połączenia materiału wypełniającego i szkliwa, brak
przebarwień;
2-
niewielkie przebarwienie w obrębie połączenia wypełnienia ze szkliwem;
3-
średniego stopnia przebarwienie na granicy połączenia materiał wypełniający –
szkliwo, o wielkości > l mm;
4-
obecność próchnicy wtórnej w obrębie brzegów wypełnienia.
Kryteria bezpośredniej klinicznej oceny wypełnień lub wkładów koronowych
według Van Dijkena
·
Kształt anatomiczny:
0-
wypełnienie stanowi kontynuację kształtu anatomicznego zęba;
1-
wypełnienie nieznacznie nawisa lub nie dochodzi do obrzeża, kontakt między
zębami lekko otwarty, wysokość okluzji miejscowo zmniejszona;
2-
wypełnienie niedokładnie przylega do zarysu ubytku, zębina/podkład są
odsłonięte, niepełna wysokość okluzji;
3-
brak częściowy lub całkowity wypełnienia, złamanie zęba, widoczny zgryz urazowy,
pojawia się ból zęba lub tkanek otaczających.
·
Adaptacja brzeżna:
0-
wypełnienie jest kontynuacją anatomicznego kształtu zęba, zgłębnik nie zahacza;
1-
zgłębnik zahacza, brak widocznej szczeliny, którą zgłębnik mógłby penetrować;
2-
szczelina brzeżna widoczna wzdłuż granicy wypełnienia, szkliwo odsłonięte;
3-
szczelina brzeżna, odsłonięcie zębiny lub podkładu;
4-
wypełnienie ruchome, odłamane lub go brak.
·
Dobranie koloru:
0-
bardzo dobre;
1-
dobre;
2-
nieznaczne różnice koloru, odcienia czy przezierności;
3-
widoczne niedobranie;
4-
brak.
·
Przebarwienia brzeżne:
0-
brak;
1-
nieznaczne, możliwe usunięcie przez wypolerowanie;

Rozdział 9
110
2-
widoczne, niemożliwe do usunięcia przez wypolerowanie;
3-
znaczne.
·
Chropowatość powierzchni:
0-
gładka
1-
lekka chropowatość lub wgłębienia;
2-
brak możliwości wygładzenia;
3-
powierzchnia z głębokimi zagłębieniami; nieregularne bruzdy.
·
Wytrzymałość na abrazję
·
Zarys wypełnienia i kształt anatomiczny według Perry i Kugel (2002):
1-
nienaruszona powierzchnia bez utraty zarysu;
2-
niewielka utrata zarysu nie wymagająca wymiany wypełnienia;
3-
nadmierna utrata zarysu wymagająca wymiany wypełnienia
·
Próchnica wtórna:
0-
nieobecna na brzegach wypełnienia;
1-
obecna na brzegach wypełnienia.
Typy przylegania brzeżnego wypełnień lub wkładów koronowych według
Rouleta:
1-
gładkie przejście (smooth transition);
2-
szczelina brzeżna (marginal opening);
3-
nadmiar wypełnienia bez nawisu – wypełnienie jest wyższe niż ząb (positive ledge);
4-
znaczny niedobór wypełnienia – wypełnienie jest niższe niż ząb (negative ledge);
5-
przepełnienie – materiał wypełniający poza zarysem ubytku (overfilled).
Przyleganie brzeżne – wtórne zmiany powstające z czasem według Rouleta
(1987, 1997):
1-
pęknięcia w obrębie szkliwa;
2-
pęknięcia w obrębie wypełnienia;
3-
złamanie lub wypadnięcie fragmentu zęba;
4-
złamanie i wypadnięcie fragmentu wypełnienia.
Szerokość szczeliny brzeżnej
-
wąska ≤ 5µm
-
średnia 5-15 µm
-
szeroka ≥ 15 µm

Metody oceny klinicznej i laboratoryjnej wypełnień
111
Wskaźnik mikroprzecieku (mikroprzenikania) brzeżnego
IMB =
głębokość penetracji brzeżnej markera w mm
x 100%
długość linii ubytku w mm
IMB = 0 – brak, szczelność optymalna
0 < IMB < 20 – nieznaczny, bardzo dobra szczelność
20 < IMB < 50 – ograniczony, dobra szczelność
50 < IMB < 100 – znaczny, zła szczelność
IMB = 100 – całkowity brak szczelności
Kryteria oceny szczelności brzeżnej wypełnienia lub wkładu testem
barwnikowym
Penetrację barwnika (0,5% fuksyna zasadowa) w badaniach in vitro ocenia się według skali:
0-
brak;
1-
do połowy wypełnienia;
2-
do dna ubytku;
3-
widoczna dookoła całego ubytku;
4-
dochodząca przez zębinę do komory miazgi.
Wypełnienia można także ocenić w warunkach in vitro, Krejci i wsp. (1994) ocenia-
li wypełnienia w SEM za pomocą techniki replik z żywicy epoksydowej. Podstawą
w tej metodzie jest trzystopniowa skala oceny: A– znakomita, dobra; B – satysfakcjonująca
i C – stan nie do zaakceptowania. Oceny przebarwienia brzegu wypełnień i dobór koloru
badacze dokonali na podstawie mikrofotografii przy zastosowaniu tej samej skali. Nato-
miast badania adaptacji brzeżnej przeprowadzali analizując modele w SEM w 200-krot-
nym powiększeniu, odnotowując następujące dane o wypełnieniu: zachowanie brzegu,
pęknięcia brzegu szkliwa, pęknięcia brzegu wypełnienia, nadmiary brzeżne materiału,
ekspozycja ścian i ujawnienie ścieralności. Ocena w warunkach in vitro poprzedzona
była za każdym razem badaniami klinicznymi z użyciem tej samej skali ocen. Repli-
ki odlewano z płynnej żywicy na podstawie wycisków dwuwarstwowych wykonanych
z mas silikonowych. Po uwolnieniu z wycisku repliki oglądano pod szkłem powięk-
szającym celem wychwycenia artefaktów, napylano złotem i oglądano w SEM w powięk-
szeniach od 30- do 250-krotnych. Cały obwód fotografowano z 30-krotnym powiększe-
niem, a wybrane fragmenty również z 200-krotnym.
Badania mikroskopowe w SEM przeprowadzano także na wyizolowanych, usuniętych
zębach ludzkich, które opracowywano i wypełniano kompozytem (Stopa i Matthews-
Brzozowska 1995). Próbki napylano złotem i oglądano w SEM w powiększeniu 1000-
i 2000-krotnym.

Rozdział 9
112
Połączenie materiału z tkankami zęba określano jako:
-
bardzo dobre, jeśli wzdłuż całej granicy połączenia we wszystkich próbkach nie
spostrzeżono mikroszczelin;
-
dobre, w niektórych próbkach widoczne były mikroszczeliny;
-
zadowalające, w przypadku obserwowania we wszystkich próbkach miejsc o dobrym
przyleganiu i jednocześnie z obecnością mikroszczelin;
-
niezadowalające, przy braku połączenia materiału z tkankami zęba.
Kryteria ADA odnośnie warunków dopuszczenia do stosowania materiałów
złożonych w zębach trzonowych i przedtrzonowych
Warunki akceptacji po 3 latach obserwacji (ADA):
1.
Trwałość pierwotnie dobranego koloru wypełnienia: odchylenie max 10%
2.
Przebarwienia: max 10%
3.
Kształt anatomiczny: max utrata materiału rzędu 150 µm
4.
Punkty kontaktu w przestrzeniach stycznych (odnosi się do całkowitej liczby
testowanych wypełnień: max utrata 5%)
5.
Szczelność brzeżna (próchnica wtórna),
6.
Przebarwienia brzeżne.
Przedstawione wyżej metody stosowane są najczęściej przy ocenie klinicznej wypełnień
wykonanych z różnych materiałów takich jak: kompozyty, cementy szkło-jonomerowe,
kompomery, giomery i amalgamaty. Badania prowadzane w warunkach in vivo nie zawsze
w pełni są obiektywne. Wpływ na wyniki ma czynnik ludzki, a więc subiektywne
odczucia badających, często obarczone błędem. Pozwalają jednak na nieinwazyjną
ocenę wypełnień, ich trwałości, przydatności i zachowanie się w trakcie użytkowania.
Celem uporządkowania, Roulet określił cechy jakie powinien posiadać materiał do
wypełnień ubytków w zębach trzonowych i przedtrzonowych:
-
odporność na zużycie podobna do wykazywanej przez amalgamat srebra;
-
dobra i nie podlegająca zmianom w czasie użytkowania integracja brzegu wypełnienia
z tkankami zęba;
-
widoczność na zdjęciach rentgenowskich;
-
zachowanie kształtu lub niewielka jego zmiana pod wpływem działania sił
zgryzowych;
-
łatwość manipulacji podczas zakładania wypełnień;
-
łatwość końcowego opracowania;
-
kolor odpowiadający barwie zębów.
W/w cechy dają możliwość prognozowania trwałości wypełnień w jamie ustnej.
Uwarunkowania trwałości wypełnień
113
10
Uwarunkowania trwałości wypełnień
Czynniki wpływające na trwałość wypełnień
-
Higiena jamy ustnej
-
Nawyki żywieniowe
-
Działania zapobiegawcze
-
Wielkość wypełnień
-
Współpraca pacjenta z lekarzem
podczas wypełniania
oczekiwana trwałość
wypełnienia
-
doświadczenie kliniczne
-
rozmiar preparacji
-
starcie
-
wytrzymałość
-
trwałość
-
wrażliwość na technikę
zakładania
czynniki
związane z pacjentem
czynniki
związane z lekarzem
czynniki
związane z materiałem
Od czego zależy trwałość wypełnień w warunkach klinicznych?
·
Czynniki fizyko-chemiczne:
Warunki panujące w jamie ustnej
-
pH śliny (od l do 9)
-
wahania temperatury (od -10 do +50
o
C)
-
siła żucia (około 700 N) – liczba kontaktów między guzkami wynosi przeciętnie od 1500
do 15 000 w ciągu doby.
·
Czynniki mechaniczne:
-
wytrzymałość fizyko-chemiczna,
-
właściwości tribologiczne (ścieralność).
Parametrem określającym właściwości mechaniczne materiału jest m.in. wytrzymałość
na ściskanie. Podczas aktu żucia pomiędzy powierzchniami łuków zębowych występują
złożone siły – najwyższe wartości sił ściskających wynoszą według Grosfeldowej (1981)
890 N (zęby trzonowe) i 370 N (zęby sieczne), według Cieszyńskiego 600-1200 N (zęby

Rozdział 10
114
trzonowe,150-300 N zęby sieczne), według Jodkowskiej (1993) 2,5-7,5 MPa (w zależności
od miejsca pomiaru, większe w rejonie zębów trzonowych, mniejsze w odcinku zębów
przednich).
Wytrzymałość na ściskanie materiałów złożonych uzależniona jest głównie od wielkości
cząsteczek wypełniacza i jakości jego połączenia z matrycą. Materiały o wielkości cząste-
czek wypełniacza 0,04-0,4 µm posiadają gorszą wytrzymałość na ścieranie w porównaniu
z materiałami o cząsteczkach l-5 µm. Wytrzymałość na ściskanie dla materiałów złożo-
nych wynosi od 170-500 MPa (Combe, Jodkowska 1993, Craig 2000), a dla amalgama-
tów 302-519 MPa (Craig 2000). Należy zaznaczyć, że uzyskane wartości zależne były od
prędkości odkształcenia przyjętego podczas wykonywania testu.
Inną istotną cechą jest twardość materiału, która zależy od wielu czynników takich jak:
rozmiar cząsteczek wypełniacza (ich zwiększenie podnosi twardość), rodzaj matrycy
(żywica Bis-GMA posiada wyższą twardość w porównaniu z 2-metakrylanem uretanu)
i typ polimeryzacji (światłoutwardzalne polimery są lepsze od polimeryzujących che-
micznie). Materiały złożone wykazują makrotwardość (odpowiada wypełniacz) i mi-
krotwardość (odpowiada matryca). W skali Vickersa ich twardość wynosi 53-95 N/mm
(Wagner 1994), a np. dla amalgamatu 90-141 N/mm (Waszkiel 1983).
Odporność na ścieranie – czyli zużycie tribologiczne jest jedną z najważniejszych
cech użytkowych wypełnienia. Ubytek materiału towarzyszy tarciu dwóch ciał i jest
modyfikowany przez czynniki natury chemicznej, fizycznej i mechanicznej. W zależności
od rodzaju ocenianego materiału starcie wynosi:
-
amalgamat ściera się 2-krotnie wolniej niż szkliwo,
-
materiał złożony ściera się 4-krotnie szybciej niż szkliwo.
Badanie porównawcze ścierania amalgamatu Dispersalloy i 6 kompozytów
przeprowadzone w warunkach in vivo po 180 dniach wykazało od 1,5- do 5-krotnie niższe
starcie amalgamatu w porównaniu z użytymi materiałami złożonymi (Lutz i wsp. 1984).
Brak zunifikowanych metod oceny powoduje występowanie znacznych rozbieżności
przy interpretacji wyników badań dotyczących tych samych materiałów ocenianych przez
różnych autorów.
Według Wilsona (cyt. za Jodkowska 1993) czynnikami warunkującymi trwałość
wypełnień są: rodzaj materiału (niepowodzenia wynoszą 6-46%), czynności związane
z wypełnieniem (niepowodzenia wynoszą 5-34%) i czynniki zewnętrzne (niepowodzenia
wynoszą 1-8%). Rodzaje materiałów stosowanych do wypełnień znacznie się między
sobą różnią. Mamy do czynienia z: amalgamatem, cementami szkło-jonomerowymi,
giomerami, kompomerami oraz kompozytami (wśród nich wyróżniamy różne podgrupy

Uwarunkowania trwałości wypełnień
115
np.: ceromery, ormocery, kondensowalne czy o małej gęstości), Każda z w/w grup
posiada swoje zalety jak i jest obarczona wadami.
Kolejnymi czynnikami warunkującymi trwałość wypełnień jest przylepność materiału
wypełniającego do tkanek zęba, klasa i rozległość ubytku, położenie zęba w łuku, rodzaj
zgryzu, liczba zębów w jamie ustnej, wiek pacjenta oraz rodzaj uzębienia (mleczne, stałe,
mieszane). Znaczenie ma także stosunek głębokości do wielkości zarysu ubytku. Im ubytek
głębszy, a zasięg mniejszy tym lepsze warunki utrzymania wypełnienia, zbieżność ścian
bocznych w kierunku wlotu oraz kształt dna ubytku (płaskie dno stanowi opór podczas
wyważania wypełnienia, niekorzystne jest dno półkoliste i nieckowate, gdyż umożliwia
wyważenie wypełnienia lub jego ruchomość), rozmiar „wlotu” ubytku w stosunku do
dna ubytku (płaskie dno ubytku oraz jego odpowiednia głębokość ~2 mm zapewniają
wystarczającą trwałość wypełnienia) oraz techniki opracowywania, które mogą być
konwencjonalne (inwazyjne opracowywanie turbiną szkliwa i końcówką na mikrosilnik
zębiny), oszczędzające tkanki twarde – mikrozachowawcze (metoda PRR, atraumatyczna
– ART i tunelowa) i nieinwazyjne (chemomechaniczna (Carisolv).

116

Nadwrażliwość zębiny
117
11
Nadwrażliwość zębiny
Nadwrażliwość zębiny (ang. hypersensitivity of dentin) dotyczy pacjentów z obnażonymi
szyjkami zębowymi, ubytkami pochodzenia niepróchnicowego czy recesjami dziąseł
prowadzącymi do odsłonięcia cementu korzeniowego. W etiopatogenezie nadwrażliwości
szyjek zębowych (NSZ) istotną rolę odgrywa połączenie szkliwno-cementowe. Jeżeli
w okolicy szyjki anatomicznej cement nie kontaktuje się ze szkliwem, to odsłonięta zębina
narażona jest na działanie bodźców zewnętrznych.
Dolegliwości bólowe, które wywołuje NSZ mogą mieć charakter ostry, przeszywający, krót-
kotrwały pojawiający się tylko w czasie działania bodźca drażniącego. Nasilenie bólu bywa
różne i zależy od stanu psychicznego pacjenta, jego subiektywnej reakcji na ból, poziomu
intelektualnego, a nawet pory roku. Najczęściej dolegliwości bólowe o różnym nasileniu wy-
stępują podczas szczotkowania zębów, spożywania zimnych napojów i wdychania zimnego
powietrza. Mogą one dotyczyć pojedynczych zębów lub obejmować większą ich liczbę.
Nadwrażliwość występuje głównie na powierzchniach policzkowych w okolicy przyszyjkowej,
rzadziej na powierzchniach językowych lub żujących zębów stałych. Najczęściej dotknięte
są kły i zęby przedtrzonowe, a w następnej kolejności siekacze i zęby trzonowe. U osób
praworęcznych dolegliwości występują częściej po lewej stronie łuku, a u leworęcznych
odwrotnie. Związane jest to z naciskiem na szczoteczkę w trakcie oczyszczania zębów.
Do wystąpienia nadwrażliwości zębiny predysponują czynniki ogólne i miejscowe. Do
ogólnych zalicza się m.in. stany wyczerpania nerwowego, przepracowanie, ciążę i okres
rekonwalescencji. Duży wpływ mają także warunki życia i środowisko pracy, dieta oraz
nawyki higieniczne. Za najważniejsze czynniki miejscowe przyjmuje się obecnie przewlekłe
mikrourazy związane z nieprawidłowo wykonywanymi zabiegami higienicznymi, dążenie
do uzyskania perfekcyjnie „białego” uśmiechu poprzez częstsze stosowanie przez pacjentów
past o zwiększonej zawartości środków ściernych, nieumiejętne szczotkowanie lub używanie
szczoteczek o zbyt twardym włosiu, zwłaszcza tuż po spożyciu pokarmów kwaśnych.
Inne czynniki to picie znacznych ilości soków owocowych, napojów energetyzujących,
szkodliwe nawyki (parafunkcje), zaburzenia zgryzowe prowadzące do kontaktów
ekscentrycznych zębów przeciwwstawnych, zaburzenia w układzie stomatognatycznym
sprzyjające odsłonięciu zębiny i otwarciu kanalików zębinowych, obnażenie części
korzeniowej w przebiegu chorób przyzębia, uszkodzenia mechaniczne po skalingu,
próchnica i ubytki pochodzenia niepróchnicowego.
Istnieje kilka teorii powstawania nadwrażliwości zębiny. Obecnie jest powszechnie
akceptowana teoria hydrodynamiczna. Tłumaczy ona powstawanie bólu w wyniku
drażnienia nerwów czuciowych w splocie pododontoblastycznym szybkim ruchem płynu

Rozdział 11
118
w kanalikach zębinowych. Ruch ten wywołują bodźce termiczne, mechaniczne i chemiczne.
Stopień nadwrażliwości jest uwarunkowany stanem ujść kanalików zębinowych. Ich
zamknięcie np. przez warstwę mazistą, adhezję białek śliny lub odkładanie się silnie
zmineralizowanej zębiny wtórnej, powoduje spadek dolegliwości.
Potwierdzeniem teorii hydrodynamicznej jest ocena w SEM penetracji barwników,
która wykazała około 8-krotnie większą liczbę kanalików i 2-krotnie większą ich średnicę
w nadwrażliwej zębinie w porównaniu z niewrażliwą. Powoduje to szybszy przepływ
płynu kanalikowego i wzrost intensywności objawów. Przepływ płynu zgodnie z prawem
hydrodynamicznym Poisenille’a jest proporcjonalny do czwartej potęgi promienia,
a zatem dwukrotne powiększenie wymiaru kanalików daje 16-krotny wzrost przepływu
płynu. Połączenie wzrostu liczby otwartych kanalików ze zwiększeniem ich średnicy
w zębach wrażliwych może wskazywać na większy około 100-krotnie przepływ płynu niż
w niewrażliwych zębach.
Nadwrażliwość zębiny należy różnicować z: bólem pochodzenia miazgowego, wrażliwością
zębów z rozległymi wypełnieniami i pozabiegową, odsłonięciem zębiny w następstwie
urazu mechanicznego, pęknięciami szkliwa i zębiny, sytuacją po zacementowaniu
uzupełnień protetycznych, szczególnie cementami szkło-jonomerowymi, jak też po
zabiegu wybielania zębów, jeśli był on przedłużony i intensywny. W tym ostatnim przypadku
zwiększona wrażliwość wiąże się z rozpuszczaniem części organicznej w defektach szkliwa
przez substancje utleniające. W rezultacie otwierają się kanały dyfuzyjne sięgające zębiny
oraz wrasta porowatość szkliwa.
Metody badań
Dolegliwości bólowe mogą być wywołane przez bodźce mechaniczne (szczotkowanie zębów,
zgłębnikowanie, dotyk), termiczne (ciepło, zimno), elektryczne i chemiczne (glukoza,
chlorek sodu i wapnia). Jedną z najnowszych metod badawczych jest użycie techniki
powielonego modelu i mikroskopu elektronowego.
Bodźce mechaniczne
– dotyk (najczęściej stosowany pierwszy bodziec). Sposób
postępowania: uciśnięcie tkanek zęba tępym zgłębnikiem. Zwykle zgłębniki wywołują
różny, nie dający się ocenić ucisk na ząb. Wynik badania zależy więc od trafności wybranego
miejsca, ostrości instrumentu i siły nacisku. Wadą tej metody jest nie ustalona siła nacisku
zgłębnika i jego wpływ na powierzchnię zębiny oraz możliwość uszkodzenia twardych
tkanek zęba. Już w 1964 r. Smith i Ash skonstruowali mechaniczny stymulator, który został
ulepszony przez Daytona (1974) i zmodyfikowany przez Morgana (1997). Urządzenie składa
się z 15 cm stalowego drutu z końcówką skierowaną do powierzchni zęba. Zakończenie
tego urządzenia może poruszać się wzdłuż policzkowej powierzchni wrażliwego zęba. Siła
nacisku regulowana jest przy pomocy śruby, która odsuwa lub przybliża końcówkę do zęba.
Pomiar odczytuje się w milimetrach. Z uwagi na rozmiar urządzenia i brak możliwości

Nadwrażliwość zębiny
119
pomiaru w jednostkach siły nie jest ono obecnie stosowane. Inny mechaniczny stymulator
skonstruowali w 1987 r. Orcharldson i Collins. Składał się on z podnośnika wznoszącego
się na krótkiej belce. Końcówka urządzenia (ostro zakończony zgłębnik) skierowana była
pionowo do powierzchni zęba i wywierała nacisk ze wzrastającą siłą, która była podawana
w gramach. Urządzenie posiadało kształt pozwalający zastosować je na większości powierzchni
badanych zębów. Najnowszym sprzętem pomiarowym jest zgłębnik Yeapla (model 200A).
Jest to elektroniczne urządzenie wrażliwe na ucisk. Rączka ma rozmiar wiecznego pióra
i przymocowana jest elektrycznym kablem do urządzenia pomiarowego, które generuje siłę
kiedy jest przykładane równolegle do powierzchni zęba. Jeśli przyłożona siła o wielkości
70 g nie powoduje żadnych objawów bólowych – ząb ocenia się jako niewrażliwy (Polson
wsp. 1980). Kleinberg (1994) skonstruował inne urządzenie składające się z przyrządu
pomiarowego i ostrej końcówki badawczej. Pomiar siły odczytuje się w cN (centiniutonach).
Jeśli pacjent nie reaguje bólem na ucisk 80 cN – ząb uznany jest za niewrażliwy.
Bodźce termiczne
– stosowano zimne powietrze lub wodę oraz zgłębniki o różnej
temperaturze. Po około 5 minutach od przeprowadzenia testu dotykowego przy użyciu
standardowej strzykawki wodno-powietrznej z odległości l cm generuje się podmuch
powietrza trwający l sekundę lub dłużej w zależności od reakcji pacjenta (Fitzgerald 1956).
Wyniki oceniano według skali wrażliwości na powietrze opisanej przez Schiffa (2000):
0 – brak reakcji na stymulację
1 – reakcja na stymulację powietrzem (pacjent nie sugeruje zaprzestania stymulacji)
2 – reakcja na stymulację powietrzem (pacjent unika działającego bodźca)
3 – reakcja na stymulację powietrzem (pacjent czuje wyraźny ból i prosi o zaprzestanie
stymulacji)
Metoda ta została uznana za mało dokładną.
Inną, lepszą formą oceny wrażliwości na bodźce termiczne było użycie Biomat Thermal
Probe – przyrządu pomiarowego składającego się z miernika temperatury podłączonego
do urządzenia rejestrującego. Wyposażone jest ono w rączkę pozwalającą określić
natężenie bólu odczuwanego przez pacjenta. Miernik temperatury przykłada się do zęba
– rejestruje on temperaturę, przy której pacjent odczuwa ból. Powietrzny system Yeah
został skonstruowany przez Minikoffa i Axelroda w roku 1987. Kontrolowany strumień
powietrza z plastikowego dozownika skierowany jest na odsłoniętą zębinę. Początkowo
wysoka temperatura powietrza stopniowo się zmniejsza aż do osiągnięcia poziomu, przy
którym pacjent nie odczuwa żadnego bólu.
Ostatnio skonstruowano nowy powietrzny system oparty na kontroli temperatury przez
mikroprocesor. Jest on w stanie generować podmuch powietrza o temperaturze od -5°C
do +85°C. Jednakże przedłużone użycie bodźca powietrznego w badaniu nadwrażliwości
jest niewskazane. Udowodniono bowiem, że zębina ludzka osuszana powietrzem przez

Rozdział 11
120
5 minut pozostaje niewrażliwa na bodźce bólowe tak długo, jak długo jest sucha. Poza
tym utrata wody z zębiny powoduje przemieszczanie się jąder odontoblastów do wnętrza
kanalików, a utrata wrażliwości może być spowodowana blokadą mechaniczną (częściowa
okluzja kanalików). Wykonano także wiele testów przy użyciu zimnej wody, która najlepiej
sprawdza się, kiedy ma temperaturę 7°C, ponieważ minimalizuje możliwość uzyskania
fałszywych odpowiedzi (inne przyczyny bólu). Do badań wykorzystywano także wodę
o zróżnicowanej temperaturze od 20 do 0°C. Odsłoniętą zębinę polewano wodą przez
3 sekundy. Jeżeli nie uzyskano pozytywnej odpowiedzi pacjenta, to zabieg odraczano
na dwie minuty i stosowano kolejną porcję wody zimniejszej o 5°C. Negatywną stroną
tego testu był brak możliwości ilościowego pomiaru podanej wody i niedokładny czas jej
stosowania. Zastanawiano się również, czy czas dwóch minut jest wystarczający do tego,
aby ząb uzyskał odpowiednią temperaturę. Również polewanie zęba strumieniem wody pod
ciśnieniem może powodować dodatkową stymulację zębiny. W roku 1985 Mc Fali i Morgan
wykorzystali do badania FTS (GForest Technology Systems), Direct-Contact-Probe i unit
pomiarowy (Model DCP-80, FTS system Inc.) (Stone Ridge 1984). Urządzenie wytwarzało
temperaturę od -80 do +130°C. Badania rozpoczynano od temperatury 36°C, a następnie
zmniejszano ją o jeden stopień przy każdym dotyku do zębiny. Przerwy pomiędzy
badaniami wynosiły 45 sekund. Procedura była powtarzana aż do uzyskania pozytywnej
odpowiedzi pacjenta.
W 1987 r. Addy użył podobnego sprzętu do testowania zębów bodźcem zimnym.
Badania rozpoczynał od temperatury 0°C, którą następnie zwiększał o 5°C. Urządzeniom
tym zarzucano, że nie odwzorowują naturalnych sytuacji, w których pacjent narzeka
na nadwrażliwość. Metoda ta wymaga także dotknięcia zęba przez końcówkę urządzenia, co
daje zakłócenia wyniku przez dodatkowy bodziec.
Bodźce elektryczne
– zalecane są do pomiaru aktywności miazgi, a nie do oceny
wrażliwości zębiny. Stwierdzono, że konwencjonalny tester stanu miazgi nie jest
odpowiedni do badania nadwrażliwości zęba (Clark 1990, Troullos 1984).
W roku 1977 Stark skonstruował stomatologiczny stetoskop miazgowy dostosowany do
pomiaru wrażliwości zębiny. Urządzenie to składało się z czułego woltomierza podłączonego
do aparatury drukującej, która była aktywowana przez przycisk kontrolny. Do woltomierza
podłączano konwencjonalny, elektryczny tester miazgi. Intensywność bodźca była mierzona
w woltach. Podczas badania używano żelu przewodzącego o pH 5,4-5,6. W momencie
kiedy pacjent odczuwał „szczypanie” naciskał przycisk kontrolny, który zatrzymywał pracę
urządzenia. Końcówka testowa była przykładana do szkliwa zęba, a nie w okolicy szyjki
zębowej. Takie umieszczenie końcówki pomiarowej miało zapobiec rozprzestrzenianiu się
bodźca na okoliczne tkanki. Badano związek pomiędzy wartościami napięcia i skalą bólu.
Jednakże wyniki tego badania poddawano w wątpliwość, a bodźce elektryczne uznano za
nie występujące w naturalnym środowisku jamy ustnej. Zaobserwowano również, że strach

Nadwrażliwość zębiny
121
pacjentów przed nieznanym bodźcem powodował, częste zaniżanie przez nich wartości,
przy których odczuwali dolegliwości bólowe.
Badania chemiczne – w metodzie tej używano osłodzonej, kwaśnej płukanki do ust (woda
z cukrem i cytryną), roztworu glukozy, NaCl i CaCl
2
. Niskie pH płynu powodowało
demineralizację w obrębie kanalików zębinowych, a następnie występowała wrażliwość.
Hipertoniczne roztwory wzbudzały ruch płynu w kanalikach, zarówno w badaniach in
vivo, jak i in vitro. Roztwór chlorku wapnia ze względu na swoją wysoką rozpuszczalność
wywoływał reakcję zarówno w płytkich, jak i głębokich warstwach zębiny. Roztwory
aplikowano za pomocą watki na odsłoniętą powierzchnię zębiny przez 10 sekund lub
do zarejestrowania dyskomfortu odczuwanego przez pacjenta. Tego rodzaju testy uznano
jednak za kłopotliwe i niebezpieczne dla otaczających ząb tkanek miękkich.
Ocena subiektywnej odpowiedzi pacjenta
– W celu oszacowania odpowiedzi
pacjenta i natężenia bólu zaleca się użycie następujących metod:
·
Werbalna skala bólu (VRS, ang. Verbal Rating Scale) według Keele’a (1948)
0-
brak
1-
słaby
2-
znaczny
3-
znaczny, trwający ponad 10 sekund
Skala oferuje ograniczoną możliwość opisu doznań bólowych przez pacjenta, przez co jest
mało dokładna.
·
Wizualna skala analogowa (VAS, ang. Visual Analog Scale)
Jest to 10 cm linia, na której pacjent zaznacza swoje odczucia. Przy czym 0 – oznacza
brak jakichkolwiek doznań, a 10 – maksymalny dyskomfort.
brak bólu 0 __________________________________ 10 najcięższy, niewyobrażalny ból
Porównuje się ją do termometru, który dokładnie wskazuje natężenie bodźca.
Użyteczność i niezawodność tej skali udowodniono w wielu badaniach (Clark
i Troullos 1990). Jednakże daje ona tylko jednowymiarową ocenę bólu oraz nie rozróżnia
intensywności i poziomu dyskomfortu. Wymaga również od pacjenta umiejętności
myślenia abstrakcyjnego.
Skala VDS (ang. Verbal Descriptor Scale) podobnie jak skala VRS używa słownych opisów
do wyrażenia intensywności bólu. Stopnie intensywności dolegliwości (skargi):
Małe – odczuwalne przy bardzo zimnym/gorącym piciu/jedzeniu;
Średnie – odczuwalne przy zimnym/gorącym piciu/jedzeniu;
Dotkliwe – odczuwalne przy zimnym/gorącym piciu/jedzeniu oraz wciąganiu powietrza.

Rozdział 11
122
·
Kwestionariusz Mc Gilla (MPQ) opracowany w 1975 r. przez Melzacha
Jest pierwszym werbalnym testem ukazującym wielowymiarową naturę bólu. Składa się
z trzech odrębnych składowych: uczucia bólu, wywołanego nim efektu emocjonalnego
oraz oceny, jaką stawia pacjent. Pacjentom przedstawia się 80 różnych przymiotników
podzielonych na grupy. Badany musi wybrać jeden przymiotnik z każdej grupy, który
najlepiej opisuje jego własne doznania. Punktacja za każdą odpowiedź jest sumowana
i daje końcowy wynik testu. Kwestionariusz ten dostępny jest również w skróconej formie
(MPQ-SF). Zawiera on wtedy 15 wybranych przymiotników. Integralną częścią skróconej
formy kwestionariusza jest Present Pain Index. Jedną z zalet tego testu jest to, że dostarcza on
dodatkowych informacji o jakościowych i ilościowych aspektach bólu. Jednakże wykonanie
tego testu jest bardzo czasochłonne w porównaniu z innymi metodami oceny.
Szpitalna skala niepokoju i depresji według Zakrzewskiego i Feinmanna (HAD)
Powstała w wyniku 4-letnich badań nad pacjentami z atypowymi bólami twarzy oraz
neuralgią nerwu trójdzielnego (Zigmond i Snaith 1983) Uznano, że skala ta efektywnie
ocenia wpływ bólu na samopoczucie pacjenta. Jednakże nie zanotowano nigdy jej użycia
w badaniach nad nadwrażliwością zębiny.
Metodyka badań oceniająca nadwrażliwość zębiny według zaleceń ADA z 1986 r.:
1.
Oceniana cecha powinna być określona ilościowo oraz winna być powtarzalna.
2.
Należy określić próg występowania reakcji na bodźce w sposób ilościowy i skorelować
go z natężeniem. Próg reakcji bólowej na bodźce powinien obejmować pewien zakres,
a nie tylko punkt.
3.
Należy ustalić relację między zastosowanym bodźcem, a obrazem nadwrażliwości,
który badamy.
4.
Do oceny należy zastosować kilka rodzajów bodźców. Słabszy, powinien być użyty
przed silniejszym tzn. badanie zgłębnikiem przed bodźcami termicznymi. Bodźce
powinny być powtarzalne, a wpływ jednego na drugi minimalny.
5.
Uzyskane wyniki badań należy poddać analizie statystycznej.
6.
Zastosowanie różnego natężenia bodźca np. z użyciem sondy Yapple’a i ustalonego
progu reakcji w przeciwieństwie do wcześniej stosowanej metody ze stałym natężeniem
bodźca (użycie strzykawki wodno-powietrzej). Granica progu bólowego 70-75 g.
7.
Percepcja bólu jest uzależniona od:
-
wielkości bodźca,
-
stopnia zaawansowania patologii twardych tkanek zęba,
-
czynników psychologicznych (tj. oczekiwania na ból, stres i osobowości pacjenta).
8.
Żadna z obecnie znanych metod służących do oceny nadwrażliwości nie jest
idealna, obiektywna i w pełni powtarzalna.
Naszym obowiązkiem wobec pacjentów cierpiących na tę dolegliwość jest ciągłe

Nadwrażliwość zębiny
123
dążenie do wynalezienia metody, która pozwoli na obiektywny pomiar subiektywnej
odpowiedzi pacjenta.
Postępowanie lecznicze
„Idealny” środek do znoszenia nadwrażliwości zębiny nie powinien:
-
drażnić miazgi,
-
powodować bólu przy kontakcie z zębem,
-
przebarwiać zębów oraz być łatwo aplikowany oraz szybko i długotrwale działać.
Niestety żaden z obecnie stosowanych w tym celu materiałów nie spełnia tych wymagań.
Istnieje wiele metod leczniczych stosowanych w znoszeniu nadwrażliwości zębiny.
Możemy je podzielić na fizykalne, chemiczne i fizykochemiczne.
Leczenie fizykalne polega na znoszeniu przewodnictwa nerwowego. Stosowne metody
zalecały „śniegowanie” zębiny schłodzonym kwasem węglowym (niebezpieczeństwo
uszkodzenia miazgi przy schłodzeniu poniżej -l°C) oraz ogrzewanie strumieniem
dwutlenku węgla pod ciśnieniem 0,5 atm. Nowe metody postępowania wykorzystują
promieniowanie laserowe, emitowane przez lasery wysokoenergetyczne, które powodują
nadtopnienie i zablokowanie kanalików zębinowych oraz lasery biostymulacyjne,
których działanie prowadzi do obniżenia wrażliwości na bodźce i ograniczenie szybkości
ich przewodzenia w kanalikach. W leczeniu nadwrażliwości zębiny znajdują obecnie
zastosowanie cztery rodzaje laserów tj. He-Ne i GaAlAs o małej mocy oraz Nd-YAG i CO
2
o średniej mocy. Po zabiegach z użyciem laserów małej mocy (trzykrotne naświetlanie
w odstępach 1-2 i 8 tygodniowych) wrażliwość na bodźce termiczne ustąpiła u 67%
pacjentów, a na bodźce mechaniczne u 65% pacjentów. W przypadku skojarzenia tej
metody z zastosowaniem lakieru zawierającego fluorek sodu lub fluorek cyny skuteczność
w znoszeniu nadwrażliwości zębiny wzrasta ponad 20%. Po zastosowaniu laserów średniej
mocy głębokość obliteracji kanalików zębinowych w przypadku lasera Nd-YAG wynosi
około 4 µm, a po użyciu lasera CO
2
od 2 do 8 µm. Po zastosowaniu lasera Nd-YAG (30 mJ,
10Hz) objawy nadwrażliwości zębiny na bodźce termiczne ustępują u 63% pacjentów, a na
bodźce mechaniczne u 61%. W przypadku zastosowania laserów CO
2
skuteczność wynosiła
94,5% już po jednokrotnym naświetleniu nadwrażliwych rejonów zębiny. Korzystnym
okazało się skojarzenie terapii laserowej z zastosowaniem żelu fluorku cyny, skuteczność
terapeutyczna wynosiła 96,5%. Czas w którym dochodziło do remisji dolegliwości bólowych
ze strony zębiny był różny, średnio wynosił około 4 miesięcy po zakończeniu laseroterapii.
W przypadku zastosowania lasera He-Ne powrót dolegliwości bólowych wynosił od 7,4%
do 66%, lasera Nd-YAG około 34%, lasera CO
2
u ponad 50%. Należy podkreślić, iż terapia
laserowa jest bezbolesna dla pacjentów, czas naświetlania jest krótki (około 2 minut),
a efekt terapeutyczny występuje natychmiast po zakończeniu zabiegu.

Rozdział 11
124
Czynniki chemiczne stosowane są w gabinecie stomatologicznym przez
wykwalifikowany personel medyczny lub używane w domu przez pacjenta.
W gabinecie stosuje się związki:
-
fluoru (fluorek sodu i cyny, fluorokrzemian sodu, aminofluorki),
-
wapnia (dwuzasadowy fosforan i chlorek),
-
szczawiany (żelaza, glinu i potasu),
-
strontu (chlorek),
-
potasu (azotan i cytrynian),
-
substancje precypitujące białka (np. azotan srebra, aldehyd glutarowy),
-
żywice adhezyjne i nieadhezyjne (np. Cervitec, Dentin Protector, All Bond, Prime
& Bond, Seal & Protect, Admira Protect).
Związki fluoru
Związki fluoru stosowane są od dawna w leczeniu nadwrażliwości zębiny. Jony fluorkowe łączą
się z jonami wapnia w płynie kanalikowym i powodują wytrącanie nierozpuszczalnego CaF
2
.
Zaobserwowano różnice w skuteczności znoszenia nadwrażliwości zębiny w zależności od
stężenia fluorku w stosowanym środku. Różna jest także szybkość działania poszczególnych
związków fluoru (np. NaF, SnF
2
czy lakierów fluorkowych (Fluor Protector, Duraphat) oraz
efektywność różnych metod ich stosowania (np. jonoforeza 2% NaF). Efekt terapeutyczny F
jest tym wyższy, im dłużej jony fluorkowe mają kontakt z powierzchnią zęba. Zakwaszone
roztwory fluorków są bardziej efektywne, niż roztwory o pH obojętnym – zakwaszony 2%
NaF – zmniejsza przepływ kanalikowy o 24,5%, a roztwór obojętny o 17%. Środki o wyższym
stężeniu fluoru są bardziej skuteczne i działają dłużej (12,5% F Biofluorid stosowany 3-krotnie
w l -tygodniowych odstępach czasu). Różnica w szybkości działania zależy także od związku
chemicznego będącego nośnikiem fluoru np. aby uzyskać efekt odpowiadający jednorazowej
aplikacji NaF, należy stosować SnF
2
przez okres 2-4 tygodni, a np. fluoroamina jako składnik
past do zębów uwalnia jony fluoru maksymalnie w ciągu 3 minut. Związek ten stosowany w
lakierach uwalnia jony F do 4 tygodni.
Związki fluoru mogą być stosowane miejscowo w postaci żeli i lakierów. Ich działanie jest
jednak krótkotrwałe. Cienka warstwa nałożonego lakieru w krótkim czasie ulega wypłukaniu
przez ślinę, ruchy warg oraz podczas szczotkowania zębów. Przy zastosowaniu IFRD (ang.
Intraoral Fluoride Releasing Device) składającego się z matrycy akrylowej (HEMA metakrylan
hydroksyetylu i MMA – metylometakrylan) przesączonej NaF i otoczonej akrylowym
kopoliomerem obserwowano stałe uwalnianie fluoru (około 0,04 mg/dobę) do jamy ustnej.
Wartość tę osiągnięto dopiero po tygodniu i utrzymywała się ona na stałym poziomie podczas
całego okresu leczenia trwającego około 4 miesięcy. IFRD umieszcza się w niewielkim
metalowym zamku (o wymiarach 2,2 na 3,2 mm) podobnym do ortodontycznego, który
jest umocowany materiałem złożonym na policzkowych powierzchniach zębów trzonowych
górnych lub dolnych. Dolegliwości bólowe po zastosowaniu IFRG w porównaniu z grupą

Nadwrażliwość zębiny
125
kontrolną po 7 dniach wyraźnie spadły, po kolejnych 3 tygodniach nadwrażliwość ustąpiła
całkowicie i stan bez dolegliwości utrzymywał się do końca badania. Według zapewnień
autorów, nowa metoda jest bezbolesna, bezpieczna, szybka i tania. Nie pozostawia dyskomfortu
ani podrażnień jamy ustnej podczas leczenia.
Związki wapnia
Uważa się, że związki wapnia zwiększają mineralizację zębiny okołokanalikowej i współdziałają
w tworzeniu precypitatów wapniowych w kanalikach zębinowych. W leczeniu nadwrażliwości
znajdują zastosowanie Ca(OH)
2
w postaci past i opatrunków oraz roztwory 10% chlorku
wapnia z dwuzasadowym fosforanem wapnia. W wyniku reakcji obu tych związków
dochodzi do powstania nierozpuszczalnych precypitatów soli wapnia, które mechanicznie
blokują światło kanalików zębinowych. Inną koncepcję zwalczania nadwrażliwości zębiny
zaproponowali producenci materiału Green Or. Jest to preparat dwuskładnikowy zawierający
związki potasu i osobno sole wapnia i strontu. Mechanizm jego działania polega na reakcji
podwójnej wymiany zachodzącej pomiędzy solami potasu, wapnia i strontu na powierzchni
zęba. W wyniku tej reakcji powstają krystaliczne kompleksy fosforanowo-węglanowe
zamykające otwarte kanaliki zębinowe, znoszące tym samym ból. Jednocześnie uwolnione
do kanalików zębinowych jony K depolaryzują włókna nerwowe i obniżają ich wrażliwość
na ruch płynu.
Szczawiany
Szczawian potasu znalazł zastosowanie w materiale „Protect Dentin Desensitizer” firmy Butler.
W wyniku reakcji szczawianu potasu z jonami wapnia w kanalikach zębinowych powstają
nierozpuszczalne sole, które powodują zwężenie ich światła. Wolne jony K przerywają
przewodnictwo nerwowe w miazdze, powodując ustąpienie bólu. Działanie środka utrzymuje
się przez około 4-6 miesięcy. Ostatnio zamiast Protect Dentin Desensitizer firma Butler Gum
wprowadziła Sensi Pro. Środek ten zawiera szczawian potasu, który z jonami Ca obecnymi
w kanalikach zębinowych tworzy szczawian wapnia zamykając ich światło. Wolne jony
K utrudniają dodatkowo przenoszenie bodźców nerwowych.
Związki strontu
Chlorek strontu (używany w stężeniu 1% i 10%) powoduje powstawanie nierozpuszczalnych
kompleksów Sr-Ca. Szczególnie intensywne wydaje się połączenie 2% lakieru flurkowego
z 10% chlorkiem strontu. Związek strontu z apatytami zębiny prawdopodobnie zwiększa
inkorporację jonów F, przez co efekt leczniczy jest silniejszy niż w przypadku użycia samego
lakieru fluorkowego. Środki Perio, Sensodyne i Thermodent zawierające chlorek strontu
wykazują podobna skuteczność terapeutyczną.
Substancje precypitujące białka
Azotan srebra to środek precypitujący białka. Ze względu na możliwość przebarwiania

Rozdział 11
126
twardych tkanek zęba i powodowanie podrażnienia miazgi obecnie nie jest stosowany. Oprócz
niego inne związki takie jak cytrynian sodu (Protect) czy formaldehyd (Emorform) wykazują
działanie lecznicze polegającego na precypitacji białek i tworzeniu nierozpuszczalnych
kompleksów wapniowych wewnątrz kanalików zębinowych. Przeprowadzone badania
wykazały, że pasty zawierające cytrynian i monofluorofosforan sodu są efektywniejsze
w działaniu w porównaniu z pastami zawierającymi sam monofluorofosforan.
Aldehyd glutarowy łączy się z proteinami płynu znajdującego się w kanalikach zębinowych
i powierzchniowych komórkach przyległej miazgi. Czynniki zawarte w glutaraldehydzie
lub w żywicy HEMA powodują jednak powstanie lokalnej martwicy prowadzącej do utraty
przyczepu. System desentitizer (Ivoclar-Vivadent) jest lakierem blokującym wytrącanie się
białek z płynu kanalikowego zawierającym dwumetakrylan glikolu i aldehyd glutarowy, który
łączy grupy aminowe wytrąconych cząsteczek. Zmniejsza to nadwrażliwość zębiny o około
50%.
Innym związkiem stosowanym w leczeniu nadwrażliwości zębiny jest hydroksyapatyt będący
głównym składnikiem kości i twardych tkanek zęba. Jego działanie polega na zwiększeniu
mineralizacji zębiny okołokanalikowej oraz na tworzeniu precypitatów białkowych
w kanalikach. Hydroksyapatyt znajduje się np. w paście Sensible Oral B. Cząsteczki tego
związku wbudowują się w strukturę zębiny, zwężając światło jej kanalików. Po 3 tygodniach
stosowania u około 31% pacjentów i po 6 tygodniach u 51% badanych spostrzega się ustąpienie
dolegliwości.
Żywice adhezyjne i nieadhezyjne
Żywice adhezyjne impregnują cienką warstwę powierzchni zębiny dając natychmiastową ulgę
w odczuwaniu bólu. Należy do nich np. materiał Seal & Protect. Jest to światłoutwardzalny
lakier zawierający cząsteczki wypełniacza o rozmiarze około 7 nm, umożliwiający im
wnikanie w głąb kanalików zębinowych. Dodatkowo w materiale znajduje się środek
przeciwdrobnoustrojowy triklosan oraz hydrofluorek cetylaminy jako źródło jonów fluoru.
W odróżnieniu od innych materiałów adhezyjnych Seal & Protect charakteryzuje się dużą
odpornością na ścieranie i pękanie struktury po polimeryzacji. Lakier działa na zasadzie
blokowania kanalików poprzez głębokie wnikanie żywicy z nanowypełniaczem do jego
przestrzeni oraz działanie jonów F- z uwodnionego fluorku cetylaminy. Pełne zniesienie
nadwrażliwości uzyskuje się po stosowaniu materiału co 6 miesięcy.
Jednym z bardziej uniwersalnych, profesjonalnie stosowanych materiałów jest Viva Sens.
Środek ten dzięki obecności metakrylanów kwasu fosfonowego i kwasu poliakrylowego
powoduje wytrącanie jonów wapnia, z którymi kwasy te następnie tworzą trudno
rozpuszczalne związki. Tworzeniu soli wapnia sprzyja obecność potasu. Za wytrącanie
białek odpowiada alkohol etylowy i metakrylan kwasu fosfonowego. Zawarta w materiale

Nadwrażliwość zębiny
127
hydroksypropyloceluloza powoduje powstanie cienkiej błony, która zamyka światło
kanalików zębinowych, natomiast zmiany polaryzacji zachodzą dzięki obecności jonów
potasu. Blokowanie kanalików zębinowych rozpoczyna się już po 5 minutach, a pełny efekt
zostaje osiągnięty po około 30 minutach.
Związki potasu
Isodan (Septodont) to środek w postaci lepkiego płynu zawierającego azotan potasu,
fluorek sodu oraz kwas hydroksyetylometakrylowy (HEMA). Azotan potasu uwalnia jony
K+, które wpływają na przemiany biochemiczne w zakończeniach nerwowych, co skutkuje
zniesieniem przewodnictwa nerwowego. Fluorek sodu blokuje kanaliki zębinowe poprzez
tworzenie złogów fluorku wapnia, na wskutek łączenia się z wapniem zawartym w płynie
kanalikowym. HEMA ułatwia dyfuzję fluorku sodu i azotanu potasu oraz zapobiega ruchowi
płynu wewnątrzkanalikowego. Sposób aplikacji środka, polega na tym, że na oczyszczoną,
odizolowaną od dopływu śliny powierzchnię zębiny, przy użyciu aplikatora nakłada się
warstwę materiału i rozprowadza delikatnym strumieniem powietrza. Czynność tę powtarza
się 2-3-krotnie, aż do ukazania się gładkiej, lśniącej powierzchni. Zaleca się ochronę
powierzchni zębiny przed szczotkowanie przez 24 godziny.
W leczeniu nadwrażliwości zębiny pomocne są materiały wypełniające takie jak cementy
szkło-jonomerowe, czy polimery (kompozyty, kompomery i giomery). Stosujemy je kiedy
zawodzą inne metody, gdyż jest to postępowanie inwazyjne. W sytuacji gdy nadwrażliwość
związana jest z obnażeniem korzenia można zastosować leczenie polegające na pokryciu
nadwrażliwego miejsca przeszczepem tkankowym (śluzówkowo-dziąsłowym) i pokrycie nim
odsłoniętej powierzchni korzenia lub też usunąć miazgę w toku leczenia endodontycznego.
Z badań wynika, że po użyciu cementu szkło-jonomerowego Vitrebond objawy nadwrażliwości
powróciły tylko u 2% pacjentów w ciągu tygodnia, a w ciągu roku odsetek ten wzrósł do
21%. Ocena porównawcza skuteczności lakieru fluorkowego Duraphat i cementu szkło-
jonomerowego Vitrebond po 12 miesiącach obserwacji wykazała u 72% pacjentów całkowity
brak objawów bólowych po założeniu cementu, podczas gdy po lakierze Duraphat odsetek
ten wyniósł 26,7%. Poza środkami stosowanymi w gabinecie stomatologicznym leczenie
nadwrażliwości winno być kontynuowane przez pacjenta w warunkach domowych. Poleca
się codzienne szczotkowanie zębów pastami zawierającymi aktywne składniki takie jak:
hydroksyapatyt, azotan i cytrynian potasu, chlorek strontu, cytrynian sodu, związku fluoru
i inne. Wybór past leczniczych jest duży np:
• Lacalut Sensitive – zawiera mleczan glinu i aminofluorek (szczotkowanie przez 2-3
minuty),
• Sensible (Oral B) – zawiera hydroksyapatyt,
• Multident E – 5,3% cytrynian trójpotasowy i 0,8% monofluorofosforan sodu,
• Sensodyne (Glaxo Smith Kline) – 3,75% chlorek potasu, 5% azotan potasu i 10% chlorek
strontu
- Sensodyne F, z 1400 ppm F Sensodyne Total Care 1450 ppm F

Rozdział 11
128
- Sensodyne Classic, zawiera 10% chlorek strontu
• Perio – 7% chlorek strontu i hydroksyapatyt
• zestaw Sensi-Kin (Laboratories Kin S.A.)
- pasta do zębów, płukanka i żel
pasta i płukanka zawiera: sole potasu, fluorek sodu o zawartości 1450 ppm F, witaminę E,
prowitaminę B5;
- żel o zawartości 1000 ppm F
• Elmex Sensitive Plus (Gaba) – zawiera organiczne związki fluoru w ilości 1000 ppm F
• Colgate Sensitive Multi Protection (Colgate – Palmolive) zawiera 5,5% cytrynian potasu,
cytrynian cynku i 1450 ppm F (MFP)
• Colgate Maximum Strength Sensitive Plus Whitening – cytrynian K i Zn oraz MFP
W metodach fizykochemicznych zasadą działania jest wprowadzenie środków chemicznych
do kanalików zębinowych z wykorzystaniem prądu elektrycznego metodą kataforezy lub
elektroforezy opartej na zasadzie elektroosmozy. Stosuje się także środki znieczulające
w postaci mieszaniny nowokainy, pantokainy i glikolu propylenowego jako rozpuszczalnika.
W metodzie jonoforezy wykorzystuje się nieorganiczne związki fluoru np. 1-2% NaF i prąd
stały o natężeniu 1-5 mA. Związki fluoru dostarczane na tej drodze wnikają głębiej i trudniej
ulegają wypłukaniu niż aplikowane w sposób klasyczny.
Podsumowanie
Pomimo szerokiej oferty środków mogących mieć zastosowanie w leczeniu nadwrażliwości
zębiny i potwierdzonej efektywności wielu z nich, idealnego jeszcze nie ma. Właściwe
przeprowadzenie zabiegu w gabinecie stomatologicznym i kontynuowana w domu terapia
pozwala osiągnąć znaczącą poprawę w większości przypadków klinicznych.

129
12
Piśmiennictwo
1.
Abrams R., Drake C., Segal K.: Dr. Sanford C. Barnum and the invention of the rubber dam.
Gen Dent 1982, 30, 320-322.
2.
Addy M., Mostafa P., Newcombe R.: Dentin hypersensitivity the distribution of recession,
sensitivity and plaque. J. Dent., 1987, 15, 242-248.
3.
Ash MM.: Quantification of stimuli. Endodod. Dent. Traumatol.,1986, 2, 153-156.
4.
Ahmad I.: Problemy estetyczne spowodowane starciem zębów. Etiologia, diagnostyka,
postępowanie i odbudowa. Quintessence dla lekarzy stomatologów, 2007, XV, 3, 145-160.
5.
Barwińska-Płużyńska J., Kochańska B.: Ocena występowania ubytków niepróchnicowego
pochodzenia u osób w wieku 55-81 lat – badania wstępne. Czas. Stomat., 2007, LX, 6,
357-366.
6.
Bratthall D.: Dental caries: intervened-interrupted-interpreted. Concluding remarks and
cariography. Europ. J. Oral Science, 1996, 104, 4/2, 486-491.
7.
Chłapowska J., Żmijewska C.: Diagnostyka próchnicy powierzchni stycznych w badaniu
klinicznym, transiluminacyjnym i radiologicznym. Stomat. Współcz., 1999, 6, 4, 32-35.
8.
Cieszyński A.: Badania nad statystyczna budową czaszki ze szczególnym uwzględnieniem
aparatu żucia. Polska Stomatologia, 11, Lwów.
9.
Clark GE., Troullos ES.: Designing hypersensitivity clinical studies. Dent.Clin.North Am.,
1990, 34, 531-544.
10.
Combe EC.: Wstęp do materiałoznawstwa stomatologicznego. Wydawnictwo Medyczne
SANMEDICA, Warszawa 1997.
11.
Craig RG., Powers JM., Wataha JC.: Materiały stomatologiczne (wyd. polskie pod red. H.
Limanowskiej-Shaw). Wydawnictwo Medyczne Urban&Partner, Wrocław 2000.
12.
Dayton RE., De Marco TJ., Swerdlow D.: Treatment of hypersensitive root surfaces with
dentinal adhesive materials. J. Perio., 1974, 45, 873-878.
13.
van Dijken J. i wsp.:Longevity of extensive class open-sandwich restorations with a resin-
modified glass-ionomer cement. J. Dent. Res., 1999, 78, 7, 1319-1325.
14.
Dybiżbańska E. i wsp.: Clinpro Cario L-Pop – nowy test do oceny ryzyka próchnicy. Stomat.
Współcz., 2003, 10, 5, 55-58.
15.
Eakle WS.: Early Detection of Dental Caries. 3rd edi., editor Stookey G.K. Indiana University 1996.
16.
Ekstrand KR., Ricketts DN., Kidd EA., Qvist U., Schon S.: Detection, diagnosing, monitoring
and logical treatment of occlusal caries in relation to lesion activity and severity: an in vivo
examination with histological validation. Caries Res., 1998, 32, 247-254.
17.
Elderton RJ., Jenkins CBG., Marshall KJ., Hooper SM., Foster LU., Hooper GR., Roberts K.:
Changing perceptions of the requirements of cavity preparations. Br. Dent. J., 1990, 168, 30-32.
18.
Elderton RJ.: Overtreatment with restorative dentistry: when intervence? J. Dent. 1993, 43,
17-24.

130
19.
Mc Fall WT., Morgan WC.: Effectiveness of a dentifrice containing formalin and sodium
monofluorophosphate on dental hypersensitivity. J. Periodontol., 1985, 56, 288-292.
20.
Fejerskov O. i Manji F.: Risk assessment in dental caries in Bader JD ed: Risk Assessment in
Dentistry Chapel Hill University of North Carolina Dental Ecology. 1990, 214-217.
21.
Fejerskov O.: Changing paradigms in concepts on dental caries: Consequences for oral
health care. Caries Res., 2004, 38, 182-191.
22.
Fitzgerald GA.: Clinical evaluation of a new agent for the relief of hypersensitive dentin.
Dent. Dig., 1956, 62, 494-497.
23.
Gajdzik-Plutecka D., Wal A.: Wstępne doniesienia z obserwacji adaptacji brzeżnej wypełnień
kompozytowych na podstawie badań klinicznych i mikroskopowych. Stomat. Współczesna,
1997, 4, 107-110.
24.
Gończowski K., Krupiński J.: Adaptacja brzeżna wypełnień wykonanych metoda kanapki
konwencjonalnej oraz uproszczonej z zastosowaniem glassionomerowego systemu
łączącego Fuji Bond LC(GC) badania laboratoryjne. Stomat. Współczesna. 2003, sup 2,
13-19.
25.
Greene JC., Vermillion JR.: The oral hygiene index: a metod for classifying oral hygiene
status. J. Am. Dent. Ass., 1960, 61, 172-179.
26.
Grosfeldowa O.: Fizjologia narządu żucia. PZWL, Warszawa 1981.
27.
27. Hals E. i wsp.: Histopathology of natural caries around silver amalgam fillings. Caries
Res., 1974, 8, 343-347.
28.
Heithersay GS.: Invasive cervical resorption. Endodontic Topics 2004, 7, 73-92.
29.
Hibst R.: Optische Messmenthoden zur Kariesdiagnose. ZWR 1999, 108, 50-55.
30.
Hill FJ., Halaseh FJ.: A laboratory investigation of tunnel restorations in premolar teeth.
Br.Dent. J., 1988, 165, 364-367.
31.
Hoffmann-Axthelm W.: History of Dentistry. Quintessence Pub Co St. Luis 1981.
32.
Hunt PR.: A modified class II cavity preparation for glass ionomer restorative materials.
Quintessence Int., 1984, 10, 1011-1018.
33.
Infeld T.: Dental erosion. Definition,classification and links. Eur. J. Oral Scien., 1996, 104,
151-155.
34.
Ingle JI., Bakland LK.: Endodontics 5th ed. BC Decker Inc Hamilton, London 2002.
35.
Jodkowska E.: Materiały złożone i pośrednie systemy wiążące w odtwarzaniu ubytków
w zębach bocznych. Med. Tour Press Inter., Wydawnictwo Medyczne Warszawa 1993.
36.
Kaczmarek U., Łoś P., Pitts NB.: Charakterystyka właściwości przewodnictwa elektrycznego
powierzchni zębowych metoda spektroskopii impedancyjnej – badania wstępne. Czas.
Stomat., 2001, LIV, 9, 359-363.
37.
Keele KD.: The pain chart. Lancet.,1948, 11, 6-8.
38.
Kleinberg J., Kaufamn HW&Wolff M.: Metods of measuring tooth hypersensitivity and
factors involved in its development. Arch.of Oral Biology 1994, 39, 63, S-71S.
39.
Krejci J., Besek M., Lutz F.: Ocena kliniczna i SEM wypełnień ubytków w zębach trzonowych
i przedtrzonowych wykonanych z materiału złożonego Tetric. Stomat. Współcz., 1994, 3,

131
200-205.
40.
Knight GM.: The tunnel restoration – nine years of clinical experience using capsulated glass
ionomer cement. Aust. Dent. J., 1992, 37, 245-249.
41.
Knight GM.: The tunnel restoration. Aesthetics., 1989, 1, 13-14.
42.
Knychalska-Karwan Z.: Stomatologia Zachowawcza Wieku Rozwojowego. CMUJ Kraków,
1992.
43.
Knychalska-Karwan Z.: Stomatologia Geriatryczna.CMUJ, Kraków, 1995.
44.
Knychalska-Karwan Z.: Podstawy chorób przyzębia i błony śluzowej jamy ustnej. CMUJ,
Kraków, 1996.
45.
Knychalska-Karwan Z.: Zbiór wskaźników stomatologicznych i niektórych testów oraz
klasyfikacji. Wydawnictwo Czelej, Lublin, wyd. I, 2006.
46.
Limanowska-Shaw H.: Zastosowanie barwnych wskaźników w leczeniu próchnicy zębów.
Stomat. Współcz., 1995, 2, 3, 216-218.
47.
Longbottom C., Pitts NB., Lussi A., Reich E.: Histological validation of in vivo measurements
using DIAGNOdent Device: A three center study. Caries Res., 1999, 33, 300-305.
48.
Longbottom C., Huysmans MCDNJ., Pitts NB., Los P., Bruce PG.: Detection of dental decay
and its extent using AC Impedance spectroscopy. Nature Medicine, 1996, 2, 235-240.
49.
Lutins ND., Greco GW., McFall WT.: Effectiveness of sodium fluoride on tooth
hypersensitivity with and without ionophoresis. J. Periodontol., 1984, 55, 285-288.
50.
Lutz F i wsp.: In vivo and in vitro. Wear of potential posterior composites. J. Dent. Res., 1984,
63, (6), 914-920.
51.
Lussi A., Francescut P., Schaffner M.: Nowe i tradycyjne metody diagnozowania próchnicy
szczelinowej. Quintessence dla lekarzy stomatologów, 2003, 6, 347-355.
52.
Lussi A i wsp.: The role of diet in the etiology of dental erosion. Caries Res., 2004, 38,
34-44.
53.
Marini I i wsp.: Intraoral fluoride releasing device: a new clinical therapy for dentine
sensitivity. J.Periodontal., 2000, 71, 90-95.
54.
Meechan JG.: Znieczulenia miejscowe. Wydawnictwo Kwintesencja, Warszawa, 2003.
55.
Melzach E.: The Mc Gill Pain Quiestionnaire: major properties and scoring methods. Pain
1., 1975, 277-299.
56.
Minikoff S., Axelrod S.: Efficiacy of strontium chloride in dental hypersensitivity. J.
Periodontal., 1987, 58, 470-474.
57.
Mitropoulos CM.: A comparison of fiber optic transillumination with bitewing radiographs.
Br. Dent. J., 1985, 159, 21-23.
58.
Mlosek K.: Radiologia stomatologiczna i szczękowotwarzowa. Meddenmpress, Warszawa,
1995.
59.
Mordan NJ., Barber PM., Gillam DG.: The dentin disc: A review of its applicability as
a model for the in vitro testing of dentine hypersensitivity. J Oral Rehabil. 1997, 24,
148-156.
60.
Mount GJ., Hume WR.: A revised classification of carious lesions by site and size. Quintessence

132
Int., 1997, 28, 5, 301-303.
61.
Noack MJ., Haak R., Wicht MJ.: Próchnica wtórna zapobieganie i leczenie. Quintessence
2005, XIII, 1, 28-35.
62.
Orchardson R., Collins WJN.: Clinical features of hypersensitive teeth. Br. Dent. J., 1987,
162, 253-256.
63.
Papa J., Wilson PR., Tyas MJ.: Tunnel restorations a review. J. Esthetic D., 1992, 4,4-9.
64.
Pashley DH.: Clinical considerations of microleakage. J. Endodont., 1990, 16, 70-73.
65.
Perry RD., Kugel G.: Dwuletnia ocena kliniczna materiału wypełniającego Sure Fil. Dentsply
Raport 2002, 11, 1-4.
66.
Petersson GH., Bratthall D.: Caries risk assessment: a comparison between the computer
program “Cariogram” dental higienists and dentists. Swed. Dent. J., 2000, 24(4), 129-137.
67.
Peterson LJ., Ellis IIIE., Hupp JR., Tucker MR.: Chirurgia stomatologiczna i szczękowo-
twarzowa. Wydawnictwo Czelej, Lublin, 2001, 144-147.
68.
Piątowska D.: Zarys kariologii. Med Tour Press International, Warszawa, 2002.
69.
Polson AM., Caton JG., Yeaple RN., Lander HA.: Histological determination of probe tip
penetration into gingival sulcus of human using an electronic pressure sensitive probe. J.
Clin.Periodontol., 1980, 7, 479-488.
70.
Postek-Stefańska L., Skowronek A., Korzonek-Szlacheta J.: Testy ślinowe a ryzyko próchnicy.
Twój Przegląd Stomat., 2006, 10, 53-57.
71.
Purdell-Lewias DJ., Pot A.: A comparison of radiographic and fiber optic diagnoses of
approximal caries lesions. J. Dent.,1974, 2, 143-148.
72.
Pużyński M., Stachura-Pużyńska A.: Bezdotykowa diagnostyka z wykorzystaniem metody
LIF. As Stomat., 2005, 5, 6-10.
73.
Raczyńska M.: Wpływ techniki preparacji ubytków próchnicowych na uzyskaną powierzchnię
zębiny, szczelność brzeżną wypełnień i wytrzymałość na ścinanie sił wiązania twardych
tkanek zęba z materiałami wypełnieniowymi. Rozprawa doktorska, Warszawa 2004.
74.
Radwan-Oczko M.: Erozje zębów etiologia, diagnostyka, zapobieganie i leczenie. Poradnik
Stomat., 7-8, 213-220.
75.
Raport American Dental Association. J. Am. Dent. Ass., 1986, 112, 707-712.
76.
Roulet JE.: A materials scientists view: assessment of wear and marginal integrity.
Quintessence Int., 1987, 18, 8-12.
77.
Roulet JF.: Benefits and disadvantages of tooth – coloured alternatives to amalgan. J. Dent.,
1997, 25, 6, 459-473.
78.
Rusyan E., Dubielecka M., Słotwińska S., Jodkowska E.: Ocena przydatności indykatora
próchnicy w pracy klinicznej studentów III roku stomatologii. Nowa Stomat., 2005, 33, 3,
118-120.
79.
Ryge G., Snyder H.: Evaluating the clinical quality of restorations. J. Am.Dent. Assoc., 1973,
7, 369-371.
80.
Ryge G.: Clinical criteria. Int.Dent.J., 1980, 30, 347-350.
81.
Simonsen RJ.: Preventive resin restorations. Quintessence Int., 1978, 9, 69-76.

133
82.
Schiff T., Zhang YP., De Vizio W., Stewart B., Chaknis P., Petrone ME., Volpe AR., Proskin
HM.: A randomized clinical trial of the desensitizing efficacy of three dentifrices. Compend
Contin Educ. Dent. Suppl., 2000 (27), 286.
83.
Shi XQ,. Welander V., Angmar-Mansson B.: Occlusal caries detection with KaVo
DIAGNOdent and radiographic examination: An in vitro comparison. Caries Res., 1999,
33, 297-301.
84.
Shi XQ., Tranaens S., Angmar-Manson B.: Validation of DIAGNOdent for quantification of
smooth-surface: an in vitro study. Acta Odontol., Scand., 2001, 592, 74-78.
85.
Sidi AD., Naylor HN.: A comparison of bitewing radiography and interdental
transillumination as adjuncts to the clinical identification of approximal caries in posterior
teeth. Bri. Dent. J., 1998, 164, 15-19.
86.
Stark MM., Kempler D., Pelzner RB., Rosenfeld J., Leung RL., Mintatos S.: Rationalization of
electric pulp-testing metods. Oral Surg. Oral Med Oral Pathol., 1977, 43, 598-606.
87.
Stephen KW et al.: A clinical, radiographic and fiber optic transillumination caries study.
Dent. Res., 1986, 65, 44-49.
88.
Stopa J.,Matthews-Brzozowska T.: Ocena ultrastrukturalna połączenia wypełnień różnych
materiałów kompozycyjnych z tkankami zęba. Czas. Stomat., 1995, XLVIII, 10, 637-643.
89.
Wagner L.: Hybrydy drobnocząsteczkowe-skład, struktura, właściwości i wymagania.
Stomat. Współcz., 1994, 1, 32-35.
90.
Waszkiel D.: Badania nad możliwością poprawy niektórych właściwości fizycznych
amalgamatu Stabil B. Praca doktorska AM w Białymstoku, Białystok, 1983.
91.
Zigmond AS., Snaith RP.: The hospital anxiety and depression scale. Acta Psycholog
Scand.,1983, 67, 361-370.

134

135

136
Wyszukiwarka
Podobne podstrony:
Temat 1 Wprowadzenie do nauki o zachowaniach organizacyjnych
Psychologia ogólna - Wprowadzenie do psychologii - Mackiewicz - wykład 24, Psychologia zachowań kons
02 Zachowania dzialania dzialania spoleczne, studia, wprowadzenie do socjologii
Psychologia społeczna Wprowadzenie do psychologii społecznej Kwiatkowska wykład 16 Zachowania pr
Psychologia społeczna Wprowadzenie do psychologii społecznej Kwiatkowska wykład 7 Ja w zachowani
Wykład 1 inżynierskie Wprowadzenie do zarządzania operacyjnego
Wprowadzenie do medycyny rozwojowej 1
PD W1 Wprowadzenie do PD(2010 10 02) 1 1
Wprowadzenie do psychologii
Wprowadzenie do filozofii
(1) Wprowadzenie do nauki o finansach 1id 778 ppt
wprowadzenie do systemu win i podst sieci
wprowadzenie do psychologii społecznej
Wprowadzenie do cw1A
1 Wprowadzenie do psychologii pracy (14)id 10045 ppt
więcej podobnych podstron