Iloczyn rozpuszczalności (Kir)
AB(s) = A+ + B-
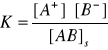
Gdy T = consts, K consts, [AB]s = consts
![]()
consts = Kir
Dla AaBb
Kir = f(R)
Zad.1
W 300 cm3nasyconego roztworu PbI2 znajduje się 81 mg jonów Pb2+.
Oblicz Kir.
Rozwiązanie:
PbI2 = Pb2+ + 2 I-
x x 2x
![]()
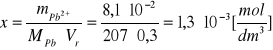
![]()
R = f(Kir)
Zad.2
Iloczyn rozpuszczalności Ag2CrO4, Kir=4·10-12. Oblicz ile jonów Ag+ znajduje się w 100 cm3 nasyconego roztworu tej soli.
Rozwiązanie:
Ag2CrO4 = 2 Ag+ + CrO42-
x 2x x
![]()
![]()
[Ag+] = 2x = 2·10-4 => ![]()
pH = f(Kir)
Zad.3
Oblicz pH nasyconego roztworu wodorotlenku magnezu. Iloczyn rozpuszczalności Mg(OH)2,, Kir=3,4·10-11.
Rozwiązanie:
Mg(OH)2 = Mg2+ + 2 OH-
x x 2x
![]()

![]()
![]()
pH = - log 2,45∙10-11
pH = 10,61
Efekt wspólnego jonu
AaBb (s) = a·A+ + b·B-
Zad.4
Ile razy zmniejszy się stężenie jonów Ag+ w nasyconym roztworze chlorku srebra, po dodaniu do tego roztworu takiej ilości HCl, że stężenie jonów chlorkowych w tym roztworze osiągnie wartość, [Cl]- = 3·10-2.
Iloczyn rozpuszczalności AgCl,, Kir=1,24·10-10.
Rozwiązanie:
AgCl = Ag+ + Cl-
W nasyconym roztworze AgCl:
![]()
Po dodaniu HCl: ![]()
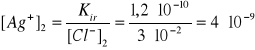
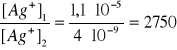
Efekt wysalania (obcego jonu)
Teoria mocnych elektrolitów
Co to są roztwory izotoniczne?
Zad.5
Jakie powinno być stężenie Al2(SO4)3 (c1), aby roztwór tej soli był izotoniczny z roztworem KCl o stężeniu c2?
![]()
![]()
![]()
Efekt relaksacyjny
Efekt elektroforetyczny
Katoda (-) (+) Anoda
Aktywność jonów (a)
Współczynnik aktywności (f)
Efekt wysalania (obcego jonu)
AB(s) = A+ + B-
Gdy T = consts, Kir = consts
Gdy I ![]()
Rozcieńczanie roztworów buforowych - ΔpH
Dla buforu kwasowego:
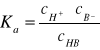
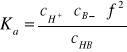
![]()
![]()
Typy zadań na iloczyn rozpuszczalności:
Kir = f(R)
R = f(Kir)
pH = f(Kir)
Efekt wspólnego jonu
Efekt wysalania (obcego jonu)
Rozpuszczalność (R)
![]()
Miano (T)
![]()
![]()
Rozpuszczalność (R)
![]()
![]()
pH = -log[H+]
![]()
![]()
Moc jonowa roztworu (I)
Efekt relaksacyjny
Efekt elektroforetyczny
Aktywność jonów (a)
Współczynnik aktywności (f)
![]()
![]()
+
-
-
-
-
-
-
-
-
-
-
+
![]()
![]()
![]()
![]()
![]()
consts
pH = -log[H+]
![]()
Gdy c => ![]()
=> ![]()
=> pH
Wyszukiwarka
Podobne podstrony:
iloczyn rozpuszczalności
Iloczyn rozpuszczalnosci roztwo Nieznany
iloczyn rozpuszczalności, STUDIA (ochrona), ROK I, chemia, laboratoria
Iloczyn rozpuszczalności
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
Iloczyn rozpuszczalnoÂci, Studia II rok, Studia, PD materialy donauki, PD materialy donauki
iloczyn rozpuszczalnosci id 210 Nieznany
iloczyn rozpuszczalności
Hydroliza soli iloczyn rozpuszczalności
Iloczyn rozpuszczalnosci (Kso) Nieznany
Iloczyn rozpuszczalności(1), Chemia, Chemia nieorganiczna
Iloczyn rozpuszczalnosci -zadania kl.I WORD2003, szkoła, chemia
Z Rownowagi dys słabe hydroliza iloczyn rozpuszczalnosci
Laboratorium 9 Iloczyn rozpuszczalności, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganic
iloczyn rozpuszczalnosci, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
iloczyn rozpuszcalnosci, chemia fizyczna, Nowy folder, zalaczniki
W10s-rownowagi heterogeniczne-Iloczyn rozpuszczalnosci, chemia, szkolka
Iloczyn rozpuszczalności
Iloczyn rozpuszczalności, CHEMIA, semestr 1, chemia ogólna, wykłady
więcej podobnych podstron