REDOKSYMETRIA
Reakcja redukcji - reakcja przyłączenia elektronów: Ox1+n1e→Red1
Reakcja utleniania - reakcja odłączenia elektronów: Red2→Ox2+n2e
Ogólne równanie reakcji redox: n2Ox1+=n2Red1+n1Ox2
Układ redox - układ zawierający 2 jony, w których ten sam pierwiastek ma różne stopnie utlenienia
Sprzężona para redox- układ redoks, w którym postać utleniona jest związana z postacią zredukowaną tylko wymiana elektronów. (np. Fe3+/Fe2+, Sn4+/Sn2+).
Potencjał redox - potencjał elektrodowy. Charakteryzuje powinowactwo postaci utlenionej układu do elektronów. Im wyższy potencjał tym silniejszym utleniaczem jest dany układ.
Potencjał normalny - potencjał w warunkach normalnych. Gdy E° > 0 postać utleniona ma silniejsze właściwości utleniające niż jony wodorowe lub postać zredukowana wywiera słabsze działanie redukujące niż wodór elementarny (reakcja przebiega w prawo).
Potencjał Formalny - potencjał układu redoks w przypadku, gdy analityczne stężenia postaci zredukowanej i utlenionej sa równe. Jest charakterystyczny dla danej reakcji w określonym środowisku (pH, c).
Zmiany potencjału podczas miareczkowania
Zmiany potencjału redoks w trakcie miareczkowania zależą od zmian stosunku stężeń postaci utlenionej i zredukowanej co jest konsekwencją wzoru Nernsta. Rozcieńczenie roztworu w czasie miareczkowania nie ma wpływu na kształt krzywej miareczkowania.
W PR stosunek stężeń postaci utlenionej do zredukowanej reduktora musi być równy stosunkowi stężeń postaci zredukowanej do utlenionej utleniacza
Wskaźniki redox
Substancje barwne, które tworzą układy redoks, przy czym postać utleniona wskaźnika jest inaczej zabarwiona niż postać zredukowana. Każdy z takich układów ma właściwy potencjał normalny. Poniżej jego wartości przeważa barwa formy zredukowanej, powyżej zabarwienie formy utlenionej. Wskaźnik dobiera się tak, aby zmiana jego barwy następowała przy potencjale odpowiadającym potencjałowi PR miareczkowania.
Manganometria
Dział w którym oznaczanie substancji prowadzi się za pomocą miareczkowania roztworem nadmanganianu potasu. Przebieg redukcji nadmanganianu zależy od pH środowiska
W roztworze kwaśnym:
W roztworze lekko kwaśnym lub obojętnym:
W roztworze zasadowym :
Sporządzanie i mianowanie roztworów KMnO4
Nadmanganianu potasu jest zanieczyszczony MnO2, a roztwory KMnO4 zmieniają miano. Nadmanganian ulega rozkładowi. Dlatego należy usunąć tlenek i substancje organiczne, gotując KMnO4 przez 30-60 min, w celu przyspieszenia redukcji. Roztwór sączy się by oddzielić wydzielony tlenek.
Do mianowania oczyszczonego nadmanganianu stosuje się szczawian sodu.
2MnO4-+5C2O42-+16H+→2Mn2++10CO2+8H2O
Reakcja przebiega wolno, prowadzi się ja w 80°C, ale jony Mn2+ przyśpieszają proces, więc potem przyspiesza. Analit otrzymuje się przez rozpuszczenie Na2C2O4 w wodzie destylowanej i dodanie H2SO4 oraz ogrzewanie do 70°C. Miareczkuje się, aż do uzyskania trwałego, różowego zabarwienia.
Oznaczanie manganometryczne żelaza
-wskaźnik KMnO4, MnO4-
- redukcja żelaza z Fe+3 do Fe+2 za pomocą chlorku cyny (II), do odbarwienia roztworu.
2FeCl3 + SnCl2 = 2FeCl2 + SnCl4
- dodajemy nadmiar cyny (II). W celu usunięcia tego nadmiaru dodaje się roztworu chlorku rtęci (II)
SnCl2 + 2HgCl2 = SnCl4 + Hg2Cl2 (trudno rozpuszczalny kalomel)
- do mieszaniny Zimmermanna (MnSO4, H3PO4, H2SO4) dodajemy kilka kropli KMnO4 do słabo różowego zabarwienia
- dodajemy roztworu z zawiesiną Hg2Cl2
- miareczkujemy roztworem KMnO4 do blado różowej barwy
MnO4-+5Fe+2+8H2O=Mn+2+5Fe+3+4H2O
- ilość oznaczonego żelaza obliczamy ze wzoru x=Vc(KMnO4)*MFe g/mmol*5
.
Oznaczanie chromianometryczne żelaza
-wskaźnik K2Cr2O7
- redukcja żelaza z Fe+3 do Fe+2 za pomocą chlorku cyny (II), do odbarwienia roztworu.
2FeCl3 + SnCl2 = 2FeCl2 + SnCl4
- dodajemy nadmiar cyny (II). W celu usunięcia tego nadmiaru dodaje się roztworu chlorku rtęci (II)
SnCl2 + 2HgCl2 = SnCl4 + Hg2Cl2 (trudno rozpuszczalny kalomel)
-do miareczkowanego roztworu dodajemy kwasu fosforowego aby związać w kompleks powstające w czasie miareczkowania żelazo (III)
-miareczkujemy roztwór dwuchromianem potasu do zmiany barwy z zielonego na fioletowy
Cr2O7-2+6Fe+2+14H+=2Cr+3+6Fe+3+7H2O
KOMPLEKSOMETRIA
stala trwałości - stala rownowagi tworzenia zwiazku kompleksowego wyrazajaca się stosunkiem stezenia kompleksu do iloczynu stezen jonow tworzacych dany kompleks w stanie rownowagi
stala nietrwalosci - stala rownowagi reakcji przeciwnej czyli reakcji dysocjacji kompleksu:
kompleksy trwale posiadaja duza wartosc stalej trwalosci (powyzej 10^7) oraz mala wartosc stalej nietrwalosci
stala trwalosci warunkowa - stala trwalosci w okreslonych warunkach doswiadczalnych (np. stezenia, pH), wyraza się wzorem ![]()
, gdzie [M`] - stezenie jonu metalu obecnego w roztworze we wszystkich postaciach z wyjątkiem kompleksu MLn, [L`] - stezenie ligandu we wszystkich postaciach z wyjątkiem kompleksu MLn.
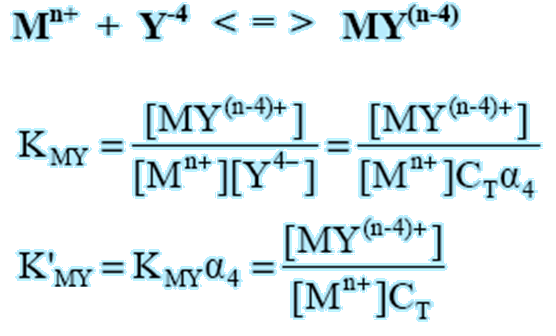
EDTA reaguje z jonami metali w stosunku 1:1
trwalosc kompleksow EDTA zalezy od stopnia utlenienia kationu, im wiekszy stopien utlenienia tym trwalszy kompleks
trwalosc kompleksow EDTA zalezy także od pH roztworu, zmniejszanie się pH powoduje zmniejszanie trwalosci kompleksu
wskazniki kompleksometryczne dzielimy na wskazniki redoks i twz. Metalowskazniki
Metalowskaźniki - wskaźniki powszechnie stosowane w kompleksometrii. Na ogół są to organiczne związki, barwne lub bezbarwne, które tworzą barwne kompleksy z jonami metalu oznaczanego. Kompleks metalu ze wskaźnikiem musi być mniej trwały niż metalu z EDTA. Czerwień eriochromowa T jest typowym metalowskaźnikiem. Jest jednocześnie słabym kwasem i jej barwa zależy od pH. Należy miareczkować przy pH > od 7 aby barwa niebieska przeważała przy PR.
Inne wskaźniki to; kwas salicylowy, tiocyjanian amonu, jodek potasu, tiomocznik, H2C2O4,
Typy miareczkowań
Bezpośrednie - polega na stopniowym dodaniu mianowanego roztworu EDTA do roztworu o odpowiednim pH, zawierającego oznaczany kation i wskaźnik (Mg, Ca, Zn, Cd, Cu (II), Ni, Pb, Sr, Ba, Mn, Al., Fe, Ce, Bi, Zr, Sc, Ga, In, Hg, Tl).
Odwrotne - polega na dodaniu do roztworu zawierającego dany kation nadmiaru mianowanego roztworu EDTA, który następnie jest odmiareczkowywany mianowanym roztworem MgSO4 lub ZnSO4. Następują zmiany barwy odwrotnie niż w miareczkowaniu bezpośrednim, tzn. najpierw roztwór ma zabarwienie wolnego wskaźnika, a potem zabarwienie kompleksu z kationem, którego roztworem miareczkuje się. Metodę stosuje się, gdy trwałość kompleksu kationu użytego do odmiareczkowania jest mniejsza niż trwałość kompleksów metali oznaczanych. (Mn, Pb, Al, Hg, Tl, Co, Ni, nawet w postaci osadów)
Podstawieniowe - polega na miareczkowaniu kationu wypartego z kompleksu. Wiele kationów tworzy z EDTA kompleksy bardziej trwałe niż kompleksy magnezu i cynku. Jeżeli do takiego roztworu doda się wersenianu magnezu lub cynku, to zachodzi reakcja wypierania:
M2++MgY2-→MY2-+Mg2+
Oznaczanie żelaza - wobec kwasu salicylowego (fioletowyàżółty) jako wskaźnika za pomocą EDTA.
Oznaczanie niklu - wobec mureksydu (żółtaàróżowofioletowa) jako wskaźnika za pomocą wersenianu.
Oznaczanie wapnia- wobec mureksydu za pomocą EDTA.
Oznaczanie twardości wody - wobec czerni eriochromowej. W wodzie musi być obecny magnez, bo kompleks czerni z wapniem jest nietrwały. Kompleks wapnia z EDTA jest trwalszy niż kompleks magnezu. Wynik podaje się w stopniach niemieckich: 1°d=10 mg CaO w 1l wody
Wyszukiwarka
Podobne podstrony:
Reakcje redoks doc
pierwiastki ph redoks
Redoksometria, Technologia chemiczna pw, 2 rok, anality
REDOKS, Szkoła (Metalurgia POLŚL), I Rok, Chemia
4 nadtlenek wodoru redoks
Wstep Redoksy Hydroliza
notatki redoksymetria
REDOKSOMETRIA 2
badanie właściwości redoks kompleksów Fe, chemia nieorganiczna, laboratorium, Chemia nieorganiczna
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
laborki, REDOKSYMETRIA
Wykłady, Wykład 7, Reakcje redoks polegają na wymianie elektronu między czynnikiem redukującym (redu
egz, e (1), REDOKSYMETRIA
Równiaa typu redoks
zadania powtrkowe- procesy redoks elektrochemia, Chemia, Materiały do korepetycji w liceum - p. rozs
Redoks
2zadania ze stechiometrii redoksymetria
więcej podobnych podstron