1) Jedynie część spośród 90 naturalnych pierwiastków – składników Ziemi, występuje w żywych organizmach
* z 60 pierwiastków, których obecność stwierdza się w materiale biologicznym, 20 występuje w prawie każdym organizmie
* pierwiastki biogenne – 6 pierwiastków stanowiących podstawę do budowy związków organicznych wszystkich istot żywych
- węgiel, wodór, tlen, azot, fosfor, siarka
* skład pierwiastkowy istot żywych nie jest wiernym odbiciem składu chemicznego ich środowiska, wskazuje natomiast na zdolność
akumulowania pierwiastków, które stosunkowo rzadko występują w otoczeniu (z wyjątkiem tlenu)
2) Występuje duże podobieństwo składu pierwiastkowego płynów zawartych w ciele bezkręgowców, ryb morskich i innych zwierząt do
wody oceanicznej
* potwierdza to powszechną hipotezę, że istoty żywe powstały w morzach oraz że wszystkie organizmy są spokrewnione
3) Podział pierwiastków ze względu na ich stężenie w organizmie
* makroelementy
- stanowią łącznie około 99% masy organizmu (każdy co najmniej 0,01% suchej masy organizmu, sucha masa – masa wszystkich
składników komórki, tkanki czy organizmu, oprócz wody, jest lepszym wskaźnikiem od masy całkowitej, gdyż zawartość wody w żywych
układach jest zmienna)
- Węgiel, Wodór, Tlen, Azot, Siarka, Fosfor, Wapń, Magnez, Sód, Potas, Chlor
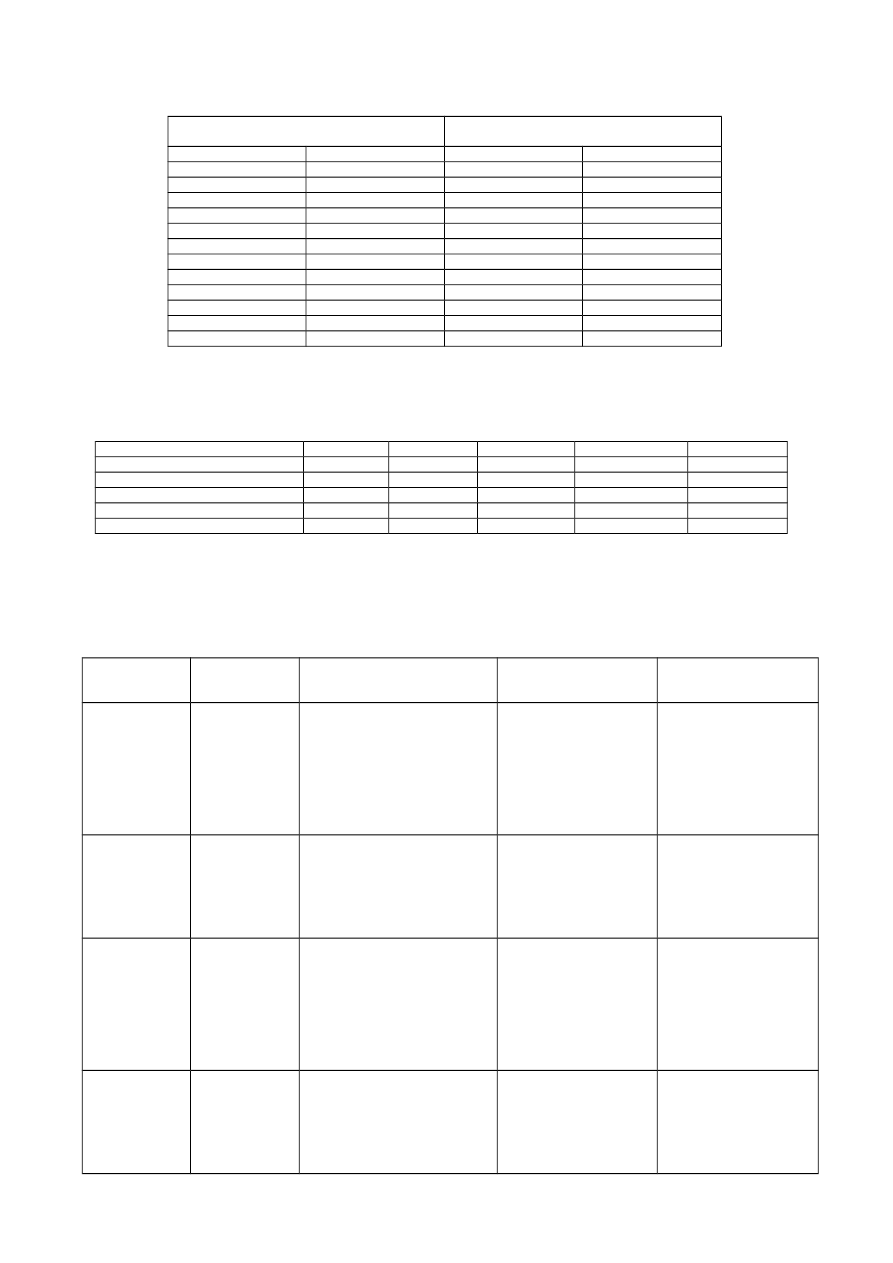
Występowanie pierwiastków w skorupie
ziemskiej
Występowanie pierwiastków w żywych
organizmach
Pierwiastek
% wagowo
Pierwiastek
% wagowo
Tlen (O)
49,50
Tlen (O)
65
Krzem (Si)
25,50
Węgiel (C)
18
Glin (Al)
7,50
Wodór (H)
10
Żelazo (Fe)
5,08
Azot (N)
3
Wapń (Ca)
3,39
Wapń (Ca)
2
Sód (Na)
2,63
Fosfor (P)
1
Wodór (H)
0,87
Potas (K)
0,9
Tytan (Ti)
0,63
Siarka (S)
0,9
Chlor (Cl)
0,19
Chlor (Cl)
0,9
Fosfor (P)
0,12
Sód (Na)
0,9
Magnez (Mg)
0,9
Żelazo (Fe)
0,9
Ciecz
Sód (Na)
Potas (K)
Wapń (Ca)
Magnez (Mg)
Chlor (Cl)
Woda oceaniczna
100
3,6
3,9
12,1
181
Morskie bezkręgowce
100
5,6
4,1
11,2
187
Ryby chrzęstnoszkieletowe
100
4,6
2,7
2,5
166
Ryby kostnoszkieletowe
100
9,5
3,9
1,4
150
Osocze krwi człowieka
100
6,7
3,1
0,7
129
Pierwiastek
Forma
występowania
Niektóre funkcje biologiczne
Przykładowe objawy
niedoboru u zwierząt i
człowieka
Przykładowe objawy
niedoboru
u roślin
Wapń (Ca)
Ca
2+
* szkieletotwórczy (kości,
muszle, pancerzyki)
* obniża stopień uwodnienia
koloidów komórkowych
* reguluje funkcje błon
komórkowych
* składnik płynów
ustrojowych
* czynnik krzepnięcia krwi
* krzywica
* łamliwość kości
* choroby zębów
* zaburzenia w
procesie krzepnięcia
krwi
* tężyczka (drgawki i
silne skurcze mięśni
szkieletowych)
* rozkład błon
plazmatycznych
* nieprawidłowy wzrost
i martwica organów
roślinnych
Magnez (Mg)
Mg
2+
* składnik kości
* obniża stopień uwodnienia
koloidów komórkowych
* składnik chlorofilu
* utrzymuje właściwą
strukturę rybosomów
* aktywator wielu enzymów
* zwiększenie
pobudliwości nerwowo-
mięśniowej
* osłabienie
* nieprawidłowość
pracy serca
* więdnięcie
* chloroza liści
(wynikająca z braku
chlorofilu)
* zahamowanie
fotosyntezy
Sód (Na)
Na
+
* bierze udział w
przewodzeniu impulsów
nerwowych
* podwyższa stopień
uwodnienia koloidów
komórkowych
* wpływa na ciśnienie
osmotyczne płynów
ustrojowych
* zanik różnicy
potencjałów
* utrata pobudliwości
komórek
* podobnie jak u
zwierząt
Potas (K)
K
+
* bierze udział w
przewodzeniu impulsów
nerwowych
* podwyższa stopień
uwodnienia koloidów
komórkowych
* aktywator wielu enzymów
* osłabienie organizmu
* zmniejszenie
kurczliwości mięśnia
sercowego
* osłabienie mięśni
szkieletowych i
gładkich
* chloroza liści
* zwiędły pokrój rośliny
* zahamowanie
wzrostu korzenia i pędu
* martwica organów

* mikroelementy
- ich udział w składzie suchej masy organizmu waha się od 0,01% do 0,00001%
- metale: Żelazo, Kobalt, Miedź, Mangan, Cynk, Molibden
- niemetale: Bor, Jod, Fluor, Krzem
4) Niektórzy biochemicy wyróżniają także ultraelementy, występujące w organizmach w ilościach nieprzekraczających bilionowej części
suchej masy
* są to m.in. Rad, Złoto, Srebro, Platyna, Selen
WIĄZANIA I ODDZIAŁYWANIA CHEMICZNE
WIĄZANIA
1) wiązania kowalencyjne (silne)
* np. między dwoma atomami C, H lub O
* połączone atomy mają wspólne elektrony i każdy z tych elektronów przyciągany jest przez protony obu pierwiastków
* wspólne pary elektronowe mogą tworzyć też różne pierwiastki, np. węgiel i atomy wodoru w cząsteczce metanu (CH
4
), atomy azotu i
atomy wodoru w cząsteczce amoniaku (NH
3
) lub tlen i atomy wodoru w cząsteczce wody (H
2
O)
* wiązanie pojedyncze – wiązanie kowalencyjne wytworzone między dwoma atomami przez wspólną parę elektronów
* wiązanie podwójne - wiązanie kowalencyjne wytworzone między dwoma atomami przez dwie wspólne pary elektronów
* wiązanie obojętne – atomy w cząsteczce wykazują podobną elektroujemność (miarę siły przyciągania przez atom elektronów
tworzących wiązanie chemiczne)
* wiązanie spolaryzowane - atomy w cząsteczce wykazują różną elektroujemność (np. cząsteczka wody)
2) wiązania jonowe (silne)
* powstają między naładowanymi różnoimiennie jonami (kationami i anionami) albo grupami chemicznymi
* elektrony zostają przeniesione z jednego atomu do drugiego, dlatego charakter wiązania jest polarny
* kation – atom, który stracił elektron, dodatnio naładowany (Na
+
, K
+
, Mg
2+,
Ca
2+,
)
* anion – atom, który zyskał elektron, ujemnie naładowany (Cl
-
)
* dzięki przeciwnym ładunkom elektrycznym kationy i aniony przyciągają się wzajemnie, tworząc związek jonowy
* związki z wiązaniami jonowymi, np. NaCl, mają tendencję do dysocjacji w środowisku wodnym na jony, które następnie podlegają
hydratacji
ODDZIAŁYWANIA
3) wiązania wodorowe (słabe)
* powstaje między wodorem związanym kowalencyjnie z elektroujemnym pierwiastkiem a innym pierwiastkiem elektroujemnym
* mogą zapewniać silne połączenia między cząsteczkami (np. wody, białek, kwasów nukleinowych), pod warunkiem że jest ich bardzo
dużo
4) wiązania van der Waalsa (bardzo słabe)
* zachodzą między grupami chemicznymi, znajdującymi się w małej odległości od siebie
* grupy te różnią się niewielkimi, przeciwstawnymi co do znaku ładunkami elektrycznymi
* mimo niewielkiej energii, siły van der Waalsa przyczyniają się do stabilizacji rozmaitych związków (np. białek, kwasów nukleinowych),
szczególnie gdy występują w większej liczbie
5) oddziaływania hydrofobowe
* powstają między fragmentami cząsteczek niepolarnych
* fragmenty te są nierozpuszczalne w wodzie i mają tendencję do skupiania się razem, jak np. w warstwie lipidowej błon komórkowych
Pierwiastek
Forma
występowania
Niektóre funkcje biologiczne
Przykładowe objawy
niedoboru u zwierząt i
człowieka
Przykładowe objawy
niedoboru
u roślin
Żelazo (Fe)
Fe
2+
* składnik białek złożonych
(hemoglobiny, mioglobiny),
transportujących tlen
* składnik wielu enzymów (np.
cytochromów)
* katalizator syntezy chlorofilu
* anemia
* osłabienie
* bóle głowy
* arytmia serca
* zakłócenia procesu
oddychania
* zakłócenia przebiegu
oddychania i fotosyntezy
* chloroza młodych liści
Kobalt (Co)
Co
2+
* składnik witaminy B
12
* konieczny dla roślin
motylkowych żyjących w symbiozie
z bakteriami brodawkowymi
* zaburzenia procesu
krzepnięcia krwi
* zahamowanie procesu
wiązania azotu przez rośliny
motylkowe
Miedź (Cu)
Cu
2+
* składnik enzymów
oksydoredukcyjnych
* ważna w syntezie hemoglobiny i
chlorofilu
* zaburzenia procesu
oddychania komórkowego
* bielenie i zasychanie
wierzchołków młodych liści
Mangan (Mn)
Mn
2+
* aktywator enzymów cyklu kwasu
cytrynowego
* aktywator enzymów fazy jasnej
fotosyntezy
* zaburzenia procesu
oddychania
* chloroza liści
* usychanie liści
Cynk (Zn)
Zn
2+
* składnik insuliny (hormonu
obniżającego poziom cukru we krwi)
* składnik wielu enzymów
uczestniczących w przemianach
białek i węglowodanów
* odpowiada za syntezę związków
regulujących wzrost i rozwój roślin
* powolne gojenie się ran
* choroby skóry
* łamliwość włosów i
paznokci
* zaburzenia rozwoju i
czynności gonad
* chloroza
* karlenie liści
Jod (J)
J-
* składnik hormonów tarczycy
* obrzęki skóry
* wole
* kretynizm
* nie stwierdzono
Fluor (F)
F
* wchodzi w skład kości i szkliwa
zębów
* podatność zębów na
próchnicę
* nie stwierdzono
Wyszukiwarka
Podobne podstrony:
28b. SKLAD CHEMICZNY KOMOREK ORAZ WIAZANIA I ODDZIALYWANIA CHEMICZNE
SKLAD CHEMICZNY KOMOREK ORAZ WIAZANIA I ODDZIALYWANIA CHEMICZNE, Biologia - mapy
Notatki Medycyna word grafy, SKLAD CHEMICZNY KOMOREK ORAZ WIAZANIA I ODDZIALYWANIA CHEMICZNE, 1) Jed
TEORIA W-F, Teoria - pytania i odp., Skład chemiczny powietrza atmosferycznego: a)składniki stałe: a
TEORIA W-F, teoria, Skład chemiczny powietrza atmosferycznego: a)składniki stałe: azot(78%),tlen(21%
Skład chemiczny nukleotydu
skład chemiczny komorki
1 Skład chemiczny skorupy ziemskiej
Skład chemiczny komórki, Notatki(1)
pyt 1-8 , Skład chemiczny żywności a podział na podstawowe grupy produktów spożywczych (12 grup wg I
Przeciętny skład chemiczny najważniejszych skał magmowych, Studia, 1-stopień, inżynierka, Ochrona Śr
sklad chemiczny komorki
Sklad chemiczny plazmy nasienia
właściwości fizyczne i skład chemiczny moczu, weterynaria, I semestr, Choroby zwierząt
Kosmetologia Budowa i skład chemiczny włosa Metody i środki do pielęgnacji różnych rodzajów włosó
Skład chemiczny Robinia Pseudoacacia L
Skład chemiczny atmosfery
skład chemiczny organizmów, biologia
więcej podobnych podstron