
Genetyczne czynniki chorobotwórcze
Etiologia i patogeneza wybranych zaburzeń
genetycznych u zwierząt

Genetyczne czynniki chorobotwórcze
1.
Kariotypy zwierząt domowych.
2.
Metody badania i zasady opisu kariotypów.
3.
Kariotypy wzorcowe i identyfikacja chromosomów przy użyciu prążków G i C.
4.
Typy mutacji punktowych i chromosomalnych: strukturalnych i liczbowych.
5.
Zaburzenia genetyczne u zwierząt domowych spowodowane przez mutacje chromosomalne
strukturalne: translokacja robertsonowska u bydła, odwrócenie płci u koni, odwrócenie płci
u psów.
6.
Mutacje chromosomalne strukturalne jako przyczyny nowotworów – chromosom
Philadelphia (Ph1) u ludzi i psów.
7.
Zaburzenia genetyczne u zwierząt domowych spowodowane przez mutacje chromosomalne
liczbowe (monosomia chromosomu X u klaczy, trisomie chromosomów somatycznych u koni
i bydła, występowanie nadliczbowych chromosomów X lub Y u koni).
8.
Metody identyfikacji mutacji genowych:
9.
PCR – łańcuchowa reakcja polimerazy
10. RFLP – polimorfizm długości fragmentów restrykcyjnych.
11. Choroby genetyczne uwarunkowane mutacjami genowymi – etiologia i patogeneza (BLAD –
niedobór leukocytarnych cząsteczek adhezyjnych u bydła, DUMPS – niedobór syntazy
monofosforanu urydyny u bydła, PSS – syndrom stresowy u świń)
12. Wykorzystanie metod PCR i RFLP w diagnostyce BLAD, DUMPS i PSS.
13. Reakcja PCR i RFLP – animacje komputerowe.
14. Ćwiczenie praktyczne
: izolacja chromosomów i analiza kariotypu w oocytach
prawidłowych oraz oocytach z zaburzeniami o charakterze euploidii i aneuploidii
pochodzących od świń.

Diploidalna liczba chromosomów niektórych gatunków zwierząt (wg Datta’y 1979, Kluga i cummingsa 1983,
Larousse’a 1990 oraz Świtońskiego 1982, 1987, 1988)
Nazwa zwyczajowa
Nazwa gatunkowa
2n
Człowiek
Szympans
Goryl
Rezus
Bydło domowe
Bydło zebu
Bawół azjatycki
Koza
Owca
Świnia domowa
Dzik
Koń domowy
Koń Przewalskiego
Osioł
Onager (półosioł)
Wielbłąd jednogarbny
Pies
Szakal
Lis pospolity
Homo sapiens
Pan troglodytes
Gorilla gorilla
Macaca mullata
Bos taurus
Bos indicus
Bubalus bubalis
Capra hirus
Ovis aries
Sus domestica
Sus scrofa
Equus caballus
Equus caballus przewalski
Equus asinus
Equus hemionus onager
Camelus dromedarius
Canis familiaris
Canis aureus
Vulpes vulpes
46
48
48
42
60
60
48
60
54
38
36
64
66
62
56
70
78
78
34
W niektórych narządach, np. wątrobie, występują komórki o zwielokrotnionej liczbie chromosomów, zwane poliploidalnymi

W zależności od umiejscowienia centromeru chromosomy dzielimy na:
1. Metacentryczne – centromer pośrodku długości chromosomu
2. Akrocentryczne – centromer blisko końca chromosomu
3. Submetacentryczne – pozycja pośrednia centromeru w odniesieniu do chromosomów
meta- i akrocentrycznych
4. Telocentryczne – centromer na końcu chromosomu
W chromosomie metacentrycznym ramiona p (krótkie) i q (długie) są równej długości


Typy mutacji chromosomowych strukturalnych
1.
Deficjencja
a) terminalna
b) interstycjalna
2.
Translokacje
a) fuzje centryczne
b) insercje
3.
Duplikacja
4.
Inwersja
a) paracentryczna
b) pericentryczna
5. Izochromosomy
6. Chromosomy pierścieniowe
7. Chromosomy dicentryczne


Trisomie chromosomów bydła
Kariotyp
Rasa
Płeć
Fenotyp
60,XX + 22
Simental
F
Normalny
60,XX t(12;12)+12
Simental
F
Defekt budowy, martwe urodzenia
60,XX t(20;20)+20
Simental
F
Defekt budowy, martwe urodzenia
61,XX + 19
Simental
F
Normalny
61, XY + 20
Romanga la
M
Deformacja kończyn, ślepota , brak zewnętrznych narządów płciowych
61, XY + 27
Hereford
M
Ogólny niedorozwój narządów wewnętrznych, hipoplazja płuc
60,XX/60, XY/61, XXY
Simental
M
Hipoplazja jąder, degeneracja nasieniowodów
61, XXY
Simental
M
Hipoplazja jąder, oligospermia
60,XY/61, XXY
Hereford
M
Niska jakość nasienia
61,XXY
Hereford
M
Żeńskie cechy budowy, hipoplazja jąder, azoospermia
61,XXX
Charolaise
F
Normalny

Translokacja robertsonowska
–
fuzja centryczna pojawiająca się najczęściej u bydła.
Polega na połączeniu się centromerami dwóch akrocentrycznych autosomów
i wytworzeniu formy meta- lub submetacentrycznej. Wystąpienie takich struktur
w komórkach prowadzi do zmniejszenia ogólnej liczby chromosomów z utrzymywaniem
się dotychczasowej liczby ramion chromatyd i nie zmienionej ilości DNA. Najczęściej
spotykana jest fuzja największego (1) i najmniejszego (29) autosomu, znana jako
translokacja 1:29. Ta forma aberracji występuje u ponad 60 ras bydła domowego, m.in. u
szwedzkiego czerwono-białego, rasy południowosyberyjskiej i u rasy polskiej czerwonej.
Nosiciele translokacji – zarówno buhaje, jak i krowy odznaczają się prawidłową budową i
parametrami fizjologicznymi.
Negatywnym efektem tej aberracji jest obniżenie płodności nosicieli powodowane
wzrostem wczesnej śmiertelności zarodkowej.
Translokacje robertsonowskie stwierdza się także u owiec, kóz, świń i lisów polarnych (u
tych ostatnich obserwuje się korzystne efekty mutacji).

Translokacja albo fuzja robertsonowska chromosomu 1/29 u krowy

PCR – Polymerase Chain Reaction
(łańcuchowa reakcja syntezy fragmentów DNA
RFLP- Restriction Fragment Lenght Polymorphism
(polimorfizm długości fragmentów restrykcyjnych)
BLAD- Bovine Leukocyte Adhesion Deficiency
(wrodzony niedobór leukocytarnych cząsteczek adhezyjnych
u bydła)
LAD- Leukocyte Adhesion Deficiency
(wrodzony niedobór leukocytarnych cząsteczek adhezyjnych)
DUMPS-Deficiency of Uridine Monophosphate Synthase
(wrodzony deficyt syntazy monofosforanu urydyny)
PSS- Porcine Stress Syndrome
(zespół stresowy świń)

Zastosowanie techniki PCR
1) Identyfikacja kwasów nukleinowych genów, bakterii, wirusów
2) Wykrywanie czynników zakaźnych, zwłaszcza latentnych wirusów
3) Prenatalna diagnostyka genetyczna
4) Wykrywanie polimorfizmu alleli
5) Precyzyjne ustalanie typu tkanek do transplantacji
6) Badania nad ewolucją przy wykorzystaniu próbek kopalnych
7) Diagnostyka chorób genetycznych – etap wstępny

Materiałem do izolacji kwasu nukleinowego mogą być:
hodowla komórkowa, bakterie, krew, wyciągi tkankowe, mleko, sperma, cebulki włosowe
Aby zamplifikować poszukiwany fragment DNA potrzebne są:
1) Wyizolowany z materiału biologicznego i oczyszczony DNA (matryca)
2) Mieszanka nukleotydów zawierająca A, C, G, T –składniki potrzebne do zbudowania nowej nici
interesującego nas fragmentu DNA
3) Polimeraza DNA
4) Czynniki inicjujące syntezę – startery - syntetyczne oligonukleotydy o sekwencji odpowiadającej ściśle
obu końcom powielanego odcinka

Postępowanie przy wykrywaniu chorób genetycznych
1)
Izolacja DNA z wybranego materiału biologicznego
2) Amplifikacja metodą PCR analizowanego fragmentu DNA
3) Analiza restrykcyjna zamplifikowanego genu (RFLP)
4) Uwidocznienie fragmentów restrykcyjnych za pomocą elektroforezy
(charakterystyczny dla danego genu i mutacji zestaw fragmentów restrykcyjnych
o określonej długości pozwalający stwierdzić, czy badany materiał pochodził
od osobnika zdrowego, chorego, czy też od nosiciela)

Niedobór leukocytarnych cząsteczek adhezyjnych u bydłą (BLAD)
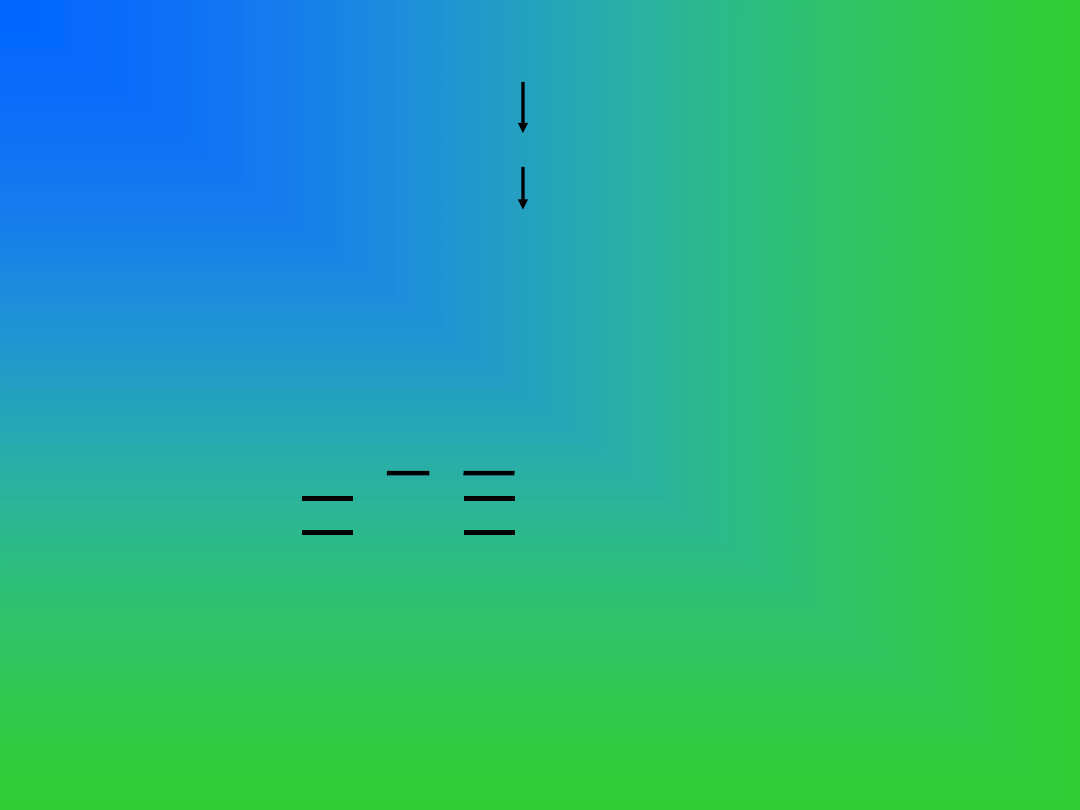
383 nukleotyd
GEN PRAWIDŁOWY
….CATCGACCTGT…
MUTACJA BLAD …..
CATCGGCCTGT ….
Taq I
1
2 3 1 genotyp normalny
2 homozygota mutacji BLAD
3 nosiciel mutacji BLAD
Wykrywanie mutacji punktowej będącej przyczyną BLAD u cieląt metodami PCR/RFLP.
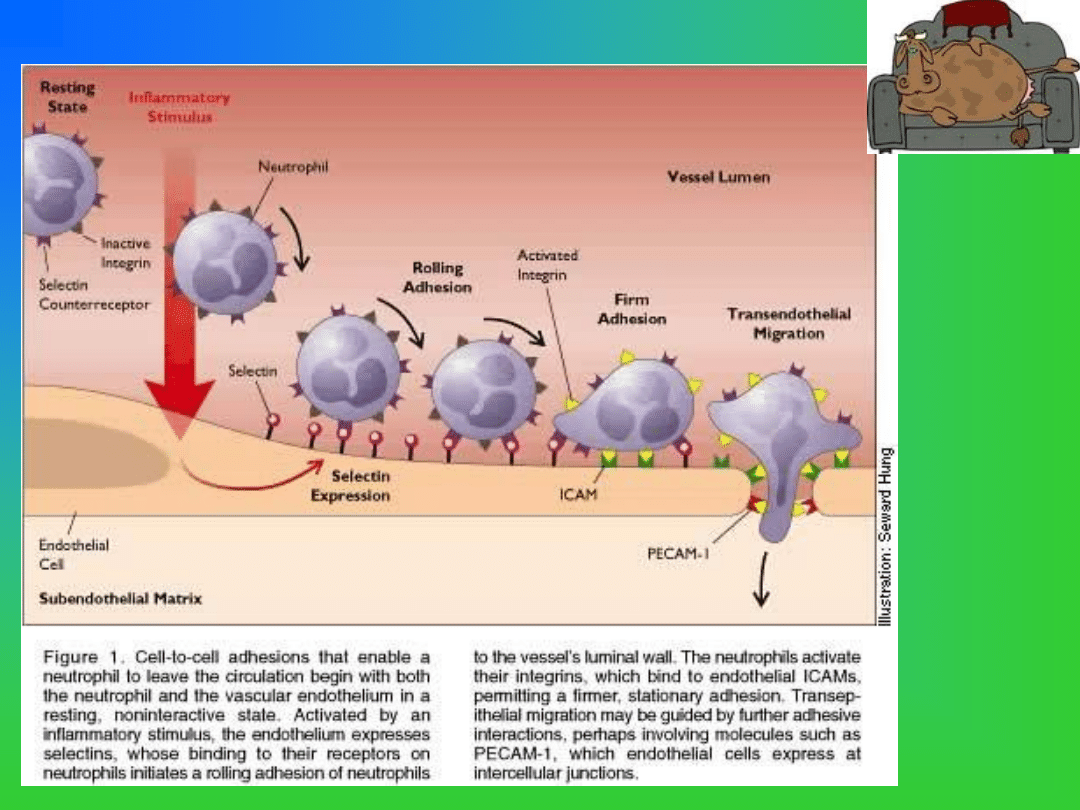
Courtesy the Hospital Practice web site ...

Wykrywanie mutacji
punktowej będącej przyczyną
DUMPS u bydła metodami
PCR/RFLP.
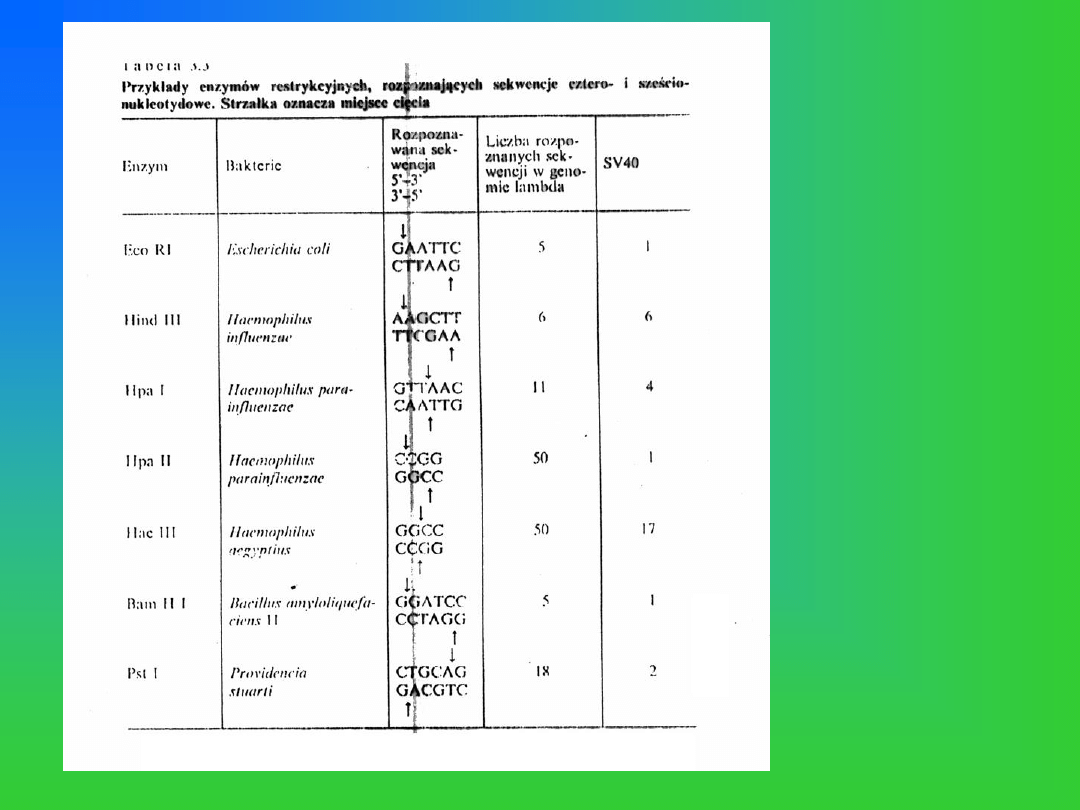
Przykłady enzymów
restrykcyjnych
wykorzystywanych
w technice RFLP
oraz rozpoznawanych
przez nie sekwencji
palindromowych
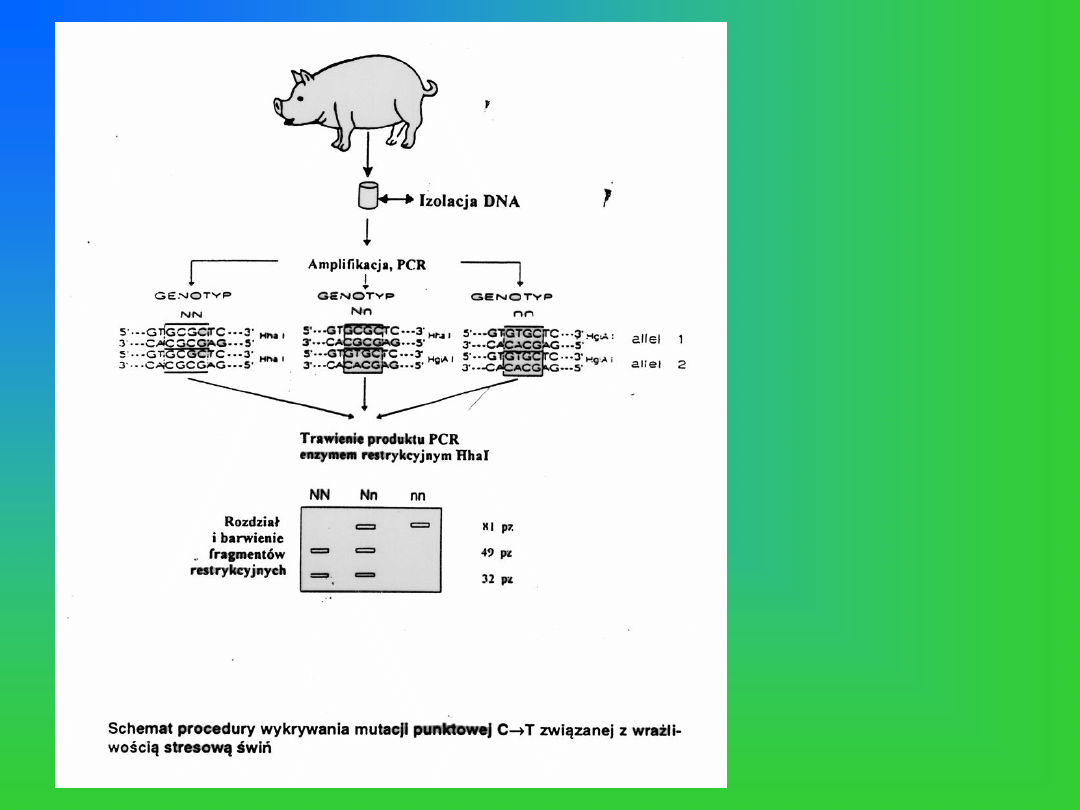
Wykrywanie mutacji
punktowej będącej przyczyną
PSS u świń u osobników
chorych i nosicieli metodami
PCR/RFLP.
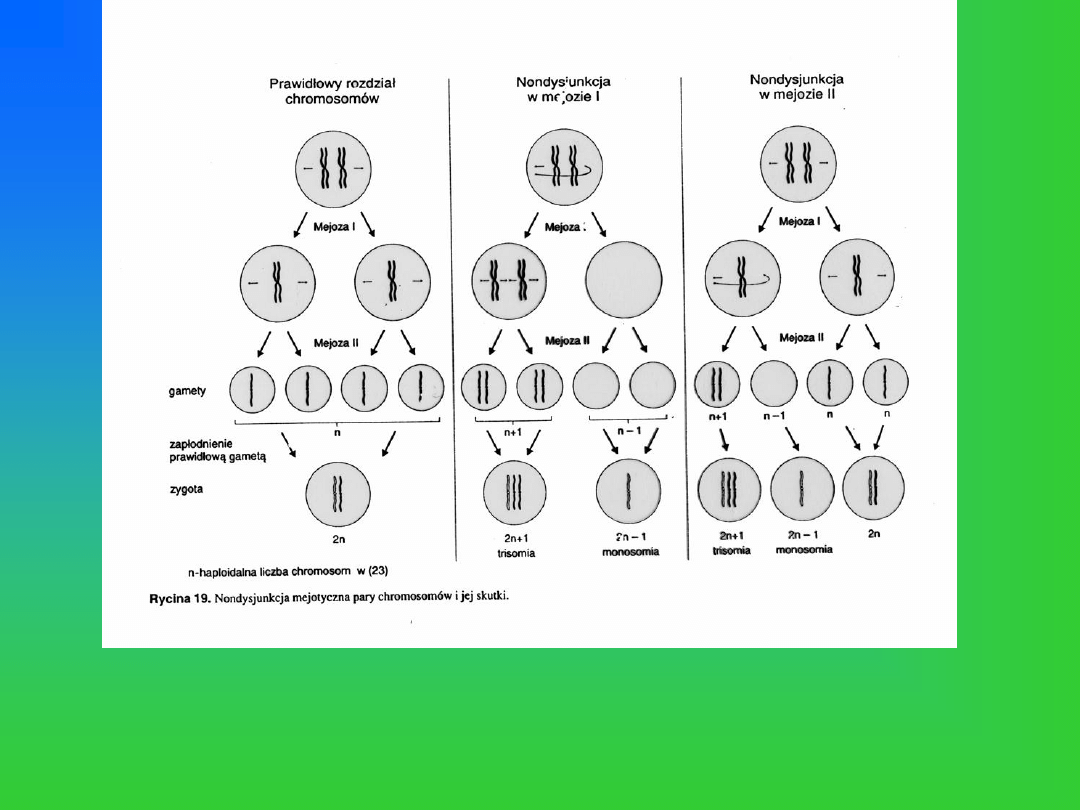
Nondysjunkcja mejotyczna jako przyczyna aberracji liczbowych o charakterze aneuploidii
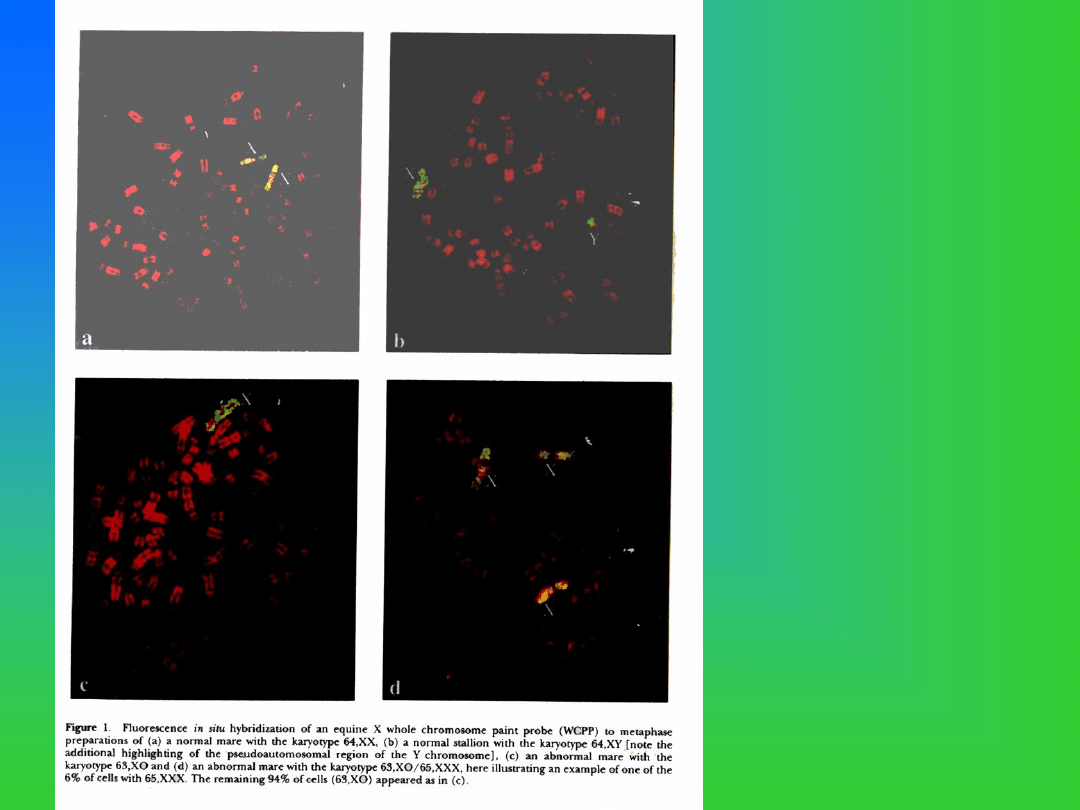
Kariotyp (chromosomy
w płytce metafazowej)
pochodzące od:
a. klaczy (64,XX)
b. ogiera (64,XY)
c. klaczy z monosomią
chromosomu X (63,X0)
d. klaczy z trisomią
chromosomu X
(65,XXX)


1. Jajniki pobrać podczas uboju i w ciągu godziny przetransportować do laboratorium
w płynie fizjologicznym (temp. 30-37
o
C).
2. Wyznaczyć na szkiełku podstawowym pole o pow. ok. 1 cm
2
.
3. Umieścić kroplę podłoża hodowlanego w wyznaczonym polu.
4. Po oczyszczeniu jajnika z okolicznych tkanek, przepłukaniu w płynie fizjologicznym
oraz umieszczeniu w jałowej płytce Petriego, wykonać nakłucie pęcherzyków i aspirację
płynu zawierającego oocyty.
5. Pobrany płyn przenieść do kropli podłoża umieszczonej na szkiełku podstawowym
i pod kontrolą mikroskopu sprawdzić miejsce położenia oocytów.
6. Oocyty poddać działaniu I-go roztworu utrwalającego (metanol/kwas octowy – 1:1) –
nanosząc pod kontrolą mikroskopu 1-2 krople – pozostawić na 5 min.
7. Następnie nanieść na preparat oocytów 1-2 krople II-go roztworu utrwalającego
(metanol/kwas octowy – 3:1) – pozostawić na 60 min., uzupełniając roztwór
w przypadku wysychania.
8. Usunąć nadmiar II-go roztworu utrwalającego i zabarwić preparaty 5% roztworem
barwnika Giemzy (5-10 min).
9. Dokonać pod mikroskopem analizy pod kątem oceny stadium dojrzewania
i występowania ewentualnych aberracji.
Ćwiczenie praktyczne: izolacja chromosomów i analiza kariotypu w oocytach
prawidłowych oraz oocytach z zaburzeniami o charakterze euploidii i aneuploidii
pochodzących od świń.

Chromosomy wyizolowane z oocytów świń -
obraz spod mikroskopu odwróconego pola
Oocyt - klasa I
Oocyt - klasa III
Oocyt - klasa IV
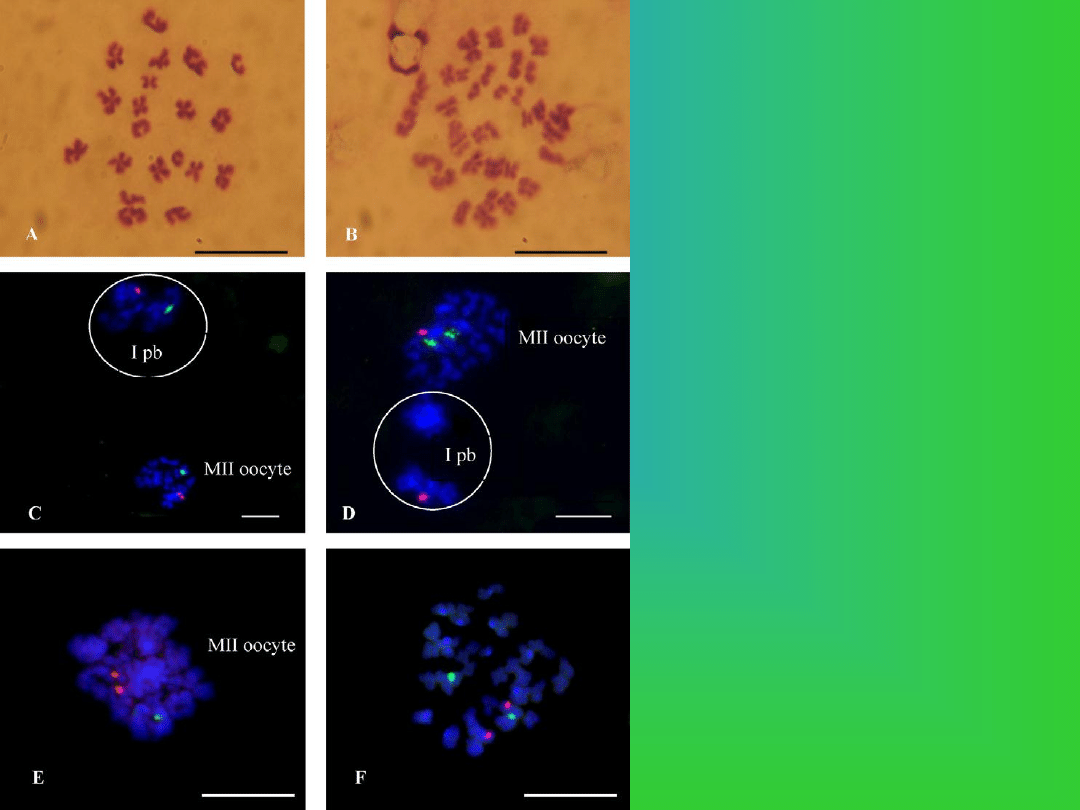
Analiza chromosomów (Giemsa, FISH)
w ooocytach świń dojrzewającyhch in vitro .
Giemsa: (A)oocyt haploidalny(n = 19);
(Boocyt diploidalny (2n = 38).
FISH: ©oocyt haploidalny; (D) aneuploidia
disomia chromosomu 1; (E) aneuploidia
disomia chromosomu 10; (F)oocyt
diploidalny.
Wyszukiwarka
Podobne podstrony:
CZYNNIKI GENETYCZNE A TERAPIA CHOROBY LEŚNIOWSKIEGO, bilogia molekularna
czynniki chorobotworcze, Genetyka(1)
Czynniki genetyczne w powstawaniu chorób
Diagnostyka predyspozycji genetycznych do chorob nowotworowych
Co wiesz na temat czynników chorobotwórczości i diagnostyki zakażeń Pseudomonas?ruginosa
ściąga-genetyczne, Genetyczne podstawy chorób SGGW
Genetyczne Uwarunkowania Chorób Endokryn nowy
Genetyczne Uwarunkowania Chorób Endokrynologicznych
Wykł XIV genetyka człowieka choroby genetyczne
GENETYKA 04. Choroby sprz¬+. z X, GENETYKA ćwiczenie 4
Genetyka molekularna chorób sercowo-naczyniowych, Genetyka
Genetyczne Uwarunkowania Chorób Endokryn
Czynniki chorobotwórcze, medycyna, Patofizjologia, Ćwiczenia 7-8 (wpływ promieniowania, ciśnień, med
rezerwuary czynnikow chorobotworczych, Medycyna ratunkowa, Ekologia z sozologią
mord psychologia i psychiatria wpływy środowiskowe jako czynnik chorobotworczy
podstawowe czynniki chorobotwórcze
więcej podobnych podstron