
MINISTERSTWO EDUKACJI
NARODOWEJ
Jolanta Gajda
Stosowanie podstawowych pojęć z zakresu chemii
ceramicznej 813[01].Z2.01
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr inż. Katarzyna Golec
mgr inż. Beata Figarska-Wysocka
Opracowanie redakcyjne:
mgr Jolanta Gajda
Konsultacja:
mgr inż. Gabriela Poloczek
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 813[01].Z2.01
Stosowanie podstawowych pojęć z zakresu chemii ceramicznej, zawartego w modułowym
programie nauczania dla zawodu operator urządzeń przemysłu ceramicznego.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenie
6
4. Materiał nauczania
7
4.1. Budowa materii
7
4.1.1. Materiał nauczania
7
4.1.2. Pytania sprawdzające
13
4.1.3. Ćwiczenia
13
4.1.4. Sprawdzian postępów
15
4.2. Substancje chemiczne stosowane w przemyśle ceramicznym
16
4.2.1. Materiał nauczania
16
4.2.2. Pytania sprawdzające
19
4.2.3. Ćwiczenia
19
4.2.4. Sprawdzian postępów
21
4.3. Reakcje chemiczne
22
4.3.1. Materiał nauczania
22
4.3.2. Pytania sprawdzające
24
4.3.3. Ćwiczenia
24
4.3.4. Sprawdzian postępów
25
4.4. Mieszaniny, roztwory, koloidy
26
4.4.1. Materiał nauczania
26
4.4.2. Pytania sprawdzające
31
4.4.3. Ćwiczenia
32
4.4.4. Sprawdzian postępów
34
4.5. Wybrane pojęcia z krystalochemii
35
4.5.1. Materiał nauczania
35
4.5.2. Pytania sprawdzające
37
4.5.3. Ćwiczenia
38
4.5.4. Sprawdzian postępów
39
5. Sprawdzian osiągnięć
40
6. Literatura
44

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Poradnik ten będzie Ci pomocny w przyswajaniu wiedzy z zakresu stosowania
podstawowych pojęć z zakresu chemii ceramicznej.
W Poradniku zamieszczono:
−
wymagania wstępne – wykaz umiejętności, jakie powinieneś mieć już ukształtowane,
abyś bez problemów mógł korzystać z poradnika,
−
cele kształcenia – wykaz umiejętności, jakie ukształtujesz podczas pracy z poradnikiem,
−
materiał nauczania – podstawowe wiadomości teoretyczne niezbędne do opanowania
treści jednostki modułowej,
−
zestaw pytań przydatny do sprawdzenia, czy już opanowałeś podane treści,
−
ć
wiczenia, które pomogą Ci zweryfikować wiadomości teoretyczne oraz ukształtować
umiejętności praktyczne,
−
sprawdzian postępów, który pomoże Ci określić, czy opanowałeś, materiał nauczania,
odpowiadając na pytanie tak lub nie,
−
sprawdzian osiągnięć, przykładowy zestaw zadań i pytań, pozytywny wynik sprawdzianu
potwierdzi, że dobrze pracowałeś podczas zajęć i że nabyłeś wiedzę i umiejętności
z zakresu tej jednostki modułowej,
−
literaturę uzupełniającą, z której możesz korzystać w czasie nauki.
W materiale nauczania zostały omówione zagadnienia z zakresu budowy materii, reakcji
chemicznych, mieszanin, roztworów, koloidów, wybranych pojęć z krystalochemii.
Poznanie przez Ciebie wszystkich lub określonej części wiadomości będzie stanowiło dla
nauczyciela podstawę przeprowadzenia sprawdzianu Twoich osiągnięć. W tym celu
nauczyciel może posłużyć się zadaniami testowymi.
W rozdziale 5 tego poradnika jest zamieszczony przykład takiego testu, zawiera on:
a) instrukcję, w której omówiono tok postępowania podczas przeprowadzania sprawdzianu,
b) przykładową kartę odpowiedzi, w której zakreśl poprawne rozwiązania poszczególnych
zadań.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
Schemat układu jednostek modułowych
813[01].Z2.01
Stosowanie podstawowych pojęć
z zakresu chemii ceramicznej
813[01].Z2.03
Formowanie wyrobów z mas
plastycznych
813[01].Z2.02
Przygotowywanie surowców
i mas ceramicznych
813[01].Z2.04
Formowanie wyrobów z mas
sypkich
813[01].Z2.08
Zdobienie i szkliwienie wyrobów
ceramicznych
813[01].Z2.06
Suszenie wyrobów ceramicznych
813[01].Z2.07
Wypalanie wyrobów ceramicznych
813[01].Z2.05
Formowanie wyrobów z mas
lejnych
813[01].Z2
Technologia produkcji wyrobów
ceramicznych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
−
posługiwać się symboliką chemiczną,
−
zapisywać wybrane związki przy użyciu symboliki chemicznej,
−
stosować przepisy bezpieczeństwa i higieny pracy przy wykonywaniu czynności
w szkolnej pracowni chemicznej,
−
obsługiwać komputer na poziomie podstawowym,
−
korzystać z różnych źródeł informacji, w tym z Internetu,
−
selekcjonować, porządkować i przechowywać informacje,
−
czytać ze zrozumieniem,
−
rozwiązywać test wielokrotnego wyboru,
−
pracować w grupie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
−
scharakteryzować podstawowe pojęcia z zakresu chemii ceramicznej,
−
posłużyć się terminologią z zakresu chemii ceramicznej,
−
określić właściwości chemiczne pierwiastków stosowanych w przemyśle ceramicznym,
−
scharakteryzować podstawowe dla przemysłu ceramicznego związki nieorganiczne
i organiczne,
−
rozróżnić rodzaje reakcji chemicznych, na podstawie zapisu równania reakcji,
−
określić stany skupienia materii oraz różnice między mieszaninami, roztworami
i układami koloidalnymi,
−
scharakteryzować zjawisko koagulacji, peptyzacji, tiksotropii, upłynniania gęstw
ceramicznych,
−
wyjaśnić podstawowe pojęcia z zakresu krystalochemii tlenków,
−
sporządzić roztwory i mieszaniny, na podstawie receptur i instrukcji technologicznych,
−
pobrać próbki do podstawowych analiz z magazynów lub linii produkcyjnych,
−
dobrać sprzęt laboratoryjny do realizacji określonych zadań.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4.
MATERIAŁ NAUCZANIA
4.1. Budowa materii
4.1.1. Materiał nauczania
Składniki atomu
Najistotniejszą cechą materii jest jej ziarnistość, czyli nieciągłość. „Ziarenkami” są atomy
oraz różne produkty ich połączeń bądź przekształceń: cząsteczki, jony i inne, zwane łącznie
drobinami. Wspólną cechą wszystkich drobin jest to, że stanowią stabilne układy
mikroskopowe zbudowane z jąder atomowych i elektronów.
−
Atom jest to drobina elektroobojętna zawierająca jedno jądro.
−
Jądro atomowe jest to centralna część atomu skupiająca cały ładunek dodatni atomu,
−
Jądro atomowe składa się z protonów i neutronów,
−
Proton jest składnikiem jądra o ładunku dodatnim, neutron jest składnikiem jądra
atomowego o ładunku elektrycznie obojętnym,
−
Elektron jest to cząstka o ładunku ujemnym i masie niemal 2000 razy mniejszej od
najlżejszego jądra,
−
Promień atomowy jest połową odległości między dwoma sąsiednimi jądrami,
−
Liczba atomowa (symbol Z) jest to liczba ładunków dodatnich w jądrze, jest równa
liczbie protonów w jądrze oraz liczbie elektronów w atomie. Liczba Z jest
niepowtarzalną cechą charakterystyczną pierwiastka chemicznego (nie istnieją dwa
pierwiastki o takiej samej liczbie atomowej), jest tożsama z „numerem” pierwiastka
w tablicy Mendelejewa. O kolejności miejsc zajmowanych przez pierwiastki w tablicy
Mendelejewa decyduje liczba atomowa. Atom każdego kolejnego pierwiastka zawiera
więc o jeden proton i o jeden elektron więcej niż jego poprzednik,
−
Liczba masowa (symbol A) jest to liczba nukleonów w jądrze, czyli suma liczby
protonów i neutronów.
Tabela 1. Elementarne składniki atomów [5, s. 49]
Cząstka
Symbol
Ładunek [e]
Liczba cząstek w atomie
(Z – liczba atomowa,
A – liczba masowa)
Proton
p
+1
Z
Neutron
n
0
A–Z
Elektron
e
- 1
Z
Powłoki elektronowe
Nie da się obliczyć ani wyznaczyć doświadczalnie toru, po jakim porusza się elektron.
Można jedynie obliczyć, w jakiej odległości od jądra przebywa on najczęściej i jakie są
szanse na pojawienie się elektronów w innym określonym rejonie. Elektron zachowuje się jak
kulista chmura ładunku ujemnego o gęstości ładunku malejącej w miarę wzrostu odległości
od jądra. Najważniejszą wielkością charakteryzującą elektron jest jego energia. Elektrony
tworzą zespoły o zbliżonych energiach. Grupa elektronów o zbliżonych wartościach energii to
powłoka elektronowa. Powłoki elektronowe mają symbole K, L, M, N, O, P, Q i numery 1, 2,
3, 4, 5, 6, 7.
Numer powłoki
1
2
3
4
5
6
7
Symbol powłoki
K
L
M
N
O
P
Q

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Liczba powłok elektronowych w atomie danego pierwiastka jest równa numerowi okresu,
do którego należy ten pierwiastek w tablicy Mendelejewa. Maksymalna liczba elektronów
w powłoce wynosi 2n
2
(n – numer powłoki).
Numer powłoki
1
2
3
4
2n
2
2
8
18
32
Rozmieszczenie elektronów w powłokach zapisuje się w postaci kolejnych liter alfabetu
(począwszy od K), oznaczających powłoki (uporządkowane od najbliższej jądra do
najdalszej) i prawych górnych indeksów określających liczbę elektronów w danej powłoce,
na przykład:
56
Ba K
2
L
8
M
18
O
18
P
8
Q
2
Elektrony walencyjne są to elektrony poruszające się w zewnętrznej strefie atomu.
Elektrony te, biorące udział w tworzeniu wiązań chemicznych, są słabo związane z jądrem.
Prawo okresowości mówi, że właściwości pierwiastków zmieniają się okresowo ze
wzrostem liczby atomowej. Okres jest uporządkowanym, według wzrastających liczb
atomowych, szeregiem pierwiastków, których atomy zawierają identyczną liczbę powłok
elektronowych. Grupa jest uporządkowaną według wzrastających liczb atomowych kolumną
pierwiastków, których atomy mają charakterystyczną konfigurację walencyjną i tę samą
liczbę elektronów walencyjnych.
Przekształcenie atomów w inne drobiny
Reguła helowca
Przyczyną przekształcania się atomów w inne drobiny jest dążenie do obniżenia energii.
Obniżenie energii łączących się atomów następuje wówczas, gdy każdy z nich uzyska trwałą
konfigurację walencyjną. Trwała konfiguracja walencyjna jest to konfiguracja helowca, czyli
2 elektrony (dublet walencyjny) w przypadku powłoki pierwszej lub 8 elektronów (oktet
walencyjny) w przypadku każdej następnej.
Konfigurację walencyjną helowca pierwiastki uzyskują trzema sposobami przez:
–
przeniesienie elektronów, które powoduje utworzenie wiązania jonowego,
–
uwspólnienie elektronów, które powodują utworzenie wiązania kowalencyjnego,
–
delokalizację elektronów, która powoduje utworzenie wiązania metalicznego.
O rodzaju powstającego wiązania decyduje konfiguracja walencyjna tworzonych je
atomów. Pierwiastki znajdujące się na początku każdego okresu tablicy Mendelejewa, czyli
metale, oddają wszystkie elektrony z powłoki zewnętrznej, uzyskując w ten sposób
konfigurację helowca zamykającego okres poprzedni. Na przykład sód uzyskuje w ten sposób
konfigurację neonu:
Rys. 1. Konfiguracja elektronowa atomu i jonu sodu [5, s. 62]
Automatycznie, powłoką zewnętrzną, staje się w tych przemianach powłoka
przedostatnia, ta zaś zawiera oktet lub dublet elektronowy.
Atom pozbawiony elektronu przestaje być elektrycznie obojętny. Przybiera ładunek
dodatni, ponieważ liczba protonów w jądrze pozostaje bez zmian i liczba ładunków dodatnich
jądra przewyższa liczbę elektronów. Wytworzona w ten sposób nowa drobina to jon dodatni,
czyli kation. Tworzenie kationów jest typową cechą metali.
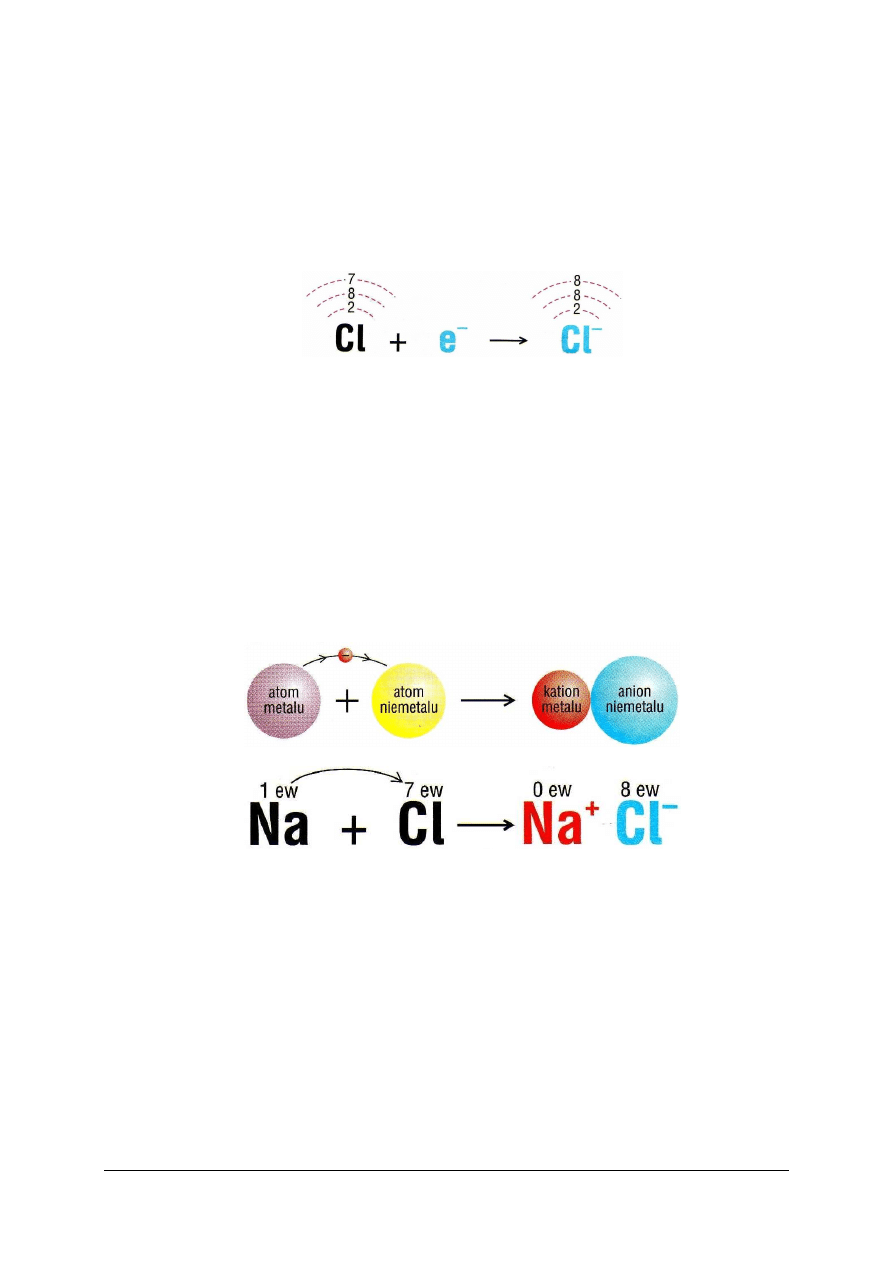
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Wymiary jonów są inne niż wymiary ich macierzystych atomów. Usunięcie elektronu
powoduje zmniejszenie odpychania między elektronami. Dzięki temu elektrony zbliżają się
do jądra i zostają silniej z nim związane. W konsekwencji wszystkie kationy mają promienie
mniejsze niż atomy, z których się utworzyły (rys. 1).
Niemetale, pierwiastki znajdujące się przy końcu okresu, mogą przyłączyć do
zewnętrznej powłoki tyle elektronów, ile brakuje im do konfiguracji helowca zamykającego
okres. Na przykład chlor uzyskuje w ten sposób konfigurację argonu:
Rys. 2. Konfiguracja elektronowa atomu i jonu chloru [5, s. 63]
Atom, który przyłączył elektron, staje się jonem ujemnym, czyli anionem. Tworzenie
anionów jest typową cechą niemetali. Wszystkie aniony mają promienie większe niż
macierzyste atomy.
Typy wiązań chemicznych
Wiązanie jonowe jest to wiązanie utworzone przez przemieszczenie jednego lub kilku
elektronów między atomami z równoczesnym powstaniem jonów, które się przyciągają.
Elektrony przemieszczają się z atomu metalu do atomu niemetalu. Atom metalu
przekształca się w kation, a atom niemetalu w anion. Typowym przykładem takiego procesu
może być reakcja sodu z chlorem, której produktem jest chlorek sodu, NaCl (rys. 3).
Substancje o wiązaniu jonowym tworzą w stanie stałym jonową sieć krystaliczną (rys. 6a).
Rys. 3. Schemat tworzenia cząsteczki chlorku sodu.(skrót ew oznacza elektrony walencyjne) [5, s. 63]
Wiązanie kowalencyjne jest to wiązanie utworzone przez uwspólnienie elektronów.
Atomy, które uwspólniły elektrony, przekształcają się w cząsteczkę, czyli drobinę obojętną
elektrycznie, zbudowaną z jąder atomowych i elektronów. Część elektronów porusza się
wokół pierwszego jądra, część wokół drugiego, a kilka wokół obu jąder i te ostatnie są
nazywane elektronami wiążącymi lub uwspólnionymi. Wspólne elektrony zachowują się jak
chmura ładunku, rozprzestrzeniona wokół jąder i wykazująca znaczną gęstość w obszarze
międzyjądrowym. Chmura ta nakłada się na chmury innych elektronów walencyjnych
i rdzeniowych. Typowym przykładem cząsteczki powstającej na tej zasadzie jest cząsteczka
chlorowodoru HCl (rys. 4):
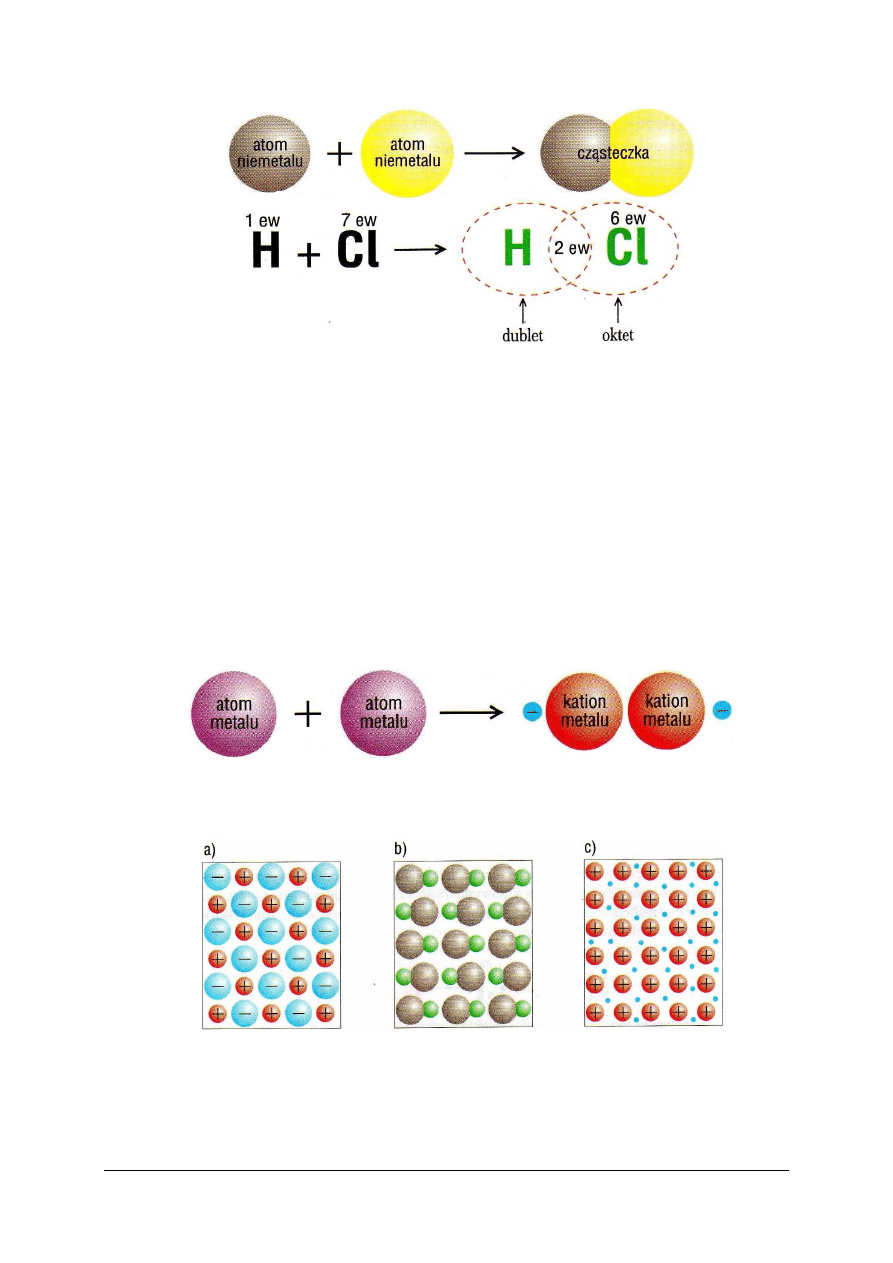
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Rys. 4.
Schemat tworzenia cząsteczki chlorowodoru (skrót ew oznacza elektrony walencyjne) [5, s. 63]
Każdy atom „oddelegowuje” jeden elektron do utworzenia wspólnego zespołu
elektronowego (w tym przypadku dwuelektronowego), w schemacie zaznaczonego symbolem
2 ew (dwa elektrony walencyjne) między symbolami atomów (rys. 4). Wokół obu jąder
utworzyła się trwała konfiguracja walencyjna, złożona z 8 elektronów.
Substancje zbudowane z cząsteczek tworzą w stanie stałym cząsteczkową sieć
krystaliczną (rys. 6b).
Wiązanie metaliczne (rys. 5) jest to wiązanie występujące w metalach i ich stopach,
polegające na oddziaływaniu zdelokalizowanych elektronów i jonów dodatnich tworzących
sieć krystaliczną. Delokalizacja elektronów następuje w samych metalach, jak i w ich
stopach.
Po oderwaniu elektronów od atomów, powstałe kationy tworzą sieć krystaliczną,
a uwolnione elektrony poruszają się swobodnie w obrębie całej próbki makroskopowej, stąd
określenie delokalizacja.
Rys. 5. Schemat tworzenia wiązania metalicznego [5, s. 64]
Sieć krystaliczną metalu przedstawiono na rysunku 6c.
Rys. 6. Schematy sieci krystalicznych: a) jonowej, b) cząsteczkowej, c) metalicznej (niebieskie kropki
oznaczają swobodnie poruszające się elektrony) [5, s. 64]
Wiązania wodorowe (mostek wodorowy) powstają między atomem wodoru, na którym
znajduje się ładunek dodatni, a wolną parą elektronową atomów takich pierwiastków jak:
O, N, S. Wiązania wodorowe są słabe, ich konsekwencją jest łączenie się cząsteczek
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
w większe zespoły. Występują w organicznych masach plastycznych i wielu strukturach
krzemianów.
Wiązania van der Waalsa zasadniczo występują wszędzie między atomami, jonami lub
cząsteczkami obok innych wiązań. Jest to wiązanie najsłabsze i dlatego na ogół działanie jego
jest zamaskowane przez wiązanie innego typu. Wiązania te są wynikiem działania tzw. sił
dyspersji. Wielkość sił dyspersji wzrasta ze wzrostem promienia jonu. W krzemianach, w tym
w wielu rodzajach minerałów ilastych, mamy również do czynienia z wiązaniami van der
Waalsa. Siły te wiążą pakiety minerałów o strukturze warstwowej lub warstwy jonów, na
przykład w talku. Talk – warstwowy zasadowy krzemian magnezu Mg [Si
4
O
10
](OH)
2
ma
właśnie to słabe wiązanie między pakietami i dlatego znany jest z łatwego ścierania, nawet
paznokciem.
Wzory elektronowe
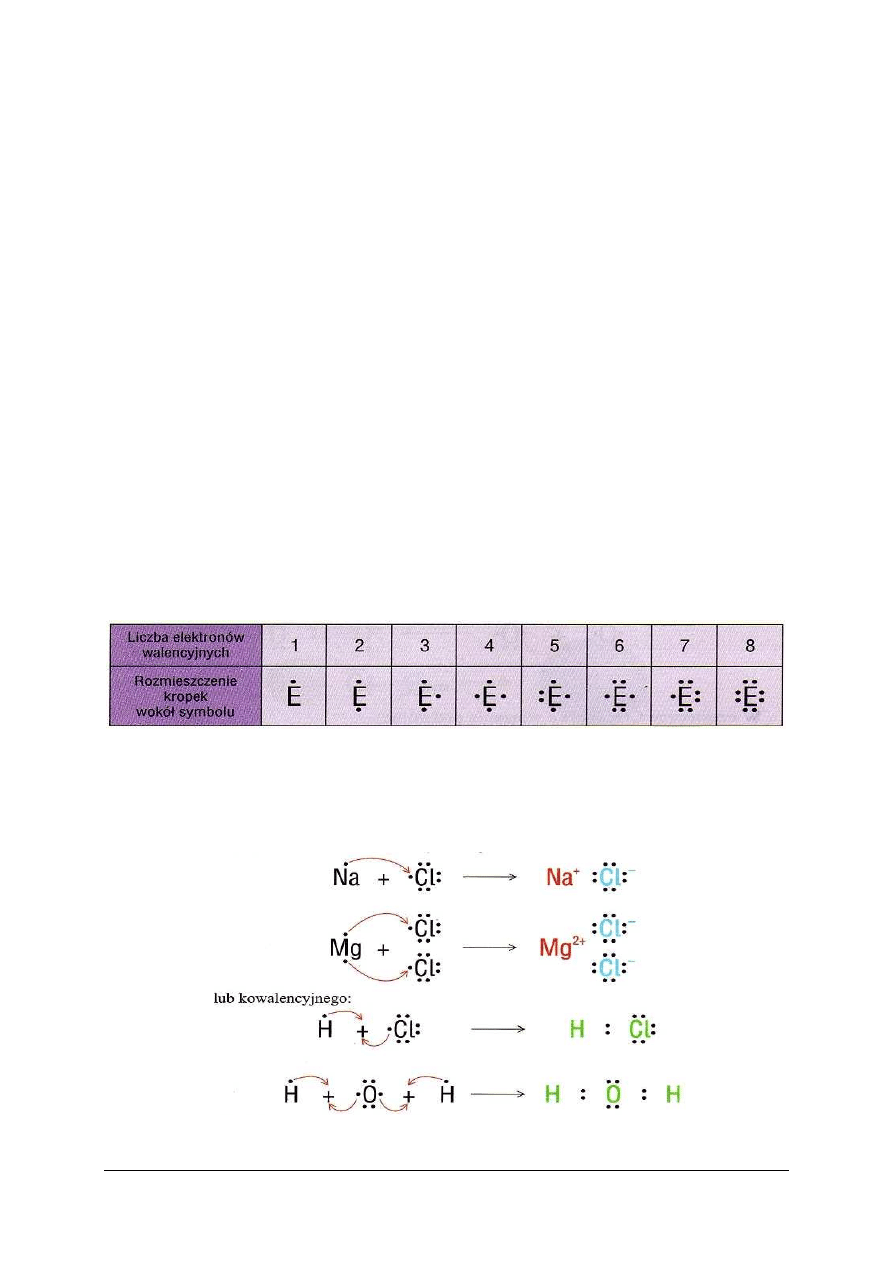
Rodzaj wiązania chemicznego można uwidocznić stosując wzory elektronowe, czyli
wzory
strukturalne
z
zaznaczonym
rozmieszczeniem
elektronów
wspólnych
i nieuwspólnionych. Istnieją dwa rodzaje wzorów elektronowych: kropkowe (w których
każdy elektron jest zaznaczony kropką) i kreskowe (w których każda para elektronów jest
zaznaczona kreską). Rysuje się tylko elektrony z zewnętrznych powłok atomów
przekształconych w drobinę.
W celu wyjaśnienia powstania wiązania, można narysować schemat uwidaczniający,
które elektrony uczestniczyły w tworzeniu wspólnych par. W takim przypadku elektrony
walencyjne pojedynczych atomów – substratów przemiany – rysuje się kropkami wokół
symbolu w sposób przedstawiony w tabeli 2.
Tabela 2. Elektronowe wzory kropkowe pojedynczych atomów [5, s. 65]
Za pomocą symboli chemicznych z kropkami, oznaczającymi elektrony walencyjne,
można przedstawić przegrupowania elektronowe, stanowiące istotę reakcji chemicznych, jak
i budowę substancji w postaci wzorów elektronowych. Rysunek 7 przedstawia
przegrupowania elektronowe zachodzące w przypadku tworzenia wiązania jonowego
i kowalencyjnego.
Rys. 7. Schemat powstawania wiązania kowalencyjnego i jonowego z zastosowaniem elektronowych wzorów
kropkowych [5, s. 65]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Wiążące wspólne pary elektronowe zaznacza się dwoma kropkami umieszczonymi
w środku między symbolami pierwiastków. Pozostałe pary elektronów, czyli elektronów
nieuwspólnionych, zwane wolnymi lub niewiążącymi, rysuje się dwoma kropkami
przylegającymi do symbolu.
We wzorach kreskowych wspólną parę elektronową zaznacza się kreską łączącą symbole
(tak samo jak w kreskowych wzorach strukturalnych), a wolne pary elektronowe rysuje się
w postaci kresek przylegających do symbolu.
Rys. 8. Schemat powstawania wiązania atomowego i jonowego z zastosowaniem elektronowych wzorów
kreskowych [5, s.
65]
Układ dwóch wspólnych elektronów (jedna para), stanowiących wiązanie kowalencyjne,
nazywany jest wiązaniem pojedynczym.
Liczba uwspólnionych elektronów powinna być taka, aby dla obu łączących je atomów
została spełniona reguła helowca. Jeżeli utworzenie jednej wspólnej pary elektronowej nie
wystarcza dla uzyskania oktetu, to może nastąpić uwspólnienie dwóch lub trzech par. Jeżeli
uzyskanie oktetu następuje po uwspólnieniu czterech elektronów (czyli dwóch par), to taki
układ nazywamy wiązaniem podwójnym. Istnieją też potrójne wiązania kowalencyjne
utworzone przez trzy wspólne pary elektronów. Przyczyną tworzenia różnej liczby wiązań
chemicznych przez poszczególne pierwiastki jest różna liczba elektronów walencyjnych.
Opisane reguły tworzenia wiązań chemicznych ujawniają przyczynę tworzenia różnej
liczby wiązań przez poszczególne pierwiastki i wyjaśniają, czym jest wartościowość
w interpretacji elektronowej.
Wartościowość pierwiastka jest równa liczbie elektronów, które atom oddaje, tworząc
kation, lub przyjmuje, tworząc anion, albo uwspólnia, tworząc wiązanie kowalencyjne.
Wiązania chemiczne występujące w krzemianach
Krzemiany są zbudowane z bardzo wielu jonów (atomów) różnych pierwiastków i często
tak zastępowanych, że wzór trudno ustalić.
Połączenia chemiczne można najogólniej podzielić na:
−
połączenia pierwszego rzędu (związki atomów lub jonów między sobą),
−
połączenia drugiego rzędu (wysycone drobiny).
Krzemiany należą więc raczej do pierwszej grupy, chociaż często spotykane są drobiny
związane strukturalnie z ich siecią (na przykład drobiny wody w minerale tzw.
montmorillonicie).
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jak zbudowane jest jądro atomowe?
2. Co to jest i jaki ma symbol liczba atomowa?
3. Co to jest i jaki ma symbol liczba masowa?
4. Jak się określa powłokę elektronową?
5. Jakie są numery i symbole powłoki?
6. Jak powstają wiązania jonowe?
7. Jak powstają wiązania kowalencyjne?
8. Jak powstają wiązania metaliczne?
9. Jakie wiązania występują w krzemianach?
4.1.3. Ćwiczenia
Ćwiczenie 1
Przyporządkuj, wymienionym w kolumnie 1, terminom odpowiadające im informacje
z kolumny 2.
Terminy
Informacje
1.
Jądro atomowe.
A.
Jest połową odległości między dwoma sąsiednimi jądrami.
2.
Elektron.
B.
Jest równa liczbie elektronów w atomie.
3.
Liczba atomowa.
C.
Jest elektrycznie obojętny.
4.
Promień atomowy.
D.
Cząsteczka o ładunku ujemnym.
5.
Atom.
E.
Ma tyle elektronów ile protonów.
6.
Neutron.
F.
Skupia dodatni ładunek atomu.
Terminy
1
2
3
4
5
6
Informacje
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać i przeanalizować treść ćwiczenia,
2) przyporządkować wymienionym terminom odpowiednie informacje,
3) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−
literatura zgodna z punktem 6 Poradnika dla ucznia.
Ćwiczenie 2
Uzupełnij tabelę o brakujące dane.
Symbol pierwiastka
Li
Liczba elektronów
17
20
Numer grupy
17
2
Powłokowa konfiguracja
elektronowa
K
2
, L
8
, M
3
K
2
, L
8
, M
6

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeanalizować wypełnione pola tabeli,
2) wypełnić wolne pola w tabeli,
3) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−
zeszyt,
−
literatura zgodna z punktem 6 Poradnika dla ucznia.
Ćwiczenie 3
Uzupełnij poniższe równania elektronowe, obserwując przekształcenia atomów w inne
drobiny:
a) Ca → Ca
2+
+…….
b) Cl + e
-
→….
c) Sn → Sn
4+
+……
d) N +3…→ N
3
.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeanalizować zapis równań elektronowych,
2) wypełnić miejsca kropkowane,
3) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−
zeszyt,
−
literatura zgodna z punktem 6 Poradnika dla ucznia.
Ćwiczenie 4
Połącz hasło z opisem.
Hasło
Opis
1.
Wiązanie jonowe
A.
Wiązanie utworzone przez uwspólnienie elektronów. Atomy, które
uwspólniły elektrony, przekształcają się w cząsteczkę. Substancje
o wiązaniu jonowym tworzą w stanie stałym jonową sieć krystaliczną.
2.
Wiązanie
kowalencyjne
B.
Wiązanie występujące w metalach i ich stopach, polegające na
oddziaływaniu
zdelokalizowanych
elektronów
i
jonów
dodatnich
tworzących sieć krystaliczną
3.
Wiązanie metaliczne
C.
Stanowiących podstawowe składniki surowców i tworzyw ceramicznych
4.
Wiązania chemiczne
występujące
w krzemianach
D.
Atom metalu przekształca się w kation, a atom niemetalu w anion.
Substancje zbudowane z cząsteczek tworzą w stanie stałym cząsteczkową
sieć krystaliczną.
Hasło
1
2
3
4
Opis
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać określone treści z poradnika dotyczące wiązań chemicznych,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
2) zastanowić się nad opisem poszczególnych haseł,
3) połączyć hasło z opisem, uzupełniając miejsce w tabelce,
4) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−
zeszyt,
−
literatura zgodna z punktem 6 Poradnika dla ucznia.
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcie liczby atomowej?
2) zdefiniować pojęcie liczby masowej?
3) zdefiniować pojęcie powłokowej konfiguracji elektronowej?
4) wyjaśnić, jak powstaje wiązanie jonowe?
5) wyjaśnić, jak powstaje wiązanie kowalencyjne?
6) wyjaśnić, jak powstaje wiązanie metaliczne?
7) zdefiniować pojęcie krzemianów?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
4.2. Substancje chemiczne stosowane w przemyśle ceramicznym
4.2.1. Materiał nauczania
Rola pierwiastków stosowanych w przemyśle ceramicznym
Różne liczby wartościowości, występujących u takich pierwiastków jak: chrom (II, III,
VI), mangan (II, III, IV, VI, VII) związane są z istnieniem nieparzystych elektronów na
zewnętrznej powłoce i na powłoce głębszej. Ma to istotny wpływ na właściwości tworzonych
przez nie związków i na ich zastosowanie w ceramice. Warto wspomnieć, że podstawą
zielonej dekoracji na wyrobach ceramicznych jest najczęściej Cr
3+
, a czerwonej na fajansie –
Cr
6+
. W praktyce mamy do czynienia ze związkami o wiązaniach posiadających charakter
mieszany, najczęściej jonowo-kowalencyjny lub kowalencyjno-jonowy, w zależności od
charakteru całego układu.
Rola jonów o charakterze modyfikatorów, barwiących i szkłotwórczych
Szkła krzemionkowe, które w ceramice są podstawą przemysłu szklarskiego, stanowią
także podstawową więźbę szkliw, którymi pokrywane są wyroby ceramiczne
w
celu
wzmocnienia i uszlachetnienia czerepu, a często dodatkowo w celach dekoracyjnych. Biorą
one również udział w powstawaniu większości czerepów typowo ceramicznych i są
składnikiem farb stosowanych do dekoracji wyrobów ceramicznych.
Ogólnie, jony najczęściej występujące w szkliwach lub w szkłach ceramicznych dzielimy
na jony:
−
szkłotwórcze,
−
modyfikatory,
−
barwiące.
Zestawienie tych jonów podano w tabeli 3.
Tabela 3. Rola pierwiastków w szkliwach ceramicznych [7, s.206]
Numer okresu w tablicy
Mendelejewa
Modyfikatory
Szkłotwórcze
Barwiące
1
H
2
O
–
–
2
Li
2
O, BeO
B
2
O
3
, F
–
3
Na
2
O
5
, MgO
Al
2
O
3
, SiO
2 ,
P
2
O
5
–
4
K
2
O, CaO
GeO
2
, As
2
O
3
, As
2
O
5
V, Cr, Mn, Fe, Co, Ni, Cu, Zn
5
Rb
2
O, SrO
SnO
2
,
Sb
2
O
3
, Sb
2
O
5
Ag, Cd
6
Cs
2
O, BaO
PbO
La, Ce, Au
7
–
–
UO
2
Jony modyfikatory pochodzą od atomów grupy 1 i 2 układu okresowego (na przykład
sód, wapń). Wpływają one na obniżenie temperatury mięknięcia szkliw, obniżając
równocześnie ich chemoodporność i twardość. Ogólnie do jonów modyfikujących zaliczamy
kationy o dużych rozmiarach na przykład: K
+
, Na
+
, Ca
2+
, Ba
2+
. Inne kationy dwuwartościowe,
takie jak Mg
2+
, Zn
2+
także modyfikują sieć, ale nie mogą być dodawane do szkła w ilości
większej od około 20%, ponieważ brak im właściwości szkłotwórczych i szkło traci ze
wzrostem ich ilości trwałość.
Jony szkłotwórcze (tworzące zasadniczą więźbę szkła) pochodzą od atomów
pierwiastków grup 3–17 (na przykład krzem, ołów).
Jony barwiące pochodzą od atomów pierwiastków grup 3–17 (na przykład: kobalt,
chrom). Są to składniki służące do zabarwiania szkliw. Barwę zieloną można uzyskać z jonu
Cr
3+
, różową i czerwoną z jonu Cr
6+
,
niebieską ,,kobaltową” z Co
2+
. Należy pamiętać, że rola,
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
jaką odgrywają pierwiastki w budowie i charakterze właściwości produkowanych szkliw
i szkieł związana jest ściśle z budową zewnętrznych części ich powłok elektronowych.
Właściwości węgla i krzemu
Właściwości okresowe pierwiastków są związane z podobieństwem budowy
zewnętrznych powłok elektronowych (elektronów walencyjnych).
Węgiel, krzem i german mają zasadniczo identyczne zewnętrzne powłoki elektronowe.
W tabeli 4 wyraźnie uwidocznione są zmiany właściwości pierwiastka przy oddalaniu się
powłoki walencyjnej od jądra atomu. Wskazują na to wyraźne różnice w twardości
i temperaturze topnienia.
Trudniejsze do wyjaśnienia są bardzo odmienne właściwości związków węgla i krzemu
jako pierwiastków należących do tej samej grupy układu okresowego. Często przy bardzo
ogólnikowej charakterystyce całej rodziny węglowców spotykamy się z wyjaśnieniem, że
węgiel i krzem tworzą raczej wiązania atomowe. Nie należy w chemii ceramicznej
przyjmować ściśle tego określenia.
Tabela 4. Zestawienie porównawcze właściwości węglowców [7, s. 19]
Właściwości
Węgiel
C
Krzem
Si
German
Ge
Cyna
Sn
Ołów
Pb
Masa atomowa
12,010
28,09
72,60
118,70
207,21
Liczba atomowa
6
14
32
50
82
Liczba elektronów
w ostatniej powłoce
4
4
4
4
4
Wartościowość
IV
IV
IV
II, IV
II, IV
Gęstość [g/cm
3
]
Grafit 2,25
2,4
5,35
7,3
11,3
Temperatura topnienia
[K]
ok. 3913
sublimuje
1683
1231,5
514,84
600,4
Twardość (porównawczo)
diament
najtwardszy
ze znanych
substancji
twardy
twardy
dość miękka
miękki
Charakter pierwiastka
w związkach
niemetal
niemetal
metal
metal
metal
Stan energetyczny elektronów zewnętrznej (walencyjnej) powłoki krzemu Si jest na tyle
odmienny od stanu energetycznego zewnętrznych elektronów węgla C, że w efekcie
większość związków organicznych to związki węgla, który stanowi główne rusztowanie
materii ożywionej. Elektrony walencyjne węgla są na tyle bliżej swego jądra niż to ma
miejsce w krzemie, że ich energia swobodna jest mniejsza, chętniej więc tworzą wiązania
atomowe (nie „mają” swobody oddać elektronów). Efektem tej cechy węgla są bardzo długie
i trwałe łańcuchy związków, na przykład węglowodory. Elektrony walencyjne krzemu są
bardziej oddalone od swego jądra i mają na tyle dużą energię swobodną, że łatwiej tworzą
wiązania nieskierowane o charakterze w dużej mierze jonowym i stąd mamy do czynienia
z trójwymiarowym, nieograniczonym wzrostem sieci przestrzennej tworzącej świat
kryształów, minerałów. Ta cecha krzemu stanowi podstawę ceramiki.
Charakterystyka podstawowych dla przemysłu ceramicznego związków nieorganicznych
i organicznych
Najważniejszymi związkami chemicznymi krzemu są: krzemionka, krzemiany oraz
glinokrzemiany. Krzemionka jest głównym składnikiem piasku i jedną z najpowszechniej
występujących substancji w przyrodzie. Piasek służy do wyrobu materiałów budowlanych,
a kwarc jest używany głównie w jubilerstwie. Z krzemionki otrzymuje się czysty krzem,
który jest stosowany w nowoczesnych technologiach, głównie w elektronice. Krzemiany

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
i glinokrzemiany to składniki skał i minerałów. Z krzemionki oraz węglanów wapnia i sodu
wytwarza się szkło.
Wodorotlenki
Właściwości ich sprawiły, że mają różnorodne zastosowanie:
–
NaOH (wodorotlenek sodu) – do produkcji papieru, szkła, barwników, do produkcji
mydła i środków piorących,
–
Ca(OH)
2
(wodorotlenek wapnia) – do produkcji nawozów mineralnych, bielenia drzew,
w budownictwie, w przemyśle cukierniczym,
–
KOH (wodorotlenek potasu) – do grawerowania, do produkcji detergentów,
–
Mg(OH)
2
(wodorotlenek magnezu) – do produkcji leków, produkcji past do zębów.
Kwasy nieorganiczne – zastosowanie
–
H
2
SO
4
(kwas siarkowy(VI) ) – do produkcji środków piorących, materiałów
wybuchowych, nawozów mineralnych, barwników, leków, akumulatorów, nafty, olejów,
smarów, środków piorących,
–
HCl (kwas chlorowodorowy) – do produkcji włókien sztucznych, barwników, wyrobów
cukierniczych, leków, tworzyw sztucznych oraz do lutowania i wyprawiania skór,
–
HNO
3
(kwas azotowy(V) ) – do produkcji nawozów mineralnych, materiałów
wybuchowych, barwników, tworzyw sztucznych, lakierów, leków i wytrawiania metali,
–
H
3
PO
4
(kwas fosforowy(V) ) – do produkcji napojów, farb i lakierów, środków
zmiękczających wodę, środków usuwających kamień i rdzę, środków piorących i do
konserwacji żywności.
Kwasy organiczne są najczęściej składnikami wielu produktów spożywczych (np. kwas:
octowy, mlekowy i cytrynowy.
Niektóre sole znalazły zastosowanie jako nawozy mineralne, najczęściej są stosowane
azotany(V), fosforany(V), chlorek potasu i siarczan(VI) potasu, inne w gospodarstwie
domowym jako przyprawy: sól kuchenna (NaCl), środki spulchniające (NaHCO
3
),
konserwujące (NaCl, KNO
3
), proszki do prania (Na
2
CO
3
) i sole do kąpieli.
Alkohole są stosowane jako rozpuszczalniki (metanol, etanol), ekstrakty, leki (etanol),
kosmetyki (glicerol), płyn do chłodnic (etanodiol).
Estry stosuje się do produkcji artykułów spożywczych, kosmetyków, leków, mydła oraz
ś
rodków owadobójczych.
Pobieranie próbek do badań analitycznych
Pobieranie próbek ma na celu uzyskanie niewielkiej ilości substancji, która reprezentuje
wszystkie właściwości badanej partii materiału Pobieranie próbek jako etap analizy, nawet
przeprowadzone według wszelkich prawideł, jest zawsze obarczone największym błędem
w całym łańcuchu czynności analitycznych. Wynika to z różnorodności składników
materiałów pobieranych, których struktura czy skład mogą się zmieniać w dużym zakresie
w wyniku procesów fizycznych, chemicznych i biologicznych. Błędy przy pobieraniu próbek
można zwykle zminimalizować, pobierając próbki o dużej masie lub objętości i dokładnie je
rozdrabniając.
Operacje związane z tym etapem mogą w sposób znaczący wpłynąć na wynik końcowy
oznaczenia. Sposób pobierania próbek jest określany normami. W normach określa się nie
tylko wielkość pobieranych próbek, ale także sposób ich pobrania, a także przyrządy, jakimi
próbki powinny być pobrane.
Z partii produktu (ilość substancji tego samego rodzaju) pobiera się próbki pierwotne.
Z wielu próbek pierwotnych, po zmieszaniu, uzyskujemy próbkę ogólną. Z próbki ogólnej, po
jej dobrym wymieszaniu i ewentualnym rozdrobnieniu, odrzuca się część substancji,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
a pozostałość stanowi próbkę laboratoryjną (dawniej zwaną średnią). Z niej pobieramy próbkę
analityczną i przeprowadzamy analizę (zgodnie z odpowiednią normą).
Próbki substancji stałych najlepiej pobierać bezpośrednio z urządzeń transportujących lub
przesypujących substancję, w sposób ciągły lub w określonych odstępach czasu. Do
pobierania próbek stosuje się różnego rodzaju próbniki (zgłębniki) z materiału odpornego na
działanie chemiczne pobieranej substancji.
Próbki substancji ciekłych najłatwiej jest pobierać bezpośrednio z rurociągu dzięki
odpowiednim zaworom. Po otworzeniu zaworu należy spuścić pewną ilość cieczy, zgodnie
z normą, i dopiero potem podstawić właściwe naczynie w celu pobrania próbki (nie jest to
konieczne, gdy ciecz jest jednorodna). Z beczek, cystern i zbiorników pobiera się próbki
cieczy za pomocą specjalnych rur zgłębnikowych, pipet lub butelek.
Próbki substancji gazowych pobiera się najczęściej z rurociągu w sposób ciągły lub
wyrywkowy. Sposób ciągły polega na pobieraniu substancji w ciągu dłuższego, określonego
czasu, np. 24 godzin.
Zasady pobierania próbek według normy ISO 17025:
–
pobieranie próbek powinno przebiegać według ustalonego planu, opartego na metodach
statystycznych,
–
należy stosować system identyfikacji próbek i obiektów badań za pomocą dokumentów
lub przez odpowiednie oznakowanie,
–
powinny istnieć procedury dotyczące transportu, przyjmowania, identyfikacji,
przechowywania i pozbywania się obiektów badań, zapewniające niezmienność
właściwości materiału.
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jaki pierwiastek chemiczny jest podstawą zielonej dekoracji na wyrobach ceramicznych?
2. Jaką rolę odgrywają pierwiastki stosowane w przemyśle ceramicznym?
3. Jak dzielimy jony występujące w szkłach ceramicznych?
4. Czym pokrywa się wyroby ceramiczne w celu wzmocnienia?
5. Jakie są najważniejsze związki chemiczne krzemu?
6. Jakie znasz tworzywa ceramiczne?
7. Jaką rolę odgrywają podstawowe dla przemysłu chemicznego związki nieorganiczne
i organiczne?
8. Jakie znasz rodzaje próbek?
4.2.3. Ćwiczenia
Ćwiczenie 1
Na podstawie tabeli 3 „Rola pierwiastków w szkliwach ceramicznych” zamieszczonej
w Poradniku dla ucznia przygotuj podział na trzy zasadnicze grupy pierwiastków
(wprowadzanych do szkliw najczęściej w postaci tlenków) używanych w szkłach.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać tekst z Poradnika ucznia podany w temacie ćwiczenia,
2) przeanalizować tabelę 3 z Poradnika ucznia,
3) przygotować w zeszycie zadany w ćwiczeniu podział pierwiastków,
4) zaprezentować wykonane ćwiczenie.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
Wyposażenie stanowiska pracy:
–
literatura zgodna z punktem 6 Poradnika dla ucznia.
Ćwiczenie 2
Rozpoznaj i omów wybrane tworzywa ceramiczne – wskaż ich zastosowanie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z właściwą treścią podręcznika,
2) zapoznać się z literaturą wskazaną przez nauczyciela,
3) obejrzeć zgrupowane tworzywa ceramiczne,
4) nazwać tworzywa ceramiczne,
5) sporządzić krótką notatkę o każdym z nich,
6) wskazać przydatność tworzyw ceramicznych,
7) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−
eksponaty z tworzywami ceramicznymi, albumy, zdjęcia,
−
literatura zgodna z punktem 6 Poradnika dla ucznia.
Ćwiczenie 3
Określ, przydatność związków nieorganicznych i organicznych na potrzeby przemysłu
Połącz w logiczne pary i uzupełnij tabelę.
Związek chemiczny
Związek chemiczny
1.
Wodorotlenek sodu NaOH
A.
Do produkcji artykułów spożywczych, kosmetyków, leków, mydła,
ś
rodków owadobójczych.
2.
Kwas siarkowy(VI)
B.
Są stosowane jako rozpuszczalniki (metanol, etanol), leki (etanol),
kosmetyki (glicerol), płyn do chłodnic (etanodiol).
3.
Chlorek sodu NaCl
C.
Do produkcji środków piorących, materiałów wybuchowych,
nawozów mineralnych, barwników, leków, akumulatorów, nafty,
olejów, smarów.
4.
Alkohole
D.
Jako przyprawy w gospodarstwie domowym.
5.
Estry
E.
Do produkcji papieru, szkła barwników, mydła, w chemii
budowlanej, w przemyśle cukierniczym.
Związek chemiczny
1.
2.
3.
4.
5.
Zastosowanie
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować opisy związków nieorganicznych i organicznych,
3) wyszukać charakterystyczne informacje o związkach podanych w tabeli,
4) dobrać w pary: związek chemiczny – zastosowanie
5) uzupełnić zapis w tabeli,
6) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−
arkusz z zadaniem,
−
literatura zgodna z punktem 6 Poradnika dla ucznia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak Nie
1) wskazać, który pierwiastek chemiczny jest podstawą zielonej dekoracji na
wyrobach ceramicznych?
2) wskazać, który pierwiastek chemiczny jest podstawą czerwonej dekoracji na
fajansie?
3) objaśnić rolę pierwiastków stosowanych w przemyśle ceramicznym?
4) wymienić rodzaje jonów występujących w szkliwach ceramicznych?
5) określić, na co wpływają modyfikatory?
6) określić, czym pokrywamy wyroby ceramiczne?
7) wskazać najważniejsze związki chemiczne krzemu?
8) wskazać podstawowe dla przemysłu związki nieorganiczne i organiczne?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
4.3. Reakcje chemiczne
4.3.1. Materiał nauczania
Wokół nas bezustannie zachodzą najrozmaitsze przemiany. Jedne z nich zaliczamy do
zjawisk fizycznych. Są to np. parowanie i skraplanie się wody. Zjawiska fizyczne nie
wywołują trwałych zmian we właściwościach substancji.
Inaczej wygląda sprawa z przemianami chemicznymi zwanymi częściej reakcjami
chemicznymi. Reakcje chemiczne są to przemiany, w czasie których z jednych substancji
powstają inne, o odmiennych właściwościach. Substraty i produkty reakcji łącznie nazywa się
reagentami.
Rys. 9. Równanie reakcji chemicznej – zapis przebiegu reakcji chemicznej [2, s. 159]
Reakcje rozkładu (analizy) są to reakcje, w których z jednej substratu powstaje dwa lub
więcej produktów.
2 KClO
3
→
2
KCl
+
4 O
2
Reakcje łączenia (syntezy) są to reakcje, w których z dwóch lub więcej substratów
powstaje jeden produkt.
2 P + 5 O
2
→ 2 P
2
O
5
3 Fe + 2 O
2
→
Fe
3
O
4
Reakcje wymiany są to reakcje, w wyniku których następuje wymiana składników
między substratami.
Cu + 2 AgNO
3
→ Cu(NO
3
)
2
+ 2 Ag
Tabela 5. Rodzaje rekcji chemicznych [2, s. 159]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
Reakcja cząsteczkowa to reakcja przebiegająca między drobinami elektroobojętnymi
(atomami, cząsteczkami). Najczęściej takie reakcje zachodzą w stanie gazowym:
H
2
+ Cl
2
→2 HCl
Reakcja jonowa to taka, w której przynajmniej jeden z substratów jest jonem. Reakcje
zachodzą między dwoma jonami, miedzy atomem i jonem, między cząsteczką i jonem:
H
+
+ OH
-
→ H
2
O
Zn + 2 H
+
→ Zn
2+
+ H
2
↑
NH
3
+ H
+
→ NH
4
+
Reakcje egzoenergetyczne i endoenergetyczne
Jednym z objawów wielu reakcji jest ogrzewanie się otoczenia, a często też rozżarzenie
i świecenie reagentów. Reagenty biorące udział w danej reakcji nazywamy układem
a otaczającą je przestrzeń nazywamy otoczeniem.
Reakcje chemiczne, którym towarzyszy przekazywanie energii z układu do otoczenia na
sposób ciepła i na sposób pracy nazywamy reakcjami egzoenergetycznymi.
Reakcje chemiczne, którym towarzyszy przekazywanie energii z otoczenia do układu
nazywamy reakcjami endoenergetycznymi.
Przykład:
2 H
2
+ O
2
→ 2H
2
O
Tabela 5. Informacje, których dostarcza równanie reakcji chemicznej [2, s. 160]
Fizyczne czynniki wpływające na szybkość reakcji
Wokół nas przebiega wiele różnych reakcji chemicznych. Łatwiej jest zauważyć reakcje
szybkie, takie jak np. reakcje spalania, niż reakcje powolne.
Szybkość reakcji określamy jako ubytek ilości molekuł substratów albo przyrost ilości
molekuł produktów w jednostce czasu.
Z obserwacji codziennych wiemy także, że nie tylko wstępne dostarczenie energii
wpływa na szybkość reakcji. Reakcje biegną szybciej w podwyższonej temperaturze. Stężenie
reagentów ma także wpływ na szybkość reakcji. Rozdrobnienie ma również wpływ na
szybkość reakcji. Oprócz temperatury, stężenia i powierzchni międzyfazowej, na szybkość
reakcji mogą mieć wpływ: promieniowanie elektromagnetyczne, rodzaj rozpuszczalnika,
ciśnienie, obecność katalizatorów i inhibitorów.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Czym różni się reakcja chemiczna od przemiany fizycznej?
2. Co nazywamy reagentami?
3. Czym charakteryzują się reakcje: rozkładu, łączenia, wymiany?
4. Co towarzyszy reakcjom egzoenergetycznym i endoenergetycznym?
5. Jakie czynniki fizyczne wpływają na szybkość reakcji?
4.3.3. Ćwiczenia
Ćwiczenie 1
Dobierz współczynniki w poniższych równaniach zgodnie prawem zachowania masy
i określ, do jakiego typu należą reakcje:
Mg + O
2
→
Mg O
CaCO
3
→
Ca O + CO
2
H
2
+ O
2
→
H
2
O
Fe
2
O
3
+
Al
→
Al
2
O
3
+
Fe
HgO
→
Hg + O
2
Na OH + H
2
SO
4
→
Na
2
SO
4
+
H
2
O
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować zapisy równań chemicznych,
3) podjąć decyzje o prawidłowym uzupełnieniu współczynników stechiometrycznych,
4) wpisać w wolne kratki odpowiednie współczynniki stechiometryczne,
5) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−
zeszyt.
Ćwiczenie 2
Określ wpływ czynników fizycznych na szybkość reakcji chemicznych. Przy każdym
z nich podaj uzasadnienie. Wpisz do rubryki, „Wpływ na szybkość” jeden z dwóch
wybranych wyrazów: zwiększa lub zmniejsza.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Tabela do ćwiczenia 2
Czynnik
Wpływ na szybkość
Uzasadnienie
Ogrzewanie
Rozdrabnianie
Zatężanie mieszaniny reakcyjnej
Chłodzenie substratu
Rozcieńczanie mieszaniny reakcyjnej
Wzrost ciśnienia
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować zawartość tabeli,
3) podjąć decyzje o prawidłowym uzupełnieniu,
4) uzupełnić tabelę,
5) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−
zeszyt.
Ćwiczenie 3
Uzupełnij rozwiązanie zadania:
Jak zmieni się szybkość reakcji: a) po ogrzaniu o 40
o
C, b) po ochłodzeniu o 40
o
C, jeżeli
zmiana temperatury o każde 10
o
C powoduje 2,5 – krotną zmianę szybkości reakcji?
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować zawartość zadania,
3) podjąć decyzje o prawidłowym rozwiązaniu,
4) uzupełnić rozwiązanie zadania,
5) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−
zeszyt.
4.3.4. Sprawdzian postępów
Czy potrafisz?
Tak
Nie
1) wyjaśnić, na czym polega reakcja łączenia (syntezy)?
2) wyjaśnić, na czym polega reakcja rozkładu (analizy)?
3) wyjaśnić, na czym polega reakcja wymiany ?
4) wyjaśnić
różnice
pomiędzy
reakcjami
egzoenergetycznymi
i endoenergetycznymi?
5) wymienić fizyczne czynniki wpływające na szybkość reakcji?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
4.4.
Mieszaniny, roztwory, koloidy
4.4.1. Materiał nauczania
Wiadomości wstępne
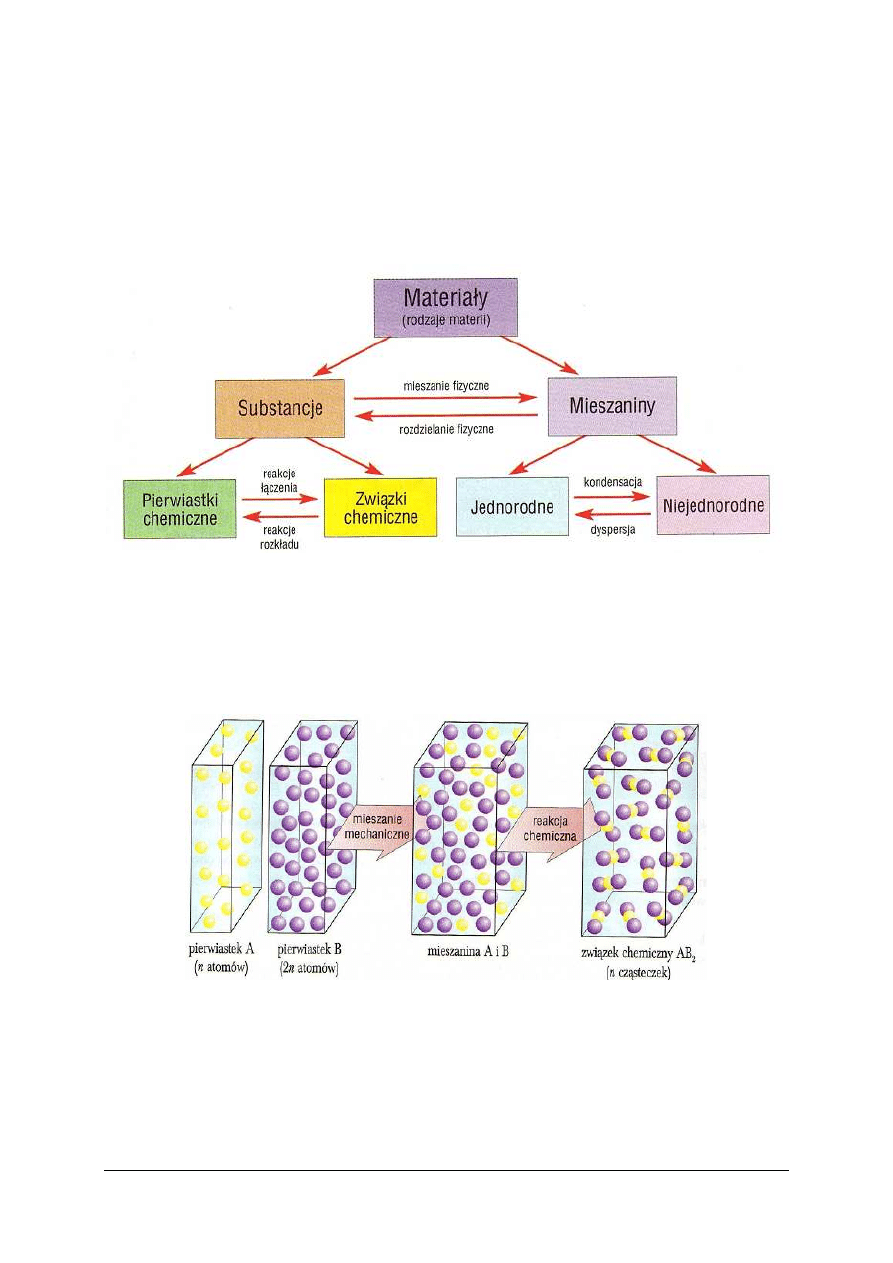
Materiały, czyli rodzaje materii spotykane w naszym otoczeniu i w przyrodzie, są
substancjami lub mieszaninami substancji (rys. 10).
Rys. 10. Podział materiałów i procesy powodujące wzajemne przekształcanie ich rodzajów [5, s. 25]
Mieszaniny dzieli się na jednorodne i niejednorodne. Cechą mieszaniny jednorodnej,
zwanej roztworem, jest to, że jej składników nie można rozróżnić wzrokowo. Różnice między
mieszaniną i związkiem chemicznym w ujęciu mikroskopowym ilustruje. Mieszanina składa
się z drobin co najmniej dwóch substancji w dowolnym stosunku. Związek chemiczny jest
zbiorem drobin.
Rys. 11. Powstanie mieszaniny A i B a następnie związku chemicznego typu AB
2
z pierwiastków, w ujęciu
atomowo-cząsteczkowym (A+2B→AB
2
) [5, s. 26]
Zmiany stanów skupienia
W ciałach stałych drobiny są uporządkowane wzdłuż linii prostych z zachowaniem
stałych odległości między środkami drobin. Drobiny znajdują się tak blisko siebie, że się
stykają. Taki układ nazywamy siecią krystaliczną. Drobiny tworzące sieć wykonują ruchy
drgające, tzn. ich środki oddalają się od pewnego punktu w różnych kierunkach i wracając

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
wciąż przez ten punkt przechodzą. Nie mogą jednak przemieszczać się w inne rejony
kryształu, jak to się dzieje w cieczach i gazach.[5]
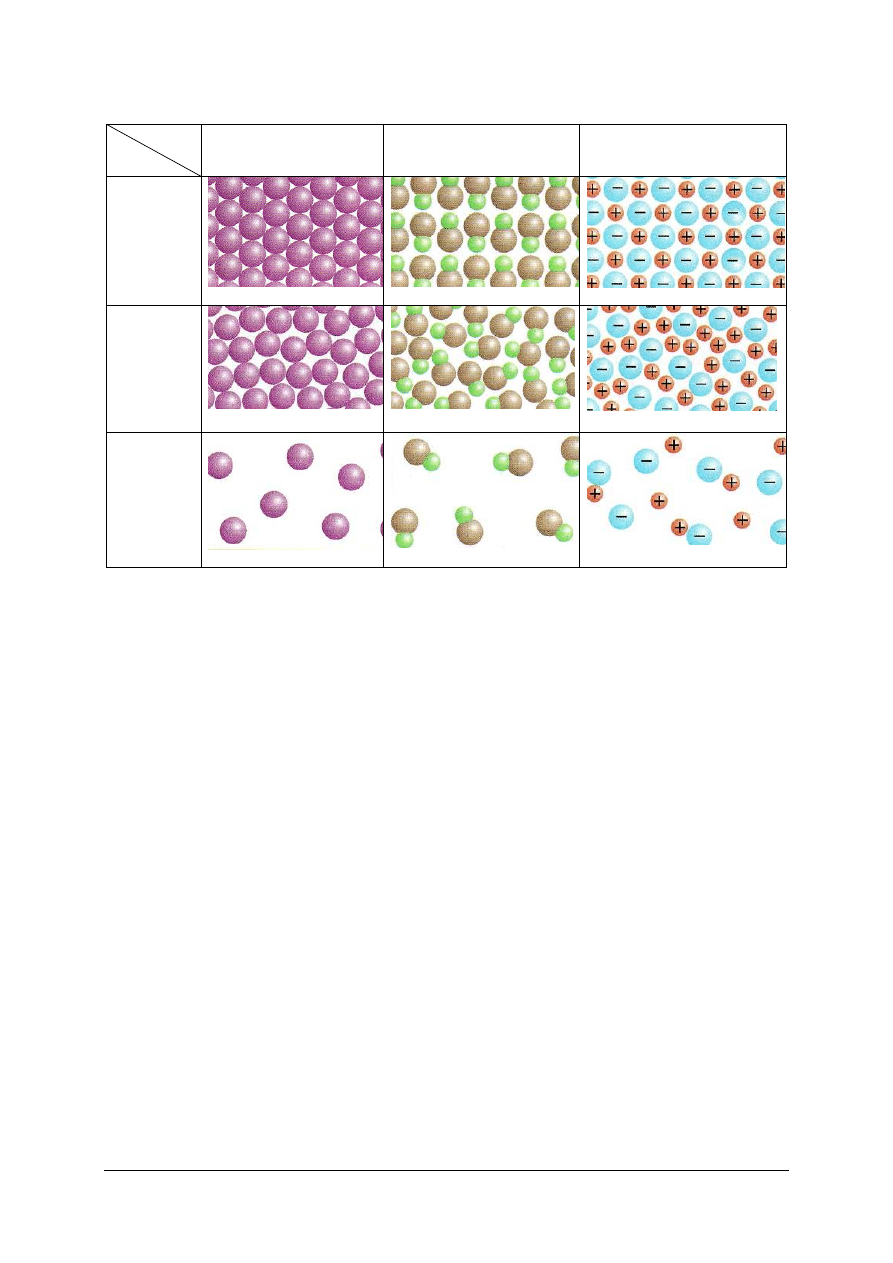
Sieć krystaliczna, w zależności od rodzaju wiązań, może być zbudowana z:
−
atomów (atomowa sieć krystaliczna) – punkt a) w tabeli 6,
−
cząsteczek (cząsteczkowa sieć krystaliczna) – punkt b) w tabeli 6,
−
jonów (jonowa sieć krystaliczna) – punkt c) w tabeli 6.
Podczas ogrzewania ciała stałego drobiny drgają coraz szybciej. Rośnie energia kinetyczna
ich ruchu drgającego. Po osiągnięciu temperatury topnienia, charakterystycznej dla danej
substancji, drobiny opuszczają sieć. Zjawisko to rozpoczyna się na powierzchni kryształu,
obejmuje coraz głębsze warstwy, w miarę ich odsłaniania, i prowadzi do zniszczenia całej sieci
krystalicznej. Proces ten nazywa się topnieniem, a jego rezultatem jest przekształcenie ciała
stałego w ciecz. Strukturę drobinową ilustruje tabela 6. Podczas topnienia każdy rodzaj sieci
krystalicznej rozpada się na takie drobiny, z jakich się składa. Tak więc stopione substancje
jonowe nie zawierają cząsteczek, lecz oddzielne kationy i aniony.
Drobiny w cieczach znajdują się prawie tak samo blisko siebie, jak w ciałach stałych.
Wykonują nieustannie różne ruchy, przemieszczając się i obracając równocześnie. Powoduje
to zderzenia między drobinami oraz ze ściankami naczynia. W konsekwencji drobiny mogą
wędrować nawet z jednego końca naczynia w drugi.
Ochładzanie cieczy prowadzi do stopniowego zmniejszenia się energii kinetycznej
drobin, a po osiągnięciu odpowiednio niskiej temperatury, czyli temperatury krzepnięcia
(równej temperaturze topnienia), zaczyna się ponowne tworzenie sieci krystalicznej. Najpierw
powstaje mały zarodek, który stopniowo się powiększa.
Podczas ogrzewania cieczy drobiny poruszają się coraz szybciej. Rośnie energia
kinetyczna wszystkich ich ruchów. Niektóre drobiny, znajdujące się na powierzchni ciecz, te
które osiągnęły dostatecznie dużą energię, „wyskakują” i poruszają się nad powierzchnią
cieczy. Jest to proces parowania, który zachodzi w każdej temperaturze, ale z różną
intensywnością, tym większą, im wyższa jest temperatura i większa powierzchnia cieczy. Po
ogrzaniu cieczy do temperatury wrzenia, charakterystycznej dla danej substancji, i zależnej od
ciśnienia, rozpoczyna się proces wrzenia, czyli parowania w całej objętości. Tworzące się
wewnątrz cieczy pęcherzyki pary wypływają na powierzchnię. W rezultacie cała ciecz
stopniowo przekształca się w stan lotny.
W stanie gazowym odległości między drobinami są znacznie większe niż w stanach
skondensowanych (czyli w cieczach i ciałach stałych), przy czym zależą od ciśnienia. Na
przykład w powietrzu atmosferycznym odległość między poszczególnymi drobinami (O
2
, N
2
,
Ar, itd.) jest rzędu kilkudziesięciu średnic tych drobin a więc znacznie większa niż pokazana
na modelach w tabeli 6. Każda drobina porusza się z szybkością rzędu setek lub tysięcy
metrów na sekundę, po linii prostej, aż zderzy się z inną drobiną lub ze ścianką naczynia.
W ciągu sekundy każda drobina ulega miliardom zderzeń. Na skutek zderzenia zmienia
kierunek i szybkość.
Przy przejściu ze stanu ciekłego do gazowego struktura drobin zostaje zachowana,
aczkolwiek niektóre substancje ulegają rozkładowi chemicznemu jeszcze przed osiągnięciem
stanu wrzenia lub równocześnie z nim. Pewną ciekawostką jest obecność, w stanie lotnym
związków jonowych, niewielkiej liczby par jonowych np. Na
+
Cl
--
, czyli cząsteczek NaCl
punkt i) w tabeli 6 wśród przeważającej liczby poruszających się niezależnie kationów Na
+
i anionów Cl
-
.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
Tabela 6. Ziarnistość materii a stany skupienia [5, s. 33]
Materiał
Stan
skupienia
Pierwiastek chemiczny
stanowiący zbiór atomów
Kowalencyjny związek
chemiczny typu AB
Jonowy związek chemiczny
typu AB
Stały
a)
b)
c)
Ciekły
d)
e)
f)
Gazowy
g)
h)
i)
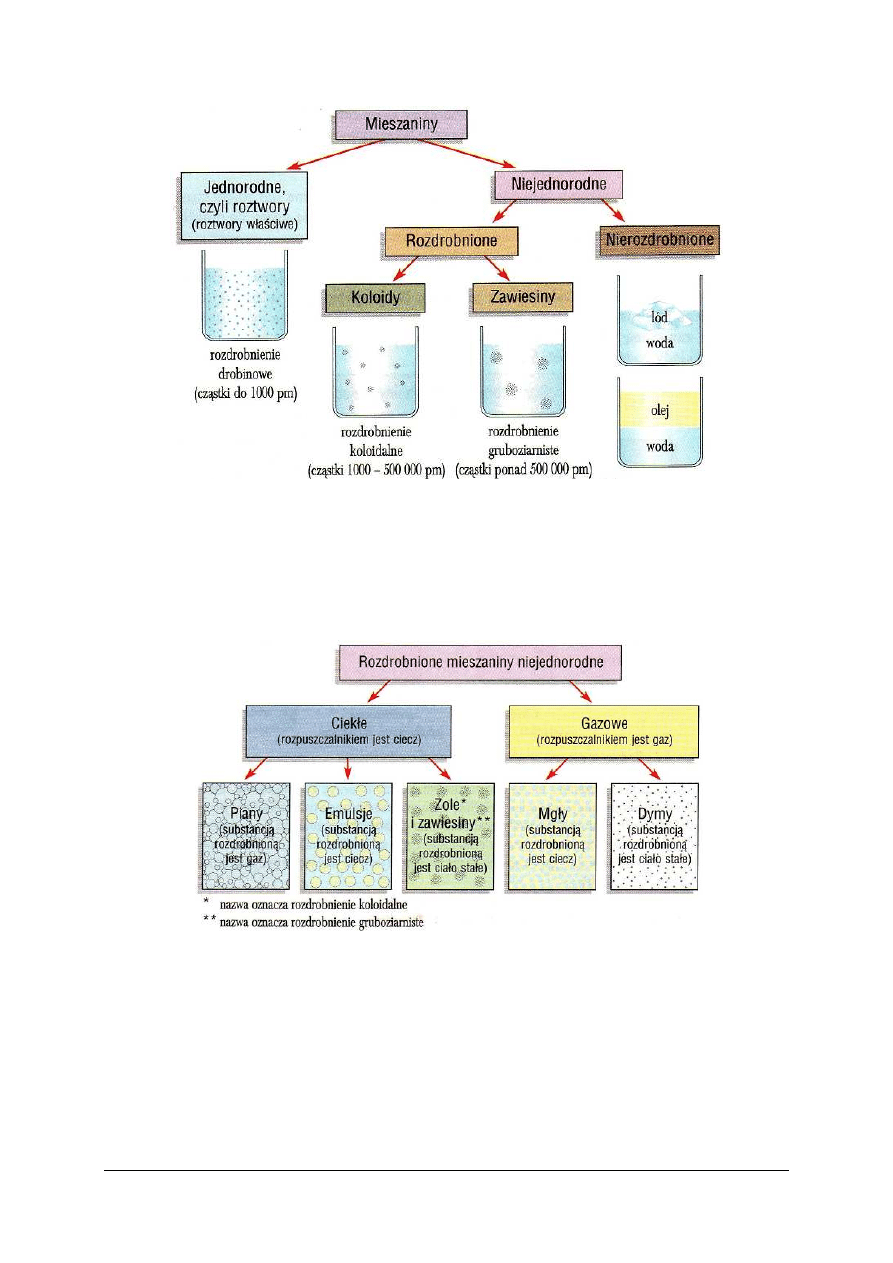
W zależności od wielkości fragmentów rozdrobnionych, czyli od stopnia rozdrobnienia,
rozróżnia się trzy rodzaje mieszanin. Pierwszy to roztwory. Drugi rodzaj mieszanin
rozdrobnionych to koloidy (to mieszanina niejednorodna o rozdrobnieniu koloidalnym.
Koloidu nie da się rozdzielić przez sączenie. Trzecim rodzajem mieszanin rozdrobnionych są
zawiesiny (mieszanina niejednorodna o rozdrobnieniu gruboziarnistym). Mieszaniny różnią
się: liczbą składników, zawartością ilościową poszczególnych składników, jednorodnością
(stopniem rozdrobnienia), liczbą faz, stanem skupienia.
Mieszanina jednorodna jest nazywana roztworem. Termin roztwór kojarzy się z ciekłym
stanem skupienia. Większość roztworów to ciecze, jednak znane są roztwory w stanie
gazowym (na przykład powietrze – mieszanina tlenu, azotu i kilku innych gazów) czy nawet
stałym (na przykład mosiądz – roztwór cynku w miedzi oraz inne stopy).
Sporządzanie mieszanin
Proces mieszania składników, prowadzący do otrzymania roztworu, nazywa się
rozpuszczaniem. Rozróżnia się rozpuszczanie cieczy w cieczy, gazu w cieczy, rozpuszczanie
ciała stałego w cieczy.
Roztwór nasycony to roztwór, którego stężenie nie ulega zmianie po wprowadzeniu
kryształu substancji rozpuszczanej. Roztwór nienasycony to można rozpuścić więcej
substancji niż rozpuszczono. Rozpuszczalność to masa substancji (najczęściej liczba
gramów), jaka jest potrzebna do nasycenia 100 g rozpuszczalnika w danej temperaturze.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
Rys. 12. Podział mieszanin ze względu na stopień rozdrobnienia [5, s. 109]
Układy, w których faza rozproszona występuje w rozdrobnieniu od 1 do 200 nm noszą
nazwę koloidów (gr. kolla – klej). Mogą one występować we wszystkich stanach skupienia,
tzn. zarówno faza rozpraszająca, jak też rozproszona może być gazem lub substancją stałą.
Układy koloidalne, w których fazą rozpraszającą jest ciecz a fazą rozproszoną –
substancja stała, nazywamy zolami.
Rys. 13. Podział rozdrobnionych mieszanin niejednorodnych ze wzglądu na stan skupienia rozpuczalnika [5, s. 110]
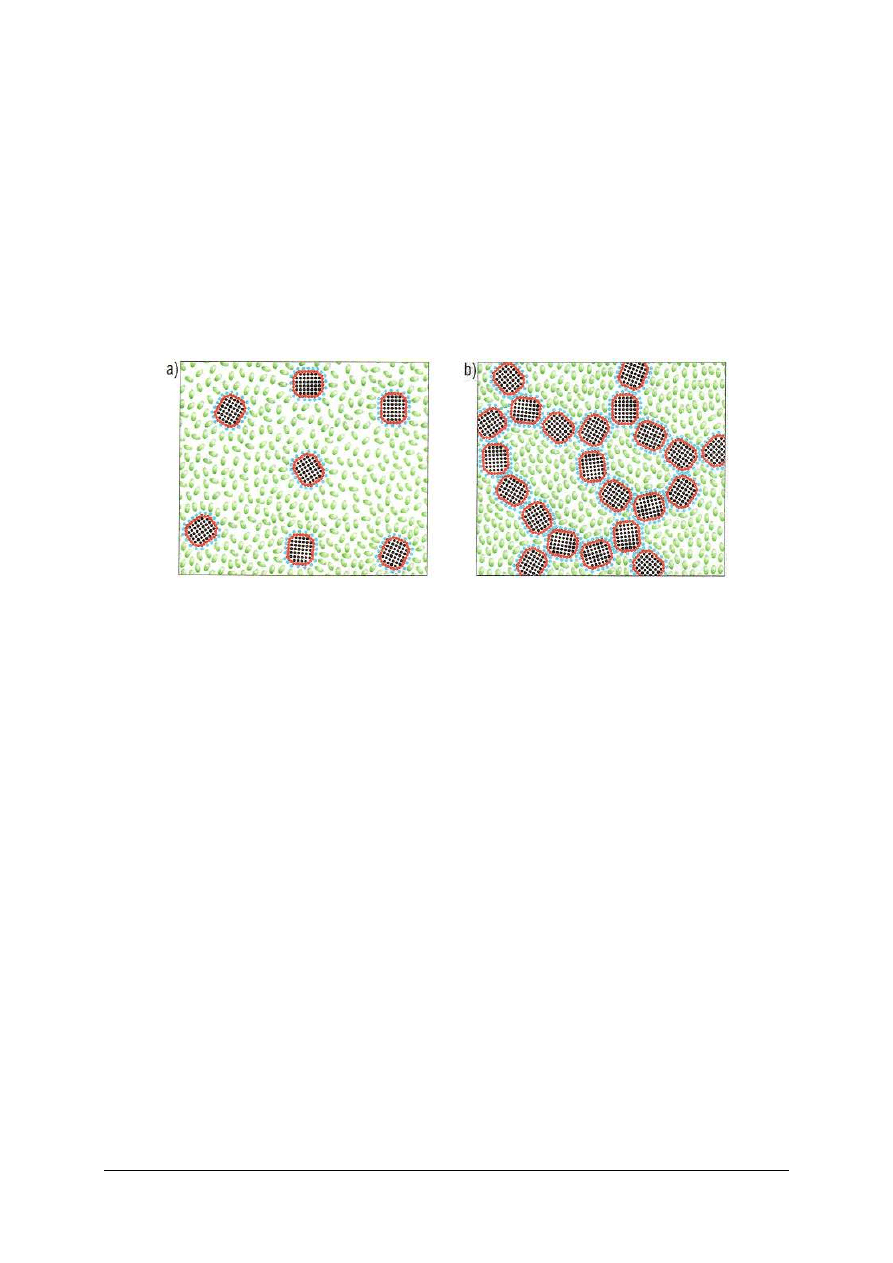
Koagulacja i peptyzacja koloidów
Koagulacją nazywamy proces polegający na zbijaniu się cząstek koloidalnych w większe
agregaty, co prowadzi do opadania ich pod wpływem działania siły ciężkości.
Koagulację (żelifikację) zolu powodują:
−
dodatek odpowiedniej ilości elektrolitu,
−
wprowadzenie innego koloidu,
−
ogrzewanie zolu.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
Najczęściej koagulację koloidów hydrofobowych przeprowadza się przez dodatek
elektrolitu.
Ogólne warunki koagulacji zolu:
−
dodanie elektrolitu o odpowiednim stężeniu,
−
wytrącenie koloidu nie następuje przy użyciu elektrolitu poniżej pewnej minimalnej
ilości zwanej progiem koagulacji,
−
koagulację powoduje jon o znaku przeciwnym niż cząstka koloidu.
Peptyzacja jest to proces odwrotny do koagulacji, czyli proces przeprowadzenia w zol
skoagulowanego osadu koloidu. W ceramice wykorzystujemy te zjawiska w procesie
peptyzacji (upłynniania) glin, których ujemnie naładowane cząstki peptyzują pod wpływem
działania zasad, np. NaOH.
Rys. 14. Modele: a) zolu, b) żelu. Jedna z możliwych struktur cząstek koloidalnych to jądro stanowiące
mikrokryształ zawierający około 1000 lub więcej drobin. Na zewnątrz jądra tworzy się warstwa
cząsteczek rozpuszczalnika lub jonów jednego znaku, a na niej kolejna warstwa jonów przeciwnego
znaku [5, s. 117]
Zjawisko tiksotropii
W układzie glina – woda znajduje się około 2/3 cząsteczek gliny w postaci zawiesiny,
a około 1/3 w postaci koloidu. Wiele układów glina – woda wykazuje zjawisko tiksotropii.
Tiksotropią nazywamy odwracalny, izotermiczny (w stałej) temperaturze proces
przemiany żelu w zol pod wpływem bodźców mechanicznych, takich jak: mieszanie,
wstrząsy, drgania. Po ustaniu działania czynników mechanicznych zole z powrotem
przechodzą w żel.
Upłynnianie mas ceramicznych
Masy ceramiczne to odpowiednio dobrane (jakościowo i granulometrycznie) zestawy
surowców ceramicznych i wody (lub innego lepiszcza), które w procesie przerobu
technologicznego uzyskują stan nadający się do formowania.
Proces technologiczny jest to szereg odpowiednio dobranych operacji jednostkowych
pozwalających na uzyskanie z surowców gotowego produktu lub półproduktu
o zaplanowanych właściwościach; np. masy ceramiczne wymagają wstępnego przygotowania
surowców, mielenia, mieszania, homogenizacji dołowania, odpowietrzenia, nawilżania itp.
Do najprostszych i najczęściej używanych konsystencji mas ceramicznych w procesie
formowania należą:
−
masy sypkie (formowanie przez prasowanie w prasach),
−
masy plastyczne (formowane ręcznie lub mechanicznie, np. garncarstwo),
−
masy lejne (gęstwy, leiwa) formowanie przez odlewanie w formach gipsowych lub
innych.
Upłynniacze to substancje zdolne do obniżenia lepkości gęstwy przy stałej ilości wody.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
Są to najczęściej elektrolity lub związki organiczne zawierające grupy aktywne (tabela 7).
Najogólniej stwierdzić można, że przez upłynnienie masy ceramicznej rozumiemy
uzyskanie odpowiedniej technologicznie płynności masy przy minimalnej ilości wody przez
dodanie substancji upłynniającej (często elektrolitu w postaci węglanu sodu lub szczawianu
sodu).
Tabela 7. Zestawienie różnych substancji upłynniających
Upłynniacze nieorganiczne
Upłynniacze organiczne
i preparaty mieszane
Nazwa
Wzór
Nazwa handlowa
Węglan sodu (soda bezwodna)
Na
2
CO
3
dwuetyloamina
Węglan sodu krystaliczny (soda
krystaliczna)
Na
2
CO
3 ·
10H
2
O
dwu-n-propylomina
Wodorotlenek sodu (soda kaustyczna)
NaOH
jedno-n-propyloamina
Krzemian sodu (szkło wodne) –
najlepsze wyniki
Na
2
O · nSiO
2 ,
n = 1-6
przy n = 3,3
jednoetyloamina
Pirofosforan czterosodowy
Na
4
P
2
O
7
trójetyloamina
Heksametafosforan sodu (tetrafosforan
sodu)
Na
6
P
4
O
13
jedno-n-butoamina
Metalglinian sodu
Na
2
O
.
Al
2
O
3
(NaAlO
2
)
pirydyna
Szczawian sodu
Na
2
C
2
O
4
piperydyna
Szczawian amonu
(NH
4
)
2
C
2
O
4 ·
H
2
O
etyloamina
Wodorotlenek litu
LiOH
poliwinyloamina
Węglan litu
Li
2
CO
3
pantarin
Glinian litu
LiAlO
2
formaldehyd
Cytrynian litu
Li
3
C
6
H
5
O
7 s
·
4H
2
O
Formsil A i S, dispex
4.4.2.Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Co rozumiesz pod pojęciem stany skupienia materii?
2. Jakie są różnice między mieszaninami, roztworami i układami koloidalnymi?
3. Jakie cechy fizyczne?
4. Co to jest tiksotropia?
5. Co to jest koagulacja?
6. Na czym polega proces ppatyzacji?
4.4.3.Ćwiczenia
Ćwiczenie 1
Przygotuj mieszaninę granulatu według receptury roboczej. Mieszaninę przygotuj
w młynku laboratoryjnym.
Tabela 1 do ćwiczenia 1. Receptura robocza
Składnik
Ilość
Uziarnienie
Techniczny tlenek glinu
0,3 kg
0–0,05 mm
Elektrokorund
0,7 kg
0,5–1 mm
Woda
50 cm
3
–

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować przebieg ćwiczenia,
3) przygotować niezbędny sprzęt laboratoryjny,
4) zapoznać się z instrukcją obsługi młynka,
5) sprawdzić stan techniczny młynka,
6) przygotować środki ochrony indywidualnej,
7) sprawdzić stan techniczny wagi,
8) odważyć surowce zgodnie z recepturą,
9) przygotować masę w młynku laboratoryjnym, zgodnie z instrukcją stanowiskową obsługi
urządzenia,
10) mieszać składniki na masę, aż uzyska się jednorodność masy,
11) skontrolować organoleptycznie jednorodność masy,
12) przenieść gotową masę z młynka do zbiornika na masę,
13) zabezpieczyć masę przed utratą wilgoci,
14) oczyścić sprzęt i uporządkować stanowisko pracy,
15) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−
zeszyt,
−
surowce,
−
młynek laboratoryjny,
−
instrukcja obsługi młynka,
−
instrukcja stanowiskowa,
−
waga laboratoryjna
−
instrukcja obsługi wagi,
−
ś
rodki ochrony indywidualnej,
−
zbiornik na masę,
−
sprzęt laboratoryjny.
Ćwiczenie 2
Przygotuj 1 litr 30% roztworu sody. Jako rozpuszczalnika użyj wody destylowanej.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować przebieg ćwiczenia,
3) przygotować niezbędny sprzęt laboratoryjny,
4) przygotować środki ochrony indywidualnej,
5) sprawdzić stan techniczny wagi,
6) odważyć sodę zgodnie z recepturą,
7) sporządzić roztwór zgodnie z procedurą,
8) oczyścić sprzęt i uporządkować stanowisko pracy,
9) zaprezentować wykonane ćwiczenie.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
Wyposażenie stanowiska pracy:
−
zeszyt,
−
surowce,
−
waga laboratoryjna
−
instrukcja obsługi wagi,
−
ś
rodki ochrony indywidualnej,
−
zbiornik na sodę,
−
sprzęt laboratoryjny.
Ćwiczenie 3
Połącz nazwy i wzory upłynniaczy nieorganicznych.
Nazwa
Wzór
1.
Węglan sodu (soda bezwodna)
A.
LiOH
2.
Węglan sodu krystaliczny (soda krystaliczna)
B.
Li
2
CO
3
3.
Wodorotlenek sodu (soda kaustyczna)
C.
Na
2
C
2
O
4
4.
Pirofosforan czterosodowy
D.
Na
2
CO
3 ·
10H
2
O
5.
Szczawian sodu
E.
NaOH
6.
Wodorotlenek litu
F.
Na
2
CO
3
7.
Węglan litu
G. Na
4
P
2
O
7
Nazwa
1
2
3
4
5
6
7
Wzór
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować zestawienie upłynniaczy,
3) połączyć nazwy i wzory upłynniaczy,
4) uzupełnić tabelę,
5) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−−−−
zeszyt.
Ćwiczenie 4
Dobierz sprzęt laboratoryjny do realizacji badań i podaj przepisy bhp obowiązujące przy
pracach laboratoryjnych. Sprzęt należy dobrać do wcześniej wykonywanych ćwiczeń 1 i 2.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z właściwą treścią Poradnika dla ucznia,
2) zapoznać się z literaturą wskazaną przez nauczyciela,
3) przygotować sprzęt laboratoryjny,
4) zaprezentować wykonanie ćwiczenia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
Wyposażenie stanowiska pracy:
−
literatura zgodna z punktem 6 Poradnika dla ucznia,
−
sprzęt laboratoryjny,
−
zeszyt.
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcia: stany skupienia, mieszanina, roztwór?
2) scharakteryzować układ koloidalny?
3) wyjaśnić pojęcie koagulacja?
4) określić co powoduje, koagulację ?
5) określić zjawisko peptyzacji?
6) przedstawić zjawisko tiksotropii?
7) wyjaśnić do czego mogą być stosowane upłynniacze?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
4.5. Wybrane pojęcia z krystalochemii
4.5.1. Materiał nauczania
Zadania krystalochemii:
−
badanie struktury kryształów,
−
badanie wpływu rozmieszczenia atomów w kryształach (struktury) i budowy ich osłon
elektronowych na właściwości fizyczne i chemiczne kryształów.
Podstawowe prawa krystalochemii
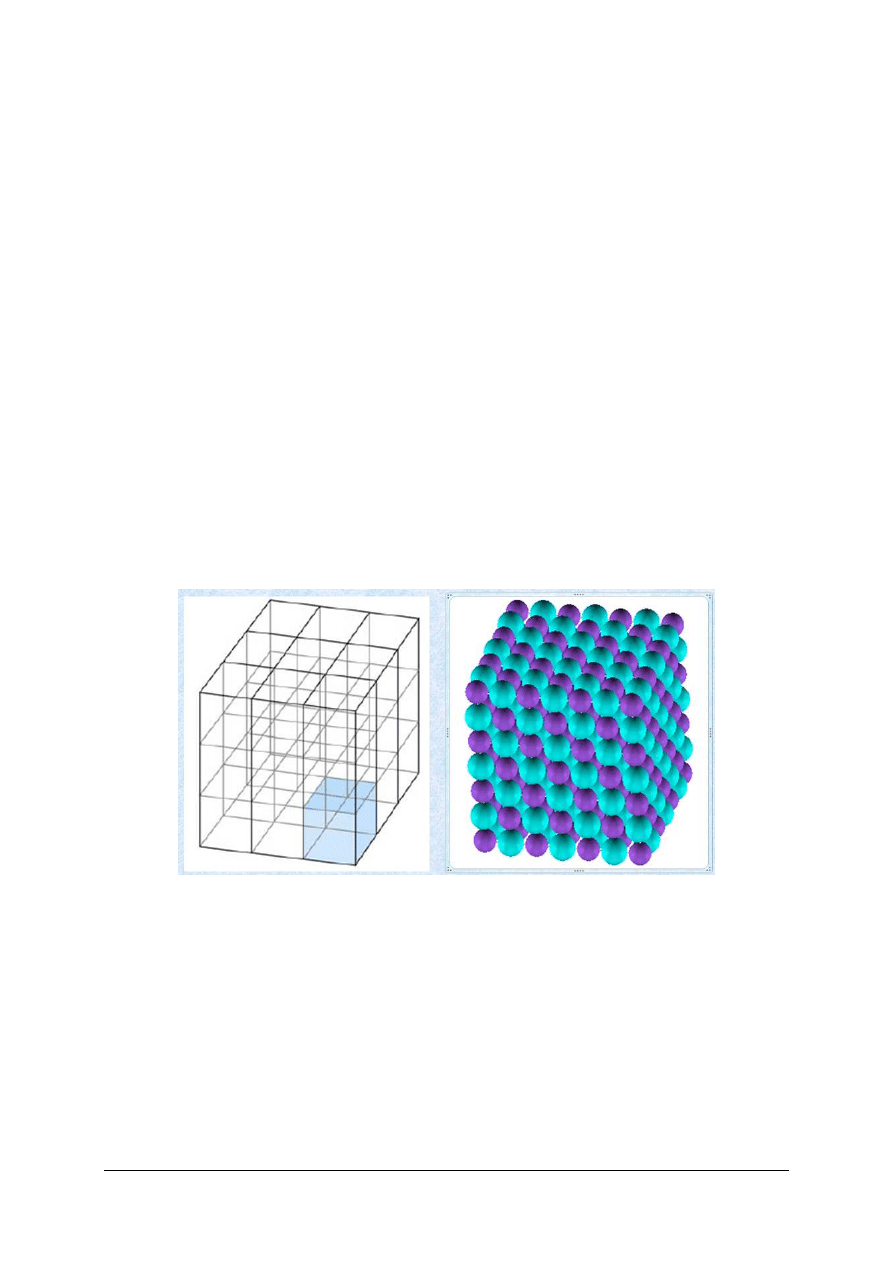
Strukturę kryształów określają [7, s. 35]:
−
stosunki ilościowe poszczególnych elementów struktury (jonów, atomów, cząsteczek),
z których zbudowany jest dany kryształ,
−
stosunki geometryczne elementów struktury,
−
zdolności polaryzacyjne elementów struktury.
Energię sieciową kryształów i związane z nią właściwości fizyczne i chemiczne określają
(rys. 15):
−
stosunki ilościowe poszczególnych elementów,
−
struktura elektronowa elementów budowy,
−
zdolności polaryzacyjne elementów budowy, zależne od budowy powłok elektronowych
i rozmiarów w danych warunkach.
Rys. 15. Sieć przestrzenna a krystaliczna [8]
Kryształem, w ogólnym znaczeniu, nazywamy ugrupowanie przestrzenne atomów, jonów
lub drobin, wykazujące prawidłową okresowość w różnych kierunkach. Jednostką
okresowości jest komórka jednostkowa, która stanowi powtarzający się motyw konstrukcyjny
danego kryształu (rys. 15). Elementami struktury kryształów są atomy, jony, lub cząsteczki.
W interesujących ceramików krzemianach, elementami struktury są najczęściej różne jony
i cząsteczki wody.
Do ciał krystalicznych zaliczamy takie substancje stałe, w których stan uporządkowania
przestrzennego elementów struktury obejmuje znaczne obszary w porównaniu z jednostką
okresowości.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
Często mamy do czynienia z ciałami polikrystalicznymi. Za ciała polikrystaliczne
uważamy takie ciała, które mogą się składać z wielu osobników krystalicznych
(pojedynczych kryształów) oddzielonych od siebie powierzchniami nieciągłości (np. metale,
skały).
Pamiętać należy, kryształy w zasadniczy sposób różnią się od cząsteczek (drobin), które
stanowią wysycony układ zamknięty. Kryształy jako układy niewysycone mogą
w odpowiednich warunkach wzrastać bez ograniczenia, przyłączając dowolną ilość
elementów struktury (rys. 16).
Rys. 16. Kryształ a cząsteczka [8]
Wszystkie znane naturalne i sztuczne kryształy należą do kryształów rzeczywistych.
Kryształy rzeczywiste są niedoskonałe, wykazują wiele wad sieciowych i nieprawidłowości.
Przez kryształ doskonały należy rozumieć kryształ powstały przez idealne powtarzanie
w trzech wymiarach komórki jednostkowej.
Do podstawowych nieprawidłowości powstających w kryształach należą:
−
migracja jonów (wędrówka jonów nieumiejscowionych),
−
rotacja jonów (wirowanie),
−
różnica w „wyposażeniu” lub ułożeniu jonów w poszczególnych komórkach
jednostkowych, przy stałym umiejscowieniu jonów w sieci.
Prawie wszystkie krzemiany są właściwie roztworami stałymi, których skład waha się
w pewnych granicach. Wahają się też w pewnym zakresie właściwości fizyczne uzależnione
przecież od składu chemicznego, ale są to jedynie odchylenia właściwości, a nie skokowa ich
zmiana.
Wady struktury kryształów mogą być w wielu przypadkach wykorzystywane w praktyce
i jakość ich może być wtedy sterowana sztucznie (półprzewodniki). Różne rodzaje wad
sieciowych można wykrywać i badać za pomocą promieni Roentgena oraz przewodnictwa
elektrycznego.
Krzemiany zbudowane są z sieci o koordynacji jonowej. Zatem siły działające w ich sieci
to ogólnie siły zgodne z prawem Coulomba. Nie mają one charakteru skierowanego, lecz są
równomiernie rozłożone kuliście wokół każdego jonu. Jony przyciągają więc do siebie taką
ilość jonów przeciwnego znaku jaka może się wokół nich zmieścić. Dzieje się to

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
w odpowiednich warunkach (np. podczas krystalizacji ochładzanego stopu) i jest ściśle
zależne od tych warunków.
Ułożeniem jonów podczas krystalizacji rządzą ściśle określone zasady. Dla uproszczenia
można przyjąć, że jony dodatnie (kationy) to małe kule, a aniony to kule większe i odległość
między środkami jonów równa się sumie ich promieni przy założeniu zasady najściślejszego
upakowania. Są to promienie rzeczywiste.
Stwierdzono, na podstawie pomiarów (np. rentgenowskich), że wskutek oddziaływania
odpychającego powłok elektronowych jony mają w strukturze sieci nieco większe promienie,
tzn. są od siebie nieco oddalone. Są to tzw. promienie efektywne, które nie mają stałej
wartości.
Liczba koordynacyjna jest to liczba najbliższych elementów struktury (np. jonów)
otaczających dany koordynujący (podporządkowujący je sobie) jon w krysztale np.: krzem
otacza się czterema jonami tlenu więc liczba koordynacyjna dla krzemu wynosi 4 (LK = 4),
a w tym samym przypadku z jonem tlenu sąsiadują jedynie dwa jony krzemu, to dla tlenu
LK = 2. Tak więc dla sieci SiO
2
charakterystyczne są dwie liczby koordynacyjne 4 i 2.
Przewodniki, dielektryki i półprzewodniki
Przewodnikami nazywamy ciała, które przewodzą prąd elektryczny wskutek
uporządkowanego przepływu elektronów w polu przyłożonego napięcia.
Dielektrykami (izolatorami) nazywamy takie ciała, które przeciwstawiają się
uporządkowanemu przepływowi prądu elektrycznego. Należą do nich głównie kryształy
krzemianów, w których warstwy zewnętrzne atomów (jonów) są obsadzone przez elektrony.
Półprzewodniki to takie kryształy, w których istnieją warunki przerzucania elektronów na
wyższe, niż zajęte poziomy energetyczne przy małej energii wzbudzenia, co umożliwia
przepływ prądu.
Do bardzo ciekawych zjawisk w chemii ceramicznej należy wykorzystywanie
zanieczyszczeń występujących w sieciach lub innych wad sieciowych. Wady te, na przykład
inne jony w sieci, mogą stwarzać „most” między zbyt odległymi poziomami energetycznymi.
Mogą pracować jak przewoźnik na szerokiej rzece przerzucając elektrony na wyższy poziom.
Powoduje to przewodzenie izolatorów, czyli zmianę ich w półprzewodniki.
4.5.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń.
1. Co rozumiesz przez pojęcia kryształ i komórka jednostkowa?
2. Jakie są zadania krystalochemii?
3. Jakie są podstawowe prawa krystalochemii?
4. Jak można wykrywać wady w strukturach kryształów?
5. Jak zbudowane są krzemiany?
6. Co to jest liczba koordynacyjna?
7. Co nazywamy przewodnikami i dielektrykami?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
4.5.3. Ćwiczenia
Ćwiczenie 1
Połącz odpowiednie terminy z kolumny I i przyporządkuj im określenia z kolumny II.
Termin
Określenie
1.
Kryształ
A.
Wszystkie znane naturalne i sztuczne kryształy
2.
Komórka jednostkowa
B.
Jest
to
liczba
najbliższych
elementów
struktury
(jonów)
otaczających dany jon w krysztale
3.
Krzemiany
C.
Ugrupowanie przestrzenne atomów, jonów lub drobin o prawidłowej
okresowości
4.
Kryształy rzeczywiste
D.
Zbudowane są z sieci o koordynacji jonowej
5.
Liczba koordynacyjna
E.
Ciało, które przeciwstawia się uporządkowanemu przepływowi
prądu elektrycznego
6.
Przewodnik
F.
Stanowi powtarzający się motyw konstrukcyjny danego kryształu
7.
Dielektryk (izolator)
G.
Ciało, które przewodzi prąd elektryczny wskutek uporządkowanego
przepływu elektronów w polu przyłożonego napięcia
Termin
1
2
3
4
5
6
7
Określenie
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować zawartość tabeli w ćwiczeniu 1,
3) dobrać w pary: termin – określenie,
4) połączyć poprawne określenia,
5) zaprezentować wykonane ćwiczenie.
Wyposażenie stanowiska pracy:
−
zeszyt,
−
literatura zgodna z punktem 6 Poradnika dla ucznia.
Ćwiczenie 2
Uzupełnij teksty odpowiednimi słowami. W każdą lukę należy wpisać tylko jedno słowo.
Zadania krystalochemii:
−
badania struktury ...............,
−
............... wpływu rozmieszczenia atomów w kryształach (struktury) i budowy ich osłon
elektronowych na właściwości fizyczne i chemiczne kryształów.
Kryształem, w ogólnym znaczeniu, nazywamy ugrupowanie przestrzenne .............. jonów
lub drobin, wykazujące prawidłową okresowość w różnych kierunkach.
Dielektrykami (.....................) nazywamy takie ciała, które przeciwstawiają się
uporządkowanemu przepływowi prądu elektrycznego. Należą do nich głównie kryształy
krzemianów, w których warstwy zewnętrzne atomów (jonów) są obsadzone przez elektrony.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeanalizować tekst ćwiczenia,
2) przeanalizować luki decydując, jakie słowa należy wpisać,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
3) uzupełnić luki odpowiednimi zwrotami,
4) zaprezentować wykonane ćwiczenie,
5) dokonać oceny poprawności wykonanego ćwiczenia.
Wyposażenie stanowiska pracy:
−
literatura zgodna z punktem 6 Poradnika dla ucznia.
Ćwiczenie 3
Określ, które zdania są prawdziwe, a które fałszywe.
Zdanie
Prawda
Fałsz
Kryształem, w ogólnym znaczeniu, nazywamy ugrupowanie przestrzenne atomów,
jonów lub drobin, wykazujące prawidłową okresowość w różnych kierunkach.
Wszystkie znane naturalne i sztuczne atomy należą do kryształów rzeczywistych.
Liczba koordynacyjna jest to liczba ułamkowa elementów struktury (np. jonów)
otaczających dany koordynujący (podporządkowujący je sobie) jon w krysztale.
Przewodnikami nazywamy ciała, które nie przewodzą prądu elektrycznego
wskutek uporządkowanego przepływu elektronów w polu przyłożonego napięcia.
Dielektrykami (atomami) nazywamy takie ciała, które przeciwstawiają się
uporządkowanemu przepływowi prądu elektrycznego.
Różne rodzaje wad sieciowych można wykrywać i badać za pomocą promieni
Roentgena, przewodnictwa elektrycznego.
Aby wykonać ćwiczenie, powinieneś:
1) przeczytać określone treści z Poradnika dla ucznia dotyczące krystalochemii,
2) przeanalizować zdania decydując czy jest prawdziwe czy fałszywe,
3) uzupełnić tabelę,
4) zaprezentować wykonane ćwiczenie,
5) dokonać oceny poprawności wykonanego ćwiczenia.
Wyposażenie stanowiska pracy:
−
zeszyt,
−
literatura zgodna z punktem 6 Poradnika dla ucznia.
4.5.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcia: kryształ, komórka jednostkowa?
2) określić zadania krystalochemii?
3) wymienić podstawowe prawa krystalochemii?
4) określić, jak zbudowana jest sieć krzemianów?
5) zdefiniować pojęcie liczby koordynacyjnej?
6) określić, na czym polega badanie wad struktury kryształów?
7) zdefiniować pojęcia: przewodniki, dielektryki?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
5. SPRAWDZIAN OSIĄGNIĘĆ
Instrukcja dla ucznia
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Test zawiera 20 zadań. Wszystkie zadania są zadaniami wielokrotnego wyboru i tylko
jedna odpowiedź jest prawidłowa.
5. Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi: zaznacz prawidłową
odpowiedź X (w przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem,
a następnie ponownie zakreślić odpowiedź prawidłową).
6. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7. Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego
rozwiązanie na później i wróć do niego, gdy zostanie Ci czas wolny. Trudności mogą
przysporzyć Ci zadania: 16–20, gdyż są one na poziomie trudniejszym niż pozostałe.
Przeznacz na ich rozwiązanie więcej czasu.
8. Na rozwiązanie testu masz 30 minut.
Powodzenia!
ZESTAW ZADAŃ TESTOWYCH
1. Jądro atomowe składa się z
a) elektronów.
b) protonów i neutronów.
c) promieni atomowych.
d) protonów.
2. Powłokowa konfiguracja elektronowa to
a) elektrony walencyjne.
b) rozmieszczenie elektronów w powłokach.
c) liczba powłok elektronowych.
d) prawo okresowości.
3. NaOH to wzór chemiczny
a) wodorotlenku sodu.
b) wodorotlenku magnezu.
c) kwasu.
d) soli.
4. Czerwony kolor na fajansie pochodzi od pierwiastka
a) germanu.
b) chromu Cr
6+
.
c) tlenu.
d) azotu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
5. Estry stosuje się do produkcji
a) tkanin.
b) środków owadobójczych.
c) ceramiki.
d) mas plastycznych.
6. Reakcja wymiany to
a) przemiana fizyczna.
b) reakcja łączenia dwóch substratów w jeden produkt.
c) reakcja, w wyniku której następuje wymiana składników między substratami.
d) reakcja rozpadu jednego substratu na dwa produkty.
7. Topnienie to przekształcenie
a) ciała stałego w gaz.
b) ciała stałego w ciecz.
c) cieczy w ciało stałe.
d) cieczy w gaz.
8. Cechą roztworu rzeczywistego jest to, że
a) można składniki rozróżnić wzrokowo.
b) można wyróżnić w nim dwie fazy: ciekłą i stałą.
c) jego składnikami są tylko ciecze.
d) składników nie można rozróżnić wzrokowo.
9. Ugrupowanie przestrzenne atomów, jonów lub drobin, wykazujące prawidłową
okresowość w różnych kierunkach nazywamy
a) liczbą koordynacyjną.
b) atomem.
c) kryształem.
d) molem.
10. Proces polegający na łączeniu się cząstek fazy rozproszonej koloidu w większe agregaty
tworzące fazę ciągłą o nieregularnej strukturze nazywamy
a) rozpuszczaniem.
b) wysalaniem.
c) peptyzacją.
d) koagulacją.
11. Wszystkie czynności, związane z przemianami fizycznymi i chemicznymi, które należy
wykonać, aby z surowca otrzymać gotowy produkt noszą nazwę
a) procesu technologicznego.
b) procesów jednostkowych.
c) procesu produkcyjnego.
d) operacji jednostkowych.
12. Z różnych miejsc, dużej partii materiału, pobrano szereg próbek. Są to próbki
a) pierwotne.
b) analityczne.
c) średnie.
d) ogólne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
13. Substancje zdolne do obniżania lepkości gęstwy przy stałej ilości wody to
a) masy.
b) roztwory.
c) koloidy.
d) upłynniacze.
14. Do pobrania próbek materiałów sypkich należy użyć
a) pojemnik.
b) kruszarkę.
c) zgłębnik.
d) cylinder.
15. Tężenie (sztywnienie, galaretowacenie) zawiesin minerałów ilastych to zjawisko
a) upłynniania.
b) koagulacji.
c) tiksotropii.
d) peptyzacji.
16. Koloidem nie jest
a) galareta.
b) klej.
c) zawiesina.
d) faza rozproszona występuje w rozdrobnieniu od 1 do 200 nm.
17. Podczas rozcieńczania stężonego kwasu siarkowego(VI) należy
a) powoli wlewać wodę do kwasu, roztwór ciągle mieszając.
b) całą ilość wody szybko wlać do odmierzonego wcześniej kwasu.
c) powoli wlewać kwas do wody, roztwór ciągle mieszając
d) całą ilość kwasu odmierzonego wcześniej kwasu szybko wlać do wody
18. Liczba koordynacyjna to liczba
a) molowa.
b) atomowa.
c) elektronów.
d) elementów struktury (np. jonów) otaczających dany koordynujący jon w krysztale.
19. Celem przygotowania próbki średniej nie jest
a) ustalenie koloru gliny.
b) wydzielenie części surowca.
c) przygotowanie potrzebnej ilości do badań.
d) ustalenie właściwości odpowiadającym nadesłanej całości.
20. Po rozpuszczeniu 50 gramów soli w 200 gramach wody otrzymamy roztwór o stężeniu
a) 2%
b) 20%
c) 25%
d) 2,5%.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
KARTA ODPOWIEDZI
Imię i nazwisko ……………………………………………………..
Stosowanie podstawowych pojęć z zakresu chemii ceramicznej
Zakreśl poprawną odpowiedź.
Numer
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
6. LITERATURA
1. Bogdańska A, Zarembina E.: Chemia. WSiP, Warszawa 1993
2. Flis B., Wyszyńska B.: Zarys technologii ceramiki. WSiP, Warszawa 1986
3. Gulińska H., Haładuda J.: Ciekawa chemia. WSiP, Warszawa 2006
4. Pazdro K. M., Czaja M.: Chemia cz.I. Oficyna Edukacyjna, Warszawa 2003
5. Pazdro K. M., Danikiewicz W.: Chemia. Podręcznik do kształcenia podstawowego
w liceach i technikach. Oficyna Edukacyjna, Warszawa 2002
6. Rusiecki A., Raabe J.: Pracownia technologiczna ceramiki. WSiP, Warszawa
7. Wyszyńska A.: Chemia ceramiczna, WSiP, Warszawa 1976
8. www.google: Krystalochemia, Handke M. wykład
Wyszukiwarka
Podobne podstrony:
operator urzadzen przemyslu ceramicznego 813[01] z2 07 u
operator urzadzen przemyslu ceramicznego 813[01] z2 06 n
operator urzadzen przemyslu ceramicznego 813[01] z2 08 u
operator urzadzen przemyslu ceramicznego 813[01] z2 08 n
operator urzadzen przemyslu ceramicznego 813[01] z2 02 u
operator urzadzen przemyslu ceramicznego 813[01] z2 03 n
operator urzadzen przemyslu ceramicznego 813[01] z2 04 n
operator urzadzen przemyslu ceramicznego 813[01] z2 07 n
operator urzadzen przemyslu ceramicznego 813[01] z2 03 u
operator urzadzen przemyslu ceramicznego 813[01] z2 06 u
operator urzadzen przemyslu ceramicznego 813[01] z2 01 n
operator urzadzen przemyslu ceramicznego 813[01] z2 04 u
operator urzadzen przemyslu ceramicznego 813[01] z2 05 n
operator urzadzen przemyslu ceramicznego 813[01] z2 05 u
operator urzadzen przemyslu ceramicznego 813[01] z2 02 n
operator urzadzen przemyslu ceramicznego 813[01] z2 07 u
operator urzadzen przemyslu ceramicznego 813[01] z2 01 n
operator urzadzen przemyslu ceramicznego 813[01] z2 02 n
operator urzadzen przemyslu ceramicznego 813[01] z2 02 u
więcej podobnych podstron