
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Jolanta Gajda
Stosowanie podstawowych pojęć z zakresu chemii
ceramicznej 813[01].Z2.01
Poradnik dla nauczyciela
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr inż. Katarzyna Golec
mgr inż. Beata Figarska-Wysocka
Opracowanie redakcyjne:
mgr Jolanta Gajda
Konsultacja:
mgr inż. Gabriela Poloczek
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 813[01].Z2.01
Stosowanie podstawowych pojęć z zakresu chemii ceramicznej, zawartego w modułowym
programie nauczania dla zawodu operator urządzeń przemysłu ceramicznego.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Przykładowe scenariusze zajęć
7
5. Ćwiczenia
12
5.1. Budowa materii
12
5.1.1. Ćwiczenia
12
5.2. Substancje chemiczne stosowane w przemyśle ceramicznym
15
5.2.1. Ćwiczenia
15
5.3. Reakcje chemiczne
17
5.3.1. Ćwiczenia
17
5.4. Mieszaniny, roztwory, koloidy
20
5.4.1. Ćwiczenia
20
5.5. Wybrane pojęcia z krystalochemii
23
5.5.1. Ćwiczenia
23
6. Ewaluacja osiągnięć ucznia
26
7. Literatura
40

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Przekazujemy Państwu Poradnik dla nauczyciela „Stosowanie podstawowych pojęć
z zakresu chemii ceramicznej”, który będzie pomocny w prowadzeniu zajęć dydaktycznych
w szkole kształcącej w zawodzie operator urządzeń przemysłu ceramicznego.
W poradniku zamieszczono:
−
wymagania wstępne, wykaz umiejętności, jakie uczeń powinien mieć już ukształtowane,
aby bez problemów mógł korzystać z poradnika,
−
cele kształcenia, wykaz umiejętności, jakie uczeń ukształtuje podczas pracy
z poradnikiem,
−
przykładowe scenariusze zajęć,
−
przykładowe ćwiczenia ze wskazówkami do realizacji, zalecanymi metodami nauczania–
uczenia oraz środkami dydaktycznymi,
−
ewaluację osiągnięć ucznia, przykładowe narzędzie pomiaru dydaktycznego,
−
literaturę uzupełniającą.
Wskazane jest, aby zajęcia dydaktyczne były prowadzone różnymi metodami ze
szczególnym uwzględnieniem aktywizujących metod nauczania.
Formy organizacyjne pracy uczniów mogą być zróżnicowane, począwszy od
samodzielnej pracy uczniów do pracy zespołowej.
Jako pomoc w realizacji jednostki modułowej dla uczniów przeznaczony jest Poradnik
dla ucznia. Nauczyciel powinien ukierunkować uczniów na właściwe korzystanie z poradnika
do nich adresowanego.
Materiał nauczania (w Poradniku dla ucznia) podzielony jest na rozdziały, które
zawierają podrozdziały. Podczas realizacji poszczególnych rozdziałów wskazanym jest
zwrócenie uwagi na następujące elementy:
−
materiał nauczania – w miarę możliwości uczniowie powinni przeanalizować
samodzielnie. Obserwuje się niedocenianie przez nauczycieli niezwykle ważnej
umiejętności, jaką uczniowie powinni bezwzględnie posiadać – czytanie tekstu
technicznego ze zrozumieniem,
−
pytania sprawdzające mają wykazać, na ile uczeń opanował materiał teoretyczny i czy
jest przygotowany do wykonania ćwiczeń. W zależności od tematu można zalecić
uczniom samodzielne odpowiedzenie na pytania lub wspólne z całą grupą uczniów,
w formie dyskusji opracowanie odpowiedzi na pytania. Druga forma jest korzystniejsza,
ponieważ nauczyciel sterując dyskusją może uaktywniać wszystkich uczniów oraz
w trakcie dyskusji usuwać wszelkie wątpliwości,
−
dominującą rolę w kształtowaniu umiejętności oraz opanowaniu materiału spełniają
ć
wiczenia. W trakcie wykonywania ćwiczeń uczeń powinien zweryfikować wiedzę
teoretyczną oraz opanować nowe umiejętności. Przedstawiono dosyć obszerną propozycję
ć
wiczeń wraz ze wskazówkami o sposobie ich przeprowadzenia, uwzględniając różne
możliwości ich realizacji w szkole. Nauczyciel decyduje, które z zaproponowanych
ć
wiczeń jest w stanie zrealizować przy określonym zapleczu techno-dydaktycznym szkoły.
Prowadzący może również zrealizować ćwiczenia, które sam opracował,
−
sprawdzian postępów stanowi podsumowanie rozdziału, zadaniem uczniów jest
udzielenie odpowiedzi na pytania w nim zawarte. Uczeń powinien samodzielnie czytając
zamieszczone w nim stwierdzenia potwierdzić lub zaprzeczyć opanowanie określonego
zakresu materiału. Jeżeli wystąpią zaprzeczenia, nauczyciel powinien do tych zagadnień
wrócić, sprawdzając czy braki w opanowaniu materiału są wynikiem niezrozumienia
przez ucznia tego zagadnienia, czy niewłaściwej postawy ucznia w trakcie nauczania.
W tym miejscu jest szczególnie ważna rola nauczyciela, gdyż od postawy nauczyciela,
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
sposobu prowadzenia zajęć zależy między innymi zainteresowanie ucznia. Uczeń
niezainteresowany materiałem nauczania, wykonywaniem ćwiczeń nie nabędzie w pełni
umiejętności założonych w jednostce modułowej. Należy rozbudzić wśród uczniów tak
zwaną „ciekawość wiedzy”. Potwierdzenie przez ucznia opanowania materiału nauczania
rozdziału może stanowić podstawę dla nauczyciela do sprawdzenia wiedzy i umiejętności
ucznia z tego zakresu. Nauczyciel realizując jednostkę modułową powinien zwracać
uwagę na predyspozycje ucznia, ocenić, czy uczeń ma większe uzdolnienia manualne,
czy może lepiej radzi sobie z rozwiązywaniem problemów teoretycznych,
−
testy zamieszczone w rozdziale Ewaluacja osiągnięć ucznia zawierają zadania z zakresu
całej jednostki modułowej i należy je wykorzystać do oceny uczniów, a wyniki osiągnięte
przez uczniów powinny stanowić podstawę do oceny pracy własnej nauczyciela
realizującego tę jednostkę modułową. Każdemu zadaniu testu przypisano określoną liczbę
możliwych do uzyskania punktów (0 lub 1 punkt). Ocena końcowa uzależniona jest od
ilości uzyskanych punktów. Nauczyciel może zastosować test według własnego projektu
oraz zaproponować własną skalę ocen. Należy pamiętać, żeby tak przeprowadzić proces
oceniania ucznia, aby umożliwić mu jak najpełniejsze wykazanie swoich umiejętności.
Metody polecane do stosowania podczas kształcenia modułowego to:
−
pokaz z objaśnieniem,
−
ć
wiczenie (laboratoryjne lub inne),
−
metoda projektów,
−
metoda przewodniego tekstu.
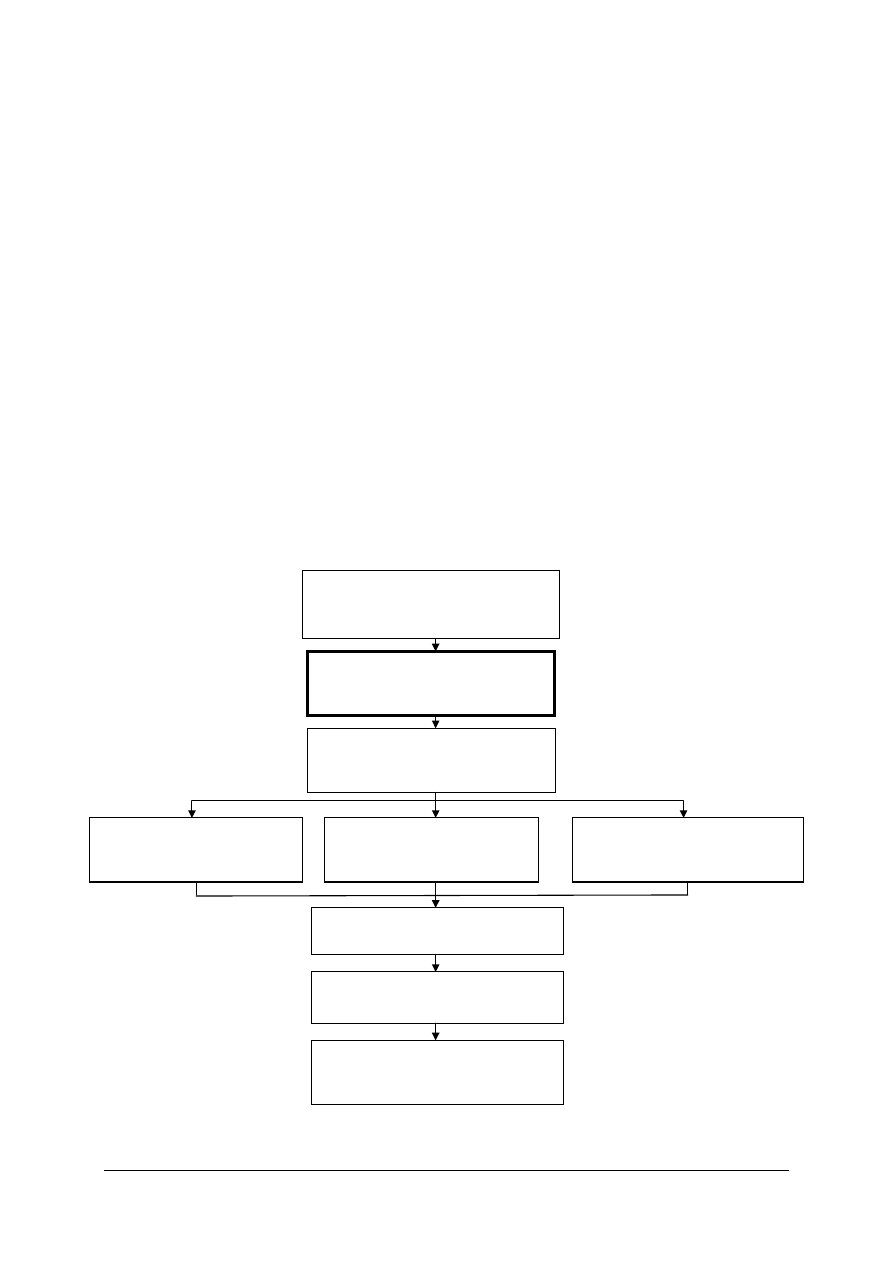
Schemat układu jednostek modułowych
813[01].Z2.01
Stosowanie podstawowych pojęć
z zakresu chemii ceramicznej
813[01].Z2.03
Formowanie wyrobów z mas
plastycznych
813[01].Z2.02
Przygotowywanie surowców
i mas ceramicznych
813[01].Z2.04
Formowanie wyrobów z mas
sypkich
813[01].Z2.08
Zdobienie i szkliwienie wyrobów
ceramicznych
813[01].Z2.06
Suszenie wyrobów ceramicznych
813[01].Z2.07
Wypalanie wyrobów ceramicznych
813[01].Z2.05
Formowanie wyrobów z mas
lejnych
813[01].Z2
Technologia produkcji wyrobów
ceramicznych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej uczeń powinien umieć:
−
posługiwać się symboliką chemiczną,
−
zapisywać wybrane związki przy użyciu symboliki chemicznej,
−
stosować przepisy bezpieczeństwa i higieny pracy przy wykonywaniu czynności
w szkolnej pracowni chemicznej,
−
obsługiwać komputer na poziomie podstawowym,
−
korzystać z różnych źródeł informacji, w tym z Internetu,
−
selekcjonować, porządkować i przechowywać informacje,
−
czytać ze zrozumieniem,
−
rozwiązywać test wielokrotnego wyboru,
−
pracować w grupie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej uczeń powinien umieć:
−
scharakteryzować podstawowe pojęcia z zakresu chemii ceramicznej,
−
posłużyć się terminologią z zakresu chemii ceramicznej,
−
określić właściwości chemiczne pierwiastków stosowanych w przemyśle ceramicznym,
−
scharakteryzować podstawowe dla przemysłu ceramicznego związki nieorganiczne
i organiczne,
−
rozróżnić rodzaje reakcji chemicznych, na podstawie zapisu równania reakcji,
−
określić stany skupienia materii oraz różnice między mieszaninami, roztworami
i układami koloidalnymi,
−
scharakteryzować zjawisko koagulacji, peptyzacji, tiksotropii, upłynniania gęstw
ceramicznych,
−
wyjaśnić podstawowe pojęcia z zakresu krystalochemii tlenków,
−
sporządzić roztwory i mieszaniny, na podstawie receptur i instrukcji technologicznych,
−
pobrać próbki do podstawowych analiz z magazynów lub linii produkcyjnych,
−
dobrać sprzęt laboratoryjny do realizacji określonych zadań.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. PRZYKŁADOWE SCENARIUSZE ZAJĘĆ
Scenariusz zajęć 1
Osoba prowadząca
……………………………………………….
Modułowy program nauczania: Operator urządzeń przemysłu ceramicznego 813[01]
Moduł:
Technologia produkcji wyrobów ceramicznych 813[01].Z2
Jednostka modułowa:
Stosowanie podstawowych pojęć z zakresu chemii
ceramicznej 813[01]Z2.01
Temat: Pobieranie próbki średniej.
Cel ogólny: Zapoznanie uczniów z przygotowaniem próbki średniej w celu wydzielenia
części surowca w ilości potrzebnej do badań, która właściwościami swymi
odpowiada nadesłanej całości.
Po zakończeniu zajęć edukacyjnych uczeń powinien umieć:
−
pobierać próbkę średnią,
−
dobierać sprzęt do pobierania próbki średniej,
−
przestrzegać zasad bhp podczas prac laboratoryjnych,
−
interpretować uzyskane wyniki.
W czasie zajęć będą kształtowane następujące umiejętności ponadzawodowe:
−
organizowania i planowania pracy,
−
pracy w zespole,
−
oceny pracy zespołu.
Metody nauczania–uczenia się:
−−−−
metoda przewodniego tekstu.
Środki dydaktyczne:
−
piasek kwarcowy,
−
literatura zgodna z punktem 7 Poradnika dla nauczyciela.
Formy organizacyjne pracy uczniów:
−−−−
praca w zespołach 2–4-osobowych.
Czas trwania zajęć: 2 godziny dydaktyczne.
Przebieg zajęć:
Zadanie dla ucznia: Przygotuj próbkę materiału sypkiego.
Faza wstępna:
1. Sprawy organizacyjne.
2. Nawiązanie do tematu, omówienie celów zajęć.
3. Zaznajomienie uczniów z pracą metodą przewodniego tekstu.
4. Podział uczniów na zespoły.
5. Zorganizowanie stanowiska pracy do wykonania ćwiczenia.
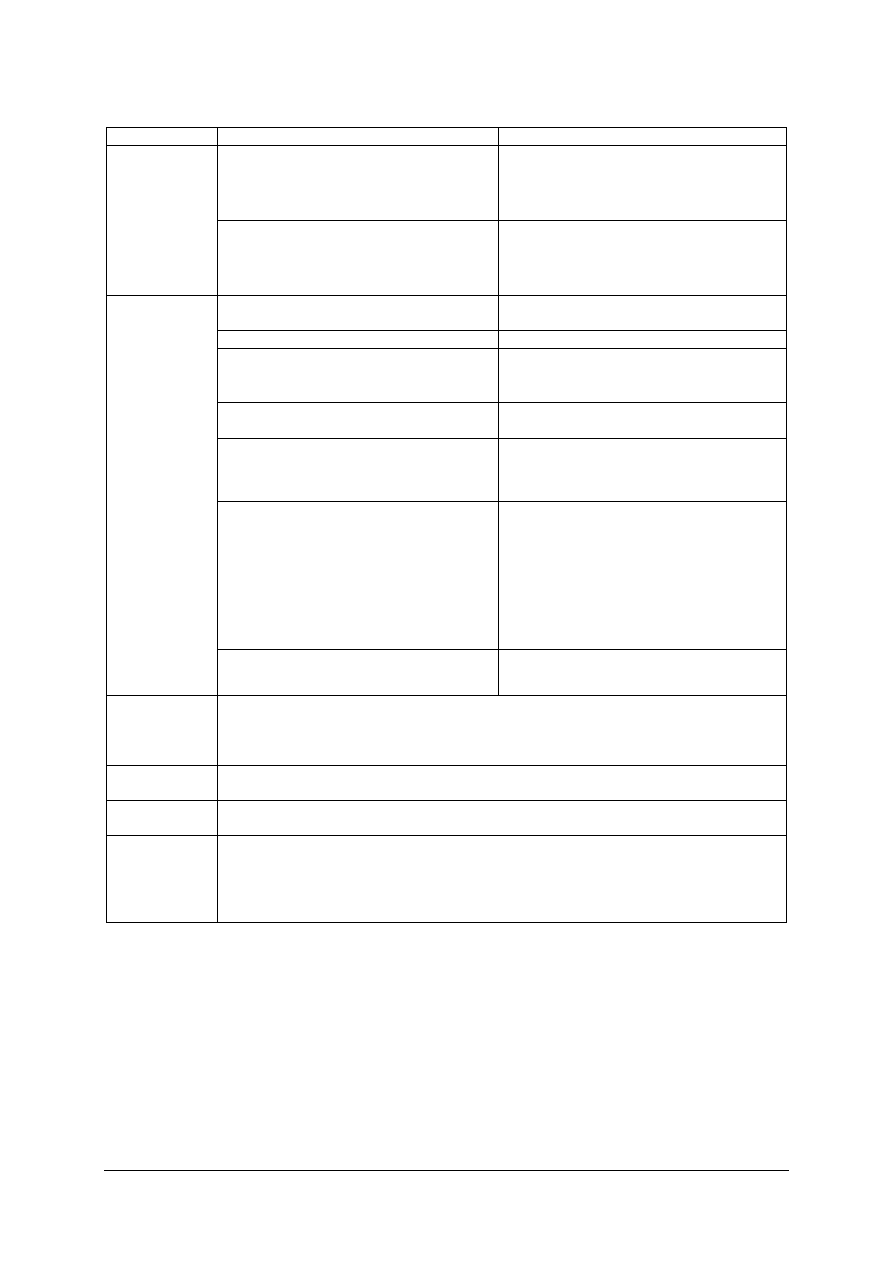
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Faza właściwa: praca metodą przewodniego tekstu – fazy 1–5
Faza
Przykłady pytań
Oczekiwane odpowiedzi
W jakim celu przygotowujemy próbkę
ś
rednią?
Przygotowanie próbki średniej ma na celu
wydzielenie
części
surowca
w
ilości
potrzebnej do badań, która właściwościami
swymi odpowiada nadesłanej całości.
1. Informacje
Dla jakich materiałów przygotowuje się
próbkę średnią?
Próbkę
ś
rednią
przygotowuje
się
dla
materiałów ilastych, materiałów sypkich,
surowców w kawałkach, w opakowaniu
workowym, materiałów półciekłych.
Jaki podstawowy sprzęt powinien się
znaleźć na stanowisku badań?
Zgłębnik do pobierania próbek z materiałów
sypkich lub wąska szufelka
Jakie surowce będziesz badał?
Piasek kwarcowy
Jak wygląda próbka do badań materiałów
sypkich?
Próbkę pobiera się bezpośrednio z worków.
Jeżeli partia nie jest większa niż pięć worków,
próbki pobiera się ze wszystkich worków.
Ile pobiera się próbki materiałów sypkich?
Masa próbki, pobranej z jednego worka,
powinna wynosić ok. 0,5 kg.
Jak wygląda miejsce pobrania próbki?
Miejsca pobrania próbek powinny być
wcześniej ustalone, aby zapewnić całkowitą
bezstronność.
Jak wykonuje się zmniejszenie wielkości
próbki
materiału
sypkiego,
zwane
ć
wiartkowaniem?
Zmniejszenie wielkości próbki materiału
sypkiego
można
wykonać
rozkładając
materiał warstwą o jednakowej grubości
w kształcie
kwadratu.
Po
przedzieleniu
kwadratu przekątnymi odrzuca się materiał
z pól I i III, a pozostały materiał z pól IV i V
miesza się dokładnie. Czynność powtarza się
do uzyskania próbki o oznaczonej wielkości.
2. Planowanie
Jaką
masę
powinny
mieć
próbki
laboratoryjne do wykonywania badań?
Próbki laboratoryjne do wykonywania badań
powinny mieć masę do ok. 500 g.
3. Ustalenia
Uczniowie pracując w grupach, proponują kolejność czynności, jakie będą musieli
zrealizować podczas pobierania próbki średniej.
Uczniowie konsultują z nauczycielem plan działań i prezentują uzyskane do tej pory
informacje.
4. Wykonanie
Uczniowie postępują według ustalonego wcześniej planu, konsultując trudniejsze czynności
zmniejszenia wielkości próbki z nauczycielem.
5. Sprawdzenie
Sprawdzenie, czy uczniowie prawidłowo przygotowali zmniejszenie wielkości próbki
materiału sypkiego.
6. Analiza
końcowa
Uczniowie wraz z nauczycielem ustalają, które etapy rozwiązania zadania sprawiły im
trudności. Nauczyciel powinien podsumować całe ćwiczenie, wskazać, jakie ważne
umiejętności zostały przyswojone, jakie wystąpiły nieprawidłowości i jak ich unikać
w przyszłości. Uczniowie muszą wymienić się wynikami, aby prawidłowo wyciągnąć
wnioski końcowe.
Praca domowa
Wykonać raport z przeprowadzonych zajęć praktycznych. Powinien on zawierać: cel pracy,
szczegółowy opis problemu, który był rozwiązywany, opis kolejnych czynności, jakie
wykonano (z zachowaniem przepisów bhp przy pracach laboratoryjnych) oraz uwagi
i wnioski końcowe.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
anonimowe ankiety ewaluacyjne dotyczące sposobu prowadzenia zajęć i zdobytych
umiejętności.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
ZAŁĄCZNIKI DO SCENARIUSZA
Załącznik A – Instrukcja pracy dla uczniów metodą przewodniego tekstu
W jaki sposób będziecie pracować na zajęciach?
Otrzymaliście od nauczyciela problem do rozwiązania (załącznik B), nad którym
zastanowicie się wspólnie. Będziecie pracować metodą przewodniego tekstu składającą się
z sześciu faz.
W pierwszej fazie pracy „Informacje wstępne”, a także w drugiej fazie „Planowanie”,
pomogą Wam pytania prowadzące (załącznik C i załącznik D). Odpowiedzi na te pytania
opracujecie pisemnie, jeśli będziecie mieć wątpliwości, nauczyciel udzieli Wam pomocy.
W fazie „Ustalenia” zaproponujcie kolejność czynności, jakie będziecie wykonywać
podczas zmniejszania wielkości próbki materiału sypkiego, zwane ćwiartkowaniem. Ponadto
sprawdźcie, czy stanowisko jest przygotowane do pracy i czy posiadacie już wszystkie
potrzebne pomoce. Na zakończenie tego punktu zajęć skonsultujcie swój plan działania
z nauczycielem i zaprezentujcie uzyskane do tej pory informacje.
W fazie „Wykonanie” przystąpcie do wykonywania ćwiczenia, według ustalonego
wcześniej planu.
W fazie „Sprawdzenie” sprawdźcie ostatecznie, czy zostało prawidłowo przygotowane
zmniejszenie wielkości próbki materiału sypkiego.
W ostatniej fazie „Analiza końcowa” zastanówcie się nad całym procesem
rozwiązywania przez Wasz zespół problemu i wskażcie, które etapy pracy nad rozwiązaniem
zadania sprawiały Wam trudności i jakie były tego przyczyny. Swój wynik podajcie kolegom,
aby każdy zespół mógł wyciągnąć wnioski końcowe.
Załącznik B – Zadanie dla zespołów uczniowskich
Zadanie:
Przygotuj próbkę piasku kwarcowego przez zmniejszenie wielkości próbki materiału
sypkiego, zwane ćwiartkowaniem. Próbkę do badań laboratoryjnych przygotować w ilości
500 g.
Załącznik C – Pytania prowadzące do fazy I – Informacje wstępne
1. W jakim celu przygotowujemy próbkę średnią?
2. Dla jakich materiałów przygotowuje się próbkę średnią?
Załącznik D – Pytania prowadzące do fazy II – Planowanie
1. Jaki podstawowy sprzęt powinien się znaleźć na stanowisku badań?
2. Jakie surowce będziesz badał?
3. Jak wygląda próbka do badań materiałów sypkich?
4. Ile pobiera się próbki materiałów sypkich?
5. Jak wygląda miejsce pobrania próbki?
6. Jak wykonuje się zmniejszenie wielkości próbki materiału sypkiego, zwane
ć
wiartkowaniem?
7. Jaką masę powinny mieć próbki do badań laboratoryjnych do wykonywania badań?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Scenariusz zajęć 2
Osoba prowadząca
……………………………………………….
Modułowy program nauczania: Operator urządzeń przemysłu ceramicznego 813[01]
Moduł:
Technologia produkcji wyrobów ceramicznych 813[01].Z2
Jednostka modułowa:
Stosowanie podstawowych pojęć z zakresu chemii
ceramicznej 813[01]Z2.01
Temat: Opis składu mieszanin.
Cel ogólny: Zapoznanie uczniów ze sposobem sporządzania mieszanin na podstawie
receptur.
Po zakończeniu zajęć edukacyjnych uczeń powinien umieć:
−
wykazać się znajomością i rozumieniem pojęć: roztwór rozcieńczony, roztwór stężony,
masa roztworu, masa rozpuszczalnika, stężenie procentowe roztworu,
−
obliczyć stężenie procentowe roztworu,
−
zapisać obliczenia na podstawie podanego wzoru,
−
z zaangażowaniem rozwiązywać zadanie.
W czasie zajęć będą kształtowane następujące umiejętności ponadzawodowe:
−
organizowania i planowania pracy,
−
pracy w zespole,
Metody nauczania–uczenia się:
−−−−
ć
wiczenie,
−−−−
pogadanka.
Środki dydaktyczne:
−
arkusze papieru
−
małe kolorowe karteczki,
−
literatura zgodna z punktem 7 Poradnika dla nauczyciela.
Formy organizacyjne pracy uczniów:
−−−−
praca indywidualna,
−−−−
praca w zespołach 2–4-osobowych.
Czas trwania zajęć: 2 godziny dydaktyczne.
Przebieg zajęć:
Część wprowadzająca:
1. Sprawy organizacyjne.
2. Nawiązanie do tematu, omówienie celów zajęć.
3. Zaznajomienie uczniów z pracą na zajęciach.
4. Realizacja zajęć:
−
nauczyciel dzieli uczniów na zespoły, za pomocą kolorowych kartek, które
uczniowie losują,
−
nauczyciel przydziela każdemu zespołowi zadania (zadania są zróżnicowane),
−
nauczyciel rozdaje grupom arkusze papieru formatu A4, flamastry,
−
nauczyciel udziela wszelkich wyjaśnień związanych z prawidłowym zapisem danych
z zadania do wzoru na obliczanie stężenia procentowego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
5. Uczniowie pracują z przydzielonymi zadaniami, obliczają masę roztworu jako sumę
masy substancji rozpuszczonej i masy rozpuszczalnika.
6. Uczniowie zadanie rozwiązują na dwa sposoby. Pierwszy sposób wstawiają dane
z zadania po obliczeniu masy roztworu do wzoru. W drugim sposobie układają proporcję
wykorzystując informację, że stężenie procentowe jest to procent masowy substancji
rozpuszczonej w roztworze (masa roztworu stanowi 100%).
7. Przedstawiciele grup przedstawiają poszczególne sposoby obliczania składu mieszanin.
8. Nauczyciel kontroluje poprawność przeprowadzanych czynności i koryguje ewentualne
błędy.
9. Nauczyciel wybiera najlepiej pracujący zespół i wystawia oceny.
Nauczyciel podsumowuje pracę poszczególnych zespołów.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
anonimowe ankiety ewaluacyjne dotyczące sposobu prowadzenia zajęć i zdobytych
umiejętności.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
5.
ĆWICZENIA
5.1. Budowa materii
5.1.1. Ćwiczenia
Ćwiczenie 1
Przyporządkuj, wymienionym w kolumnie 1, terminom odpowiadające im informacje
z kolumny 2.
Terminy
Informacje
1.
Jądro atomowe.
A.
Jest połową odległości między dwoma sąsiednimi jądrami.
2.
Elektron.
B.
Jest równa liczbie elektronów w atomie.
3.
Liczba atomowa.
C.
Jest elektrycznie obojętny.
4.
Promień atomowy.
D.
Cząsteczka o ładunku ujemnym.
5.
Atom.
E.
Ma tyle elektronów ile protonów.
6.
Neutron.
F.
Skupia dodatni ładunek atomu.
Terminy
1
2
3
4
5
6
Informacje
Wskazówki do realizacji
Uczniowie pracują indywidualnie Po zakończeniu ćwiczenia uczniowie prezentują swoją
pracę.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać i przeanalizować treść ćwiczenia,
2) przyporządkować wymienionym terminom odpowiednie informacje,
3) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−
ć
wiczenie.
Ś
rodki dydaktyczne:
−−−−
Poradnik dla ucznia,
−−−−
literatura zgodna z punktem 7 Poradnika dla nauczyciela.
Ćwiczenie 2
Uzupełnij tabelę o brakujące dane.
Symbol pierwiastka
Li
Liczba elektronów
17
20
Numer grupy
17
2
Powłokowa konfiguracja
elektronowa
K
2
, L
8
, M
3
K
2
, L
8
, M
6

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Wskazówki do realizacji
Uczniowie pracują indywidualnie. Po zakończeniu pracy przeprowadzają dyskusję.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeanalizować wypełnione pola tabeli,
2) wypełnić wolne pola w tabeli,
3) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−
ć
wiczenie,
−
dyskusja dydaktyczna.
Ś
rodki dydaktyczne:
−
Poradnik dla ucznia,
−
zeszyt,
−
literatura zgodna z punktem 7 Poradnika dla nauczyciela.
Ćwiczenie 3
Uzupełnij poniższe równania elektronowe, obserwując przekształcenia atomów w inne
drobiny:
a) Ca → Ca
2+
+…….
b) Cl + e
-
→….
c) Sn → Sn
4+
+……
d) N +3…→ N
3
.
Wskazówki do realizacji
Uczniowie pracują indywidualnie Po zakończeniu ćwiczenia uczniowie prezentują swoją
pracę.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeanalizować zapis równań elektronowych,
2) wypełnić miejsca kropkowane,
3) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−
ć
wiczenie,
−
dyskusja dydaktyczna.
Ś
rodki dydaktyczne:
−−−−
Poradnik dla ucznia,
−−−−
zeszyt,
−−−−
literatura zgodna z punktem 7 Poradnika dla nauczyciela
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Ćwiczenie 4
Połącz hasło z opisem.
Hasło
Opis
1.
Wiązanie jonowe
A.
Wiązanie utworzone przez uwspólnienie elektronów. Atomy, które
uwspólniły elektrony, przekształcają się w cząsteczkę. Substancje
o wiązaniu jonowym tworzą w stanie stałym jonową sieć krystaliczną.
2.
Wiązanie
kowalencyjne
B.
Wiązanie występujące w metalach i ich stopach, polegające na
oddziaływaniu
zdelokalizowanych
elektronów
i
jonów
dodatnich
tworzących sieć krystaliczną
3.
Wiązanie metaliczne
C.
Stanowiących podstawowe składniki surowców i tworzyw ceramicznych
4.
Wiązania chemiczne
występujące
w krzemianach
D.
Atom metalu przekształca się w kation, a atom niemetalu w anion.
Substancje zbudowane z cząsteczek tworzą w stanie stałym cząsteczkową
sieć krystaliczną.
Hasło
1
2
3
4
Opis
Wskazówki do realizacji
Uczniowie pracują w dwuosobowych grupach. Po zakończeniu pracy przeprowadzają
dyskusję.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać określone treści z poradnika dotyczące wiązań chemicznych,
2) zastanowić się nad opisem poszczególnych haseł,
3) połączyć hasło z opisem, uzupełniając miejsce w tabelce,
4) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−
dyskusja dydaktyczna,
−
ć
wiczenie.
Ś
rodki dydaktyczne:
−
Poradnik dla ucznia,
−
zeszyt,
−
literatura zgodna z punktem 7 Poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
5.2. Substancje chemiczne stosowane w przemyśle ceramicznym
5.2.1. Ćwiczenia
Ćwiczenie 1
Na podstawie tabeli 3 „Rola pierwiastków w szkliwach ceramicznych” zamieszczonej
w Poradniku dla ucznia przygotuj podział na trzy zasadnicze grupy pierwiastków
(wprowadzanych do szkliw najczęściej w postaci tlenków) używanych w szkłach.
Wskazówki do realizacji
Uczniowie pracują w dwuosobowych grupach. Po zakończeniu pracy przeprowadzają
dyskusję.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać tekst z Poradnika ucznia podany w temacie ćwiczenia,
2) przeanalizować tabelę 3 z Poradnika ucznia,
3) przygotować w zeszycie zadany w ćwiczeniu podział pierwiastków,
4) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−−−−
ć
wiczenie,
−−−−
dyskusja dydaktyczna.
Ś
rodki dydaktyczne:
−−−−
Poradnik dla ucznia,
−−−−
literatura zgodna z punktem 7 Poradnika dla nauczyciela.
Ćwiczenie 2
Rozpoznaj i omów wybrane tworzywa ceramiczne – wskaż ich zastosowanie.
Wskazówki do realizacji
Celem tego ćwiczenia jest sprawdzenie na ile uczniowie potrafią rozróżniać tworzywa
ceramiczne. Nauczyciel powinien przygotować jak najwięcej tworzyw ceramicznych.
Nauczyciel może pokazać katalogi i albumy tworzyw ceramicznych. Uczniowie mogą
pracować w parach. Nauczyciel wskazuje uczniów do prezentacji.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z właściwą treścią podręcznika,
2) zapoznać się z literaturą wskazaną przez nauczyciela,
3) obejrzeć zgrupowane tworzywa ceramiczne,
4) nazwać tworzywa ceramiczne,
5) sporządzić krótką notatkę o każdym z nich,
6) wskazać przydatność tworzyw ceramicznych,
7) zaprezentować wykonane ćwiczenie.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Zalecane metody nauczania–uczenia się:
−−−−
ć
wiczenie,
−−−−
dyskusja dydaktyczna.
Ś
rodki dydaktyczne:
−−−−
Poradnik dla ucznia,
−−−−
eksponaty z tworzywami ceramicznymi, albumy, zdjęcia,
−−−−
literatura zgodna z punktem 7 Poradnika dla nauczyciela.
Ćwiczenie 3
Określ, przydatność związków nieorganicznych i organicznych na potrzeby przemysłu
Połącz w logiczne pary i uzupełnij tabelę.
Związek chemiczny
Związek chemiczny
1.
Wodorotlenek sodu NaOH
A.
Do produkcji artykułów spożywczych, kosmetyków, leków, mydła,
ś
rodków owadobójczych.
2.
Kwas siarkowy(VI)
B.
Są stosowane jako rozpuszczalniki (metanol, etanol), leki (etanol),
kosmetyki (glicerol), płyn do chłodnic (etanodiol).
3.
Chlorek sodu NaCl
C.
Do produkcji środków piorących, materiałów wybuchowych,
nawozów mineralnych, barwników, leków, akumulatorów, nafty,
olejów, smarów.
4.
Alkohole
D.
Jako przyprawy w gospodarstwie domowym.
5.
Estry
E.
Do produkcji papieru, szkła barwników, mydła, w chemii
budowlanej, w przemyśle cukierniczym.
Związek chemiczny
1.
2.
3.
4.
5.
Zastosowanie
Wskazówki do realizacji
Celem tego ćwiczenia jest sprawdzenie przyswojenia i stosowania przez uczniów
terminologii z zakresu chemii. Uczniowie powinni pracować samodzielnie. Nauczyciel
wskazuje uczniów do prezentacji.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować opisy związków nieorganicznych i organicznych,
3) wyszukać charakterystyczne informacje o związkach podanych w tabeli,
4) dobrać w pary: związek chemiczny – zastosowanie
5) uzupełnić zapis w tabeli,
6) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−−−−
ć
wiczenie,
−−−−
dyskusja dydaktyczna.
Ś
rodki dydaktyczne:
−−−−
Poradnik dla ucznia,
−−−−
arkusz z zadaniem,
−−−−
literatura zgodna z punktem 7 Poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
5.3.
Reakcje chemiczne
5.3.1. Ćwiczenia
Ćwiczenie 1
Dobierz współczynniki w poniższych równaniach zgodnie prawem zachowania masy
i określ, do jakiego typu należą reakcje:
Mg + O
2
→
Mg O
CaCO
3
→
Ca O + CO
2
H
2
+ O
2
→
H
2
O
Fe
2
O
3
+
Al
→
Al
2
O
3
+
Fe
HgO
→
Hg + O
2
Na OH + H
2
SO
4
→
Na
2
SO
4
+
H
2
O
Wskazówki do realizacji
Uczniowie pracują indywidualnie. Uczniowie, wybrani przez nauczyciela kolejno
omawiają zdania, uzasadniając wybraną odpowiedź.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować zapisy równań chemicznych,
3) podjąć decyzje o prawidłowym uzupełnieniu współczynników stechiometrycznych,
4) wpisać w wolne kratki odpowiednie współczynniki stechiometryczne,
5) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−−−−
ć
wiczenie.
Ś
rodki dydaktyczne:
−
Poradnik dla ucznia,
−
zeszyt.
Ćwiczenie 2
Określ wpływ czynników fizycznych na szybkość reakcji chemicznych. Przy każdym
z nich podaj uzasadnienie. Wpisz do rubryki, „Wpływ na szybkość” jeden z dwóch
wybranych wyrazów: zwiększa lub zmniejsza.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Tabela do ćwiczenia 2
Czynnik
Wpływ na szybkość
Uzasadnienie
Ogrzewanie
Rozdrabnianie
Zatężanie mieszaniny reakcyjnej
Chłodzenie substratu
Rozcieńczanie mieszaniny reakcyjnej
Wzrost ciśnienia
Wskazówki do realizacji
Uczniowie pracują indywidualnie. Uczniowie, wybrani przez nauczyciela kolejno
omawiają poprawnie wstawione wyrazy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować zawartość tabeli,
3) podjąć decyzje o prawidłowym uzupełnieniu,
4) uzupełnić tabelę,
5) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−
dyskusja dydaktyczna,
−
ć
wiczenie.
Ś
rodki dydaktyczne:
−
Poradnik dla ucznia,
−
zeszyt.
Ćwiczenie 3
Uzupełnij rozwiązanie zadania:
Jak zmieni się szybkość reakcji: a) po ogrzaniu o 40
o
C, b) po ochłodzeniu o 40
o
C, jeżeli
zmiana temperatury o każde 10
o
C powoduje 2,5 – krotną zmianę szybkości reakcji?
Odpowiedź: Po ogrzaniu o 40
o
C szybkość wzrasta …….. razy. Po ochłodzeniu o 40
o
C
szybkość maleje…….. razy.
Wskazówki do realizacji
Uczniowie pracują indywidualnie. Przed przystąpieniem do realizacji ćwiczenia
nauczyciel powinien omówić jego zakres i sposób wykonania.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować zawartość zadania,
3) podjąć decyzje o prawidłowym rozwiązaniu,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
4) uzupełnić rozwiązanie zadania,
5) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−
ć
wiczenie.
Ś
rodki dydaktyczne:
−
Poradnik dla ucznia,
−
zeszyt.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
5.4. Mieszaniny, roztwory, koloidy
5.4.1. Ćwiczenia
Ćwiczenie 1
Przygotuj mieszaninę granulatu według receptury roboczej. Mieszaninę przygotuj
w młynku laboratoryjnym.
Tabela 1 do ćwiczenia 1. Receptura robocza
Składnik
Ilość
Uziarnienie
Techniczny tlenek glinu
0,3 kg
0–0,05 mm
Elektrokorund
0,7 kg
0,5–1 mm
Woda
50 cm
3
–
Wskazówki do realizacji
Uczniowie pracują indywidualnie Po zakończeniu pracy uczniowie prezentują swoją
pracę.
Sposób wykonania ćwiczenia:
Uczeń powinien:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować przebieg ćwiczenia,
3) przygotować niezbędny sprzęt laboratoryjny,
4) zapoznać się z instrukcją obsługi młynka,
5) sprawdzić stan techniczny młynka,
6) przygotować środki ochrony indywidualnej,
7) sprawdzić stan techniczny wagi,
8) odważyć surowce zgodnie z recepturą,
9) przygotować masę w młynku laboratoryjnym, zgodnie z instrukcją stanowiskową obsługi
urządzenia,
10) mieszać składniki na masę, aż uzyska się jednorodność masy,
11) skontrolować organoleptycznie jednorodność masy,
12) przenieść gotową masę z młynka do zbiornika na masę,
13) zabezpieczyć masę przed utratą wilgoci,
14) oczyścić sprzęt i uporządkować stanowisko pracy,
15) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−
ć
wiczenie laboratoryjne.
Ś
rodki dydaktyczne:
−
Poradnik dla ucznia,
−
zeszyt,
−
surowce,
−
młynek laboratoryjny,
−
instrukcja obsługi młynka,
−
instrukcja stanowiskowa,
−
waga laboratoryjna
−
instrukcja obsługi wagi,
−
ś
rodki ochrony indywidualnej,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
−
zbiornik na masę,
−
sprzęt laboratoryjny.
Ćwiczenie 2
Przygotuj 1 litr 30% roztworu sody. Jako rozpuszczalnika użyj wody destylowanej.
Wskazówki do realizacji
Uczniowie pracują indywidualnie. Pierwszych pięciu uczniów przedstawia wyniki swojej
pracy z uzasadnieniem do oceny pracy swojemu nauczycielowi. Po upływie czasu pracy
pozostali uczniowie prezentują wykonanie ćwiczenia.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować przebieg ćwiczenia,
3) przygotować niezbędny sprzęt laboratoryjny,
4) przygotować środki ochrony indywidualnej,
5) sprawdzić stan techniczny wagi,
6) odważyć sodę zgodnie z recepturą,
7) sporządzić roztwór zgodnie z procedurą,
8) oczyścić sprzęt i uporządkować stanowisko pracy,
9) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−
ć
wiczenie laboratoryjne.
Ś
rodki dydaktyczne:
−
Poradnik dla ucznia,
−
zeszyt,
−
surowce,
−
waga laboratoryjna
−
instrukcja obsługi wagi,
−
ś
rodki ochrony indywidualnej,
−
zbiornik na sodę,
−
sprzęt laboratoryjny.
Ćwiczenie 3
Połącz nazwy i wzory upłynniaczy nieorganicznych
Nazwa
Wzór
1.
Węglan sodu (soda bezwodna)
A.
LiOH
2.
Węglan sodu krystaliczny (soda krystaliczna)
B.
Li
2
CO
3
3.
Wodorotlenek sodu (soda kaustyczna)
C.
Na
2
C
2
O
4
4.
Pirofosforan czterosodowy
D.
Na
2
CO
3 ·
10H
2
O
5.
Szczawian sodu
E.
NaOH
6.
Wodorotlenek litu
F.
Na
2
CO
3
7.
Węglan litu
G. Na
4
P
2
O
7

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Nazwa
1
2
3
4
5
6
7
Wzór
Wskazówki do realizacji
Uczniowie pracują indywidualnie Po zakończeniu pracy uczniowie prezentują swoją
pracę.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować zestawienie upłynniaczy,
3) połączyć nazwy i wzory upłynniaczy,
4) uzupełnić tabelę,
5) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−
ć
wiczenie.
Ś
rodki dydaktyczne:
−
Poradnik dla ucznia,
−
zeszyt.
Ćwiczenie 4
Dobierz sprzęt laboratoryjny do realizacji badań i podaj przepisy bhp obowiązujące przy
pracach laboratoryjnych. Sprzęt należy dobrać do wcześniej wykonywanych ćwiczeń 1 i 2
Wskazówki do realizacji
Uczniowie pracują indywidualnie. Po zakończeniu pracy uczniowie prezentują swoją
pracę.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować literaturę wskazaną przez nauczyciela,
3) przygotować sprzęt laboratoryjny,
4) zaprezentować wykonanie ćwiczenia.
Zalecane metody nauczania–uczenia się:
−−−−
ć
wiczenie.
Ś
rodki dydaktyczne:
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 Poradnika dla nauczyciela,
−
sprzęt laboratoryjny,
−
zeszyt.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
5.5. Wybrane pojęcia z krystalochemii
5.5.1. Ćwiczenia
Ćwiczenie 1
Połącz odpowiednie
terminy z kolumny I i przyporządkuj im określenia z kolumny II.
Termin
Określenie
1.
Kryształ
A.
Wszystkie znane naturalne i sztuczne kryształy
2.
Komórka jednostkowa
B.
Jest
to
liczba
najbliższych
elementów
struktury
(jonów)
otaczających dany jon w krysztale
3.
Krzemiany
C.
Ugrupowanie przestrzenne atomów, jonów lub drobin o prawidłowej
okresowości
4.
Kryształy rzeczywiste
D.
Zbudowane są z sieci o koordynacji jonowej
5.
Liczba koordynacyjna
E.
Ciało, które przeciwstawia się uporządkowanemu przepływowi
prądu elektrycznego
6.
Przewodnik
F.
Stanowi powtarzający się motyw konstrukcyjny danego kryształu
7.
Dielektryk (izolator)
G.
Ciało, które przewodzi prąd elektryczny wskutek uporządkowanego
przepływu elektronów w polu przyłożonego napięcia
Termin
1
2
3
4
5
6
7
Określenie
Wskazówki do realizacji
Celem tego ćwiczenia jest sprawdzenie stosowania przez uczniów prawidłowej
terminologii z zakresu krystalochemii. Uczniowie pracują indywidualnie. Czas wykonania
ć
wiczenia 10 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać określone treści z Poradnika dla ucznia,
2) przeanalizować zawartość tabeli w ćwiczeniu.1,
3) dobrać w pary: termin – określenie,
4) połączyć poprawne określenia,
5) zaprezentować wykonane ćwiczenie.
Zalecane metody nauczania–uczenia się:
−
ć
wiczenie,
−
dyskusja dydaktyczna.
Ś
rodki dydaktyczne:
−
Poradnik dla ucznia,
−
zeszyt,
−
literatura zgodna z punktem 7 Poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
Ćwiczenie 2
Uzupełnij teksty odpowiednimi słowami. W każdą lukę należy wpisać tylko jedno słowo.
Zadania krystalochemii:
−
badania struktury ...............,
−
............... wpływu rozmieszczenia atomów w kryształach (struktury) i budowy ich osłon
elektronowych na właściwości fizyczne i chemiczne kryształów.
Kryształem, w ogólnym znaczeniu, nazywamy ugrupowanie przestrzenne .............. jonów
lub drobin, wykazujące prawidłową okresowość w różnych kierunkach.
Dielektrykami (.....................) nazywamy takie ciała, które przeciwstawiają się
uporządkowanemu przepływowi prądu elektrycznego. Należą do nich głównie kryształy
krzemianów, w których warstwy zewnętrzne atomów (jonów) są obsadzone przez elektrony.
Wskazówki do realizacji:
Celem tego ćwiczenia jest sprawdzenie na ile uczniowie potrafią posłużyć się
terminologią z zakresu struktury kryształu. Uczniowie powinni pracować samodzielnie.
Nauczyciel wskazuje uczniów do prezentacji.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeanalizować tekst ćwiczenia,
2) przeanalizować luki decydując, jakie słowa należy wpisać,
3) uzupełnić luki odpowiednimi zwrotami,
4) zaprezentować wykonane ćwiczenie,
5) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
–
ć
wiczenie.
Ś
rodki dydaktyczne:
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 Poradnika dla nauczyciela.
Ćwiczenie 3.
Określ, które zdania są prawdziwe, a które fałszywe.
Zdanie
Prawda
Fałsz
Kryształem, w ogólnym znaczeniu, nazywamy ugrupowanie przestrzenne atomów,
jonów lub drobin, wykazujące prawidłową okresowość w różnych kierunkach.
Wszystkie znane naturalne i sztuczne atomy należą do kryształów rzeczywistych.
Liczba koordynacyjna jest to liczba ułamkowa elementów struktury (np. jonów)
otaczających dany koordynujący (podporządkowujący je sobie) jon w krysztale.
Przewodnikami nazywamy ciała, które nie przewodzą prądu elektrycznego
wskutek uporządkowanego przepływu elektronów w polu przyłożonego napięcia.
Dielektrykami (atomami) nazywamy takie ciała, które przeciwstawiają się
uporządkowanemu przepływowi prądu elektrycznego.
Różne rodzaje wad sieciowych można wykrywać i badać za pomocą promieni
Roentgena, przewodnictwa elektrycznego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Wskazówki do realizacji
Celem tego ćwiczenia jest sprawdzenie na ile uczniowie potrafią posłużyć się
terminologią z zakresu krystalochemii. Uczniowie powinni pracować samodzielnie.
Nauczyciel wskazuje uczniów do prezentacji.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przeczytać określone treści z Poradnika dla ucznia dotyczące krystalochemii,
2) przeanalizować zdania decydując czy jest prawdziwe czy fałszywe,
3) uzupełnić tabelę,
4) zaprezentować wykonane ćwiczenie,
5) dokonać oceny poprawności wykonanego ćwiczenia.
Zalecane metody nauczania–uczenia się:
−
ć
wiczenie.
Ś
rodki dydaktyczne:
−
Poradnik dla ucznia,
−
zeszyt,
−
literatura zgodna z punktem 7 Poradnika dla nauczyciela.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
6. EWALUACJA OSIĄGNIĘĆ UCZNIA
Przykłady narzędzi pomiaru dydaktycznego
TEST 1
Test dwustopniowy do jednostki modułowej „Stosowanie podstawowych
pojęć z zakresu chemii ceramicznej”
Test składa się z 20 zadań wielokrotnego wyboru, z których:
−−−−
zadania 1–15 są poziomu podstawowego,
−−−−
zadania 16–20 są poziomu ponadpodstawowego.
Punktacja zadań 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzymuje następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 8 zadań,
−
dostateczny – za rozwiązanie co najmniej 10 zadań,
−
dobry – za rozwiązanie 14 zadań, w tym co najmniej 2 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 18 zadań, w tym 4 z poziomu ponadpodstawowego.
Klucz odpowiedzi: 1. b, 2. b, 3. a, 4. b, 5. b, 6. c, 7. b, 8. d, 9. c, 10. d,
11. a,
12. a, 13. d, 14. c, 15. b, 16. c, 17. c, 18. d, 19. a, 20. b.
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1.
Zdefiniować podstawowe pojęcia z zakresu
chemii
A
P
b
2. Rozróżnić terminologię z zakresu chemii
B
P
b
3. Dobrać terminologię chemiczną
B
P
a
4. Rozpoznać pierwiastki stosowane w ceramice
C
P
b
5. Wskazać związki organiczne
A
P
b
6. Zdefiniować reakcje chemiczne
A
P
c
7. Zdefiniować zmiany stanów skupienia
A
P
b
8.
Wyjaśnić
różnicę
między
mieszaniną
a roztworem rzeczywistym
B
P
d
9. Dobrać terminologię krystalochemii
B
P
c
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
10. Objaśnić zjawisko koagulacji
B
P
d
11. Rozróżnić podstawowe pojęcia technologiczne
B
P
a
12. Rozróżnić rodzaje próbek materiałów
B
P
a
13. Zdefiniować pojęcie upłynniaczy
A
P
d
14.
Nazwać potrzebny sprzęt do pobrania próbek
materiału sypkiego
A
P
c
15. Zdefiniować zjawisko koagulacji
A
P
b
16.
Rozróżnić układy koloidalne i określić ich
właściwości
C
PP
c
17.
Dobrać
sposób
bezpiecznego
sposobu
rozcieńczania kwasów
C
PP
c
18. Scharakteryzować liczbę koordynacyjną
C
PP
d
19. Określić cel przygotowania próbki średniej
C
PP
a
20. Obliczyć stężenie procentowe roztworu
C
PP
b

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
Przebieg testowania
Instrukcja dla nauczyciela
1. Ustal z uczniami termin przeprowadzenia sprawdzianu z co najmniej jednotygodniowym
wyprzedzeniem.
2. Omów z uczniami cel stosowania pomiaru dydaktycznego.
3. Zapoznaj uczniów z rodzajem zadań podanych w zestawie oraz z zasadami punktowania.
4. Przeprowadź z uczniami próbę udzielania odpowiedzi na takie typy zadań testowych,
jakie będą w teście.
5. Omów z uczniami sposób udzielania odpowiedzi (karta odpowiedzi).
6. Zapewnij uczniom możliwość samodzielnej pracy.
7. Rozdaj uczniom zestawy zadań testowych i karty odpowiedzi, podaj czas przeznaczony
na udzielanie odpowiedzi.
8. Postaraj się stworzyć odpowiednią atmosferę podczas przeprowadzania pomiaru
dydaktycznego (rozładuj niepokój, zachęć do sprawdzenia swoich możliwości).
9. Na 5 minut przed zakończeniem sprawdzianu przypomnij uczniom o zbliżającym się
czasie zakończenia udzielania odpowiedzi.
10. Zbierz karty odpowiedzi oraz zestawy zadań testowych.
11. Sprawdź wyniki i wpisz do arkusza zbiorczego.
12. Przeprowadź analizę uzyskanych wyników sprawdzianu i wybierz te zadania, które
sprawiły uczniom największe trudności.
13. Ustal przyczyny trudności uczniów w opanowaniu wiadomości i umiejętności.
14. Opracuj wnioski do dalszego postępowania, mającego na celu uniknięcie niepowodzeń
dydaktycznych – niskie wyniki przeprowadzonego sprawdzianu.
Instrukcja dla ucznia
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Test zawiera 20 zadań. Wszystkie zadania są zadaniami wielokrotnego wyboru i tylko
jedna odpowiedź jest prawidłowa.
5. Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi: zaznacz prawidłową
odpowiedź X (w przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem,
a następnie ponownie zakreślić odpowiedź prawidłową).
6. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7. Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego
rozwiązanie na później i wróć do niego, gdy zostanie Ci czas wolny. Trudności mogą
przysporzyć Ci zadania: 16–20, gdyż są one na poziomie trudniejszym niż pozostałe.
Przeznacz na ich rozwiązanie więcej czasu.
8. Na rozwiązanie testu masz 30 minut.
Powodzenia!
Materiały dla ucznia:
−
instrukcja,
−
zestaw zadań testowych,
−
karta odpowiedzi.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
ZESTAW ZADAŃ TESTOWYCH
1. Jądro atomowe składa się z
a) elektronów.
b) protonów i neutronów.
c) promieni atomowych.
d) protonów.
2. Powłokowa konfiguracja elektronowa to
a) elektrony walencyjne.
b) rozmieszczenie elektronów w powłokach.
c) liczba powłok elektronowych.
d) prawo okresowości.
3. NaOH to wzór chemiczny
a) wodorotlenku sodu.
b) wodorotlenku magnezu.
c) kwasu.
d) soli.
4. Czerwony kolor na fajansie pochodzi od pierwiastka
a) germanu.
b) chromu Cr
6+
.
c) tlenu.
d) azotu.
5. Estry stosuje się do produkcji
a) tkanin.
b) środków owadobójczych.
c) ceramiki.
d) mas plastycznych.
6. Reakcja wymiany to
a) przemiana fizyczna.
b) reakcja łączenia dwóch substratów w jeden produkt.
c) reakcja, w wyniku której następuje wymiana składników między substratami.
d) reakcja rozpadu jednego substratu na dwa produkty.
7. Topnienie to przekształcenie
a) ciała stałego w gaz.
b) ciała stałego w ciecz.
c) cieczy w ciało stałe.
d) cieczy w gaz.
8. Cechą roztworu rzeczywistego jest to, że
a) można składniki rozróżnić wzrokowo.
b) można wyróżnić w nim dwie fazy: ciekłą i stałą.
c) jego składnikami są tylko ciecze.
d) składników nie można rozróżnić wzrokowo.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
9. Ugrupowanie przestrzenne atomów, jonów lub drobin, wykazujące prawidłową
okresowość w różnych kierunkach nazywamy
a) liczbą koordynacyjną.
b) atomem.
c) kryształem.
d) molem.
10. Proces polegający na łączeniu się cząstek fazy rozproszonej koloidu w większe agregaty
tworzące fazę ciągłą o nieregularnej strukturze nazywamy
a) rozpuszczaniem.
b) wysalaniem.
c) peptyzacją.
d) koagulacją.
11. Wszystkie czynności, związane z przemianami fizycznymi i chemicznymi, które należy
wykonać, aby z surowca otrzymać gotowy produkt noszą nazwę
a) procesu technologicznego.
b) procesów jednostkowych.
c) procesu produkcyjnego.
d) operacji jednostkowych.
12. Z różnych miejsc, dużej partii materiału, pobrano szereg próbek. Są to próbki
a) pierwotne.
b) analityczne.
c) średnie.
d) ogólne.
13. Substancje zdolne do obniżania lepkości gęstwy przy stałej ilości wody to
a) masy.
b) roztwory.
c) koloidy.
d) upłynniacze.
14. Do pobrania próbek materiałów sypkich należy użyć
a) pojemnik.
b) kruszarkę.
c) zgłębnik.
d) cylinder.
15. Tężenie (sztywnienie, galaretowacenie) zawiesin minerałów ilastych to zjawisko
a) upłynniania.
b) koagulacji.
c) tiksotropii.
d) peptyzacji.
16. Koloidem nie jest
a) galareta.
b) klej.
c) zawiesina.
d) faza rozproszona występuje w rozdrobnieniu od 1 do 200 nm.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
17. Podczas rozcieńczania stężonego kwasu siarkowego(VI) należy
a) powoli wlewać wodę do kwasu, roztwór ciągle mieszając.
b) całą ilość wody szybko wlać do odmierzonego wcześniej kwasu.
c) powoli wlewać kwas do wody, roztwór ciągle mieszając
d) całą ilość kwasu odmierzonego wcześniej kwasu szybko wlać do wody
18. Liczba koordynacyjna to liczba
a) molowa.
b) atomowa.
c) elektronów.
d) elementów struktury (np. jonów) otaczających dany koordynujący jon w krysztale.
19. Celem przygotowania próbki średniej nie jest
a) ustalenie koloru gliny.
b) wydzielenie części surowca.
c) przygotowanie potrzebnej ilości do badań.
d) ustalenie właściwości odpowiadającym nadesłanej całości.
20. Po rozpuszczeniu 50 gramów soli w 200 gramach wody otrzymamy roztwór o stężeniu
a) 2%
b) 20%
c) 25%
d) 2,5%.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
KARTA ODPOWIEDZI
Imię i nazwisko ……………………………………………………..
Stosowanie podstawowych pojęć z zakresu chemii ceramicznej
Zakreśl poprawną odpowiedź.
Numer
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
TEST 2
Test dwustopniowy do jednostki modułowej „Stosowanie podstawowych
pojęć z zakresu chemii ceramicznej”
Test składa się z 20 zadań wielokrotnego wyboru, z których:
−
zadania 1–15 są poziomu podstawowego,
−
zadania 16–20 są poziomu ponadpodstawowego.
Punktacja zadań 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzymuje następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 8 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 10 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 14 zadań, w tym co najmniej 2 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 18 zadań, w tym 4 z poziomu ponadpodstawowego.
Klucz odpowiedzi: 1. a, 2. d, 3. a, 4. b, 5. b, 6. d 7. b, 8. b, 9. d,
10. d, 11. a,
12. c, 13. c, 14. a, 15. a, 16. a, 17. b, 18. a, 19. a, 20. b.
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1.
Zdefiniować podstawowe pojęcia z zakresu
chemii
A
P
a
2. Dobrać terminologię ceramiczną
B
P
d
3. Dobrać terminologię chemiczną
B
P
a
4. Objaśnić zastosowanie kwasu
B
P
b
5. Wskazać typ reakcji chemicznej
B
P
b
6.
Zidentyfikować symbole pierwiastków
chemicznych
A
P
d
7.
Rozpoznać wzory chemiczne substancji
stosowanych w technologii ceramicznej
C
P
b
8.
Obliczyć skład roztworu o określonym stężeniu
procentowym
C
P
b
9. Zdefiniować zjawisko tiksotropii
A
P
d
10.
Zdefiniować fizyczne czynniki wpływające na
szybkość reakcji
B
P
d
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
11. Zdefiniować upłynnienie masy ceramicznej
B
P
a
12. Zdefiniować pojęcie masy ceramicznej
B
P
c
13. Wskazać masę ceramiczną
B
P
c
14. Rozróżnić rodzaje próbek materiałów
B
P
a
15.
Rozpoznać substraty w równaniu reakcji
chemicznej
C
P
a
16. Określić masy ceramiczne
C
PP
a
17.
Określić metodę wykrywania wad sieciowych
w strukturze kryształów
C
PP
b
18.
Scharakteryzować konfigurację elektronów dla
pierwiastka węgla
C
PP
a
19.
Określić, w jakich jednostkach wyrażany jest
skład mieszanin
C
PP
a
20. Określić skład piasku
C
PP
b

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
Przebieg testowania
Instrukcja dla nauczyciela
1. Ustal z uczniami termin przeprowadzenia sprawdzianu z co najmniej jednotygodniowym
wyprzedzeniem.
2. Omów z uczniami cel stosowania pomiaru dydaktycznego.
3. Zapoznaj uczniów z rodzajem zadań podanych w zestawie oraz z zasadami punktowania.
4. Przeprowadź z uczniami próbę udzielania odpowiedzi na takie typy zadań testowych,
jakie będą w teście.
5. Omów z uczniami sposób udzielania odpowiedzi (karta odpowiedzi).
6. Zapewnij uczniom możliwość samodzielnej pracy.
7. Rozdaj uczniom zestawy zadań testowych i karty odpowiedzi, podaj czas przeznaczony
na udzielanie odpowiedzi.
8. Postaraj się stworzyć odpowiednią atmosferę podczas przeprowadzania pomiaru
dydaktycznego (rozładuj niepokój, zachęć do sprawdzenia swoich możliwości).
9. Na 5 minut przed zakończeniem sprawdzianu przypomnij uczniom o zbliżającym się
czasie zakończenia udzielania odpowiedzi.
10. Zbierz karty odpowiedzi oraz zestawy zadań testowych.
11. Sprawdź wyniki i wpisz do arkusza zbiorczego.
12. Przeprowadź analizę uzyskanych wyników sprawdzianu i wybierz te zadania, które
sprawiły uczniom największe trudności.
13. Ustal przyczyny trudności uczniów w opanowaniu wiadomości i umiejętności.
14. Opracuj wnioski do dalszego postępowania, mającego na celu uniknięcie niepowodzeń
dydaktycznych – niskie wyniki przeprowadzonego sprawdzianu.
Instrukcja dla ucznia
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Test zawiera 20 zadań. Wszystkie zadania są zadaniami wielokrotnego wyboru i tylko
jedna odpowiedź jest prawidłowa.
5. Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi: zaznacz prawidłową
odpowiedź X (w przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem,
a następnie ponownie zakreślić odpowiedź prawidłową).
6. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7. Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego
rozwiązanie na później i wróć do niego, gdy zostanie Ci czas wolny. Trudności mogą
przysporzyć Ci zadania: 16–20, gdyż są one na poziomie trudniejszym niż pozostałe.
Przeznacz na ich rozwiązanie więcej czasu.
8. Na rozwiązanie testu masz 30 minut.
Powodzenia!
Materiały dla ucznia:
−
instrukcja,
−
zestaw zadań testowych,
−
karta odpowiedzi.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
ZESTAW ZADAŃ TESTOWYCH
1. Liczba atomowa jest
a) równa liczbie elektronów w atomie.
b) jest liczbą masową.
c) nukleonem.
d) drobiną.
2. Zielony kolor dekoracji na wyrobach ceramicznych pochodzi od pierwiastka
a) żelaza.
b) węgla.
c) tlenu.
d) chromu Cr
3+
.
3. Wiązanie kowalencyjne to wiązanie
a) utworzone przez uwspólnienie pary elektronów.
b) utworzone przez oderwanie elektronów.
c) między cząsteczkami pierwiastków.
d) między jonami tego samego znaku.
4. Kwas siarkowy(VI) stosuje się w produkcji
a) pasty do zębów.
b) akumulatorów.
c) pieczywa.
d) artykułów spożywczych.
5. Reakcja, w której z dwóch lub więcej substratów powstaje jeden produkt to reakcja
a) analizy.
b) łączenia (syntezy).
c) egzoenergetyczna.
d) rozkładu.
6. W skład związku o wzorze sumarycznym Na
2
SiO
3
wchodzą następujące pierwiastki
a) sód, siarka i ozon.
b) azot, krzem i tlen.
c) azot, siarka i tlen.
d) sód, krzem i tlen.
7. Na etykiecie opakowania surowca umieszczono nazwę „soda kaustyczna”.
W opakowaniu znajduje się związek
a) Na
2
CO
3
.
b) NaHCO
3
.
c) NaOH.
d) Na
2
SO
4
.
8. Do przygotowania 200 g 5% roztworu NaOH należy użyć
a) 10 g stałego NaOH i 1900 g H
2
O.
b) 10 g stałego NaOH i 190 g H
2
O.
c) 5 g stałego NaOH i 95 g H
2
O.
d) 5 g stałego NaOH i 195 g H
2
O.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
9. Proces, w wyniku którego pod wpływem czynników mechanicznych żel przechodzi w zol, to
a) upłynnianie.
b) koagulacja.
c) peptyzacja.
d) tiksotropia.
10. Na szybkość reakcji chemicznej ma wpływ
a) tylko temperatura.
b) tylko stężenie reagentów.
c) tylko stopień rozdrobnienie reagentów.
d) temperatura, stężenie i stopień rozdrobnienia reagentów.
11. Uzyskanie odpowiedniej technologicznie płynności masy przy minimalnej ilości wody
przez dodanie substancji upłynniającej to
a) upłynnianie masy ceramicznej.
b) tiksotropia.
c) rozpuszczanie.
d) topnienie.
12. Odpowiednio
dobrane
(jakościowo
i
granulometrycznie)
zestawy
surowców
ceramicznych i wody, które w procesie przerobu technologicznego uzyskują stan
nadający się do formowania to
a) koloidy.
b) upłynniacze.
c) masy ceramiczne.
d) roztwory.
13. Przy użyciu 50%, a czasem nawet 70% wody można uzyskać
a) koloid.
b) masę sypką.
c) masę lejną.
d) masę plastyczną.
14. Z różnych miejsc, dużej partii materiału, pobrano szereg próbek. Po wymieszaniu
pobranego materiału uzyskano próbkę
a) ogólną.
b) średnią.
c) analityczną.
d) pierwotną.
15. Wskaż reakcję, w której wodorotlenek wapnia Ca(OH)
2
jest substratem
a) Ca(OH)
2
+ SO
3
→
CaSO
4
+ H
2
O.
b) CaCO
3
→
CaO + CO
2
c) CaO + H
2
O
→
Ca(OH)
2
d) CaO + CO
2
→
CaCO
3

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
16. Masą ceramiczną nie jest
a) koloid.
b) masa sypka.
c) masa plastyczna.
d) masa lejna.
17. Wady struktury kryształów można wykrywać za pomocą
a) oględzin makroskopowych.
b) badań promieniami Roentgena.
c) mikroskopu laboratoryjnego.
d) oględzin przy pomocy lupy.
18. Konfiguracją elektronową węgla nie jest
a) powłoka elektronowa.
b) zapis: K
2
L
6
.
c) zapis:
6
C K
2
L
6.
d) zapis: węgiel K
2
L
6
.
19. Skład mieszanin najczęściej wyraża się w
a) gramach.
b) procentach wagowych.
c) kilogramach.
d) litrach.
20. Głównym składnikiem piasku jest
a) glina.
b) krzemionka.
c) techniczny tlenek glinu.
d) szkło.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
KARTA ODPOWIEDZI
Imię i nazwisko ……………………………………………………..
Stosowanie podstawowych pojęć z zakresu chemii ceramicznej
Zakreśl poprawną odpowiedź.
Numer
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
7. LITERATURA
1. Bogdańska A, Zarembina E.: Chemia. WSiP, Warszawa 1993
2. Flis B., Wyszyńska B.: Zarys technologii ceramiki. WSiP, Warszawa 1986
3. Gulińska H., Haładuda J.: Ciekawa chemia. WSiP, Warszawa 2006
4. Pazdro K. M., Czaja M.: Chemia cz.I. Oficyna Edukacyjna, Warszawa 2003
5. Pazdro K. M., Danikiewicz W.: Chemia. Podręcznik do kształcenia podstawowego
w liceach i technikach. Oficyna Edukacyjna, Warszawa 2002
6. Rusiecki A., Raabe J.: Pracownia technologiczna ceramiki. WSiP, Warszawa
7. Wyszyńska A.: Chemia ceramiczna, WSiP, Warszawa 1976
8. www.google: Krystalochemia, Handke M. wykład
Literatura metodyczna
1. Krogulec-Sobowiec M., Rudziński M.: Poradnik dla autorów pakietów edukacyjnych.
KOWEZiU, Warszawa 2003
2. Niemierko B.: Pomiar wyników kształcenia zawodowego. Biuro Koordynacji Kształcenia
Kadr, Fundusz Współpracy, Warszawa 1997
3. Szlosek F.: Wstęp do dydaktyki przedmiotów zawodowych. Instytut Technologii
Eksploatacji, Radom 1998
Wyszukiwarka
Podobne podstrony:
operator urzadzen przemyslu ceramicznego 813[01] z2 07 u
operator urzadzen przemyslu ceramicznego 813[01] z2 06 n
operator urzadzen przemyslu ceramicznego 813[01] z2 08 u
operator urzadzen przemyslu ceramicznego 813[01] z2 08 n
operator urzadzen przemyslu ceramicznego 813[01] z2 02 u
operator urzadzen przemyslu ceramicznego 813[01] z2 01 u
operator urzadzen przemyslu ceramicznego 813[01] z2 03 n
operator urzadzen przemyslu ceramicznego 813[01] z2 04 n
operator urzadzen przemyslu ceramicznego 813[01] z2 07 n
operator urzadzen przemyslu ceramicznego 813[01] z2 03 u
operator urzadzen przemyslu ceramicznego 813[01] z2 06 u
operator urzadzen przemyslu ceramicznego 813[01] z2 01 n
operator urzadzen przemyslu ceramicznego 813[01] z2 04 u
operator urzadzen przemyslu ceramicznego 813[01] z2 05 n
operator urzadzen przemyslu ceramicznego 813[01] z2 05 u
operator urzadzen przemyslu ceramicznego 813[01] z2 02 n
operator urzadzen przemyslu ceramicznego 813[01] z2 07 u
operator urzadzen przemyslu ceramicznego 813[01] z2 02 n
operator urzadzen przemyslu ceramicznego 813[01] z2 02 u
więcej podobnych podstron