
P
ATOFIZJOLOGIA
G
OSPODARKI
K
WASOWO
-Z
ASADOWEJ
P
P
ATOFIZJOLOGIA
ATOFIZJOLOGIA
G
G
OSPODARKI
OSPODARKI
K
K
WASOWO
WASOWO
-
-
Z
Z
ASADOWEJ
ASADOWEJ
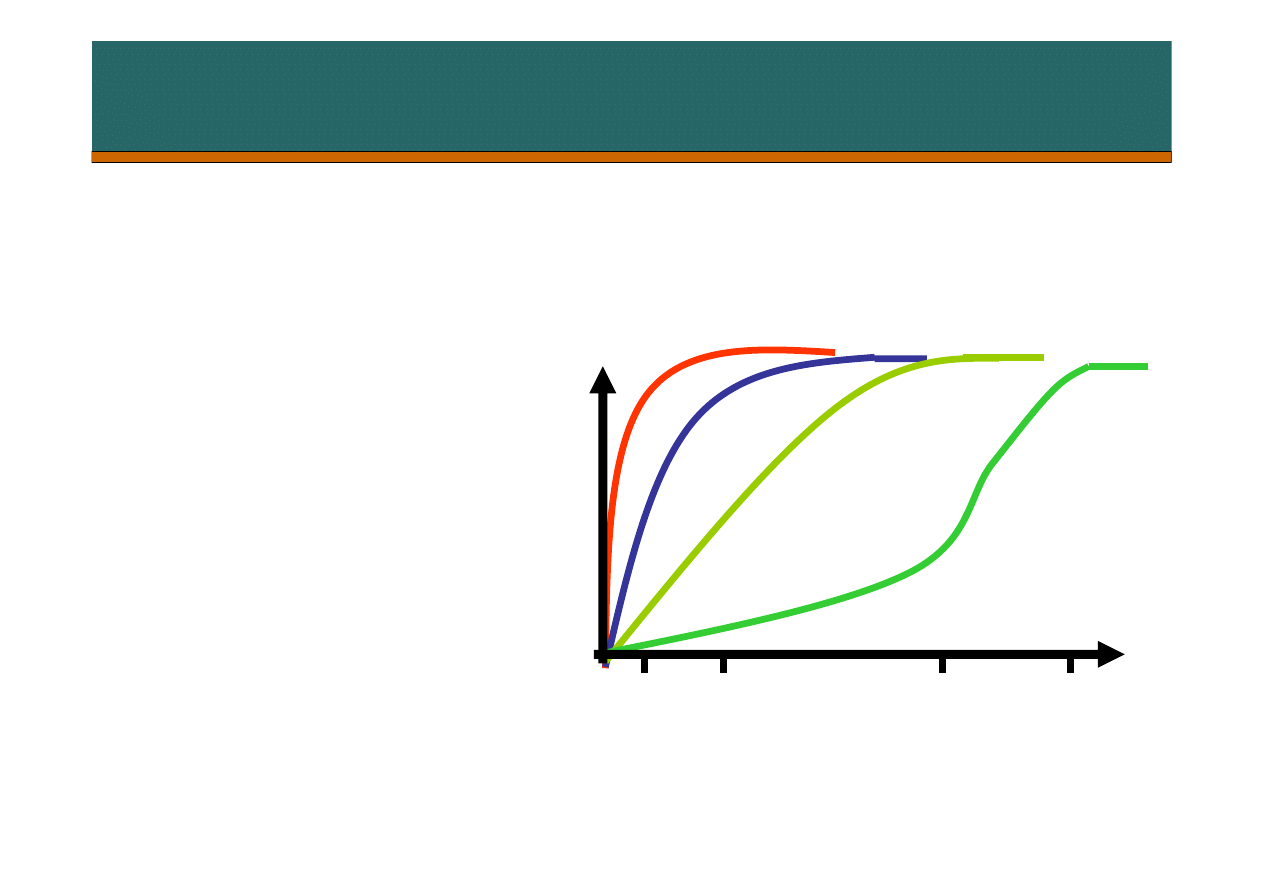
Sposoby buforowania jonów H
+
Sposoby buforowania jonów H
+
3h 6h 12h 72h
B
A
C
D
Aktywacja kolejnych systemów buforowych w
przebiegu kwasicy metabolicznej.
A. Bufory pozakomórkowe:
- wodorowęglanowy,
- fosforanowy,
- białczanowy,
- hemoglobinianowy
B. Bufory wewnątrzkomórkowe
- białczany
- fosforany
C. Buforowanie płucne
D. Buforowanie nerkowe

Równanie Hendersona-Hasselbalcha
Równanie Hendersona-Hasselbalcha
pH = pK
a
+ log
HCO
3
-
(zasada)
α
pCO
2
(kwas)
pH =
HCO
3
-
pCO
2

Reguły prawidłowej kompensacji
Reguły prawidłowej kompensacji
↑ pH =
↓
HCO
3
-
↓
pCO
2
1
2
3
i.
zmiana jednokierunkowa
ii. ze strony komponenty przeciwnej
1- zmiana pierwotna
2-efekt
3-zmiana wyrównawcza

Bufory pozakomórkowe
Bufory pozakomórkowe
Wodorowęglanowy:
- CO
2
/HCO
3
¯
(1:20)
- 53% ogólnej pojemności buforowej
Fosforanowy:
- H
2
PO
4
¯
/HPO
4
2 ¯
(1:4)
- 5% ogólnej pojemności buforowej
- główny bufor wewnątrzkomórkowy
Białczanowy:
- 7% ogólnej pojemności buforowej
- ważny bufor wewnątrzkomórkowy
Hemoglobinianowy:
- 35% ogólnej pojemności buforowej
-
efekt Bohra
– zmiana powinowactwa Hb do O
2
w zależności od pH
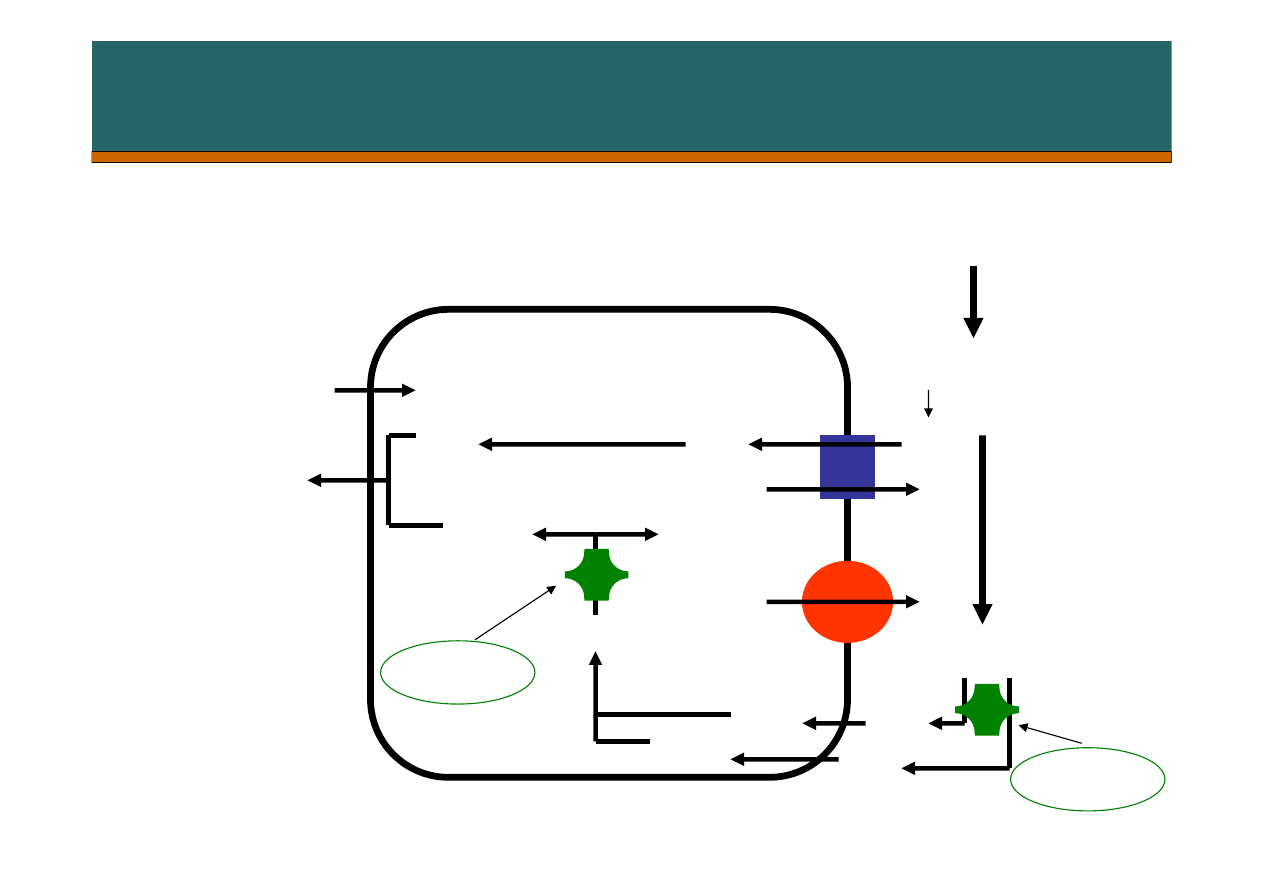
Transport CO
2
we krwi
Transport CO
2
we krwi
CO
2
CO
2
+H
2
O
a.w.
H
2
CO
3
H
+
HCO
3
¯
HCO
3
¯
Cl
¯
Cl
¯
O
2
KHb
O
2
K
+
HHb
HCO
3
¯
HHb
H
+
H
2
CO
3
CO
2
H
2
O
Cl
¯
Cl
¯
K
+
O
2
O
2
O
2
KHb
CO
2
H
2
O
TKANKI
PŁUCA
karbaminian-Hb
karbaminian-Hb
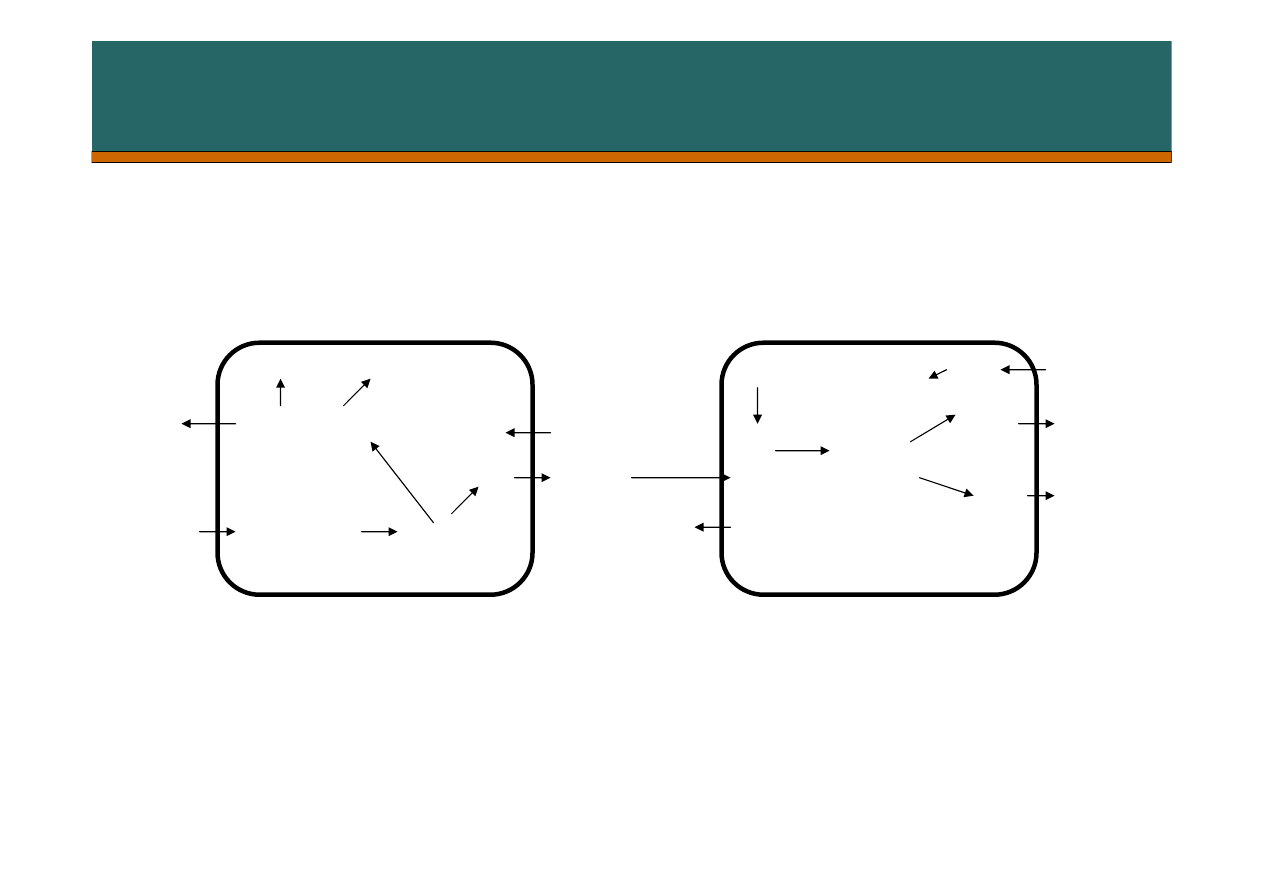
Buforowanie wewnątrzkomórkowe
Buforowanie wewnątrzkomórkowe
↑ K
+
↓ HCO
3
¯
H
+
H
+
K
+
K
+
Na
+
Na
+
Cl
¯
Cl
¯
H
+
H
+
K
+
K
+
Na
+
Na
+
Kwasica
metaboliczna
Zasadowica
metaboliczna
↓ K
+

Rola płuc w gospodarce kwasowo-zasadowej
Rola płuc w gospodarce kwasowo-zasadowej
dobowa produkcja CO
2
= 330 - 440 litrów
zadaniem płuc w r.k.z. jest usuwanie CO
2
(KWASU)
składowe decydujące o prawidłowym wydalaniu CO
2
przez płuca:
- wentylacja płuc,
- ukrwienie (perfuzja) płuc,
- stosunek wentylacji do perfuzji (średnio 0.8-1.0)
znaczenie odruchu pęcherzykowo-włośniczkowego
- dyfuzja gazów.
saturacja krwi tętniczej tlenem sO
2
= 95-98%

Rola nerek w gospodarce kwasowo-zasadowej
Rola nerek w gospodarce kwasowo-zasadowej
Rolą nerek w r.k.z. jest zatrzymywanie HCO
3
¯
(ZASAD)
RESORPCJA HCO
3
¯
:
a) kanalik proksymalny (75-95%)
- H
+
-ATPaza (pompa wodorowa)
- antyporter Na
+
/H
+
b) kanalik dystalny (5-25%)
- H
+
-ATPaza
- ATPaza K
+
/H
+
REGENERACJA HCO
3
¯
:
- wytwarzanie kwaśności miareczkowej
- proces amoniogenezy
Resorpcja HCO
3
¯
w kanaliku proksymalnym
Resorpcja HCO
3
¯
w kanaliku proksymalnym
Światło kanalika
Tkanka śródmiąższowa
NaHCO
3
H
+
H
+
Na
+
Na
+
H
2
CO
3
H
+
H
+
CO
2
CO
2
H
2
O
H
2
O
H
2
CO
3
H
+
HCO
3
¯
Na
+
K
+
K
+
anhydraza
węglanowa
anhydraza
węglanowa
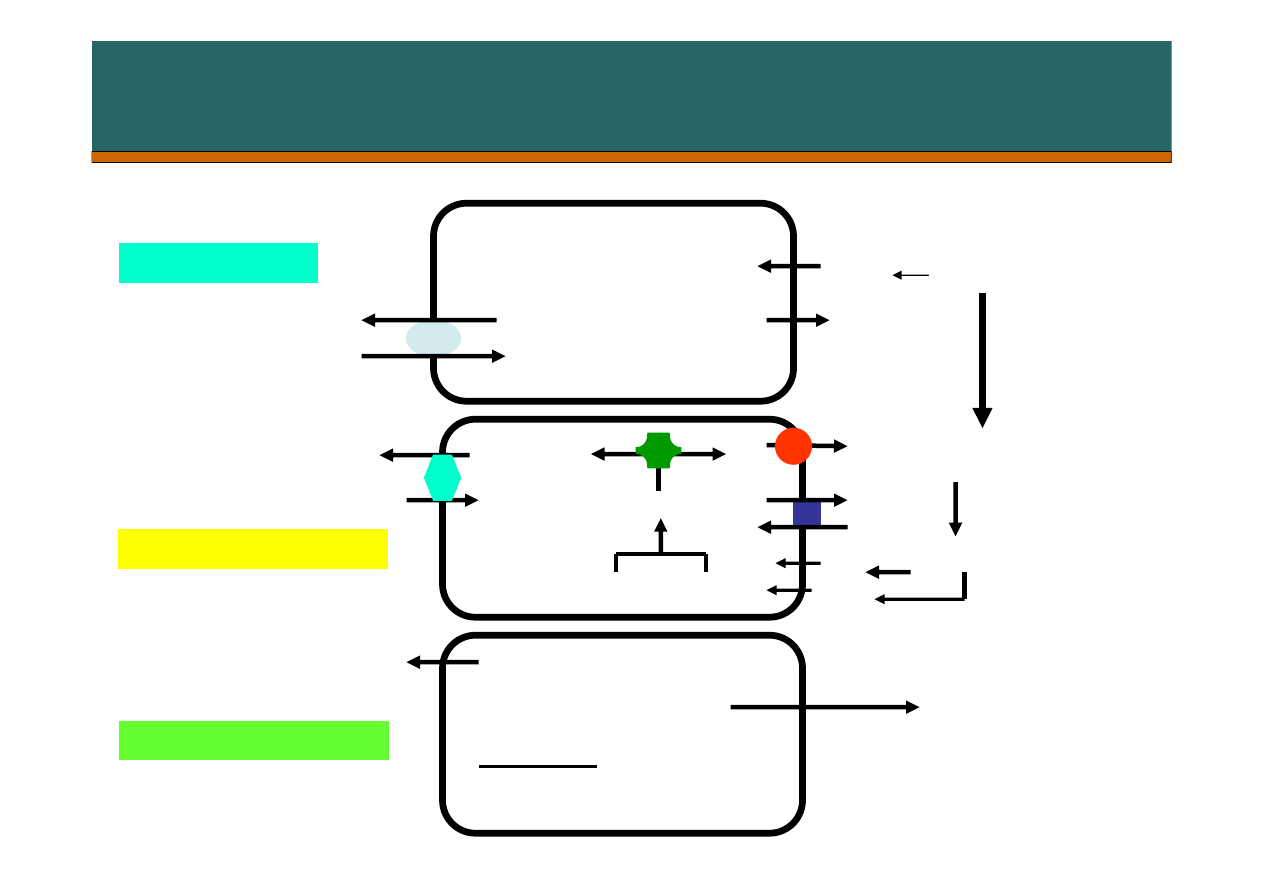
Resorpcja HCO
3
¯
w kanaliku dystalnym
Resorpcja HCO
3
¯
w kanaliku dystalnym
Na
+
H
+
HCO
3
¯
H
2
CO
3
K
+
Światło kanalika
Tkanka śródmiąższowa
Na
+
K
+
K
+
K
+
Na
+
Na
+
NaHCO
3
CO
2
H
2
O
H
2
CO
3
Cl
¯
Cl
¯
H
+
H
+
H
+
HCO
3
¯
CO
2
H
2
O
na odwrót (aktywacja w
stanach zasadowicy)
Komórki wstawkowe
α
Komórki główne
Komórki wstawkowe
β
K
+
K
+
HCO
3
¯
H
+
Regeneracja zasad
Regeneracja zasad
Istotą procesów regeneracji zasad jest wydalanie jonów H
+
w postaci
związanej z buforem oraz równoczesna synteza de novo jonów HCO
3
¯
.
Kwaśność miareczkowa:
- wydalanie H
+
jako kwaśny fosforan (H
2
PO
4
¯
), kwas moczowy, kreatynina
- zachodzi w kanaliku proksymalnym
- wydalanie H
+
= 20-30 mmol/dobę
Amoniogeneza:
- wydalanie H
+
jako jon NH
4
+
- przebieg: kanalik proksymalny
→ wstępujące ramię pętli Henlego →
kanalik dystalny
- sprawność amoniogenezy jest miarą sprawności kanalika dystalnego
- wydalanie H
+
= 30-300 mmol/dobę

Kwasice oddechowe
Kwasice oddechowe
PRZYCZYNY:
Uszkodzenie nerwowej regulacji oddychania:
- choroby organiczne mózgu,
- uszkodzenie nerwów motorycznych (polyomyelitis),
- porażenie OUN przez leki: morfina, barbiturany
Ograniczenia ruchomości klatki piersiowej:
- zmiany kośćca klatki piersiowej
- uszkodzenie czynności mięśni oddechowych (hipokalemia)
- nadmierna otyłość (zespół Pickwicka)
Choroby restrykcyjne i obturacyjne płuc.
Niewydolność serca.
PIERWOTNĄ PRZYCZYNĄ KWASIC ODDECHOWYCH JEST
NAGROMADZENIE SIĘ CO
2
(KWASU) W ORGANIZMIE.

Następstwa hiperkapni (
↑pCO
2
)
Następstwa hiperkapni (
↑pCO
2
)
Rozszerzenie obwodowych naczyń krwionośnych
- zwolnienie przepływu krwi na obwodzie,
- wydłużenie fazy wymiany gazowej,
Rzekome zmniejszenie przestrzeni wodnej pozakomórkowej.
- obkurczenie tętniczki doprowadzającej
- spadek filtracji (GFR),
- aktywacja układu RAA
Wzrost powrotu żylnego.
Hipoksyczny skurcz naczyń płucnych (HSNP).
Objawy niewydolności prawokomorowej serca:
- obrzęki,
- sinica obwodowa,
- wzrost ciśnienia śródczaszkowego

Kompensacja kwasic oddechowych
Kompensacja kwasic oddechowych
Buforowanie wewnątrzkomórkowe:
Buforowanie płucne:
- stymulacja ośrodka oddechowego
Buforowanie nerkowe:
- wzrost resorpcji i regeneracji zasad
Wzrost pCO
2
o 10 mmHg powinien być wyrównany przez podwyższenie [HCO
3
¯
]
o 1 mM (zaburzenia ostre).
Wzrost pCO
2
o 10 mmHg powinien być wyrównany przez podwyższenie [HCO
3
¯
]
o 3,5 mM (zaburzenia przewlekłe).

Zasadowice oddechowe
Zasadowice oddechowe
PIERWOTNĄ PRZYCZYNĄ ZASADOWIC ODDECHOWYCH JEST
NADMIERNE USUWANIE CO
2
Z ORGANIZMU
(HIPERWENTYLACJA).
Pobudzenie czynności ośrodka oddechowego:
a)
bodźce nerwowe:
- ból, histeria
b)
toksyny endo- i egzogenne:
- toksyny bakteryjne
- encefalopatia wątrobowa
c) hipoksja:
- niedokrwistości
- przewlekłe choroby płuc
d) czynniki
drażniące ośrodek oddechowy:
-
salicylany,
- progesteron, estrogeny
Zmiany zwyrodnieniowe OUN,
Nadmierna sztuczna hiperwentylacja

Następstwa hipokapni (
↓pCO
2
)
Następstwa hipokapni (
↓pCO
2
)
Obkurczenie obwodowych naczyń krwionośnych,
Objawy związane z niedotlenieniem mózgu:
- zaburzenia świadomości i mowy
- parestezje,
Wzrost wiązania wapnia przez białka osocza – spadek poziomu wapnia
zjonizowanego – objawy tężyczki.
Wzrost wrażliwości komórek cewki zbiorczej na działanie ADH – nadmierna
retencja wody.
Obkurczenie naczyń wieńcowych (dławica Prinzmetala)

Kompensacja zasadowicy oddechowej
Kompensacja zasadowicy oddechowej
Buforowanie wewnątrzkomórkowe:
- uwalnianie jonów H
+
z białek i fosforanów
- stymulacja produkcji kwasu mlekowego (indukcja fosfofruktokinazy)
Buforowanie nerkowe:
- zmniejszenie sekrecji jonów H
+
,
- zmniejszenie resorpcji i regeneracji zasad
Obniżenie pCO
2
o 10 mmHg powinno być wyrównane przez spadek [HCO
3
¯
] o
2 mM (zaburzenia ostre).
Obniżenie pCO
2
o 10 mmHg powinno być wyrównane przez spadek [HCO
3
¯
] o
4 mM (zaburzenia przewlekłe).

Luka anionowa osocza
Luka anionowa osocza
LA =
ΣNA
¯
-
ΣNK
+
=
[Na
+
] – ([Cl
¯
]+[HCO
3
¯
]) =
12
±4 mEq/l
ΣNA
¯
- nieoznaczone aniony (wszystkie oprócz chlorków i wodorowęglanów,
szczególnie białczany
)
ΣNK
+
- nieoznaczone kationy – wszystkie oprócz jonów sodu

Podział kwasic metabolicznych
Podział kwasic metabolicznych
KWASICE Z PODWYŻSZONĄ LUKĄ ANIONOWĄ:
a) Endogenne
- ketonowa cukrzycowa i głodowa,
- mleczanowa,
- mocznicowa (kumulacja różnego typu kwasów organicznych)
b) Egzogenne (
zatrucia substancjami o charakterze kwasów
):
- salicylanami, etanolem, metanolem, glikolem etylenowym
KWASICE Z PRAWIDŁOWĄ LUKĄ ANIONOWĄ (hiperchloremiczne)
- masywne biegunki (utrata zasadowej treści przewodu pokarmowego)
- w nadczynności przytarczyc (PTH hamuje antyporter Na
+
/H+),
- w hipoaldosteronizmie
- zespolenie moczowodowo-esicze,
- we wczesnym okresie niewydolności nerek,
- kwasice nerkowe kanalikowe,
- polekowe (acetazolamid, cholestyramina)
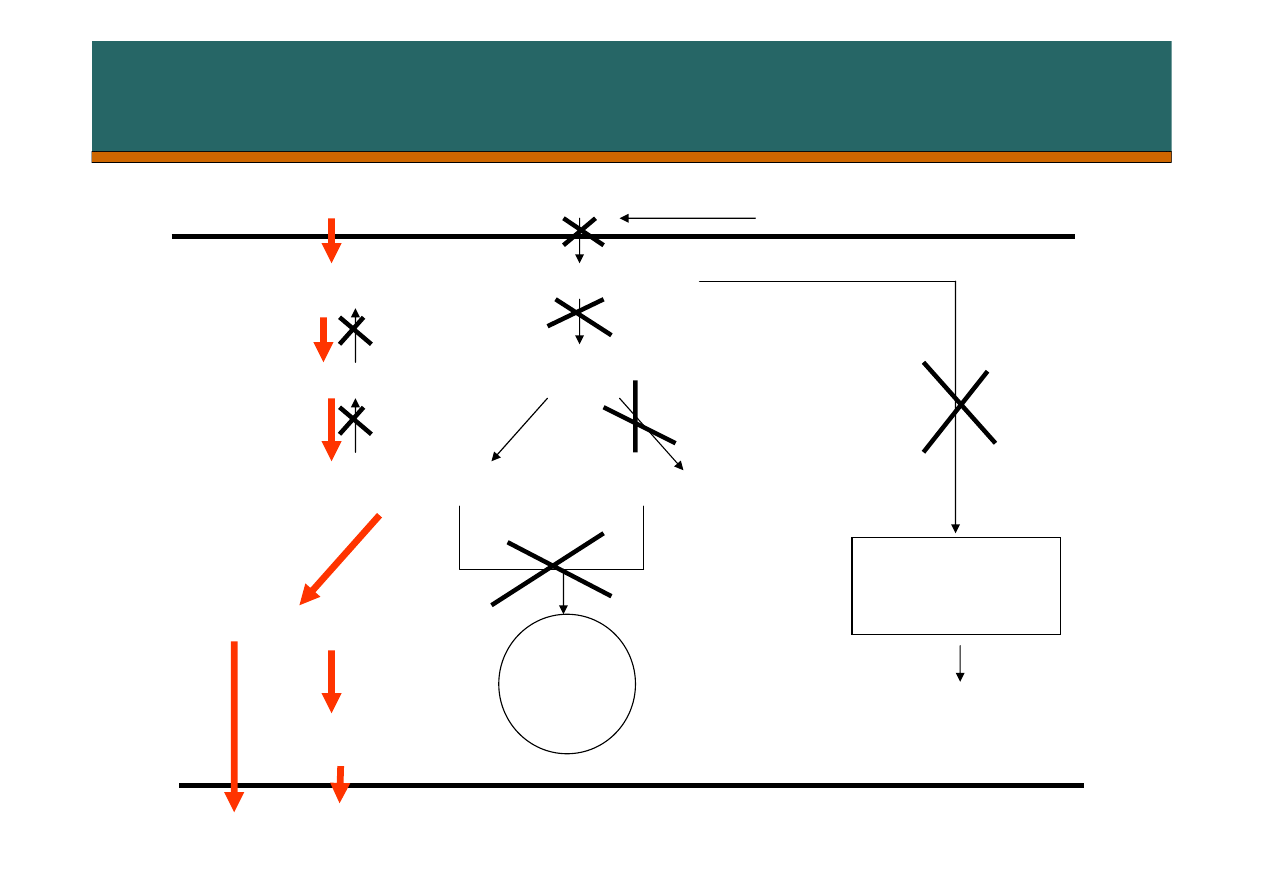
Patogeneza kwasicy ketonowej cukrzycowej
Patogeneza kwasicy ketonowej cukrzycowej
KREW
HEPATOCYT
WKT
TG
WKT
Acetylo-CoA
GLUKOZA
Insulina
GLUKOZA
PIROGRONIAN
- CO
2
+CO
2
SZCZAWIOOCTAN
CYKL
KREBSA
acetooctan
KREW
Beta-hydroksymaślan
CYKL
PENTOZOWY
NADPH
2
KETONEMIA !!
Glikoliza
Beta-oksydacja

Patogeneza kwasicy mleczanowej
Patogeneza kwasicy mleczanowej
Typ A - spowodowana niedoborem tlenu (niedokrwistości)
Typ B – upośledzony rozkład mleczanów:
a) cukrzyca:
- typu 1 – konkurencja z ciałami ketonowymi o równoważniki redukcyjne
- typu 2 – przedawkowanie leków hipoglikemicznych z grupy biguanidów (hamują
glukoneogenezę)
b) zatrucia etanolem (NADH hamuje glukoneogenezę)
c) zatrucia metanolem i
kwasem salicylowym
(upośledzony rozkład mleczanu
w cyklu Krebsa),

Luka osmotyczna osocza
Luka osmotyczna osocza
Luka osmotyczna = osmolalność zmierzona –
osmolalność obliczona = 11
±4 mOsm/kg
Osm. = 2 x [Na
+
] + [mocznik] + [glukoza] = 280-290 mOsm/kg
Jeśli luka osmotyczna jest podwyższona wskazuje to na
kwasicę wynikającą z zatrucia anionami egzogennymi.
LUKA OSMOTYCZNA SŁUŻY OD RÓŻNICOWANIA KWASIC
ENDOGENNYCH OD EGZOGENNYCH

Kwasice nerkowe kanalikowe
Kwasice nerkowe kanalikowe
TYP 1. KWASICA DYSTALNA KLASYCZNA:
a) upośledzone mechanizmów wydzielających H
+
w kanaliku dystalnym:
b) dyfuzja wsteczna jonów H
+
wywołana wzrostem przepuszczalności błony luminalnej
kanalika dystalnego (po amfoterycynie B).
c) upośledzenie wydzielania jonów H
+
zależnego od resorpcji Na
+
TYP 2. KWASICA PROKSYMALNA:
a)
upośledzenie mechanizmów zakwaszania moczu w kanaliku proksymalnym.
TYP 4. KWASICA DYSTALNA HIPERKALEMICZNA:
a)
niedobór aldosteronu,
b)
oporność na aldosteron
c)
stosowanie antagonistów aldosteronu (spironolaktonów)

Luka anionowa moczu
Luka anionowa moczu
Luka anionowa moczu = [Na]
m
+ [K]
m
– [Cl]
m
miernik amoniogenezy
Jeżeli LA moczu jest <0 (suma stężeń [Na]
m
+ [K]
m
< [Cl]
m
), świadczy to o:
a) prawidłowej amoniogenezie,
b) prawidłowej czynności kanalika dystalnego
i przez to wyklucza kwasicę kanalikową dystalną (może wskazywać na
proksymalną).

Kompensacja kwasic metabolicznych
Kompensacja kwasic metabolicznych
Bufory pozakomórkowe:
- wodorowęglanowy (
buforowanie kwasów nielotnych
)
- niewodorowęglanowe + bufor kostny (w kwasicach kanalikowych)
Bufory wewnątrzkomórkowe.
Buforowanie płucne (
oddech Kussmaula
)
Buforowanie nerkowe (
jeśli nerki są sprawne !):
- wzrost resorpcji i regeneracji zasad,
Wartość pCO
2
powinna być równa stężeniu [HCO
3
¯
] + liczba 15.
np. jeśli [HCO
3
¯
] = 15 mM, to pCO
2
powinna być równa 30 (15+15 mM)

Zasadowice metaboliczne
Zasadowice metaboliczne
PIERWOTNĄ PRZYCZYNĄ ZASADOWIC METABOLICZNYCH
JEST WZROST STĘŻENIA WODOROWĘGLANÓW WE KRWI.
Nadmierna utrata jonów H
+
(z. substrakcyjna):
- wymioty,
- utrata z moczem
Nadmierna podaż zasad (z. addycyjna):
- cytrynian sodu, wodorowęglan sodu
Niedobory potasu:
- hiperaldosteronizm,
- hiperkortyzolemia,
- niedobór potasu w diecie,
- utrata potasu z kałem (zespoły złego wchłaniania),
- utrata potasu z moczem,
- tubulopatie (zespół Barttera i zespół Gitelmana),
- leki potasopędne (wyciąg z lukrecji, aldosteron)

Następstwa zasadowic metabolicznych
Następstwa zasadowic metabolicznych
upośledzone ukrwienie tkanek,
niedotlenienie tkanek,
niemiarowość pracy serca,
niewydolność krążenia,
objawy niedotlenienia mózgu,
spadek stężenia Ca
++
- tężyczka,
objawy niedoboru potasu

Kompensacja zasadowic metabolicznych
Kompensacja zasadowic metabolicznych
Bufory zewnątrzkomórkowe:
- uwalnianie jonów H
+
z białek
Bufory wewnątrzkomórkowe:
- wzrost produkcji kwasu mlekowego
Buforowanie płucne:
-
↓ wentylacji płuc
Buforowanie nerkowe:
- na skutek niedoboru potasu zachodzi
↑ wydalania H
+
z moczem mimo
zasadowicy (aciduria paradoxa).
Kompensacja nerkowa jest możliwa dopiero po
wyrównaniu istniejącej kwasicy wewnątrzkomórkowej (uzupełnienie K
+
).
Wzrost [HCO
3
¯
] o 1 mM powinien być wyrównany przez wzrost pCO
2
o 0,7 mmHg.

Narządowe skutki zaburzeń kwasowo-zasadowych
Narządowe skutki zaburzeń kwasowo-zasadowych
Serce
a)
kwasice:
- efekt inotropowy (-) wywołany konkurencją jonów H
+
z Ca
++
b)
zasadowice:
- efekt inotropowy (+)
Kości
- mobilizacja węglanu wapnia w kwasicach nerkowych kanalikowych
- kwasica metaboliczna pobudza osteoklasty
Naczynia krwionośne
- zarówno kwasica i zasadowica wywołują spadek napięcia włókien mięśniowych
- spadkowi temu przeciwdziała produkcja katecholamin
- kwasica wpływa na obkurczenie naczyń żylnych
Mózg
- hiperkapnia zwiększa przepływ krwi
- hipokapnia ogranicza ukrwienie tkanki mózgowej

Wartości referencyjne
Wartości referencyjne
pH = 7.35 – 7.45
[H
+
] = 45 – 35 nmol/l
pO
2
= 75-95 mmHg (8.6-13.3 kPa)
pCO
2
= 35-45 mmHg (4.8-6.0 kPa)
[HCO
3
¯
] = 21-26 mmol/l
sO
2
= 95-98%
BE (nadmiar/niedobór zasad) = ±2.0 mmol/l
BB (zasób zasad) = 42 mEq/l

Obliczenia
Obliczenia
pCO
2
[HCO
3
¯] = 24 x [H
+
]
Obliczanie stężenia wodorowąglanów, pCO
2
i stężenia jonów wodorowych.
pH = 9 – log [H
+
]
[H
+
] = antylog (9 - pH)
(w kalkulatorach antylog to 10
X
)
Przeliczanie wartości H
+
na pH.
Przeliczanie wartości pH na H
+
.
Oblicz stężenie jonów [HCO
3
¯], wiedząc, że wartości pozostałych parametrów gospodarki
kwasowo-zasadowej wynoszą:
pH = 7.32, pCO
2
= 68 mmHg

Przypadek 1
Przypadek 1
Młoda kobieta została przywieziona do izby przyjęć po wypadku samochodowym. Widoczne
poważne obrażenia głowy, częstość oddechu 38/min. Wyniki badań laboratoryjnych:
pH=7.44, pCO
2
= 29.3 mmHg, HCO
3
−
= 19 mM
1. Jaki jest stan gospodarki kwasowo-zasadowej pacjentki?
Wyniki badań laboratoryjnych wskazują na obecność
skompensowanej zasadowicy
oddechowej
.

Przypadek 2
Przypadek 2
16 letni chłopiec trafia do izby przyjęć po zasłabnięciu w szkole. W badaniu przedmiotowym
stwierdzono u niego poważne zaburzenia świadomości i niedociśnienie ortostatyczne.
Dalsze badania wykazały niedokrwistość sierpowatokrwinkową, hemochromatozę i
marskość wątroby. Od kilku dni wymiotuje.
pH=7.55, pCO
2
= 66, HCO
3
−
= 56 mM, Na
+
= 166, K
+
=3, Cl
−
=90.
Jaki jest stan gospodarki kwasowo-zasadowej pacjenta?
zasadowica metaboliczna
Jak ocenisz skuteczność kompensacji tego stanu?
Kompensacja jest skuteczna.
Wzrost [HCO3¯] o 1 mM powinien być wyrównany przez wzrost pCO2 o 0,7 mmHg. Czyli obecny w
tym przypadku wzrost [HCO3¯] o 30 mM (ponad normę) powinien zostać skompensowany wzrostem
pCO2 o 21 mmHg. Ponieważ zmierzone pCO2 wynosi 66 mmHg (45 + 21 mmHg) kompensacja jest w
pełni skuteczna.
Czy możliwa jest obecność innego, „ukrytego” zaburzenia gosp. kwasowo-zasadowej?
Możliwa jest kwasica metaboliczna (mleczanowa).
Potwierdza to podwyższona LA (20 mM)
Jaka jest przyczyna hipernatremii?
Jest nią hiperaldosteronizm wtórny w przebiegu marskości wątroby.

Przypadek 3
Przypadek 3
W nocy, do izby przyjęć trafia 3-letnie dziecko z zaburzeniami świadomości i
przyspieszonym oddechem. W badaniach laboratoryjnych stwierdzono:
pH=7.53, pCO
2
= 12, HCO
3
−
= 10 mM, Na
+
= 140, K
+
=3, Cl
−
=106.
Jaki jest stan gospodarki kwasowo-zasadowej pacjenta?
zasadowica oddechowa (wskutek hiperwentylacji)
Jak ocenisz skuteczność kompensacji tego stanu?
Kompensacyjne obniżenie stężenia HCO
3
−
(o 11 mM poniżej normy) jest znacznie większe
od wymaganego (4.6 mM).
O czym to świadczy?
Mamy do czynienia z „ukrytą” kwasicą metaboliczną, czego dowodem jest podwyższona
wartość wyliczonej luki anionowej (24).
Jaka może być przyczyna takiego mieszanego zaburzenia?
Posocznica (pobudzenie wentylacji przez krążące toksyny bakteryjne)
Zatrucie salicylanami (pobudzenie wentylacji + kwasica mleczanowa)

Przypadek 4
Przypadek 4
Do szpitala został przyjęty gorączkujący 9-latek z zespołem Barttera. Drugiego dnia pobytu
doznaje zapaści. Wyniki badań laboratoryjnych są następujące:
pH=6.9, pCO
2
=81, HCO
3
−
=16 mM, Na
+
=142, K
+
=2.8, Cl
−
=87.
Jaki jest stan gospodarki kwasowo-zasadowej pacjenta?
Ostra kwasica.
Jaka jest natura zaburzenia?
Dwojaka; i oddechowa, i metaboliczna.
Co jest zaburzeniem pierwotnym (dominującym)?
Kwasica oddechowa (większe odstępstwo od normy)
Jak ocenisz skuteczność kompensacji tego stanu?
Brak kompensacji (stężenie wodorowęglanów jest obniżone).
O czym to świadczy?
Potwierdza to obecność kwasicy metabolicznej. Podobnie jak wartość LA (39)
Jaki jest możliwy wpływ zespołu Barttera?
Zasadowica metaboliczna.
Potwierdza to wyliczenie wyjściowego stężenia wodorowęglanów (39 mM).

Przypadek 5
Przypadek 5
Do szpitala zostaje przyjęty mężczyzna skarżący się na zaburzenia świadomości, osłabienie i
bardzo częste krwawienia z nosa. W badaniu przedmiotowym stwierdzono wzdęcie brzucha,
rozluźnienie jego powłok oraz nadciśnienie tętnicze.
pH=7.2, pCO
2
=25mmHg, HCO
3
−
=10mM, Na
+
=150mM, Cl
−
=130mM, Osm=310mOsm/kg,
Glukoza=5 mM,
parametry moczu: Na
+
=50 mM, K
+
=47 mM, Cl
−
=28 mM.
Jaki jest stan gospodarki kwasowo-zasadowej pacjenta?
Kwasica metaboliczna.
Jak ocenisz skuteczność kompensacji tego stanu?
Kompensacja jest skuteczna.
Co może być przyczyną obniżenia luki anionowej?
Hipoalbuminemia.
Jaka może być przyczyna takiego stanu rzeczy?
Marskość wątroby.
Co potwierdza obecność marskości?
Osmolarność osocza, nadciśnienie tętnicze i inne kliniczne objawy niewydolności wątroby
Z jakim typem kwasicy metabolicznej mamy do czynienia?
Z kwasicą nerkową kanalikową (dystalną)

Dziękuję za uwagę.
Koniec
Koniec
Document Outline
- Sposoby buforowania jonów H+
- Równanie Hendersona-Hasselbalcha
- Reguły prawidłowej kompensacji
- Bufory pozakomórkowe
- Transport CO2 we krwi
- Buforowanie wewnątrzkomórkowe
- Rola płuc w gospodarce kwasowo-zasadowej
- Rola nerek w gospodarce kwasowo-zasadowej
- Resorpcja HCO3¯ w kanaliku proksymalnym
- Resorpcja HCO3¯ w kanaliku dystalnym
- Regeneracja zasad
- Kwasice oddechowe
- Następstwa hiperkapni (pCO2)
- Kompensacja kwasic oddechowych
- Zasadowice oddechowe
- Następstwa hipokapni (pCO2)
- Kompensacja zasadowicy oddechowej
- Luka anionowa osocza
- Podział kwasic metabolicznych
- Patogeneza kwasicy ketonowej cukrzycowej
- Patogeneza kwasicy mleczanowej
- Luka osmotyczna osocza
- Kwasice nerkowe kanalikowe
- Luka anionowa moczu
- Kompensacja kwasic metabolicznych
- Zasadowice metaboliczne
- Następstwa zasadowic metabolicznych
- Kompensacja zasadowic metabolicznych
- Narządowe skutki zaburzeń kwasowo-zasadowych
- Wartości referencyjne
- Obliczenia
- Przypadek 1
- Przypadek 2
- Przypadek 3
- Przypadek 4
- Przypadek 5
- Koniec
Wyszukiwarka
Podobne podstrony:
Kw zas
Rownowaga kw zas[1]
stała równowagi kw zas
EGZ 2009 hip nerka kw-zas, Patofizjologia
g wod el i kw zas
Gospodarka wodno elektrolitowe, kw zas, ketoza, cukrzyca
pol gosp
pol gosp plan prof wludyka, polityka gospodarcza
pol.gosp.test-sciaga, Polityka gospodarcza
Pol społ gosp
Pytania pol gosp ZALICZENIE, UE Katowice, Gospodarka Turystyczna Mgr I rok, pol. gospodarcza
pol gosp
4 zas stw kw
Pol społ gosp
Ubytki,niepr,poch poł(16 01 2008)
GOSPODARKA KWAS ZAS
kw żółciowe
więcej podobnych podstron