ENZYMOLOGIA – Badanie wpływu temperatury, pH, aktywatorów i inhibitorów na aktywność
α
-amylazy
1
Wydział Chemiczny Politechniki Gdańskiej
Katedra Technologii Leków i Biochemii
Badanie wpływu temperatury, pH, aktywatorów i inhibitorów na
aktywność
αααα
-amylazy
Wstęp
Szybkość reakcji enzymatycznej jest ściśle uzależniona od stężenia zarówno enzymu, jak i
substratu. Nie są to jednak jedyne czynniki determinujące przebieg reakcji. Na katalityczne
działanie enzymów mają również wpływ: pH, temperatura reakcji, w niektórych przypadkach
potencjał redukcyjno-oksydacyjny środowiska, w którym zachodzi reakcja, obecność
rozmaitych związków (koenzymów, aktywatorów, inhibitorów), a także siła jonowa i stała
dielektryczna środowiska.
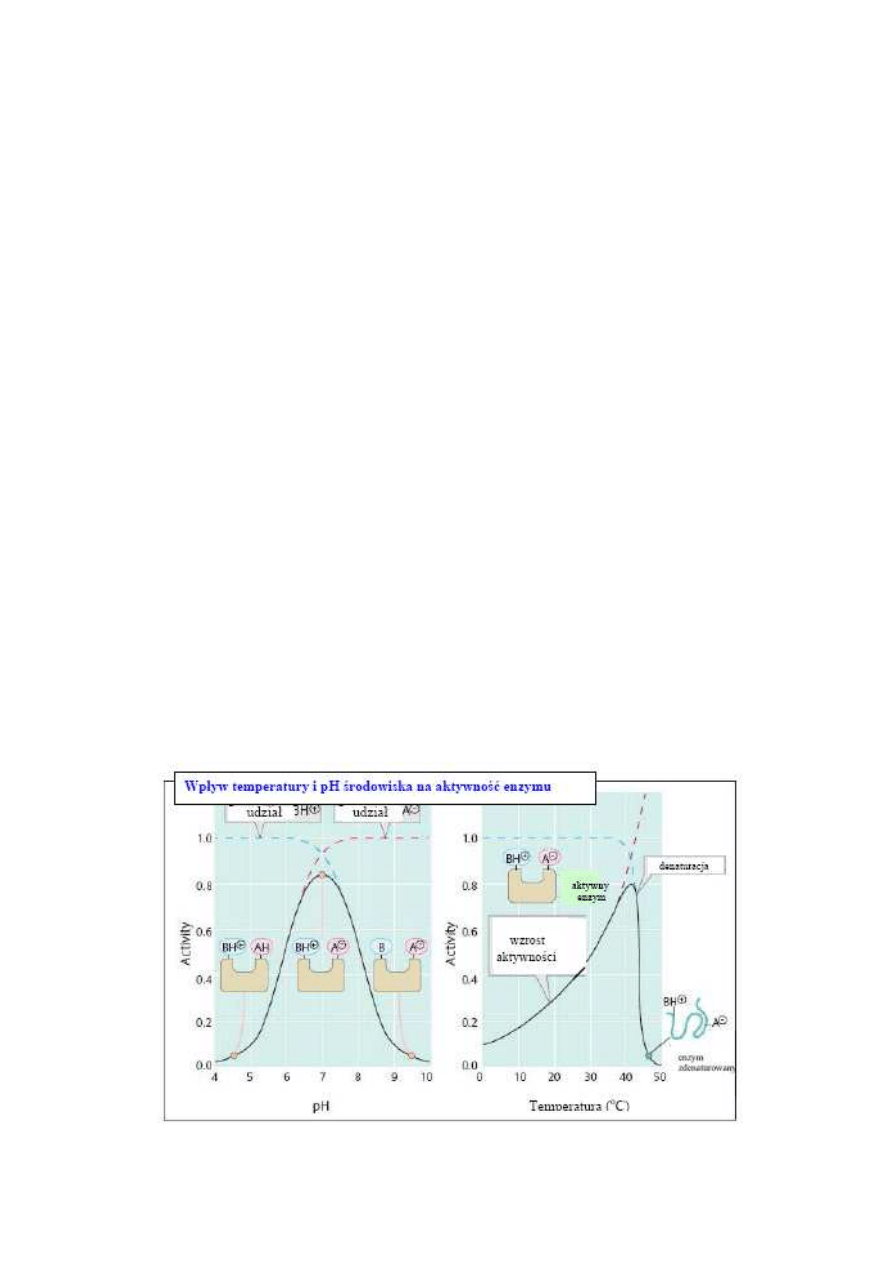
Wpływ temperatury na aktywność enzymów
Wzrost temperatury zwiększa szybkość reakcji enzymatycznych, ale tylko w pewnym
zakresie. Ponieważ enzym jest substancją białkową, wzrost temperatury powyżej temperatury
optymalnej dla jego działania powoduje stopniową denaturacje i zanik zdolności
katalitycznych. Dla większości enzymów optymalna temperatura jest bliska 40°C. Znane są
jednak przykłady enzymów, których optymalna temperatura jest zarówno wyraźnie wyższa,
jak i niższa niż 40°C. Nadmierny wzrost temperatury zwiększa prawdopodobieństwo
zrywania licznych słabych wiązań stabilizujących strukturę przestrzenną białka, w tym
strukturę centrum katalitycznego. Szybkość inaktywacji enzymu zależy w pewnym stopniu od
stężenia enzymu, pH środowiska reakcji oraz siły jonowej roztworu. Krzywa zależności
aktywności enzymatycznej od temperatury posiada charakterystyczne maksimum, przy
którym szybkość katalizowanej reakcji jest największa (Rys. 1). Dla większości enzymów
zmiany denaturacyjne zachodzą bardzo intensywnie powyżej 45-50°C, jednakże są i takie,
które wykazują znaczną odporność na inaktywujące działanie podwyższonej temperatury –
cechuje je wysoka termostabilność. Termostabilność enzymu określa się, podając najwyższą
temperaturę, w której nie dochodzi jeszcze do termicznej inaktywacji enzymu.
Rys. 1 Wpływ temperatury i pH środowiska na aktywność enzymu.

ENZYMOLOGIA – Badanie wpływu temperatury, pH, aktywatorów i inhibitorów na aktywność
α
-amylazy
2
Wpływ pH na aktywność enzymów
Do utrzymania aktywności katalitycznej enzymy wymagają odpowiedniego pH środowiska.
Dla większości enzymów optymalne jest pH 5,5 – 7,4. Znane są jednak enzymy, które
działają najlepiej w środowisku kwaśnym (np. pepsyna w pH 1,5 – 2,7; fosfataza kwaśna pH
4 - 6) lub zasadowym ( trypsyna, chymotrypsyna – pH 7 – 9; fosfataza zasadowa pH 8-9 ).
Dla jeszcze innych enzymów najkorzystniejsze jest środowisko bliskie obojętnego
(dehydrogenaza mleczanowa pH 7,2; kinaza pirogronianowa pH 7,4). Uwzględniając odczyn
ś
rodowiska wewnątrzkomórkowego, należy zauważyć, iż w organizmie nie wszystkie enzymy
działają przy optymalnym pH. Zależność aktywności enzymów od pH środowiska jest więc
jednym z istotnych czynników regulujących szybkość reakcji. Niewielkie zmiany pH nie
dezaktywują enzymu, ale obniżają szybkość reakcji, ponieważ wpływając na stopień jonizacji
enzymu i substratu, zmieniają warunki tworzenia się kompleksu enzym-substrat. Środowisko
silnie kwaśne i silnie zasadowe z reguły działa denaturująco, niszcząc nieodwracalnie
wiązania stabilizujące cząsteczkę enzymu i zmieniają jonizację reszt aminokwasowych w
łańcuchu polipeptydowym białka (Rys. 1).
Wpływ aktywatorów i inhibitorów na aktywność enzymów
Enzymy mogą podlegać zarówno inhibicji, jak i aktywacji przez różne specyficzne cząsteczki
lub jony. Ma to szczególnie istotne znaczenie dla kontroli fizjologicznej ich działania w
układach biologicznych. W ten sam sposób działa wiele leków i czynników toksycznych.
Większość enzymów wymaga dla zachowania swojej aktywności aktywatorów.
Aktywatorami nazywamy związki niskocząsteczkowe, których obecność w miejscu katalizy
enzymatycznej przyspiesza przebieg reakcji. Aktywatorami enzymów mogą być jony metali
(np. Mn
2+
, Mg
2+
, Zn
2+
,
Ca
2+
, rzadziej Co
2+
, Cu
2+
, Ni
2+
), czy aniony współdziałające z białkami
(np. Cl
-
). Jon metalu może być zlokalizowany w katalitycznym centrum enzymu (bierze
wówczas bezpośredni udział w reakcji) lub też w innym fragmencie molekuły (stabilizuje
wtedy jej aktywną konformację).
Substancje hamujące działanie enzymów to inhibitory reakcji enzymatycznych. Inhibicja
enzymu może zachodzić pod wpływem małych cząsteczek lub jonów, zarówno
nieodwracalnie jak i odwracalnie. W inhibicji nieodwracalnej inhibitor wiąże się
kowalencyjnie z enzymem tak silnie, że jego dysocjacja jest niemożliwa. W inhibicji
odwracalnej szybko osiągany jest stan równowagi w układzie enzym-inhibitor. Podstawowe
typy odwracalnej inhibicji, to:
Inhibicja kompetycyjna, kiedy inhibitor jest podobny do substratu i wiąże się w
miejscu aktywnym enzymu, blokując wiązanie substratu. Inhibitor współzawodniczy z
enzymem o centrum aktywne.
Inhibicja niekompetycyjna, kiedy inhibitor wiąże się z cząsteczka enzymu w innym
miejscu niż centrum aktywne enzymu. Następuje wtedy zmiana konformacji enzymu,
która pociąga za sobą zmianę konformacji centrum aktywnego.
Niespecyficznymi inhibitorami enzymów są jony metali ciężkich (Cu, Pb, Hg, Ag). Wiążą się
one łatwo i w sposób nieodwracalny ze wszystkimi białkami, powodując rozległe zmiany ich
konformacji, prowadzące do denaturacji, której często towarzyszy wypadanie białka w
postaci osadu. Szczególnie podatne na wiązanie jonów metali ciężkich są grupy
sulfhydrylowe (-SH); metal może się również wbudować w mostek disiarczkowy.
Ogólna charakterystyka amylaz
Wśród enzymów katalizujących konwersje skrobi wyróżniamy:
ENZYMOLOGIA – Badanie wpływu temperatury, pH, aktywatorów i inhibitorów na aktywność
α
-amylazy
3
endoamylazy (amylazy dekstrynujące, tzw.
α
-amylazy), rozcinające przypadkowo
wewnętrzne wiązania
α
,1-4 glikozydowe amylozy i amylopektyny (frakcje skrobi).
Wskutek działania
α
-amylazy silnie spada lepkość produktów skrobiowych, gdyż
rozkłada ona skrobie do
α
-dekstryn o małej masie cząsteczkowej,
egzoamylazy (amylazy scukrzające), rozkładające skrobie od końca łańcucha. Wśród
nich wyróżnia się
β
-amylazy, które rozkładają wyłącznie wiązanie
α
-1,4 glikozydowe
lub takie, które rozkładają zarówno wiązanie
α
-1,4-, jak i
α
-1,6 glikozydowe
(amyloglukozydazy i glukoamylazy). W wyniku działania
β
-amylazy powstają
dekstryny o dużych cząsteczkach, tzw. amylodekstryny oraz znaczna ilość maltozy.
Glukoamylaza rozkłada długołańcuchowe polisacharydy do glukozy, a glukozydaza –
maltooligosacharydy.
enzymy rozkładające wyłącznie wiązanie
α
-1,6 glikozydowe: izoamylaza i
pullulanaza typu I.
transferazy rozcinające wiązanie
α
-1,4 i przenoszące uzyskany w wyniku rozkładu
sacharydu fragment do glikozydowego akceptora z utworzeniem nowego wiązania
glikozydowego.
Amylazy są olbrzymią rodziną enzymów, wytwarzają je liczne drobnoustroje oraz organizmy
roślinne i zwierzęce. W przemyśle znacząca rolę odgrywają przede wszystkim
α
-amylazy,
począwszy od przemysłu spożywczego, fermentacyjnego, lekkiego, a skończywszy na
papierniczym. Źródłem enzymów dla tych przemysłów mogą być zarówno rośliny, jak i
mikroorganizmy. Amylazy wykazują bardzo zróżnicowane właściwości. Tak np.:
α
- i
β
-
amylazy roślinne mają odmienne optymalne warunki działania, tj. temperaturę i pH
ś
rodowiska.
α
-amylaza jest najbardziej aktywna w środowisku mało kwaśnym (pH 4,7 – 5,0)
i w temp. 51 – 66°C, natomiast
β
-amylaza jest aktywniejsza w środowisku bardziej kwaśnym,
ale w niższej temperaturze (48 – 51°C). Podobnie bardzo zróżnicowane właściwości
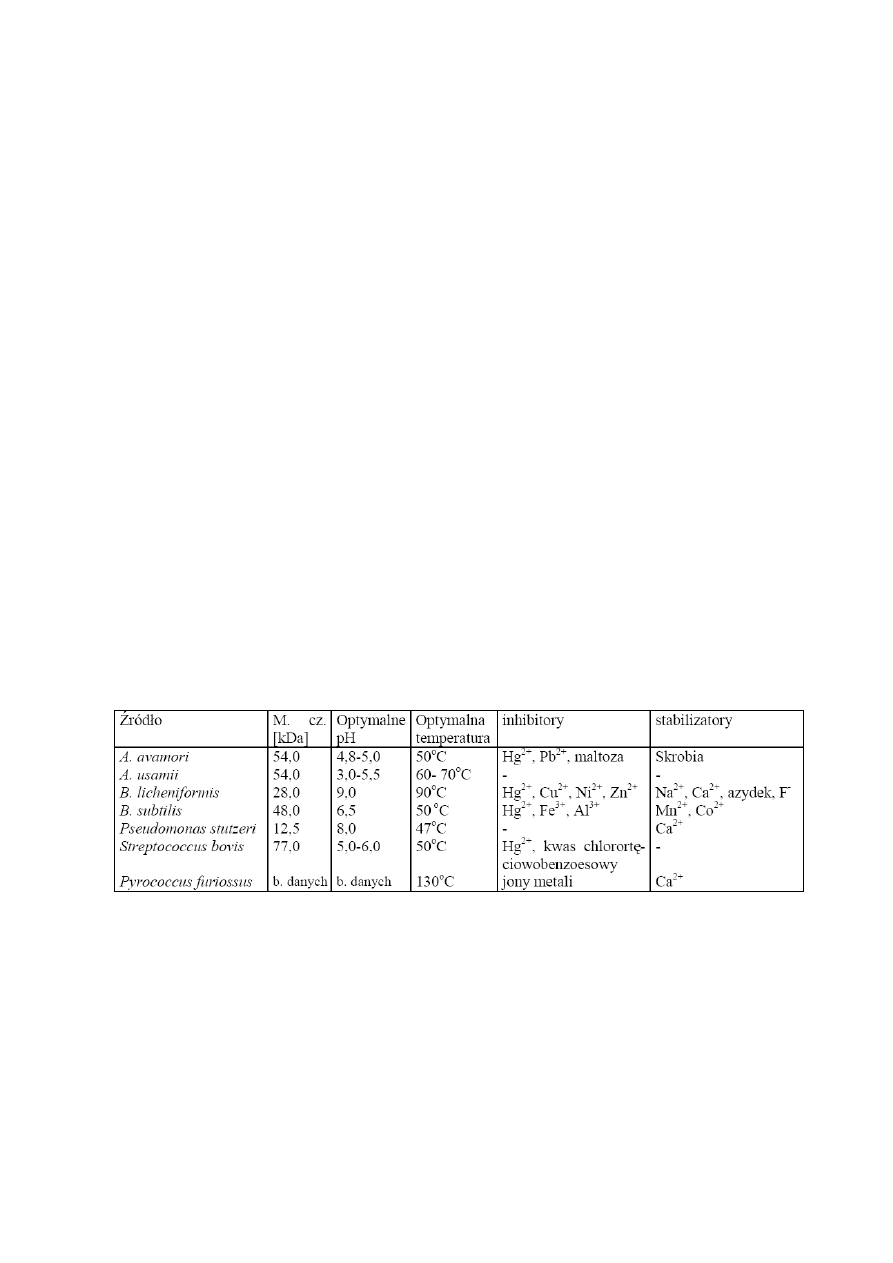
wykazują
α
-amylazy wytwarzane przez różne mikroorganizmy (Tab. 1).
Tab. 2. Porównanie właściwości
α
-amylaz produkowanych przez wybrane mikroorganizmy.
α
-amylaza katalizuje reakcję rozkładu wewnętrznego wiązania
α
,1-4 glikozydowego,
powodując stopniowe rozszczepienie łańcuchów skrobi na coraz krótsze fragmenty, zwane
dekstrynami. Przebieg tego etapu, zwanego etapem dekstrynowania, można śledzić dzięki
barwnej reakcji zarówno nierozłożonej skrobi, jak i dłuższych dekstryn z roztworem jodu w
jodku potasu. Nierozłożona skrobia potraktowana tym odczynnikiem zabarwia się na kolor
ciemnoniebieski. Nieco krótsze od łańcuchów skrobi, łańcuchy dekstryn, zwane
amylodekstrynami, zabarwiają się z J
2
w KJ na kolor fioletowy, a jeszcze krótsze produkty
hydrolizy, zwane erytrodekstrynami barwią się podczas wspomnianej reakcji na kolor
czerwono-brunatny.
α
-amylaza degraduje powstałe erytrodekstryny do achrodekstryn,
których łańcuchy są zbyt krótkie by reagować z J
2
w KJ. W kolejnym etapie hydrolizy
ENZYMOLOGIA – Badanie wpływu temperatury, pH, aktywatorów i inhibitorów na aktywność
α
-amylazy
4
achrodekstryny rozkładane są przez
α
-amylazę do mieszaniny glukozy, maltozy i
oligocukrów redukujących, zawierających do 5 reszt glukozy w cząsteczce.
Przebieg hydrolizy skrobi pod działaniem
α
-amylazy można obserwować nie tylko za
pomocą barwnej reakcji z roztworem jodu w jodku potasu. Wykorzystuje się w tym celu także
metody pozwalające na pomiar przyrostu stężenia cukrów redukujących uwalnianych z
substratu przez enzym. Jedną z nich jest metoda Millera z kwasem 3,5-dinitrosalicylowym
(DNS), który w obecności cukrów redukujących przekształcany jest do kwasu 3-amino-5-
nitrosalicylowego. Pomiar absorbancji następuje przy długości fali 530 nm. Stężenie cukrów
redukujących odczytuje się z krzywej wzorcowej sporządzonej dla maltozy.
Wykonanie ćwiczenia
Celem ćwiczenia jest zbadanie wpływu jonów metali Cu
2+
, Ag
2+
oraz Cl
-
na
aktywności
α
-amylazy z Aspergillus oryzae oraz określenie optymalnych warunków działania
enzymu ( temperatura, pH).
Materiały i sprzęt
1.
Amylaza: 15mg
α
-amylazy Aspergillus oryzae rozpuścić w 10 ml wody.
2.
1% roztwór skrobi ziemniaczanej: odważyć 1 g skrobi i przygotować zawiesinę w ok.
10 ml wody, odmierzyć 90 ml wody i zagotować. Do wrzącej wody wlać zawiesinę
skrobiową, zagotować i szybko schłodzić otrzymany 1 % kleik skrobiowy.
3.
0,2M Na
2
HPO
4
4.
0,1M kwas cytrynowy
5.
bufor fosforanowo-cytrynianowy o pH 5,5
6.
1% roztwór kwasu 3,5-dinitrosalicylowego (DNS):
Przygotowując roztwór DNS w
pierwszej kolejności przygotowano roztwory:
1g DNS w 20 ml H
2
O – roztwór A
1,6g NaOH w 15 ml H
2
O – roztwór B
Do roztworu A powoli wkraplać roztwór B i mieszaninę ogrzać na łaźni
wodnej, aż do całkowitego rozpuszczenia osadu. Następnie do ciepłego płynu –
ciągle mieszając -dodać 30g winianu sodowo-potasowego. Roztwór uzupełnić
do objętości 100 ml i w razie potrzeby przefiltrować.
7.
20 mM NaCl
8.
20 mM CuSO
4
9.
20 mM AgNO
3
10.
łaźnia wodna: 35°C, 55°C, 80°C
11.
pipeta szklana 10ml, pipety automatyczne: 200-1000
µ
l, 20-200
µ
l
1. Badanie wpływu pH na aktywność a-amylazy z Aspergillus oryzae
Oznaczenie aktywności enzymu
•
Przygotować bufory fosforanowo-cytrynianowe zgodnie z tabelą:
Wartości pH
3,0
4,0
5,0
5,5
6,0
7,0
Wyjściowe roztwory
Objętości roztworów [ml]
0,2 M Na
2
HPO
4
2
4
5,15
5,75
6,3
7,45
0,1 M kwas cytrynowy
8
6
4,85
4,25
3,7
2,55
ENZYMOLOGIA – Badanie wpływu temperatury, pH, aktywatorów i inhibitorów na aktywność
α
-amylazy
5
•
Przygotować siedem probówek na mieszaninę inkubacyjną. Do każdej dodać 0,5 ml
1% kleiku skrobiowego oraz 0,5 ml buforu o odpowiednim pH. Do wszystkich dodać
0,1 ml roztworu
α
-amylazy. W próbie kontrolnej zastąpić bufor oraz enzym wodą.
Reakcję prowadzić w temperaturze pokojowej przez 5 min.
•
W celu zatrzymania reakcji enzymatycznej do probówek dodać 1 ml roztworu DNS i
umieścić je na 5 min w łaźni wrzącej.
•
Probówki schłodzić i dodać 5 ml wody.
•
Zmierzyć absorbancję przy długości fali 530 nm
Wykonanie krzywej wzorcowej dla maltozy.
Wykonać roztwory maltozy w buforze fosforanowo-cytrynianowym pH 6 według tabeli:
2% roztwór
maltozy [ml]
bufor [ml]
0
2
0,1
1,9
0,2
1,8
0,3
1,7
0,4
1,6
0,5
1,5
Pobrać do probówek po 0,5 ml przygotowanych roztworów maltozy, dodać 0,5 ml buforu i
1ml DNS. Mieszaninę ogrzać we wrzącej łaźni wodnej przez 5minut i po schłodzeniu dodać 5
ml wody. Zmierzyć absorbancję roztworów na spektrofotometrze przy długości fali 530 nm
wobec próby kontrolnej (woda zamiast maltozy).
2. Badanie wpływu temperatury na aktywność a-amylazy z Aspergillus oryzae
Przygotować dwie serie po 5 probówek oznaczonych A
1
-A
5
i B
1
-B
5
oraz próbę kontrolną . Do
wszystkich dodać 0,5 ml 1% roztworu skrobi. Do serii A dodać 0,5 ml buforu o pH 5, zaś do
serii B 0,5 ml buforu o pH 6. Do wszystkich dodać 0,1 ml roztworu
α
-amylazy. W próbie
kontrolnej zastąpić bufor oraz enzym wodą. Próbki umieścić w odpowiedniej temperaturze
zgodnie z tabelą:
Seria A
Seria B
Temperatura [°C]
A
1
B
1
4
lodówka
A
2
B
2
20
Temp. pokojowa
A
3
B
3
35
łaźnia
A
4
B
4
55
łaźnia
A
5
B
5
80
łaźnia
•
Reakcję prowadzić przez 5 min.
•
W celu zatrzymania reakcji enzymatycznej do probówek dodać 1 ml roztworu DNS i
umieścić je na 5 min w łaźni wrzącej.
•
Probówki schłodzić i dodać 5 ml wody.
•
Zmierzyć absorbancję przy długości fali 530nm wobec K(-)
2. Badanie wpływu Cu
2+
, Ag
2+
oraz Cl
-
na aktywność a-amylazy z Aspergillus oryzae
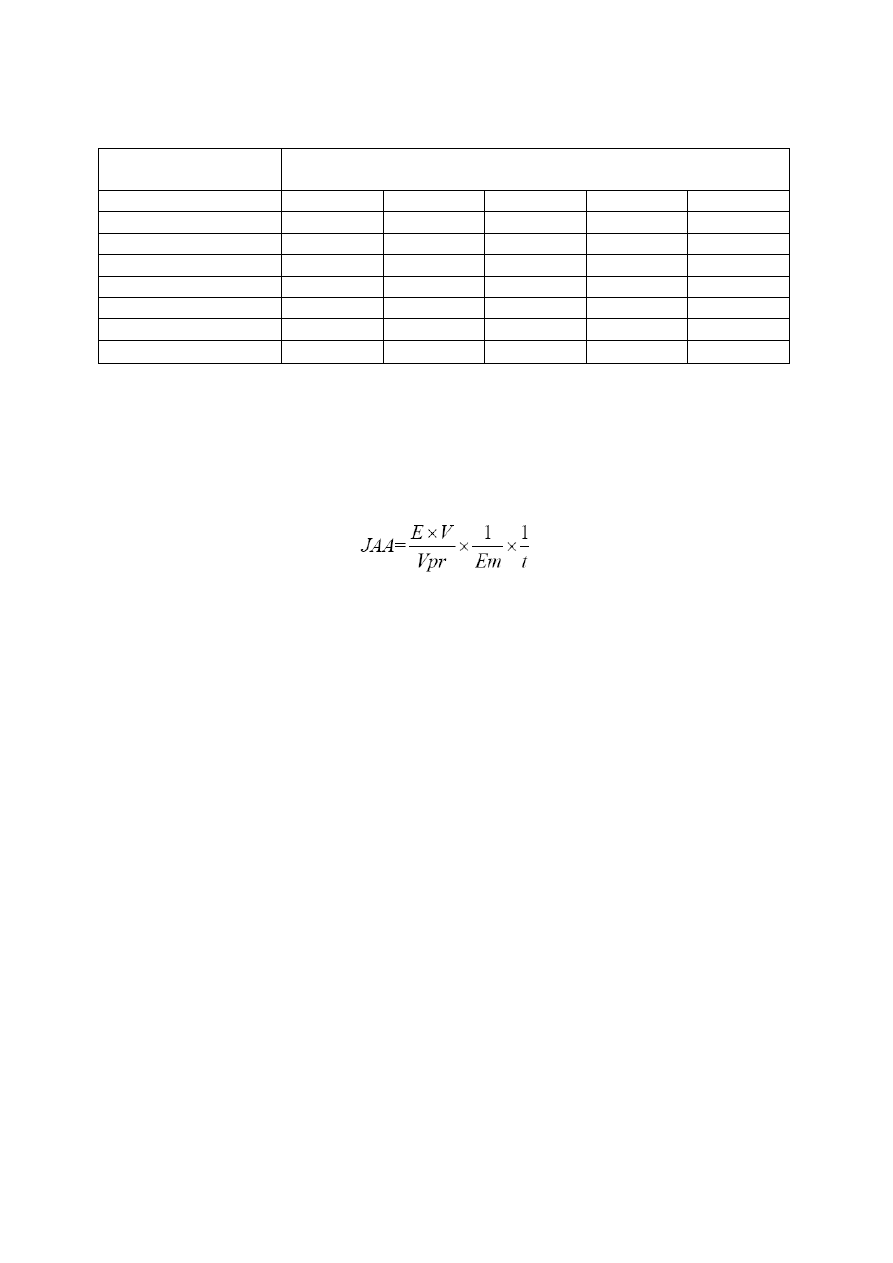
ENZYMOLOGIA – Badanie wpływu temperatury, pH, aktywatorów i inhibitorów na aktywność
α
-amylazy
6
Mieszaniny inkubacyjne przygotować w probówkach zgodnie z danymi w tabelce:
Odczynniki
Oznakowanie probówek i objętości dodawanych roztworów
[ml]
K(-)
K(+)
C
1
C
2
C
3
1% kleik skrobiowy
0,5
0,5
0,5
0,5
0,5
Bufor o pH 6
0,5
0,5
0,5
0,5
0,5
woda
0,35
0,25
-
-
-
20 mM CuSO
4
-
-
0,25
-
-
20 mM AgNO
3
-
-
-
0,25
-
20 mM NaCl
-
-
-
-
0,25
Roztwór
α
-amylazy
-
0,1
0,1
0,1
0,1
Reakcję prowadzić w temperaturze pokojowej zgodnie z procedurą opisaną w poprzednim
punkcie.
Opracowanie wyników
1.
Wyznaczyć aktywność
α
- amylazy, przyjmując jako jednostkę aktywności (JAA) ilość
maltozy (µM) uwolnionej podczas 1-minutowej hydrolizy 1 %-owej skrobi:
gdzie:
V – objętość, w której wyrażamy aktywność enzymu (1000 µl)
V pr – objętość próbki enzymu (100
µ
l)
t – czas inkubacji (5 min)
E – odczytana wartość absorbancji
Em – wartość absorbancji dla 1
µ
M maltozy
2.
Wyznaczyć zależności JAA = f(pH) oraz JAA = f(temp). Na podstawie wykresów
wyznaczyć optimum pH oraz temperatury dla
α
-amylazy z Aspergillus oryzae.
3.
Określić jak pH zmienia wrażliwość
α
-amylazy na temperaturę, oszacować
termostabilność enzymu.
4.
Określić wpływ badanych związków na aktywność enzymu. Obliczyć procentowy
stopień wzrostu lub spadku aktywności enzymu po dodaniu soli.
Wyszukiwarka
Podobne podstrony:
Termostabilna B amylaza
AMYLAZA
cw 7 amylaza
Lipazy, proteazy, amylazy mikrobiologia przemysłowa
B amylaza
Biochemia, Oznaczanie aktywnościi amylazy metodą Noeltinga i Bernfelda w ziarnie pszenicy
cwiczenie 5 amylaza oznaczanie aktywnosci enzymu metoda kolorymetryczna 05 05 2014
7 ćw. - amylazy -sprawozdania, Biotechnologia UKW I ST, Biotechnologia żywności UKW
7 ćw. - amylazy -sprawozdania (2), Biotechnologia UKW I ST, Biotechnologia żywności UKW
Badanie aktywności amylazy instrukcja 2013
7 ćw. - amylazy -materiały dydaktyczne, Biotechnologia UKW I ST, Biotechnologia żywności UKW
alfa amylaza(1)
Amylaza ślinowa trzustkowa wielocukry dwucukry maltaza ściąga, Notatki
7 ćwi. produkcja enzymu -amylazy - NOWE (1), Biotechnologia UKW I ST, Biotechnologia żywności UKW
Doktorska praca Wpływ procesu suszenia rozpyłowego na degradację preparatu alfa amylazy z Aspergill
Kataliza kowalencyjna; Mechanizm działania alfa amylazy; Grupy funkcyjne i ich modyfikacje
więcej podobnych podstron