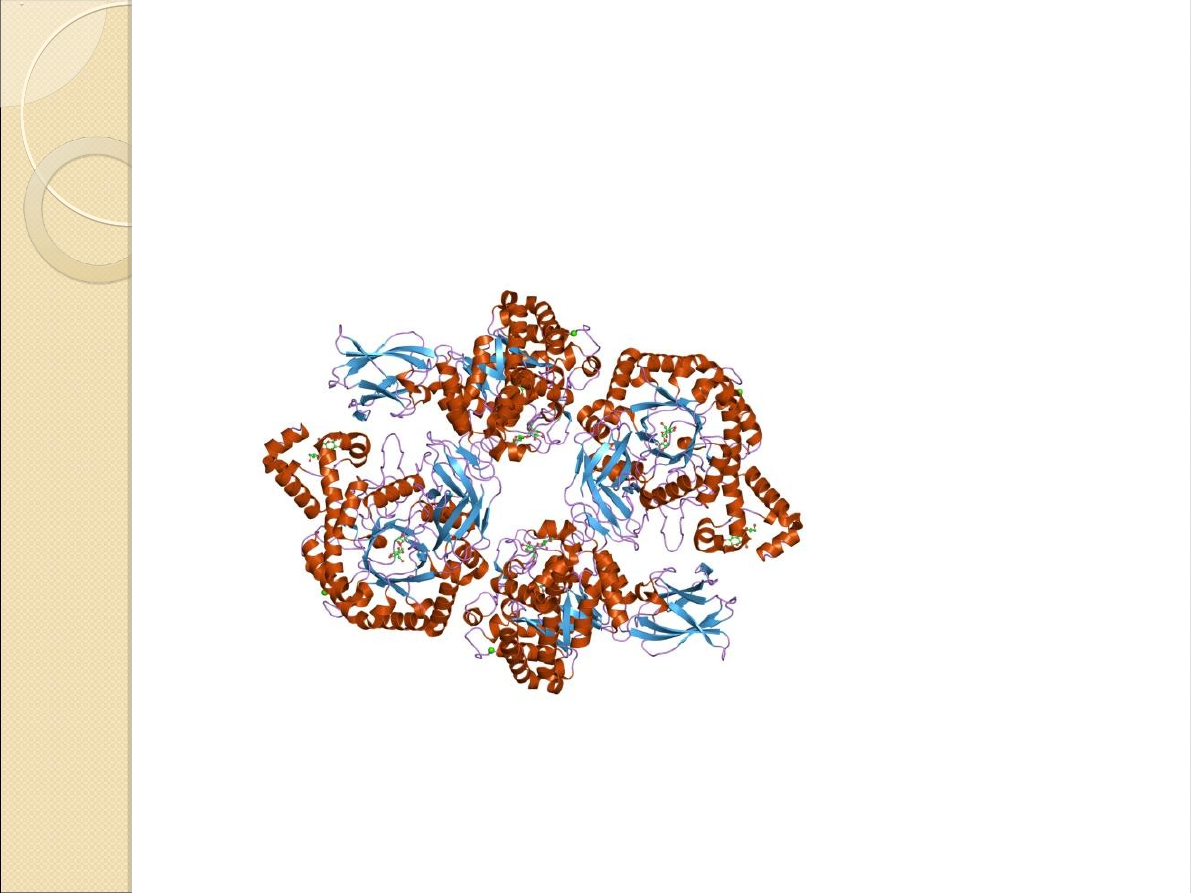
β-amylaza
β-amylaza
EC 3.2.1.2
EC 3.2.1.2

Amylazy:
Amylazy:
Enzymy hydrolityczne z grupy hydrolaz,
rozkładające skrobię i inne wielocukry.
Rodzaje amylaz:
α-Amylaza
β-Amylaza
γ-Amylaza
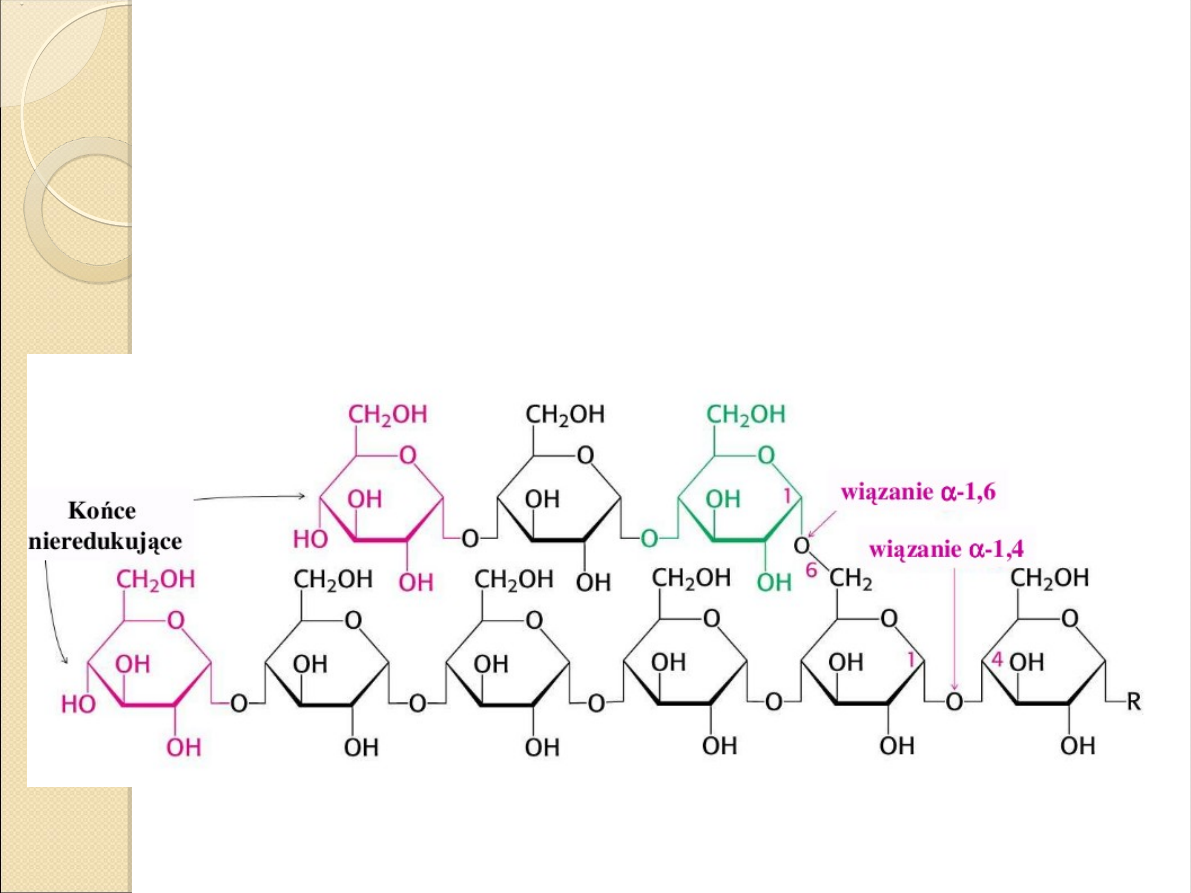
β
β
-amylaza jest egzoamylazą i hydrolizuje
-amylaza jest egzoamylazą i hydrolizuje
wiązania α-1,4 glikozydowe. Enzym atakuje
wiązania α-1,4 glikozydowe. Enzym atakuje
cząsteczki skrobi na ich nieredukujących
cząsteczki skrobi na ich nieredukujących
końcach (jednostkach glukozy z niezwiązanym
końcach (jednostkach glukozy z niezwiązanym
węglem C4) odcinając cząsteczkę maltozy
węglem C4) odcinając cząsteczkę maltozy
(dimer glukozy)
(dimer glukozy)
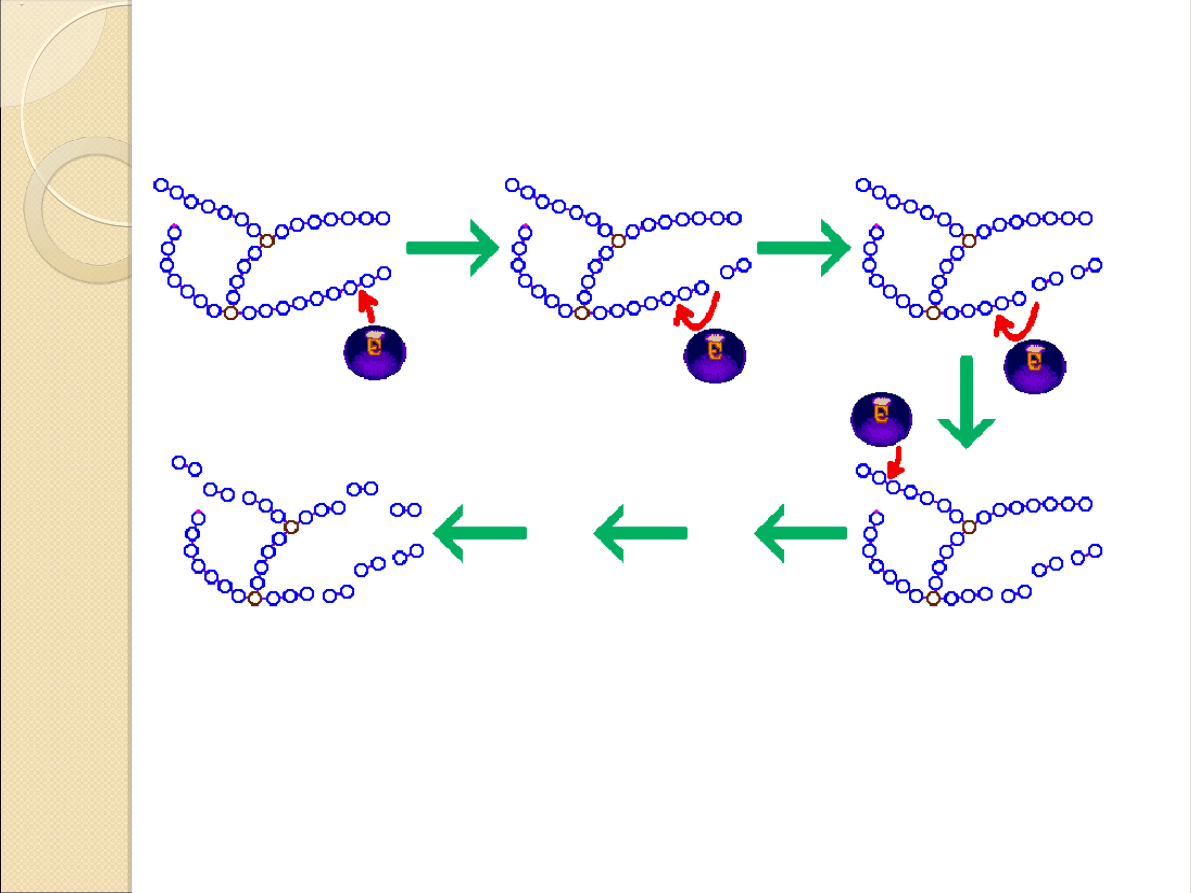
Schemat działania enzymu:
Schemat działania enzymu:
Podjednostki glukozy zaznaczono jako okręgi niebieskie
lub brązowe (w przypadku punktów rozgałęzienia). Koniec
redukjący w cząsteczce amylopektyny odpowiada
małemu fioletowemu punktowi zaznaczonemu na jednej
skrajnej podjednostce glukozy. Miejsce ataku enzymu
("cięcia") zaznaczono czerwoną strzałką.
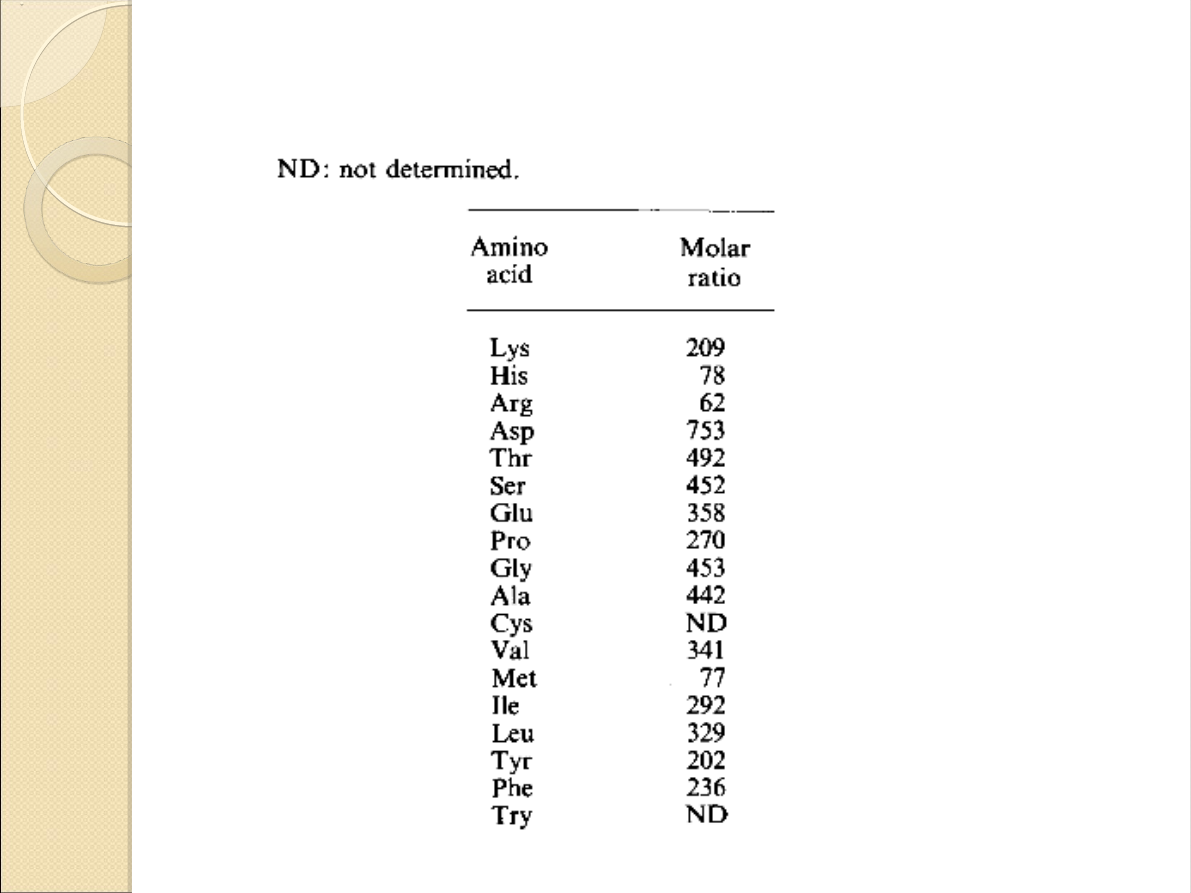
Skład enzymu:
Skład enzymu:
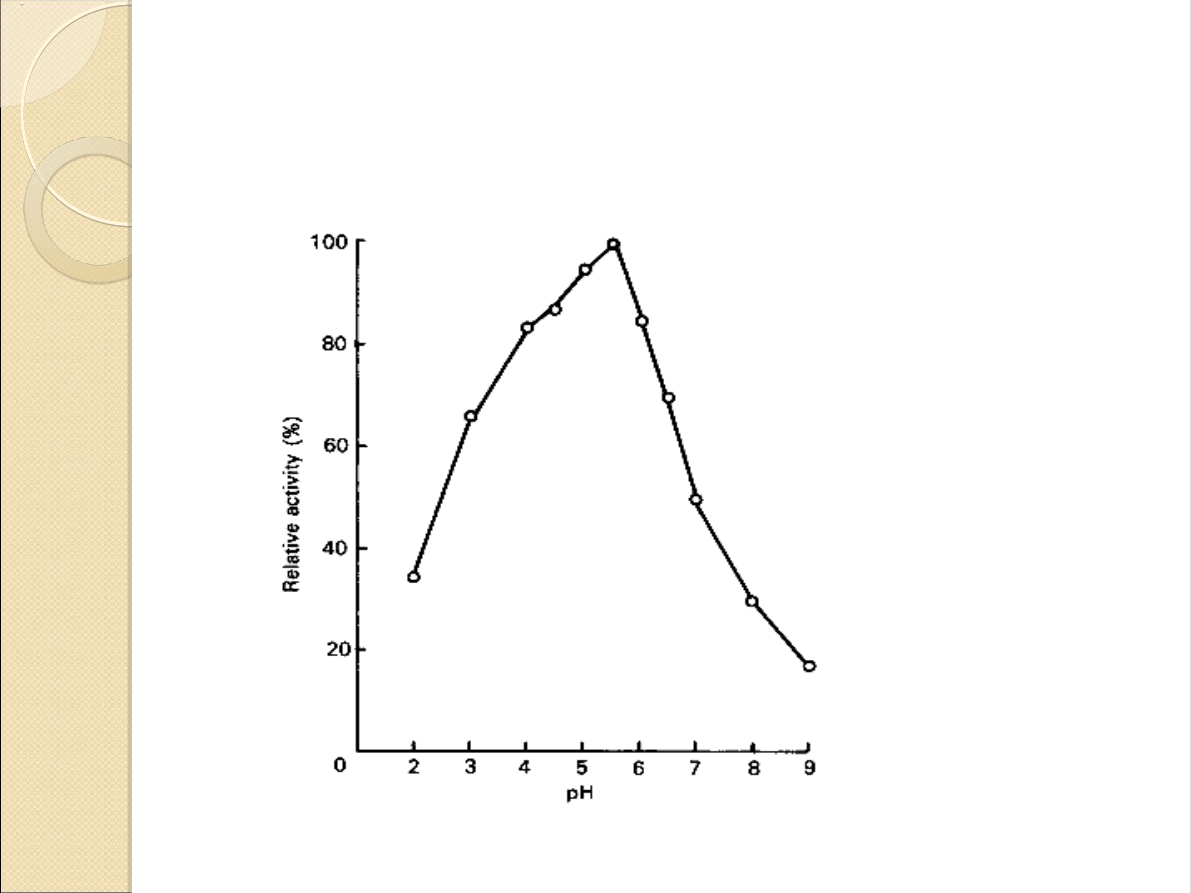
Zależność wydajności enzymu
Zależność wydajności enzymu
od pH:
od pH:
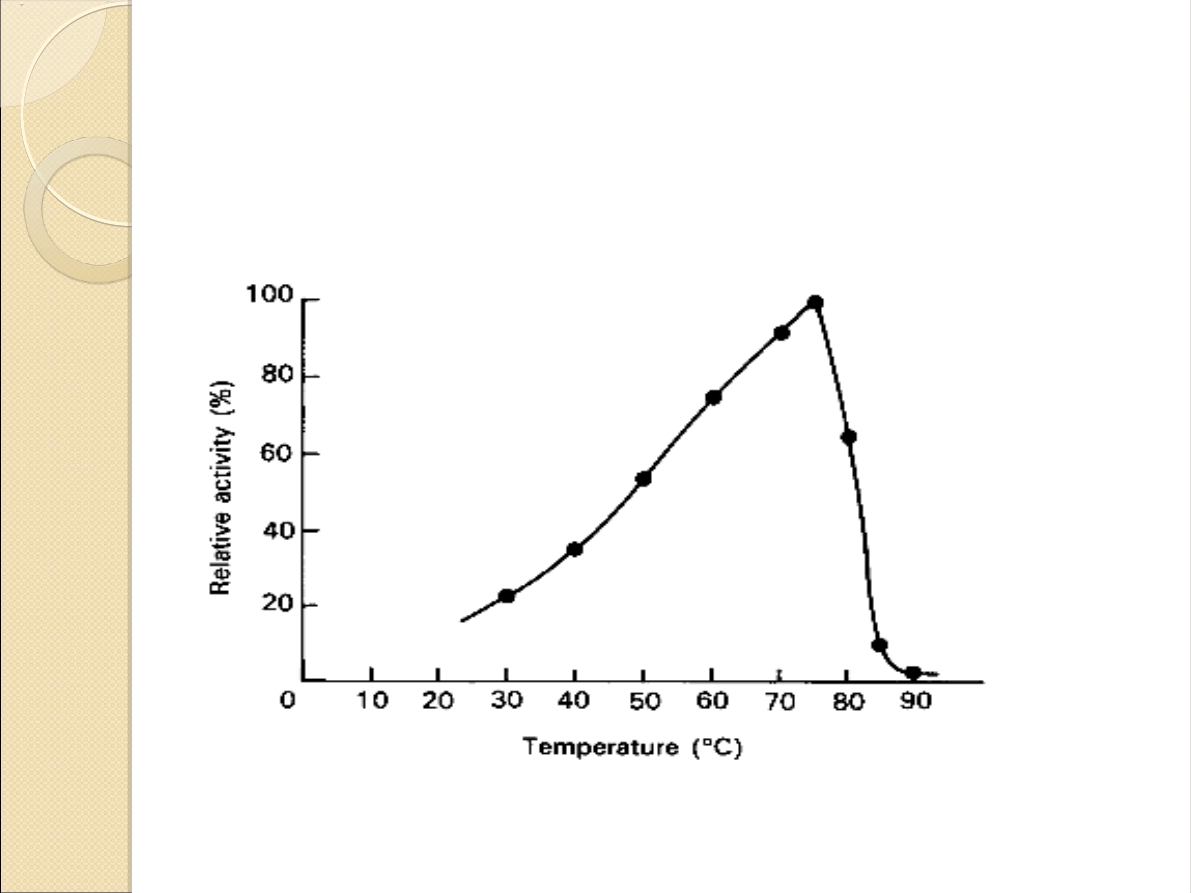
Zależność wydajności enzymu
Zależność wydajności enzymu
od temperatury:
od temperatury:
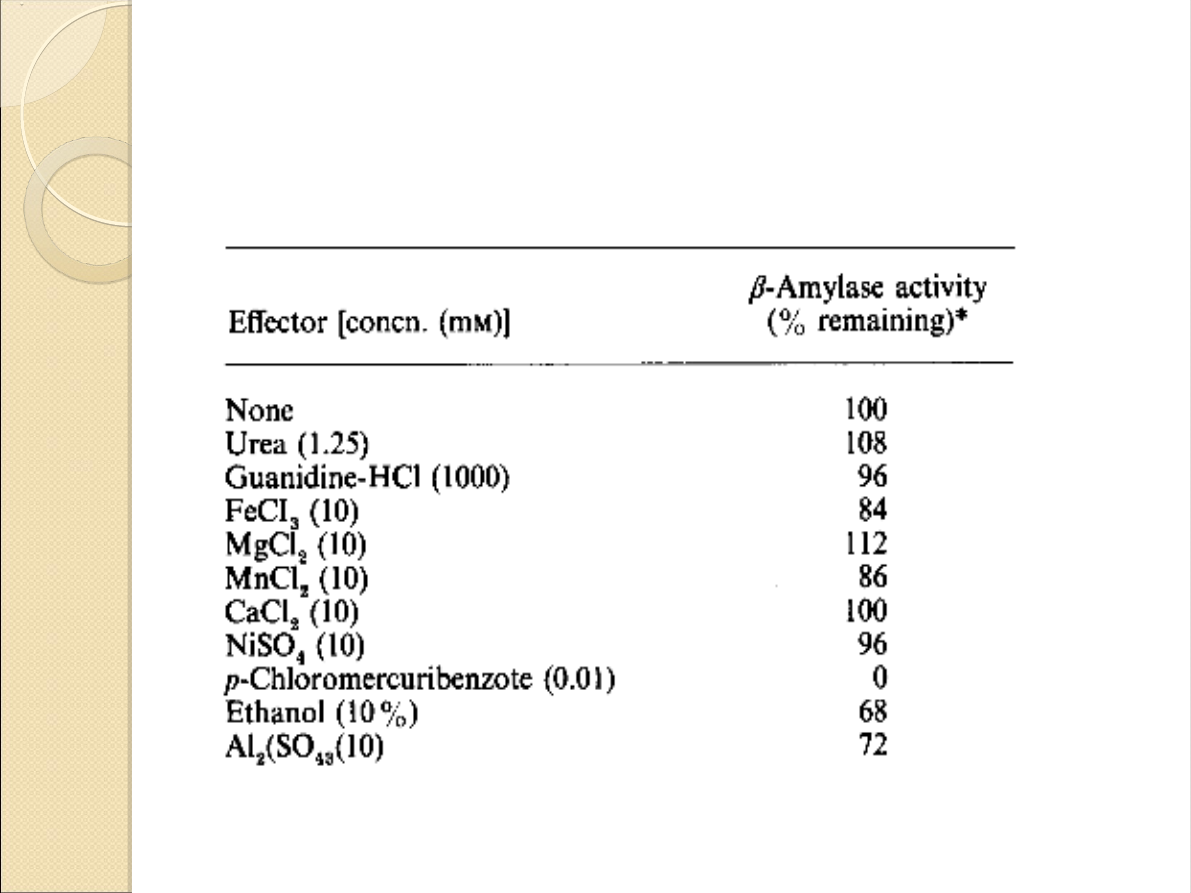
Wpływ czynników chemicznych
Wpływ czynników chemicznych
na aktywność enzymu:
na aktywność enzymu:

Produkty działania enzymu:
Produkty działania enzymu:
maltoza
dekstryny graniczne
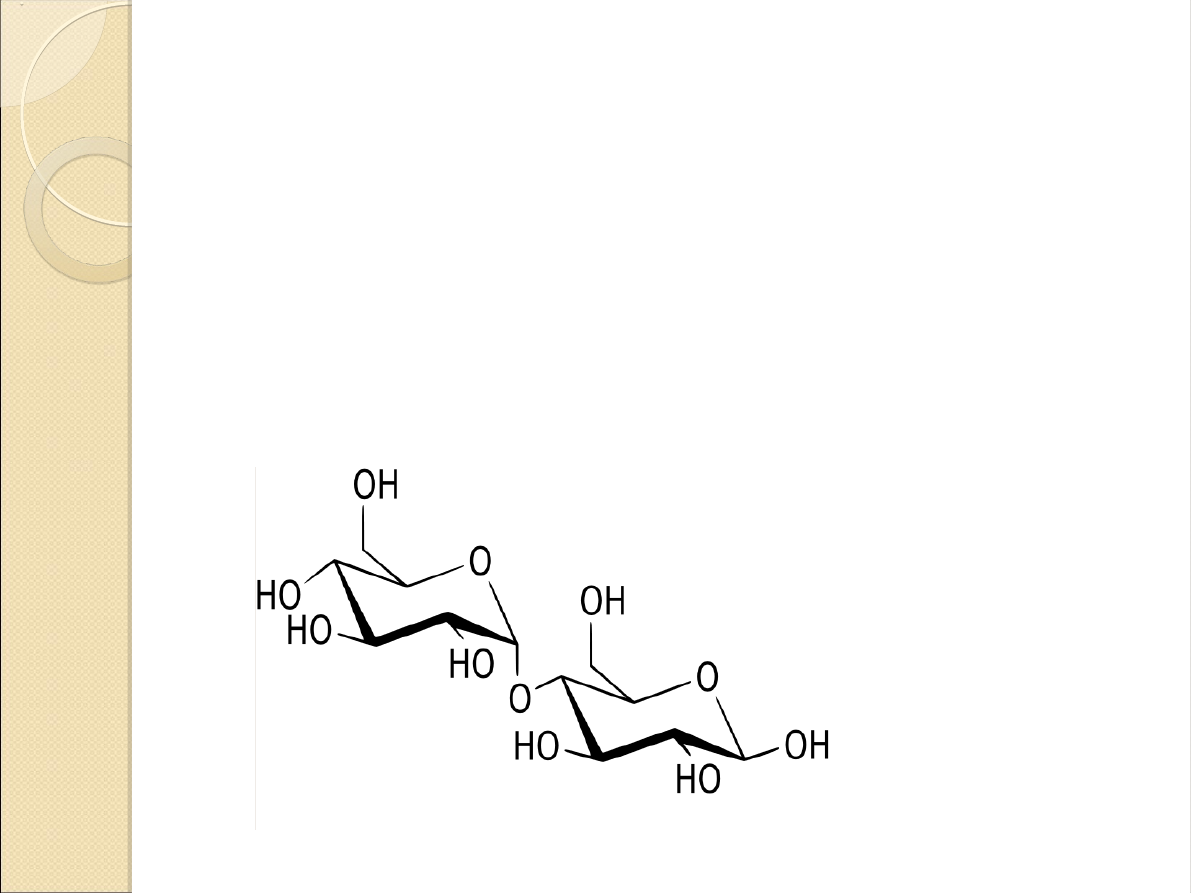
Zastosowanie maltozy:
Zastosowanie maltozy:
środek słodzący
składnik pożywek bakteriologicznych
stabilizator wielosiarczków

Etapy produkcji enzymu:
Etapy produkcji enzymu:
pozyskanie preparatu
oczyszczenie preparatu

Źródła preparatu:
Źródła preparatu:
Mikroorganizmy (np. Bacillus sp.)
Ziarna zbóż (np. jęczmienia,
pszenicy)

Enzym może być wykorzystywany w
Enzym może być wykorzystywany w
naturalnej formie bez konieczności jego
naturalnej formie bez konieczności jego
izolacji – proces słodowania podczas
izolacji – proces słodowania podczas
produkcji piwa.
produkcji piwa.

Pozyskiwanie preparatu:
Pozyskiwanie preparatu:
Konkretny przykład produkcji zostanie przedstawiony z
użyciem Clostridium thermosulfurogenes – termofilnej
bakterii pozyskanej z gorących źródeł w parku
narodowym Yellowstone. Mikrob produkuje termostabilny
enzym o optymalnej temperaturze pracy wynoszącej 80
C.

Pozyskiwanie preparatu:
Pozyskiwanie preparatu:
Bakterie we współpracy z Clostridium
thermohydrosulfuricum wykazują
zwiększoną aktywność fermentacji skrobi
i większą wydajnością syntezy enzymów.
Ta zmiana metabolizmu była podstawą
do poszukiwania bardziej wydajnych
mutantów.

Hodowla bakterii:
Hodowla bakterii:
Hodowla okresowa: 60 C
w kolbach 125 ml bez
wstrząsania z 50 ml TYE i
źródło węgla oraz N2-
CO2 (95:5) w celu
uzyskania warunków
beztlenowych.
Hodowla ciągła: mieszanie
200 rpm, przepływ 40
ml/min w fermentorze o
pojemności 320 ml, brak
kontroli pH.
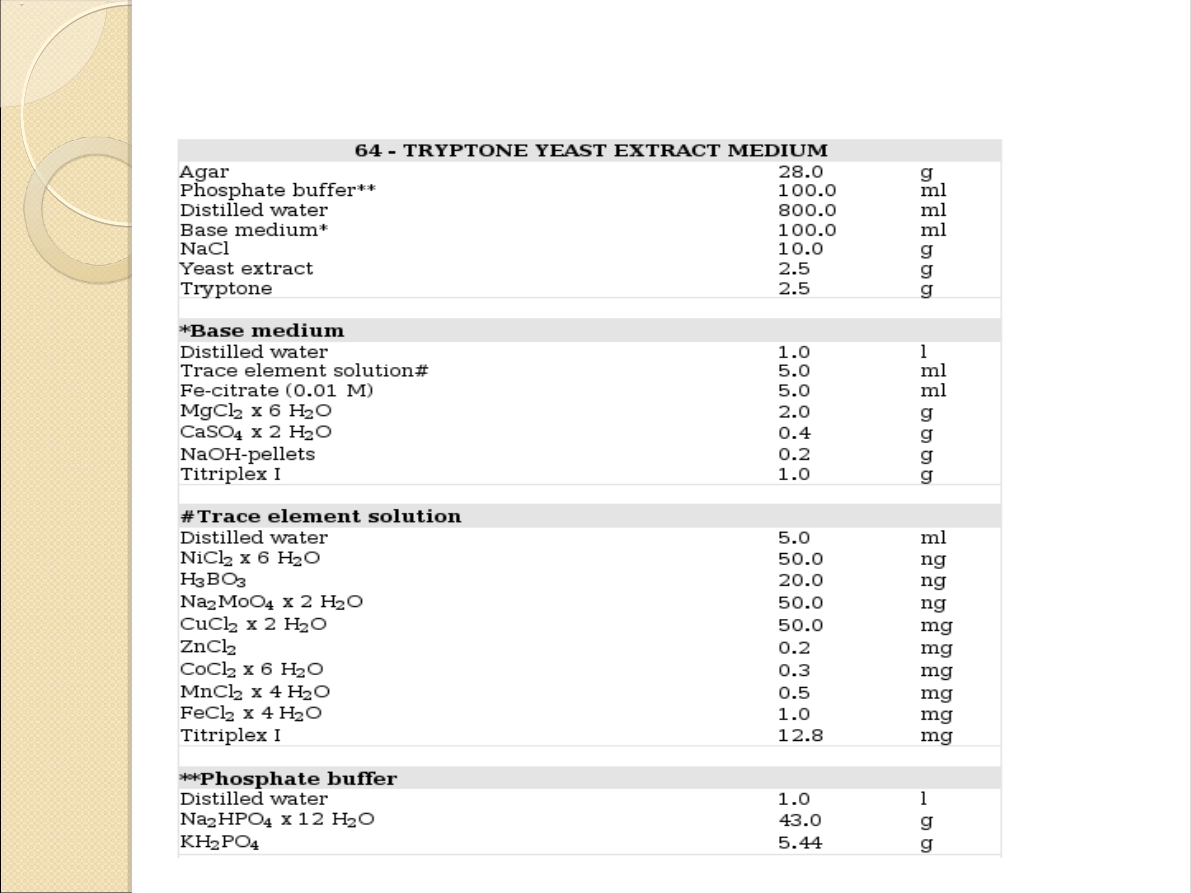
Skład TYE:
Skład TYE:

Izolacja czystych kultur:
Izolacja czystych kultur:
Do izolacji czystych kultur można użyć
płytek z TYE, 0,5% skrobi i 3% agaru
zamkniętych w komorze beztlenowej.
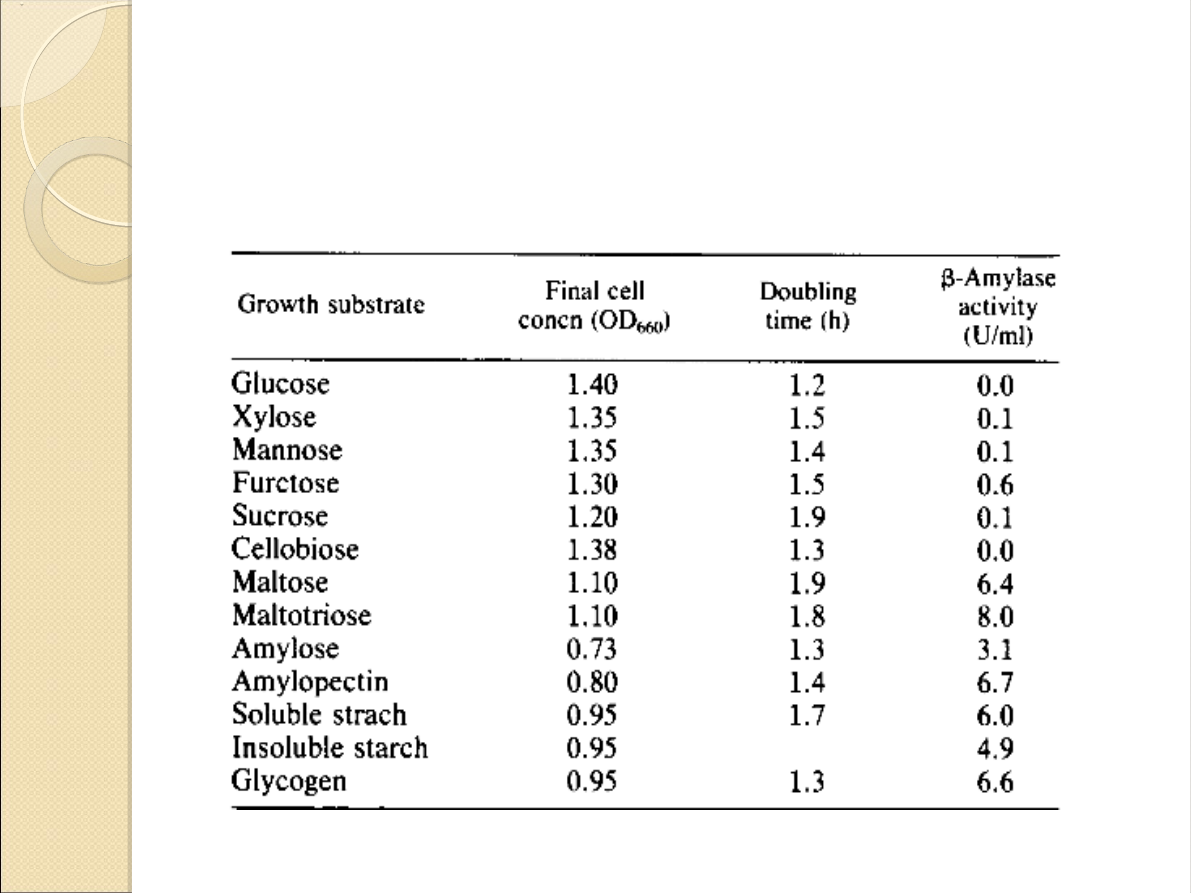
Wpływ źródła węgla na
Wpływ źródła węgla na
wydajność:
wydajność:
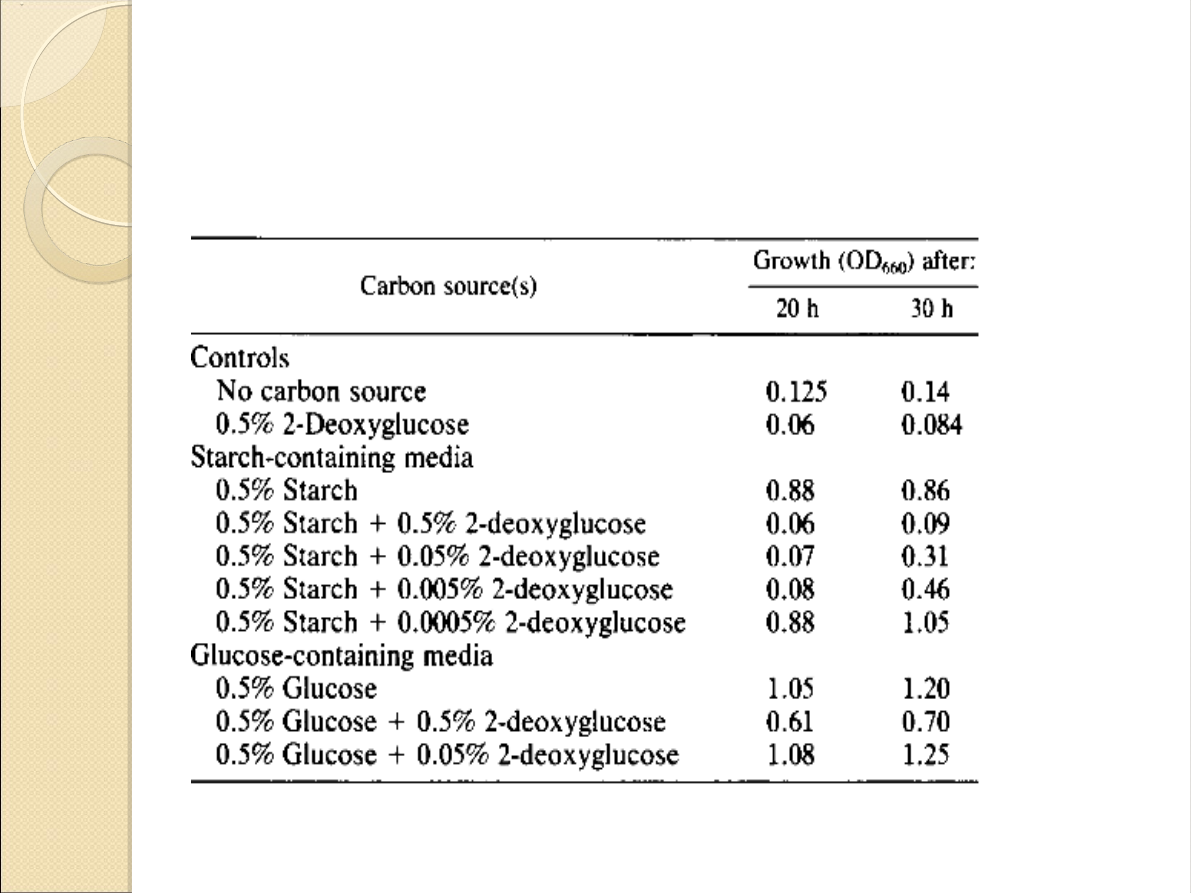
Wpływ dodatku 2-
Wpływ dodatku 2-
deoksyglukozy:
deoksyglukozy:

Mutagenizacja:
Mutagenizacja:
Przeprowadzono mutagenizacje
metodą chemiczną wykorzystując N-
metylo-N'-nitro-N nitrozoguanidyne
(250 ug/ml). Komórki traktowano
związkiem przez 1 godzinę w
temperaturze 60 C co skutkowało
zabiciem ponad 99% mikroorganizmów.
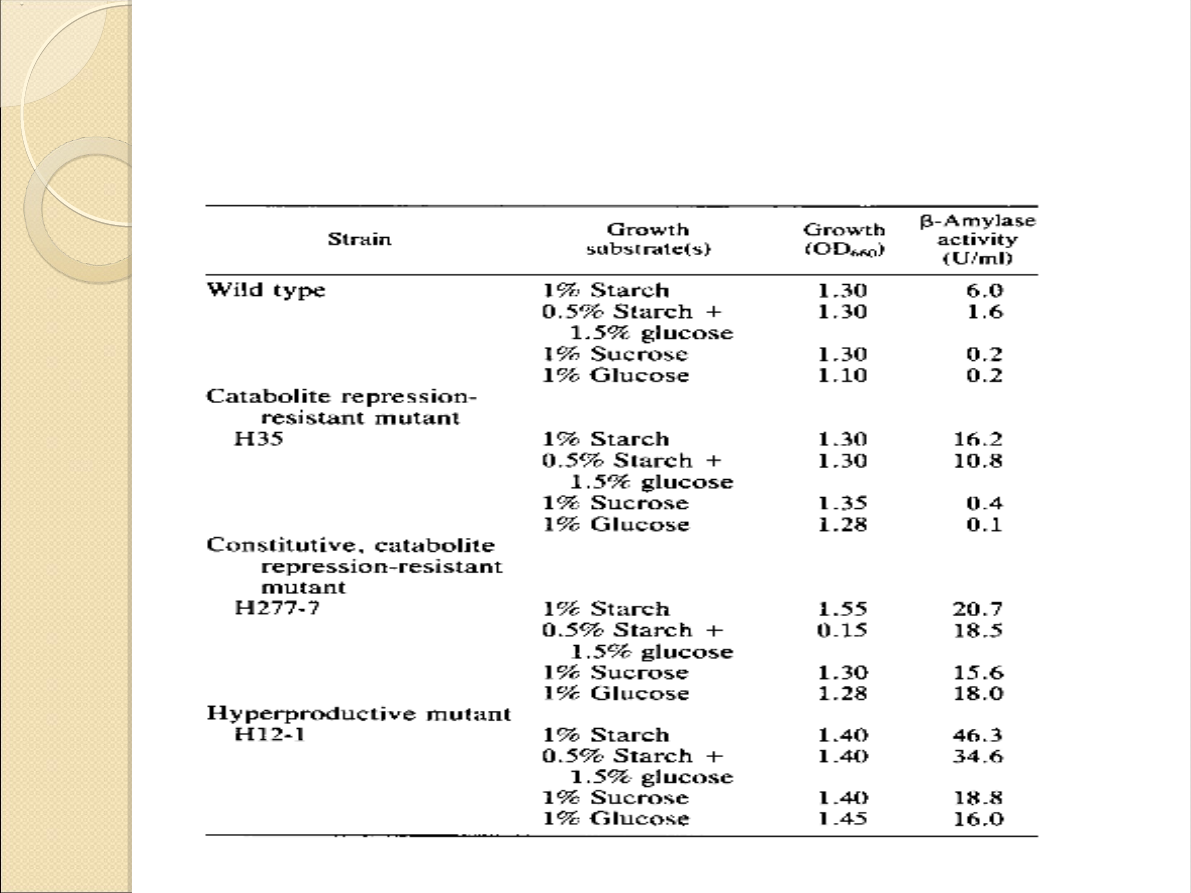
Porównanie mutantów:
Porównanie mutantów:
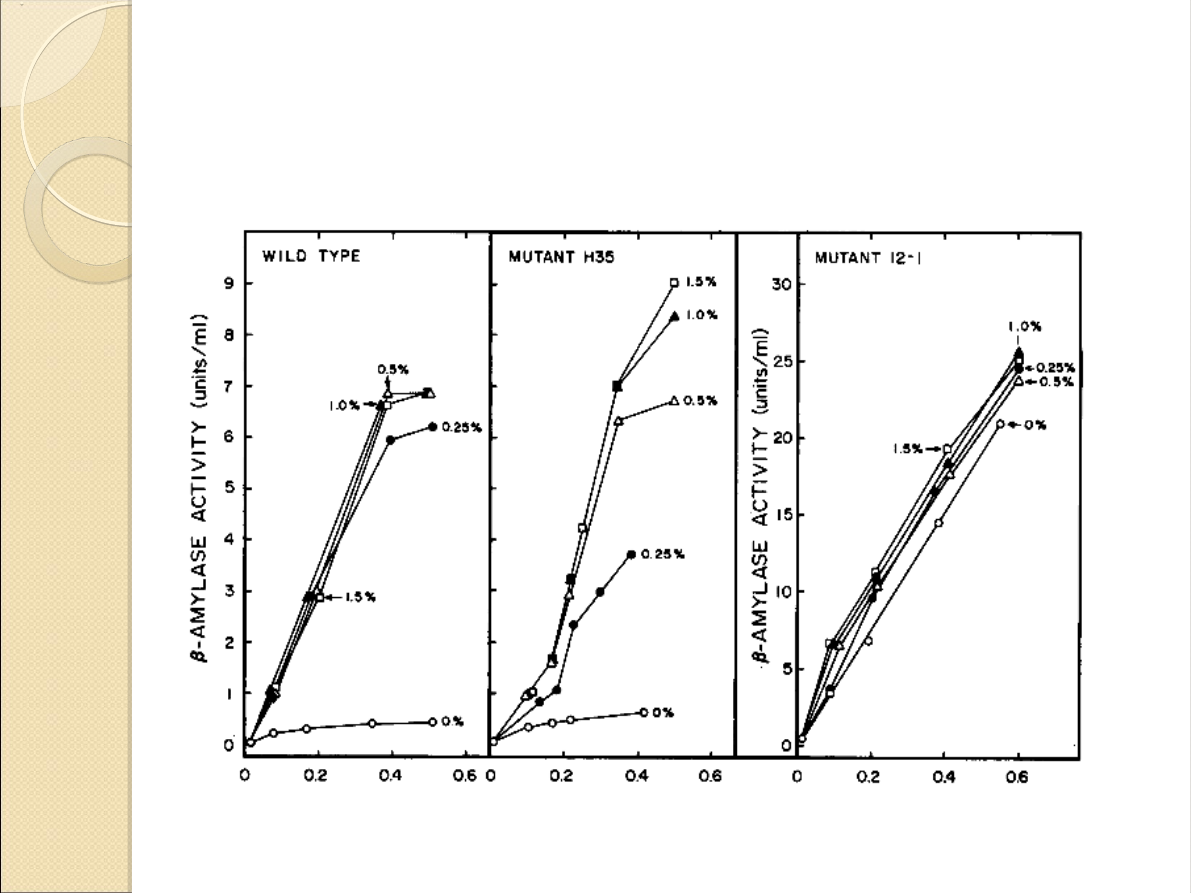
Porównanie mutantów:
Porównanie mutantów:

Oczyszczanie preparatu:
Oczyszczanie preparatu:
ultrafiltracja
precypitacja
chromatografia jonowymienna
filtracja żelowa

Ultrafiltracja:
Ultrafiltracja:
Ultrafiltracja (filtracja molekularna) - to proces
filtracji z użyciem sit molekularnych, membran i
wszelkich materiałów porowatych, o porach
których rozmiary są zbliżone do wielkości
pojedynczych cząsteczek.
Ultrafiltracje zastosowano w celu zagęszczenia
materiału.
Po filtracji enzym pozostaje w frakcji komórkowej.

Precypitacja etanolem:
Precypitacja etanolem:
Frakcje komórkową wiruje się przez 30
min przy 15 000 g. Do supernatantu
dodaje się schłodzonego etanolu do
uzyskania stężenia 20% (v/v). Tak
przygotowany roztwór pozostawia się
na noc w temperaturze 4 C. Wytrącony
osad rozpuszcza się w buforze
imidazolowym (50 mM, pH 6).

Chromatografia
Chromatografia
jonowymienna:
jonowymienna:
Do chromatografii jonowymiennej
należy użyć kolumny wypełnionej
słabym anionitem np. DEAE-Sepharose
CL-6B. Do elucji można użyć np. octanu
sodu.
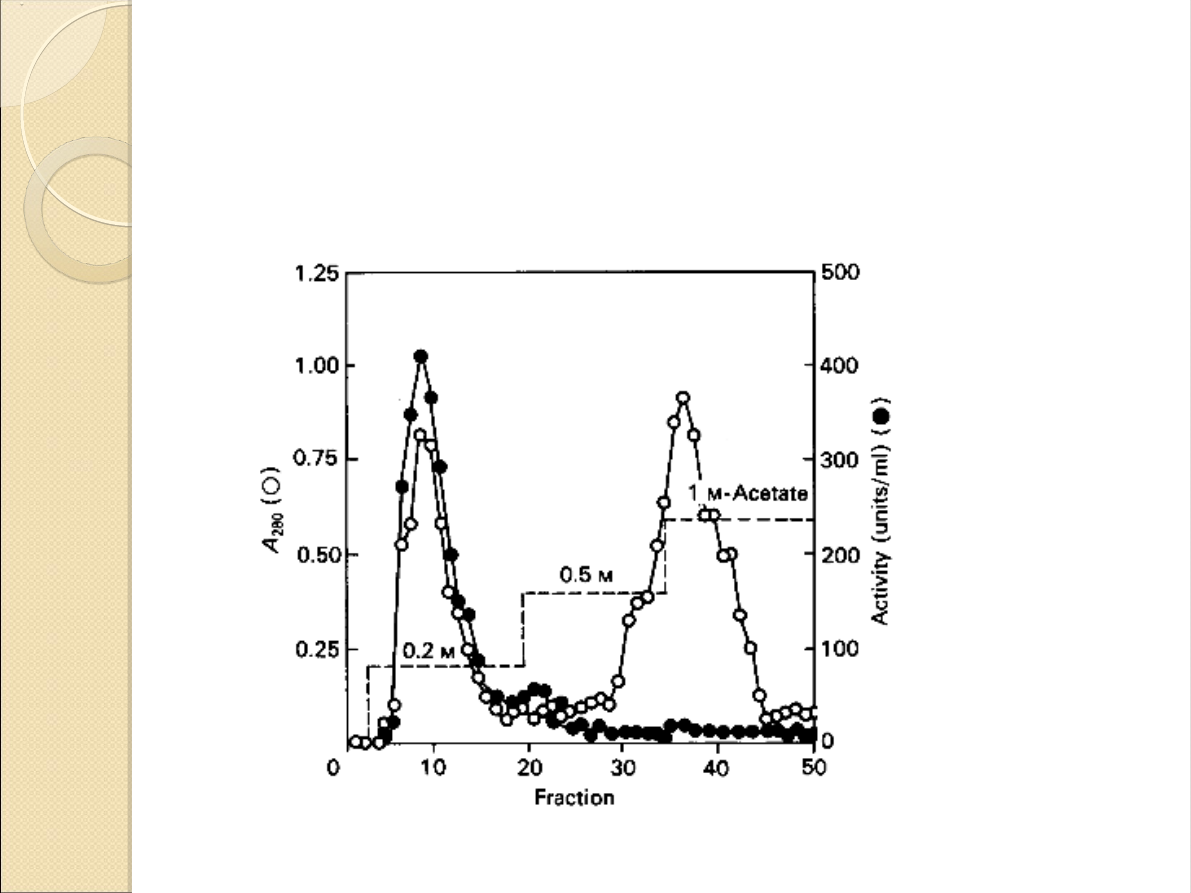
Chromatografia
Chromatografia
jonowymienna:
jonowymienna:

Filtracja żelowa:
Filtracja żelowa:
Końcowym etapem oczyszczania jest
zastosowanie filtracji żelowej (sączenia
molekularnego), pozwalającej na
rozdział cząstek pod względem
wielkości Po zastosowaniu tej techniki
otrzymuje się gotowy preparat.
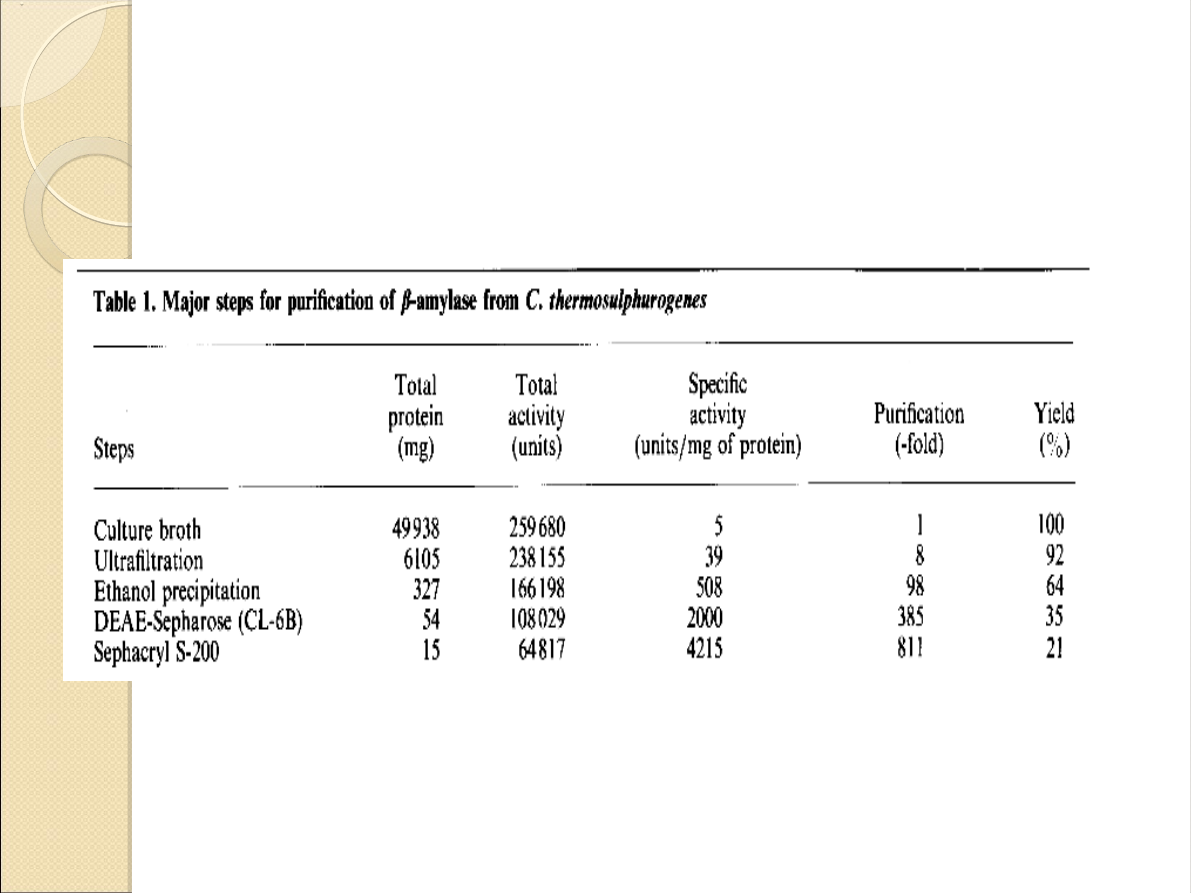
Oczyszczanie:
Oczyszczanie:

Metody sprawdzenia czystości
Metody sprawdzenia czystości
enzymu:
enzymu:
SDS-PAGE
Ogniskowanie izoelektryczne
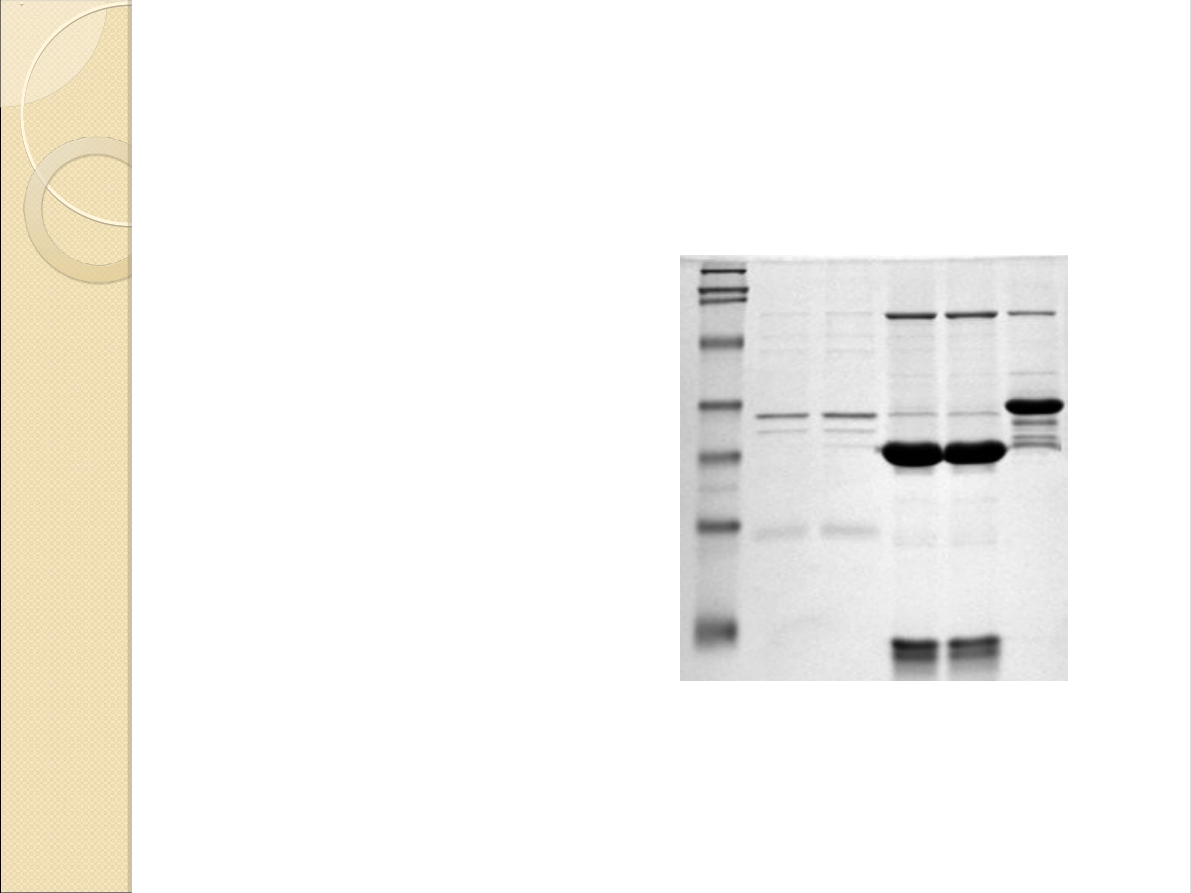
SDS-PAGE:
SDS-PAGE:
Elektroforeza w żelu
denaturującym
pozwala na rozdział
cząstek pod
względem wielkości.
Uzyskanie
pojedynczego paska
świadczy o czystości
produktu.
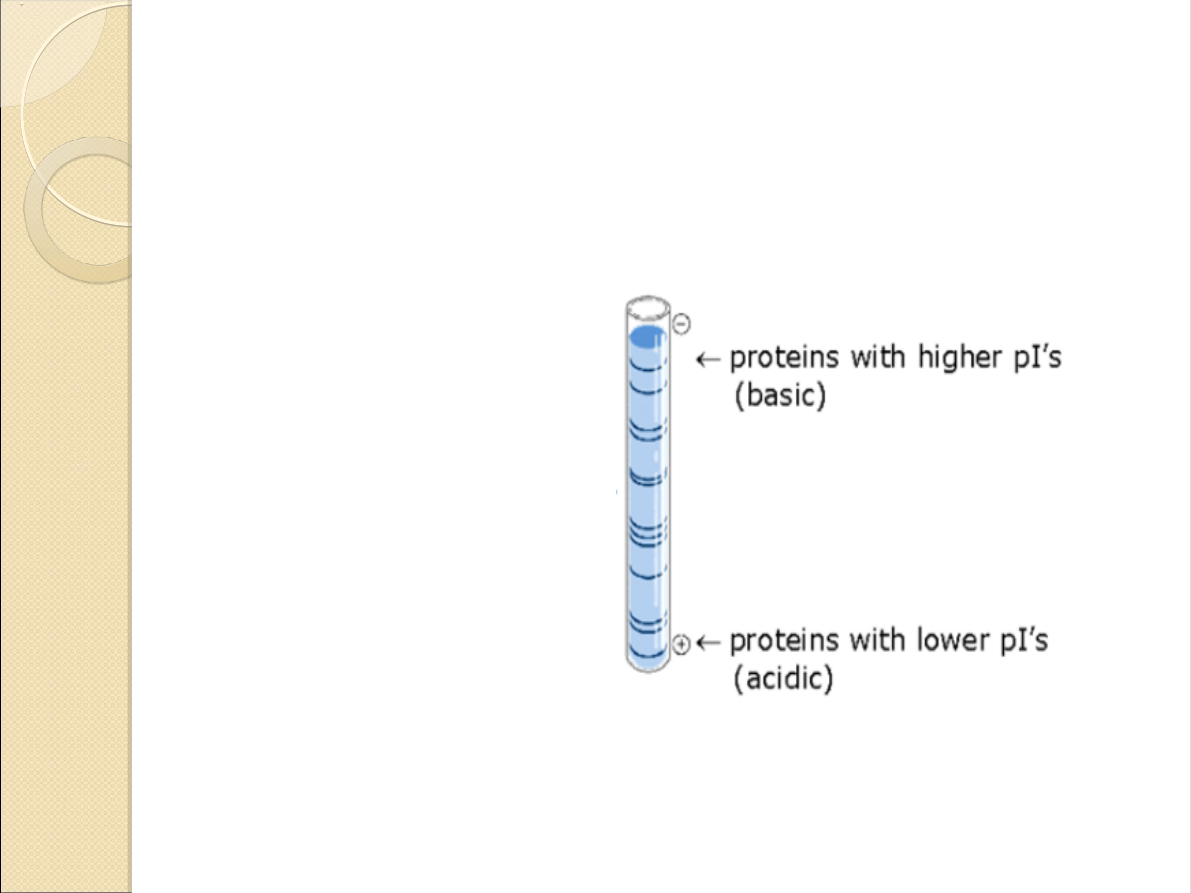
Ogniskowanie
Ogniskowanie
izoelektryczne:
izoelektryczne:
Pozwala na rozdział
białek ze względu
na ich punkt
izoelektryczny.
Otrzymanie
pojedynczego paska
świadczy o czystości
produktu.

Leki:
Leki:
Poza
zastosowaniami
przemysłowymi
enzym może być
stosowany jako
składnik leków na
trawienie np. lek
ENZOsystem
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
Termostabilna B amylaza
AMYLAZA
cw 7 amylaza
Lipazy, proteazy, amylazy mikrobiologia przemysłowa
Biochemia, Oznaczanie aktywnościi amylazy metodą Noeltinga i Bernfelda w ziarnie pszenicy
cwiczenie 5 amylaza oznaczanie aktywnosci enzymu metoda kolorymetryczna 05 05 2014
7 ćw. - amylazy -sprawozdania, Biotechnologia UKW I ST, Biotechnologia żywności UKW
7 ćw. - amylazy -sprawozdania (2), Biotechnologia UKW I ST, Biotechnologia żywności UKW
Badanie aktywności amylazy instrukcja 2013
7 ćw. - amylazy -materiały dydaktyczne, Biotechnologia UKW I ST, Biotechnologia żywności UKW
amylaza
alfa amylaza(1)
Amylaza ślinowa trzustkowa wielocukry dwucukry maltaza ściąga, Notatki
7 ćwi. produkcja enzymu -amylazy - NOWE (1), Biotechnologia UKW I ST, Biotechnologia żywności UKW
Doktorska praca Wpływ procesu suszenia rozpyłowego na degradację preparatu alfa amylazy z Aspergill
Kataliza kowalencyjna; Mechanizm działania alfa amylazy; Grupy funkcyjne i ich modyfikacje
więcej podobnych podstron