22 lutego 2013
Ćwiczenia 1 (struktura elektronowa, rezonans, hybrydyzacja, momenty dipolowe…)
Tworzenie struktur Lewisa:
1) narysuj szkielet,
2) policz elektrony walencyjne,
3) utwórz maksymalną ilość wiązań walencyjnych (pamiętaj o regule oktetu),
4) oznacz ładunki atomów.
Reguła oktetu nie obowiązuje, gdy:
A. nieparzysta jest ilość elektronów;
B. w przypadku niektórych pierwiastków II okresu;
C. w pierwiastkach wyższych okresów niż II, które mogą mieć poszerzoną sferę elektronów walencyjnych.
Ładunek formalny = liczba elektronów walencyjnych – liczba nieuwspólnionych elektronów – ½ liczby
elektronów wiążących wokół atomu.
Struktury rezonansowe: 1. nierealne; 2. względne pozycje jąder – niezmienne; 3. nie wszystkie struktury
jednakowo prawdopodobne - najistotniejsze są: a/ struktury o max liczbie układów oktetowych (NO
+
); b/ z
ładunkami na atomach o kompatybilnej elektroujemności; c/ z mniejszym rozdziałem ładunku (a > b; a > c); 4.
istnienie struktur rezonansowych oznacza rozmycie ładunku w cząsteczce (stabilizację).
1. Narysuj strukturę Lewisa dla: (CH
3
)
2
CNH
,
BF
3
, C
3
H
4
, CH
3
+
,
C
6
H
5
NO
2
, [CH
2
=OH]
+
, NH
3
-BH
3
, przypisując ładunek
odpowiednim atomom. Co niezwykłego jest w strukturze BF
3
czy CH
3
+
?
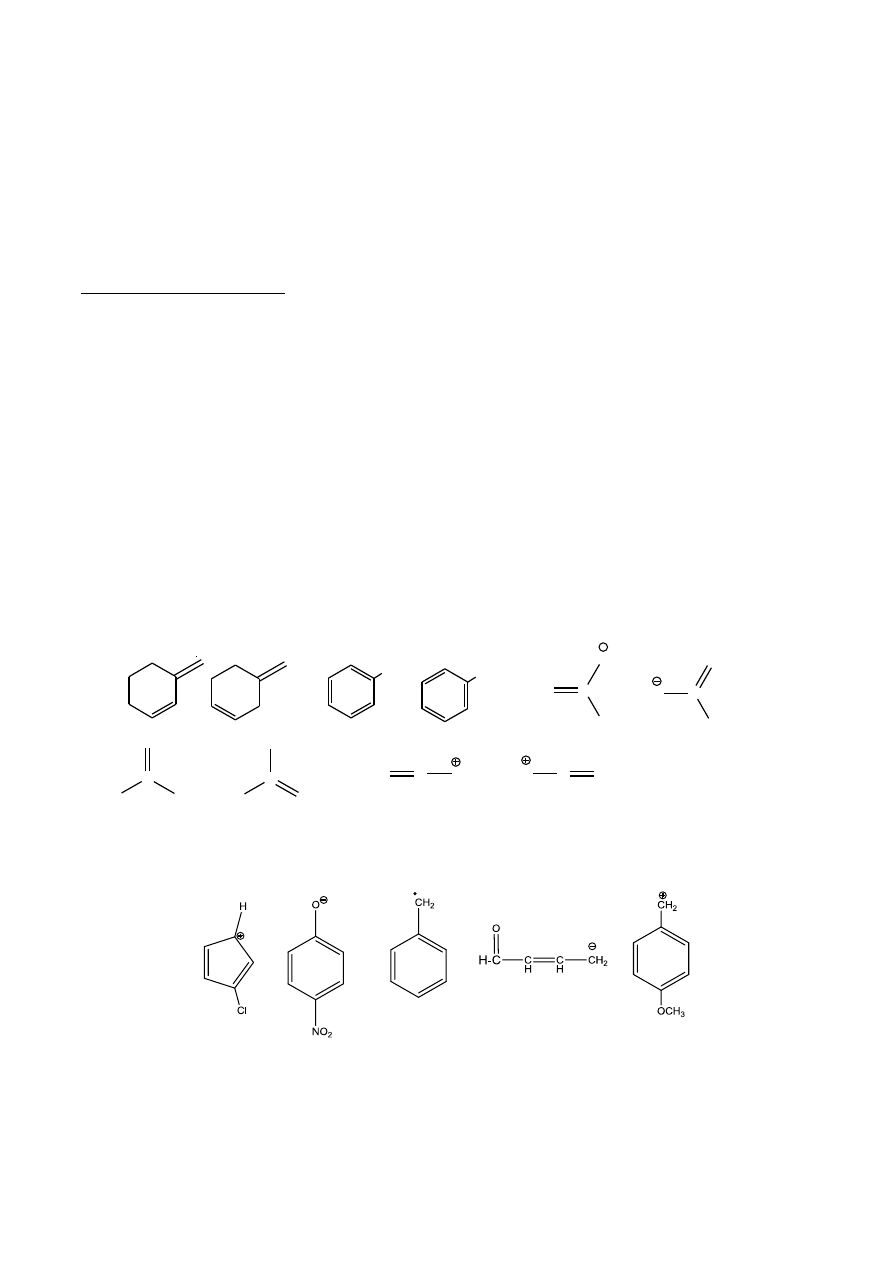
2. Oceń, które pary przedstawiają 2 różne związki, które 2 struktury rezonansowe:
O
O
CH
3
CH
3
H
2
C
C
O
H
H
2
C
C
O
H
H
C
CH
3
O
H
C
CH
2
OH
H
2
C
C
H
CH
2
H
2
C
C
H
CH
2
3. Narysuj strukturę Lewisa dla CH
2
N
2
oraz jonów NO
2
+
i NO
2
-
, przypisując ładunek odpowiednim atomom.
4. Dla następujących cząstek dorysuj brakujące pary elektronowe, narysuj istotne struktury rezonansowe,
podkreśl dominującą, umotywuj wybór.
Reguły dotyczące hybrydyzacji orbitali:
Zarówno elektrony wiążące, jak i wolne pary elektronowe zajmują zwykle orbitale zhybrydyzowane. Ilość
orbitali hybrydowych równa jest sumie ilości wiązań σ i ilości wolnych par elektronowych.
Hybrydyzacja i geometria cząsteczki powinna prowadzić do maksymalnej separacji wiązań
i wolnych par el. (wolne pary zajmują więcej przestrzeni niż pary wiążące, prowadzą więc do
zmniejszenia kąta między wiązaniami).
Jeśli 2 lub 3 pary elektronowe tworzą wiązanie wielokrotne, to pierwsze z nich jest
wiązaniem σ tworzonym przez orbital zhybrydyzowany, drugie – wiązaniem π poniżej i
powyżej σ, a trzecie – wiązaniem π prostopadłym do poprzedniego.
W cząstkach, w których występuje więcej niż 1 znacząca struktura rezonansowa atomy
przyjmują hybrydyzację umożliwiającą tworzenie występujących w strukturach
rezonansowych wiązań π.
5. Określ konfigurację elektronową atomu centralnego, podaj jego hybrydyzację i opisz strukturę następujących
związków: BeCl
2
(
4
Be); BH
3
(
5
B); CH
4
(
6
C); (CH
3
)
2
NH (
7
N).
6. Zaproponuj możliwą hybrydyzację, geometrię i kąty wiązań dla: acetonitrylu (CH
3
CN), aldehydu octowego
(CH
3
COH), kwasu mrówkowego (HCOOH), allenu (CH
2
CCH
2
).
7. Alkohol butylowy (t.w.= 118
◦
C) jest izomerem eteru dietylowego (t.w.= 35
◦
C). Oba związki wykazują
podobną rozpuszczalność w wodzie. Dlaczego wykazują tak różne temperatury wrzenia?
8. Wiązanie N-F jest bardziej polarne niż NH, jednak NF
3
ma mniejszy moment dipolowy (0,2 D) niż NH
3
(1,5 D).
Dlaczego?
9. Bromocykloheksan ma moment dipolowy 2,3 D, a bromobenzen – 1,53 D. Czy możliwość rezonansu może to
wyjaśnić?
W domu:
1. Podaj cząstki elementarne składające się na: H
+
, H, H
-
, D, D
+
.
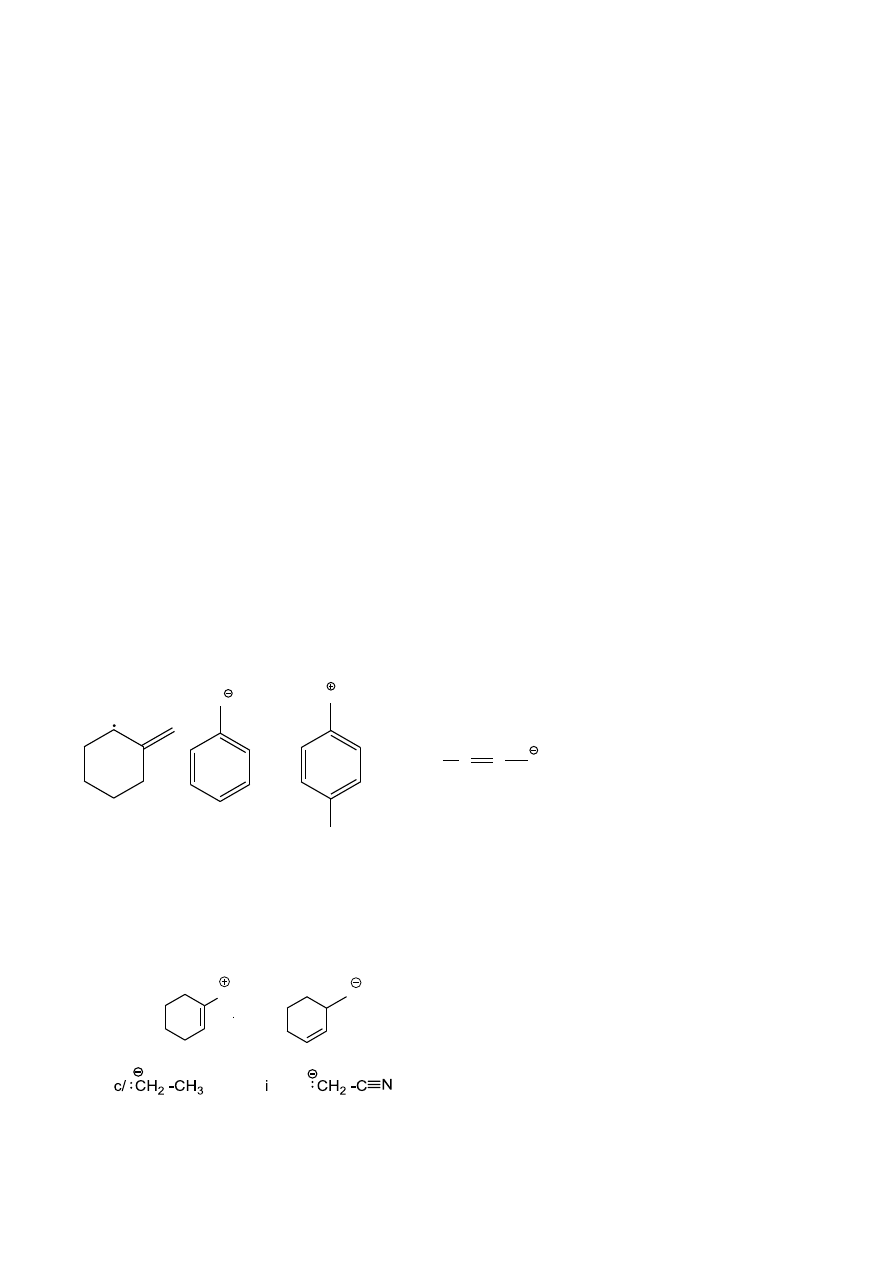
2. Dla następujących cząstek dorysuj brakujące pary elektronowe, narysuj istotne struktury rezonansowe, podkreśl
dominującą (zachowanie aromatyczności ma istotne znaczenie dla stabilności struktury rez.), umotywuj wybór.
O
2
N
C
H
C
H
CH
2
CH
2
O
Cl
3. Narysuj strukturę Lewisa dla cząsteczki ozonu (O
O
O). Jak wyjaśnisz fakt, iż wiązanie O
O w ozonie (128 pm) jest
krótsze niż wiązanie pojedyncze w H
O
O
H (147 pm), a dłuższe niż podwójne wiązanie w cząsteczce tlenu.
4. W oparciu o możliwość stabilizacji rezonansowej ustal, który z jonów jest bardziej stabilny :
a/ CH
3
-CH
+
-CH
3
i
CH
3
-CH
+
-OCH
3
b/
i
CH
2
CH
2
Wyszukiwarka
Podobne podstrony:
cw med 5 id 122239 Nieznany
cw med 2 id 122233 Nieznany
cw med 3 id 122235 Nieznany
cw med 4 id 122237 Nieznany
cw med 7 id 122243 Nieznany
cw med 5 id 122239 Nieznany
cw excel3 id 166408 Nieznany
cw 6 podobienstwo id 122439 Nieznany
nauki human w med id 315728 Nieznany
cw 13 id 121763 Nieznany
Cw mikrob 2 id 122249 Nieznany
CW K2 id 217375 Nieznany
cw mocz id 100534 Nieznany
cw 11 id 122151 Nieznany
Instrukcja cw 3 PI id 216486 Nieznany
cw 1 ZL id 100327 Nieznany
CW 08 id 122562 Nieznany
cw 12 id 122179 Nieznany
cw excel2 id 122222 Nieznany
więcej podobnych podstron