12/19 (?) kwietnia 2013
Ćwiczenia 7 (alkeny)
1. W procesie alkilowania etenu izobutanem w obecności kwasu siarkowego nie otrzymuje się
neoheksanu, lecz głównie 2,3-dimetylobutan. W oparciu o mechanizm reakcji wyjaśnij przyczyny
tworzenia się tego produktu.
2. Połączona z redukcją ozonoliza nieznanego alkenu dała równomolową mieszaninę
cyklopentanokarboaldehydu i acetonu. Jaka była struktura alkenu?
3. Jaki będzie główny produkt reakcji:
a/ reakcja cykloheksenu z kw. nadbenzoesowym w CHCl
3
,
b/ 1-metylocykloheksenu z gorącym, stężonym KMnO
4
, a jaki -
z zimnym,
alkalicznym roztworem KMnO
4
(lub z OsO
4
);
c/ (Z)-but-2-enu z diazometanem wobec światła.
4. Jak przeprowadzić następującą przemianę:
a/ 3-metylopent-2-en → 2-chloro-3-metylopentan-3-ol;
b/ chlorocyklopentan → trans-2-chlorocyklopentanol.
5. Podaj szczegółowy mechanizm kwasowo katalizowanej przemiany 2-metylo-but-2-enu w 2,3,4,4-
tetrametyloheks-2-en.
6. Jakiego produktu należy się spodziewać po zainicjowanej światłem reakcji:
a/ cykloheksenu,
b/ pent-1-enu
z N-bromosukcynimidem w czterochlorku węgla (z bromem o małym stężeniu)?
Jaki jest mechanizm tej reakcji?
W domu:
1. Zaproponuj mechanizm następującej reakcji:
OH
O
1. Hg(OAc)
2
2. NaBH
4
2. Jaki produkt powstanie wskutek hydroborowania/utleniania 1-etylocyklopentenu w metanolu za
pomocą deuterowanego boranu, BD
3
? Wskaż stereochemię produktu i w oparciu o mechanizm
reakcji wyjaśnij jej regioselektywność.
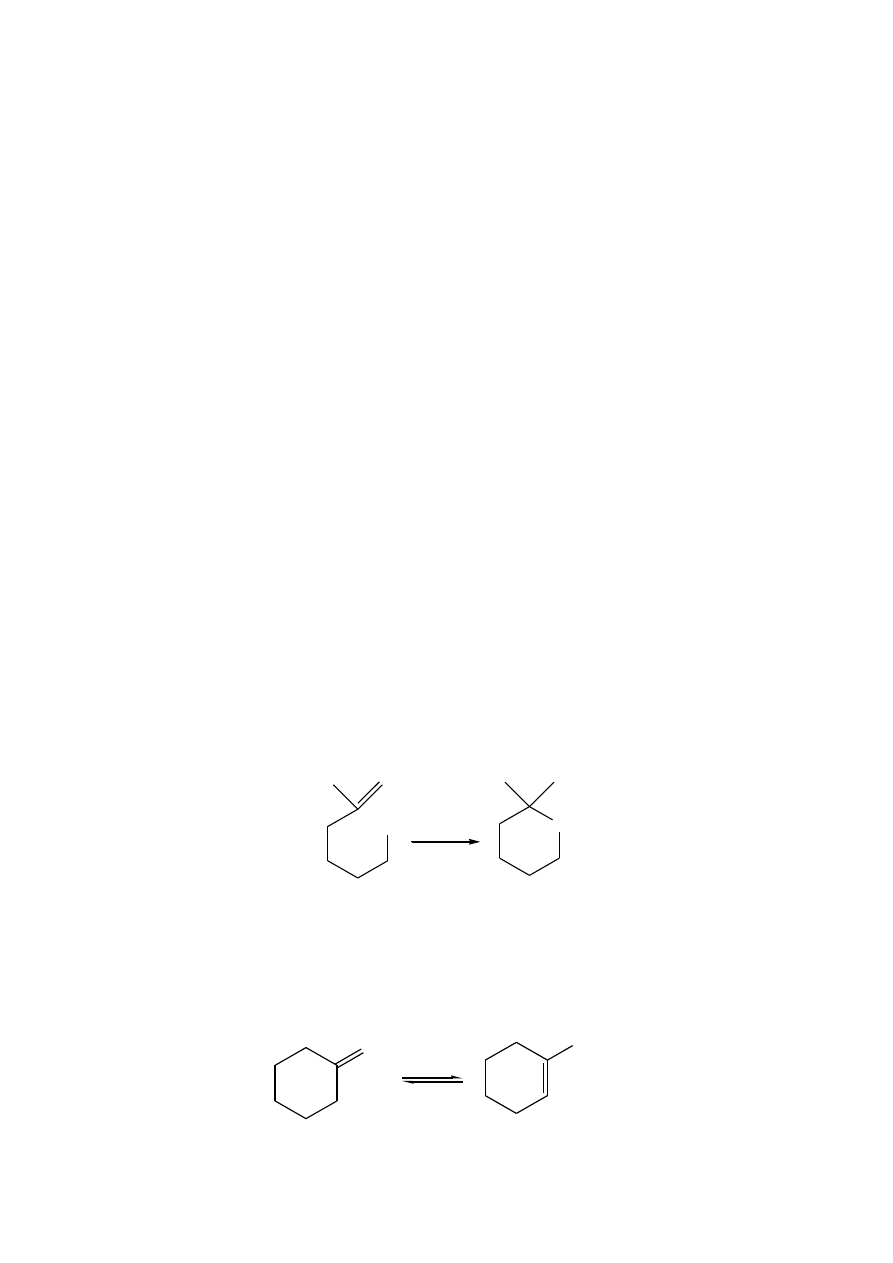
3. Etylidenocykloheksan, pod wpływem silnego kwasu izomeryzuje dając 1-etylocykloheksen.
Zaproponuj mechanizm tej przemiany. W którą stronę przesunięta jest stała równowagi? Dlaczego?
H
2
SO
4
CHCH
3
CH
2
CH
3
Wyszukiwarka
Podobne podstrony:
cw med 5 id 122239 Nieznany
cw med 2 id 122233 Nieznany
cw med 1 id 122231 Nieznany
cw med 3 id 122235 Nieznany
cw med 4 id 122237 Nieznany
cw med 5 id 122239 Nieznany
cw excel3 id 166408 Nieznany
cw 6 podobienstwo id 122439 Nieznany
nauki human w med id 315728 Nieznany
cw 13 id 121763 Nieznany
Cw mikrob 2 id 122249 Nieznany
CW K2 id 217375 Nieznany
cw mocz id 100534 Nieznany
cw 11 id 122151 Nieznany
Instrukcja cw 3 PI id 216486 Nieznany
cw 1 ZL id 100327 Nieznany
CW 08 id 122562 Nieznany
cw 12 id 122179 Nieznany
cw excel2 id 122222 Nieznany
więcej podobnych podstron