Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
1/6
5.4. Przemiana izobaryczna
Przemiana przy stałym ciśnieniu, czyli izobaryczna jest przemianą politropową
o wykładniku m = 0, gdyż
pv
m
=pv
0
=p= const.
Przemiana ta zachodzi, gdy ogrzewa się gaz zamknięty w cylindrze tłokiem, stale jednakowo
obciążonym, więc np. własnym ciężarem lub ciężarem dodatkowym. Przez ogrzewanie gaz
zwiększa swą objętość i tłok unosi się. Przy oziębianiu gaz będzie się kurczył, więc tłok będzie
opadać.
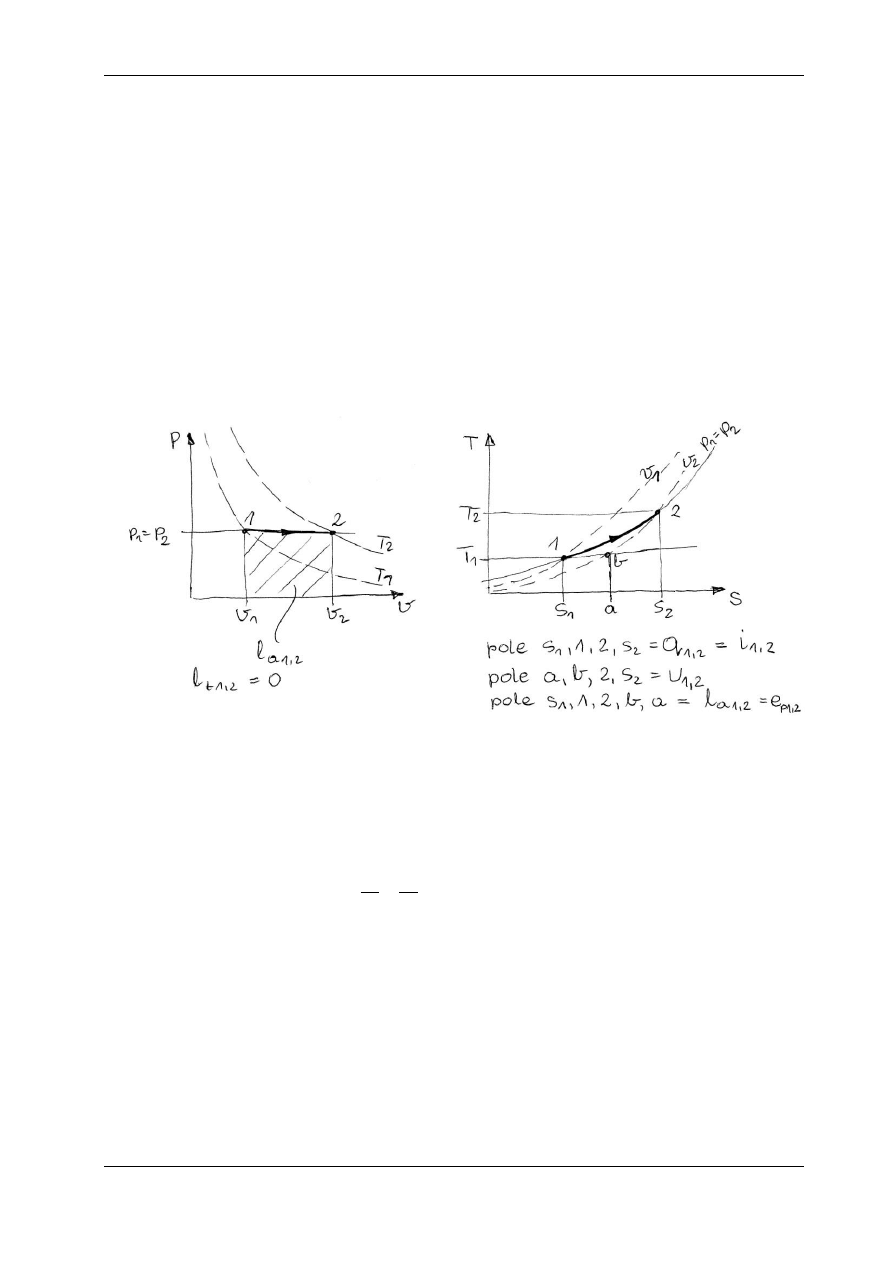
Krzywa przemiany izobarycznej nazywana izobarą jest przedstawiona na rys. 5.4.1
w układzie p – v i T – s.
Rys. 5.4.1. Przemiana izobaryczna na wykresie p – v i T – s
la
1,2
– praca absolutna, q
1,2
- ciepło, u
1,2
– przyrost energii wewnętrznej,
i
1,2
– przyrost entalpii, e
1,2
– energia przetłaczania
Parametry stanu w przemianie izobarycznej zmieniają się według zależności
Praca absolutna przemiany wynosi
2
1
1
2
2
,
1
)
(
v
v
p
dv
p
l
a
Praca techniczna wynosi
2
1
2
,
1
0
dp
v
l
t
Zgodnie z definicją, ciepło przemiany wynosi
2
1
2
1
T
T
v
v

Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
2/6
)
(
1
2
2
,
1
T
T
c
q
Wobec tego, że dla przemiany izobarycznej wykładnik politropy m = 0 ciepło właściwe c tej
przemiany wynosi
p
v
v
c
c
k
m
k
m
c
c
1
)
(
A zatem, ciepło dostarczone bądź odebrane w przemianie izobarycznej można przedstawić
zależnością
1
2
2
,
1
T
T
c
q
p
Wobec tego, że w przemianie izobarycznej l
t1,2
=0, z równania pierwszej zasady termodynamiki
w postaci
2
,
1
2
,
1
2
,
1
t
l
q
i
wynika, że dostarczone ciepło jest równe przyrostowi entalpii czynnika.
2
,
1
2
,
1
i
q
Przyrost entropii można wyznaczyć z definicji entropii:
T
dq
ds
Dla przemiany izobarycznej dq = c
p
·dT, a zatem
1
2
2
1
2
1
2
,
1
ln
T
T
c
T
dT
c
T
dq
s
p
p
Przyrost energii wewnętrznej, zgodnie z definicją wynosi
)
(
1
2
2
,
1
T
T
c
u
v
Przyrost entalpii, zgodnie z definicją wynosi
)
(
1
2
2
,
1
T
T
c
i
p
5.5. Przemiana izochoryczna
Przemiana przy stałej objętości czyli izochoryczna zachodzi wówczas, gdy mimo zmian
temperatury i ciśnienia oraz mimo doprowadzania i odprowadzania ciepła objętość gazu
zamkniętego w naczyniu nie ulega zmianie. Przemiana izochoryczna (v = const.) jest przemianą
politropową o wykładniku m = ± ∞ .
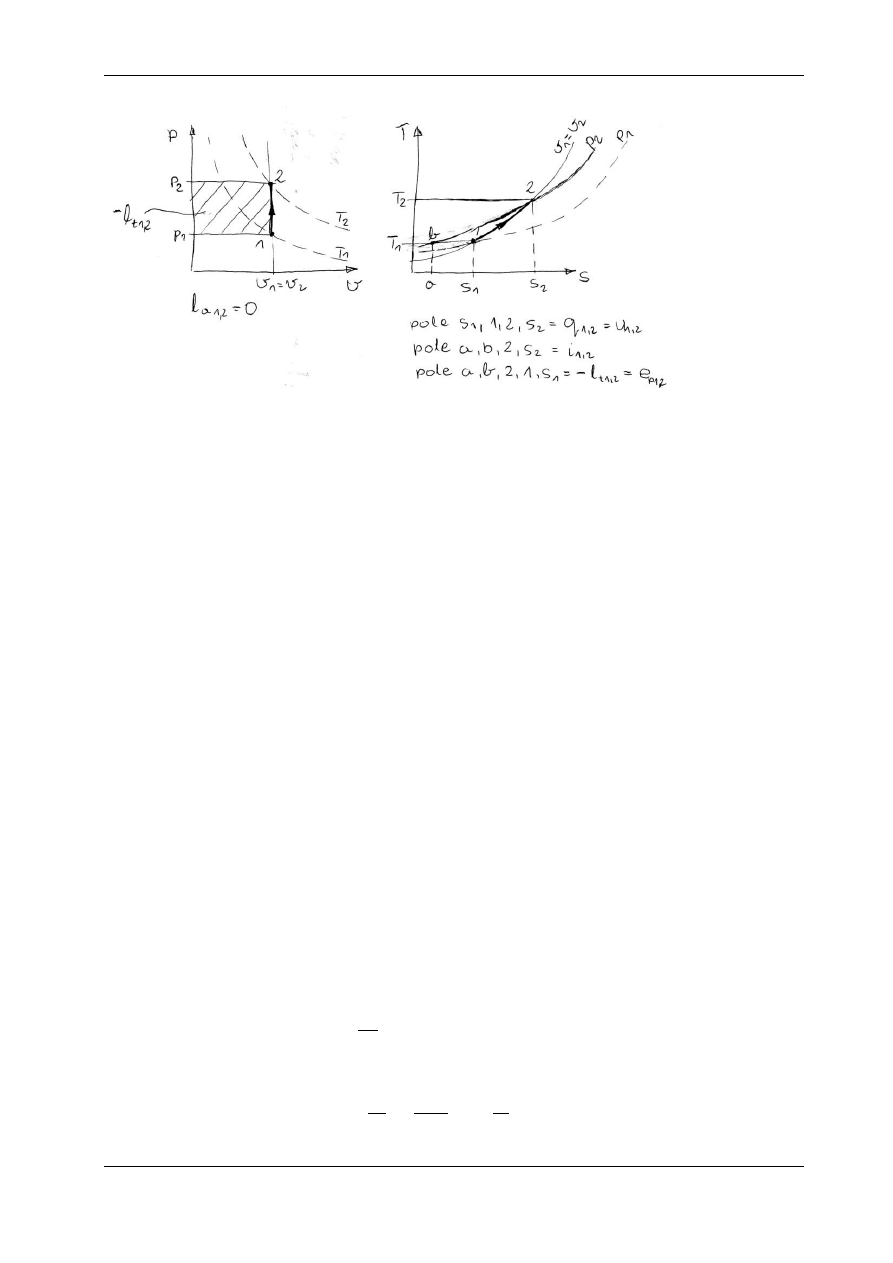
Krzywa przemiany izochorycznej nosi nazwę izochory i jest przedstawiona na rys. 5.5.1
w układzie p – v i T – s. Parametry stanu gazu w tej przemianie zmieniają się zgodnie z równaniem
2
1
2
1
T
T
p
p
Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
3/6
Rys. 5.5.1. Przemiana izochoryczna na wykresie p – v i T – s
lt
1,2
– praca techniczna, q
1,2
- ciepło, u
1,2
– przyrost energii wewnętrznej,
i
1,2
– przyrost entalpii, e
1,2
– energia przetłaczania
Praca absolutna przemiany wynosi
2
1
2
,
1
0
dv
p
l
a
Praca techniczna wynosi
2
1
1
2
2
,
1
p
p
v
dp
v
l
t
Zgodnie z definicją, ciepło przemiany wynosi
)
(
1
2
2
,
1
T
T
c
q
Wobec tego, że dla przemiany izochorycznej c =c
v
, otrzymuje się
1
2
2
,
1
T
T
c
q
v
Wobec tego, że w przemianie izobarycznej l
a1,2
=0, z równania pierwszej zasady termodynamiki
w postaci
2
,
1
2
,
1
2
,
1
a
l
q
u
wynika, że dostarczone ciepło jest równe przyrostowi energii wewnętrznej czynnika.
2
,
1
2
,
1
u
q
Przyrost entropii można wyznaczyć z definicji entropii:
T
dq
ds
Dla przemiany izochorycznej dq = c
v
·dT, a zatem
1
2
2
1
2
1
2
,
1
ln
T
T
c
T
dT
c
T
dq
s
v
v
Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
4/6
Przyrost energii wewnętrznej, zgodnie z definicją wynosi
)
(
1
2
2
,
1
T
T
c
u
v
Przyrost entalpii, zgodnie z definicją wynosi
)
(
1
2
2
,
1
T
T
c
i
p
5.6. Przemiana izotermiczna
Przemiana przy stałej temperaturze czyli izotermiczna (T = const.) jest przemianą
politropową o wykładniku m = 1, a więc
p·v = const.
Jest równocześnie przemianą przy stałej energii wewnętrznej, tj.
u = c
v
·T = const. lub du = c
v
·dt = 0
oraz przemianą przy stałej entalpii, tj.
i = c
p
·T = const. lub di = c
p
·dt = 0
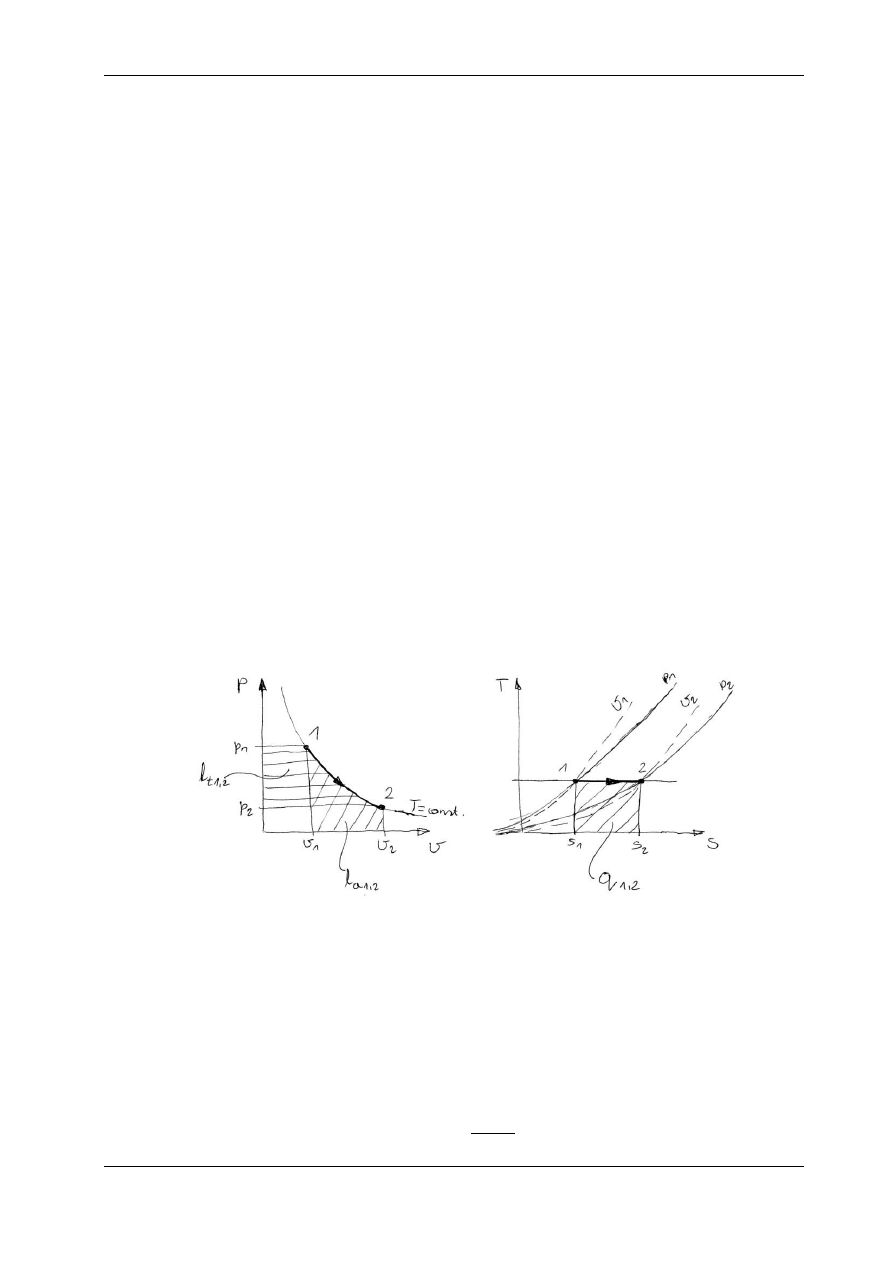
Linia przemiany przestawiającej przemianę o stałej temperaturze nosi nazwę izotermy i jest
przedstawiona na rys. 5.6.1 w układzie p – v i T – s. Parametry stanu gazu w tej przemianie
zmieniają się zgodnie z równaniem
T
R
v
p
v
p
2
2
1
1
Izoterma jest więc na wykresie p – v hiperbolą równoosiową.
Rys. 5.6.1. Przemiana izochoryczna na wykresie p – v i T – s
la
1,2
– praca absolutna, lt
1,2
– praca techniczna, q
1,2
- ciepło
Praca absolutna przemiany wynosi
2
1
2
,
1
dv
p
l
a
Z równania izotermy:
v
v
p
p
v
p
v
p
1
1
1
1

Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
5/6
A zatem
2
1
1
2
1
2
1
1
1
2
1
1
1
1
2
1
1
1
2
1
1
1
2
,
1
ln
ln
ln
ln
ln
ln
2
1
p
p
T
R
v
v
T
R
v
v
v
p
v
v
v
p
v
v
p
v
dv
v
p
v
dv
v
p
l
v
v
a
2
1
1
2
2
,
1
ln
ln
p
p
T
R
v
v
T
R
l
a
Praca techniczna wynosi
2
1
dp
v
l
t
Z równania izotermy:
p
v
p
v
v
p
v
p
1
1
1
1
A zatem
2
1
1
1
1
2
1
1
1
1
1
1
2
1
1
ln
ln
2
p
p
v
p
p
p
v
p
dp
p
v
p
p
dp
v
p
l
t
2
,
1
1
2
2
1
2
,
1
ln
ln
a
t
l
v
v
T
R
p
p
T
R
l
Przyrost energii wewnętrznej, zgodnie z definicją wynosi
)
(
1
2
2
,
1
T
T
c
u
v
Ponieważ :
2
1
T
T
przyrost energii wewnętrznej w przemianie izotermicznej:
0
2
,
1
u
Przyrost entalpii, zgodnie z definicją wynosi
)
(
1
2
2
,
1
T
T
c
i
p
Ponieważ :
2
1
T
T
przyrost entalpii w przemianie izotermicznej:
0
2
,
1
i
Ciepło przemiany można wyznaczyć z równania pierwszej zasady termodynamiki. Wobec tego, że
0
2
,
1
u
, z pierwszej postaci równania

Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
6/6
2
,
1
2
,
1
2
,
1
A
l
q
u
wynika
2
,
1
2
,
1
a
l
q
a wobec
0
2
,
1
i
, z drugiej postaci równania
2
,
1
2
,
1
2
,
1
t
l
q
i
wynika
2
,
1
2
,
1
t
l
q
A zatem, w przemianie izotermicznej
2
1
1
2
2
,
1
2
,
1
2
,
1
ln
ln
p
p
T
R
v
v
T
R
l
l
q
t
a
Przyrost entropii można wyznaczyć z definicji entropii:
T
dq
ds
a zatem:
2
1
1
2
1
2
,
1
2
,
1
ln
ln
p
p
R
v
v
R
T
q
s
5.7. Przemiana izentropowa
Jest to przemiana odbywająca się bez wymiany ciepła z otoczeniem, czyli przemiana
adiabatyczna, w której
dq = 0 oraz q= 0
Warunek ten powiązany ze wzorem definicyjnym na entropię, reprezentuje jednocześnie warunek
stałej entropii
dq = T·ds. = 0
Ponieważ T ≠ 0 to ds = 0, czyli s = const. przemiana przy stałej entropii nazywa się przemianą
izentropową a krzywa przedstawiająca tę przemianę nosi nazwę izentropy. Nie każda jednak
przemiana adiabatyczna jest przemianą izentropową. Równoważność obu przemian odnosi się tylko
do przemian odwracalnych gazu doskonałego bez wymiany ciepła z otoczeniem, gdy w układzie nie
ma wewnętrznych źródeł ciepła wynikłych np. z lepkości.
Pierwsze równanie termodynamiki w odniesieniu do przemiany adiabatycznej przybiera
postać
(5.7.1)

Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
7/6
Z równania
oraz
obliczone c
v
ma wartość
a po wstawieniu tej wartości do równania (5.7.1) otrzymuje się
a po przekształceniu
(5.7.2)
Różniczkując równanie pv=RT , otrzymuje się
p dv + v dp = R dT
i podstawiając do (5.7.2) wartość R dT otrzymuje się
Stąd
lub ostatecznie
Jest to równanie różniczkowe adiabaty. Całkując to równanie przy założeniu, że k = const.
otrzymuje się równanie
lub
skąd
= const.
(5.7.3)
A więc jest to postać przemiany politropowej, dla której m = k.
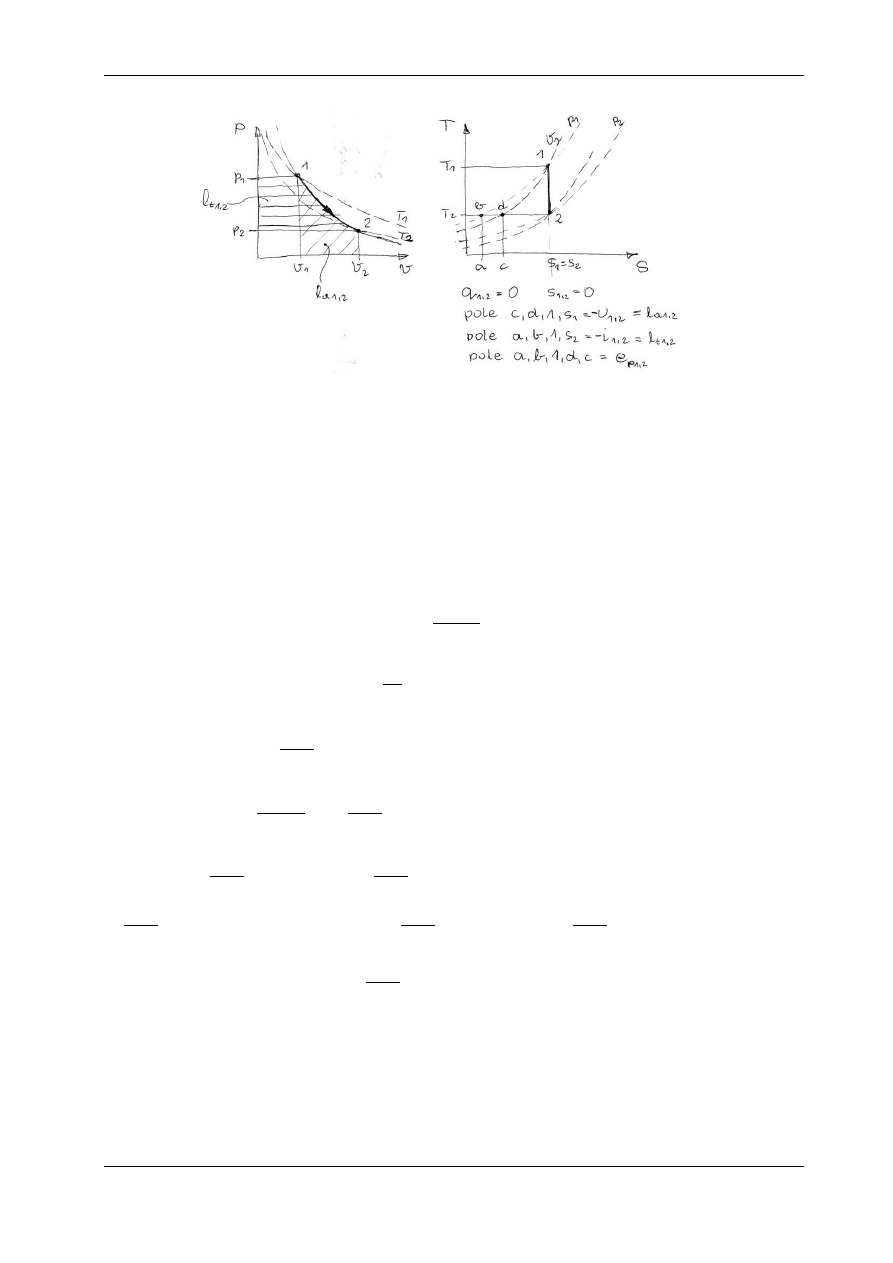
Adiabata w układzie p – v jest hiperbolą nierównoboczną przebiegającą bardziej stromo niż
izoterma. Jest przedstawiona na rys. 5.7.1 w układzie p – v i T – s.
Korzystając z równania stanu gazu można w równaniu (5.7.3) wyeliminować kolejno jeden
z parametrów i zastąpić go temperaturą. Po dokonaniu przekształceń otrzymuje się równanie
przemiany izentropowej w następujących postaciach
)
1
(
2
2
)
1
(
1
1
k
k
v
T
v
T
k
k
k
k
p
T
p
T
1
2
2
1
1
1
Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
8/6
Rys. 5.7.1. Przemiana izentropowa na wykresie p – v i T – s
la
1,2
– praca absolutna, lt
1,2
– praca techniczna, u
1,2
– przyrost energii wewnętrznej,
i
1,2
– przyrost entalpii, e
1,2
– przyrost energii przetłaczania
Praca absolutna przemiany wynosi
2
1
2
,
1
dv
p
l
a
Z równania izentropy
k
k
k
k
v
v
p
p
v
p
v
p
1
1
1
1
2
1
1
1
2
1
1
1
2
,
1
dv
v
v
p
v
dv
v
p
l
k
k
k
k
a
Wiadomo, że:
1
1
1
n
n
x
dx
x
n
n
A zatem:
1
1
1
2
2
1
1
2
1
1
1
1
k
k
v
v
k
k
v
v
k
k
v
dv
v
2
,.
1
1
2
1
2
1
1
2
2
1
1
1
1
1
2
2
2
1
1
1
1
1
2
1
1
1
1
1
2
1
1
2
,
1
1
1
1
1
1
1
1
1
1
u
T
T
c
T
T
k
R
v
p
v
p
k
v
v
p
v
v
p
k
v
v
p
v
v
p
k
v
v
k
v
p
l
v
k
k
k
k
k
k
k
k
k
k
k
a
2
,
1
1
2
2
,
1
1
u
T
T
k
R
l
a
Praca techniczna wynosi
2
1
dp
v
l
t

Przypadki szczególne przemiany politropowej
Opracowanie: Ewa Fudalej-Kostrzewa
9/6
Zrównania izentropy:
1
1
1
1
1
1
v
p
p
v
v
p
v
p
k
k
k
k
dp
p
v
p
p
dp
v
p
l
k
k
k
k
t
2
1
1
1
1
1
1
1
2
1
1
1
k
k
k
k
k
k
k
p
p
k
k
p
p
k
k
p
p
k
k
p
dp
p
1
1
1
2
1
1
1
1
1
2
1
1
2
1
1
1
1
1
1
1
1
2
1
2
,
1
1
2
1
2
1
1
2
2
1
1
2
2
1
1
1
1
1
1
2
1
1
1
1
1
1
2
1
1
1
2
,
1
)
(
1
1
1
1
1
i
T
T
c
T
T
R
k
k
v
p
v
p
k
k
v
p
v
p
k
k
p
v
p
p
v
p
k
k
p
p
k
k
v
p
l
p
k
k
k
k
k
k
k
k
k
k
k
t
2
,
1
2
,
1
1
2
2
,
1
1
i
u
k
T
T
k
R
k
l
t
Ciepło przemiany, zgodnie z definicją:
)
(
1
2
2
,
1
T
T
c
q
Wobec tego, że c =0:
0
2
,
1
q
Przyrost entropii, zgodnie z definicją:
T
dq
ds
Wobec tego, że c =0, q
1,2
=0:
0
2
,
1
s
Przyrost energii wewnętrznej, zgodnie z definicją:
)
(
1
2
2
,
1
T
T
c
u
v
Przyrost entalpii, zgodnie z definicją:
)
(
1
2
2
,
1
T
T
c
i
p
Wyszukiwarka
Podobne podstrony:
PRZEMIANY id 405233 Nieznany
5 Przemiany 1 id 39777 Nieznany
PM 3Ta Prad przemienny id 36333 Nieznany
9 Przemiany P id 48352 Nieznany (2)
przemiany 2 id 405234 Nieznany
PRZEMIESZCZENIA W BELKACH id 40 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
więcej podobnych podstron