
Kinetyczna teoria gazów
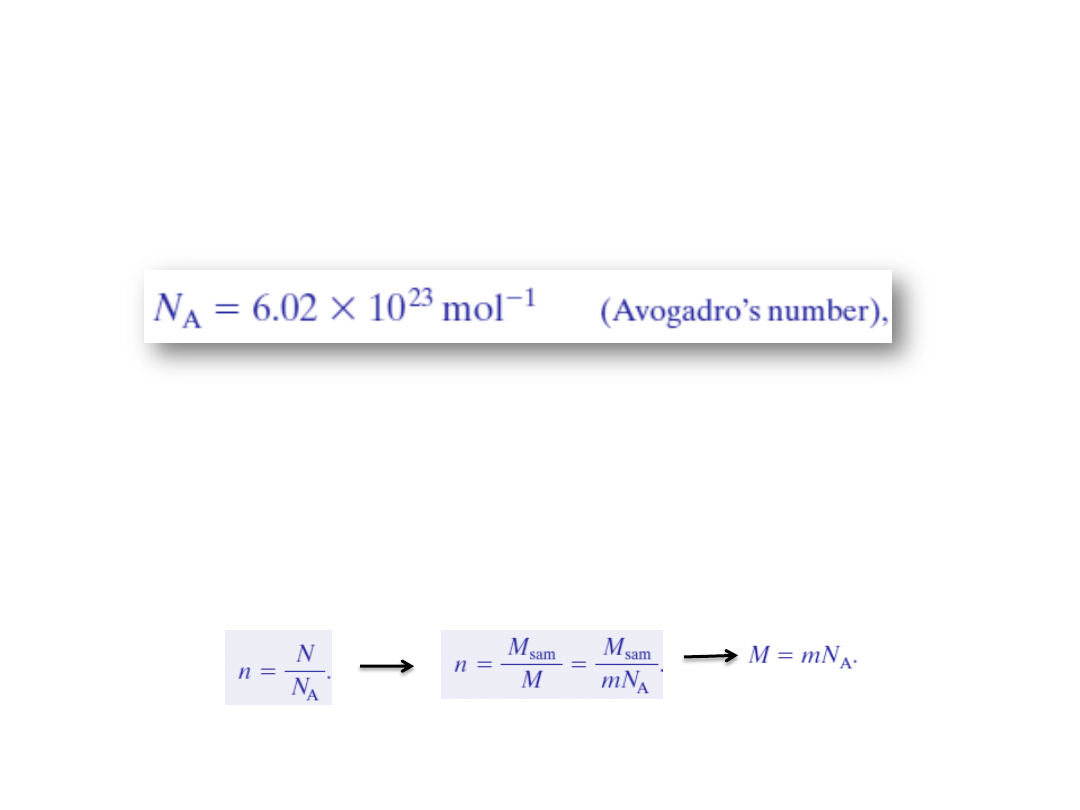
1. Liczba Avogadra
Jeden mol to liczba atomów w próbce węgla-12 o masie 12 g.
Liczba atomów lub cząstek w jednym molu jest nazywana
liczbą Avogadra, N
A
.
Jeśli:
n – liczba moli zawarta w próbce dowolnej substancji,
N – liczba cząsteczek,
M
sam
–masa próbki,
M – masa molowa,
wówczas:
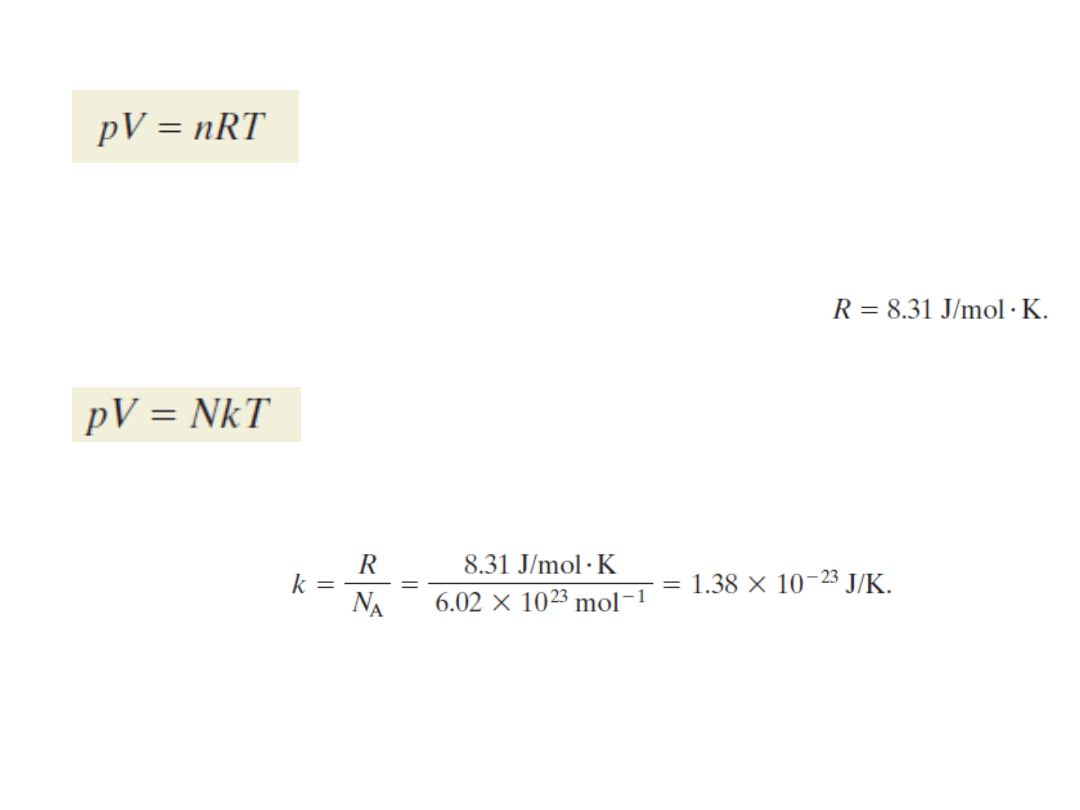
2.
Gazy doskonałe
p – bezwzględna wartość ciśnienia,
n – liczba moli gazu w próbce,
T – temperatura bezwzględna gazu (w kelwinach),
R – stała gazowa, która ma tę samą wartość dla wszystkich gazów:
k – stała Boltzmanna,
N – liczba cząsteczek
(równanie stanu gazu doskonałego)
(równanie stanu gazu doskonałego)
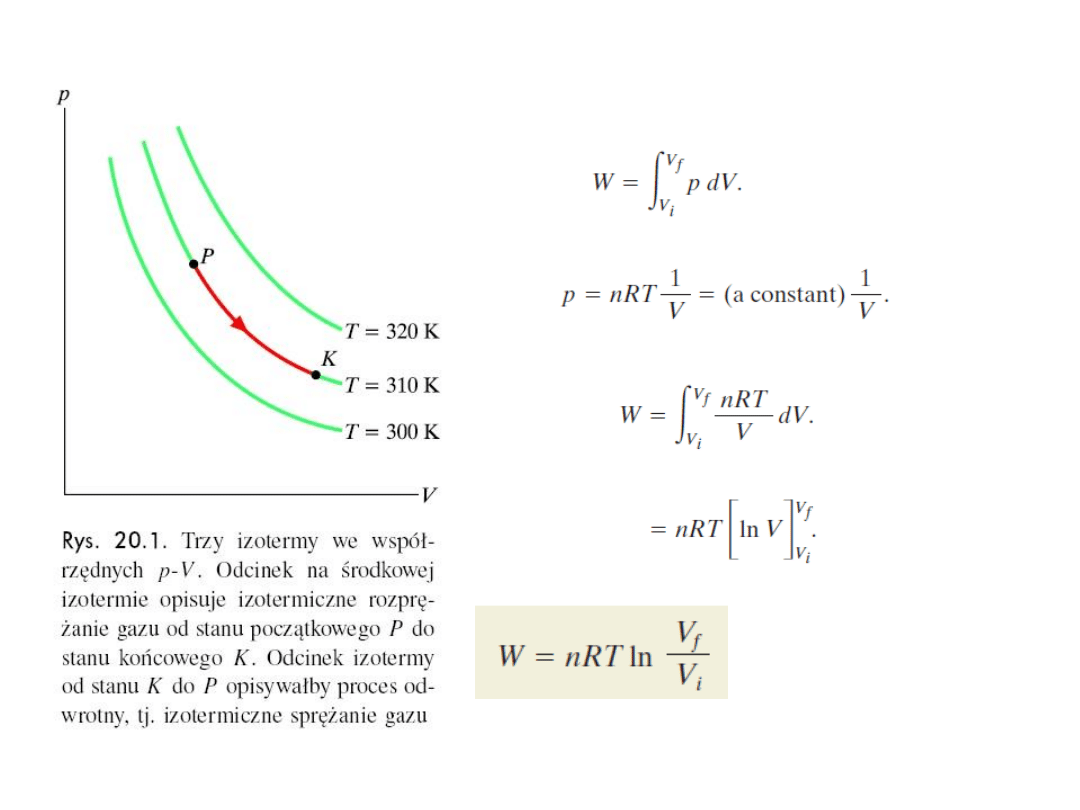
3.
Praca wykonywana przez gaz doskonały w stałej temperaturze
(gaz doskonały,
przemiana izotermiczna)
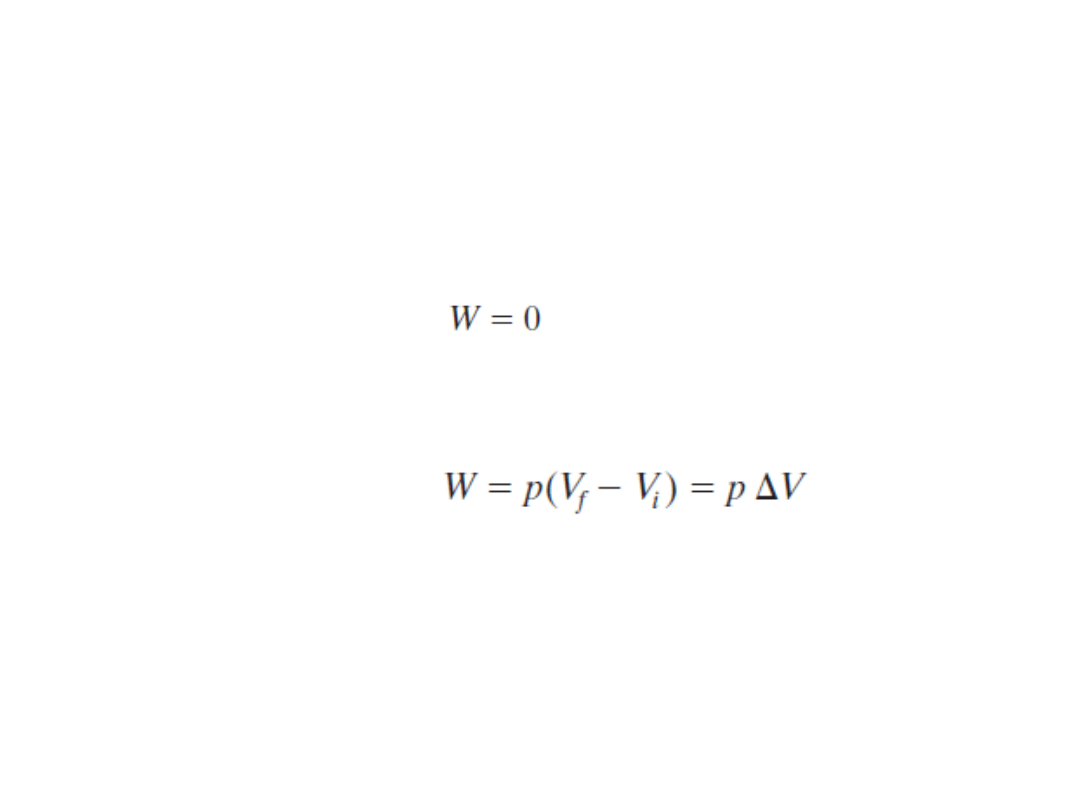
4.
Praca wykonywana przez gaz doskonały przy stałej objętości
i przy stałym ciśnieniu
Praca W wykonywana przez gaz doskonały (lub dowolny inny gaz) podczas przemian
przy stałej objętości i przy stałym ciśnieniu:
Jeżeli objętość gazu jest stała, to
Jeżeli zmienia się objętość, a ciśnienie p jest stałe, to
(przemiana przy stałej objętości)
(przemiana przy stałym ciśnieniu)

Example, Ideal Gas Processes
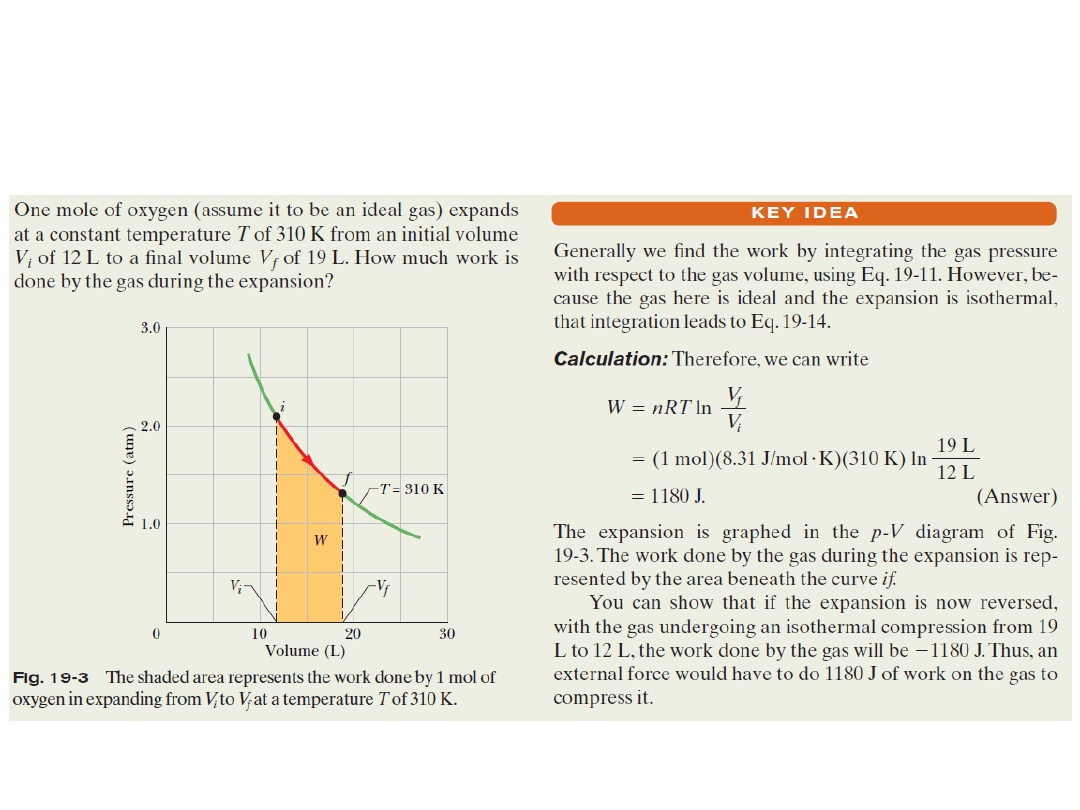
Example, Work done by an Ideal Gas
.
Zatem
Ciśnienie:
But,
Zatem
Z
otrzymujemy
oraz
5. Ciśnienie, temperatura i prędkość średnia kwadratowa
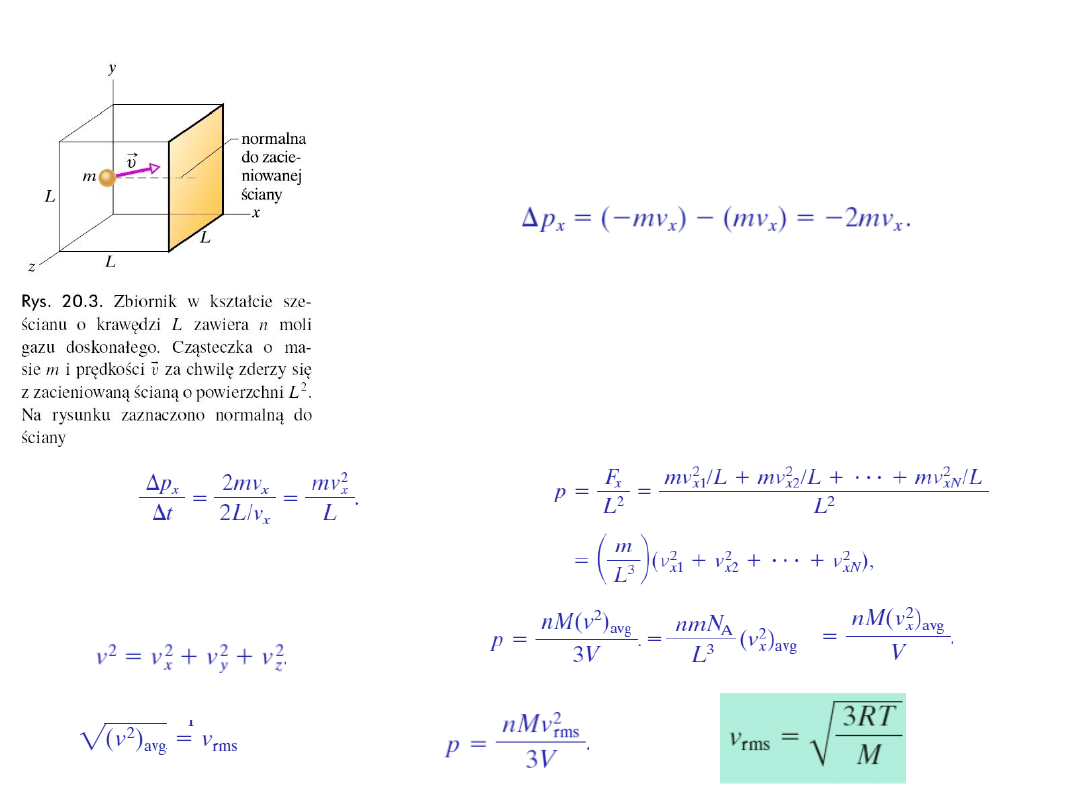
Dla cząsteczki gazu o masie m i prędkości v, która za chwilę
zderzy się z zacieniowaną ścianką zbiornika (rys. 20.3), jeśli
zderzenie jest sprężyste, zmieni się tylko składowa prędkości w
kierunku osi x. Zatem zmieni się jedynie składowa pędu
cząsteczki w kierunku osi x:
Zatem pęd
D
p
x
, który otrzymuje ściana w wyniku zderzenia jest
równy +2mv
x
.
Czas
D
t pomiędzy zderzeniami jest czasem potrzebnym
cząsteczce poruszającej się z prędkością v
x.
na przebycie drogi do
przeciwnej ściany i z powrotem (2L).
Czas
D
t jest więc równy 2L/v
x
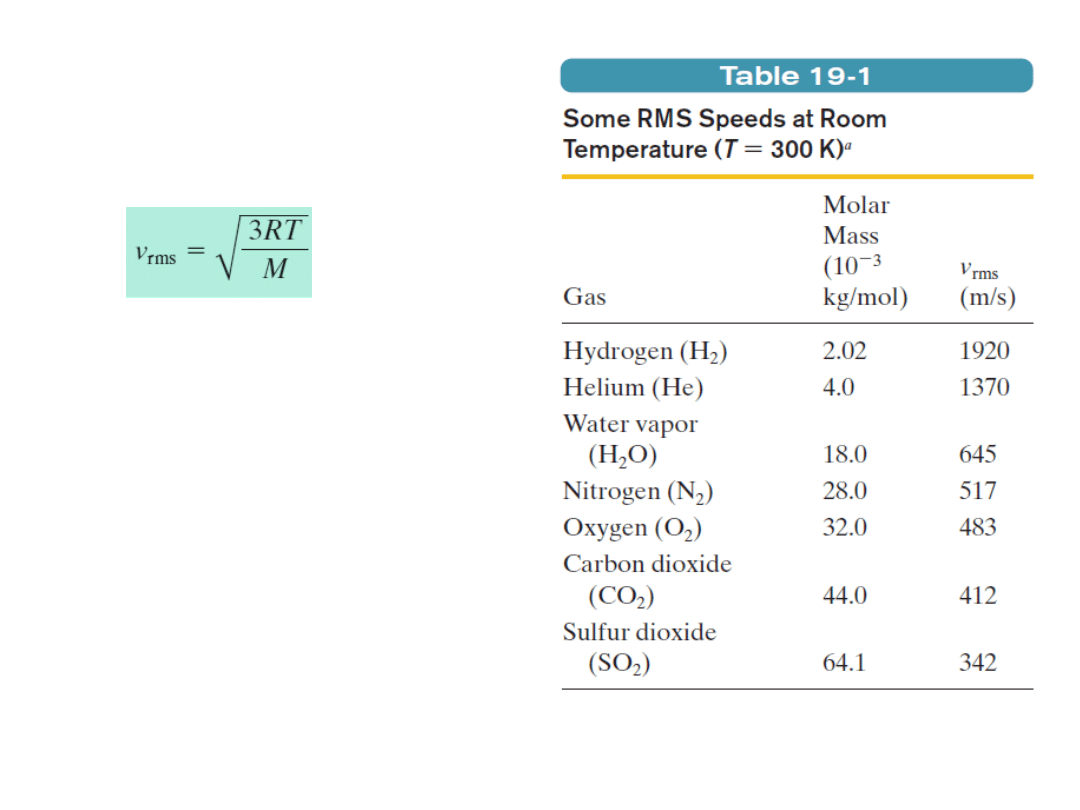
Prędkość średnia kwadratowa:
Przykładowa wartości prędkości
średniej kwadratowej cząsteczek
obliczone na podstawie równania

Example:
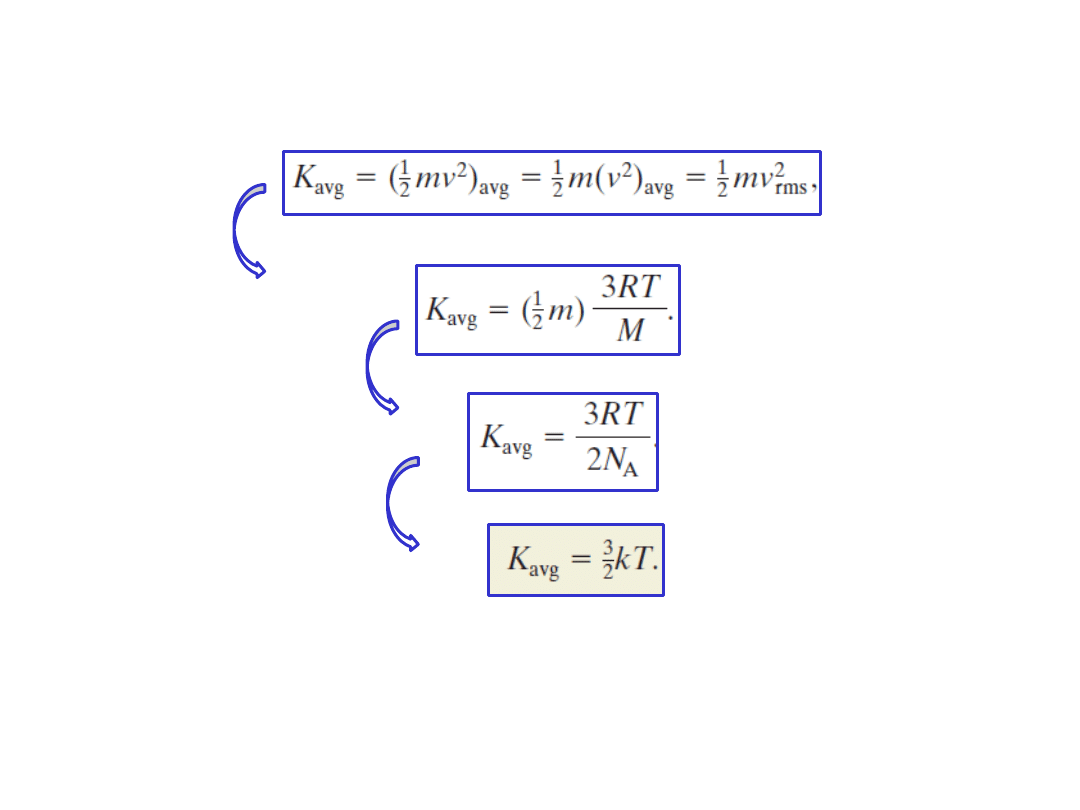
6. Energia kinetyczna ruchu postępowego
– w danej temperaturze T wszystkie cząsteczki gazu doskonałego
(niezależnie od swojej masy) mają taką samą energie kinetyczną ruchu postępowego
– mierząc temperaturę gazu, wyznaczamy jednocześnie średnią energię kinetyczną
ruchu postępowego jego cząsteczek
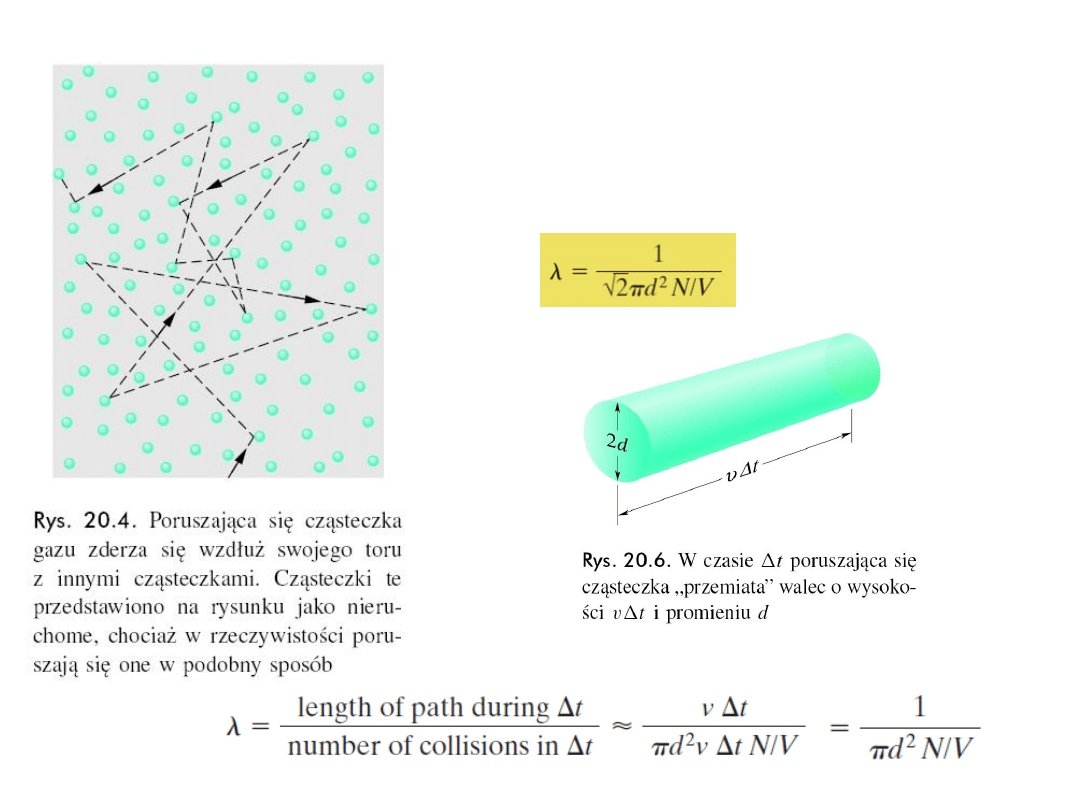
7. Średnia droga swobodna
Średnia droga swobodna
l -
droga, jaką pokonuje średnio
cząsteczka między swoimi kolejnymi zderzeniami.
Wzór opisujący średnią drogę swobodną cząsteczki:
(średnia droga swobodna)

Example, Mean Free Path, Average Speed, Collision Frequency:
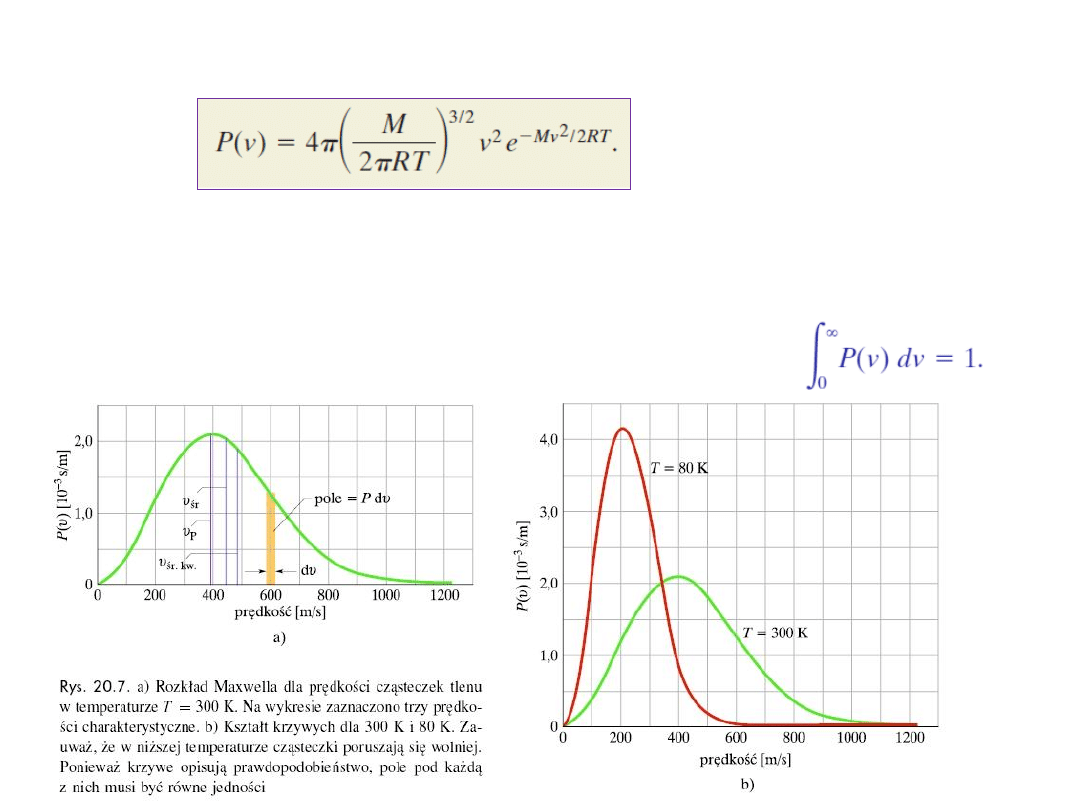
Rozkład Maxwella prędkości cząsteczek gazu: M – masa molowa gazu,
R – stała gazowa,
T – temperatura gazu,
v – prędkość cząsteczek.
Wielkość P(v) jest funkcją rozkładu prawdopodobieństwa: dla dowolnej prędkości v
iloczyn P(v)dv wskazuje, jaki ułamek cząsteczek ma prędkości z przedziału o szerokości dv
i środku w punkcie v.
Całkowite pole powierzchni pod krzywą rozkładu określa, jaka część
cząsteczek ma prędkości z przedziału od zera do nieskończoności:
8. Rozkład prędkości cząsteczek
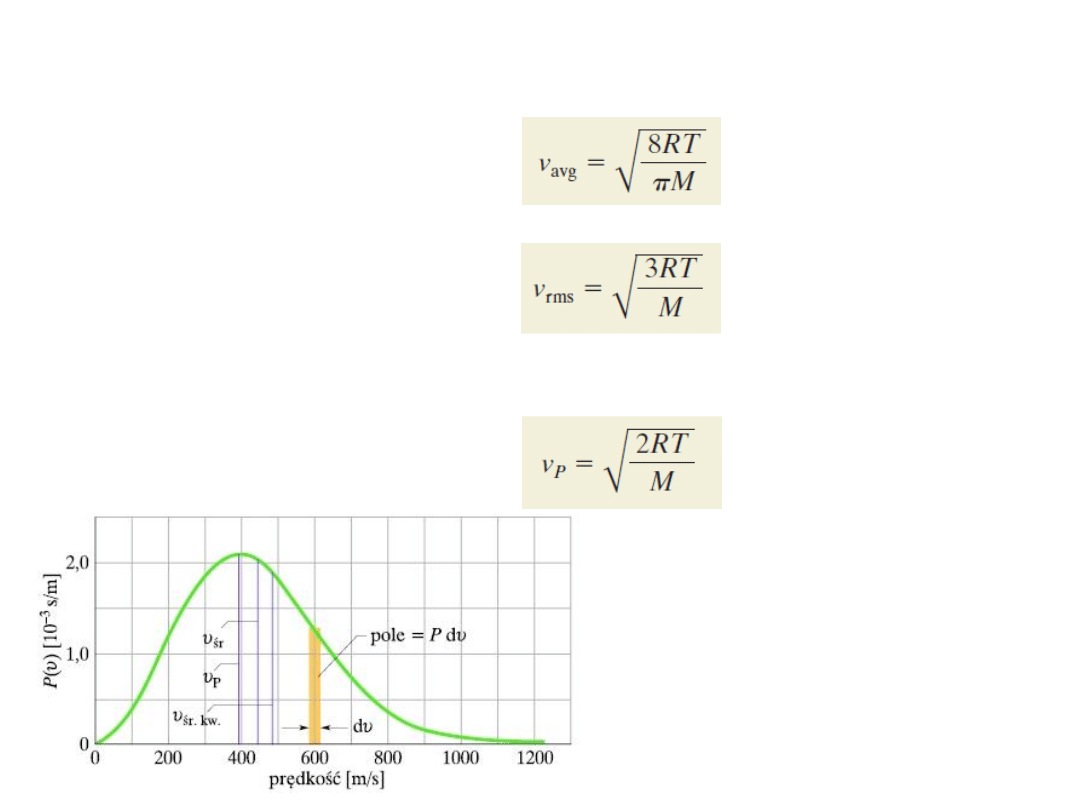
9. Prędkość średnia, prędkość średnia kwadratowa
i prędkość najbardziej prawdopodobna
Prędkość średnia v
avg
cząsteczek gazu:
Prędkość średnia kwadratowa v
rms
:
Prędkość najbardziej prawdopodobna v
P
(prędkość, dla której funkcja rozkładu P(v)
osiąga maksimum:

Example, Speed Distribution in a Gas:
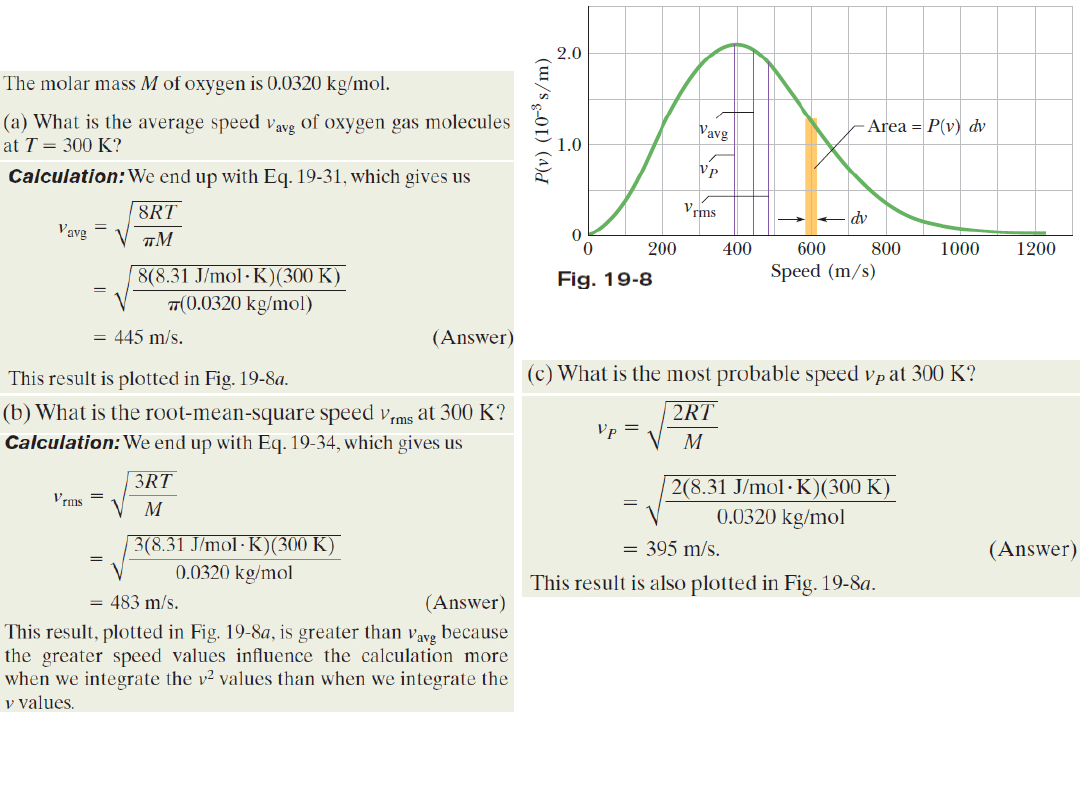
Example, Different Speeds
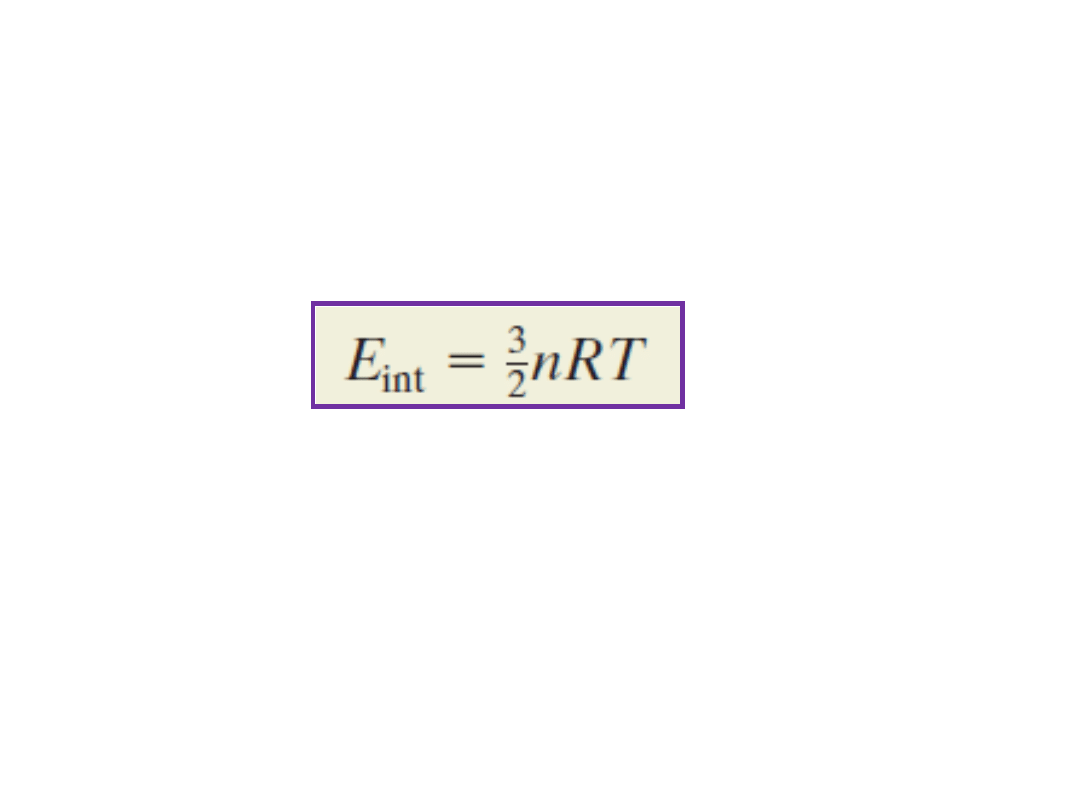
10. Molowe ciepła właściwe gazu doskonałego
Energia wewnętrzna E
int
gazu doskonałego zależy tylko
od temperatury gazu; nie zależy od żadnej innej wielkości
opisującej jego stan:
(jednoatomowy gaz doskonały)
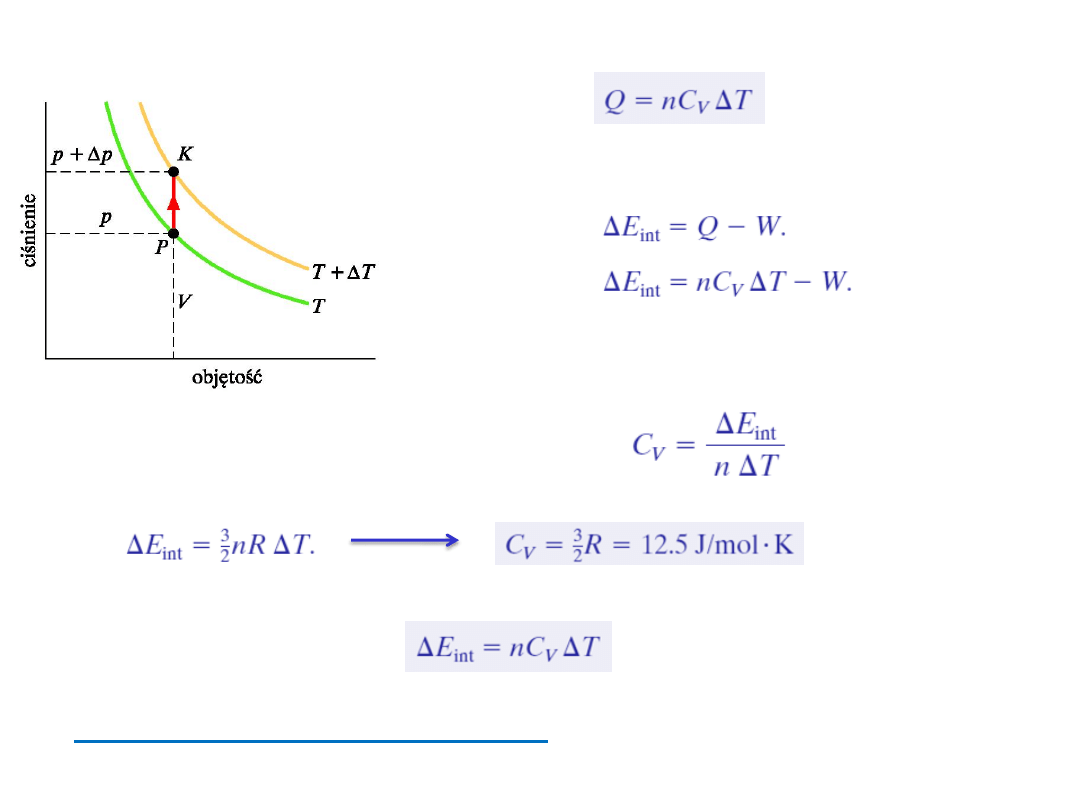
11. Molowe ciepło właściwe przy stałym ciśnieniu
C
V
– molowe ciepło właściwe gazu przy stałej objętości.
Ale
Stąd:
Przy zachowaniu stałej objętości gaz nie może się rozprężać
i dlatego nie wykonuje on pracy (W=0 ). Stąd:
Jeśli gaz doskonały zamknięty w zbiorniku podlega zmianie temperatury
D
T, zmienia
się jego energia wewnętrzna:
Zmiana energii wewnętrznej E
int
gazu doskonałego zamkniętego w zbiorniku
zależy tylko od zmiany temperatury gazu, nie zależy od typu procesu, w wyniku
którego nastąpiła zmiana temperatury.
(stała objętość)
(gaz jednoatomowy)
(gaz doskonały, dowolny proces)
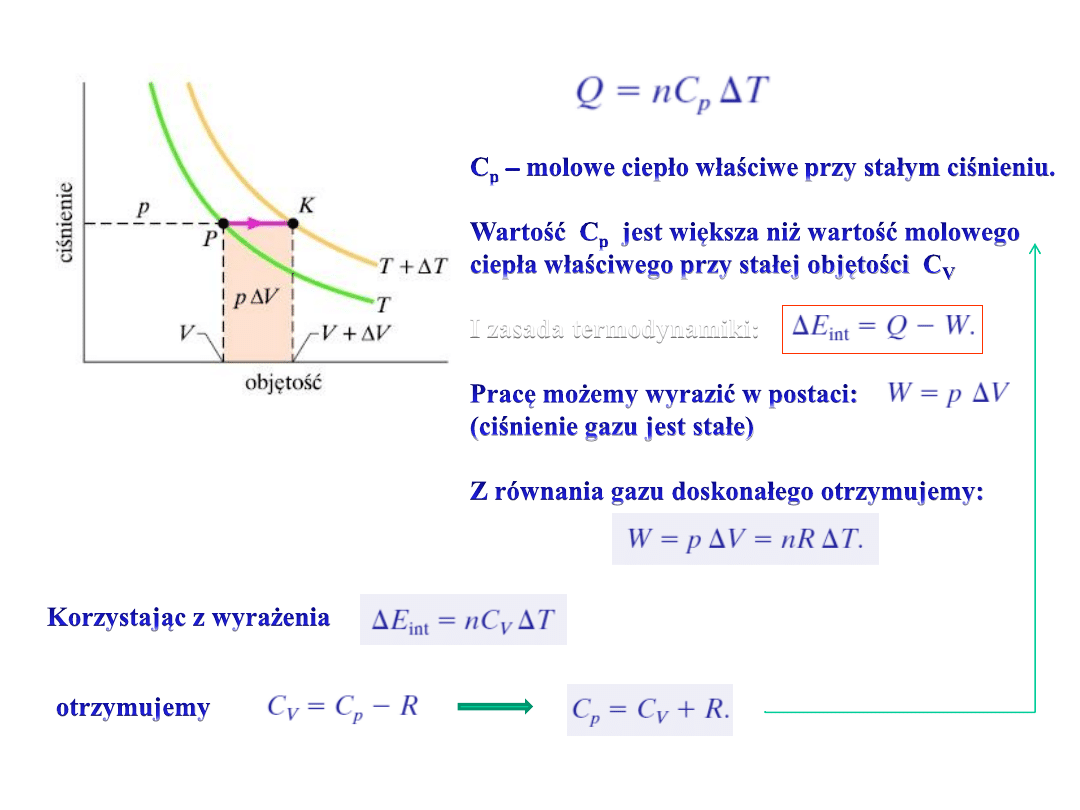
12. Molowe ciepło właściwe przy stałym ciśnieniu
I zasada termodynamiki:
(stałe ciśnienie)
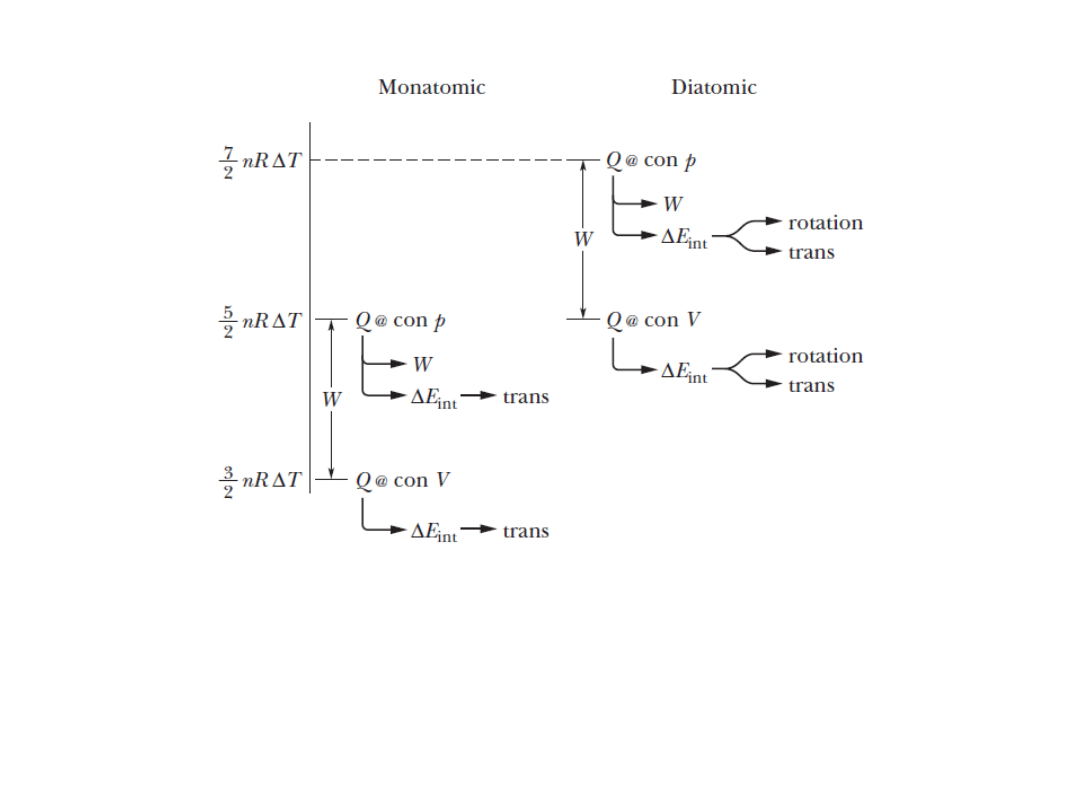
19.8: Molar Specific Heats
Fig. 19-12 The relative values of Q for a monatomic gas (left side) and a diatomic
gas undergoing a constant-volume process (labeled “con V”) and a constant-
pressure process (labeled “con p”). The transfer of the energy into work W and
internal energy (E
int
) is noted.

Example, Monatomic Gas:
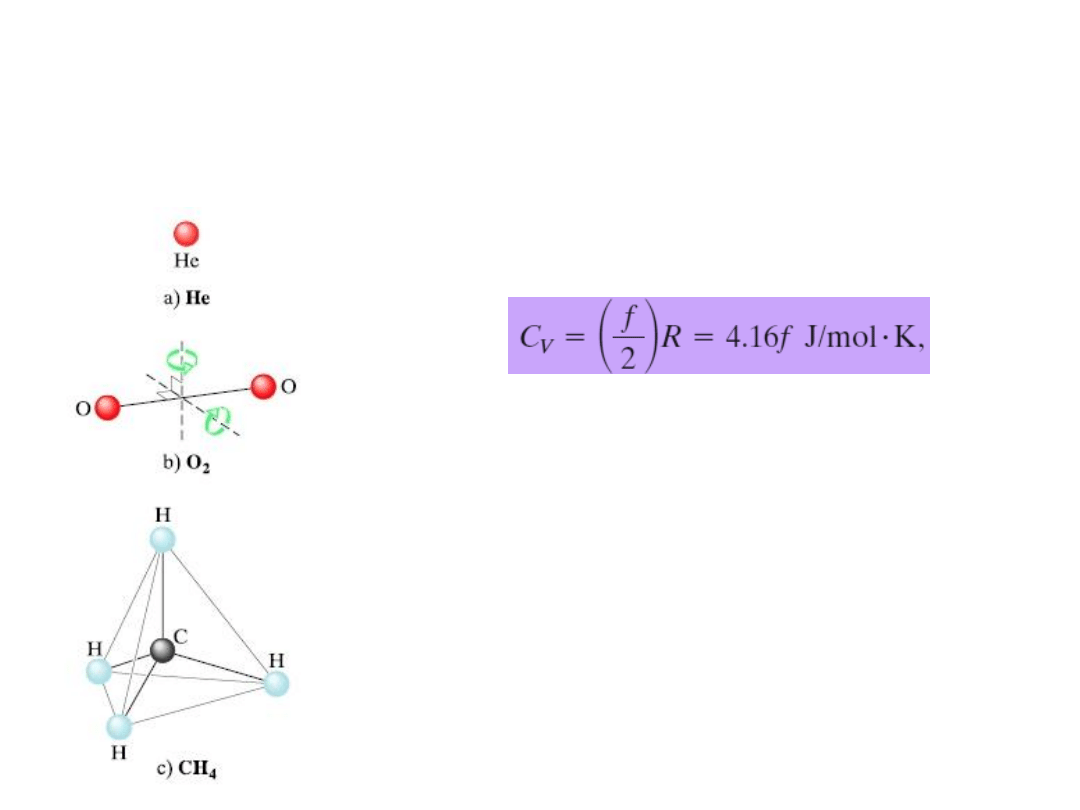
13. Stopnie swobody a molowe ciepła właściwe
Każdy rodzaj cząsteczek charakteryzuje pewna liczba stopni
swobody f, które dają cząsteczce niezależne sposoby
przechowywania energii.
Na każdy stopień swobody przypada – średnio – energia równa
½ kT na cząsteczkę (lub ½ RT na mol).
Rys. 20.11. Modele cząsteczek występujących w teorii kinetycznej:
a)
Hel – przykład cząsteczki jednoatomowej,
b) Tlen – przykład cząsteczki dwuatomowej,
c)
Metan – przykład cząsteczki wieloatomowej.
Kule oznaczają atomy, a linie – wiązania.
Dla cząsteczki tlenu zaznaczono dwie osie obrotu.
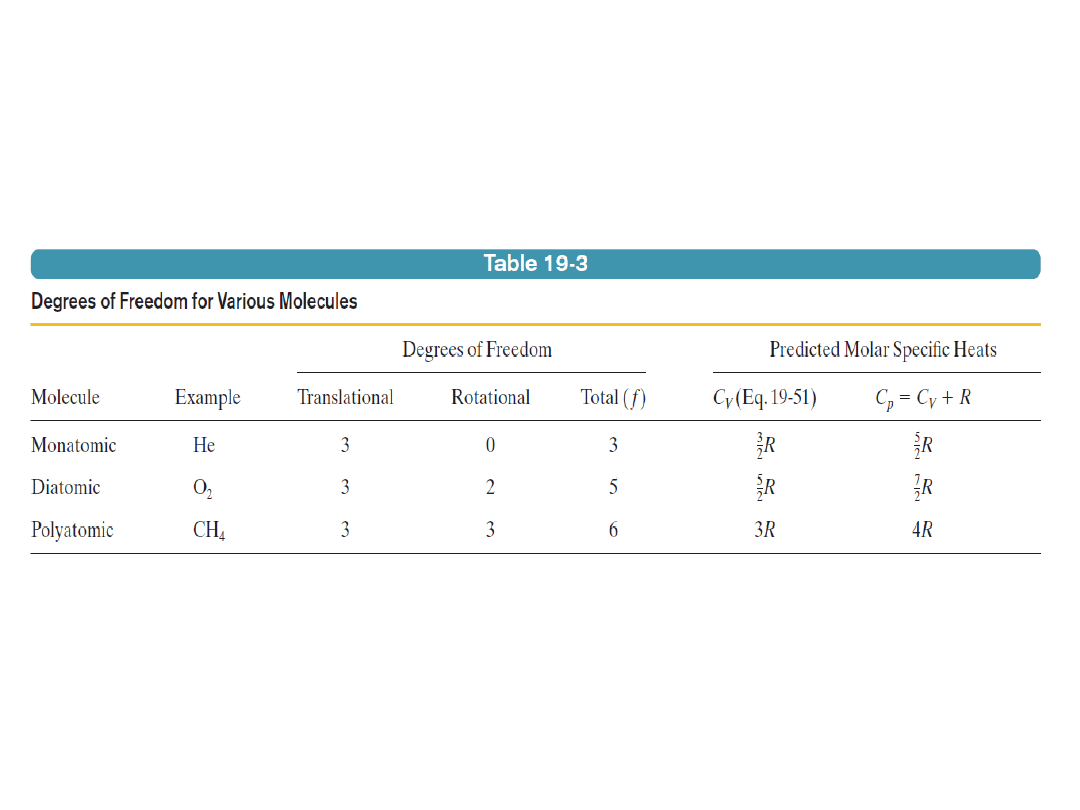
13. Stopnie swobody a molowe ciepła właściwe

Example, Diatomic Gas:
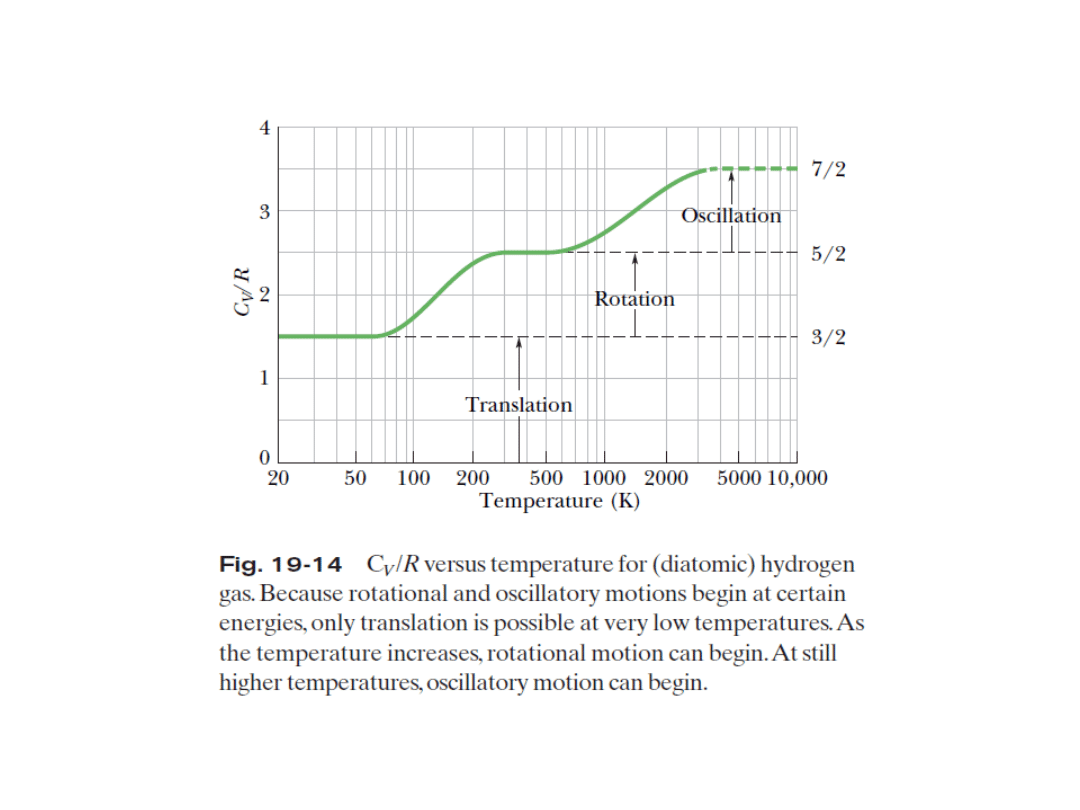
19.10: A Hint of Quantum Theory

I zasada termodynamiki:
Ponieważ Q=0 (rozprężanie adiabatyczne),
korzystając ze wzoru na E
int
, otrzymujemy:
Różniczkując równanie stanu gazu doskonałego
Ponieważ C
P
–
C
V
= R, więc
Korzystając z powyższych równań otrzymujemy:
Zastępująć
g
= C
P
/C
V
i całkując powyższe równanie otrzymujemy:
Ostatecznie:
14. Rozprężania adiabatyczne gazu doskonałego
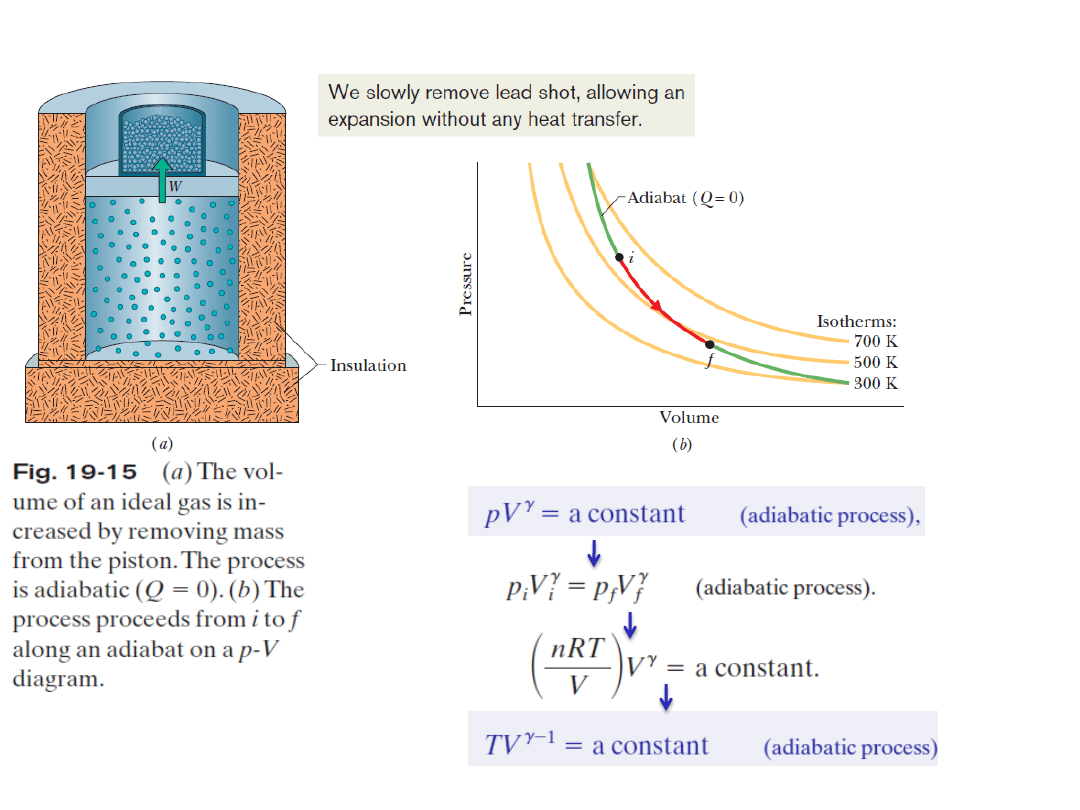
14. Rozprężania adiabatyczne gazu doskonałego

15. Rozprężanie adiabatyczne gazu doskonałego, rozprężanie swobodne
Rozprężanie swobodne – przemiana adiabatyczna, w której gaz nie wykonuje żadnej
pracy, ani żadna praca nie jest wykonywana nad gazem – nie zmienia się energia
wewnętrzna gazu. Rozprężanie swobodne jest więc całkowicie odmiennym procesem
niż przemiana adiabatyczna, w której gaz wykonuje pracę, a więc zmienia swoją
energię wewnętrzną.
W trakcie rozprężania swobodnego gaz znajduje się w równowadze termodynamicznej
tylko w stanie początkowym i końcowym – na wykresie możemy więc przedstawić
tylko te dwa punkty, ale nie możemy wykreślić łączącej ich linii.
Ponieważ E
int
=0, temperatura w stanie końcowym musi być równa temperaturze w
stanie początkowym. Dlatego na wykresie stan początkowy i końcowy muszą
znajdować się na tej samej izotermie oraz
Zatem dla gazu doskonałego:
(rozprężanie swobodne)
(rozprężanie swobodne)

Example, Adiabatic Expansion:

Four Gas Processes for an Ideal Gas
Wyszukiwarka
Podobne podstrony:
17 kinetyczna teoria gazów i termodynamika II
Sprawozdania, KINETYCZNA TEORIA GAZÓW, KINETYCZNA TEORIA GAZÓW
Kinetyczna teoria gazów i termodynamika I
CHEM-G~2, Podstawowym dzia˙aniem ga˙niczym gaz˙w jest st˙˙enie tlenu
CHEM-G~2, Podstawowym dzia˙aniem ga˙niczym gaz˙w jest st˙˙enie tlenu
16 kinetyczna teoria gazów i termodynamika I
20 Big Dance - Gaz gaz, kwitki, kwitki - poziome
11, 11-teoria, Gaz doskonały to model, słuszny w pełni jedynie dla bardzo rozrzedzonych gazów (wzros
Kinetyczna teoria gazów 2
Ciepło- Kinetyczno–molekularna teoria budowy ciała, Sprawozdania - Fizyka
Kinetyczna teoria gazów i termodynamika II
zestaw 13 kinetyczna teoria gazów, SEMESTR I, MECHANIKA I FIZYKA STATYSTYCZNA, zadania
Kinetyczna teoria gazów
SPAWNI~1, Spawanie w os?onie gaz?w ochronnych
17 kinetyczna teoria gazów
10 Kinetyczna teoria gazow (2)
więcej podobnych podstron