
Fenole
- 1 -
Fenolami
nazywane
są
areny
zawierające
grupę
hydroksylową -OH związaną bezpośrednio z pierścieniem
aromatycznym. Do fenoli nie są zaliczane areny zawierające
grupę -OH związaną z atomem węgla w łańcuchu bocznym,
te związki noszą nazwę alkoholi aromatycznych, ich
reprezentantem jest alkohol benzylowy. Fenol jest bezbarwną substancją krystaliczną, szybko jednak zmienia
kolor pod wpływem pojawiających się produktów utlenienia, początkowo różowy staje się ciemno-brunatny. Jest
higroskopijny. W zimnej wodzie rozpuszcza się umiarkowanie, ale wraz ze wzrostem temperatury jego
rozpuszczalność szybko rośnie i powyżej 65
o
C miesza się z wodą w każdym stosunku. W etanolu, eterze czy
benzenie rozpuszcza się w każdej ilości tych rozpuszczalników. Jego roztwory, nawet rozcieńczone stają się
czerwonofioletowe w obecności FeCl
3
. Jest to reakcja charakterystyczna dla fenoli.
Fenol należy do bardzo toksycznych związków, na skórze po kontakcie z fenolem tworzą się trudno gojące
pęcherze. Ma właściwości bakteriobójcze i przez długi okres czas był stosowany jako popularny środek
dezynfekujący. Obecnie nowoczesne, bardziej skuteczne preparaty, które są mniej niebezpieczne i nie tak
cuchnące jak fenol całkowicie go wyparły z tej roli. Pochodne fenolu, krezole mają silniejsze działanie
bakteriobójcze i też były stosowane jako środki dezynfekujące (lizol).
Reakcje fenolu
Fenole w przeciwieństwie do alkoholi ulegają w wodzie dysocjacji elektrolitycznej z
odszczepieniem jonu H
+
, co oznacza, że fenole są mocniejszymi kwasami niż alkohole.
Są to jednak nadal słabe kwasy, ponieważ tylko niewielki procent ich cząsteczek
dysocjuje na jony, a reszta zostaje w roztworze w postaci niezdysocjowanej.
Fenole mają właściwości kwasowe, więc reagują z zasadami. W wyniku reakcji wodorotlenków z fenolem
powstają sole – fenolany np.:
Fenole to słabe kwasy. Kwas węglowy wypiera fenol z jego soli, co świadczy o tym, że fenol jest słabszym
kwasem niż kwas węglowy.
Fenole, podobnie jak alkohole, ulegają reakcji z niektórymi metalami, np. z sodem:
Fenole, w przeciwieństwie do alkoholi, nie ulegają reakcji z fluorowcowodorami, w której następowało
podstawienie grupy hydroksylowej w alkoholu atomem fluorowca:
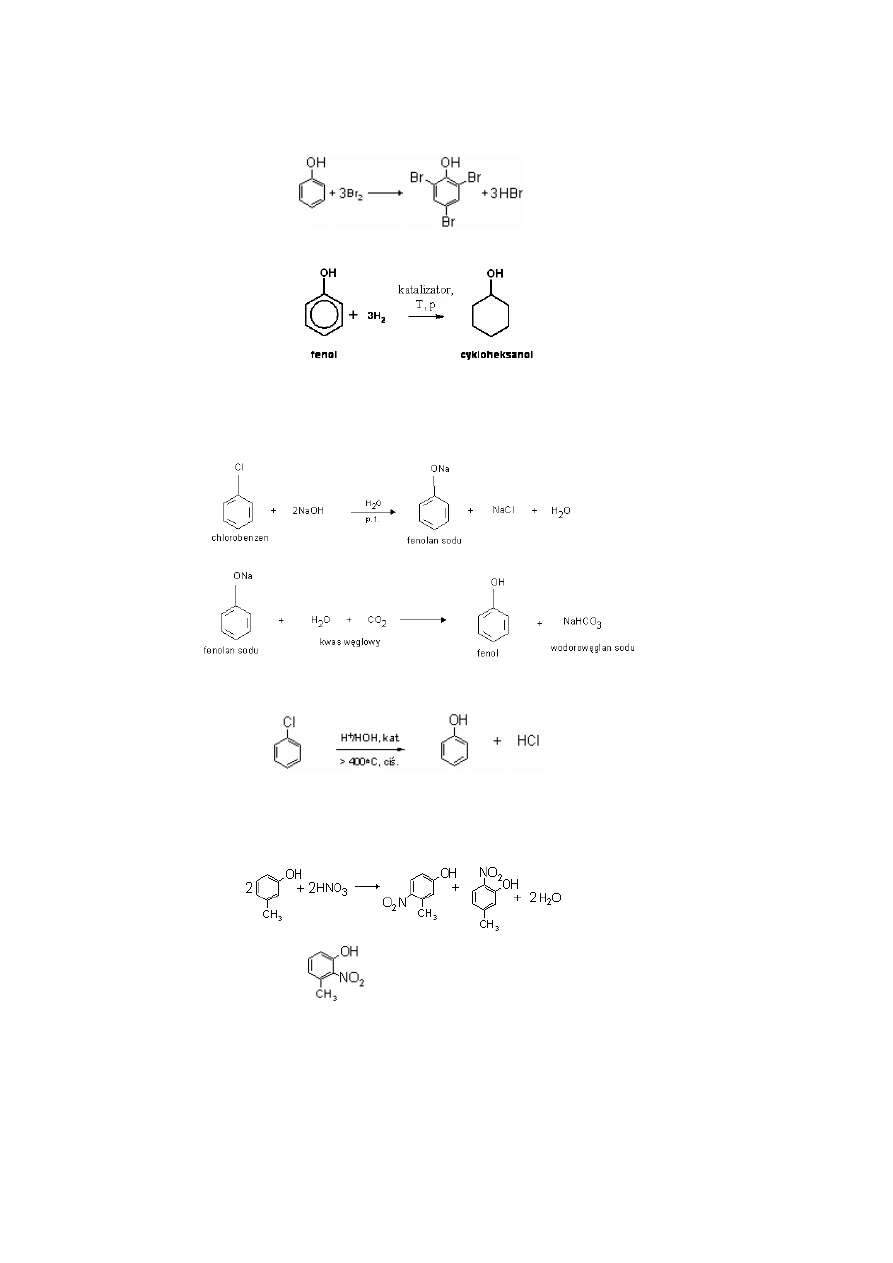
Fenol reaguje już z rozcieńczonym kwasem azotowym(V) tworząc mieszaninę o-nitrofenolu i p-nitrofenolu.
Reakcja ta nie wymaga użycia katalizatora – stężonego kwasu siarkowego(VI) – jak w przypadku benzenu:
Intensywne nitrowanie fenolu za pomocą stężonego roztworu kwasu azotowego(V) prowadzi do powstania
2,4,6 – trinitrofenolu (kwasu pikrynowego):
Fenole
- 2 -
Znacznie łatwiej niż dla benzenu, bez użycia katalizatora, zachodzi również reakcja bromowania pierścienia
aromatycznego. Przebiega ona bardzo szybko i prowadzi do powstania 2,4,6 - tribromofenolu. Reakcja ta służy
do analizy ilościowej fenolu:
W obecności katalizatora i pod wysokim ciśnieniem fenole można uwodornić do związków cykloalifatycznych:
Otrzymywanie fenolu
1) hydroliza halogenków arylowych zachodząca w bardzo ostrych warunkach
(ogrzewanie ze stężonym roztworem NaOH w temperaturze ponad 370 °C i pod ciśnieniem) a następnie
wypieranie fenolu kwasem węglowym:
2) Jedna ze współczesnych metod produkcji fenolu polega na hydrolizie chlorobenzenu w środowisku kwaśnym:
3) destylacja smoły węglowej.
Pochodne fenolu
Pochodnymi fenolu są np. krezole. Reakcja nitrowania m-krezolu zachodzi zgodnie z równaniem reakcji:
Trzeci z produktów o wzorze:
Powstaje w mniejszej ilości, głównie ze względów przestrzennych – grupie NO
2
trudno się dostać w to miejsce
gdyż jest ono zasłaniane przez inne grupy.
Wyszukiwarka
Podobne podstrony:
otrzymywanie-i-reakcje-fenolu
otrzymywanie i reakcje alkenow i alkinow
otrzymywanie i reakcje kwasow karboksylowych
Chemia organiczna Tabela otrzymywania i reakcji związków od alkanów do amidów
otrzymywanie-i-reakcje-weglowodorow-aromatycznych
otrzymywanie-i-reakcje-aldehydow i ketonow
otrzymywanie-i-reakcje-kwasow karboksylowych
otrzymywanie i reakcje aldehydow i ketonow
otrzymywanie i reakcje weglowodorow aromatycznych
otrzymywanie i reakcje alkenow i alkinow
otrzymywanie i reakcje alkoholi
otrzymywanie i reakcje alkanow
REAKCJE GRUPOWE I OTRZYMYWANIE POCHODNYCH
więcej podobnych podstron