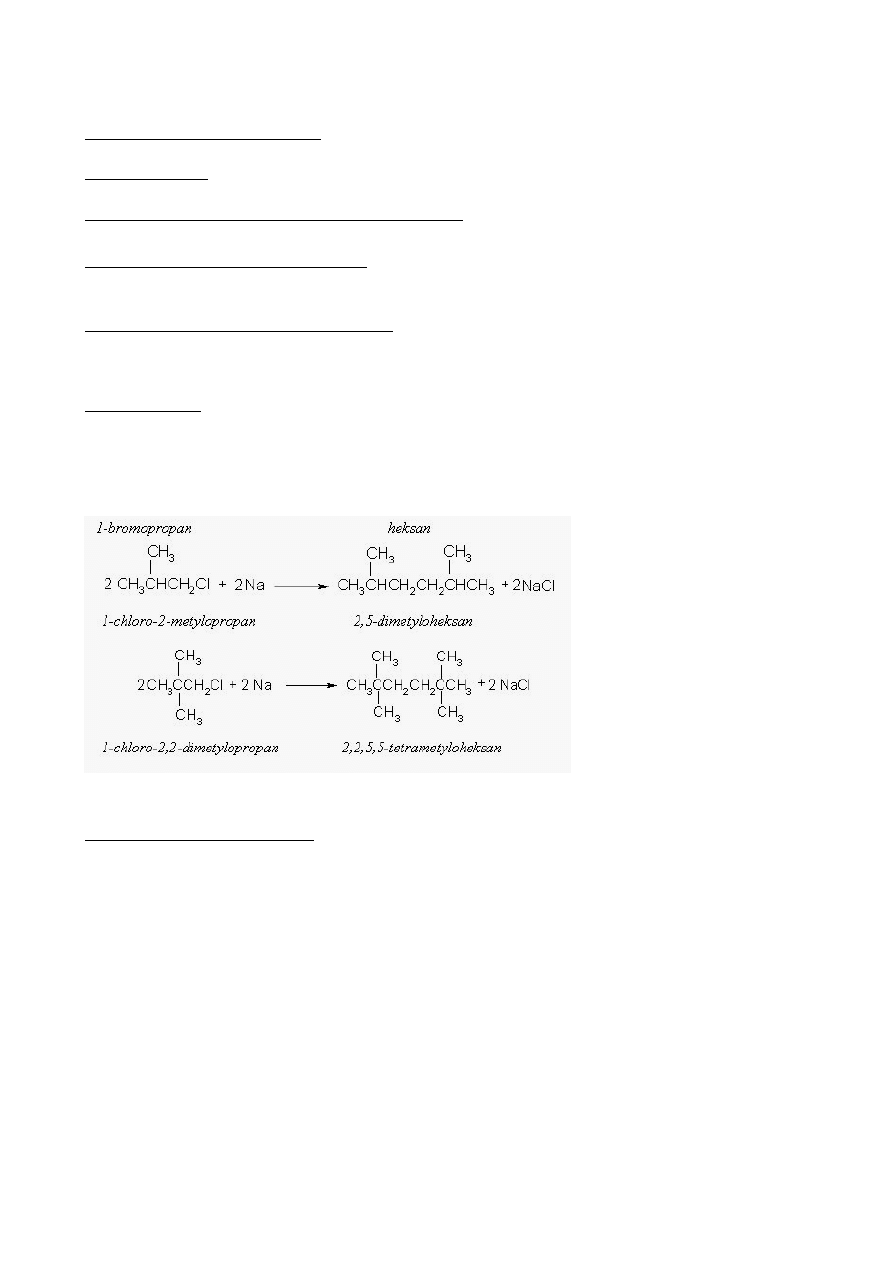
Otrzymywanie i reakcje alkanów
- 1 -
Otrzymywanie metanu:
- bezpośrednia synteza z pierwiastków:
C + 2H
2
CH
4
reakcja ta zachodzi w temperaturze ok. 500 stopni Celsjusza
- gazu syntezowego:
CO + 3H
2
CH
4
+ H
2
O
- ogrzewanie mieszaniny octanu sodu z wodorotlenkiem sodu :
CH
3
COONa + NaOH
→
stapianie
CH
4
+ Na
2
CO
3
- reakcja węglika glinu z kwasem (np.solnym):
Al
4
C
3
+ 12HCl
4AlCl
3
+ 3CH
4
Otrzymywanie alkanów:
- uwodornienie węglowodorów nienasyconych np.:
CH
2
=CH
2
+ H
2
CH
3
-CH
3
CH
≡
CH + 2H
2
CH
3
-CH
3
katalizatorami w powyższych reakcjach są najczęściej: Pt, Pd, Ni.
- w reakcji Würtza:
R
1
X + Na + XR
1
R
1
-R
1
+ 2NaX
reakcja ogólna
2 CH
3
-CH
2
Cl + 2Na
2NaCl + CH
3
-CH
2
-CH
2
-CH
3
Jeżeli użyjemy różnych monochloropochodnych, otrzymamy mieszaninę produktów np.:
3 CH
3
-CH
2
-CH
2
Cl + 3 CH
3
Cl + 6 Na
CH
3
-CH
2
-CH
2
-CH
2
-CH
2
-CH
3
+ CH
3
-CH
3
+ CH
3
-CH
2
-CH
2
-CH
3
+ 6NaCl
3 CH
3
-CHCl-CH
3
+ 3 CH
3
Cl + 6 Na
CH
3
-CH(CH
3
)-CH
3
+ CH
3
-CH
3
+ CH
3
-CH(CH
3
)-CH(CH
3
)-CH
3
+ 6NaCl
Reakcje chemiczne alkanów:
- halogenowanie (reakcja substytucji):
R-H + X
2
→
ś
wiatło
R-X + H-X
reakcja ogólna
CH
4
+ Cl
2
→
ś
wiatło
CH
3
Cl + HCl
chlorometan
CH
3
Cl + Cl
2
→
ś
wiatło
CH
2
Cl
2
+ HCl
dichlorometan
CH
2
Cl
2
+ Cl
2
→
ś
wiatło
CHCl
3
+ HCl
trichlorometan
CHCl
3
+ Cl
2
→
ś
wiatło
CCl
4
+ HCl
tetrachlorometan
Powyższe reakcje nazywa się następczymi (produkt jednej reakcji jest substratem kolejnej reakcji).
Powyższe reakcje nie są mechanizmem reakcji, mechanizm reakcji chlorowania alkanów jest opisany w rozdziale 2.1.5.

Otrzymywanie i reakcje alkanów
- 2 -
- reakcje dłuższych alkanów:
2CH
3
-CH
2
-CH
2
-CH
3
+ Cl
2
→
ś
wiatło
CH
3
-CHCl-CH
2
-CH
3
+ CH
3
-CH
2
-CH
2
-CH
2
Cl + 2HCl
produkt główny
produkt uboczny
Reakcje obok przedstawione
są za pomocą schematu.
- spalanie:
-całkowite:
2C
2
H
6
+ 7O
2
4CO
2
+ 6H
2
O
-niecałkowite:
2C
2
H
6
+ 5O
2
4CO + 6H
2
O
2C
2
H
6
+ 3O
2
4C + 6H
2
O
Wyszukiwarka
Podobne podstrony:
Chemia organiczna Tabela otrzymywania i reakcji związków od alkanów do amidów
otrzymywanie i reakcje alkenow i alkinow
otrzymywanie i reakcje kwasow karboksylowych
otrzymywanie-i-reakcje-weglowodorow-aromatycznych
otrzymywanie-i-reakcje-fenolu
otrzymywanie-i-reakcje-aldehydow i ketonow
otrzymywanie-i-reakcje-kwasow karboksylowych
otrzymywanie i reakcje aldehydow i ketonow
otrzymywanie i reakcje fenolu
otrzymywanie i reakcje weglowodorow aromatycznych
otrzymywanie i reakcje alkoholi
REAKCJE GRUPOWE I OTRZYMYWANIE POCHODNYCH
więcej podobnych podstron