
Zagadnienia
Podstawy technologii chemicznej
Semestr letni 2011/2012

1. Bilans materiałowy układów bez reakcji chemicznej i z reakcją chemiczną, obliczenia
2. Stopień przemiany w stechiometrycznej i niestechiometrycznej mieszaninie reagentów

BILANS MATERIAŁOWY
[Masowe natężenie przepływu strumieni
dopływających] – [Masowe natężenie przepływu
strumieni odpływających] = [szybkość akumulacji
wewnątrz aparatu]

BILANS MATERIAŁOWY –
podstawa obliczeń w technologii chemicznej
przy braku akumulacji masy wewnątrz aparatu
(STAN USTALONY):
ΣF
i zasil.
= ΣF
i prod.
[masowe natężenie przepływu strumieni
dopływających]
= [masowe natężenie przepływu
strumieni odpływających]

3. Bilans energetyczny:
-
Zasada zachowania energii
-
Składowe energii układów
-
Obliczanie pracy sprężania i ekspansji gazów
-
Entalpia: obliczanie zmian entalpii, pojemność cieplna
-
Entalpia reakcji: obliczanie zmian entalpii w stanie standardowym i
w temperaturze innej niż standardowa
Praca jest dodatnia, gdy tłok jest naszym układem
termodynamicznym.
Jeśli naszym układem będzie gaz, to praca dostarczona temu
układowi będzie ujemna.
Wtedy;
∫
⋅
−
=
2
1
v
v
v
dv
p
W
Z powyższych rozważań wynika, że znak pracy zależy od
wyboru układu termodynamicznego.
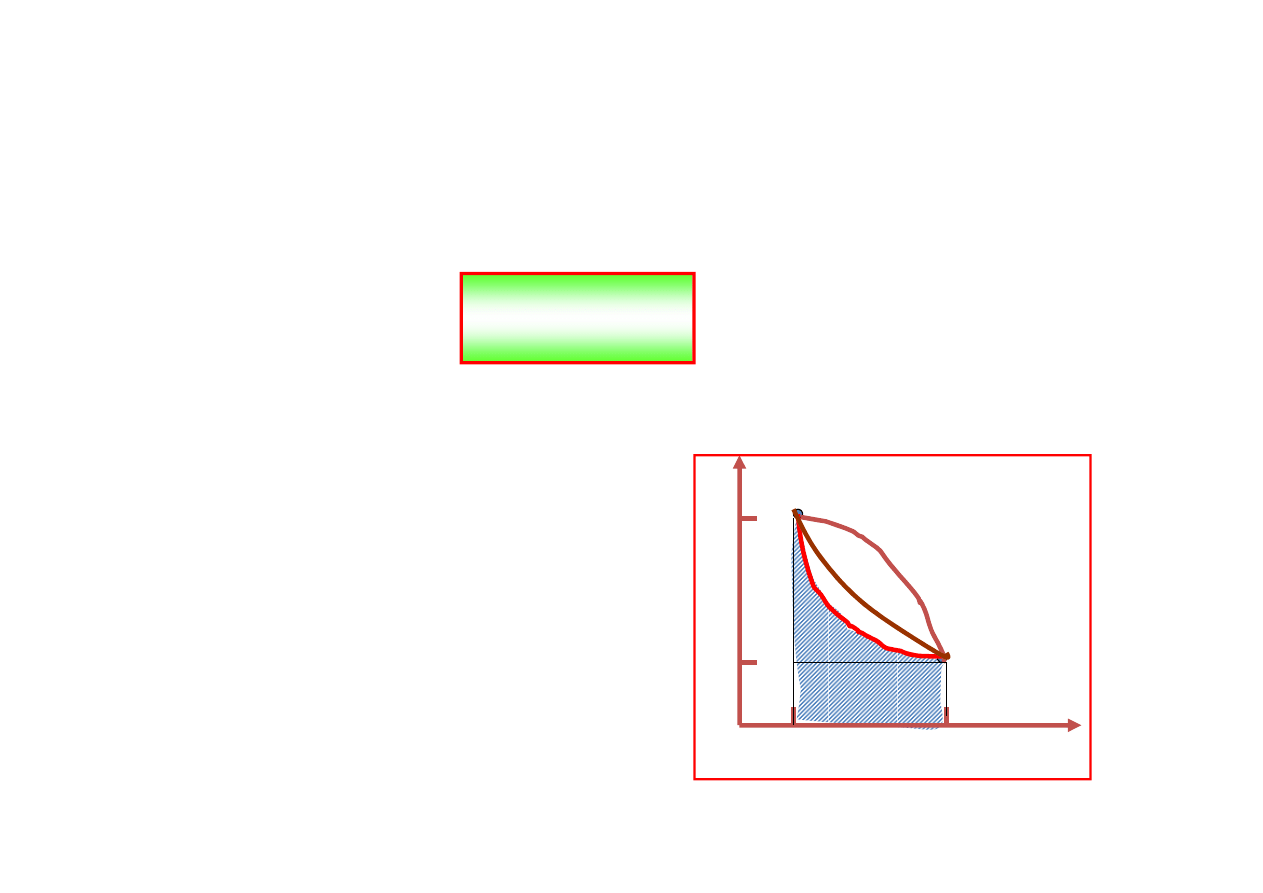
Graficzne przedstawienie pracy
wykonanej przez rozprężający
się gaz jest pokazane obok.
Drogi od punktu 1 do punktu 2
mogą być różne (
różne
przemiany gazowe
)
1
2
V
1
V
2
p
V
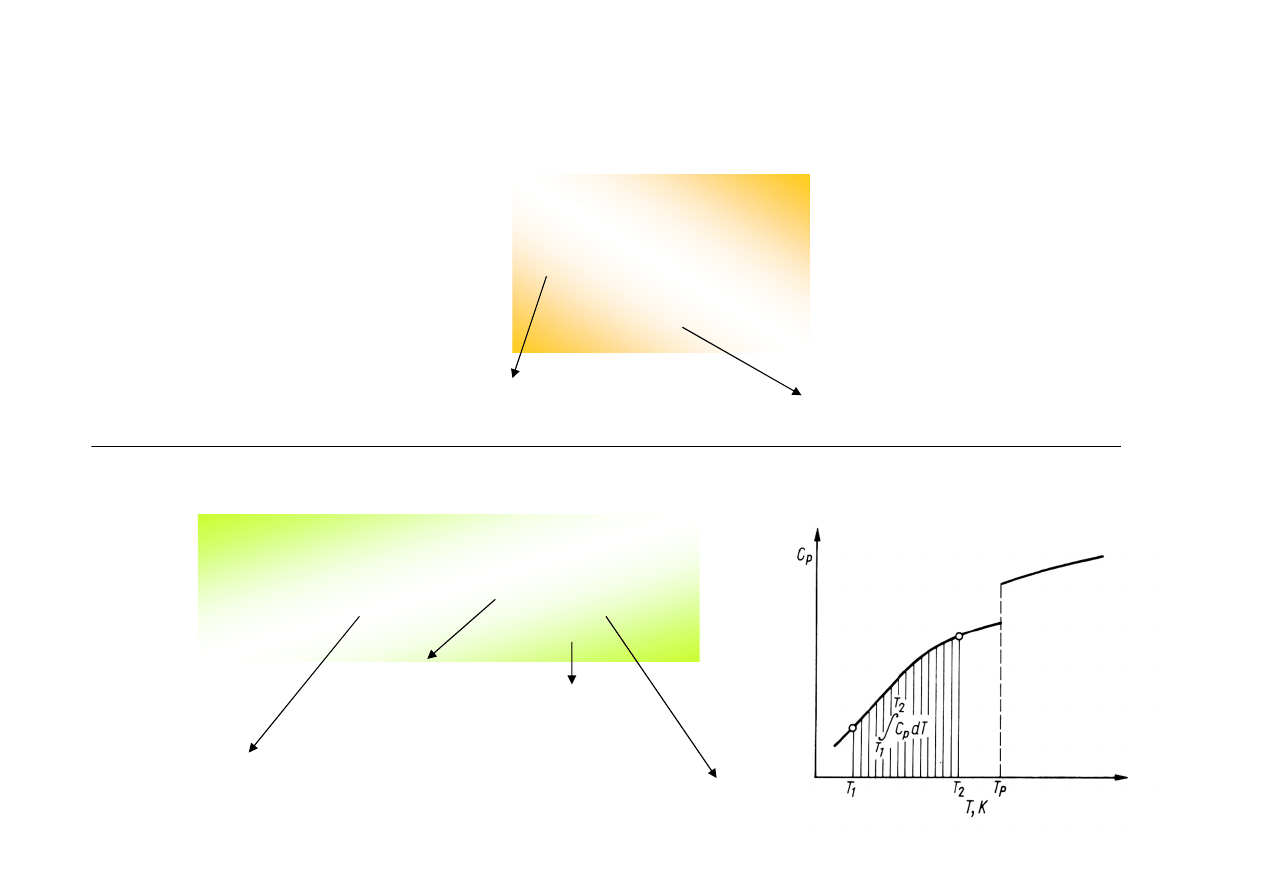
OBLICZANIE ZMIAN ENTALPII
∫
=
−
2
1
1
2
T
T
p
dT
c
H
H
∫
=
T
T
p
T
o
dT
c
H
entalpia molowa
w temperaturze T
temperatura odniesienia
Obliczania entalpii
w przedziale temperatur,
w którym nie ma
przejścia fazowego
*
∫
∫
+
+
=
T
T
p
T
T
f
p
T
f
f
o
dT
c
H
dT
c
H
2
1
Jeżeli w rozważanym zakresie temperatur występuje przemiana fazowa:
temperatura
przejścia fazowego
pojemność cieplna
w fazie 1
pojemność cieplna
w fazie 2
entalpia
przemiany
fazowej
**

Sposób obliczania entalpii reakcji w temperaturze innej niż 298 K
Przyjmujemy, że równanie stechiometryczne reakcji można opisać równaniem:
0 = –
νννν
A
A –
νννν
B
B +
νννν
C
C +
νννν
D
D
w którym A i B są substratami, a C i D – produktami reakcji

Wyrażenia oznaczające zależność molowej pojemności cieplnej od
temperatury mają znaną już postać szeregu potęgowego.
3
2
T
d
T
c
T
b
a
c
i
i
i
i
pi
+
+
+
=
o
dla wszystkich
czterech reagentów!
Po uwzględnieniu współczynników stechiometrycznych reakcji otrzymamy udziały
poszczególnych reagentów:
(
)
3
2
,
T
d
T
c
T
b
a
c
A
A
A
A
A
A
p
A
+
+
+
=
ν
ν
o
(
)
3
2
,
T
d
T
c
T
b
a
c
B
B
B
B
B
B
p
B
+
+
+
=
ν
ν
o
(
)
3
2
,
T
d
T
c
T
b
a
c
C
C
C
C
C
C
p
C
+
+
+
=
ν
ν
o
(
)
3
2
,
T
d
T
c
T
b
a
c
D
D
D
D
D
D
p
D
+
+
+
=
ν
ν
o
Zdefiniujemy teraz wielkość
o
p
c
∆
jako:
∑
=
∆
i
i
,
p
i
p
c
c
o
o
ν
oraz zmiany współczynników:
∑
=
∆
i
i
i
a
a
ν
∑
=
∆
i
i
i
b
b
ν
∑
=
∆
i
i
i
c
c
ν
∑
=
∆
i
i
i
d
d
ν

Po podstawieniu otrzymujemy uproszczone wyrażenie przedstawiające
różnicę pojemności cieplnej produktów i substratów reakcji:
3
2
dT
cT
bT
α
c
p
∆
+
∆
+
∆
+
∆
=
∆
o
Jeżeli znamy standardową entalpię reakcji w jednej temperaturze, np. 298 K,
obliczyć standardową entalpię reakcji
o
T
r
H
,
∆
w innej temperaturze:
(
)
∫
∫
∆
+
∆
+
∆
+
∆
+
∆
=
∆
+
∆
=
∆
T
r
T
p
r
T
r
dT
dT
cT
bT
a
H
dT
c
H
H
298
3
2
298
,
298
298
,
,
o
o
o
o
Jeżeli w przedziale całkowania występują przemiany fazowe substratów lub produktów reakcji,
należy to uwzględnić.
Zakładając, że w temperaturze T
f
występuje przemiana fazowa któregoś z reagentów, wówczas:
∫
∫
∆
+
∆
+
∆
+
∆
=
∆
298
Τ
T
f
p
f
i
Τ
i
p
r
T
r
f
dT
c
H
dT
c
H
H
,
,
298
,
,
o
o
o
o
o
ν

4. Gaz doskonały
-
Właściwości
-
Równanie stanu
-
przemiany: adiabatyczna, politropowa, izotermiczna
-
Obliczanie pracy sprężania i rozprężania gazu doskonałego

PRZEMIANA POLITROPOWA
W urządzeniach przemysłowych sprężanie lub rozprężanie jest przemianą
politropową, opisaną wyrażeniem
const
=
n
PV
( )
( )
−
−
=
−
−
=
−
−
1
1
1
1
1
1
2
1
1
1
2
1
1
n
n
n
n
P
P
n
n
M
ZRT
P
P
n
n
V
ZP
W
Z jest współczynnikiem ściśliwości,
R – stałą gazową,
M – masą cząsteczkową gazu.
Wartość n zależy od rodzaju i sposobu pracy urządzenia

Zasada zachowania energii dla jednostki procesowej
w stanie ustalonym ma postać:
∑
∑
∑
=
+
+
∆
=
0
1
dt
dW
dt
dQ
H
F
i
i
N
i
i
i
s
strumień
wyrażony
w molach (kilomolach)
na jednostkę czasu
entalpia molowa
natężenie przepływu
ciepła przez granicę
jednostki procesowej
- od jednostki procesowej
do otoczenia
natężenie przepływu
energii w postaci pracy
+ praca wykonana
na jednostce procesowej

Właściwości substancji chemicznych:
-
Zasada stanów odpowiadających sobie
-
Wyznaczanie gęstości: metoda Watsona, metoda Bensona, w obszarze krytycznym
-
Lepkość, równanie Soundersa
-
Metoda inkrementów grupowych lub atomowych, na czym polega

METODA BENSONA
•
wzór empiryczny, umo
ż
liwia obliczenie g
ę
sto
ś
ci cieczy nasyconej
w temperaturze wrzenia
403
,
2
lg
4221
,
0
+
=
=
c
c
w
w
c
p
V
V
ρ
ρ
gdzie: V
w
– objętość molowa cieczy nasyconej (wrzącej)
ρ
w
– gestość cieczy w temperaturze wrzenia
p
c
–ciśnienie krytyczne, w MPa

LEPKOŚĆ CIECZY c.d.
Równanie empiryczne Soudersa:
(
)
9
2
log
log
,
M
I
−
10
⋅
=
−3
ρ
η
w którym
η
– lepkość, mPa·s,
ρ
– gęstość w danej temperaturze, kg/m3,
M – masa cząsteczkowa,
I – współczynnik Soudersa, obliczony addytywnie według tabeli inkrementów
grupowych.

Odchylenia od stanu doskonałego:
-współczynnik ściśliwości: definicja, zależność od ciśnienia i temperatury
-
właściwości gazów rzeczywistych-
-
Równanie stanu gazów rzeczywistych: Redlicha-Kwonga, wirialne
-
Współczynnik acentryczny, obliczanie współczynnika acentrycznego
-
Wyznaczanie objętości molowej gazów i cieczy na podstawie
współczynników ściśliwości
WSPÓŁCZYNNIK ŚCIŚLIWOŚCI
RT
PV
Z
=
Dla gazu idealnego: Z=1
Dla gazów rzeczywistych przedstawiany
w postaci tabelaryczne, graficznej
lub matematycznej jako funkcja T
r
, P
r

Równanie Redlicha–Kwonga
(
)
b
V
V
T
a
b
V
RT
P
,
+
−
−
=
5
0
c
,
c
P
T
R
,
a
5
2
2
42748
0
=
c
c
P
T
R
b
0867
,
0
=
Jest ono stosowane do wartości P
r
= 0,8

Równanie Redlicha–Kwonga c.d.
Postać wielomianowa:
0
)
(
2
2
3
=
−
−
−
+
−
AB
Z
B
B
A
Z
Z
Ma trzy rozwiązania względem Z.
Największą otrzymaną wartość Z przypisuje się fazie gazowej, najmniejszą – fazie ciekłej,
pośrednia zaś nie jest brana pod uwagę
5
2
5
2
2
42748
0
,
r
r
,
T
P
,
T
R
aP
A
=
=
r
r
T
P
,
RT
bP
B
08664
0
=
=

Współczynnik acentryczny
P
vp,r
jest zredukowanym ciśnieniem pary nasyconej wyznaczonym dla T
r
= 0,7.
Współczynnik acentryczny obliczono i stabelaryzowano dla kilkuset płynów
(
)
7
0
log
,
T
r
,
vp
r
P
=
+
1
−
=
ω
Współczynnik acentryczny w razie potrzeby można obliczyć ze wzoru:
1
3
,
101
log
1
−
−
7
3
=
c
br
br
P
T
T
ω
T
br
jest zredukowaną temperaturą
wrzenia,
P
c
– ciśnieniem krytycznym wyrażonym w
kPa.

Wirialne równanie stanu
( )
( )
K
+
+
+
=
2
1
V
T
C
V
T
B
Z
( )
( )
K
+
+
+
=
2
1
V
T
C
V
T
B
RT
PV

Wyznaczanie wielkości cząstkowych molowych mieszaniny
Lotność
-
lotność (aktywność ciśnieniowa)
-
Współczynnik lotności
-
reguła Lewisa-Randalla, wyznaczanie wartości współczynnika
aktywności ciśnieniowej składnika mieszaniny gazowej
-
Wyznaczanie aktywności ciśnieniowej na podstawie podanego
równania stanu
-
Metody UNIFAC i UNIQUAC
-
Równowaga fazowa, kryterium równowagi, opis równowagi ciecz-para
-
Mieszaniny gazów (płynów), sposób uśredniania współczynników w
równaniach stanu

LOTNOŚĆ GAZÓW I CIECZY
Znajomość lotności (aktywności ciśnieniowej) gazów i ich mieszanin jest
potrzebna do obliczania funkcji termodynamicznych, takich jak entalpia i
entropia w stanie nieidealnym oraz do wyznaczania równowag fazowych.
Dla czystych gazów lotność jest zdefiniowana następująco:
∫
=
P
VdP
RT
f
0
1
ln
*
W praktyce częściej oblicza się współczynnik lotności (fugatywności)
φ
,
który dla czystego gazu jest stosunkiem jego lotności do ciśnienia:
P
f
=
φ
LOTNOŚĆ GAZÓW I CIECZY c.d.
Dla składnika i w mieszaninie stosunkiem lotności tego składnika do jego
ciśnienia parcjalnego
P
y
f
i
i
i
=
φ

LOTNOŚĆ CIECZY
Lotność
składnika i w fazie ciekłej jest odniesiona do
zawartości tego składnika w cieczy (ułamka molowego) przez
następujące korelacje:
L
i
f
i
i
i
x
a
=
γ
oL
i
i
i
L
i
f
x
f
γ
=
w których:
a
i
oznacza aktywność składnika i,
γγγγ
i
jego współczynnik aktywności,
f
i
oL
jest lotnością składnika i w stanie standardowym w temperaturze mieszaniny dla
arbitralnie wybranego ciśnienia i składu.

RÓWNOWAGI FAZOWE
RÓWNOWAGA CIECZ-PARA
Kryterium równowagi termodynamicznej między fazą ciekłą a gazową w
mieszaninie wieloskładnikowej jest równość obowiązująca dla wszystkich
składników i tej mieszaniny:
L
i
v
i
f
f
=

RÓWNOWAGA CIECZ-PARA
Dla fazy gazowej możemy napisać:
dla fazy ciekłej zaś
P
y
f
i
v
i
i
=
φ
oL
i
i
i
L
i
f
x
f
γ
=
f oznacza lotność,
γ
– współczynnik aktywności,
indeksy v i L odnoszą się do pary (fazy gazowej) oraz cieczy,
f
i
oL
oznacza lotność składnika i w stanie standardowym,
x
i
jest ułamkiem molowym składnika i w fazie ciekłej,
y
i
– w fazie gazowej.

Współczynnik lotności
φφφφ
i
zależy od temperatury i ciśnienia, a w przypadku
mieszaniny
wieloskładnikowej
także
od
ułamków
molowych
innych
składników fazy parowej. Współczynnik lotności jest tak zdefiniowany, że gdy
P
→
0,
φ
i
→
1 dla wszystkich składników. Dlatego dla małych ciśnień często
przyjmuje się, że współczynnik lotności jest równy jedności.
RÓWNOWAGA CIECZ-PARA
Wyszukiwarka
Podobne podstrony:
2 Zagadnienia utrzymania czystości w procesach mikro i nanotechnologii [tryb zgodności]
I Wybrane zagadnienia Internetu SLAJDY [tryb zgodności]
2012 KU W5 tryb dzienny moodle tryb zgodnosci
(W7a Stale do kszta t na zimno cz I [tryb zgodno ci])
2 Sieci komputerowe 09 03 2013 [tryb zgodności]
Microsoft PowerPoint IP5 klasyfikacje tryb zgodnosci
Microsoft PowerPoint IP tryb zgodnosci
PA2 opis matematyczny [tryb zgodności]
ATMOSFERA [tryb zgodnosci]a id Nieznany
(Rachunkowosc podatkowa wyklad 4 5 [tryb zgodności])
Microsoft PowerPoint IP5 bazydanych tryb zgodnosci
OUN2009 [tryb zgodno
Bankowosc materialy 14 [tryb zgodnosci]
MikroI 9 [tryb zgodnosci]
(5 ja i samoocena (1 ) [tryb zgodności])id 1080
MT st w 06 [tryb zgodności]
cz 1c projektowanie systemow czasu rzeczywistego tryb zgodnosci
5 Planowanie w procesie zarzdzania [tryb zgodnoci]
Podstawy automatyki (w 5) elementy wykonawcze i pomiarowe ppt [tryb zgodnosci]
więcej podobnych podstron