
Termodynami
ka
teoria kinetyczno –
molekularna,
zasady termodynamiki
TERMODYNAMIKA
TERMODYNAMIKA
Kinetyczna teoria gazów
Kinetyczna teoria gazów
Problem: opis ruchu układów
wielocząsteczkowych
→
10
19
równań !
1 cm
3
około 10
19
cząsteczek
powietrza !
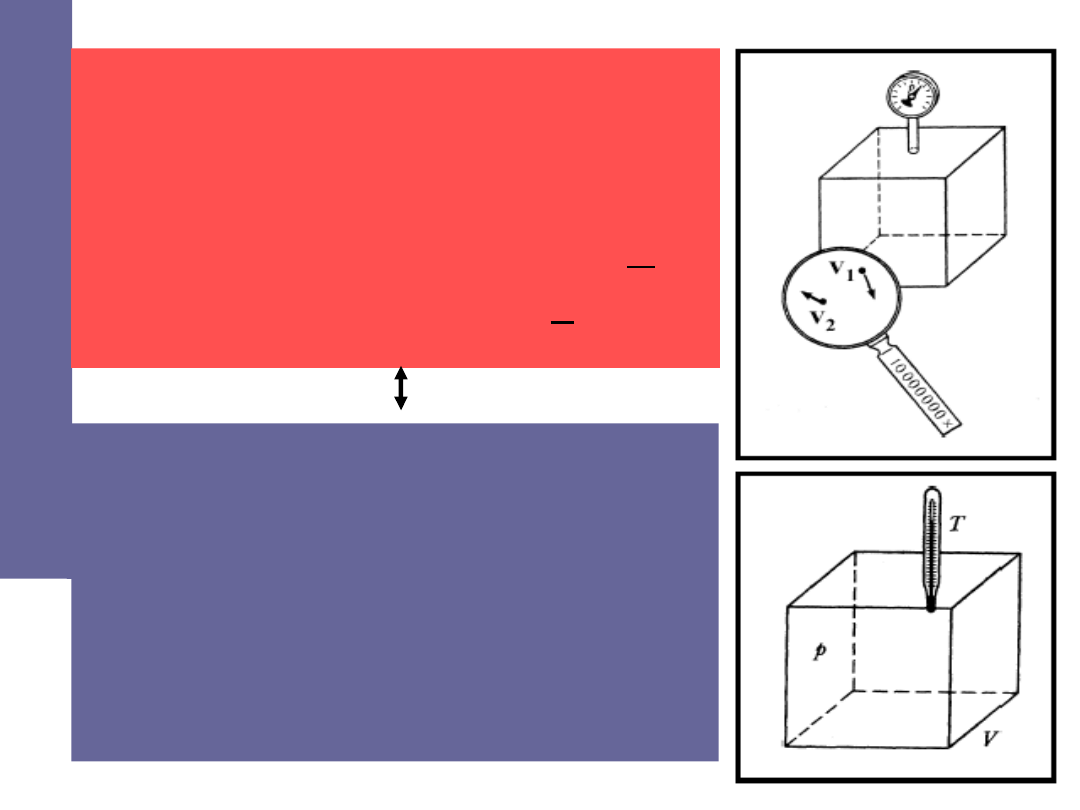
Opis makroskopowy
→
termodynamika
Parametry:
• temperatura
• ciśnienie
• objętość
Opis mikroskopowy
→
fizyka statystyczna
Parametry:
• masa cząsteczki
• średnia energia kinetyczna
• średnia prędkość
k
E
v
m
T
p
V
Prawo gazów
Prawo gazów
dos kona ych
ł
dos kona ych
ł
Gaz doskona
Gaz doskona
ł
ł
y
y
- założenia:
•
Objętość cząsteczek
gazu jest
o wiele mniejsza niż objętość
zajmowana przez gaz (cząsteczki gazu
– punkty materialne)
•
Zasięg sił
działających między
dwiema cząstkami jest
o wiele mniejszy niż średnia odległość
międzycząsteczkowa
(oddziaływania międzycząsteczkowe –
pomijane)
•
Zderzenia
cząsteczek są idealnie
sprężyste
Prawo gazów
Prawo gazów
dos kona ych
ł
dos kona ych
ł
Warunki normalne
Warunki normalne
- założenia:
K
C
T
dm
V
hPa
Pa
atm
p
o
15
,
273
0
415
,
22
1013
101325
1
0
3
0
0
=
=
=
=
=
=
Prawo Avogadra
Prawo Avogadra
Jednakowe objętości różnych gazów
znajdujących się pod tym samym
ciśnieniem i w tej samej temperaturze
zawierają jednakową liczbę cząsteczek.
3
0
23
415
,
22
1
6.023·10
dm
V
mol
N
A
=
=
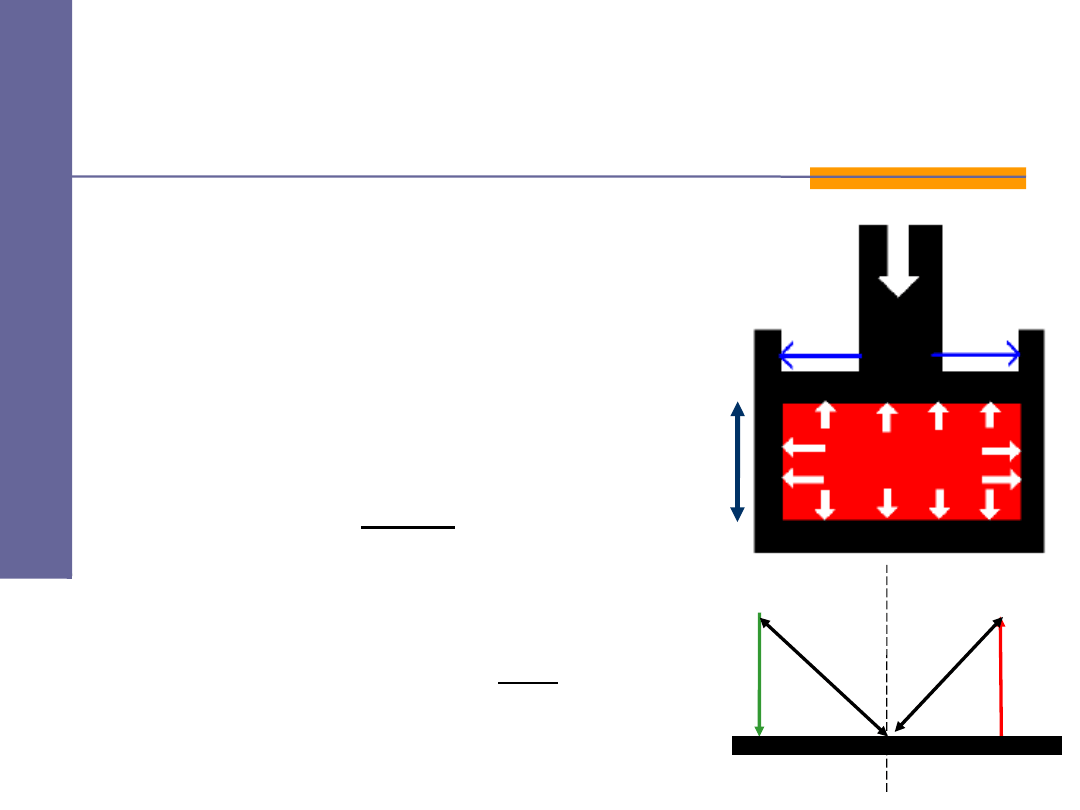
Ci
Ci
ś
ś
nieniem
nieniem
p
p
nazywamy wielkość
fizyczną liczbowo równą sile działającej
na powierzchnię ciała wzdłuż normalnej
do tej powierzchni:
Jednostka:
paskal
1
v
1
v
x
v
1
x
v
1
−
m
m
Ci nienie
ś
Ci nienie
ś
S
F
p
n
∆
=
2
m
N
Pa
=
ciśnienie
siła
powierzchnia
l
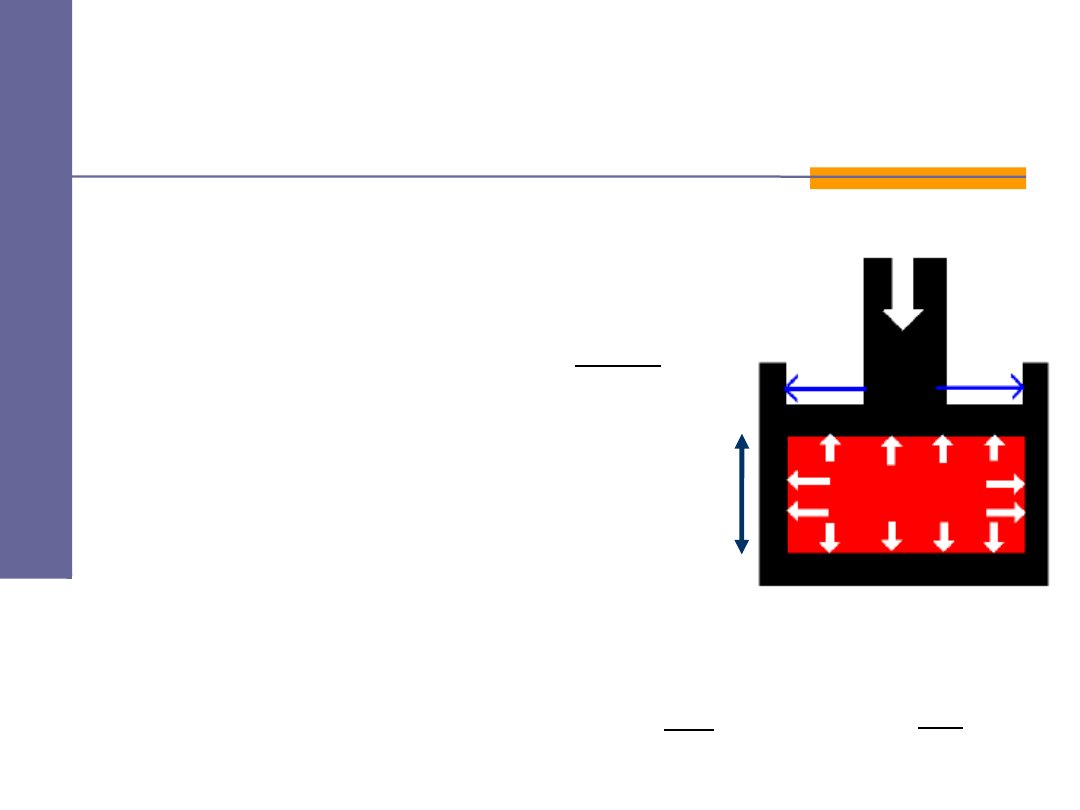
Średnia siła
jaką cząsteczka wywiera na ściankę
w czasie
∆
t wynosi:
t
p
F
x
n
∆
∆
=
⇒
Zmiana pędu
cząsteczki:
Czas
pomiędzy kolejnymi
zderzeniami z tą samą ścianką:
Ci nienie
ś
Ci nienie
ś
x
n
p
t
F
∆
=
∆
⋅
x
x
x
x
v
m
v
m
v
m
p
⋅
⋅
=
⋅
−
−
⋅
=
∆
2
)
(
x
v
l
t
2
=
∆
⇒
t
l
v
x
∆
=
2
ciśnienie
siła
powierzchnia
l
Całkowita siła działająca na ściankę od N cząsteczek:
l
m
N
F
x
n
2
v
=
gdzie jest to uśrednione po wszystkich
cząsteczkach (średnia kwadratu prędkości).
2
x
v
2
x
v
l
m
l
m
F
x
x
x
n
2
v
v
2
)
v
2
(
⋅
=
⋅
⋅
⋅
=
Stąd:
Ci nienie
ś
Ci nienie
ś
2
2
2
2
z
y
x
v
v
v
v
+
+
=
2
2
2
z
y
x
v
v
v
=
=
ponieważ
oraz
więc
3
,
3
2
2
2
2
v
v
v
v
=
=
x
x
czyli
ostatecznie
Ci
Ci
ś
nienie
nienie
V
v
m
N
S
l
v
m
N
S
l
v
m
N
S
F
p
n
⋅
⋅
⋅
=
⋅
⋅
⋅
⋅
=
⋅
⋅
⋅
=
∆
=
3
3
3
2
2
2
ponieważ
Ostatecznie możemy napisać:
Ci nienie
ś
Ci nienie
ś
k
E
V
N
V
v
m
N
V
v
m
N
p
⋅
⋅
=
⋅
⋅
⋅
=
⋅
⋅
⋅
=
3
2
2
3
2
3
2
2
2
2
v
m
E
k
⋅
=
obj to naczynia
ę ść
ilo cz stek
ść
ą
gazu w naczyniu
- energia kinetyczna
k
E
T
T
emperatura
emperatura
2
v
3
2
2
⋅
⋅
=
m
k
T
- s ta a
ł Boltzmanna
Je dno s tka:
ke lvin - K
Temperaturę bezwzględną
definiujemy jako wielkość
wprost proporcjonalną do średniej energii kinetycznej
cząsteczek:
K
J
k
23
10
38
.
1
−
⋅
=
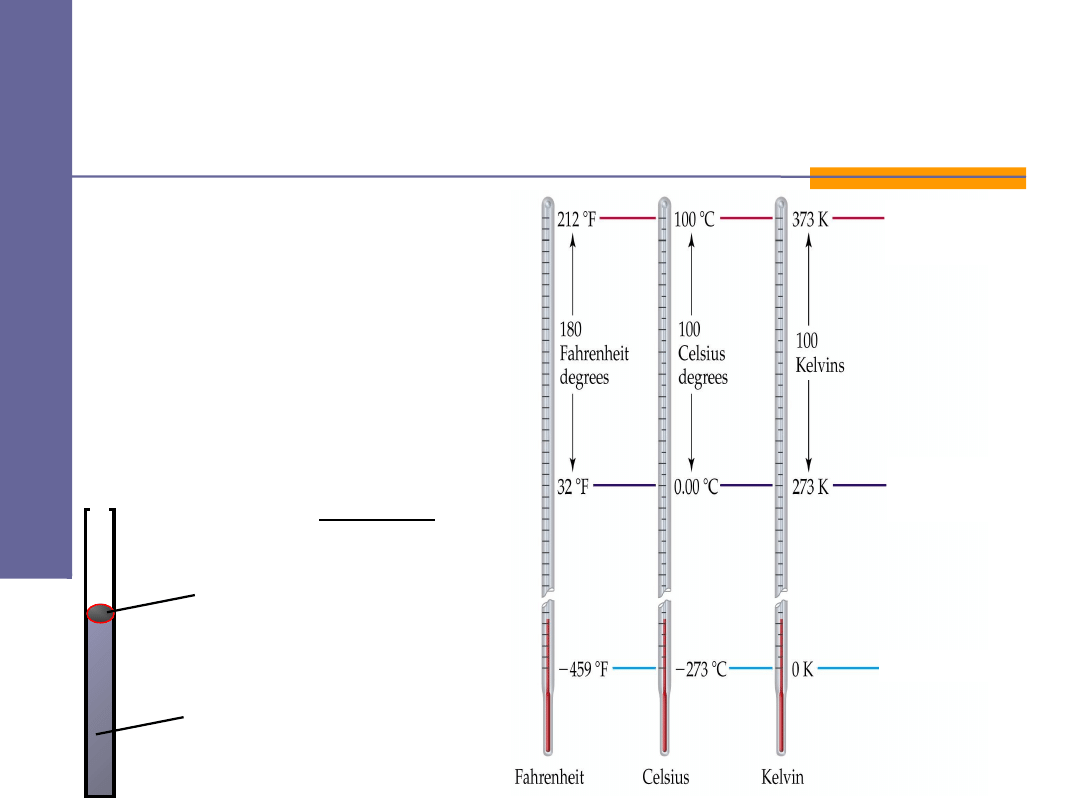
Pomiar
temperatury T
poprzez pomiar
p
i
V
gaz doskona y
ł
rtęć
zero bezwzględne
punkt zamarzania
wody
punkt wrzenia
wody
T
T
emperatura
emperatura
V
T
T
E
V
E
p
k
k
~
~
,
~
T
p
k
N
V
⋅
⋅
=
Równanie s tanu gazu dos kona ego
ł
Równanie s tanu gazu dos kona ego
ł
Clapeyro
Clapeyro
n -
n -
XIX w
XIX w
.
.
k
E
V
N
p
⋅
⋅
=
3
2
k
E
k
T
⋅
=
3
2
i
po przekształceniach:
k
E
⇒
T
k
N
V
p
⋅
⋅
=
⋅
ci nienie
ś
obj to
ę ść
liczba cz steczek gazu
ą
sta a Boltzmanna
ł
temperatura w kelwinach - K
wprowadźmy stałą gazowa R:
T
R
n
V
p
T
N
R
N
V
p
A
⋅
⋅
=
⋅
⇒
⋅
⋅
=
⋅
ci nienie
ś
obj to
ę ść
sta a gazowa
ł
temperatura w kelwinach - K
K
mol
J
R
⋅
=
31
.
8
k
N
R
A
⋅
=
Mol
- jednostka liczności
materii w układzie SI.
Jeden
mol
jest to liczność
materii, mającej taką samą
liczbę cząstek ile jest
atomów zawartych w 12
gramach izotopu węgla
12
C.
liczba moli gazu
µ
M
N
N
n
A
=
=
liczba moli gazu
masa molowa – 1 mola
Równanie s tanu gazu dos kona ego
ł
Równanie s tanu gazu dos kona ego
ł
Clapeyro
Clapeyro
n -
n -
XIX w
XIX w
.
.
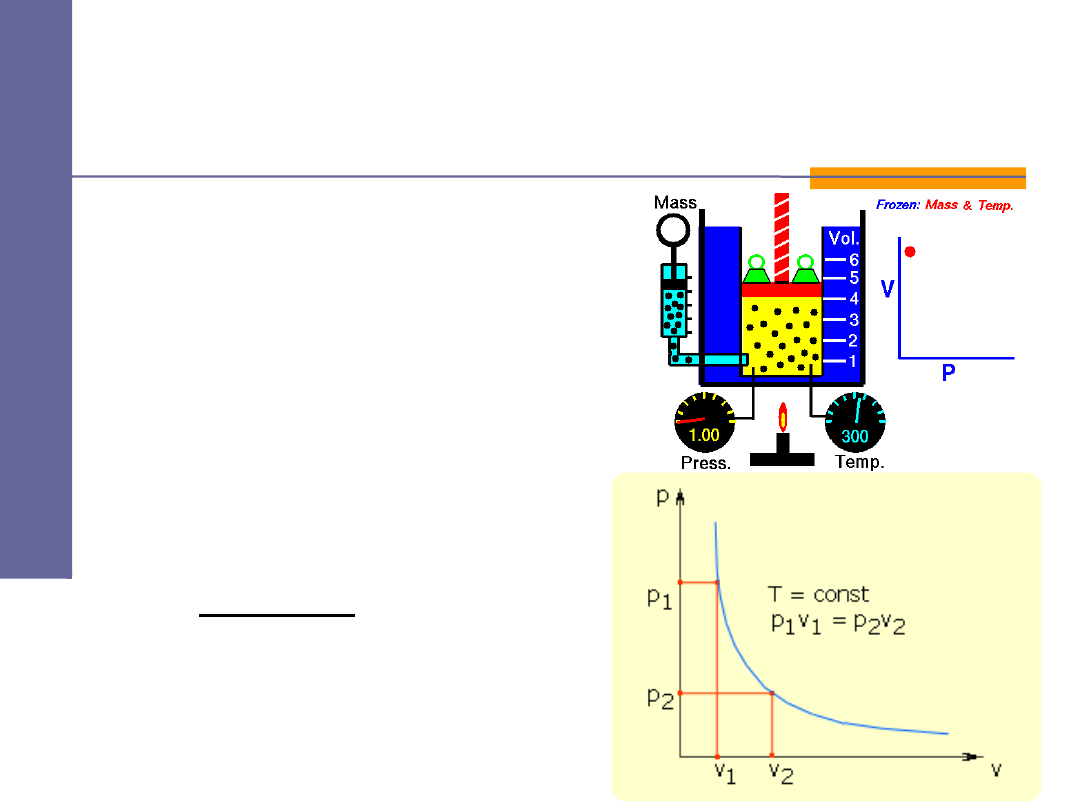
Przemiany gazowe -
Przemiany gazowe -
izotermiczna
izotermiczna
prawo Boyle'a Mariotte'a:
‑
T
R
n
V
p
⋅
⋅
=
⋅
lub
jeżeli
const
T
=
⇓
const
V
p
=
⋅
2
2
1
1
V
p
V
p
⋅
=
⋅
V
const
p
=
lub
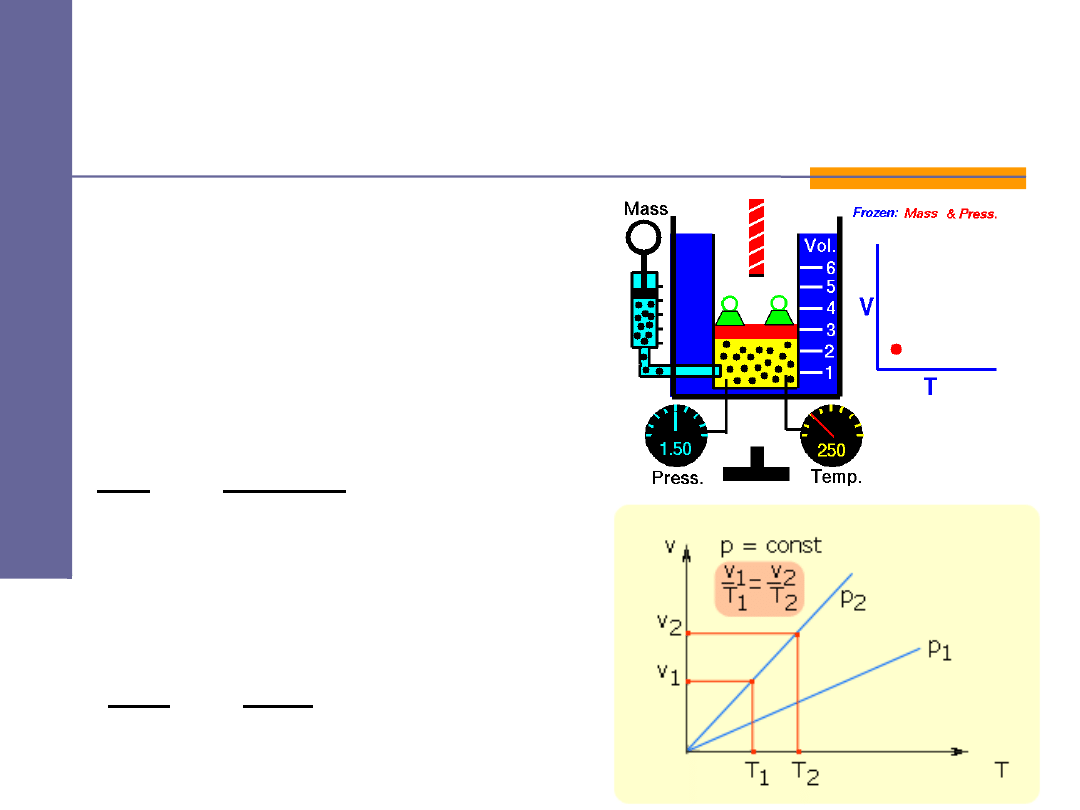
Przemiany gazowe -
Przemiany gazowe -
izobaryczna
izobaryczna
prawo Gay – Lussaca:
T
R
n
V
p
⋅
⋅
=
⋅
lub
jeżeli
const
p
=
⇓
const
R
n
p
T
V
=
⋅
=
2
2
1
1
T
V
T
V
=
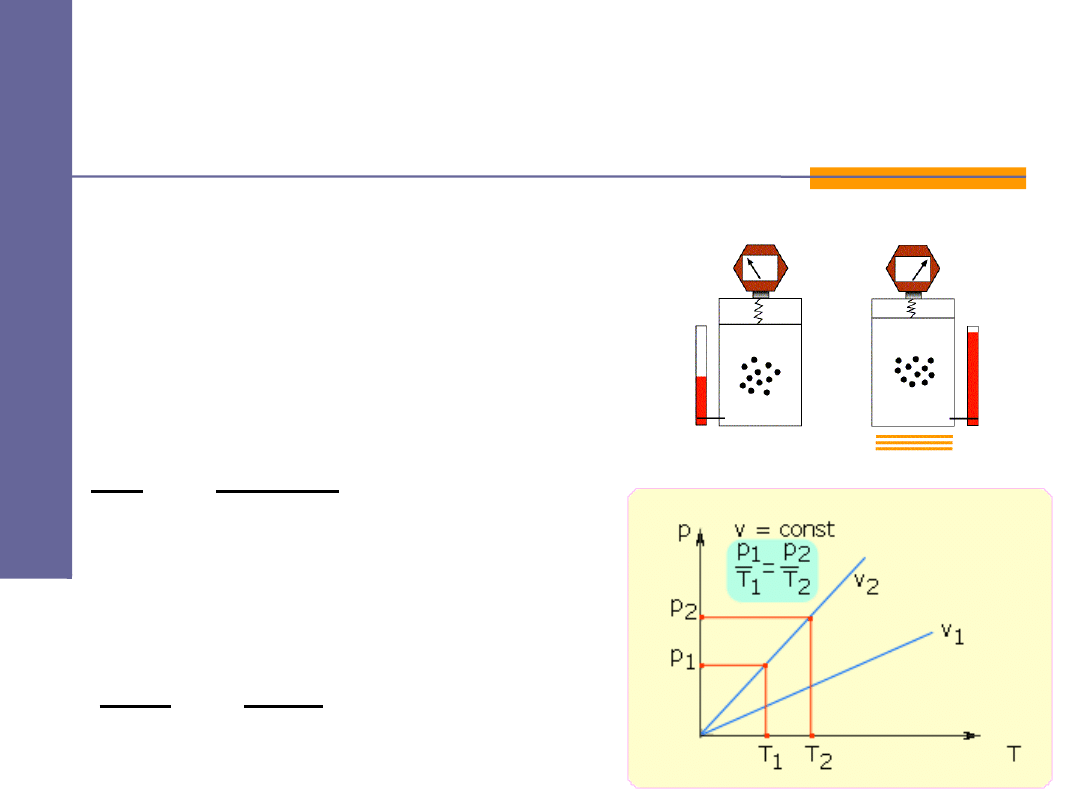
Przemiany gazowe -
Przemiany gazowe -
izochoryczna
izochoryczna
prawo Charlesa :
T
R
n
V
p
⋅
⋅
=
⋅
lub
jeżeli
const
V
=
⇓
const
V
R
n
T
p
=
⋅
=
2
2
1
1
T
p
T
p
=
niskie
ci nienie
ś
wysokie
niska
wysoka
temp.
temp.
Zas ady termodynamiki
Zas ady termodynamiki
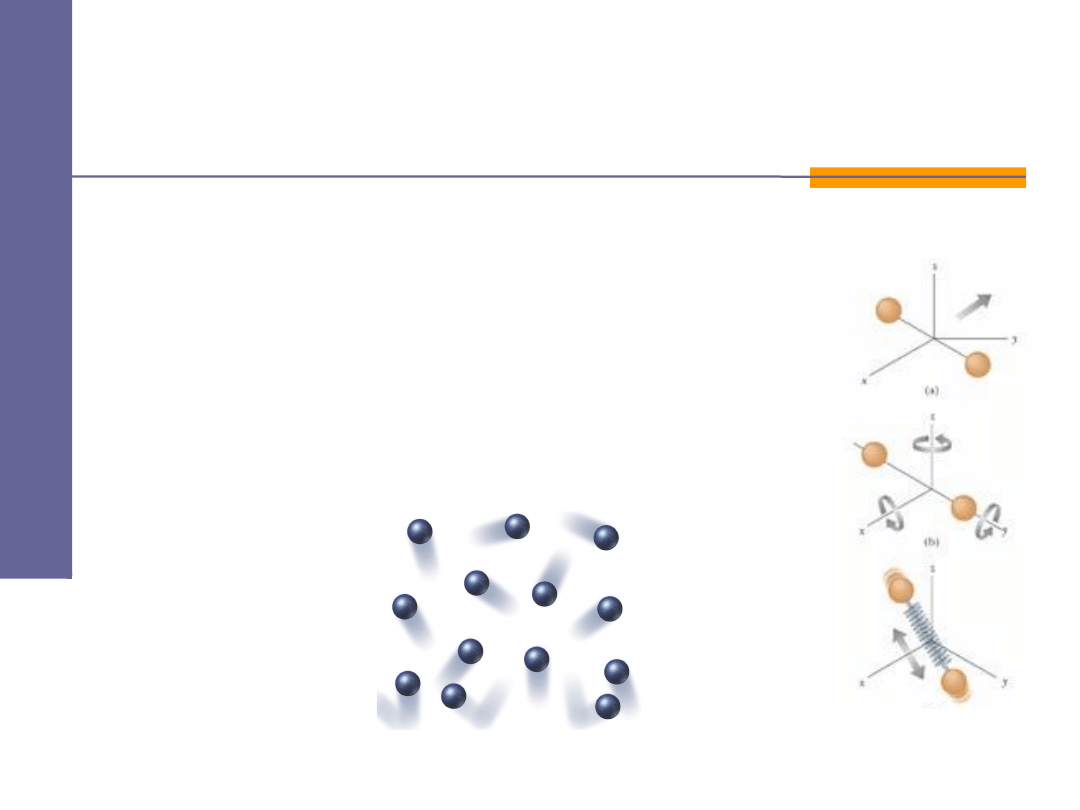
Energia wewnętrzna U
Energia wewnętrzna U
to część energii układu
zależna tylko od jego stanu wewnętrznego, stanowi
ona sumę energii oddziaływań międzycząsteczkowych
i wewnątrzcząsteczkowych układu oraz energii ruchu
cieplnego cząsteczek. Dla gazu doskonałego jest to
suma energii kinetycznej bezładnego ruchu
cząsteczek gazu.
Zas ady termodynamiki
Zas ady termodynamiki
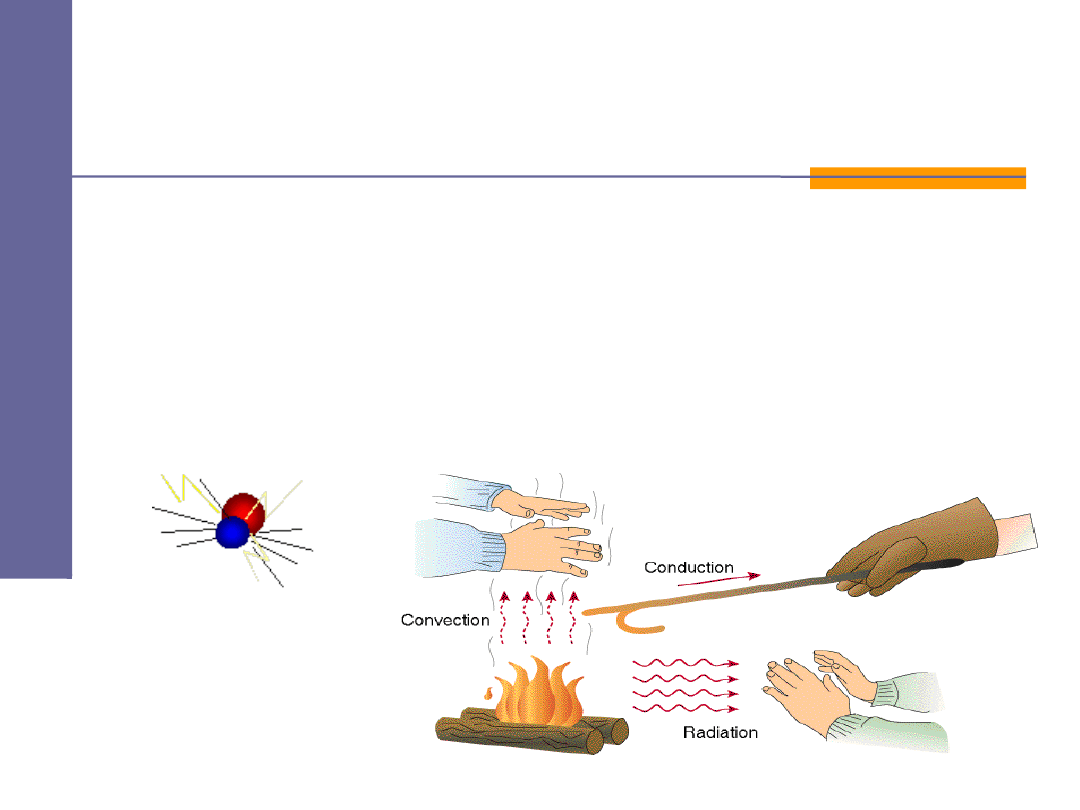
Ciepło
Ciepło
∆
∆
Q
Q
to sposób przekazu energii wewnętrznej od ciała o
wyższej temperaturze do ciała o niższej temperaturze - bez
wykonywania pracy. Ciepło w sensie fizycznym można
wyłącznie
oddać lub przyjąć
, ale nie można go
"mieć"!
Ciepło jest tą częścią
energii przekazywanej, która zachodzi w wyniku
zderzeń
między cząsteczkami
ciał,
konwekcji
,
przewodzenia
lub
wypromieniowania
∆
Q > 0
gdy my dostarczamy
energię,
∆
Q < 0
gdy gaz oddaje energie.
Zas ady termodynamiki
Zas ady termodynamiki
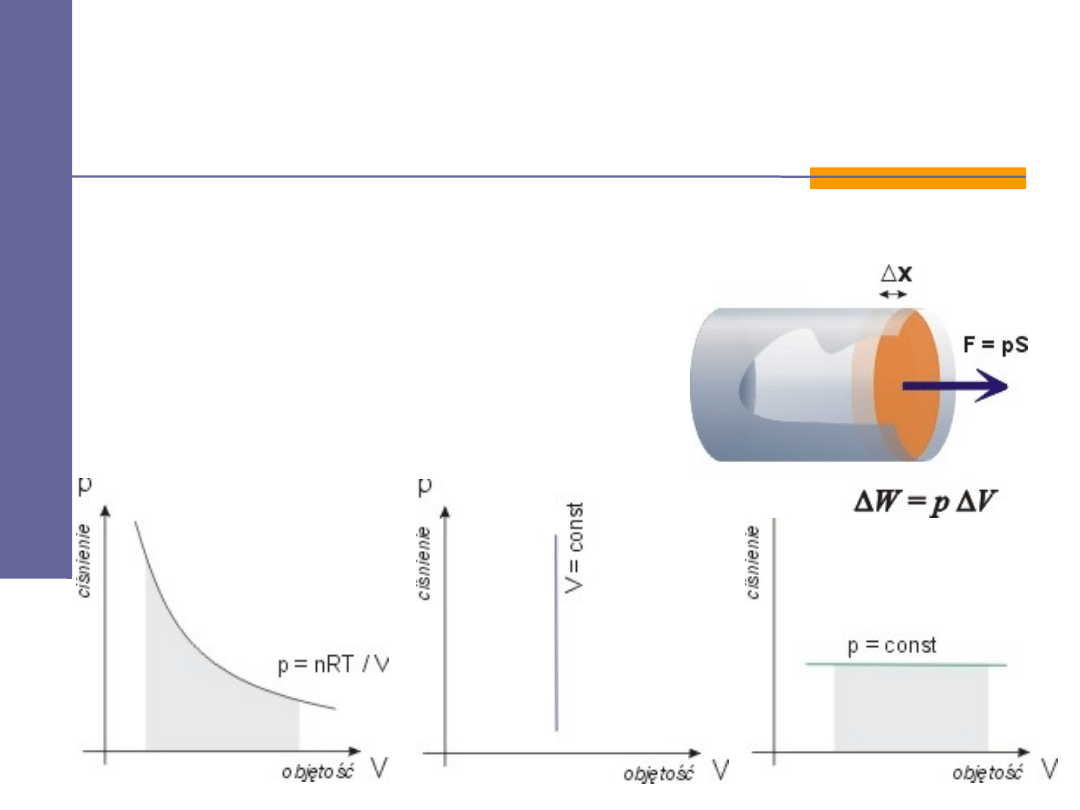
Praca W
jest w termodynamice rozumiana na sposób mechaniczny.
Jest funkcja procesu fizycznego, w którym charakteryzujące układ
parametry ulegają zmianie.
W > 0
gdy my wykonujemy pracę nad gazem,
W < 0
gdy gaz wykonuje pracę.
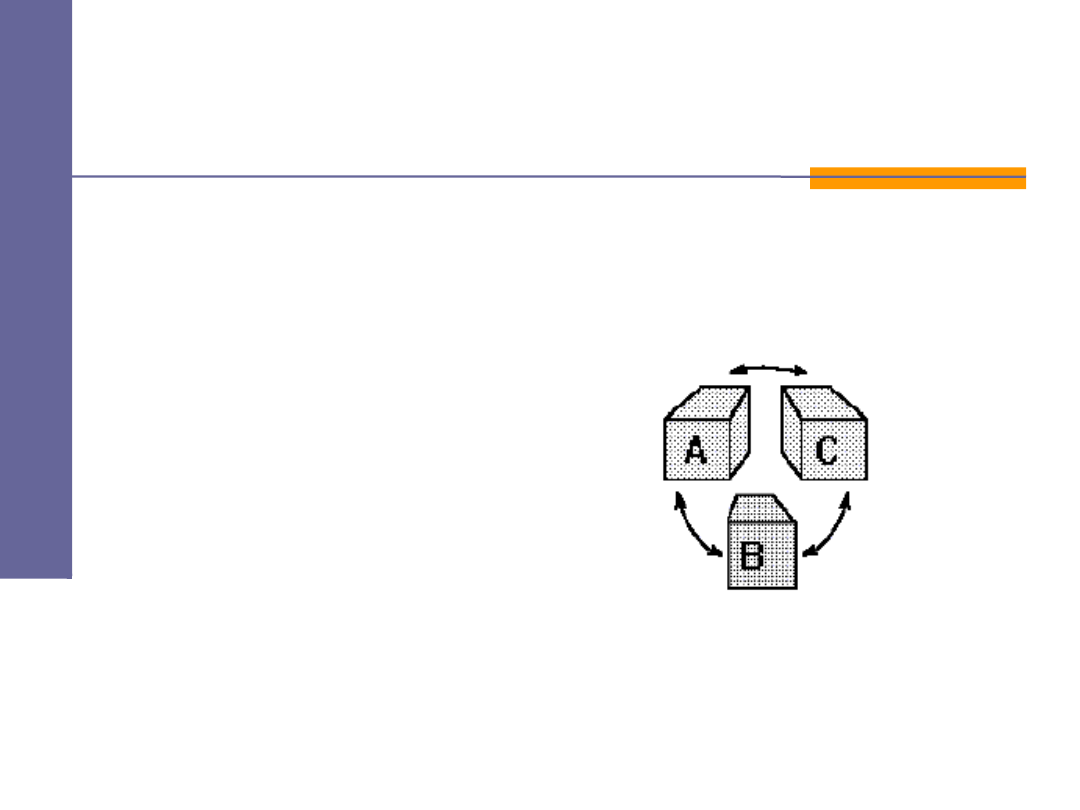
Jeżeli dwa ciała
A
i
B
są w równowadze termicznej z
ciałem
C
, to ciała
A
i
B
są w równowadze termicznej ze sobą.
Mówimy
o nich, że mają tą samą temperaturę.
średnie energie kinetyczne ruchu postępowego
(na cząsteczkę) dla dwu kontaktujących się gazów są równe
Zerowa zas ada termodynamiki
Zerowa zas ada termodynamiki

Pierws za zas ada termodynamiki
Pierws za zas ada termodynamiki
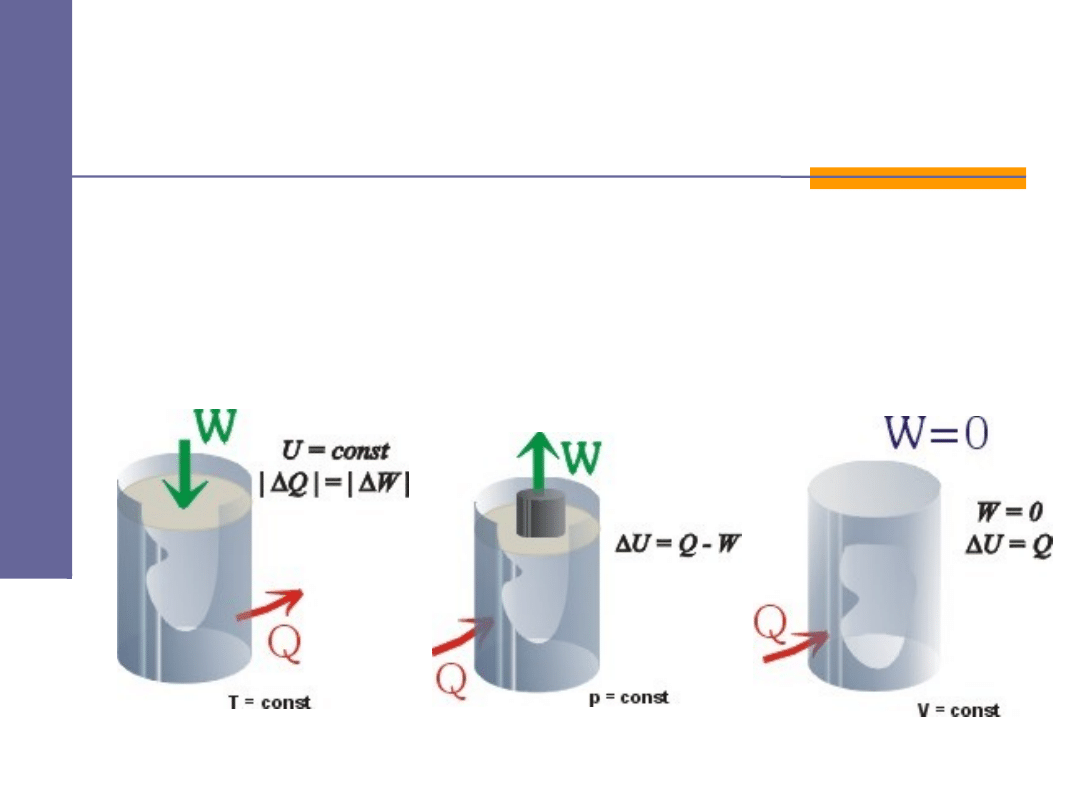
Zmiana energii wewnętrznej układu równa jest
algebraicznej sumie ciepła wymienionego miedzy
ciałem (układem) a otoczeniem i pracy wykonanej
przez to ciało (układ) lub przez siłę zewnętrzna.
W
Q
U
+
∆
=
∆
Ka da z wielko ci wys t puj ca w tym wzorze
ż
ś
ę
ą
mo e by dodatnia, ujemne lub równa zeru.
ż
ć
Energię wewnętrzną ciała można zmieniać na dwa sposoby:
niewidoczny dla oka (mikroskopowy) – poprzez dostarczenie
ciepła,
dający się zaobserwować makroskopowo - za pomocą pracy.
Pierws za zas ada termodynamiki
Pierws za zas ada termodynamiki
W
Q
U
+
∆
=
∆
Document Outline
- Slajd 1
- Slajd 2
- Slajd 3
- Slajd 4
- Slajd 5
- Slajd 6
- Slajd 7
- Slajd 8
- Slajd 9
- Slajd 10
- Slajd 11
- Slajd 12
- Slajd 13
- Slajd 14
- Slajd 15
- Slajd 16
- Slajd 17
- Slajd 18
- Slajd 19
- Slajd 20
- Slajd 21
- Slajd 22
- Slajd 23
Wyszukiwarka
Podobne podstrony:
Fizyka INF 5 2011(1)
Fizyka INF 1 2011
Fizyka INF 8 2011
Fizyka INF 4 2011
Fizyka INF 2 2011
Fizyka INF 9 2011
Fizyka INF 3 2011
Fizyka INF 4 2011(1)
29 sprawozdanie, Politechnika Rzeszowska, Fizyka Sprawozdania, prz inf 2011
Ćw 4 Fizyka, Politechnika Rzeszowska, Fizyka Sprawozdania, prz inf 2011
SPRAWOZDANIE 45, Politechnika Rzeszowska, Fizyka Sprawozdania, prz inf 2011
FIZYKA 2002 2011
FIZYKA 2002 2011
Fizyka Wsp 2011
Tech Inf 2011 temat 2, UG, UG1, Technologia Informacyjna
fizyka budowli I 2011, politechnika lubelska, budownictwo, 3 rok, semestr 5, fizyka budowli, laborat
fizyka pr 2011
więcej podobnych podstron