2.1
2.Wiązanie peptydowe.
Białka
2.1. Wykrywanie wiązania peptydowego - reakcja biuretowa (Piotrowskiego)
Zasada: Reakcja biuretowa jest charakterystyczna dla wiazań peptydowych przy
czym dają ją zwiazki posiadające w cząsteczce co najmniej dwa takie wiązania.
Nazwa metody pochodzi od biuretu (dwumocznika), który jest najprostszym
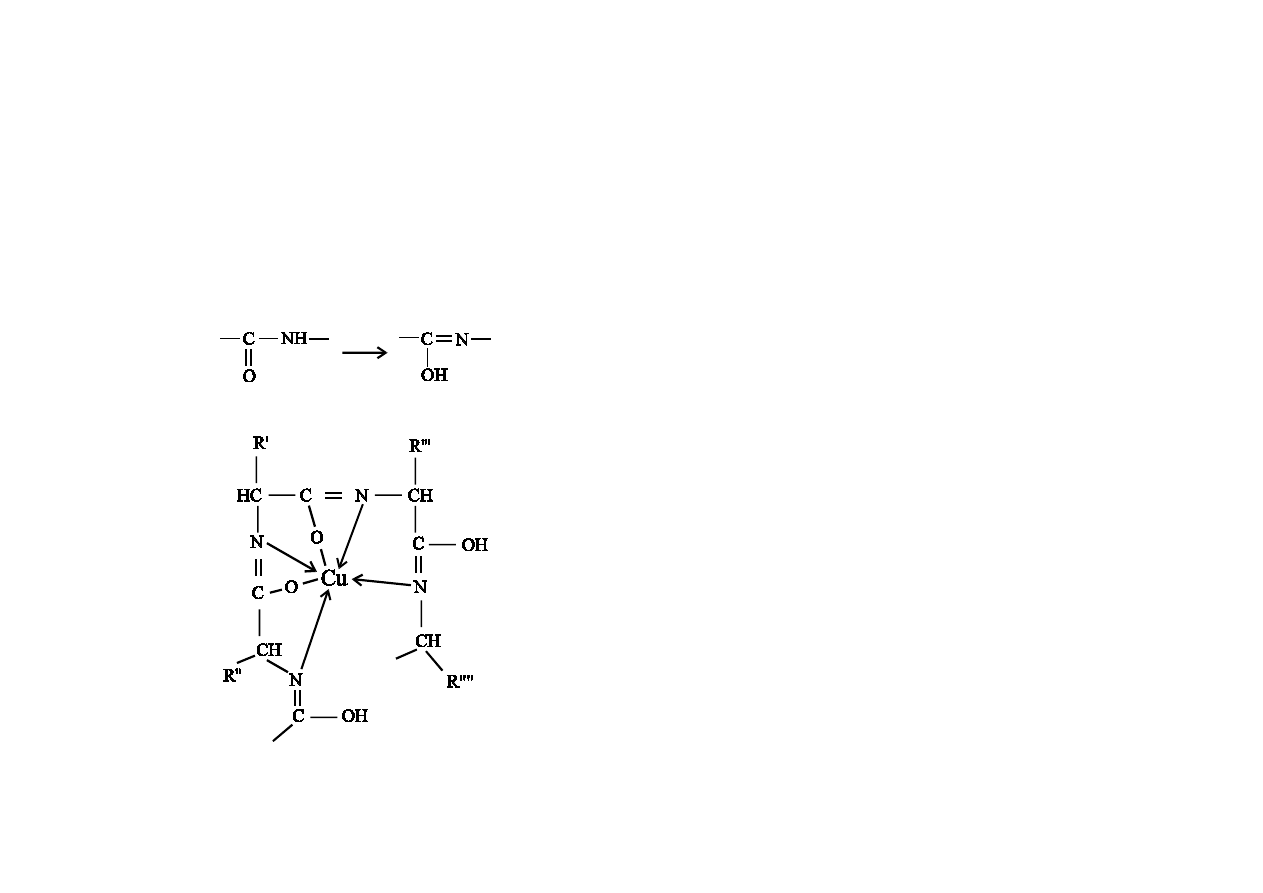
związkiem spełniającym wymieniony wyżej warunek. W środowisku zasadowym
zachodzi tautomeryzacja wiązania peptydowego z utworzeniem formy enolowej
(rys.1).
rys.1.
rys.2
Z ugrupowaniami tego typu jony miedzi ( Cu+2 ) tworzą dwa wiązania atomami
tlenu grup enolowych oraz cztery wiązania koordynacyjne z atomami azotu
(rys.2.). Powstały kompleks ma barwę fioletową.
Wykonanie: Do 1 ml 15-krotnie rozcieńczonego roztworem soli fizjologicznej
białka jaja kurzego dodać 1 ml 10% NaOH i 20
µ
l 2% CuSO4. Pojawia się barwa
fioletowa. Doświadczenie porównawcze wykonać z 1% roztworem aminokwasu.
2.2. Wysalanie i odsalanie białek
Zasada: Rozpuszczalność białek w wodzie jest określona głównie przez ich
zdolność do hydratacji. Zjawisko to polega na wiązaniu dipoli wodnych z grupami
polarnymi białka, dzięki czemu cząsteczka białka otacza się płaszczem wodnym.
Obecność niewielkich stężeń soli wpływa dodatnio na rozpuszczalność białek,
natomiast wzrost stężenia soli powoduje wypadanie białek z roztworu - zjawisko
to nosi nazwę "wysalania białka". Działanie wysalające dużych stężeń jonów
polega na ich znacznie większym oddziaływaniu na cząsteczki wody w
porównaniu z siłami wywołującymi uwodnienie cząsteczki białka. Do wysalania
białek używa się soli, które łatwo tworzą wodziany. Sole takie, mające możność
wiązania wody konkurując z białkiem o cząsteczki wody, odbierają cząsteczkom
białek płaszcz wodny, co obniża ich rozpuszczalność i prowadzi do wytracąnia z
roztworu. Wysalanie białek jest procesem odwracalnym - dodanie czystego
rozpusczalnika powoduje ponowne rozpuszczenie białka. Stężenie soli potrzebne
do wysolenia białka zależy od właściwości danego białka i od pH środowiska.
Białko najłatwiej wysolić w punkcie izoelektrycznym. Różne białka wymagają do
wysolenia różnych stężeń soli i właściwość ta jest wykorzystywana do
frakcjonowania mieszanin białkowych np: białek osocza. Przy 25 % nasyceniu
siarczanem amonu z osocza wysala się fibrynogen, przy nasyceniu 50%
(NH4)2SO4 wysoleniu ulega większość globulin, a do wysolenia albumin i
niektórych dobrze rozpuszczalnych glikoprotein wymagane jest 80% nasycenia
siarczanem amonu.
Wykonanie: Do 3 szklanych probówek nalać po 1,5 ml 33.3% (v/v) roztworu
białka jaja kurzego. Do pierwszej probówki dodać 0,5 ml nasyconego roztworu
siarczanu amonu uzyskując w ten sposób końcowe nasycenie równe 25%, do
drugiej 1,5 ml nasyconego roztworu siarczanu amonu (końcowe nasycenie 50%),
a do trzeciej 1,5 ml roztworu siarczanu amonu oraz 0,67 g siarczanu amonu in
subst. (końcowe nasycenie 80%). Zawartość drugiej probówki odwirować
(wirówka K-24, 10 min, 12 000obr/min). Osad białka zawiesić w 3 ml nasyconego

2.2
roztworu siarczanu amonu i dializować do 2 l soli fizjologicznej (lub wody
destylowanej). Zaobserwować ponowne rozpuszczanie się białek.
2.3. Denaturacja białek
Struktura łańcuchów polipeptydowych w białkach jest stabilizowana poprzez
różnorodne wiązania niekowalencyjne. Do wiązań tych zaliczamy wiązania
wodorowe, jonowe, oddziaływania hydrofobowe, oddziaływania typu dipol-dipol.
Zniszczenie tych wiązań prowadzi do zmiany przestrzennej struktury łańcuchów
polipeptydowych; proces ten nazywa się denaturacją. W wyniku zniszczenia
wiązań stabilizujących strukturę przestrzenną białek, łancuchy polipeptydowe
przyjmują w roztworze inną konformację a uwolnione grupy funkcyjne
aminokwasów mogą wytworzyć nowe wiązania. Ponieważ różnorodne czynniki
denaturujące wpływają na zerwanie różnych typów wiązań stabilizujących
strukturę białek , dlatego też mechanizm denaturacji może być różny dla różnych
czynników denaturujących. Zdenaturowane białko może nie ulegać wytrąceniu z
roztworu wówczas, gdy znajduje się w środowisku o pH różnym od jego punktu
izoelektrycznego.
2.3.1. Denaturacja cieplna w punkcie izolektrycznym.
Zasada: Pod wpływem wzrostu temperatury zwiększają się drgania atomów
połączonych wiązaniami wodorowymi, wskutek czego ulegają one rozerwaniu.
Zakwaszenie roztworu przesuwa stężenie jonów wodorowych do pH
odpowiadającego punktowi izoelektrycznemu białka.
Wykonanie: Do 1 ml 6,7% roztworu białka dodać kroplę roztworu kwasu
octowego i ogrzać do wrzenia. Tworzy się biały, kłaczkowaty osad, który staje się
wyraźny po dodaniu niewielkiej ilości NaCl lub MgS04.
2.3.2. Działanie alkoholu etylowego lub acetonu
Zasada: Rozpuszczalniki organiczne obniżają stałą dielektryczną wody, osłabiają
wiązania hydrofobowe i dezorganizują płaszcz wodny cząsteczek białka.
Krótkotrwałe działanie etanolu powoduje wytrącenie białka, nie denaturując go.
Denaturacja zachodzi przy wyższych stężeniach i dłuższym czasie działania
alkoholu.
Wykonanie: W dwóch probówkach do 1 ml 6.7% roztworu białka dodać 100
µ
l
95 % alkoholu etylowego (ilość dodawanego etanolu skonsultować z
prowadzącym ćwiczenia). Do jednej próbki natychmiast po obserwacji wytrącenia
się osadu dolać dużą ilość wody, zaobserwować zachowanie się osadu. Do.drugiej
próbki taką samą ilość wody dolać po 30 min. Takie samo doświadczenie wykonać
z użyciem 100% acetonu.
2.3.3. Działanie kationów i anionów
Zasada: Białka są substancjami amfoterycznymi. W pH wyższym od punktu
izoelektrycznego białka posiadają ładunek ujemny i mogą reagować z kationami.
Kationy metali alkalicznych tworzą sole dobrze dysocjujące i rozpuszczalne w
wodzie, natomiast kationy metali ciężkich (Pb+ ,Cu+2, Fe+3) dają sole trudno
rozpuszczalne.
Wykonanie: Do 2 probówek zawierających po 1ml roztworu białka dodać parę
kropel 2% Pb(CH3COO)2 lub CuSO4.
Odczynniki: białko jaja kurzego lub inny roztwór białka, 1%roztwór dowolnego
aminokwasu, sól fizjologiczna, 10% roztwór NaOH, nasycony roztwór siarczanu
amonu, siarczan amonu in subst., 0.9% roztwór NaCl, 5% kwas octowy, NaCl lub
MgSO4 in subst., etanol 95%, aceton 100%, 2% roztwory Pb(CH3COO)2 i
CuSO4.
Wyszukiwarka
Podobne podstrony:
białka i wiaz peptyd 2011
59 Zmiany strukturalne w dwuwarstwie po zwiazaniu z bialkami lub peptydami
Peptydy i białka
Peptydy i białka
01 Aminokwasy, peptydy, białka, enzymyid 3054 ppt
68 Aminokwasy peptydy i bialka(1)
68 Aminokwasy peptydy i bialka
BIAŁKA FUZYJNE 2011, BIOTECHNOLOGIA FARMACEUTYCZNA
Biochemia, Peptydy, Peptydy, Białka
bialka peptydy
biologia, bialka, 1 I rzedna struktora bialek- peptydy w budowie jednej plaszczyzny
Aminokwasy,peptydy,białka i inne
peptydy i bialka, Biologia-liceum
Dietetyka Białka roslinne i jaja 24.01.2011, Dietetyka 1 Rok, Biochemia
DIETETYKA Białka zwierzęce 24.01.2011, Dietetyka 1 Rok, Biochemia
Aminokwasy, peptydy, białka
Peptydy i białka, STOMATOLOGIA, II ROK, Biochemia, zbiorcze
więcej podobnych podstron