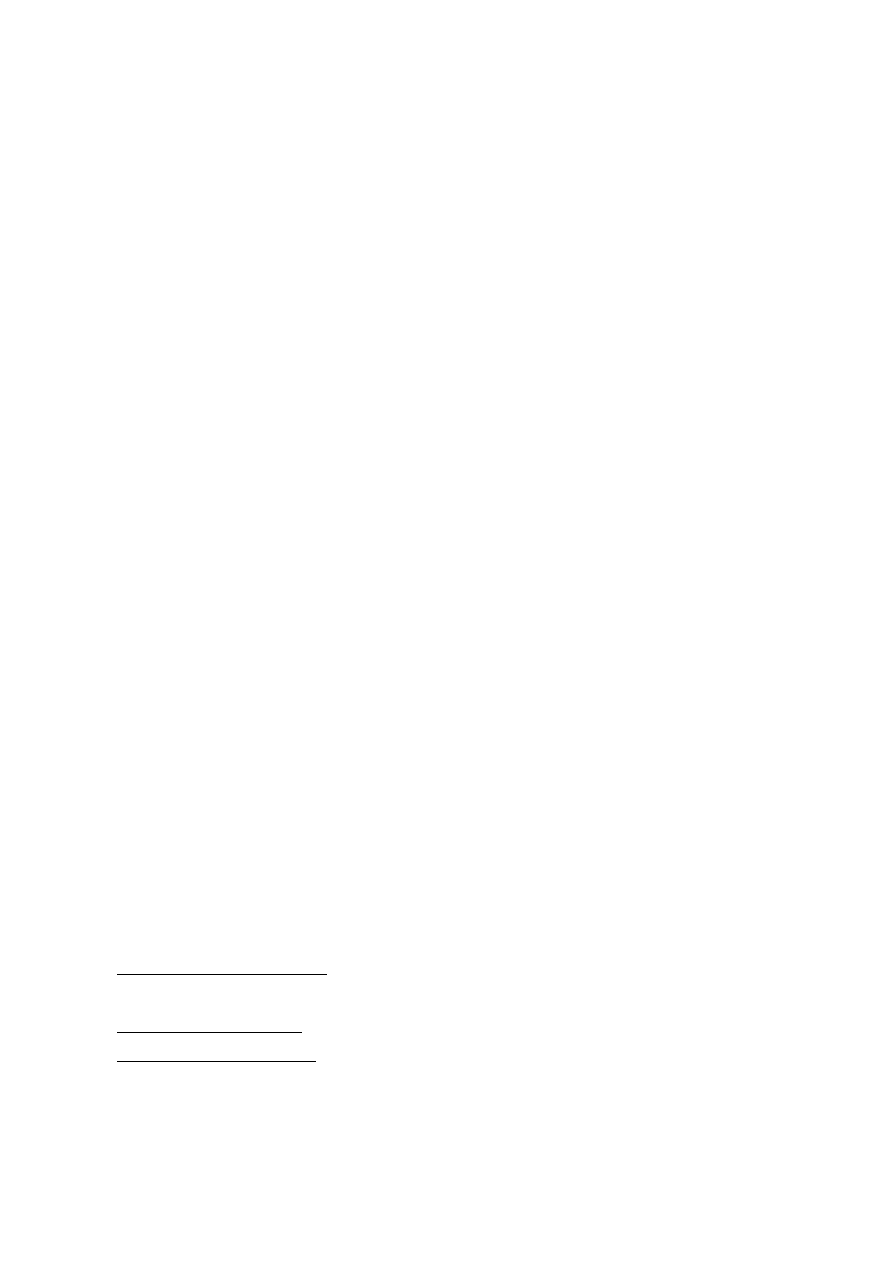
FARMACJA – Chemia organiczna
1
CHROMATOGRAFICZNE METODY ROZDZIAŁU SUBSTANCJI
Chromatografia, „pisanie kolorem” (gr. chroma = kolor + graphe = pisanie) jest
techniką służącą do rozdzielania lub badania składu mieszanin związków chemicznych.
W metodzie tej następuje rozdział mieszaniny składników pomiędzy dwie fazy: fazę
nieruchomą – stacjonarną (bibuła filtracyjna, cienka warstwa adsorbentu naniesiona na
płytkę, wypełnienie kolumny) oraz dużą objętościowo fazę ruchomą – mobilną (ciecz lub
gaz). Faza ruchoma stanowi tu siłę napędową procesu, z kolei faza nieruchoma odgrywa
rolę siły hamującej migrację składników. Rozdział substancji pomiędzy obie fazy
następuje na skutek różnicy współczynników podziału składników mieszaniny pomiędzy
obydwie fazy. Szybkość migracji substancji jest tym większa, im mniejszy jest
współczynnik podziału (mniejsze powinowactwo składnika do fazy stacjonarnej).
W ogólnym przypadku, chromatograficzny rozdział substancji następuje w wyniku
przepuszczenia roztworu badanej mieszaniny przez specjalnie spreparowaną fazę
stacjonarną. Podczas przepływu eluentu (fazy ruchomej) przez fazę stacjonarną następuje
proces elucji czyli wymywania zaadsorbowanych (lub związanych) substancji.
Intensywność tego procesu jest różna dla poszczególnych składników mieszaniny. Jedne
składniki są zatrzymywane w fazie stacjonarnej dłużej, a inne krócej (inna jest retencja),
dzięki czemu może następować ich separacja.
Chromatografia stosowana jest zarówno do badań jakościowych, ilościowych, jak i dla
celów preparatywnych. Sprzężenie, chromatografii gazowej z innymi metodami, na
przykład spektrometrią masową lub spektrofotometrią w podczerwieni, znacznie
rozszerza możliwości identyfikacji rozdzielanych składników.
PODZIAŁ METOD CHROMATOGRAFICZNYCH
Metody
chromatograficzne
można
klasyfikować
według
wielu
kryteriów.
W zależności od stanu skupienia fazy ruchomej, czyli medium wymywającego (eluentu),
rozróżnia się następujące techniki chromatograficzne:
•
chromatografia cieczowa, w której eluentem jest ciekły rozpuszczalnik lub
mieszanina rozpuszczalników,
•
chromatografia gazowa, w której eluentem jest gaz (hel, argon, azot, rzadziej wodór),
•
chromatografia fluidalna, w której eluentem jest ciecz w stanie nadkrytycznym (fluid).
FARMACJA – Chemia organiczna
2
Ze względu na stan skupienia fazy nieruchomej – stacjonarnej wyróżniamy układy:
Faza ruchoma
Faza stacjonarna
Typ chromatografii
gaz
ciecz
GLC gas – liquid chromatography
ciecz
ciecz
LLC liquid – liquid chromatography
gaz
ciało stałe
GSC gas – solid chromatography
ciecz
ciało stało
LSC liquid – solid chromatography
Zależnie od rodzaju zjawisk odpowiedzialnych za podział substancji wyróżnia się:
a.
chromatografię rozdzielczą (podziałową) – o zachowaniu się mieszaniny poddanej
rozdzieleniu decyduje współczynnik podziału poszczególnych składników pomiędzy
dwie nie mieszające się ze sobą ciecze. Fazę stacjonarną stanowi rozpuszczalnik
bardziej polarny zaadsorbowany w postaci cienkiej warstwy na odpowiednim
nośniku, a fazą ruchomą jest układ o mniejszej polarności (w chromatografii z
odwróconymi fazami układ faz jest odwrotny). Nośnikiem fazy stacjonarnej
najczęściej jest żel krzemionkowy, celuloza, ziemia okrzemkowa, skrobia
ziemniaczana, kauczuk.
b.
chromatografię adsorpcyjną – podstawą rozdziału jest niejednakowa skłonność
składników mieszaniny do adsorpcji fizycznej i chemicznej na powierzchni fazy
stacjonarnej (ciało stałe). Jako fazę stacjonarną stosuje się tlenek glinu, żel
krzemionkowy, węgiel aktywny, syntetyczne i naturalne krzemiany, tlenki,
siarczany i fosforany wapnia i magnezu. Fazę ruchomą stanowi ciecz lub gaz.
c.
chromatografię jonowymienną – wykorzystywane jest zjawisko różnych zdolności
do wymiany jonów przez składniki mieszaniny z wymieniaczem jonowym. Fazę
stacjonarną stanowi odpowiednio przygotowana żywica jonitowa.
d.
chromatografię żelową (sitową lub sączenie molekularne) – rozdzielanie polega
na zróżnicowanej dyfuzji cząsteczek w pory fazy stacjonarnej. Cząsteczki na tyle
duże, że ich dyfuzja jest wykluczona, szybko są wypłukiwane przez fazę ruchomą.
Cząsteczki mniejsze zatrzymują się na materiale nośnym i są wypłukiwane w
następnej kolejności.
Kolejny podział metod chromatograficznych wynika z różnego sposobu
umieszczenia nośnika:
a.
chromatografia kolumnowa – nośnik fazy stacjonarnej umieszczony jest w
kolumnie chromatograficznej, którą stanowi rura szklana, przewężona w dolnej
swej części, o stosunku wysokości fazy stacjonarnej (L) do kwadratu wewnętrznej
średnicy kolumny (D
2
) wynoszącym co najmniej 20. Lepsze warunki rozdziału

FARMACJA – Chemia organiczna
3
otrzymuje się, gdy stosunek L/D
2
przyjmuje większe wartości (od 90 do 150). Faza
ruchoma przemieszcza się pod wpływem siły grawitacyjnej.
b.
chromatografia planarna – możliwa tylko w chromatografii cieczowej. W jej
ramach można wyróżnić:
•
technikę cienkowarstwową TLC (ang. Thin Layer Chromatography) – faza
stacjonarna naniesiona jest na odpowiednie podłoże (płytki szklane lub
aluminiowe) w postaci cienkiej warstwy. Faza ruchoma przenoszona jest w
wyniku działania sił kapilarnych.
•
technikę bibułową – fazą stacjonarną jest bibuła (100% celulozy) o izotropowym
układzie włókien, fazą ruchomą – homogenna mieszanina rozpuszczalników
zawierająca wodę. Wykonuje się techniką wstępującą (rozpuszczalnik migruje
od dolnego końca bibuły zanurzonego w eluencie) lub zstępującą (spływową;
rozpuszczalnik migruje od górnego końca bibuły zanurzonego w eluencie).
Stosowana jest głównie do rozdziału aminokwasów, peptydów, sacharydów i
nukleotydów.
W
preparatywnej
chemii
organicznej
największe
zastosowanie
mają
chromatografie: adsorpcyjna i rozdzielcza, ze względu na przydatność tych technik do
całkowitego lub częściowego rozdzielania składników mieszanin reakcyjnych.
ADSORBENTY STOSOWANE W CHROMATOGRAFII
Adsorbenty stosowane w chromatografii powinny wykazywać odpowiednią
selektywność i aktywność w stosunku do rozdzielanych substancji oraz nie mogą z nimi
reagować.
Adsorbenty można podzielić na dwie grupy:
a.
adsorbenty polarne – wykazują zmienną aktywność w zależności od zawartości w
nich wody i rozpuszczalników organicznych. Należą do nich przede wszystkim
tlenek glinu, żel krzemionkowy oraz siarczany, fosforany i węglany magnezu i
wapnia, celuloza. Adsorbują się na nich dobrze związki o charakterze polarnym.
b.
adsorbenty niepolarne – wykazują zdolność do silnego wiązania rozpuszczalników
węglowodorowych. Należą do nich węgiel aktywny, grafit, talk. Adsorpcja związków
zależy od wielkości cząsteczek i od długości łańcuchów węglowych.
Adsorbenty stosowane w chromatografii adsorpcyjnej winny charakteryzować się
szczególnie rozwiniętą powierzchnią, gdyż substancja adsorbowana wiąże się z nią pod
postacią warstewki monomolekularnej. Takie właściwości wykazują zwłaszcza tlenek
glinu i węgiel aktywny.

FARMACJA – Chemia organiczna
4
Zastosowanie tlenku glinowego jako adsorbentu z reguły ogranicza się do związków
o niezbyt wielkiej polarności. Związki silnie polarne (cukry, aminokwasy), związane z
Al
2
O
3
, z trudem ulegają elucji.
Węgiel aktywny wykazuje szczególne powinowactwo do związków aromatycznych;
ich elucja może być przeprowadzona przy użyciu rozpuszczalników o budowie
aromatycznej.
Szereg aktywności adsorbentów pod względem wiązania związków organicznych
przedstawia się następująco:
celuloza < skrobia < sacharoza < CaSO
4
< silikażel < MgO < Al
2
O
3
< węgiel aktywny.
Zdolność adsorpcyjna związków organicznych zależy więc od ich polarności oraz
wielkości i polaryzowalności cząsteczek. Poszczególne grupy związków można ułożyć w
następujący szereg, w zależności od ich wzrastającego powinowactwa do polarnych
środków adsorbujących:
chlorowcopochodne węglowodorów < etery < aminy trzeciorzędowe, związki nitrowe
< estry < ketony, aldehydy < aminy pierwszorzędowe < amidy kwasowe < kwasy
karboksylowe.
ROZPUSZCZALNIKI STOSOWANE W CHROMATOGRAFII
Podobne obserwacje odnoszą się do stosowanych rozpuszczalników. Wynika z
nich, że zaadsorbowana substancja może zostać wyparta z adsorbentu przez
rozpuszczalnik wykazujący większe powinowactwo do tego adsorbentu niż wymywana
substancja.
Rozpuszczalniki można zestawić w szereg eluotropowy według ich wzrastających
zdolności wymywania (eluowania) adsorbowanej substancji z powierzchni adsorbentu
polarnego (Tab. 1):
Tabela 1.
Szereg eluotropowy rozpuszczalników.
1.
eter naftowy
2.
cykloheksan
3.
disiarczek węgla
4.
tetrachlorek węgla
5.
toluen
6.
benzen
7.
chlorek metylenu
8.
chloroform
9.
tetrahydrofuran
10.
octan etylu
11.
aceton
12.
butan-2-on
13.
n-propanol
14.
etanol
15.
metanol
16.
woda
17.
kwas octowy
18.
pirydyna
Zastosowanie niepolarnego adsorbentu (np. węgla aktywnego) wymaga użycia
rozpuszczalników (wymienionych w powyższym szeregu eluotropowym) w odwrotnej
kolejności, a więc elucję należy rozpoczynać rozpuszczalnikami najbardziej polarnymi.

FARMACJA – Chemia organiczna
5
Najczęściej jednak stosuje się odpowiednio dobraną mieszaninę dwóch lub więcej
rozpuszczalników.
Podsumowując, przy doborze warunków chromatografii adsorbcyjnej należy więc
pamiętać o następujących zasadach ogólnych:
•
związki polarne adsorbują się silniej niż związki niepolarne,
•
chromatografowanie
substancji
polarnych
wymaga
stosowania
słabszego
adsorbentu i polarnego eluentu,
•
chromatografowanie substancji niepolarnych wymaga zastosowania silniejszego
adsorbentu i niepolarnego eluentu.
CHROMATOGRAFIA CIENKOWARSTWOWA
Chromatografia cienkowarstwowa (TLC – thin layer chromatography) służy jako
niezwykle efektywna i wygodna metoda szybkiej analizy jakościowej oraz w preparatyce
do rozdziału niewielkich ilości substancji. Termin ten oznacza proces chromatograficzny
prowadzony na cienkiej warstwie fazy stacjonarnej naniesionej na podłoże z płytek
szklanych lub folii aluminiowych czy polimerowych. Przede wszystkim stosuje się ją do:
a.
określania liczby składników w mieszaninie,
b.
potwierdzenia lub wykluczenia obecności danej substancji,
c.
monitorowania postępu reakcji chemicznych,
d.
znalezienia optymalnych warunków dla chromatografii kolumnowej,
e.
analizy frakcji uzyskanych techniką chromatografii kolumnowej.
Technika chromatografii cienkowarstwowej łączy w sobie dwa zjawiska: podziału
substancji między dwie różne fazy ciekłe – obowiązuje tu prawo podziału Nernsta i
adsorpcji substancji na nośniku, czyli fazie stacjonarnej. W metodzie tej substancje
chromatografowane poruszają się z różną prędkością wraz z ciekłą fazą ruchomą przez
cienką warstwę stałego adsorbentu naniesionego na płytkę. Towarzyszą temu procesy
adsorpcji i desorpcji oraz podział między ciekłą fazą organiczną i wodą, która w
niewielkich ilościach znajduje się na nośniku. W związku z tym warunki procesu są
trudne do jednoznacznej definicji i kontroli eksperymentalnej.
W chromatografii cienkowarstwowej adsorbent (zazwyczaj z dodatkiem gipsu)
nakładany jest w postaci papki na odtłuszczoną płytkę za pomocą specjalnych urządzeń
(powlekaczy). Grubość warstwy adsorbentu uzależniona jest od rodzaju przeznaczenia:
a.
do analizy jakościowej używa się płytek o grubości nośnika ok. 0.25 mm,
b.
przy analizie ilościowej grubość warstwy wynosi ok. 2 mm.
Płytki do chromatografii cienkowarstwowej można przygotowywać samodzielnie.
Jednakże dostępne w handlu gotowe produkty charakteryzują się dużo lepszą jakością
FARMACJA – Chemia organiczna
6
(równomierność warstwy nośnika, aktywność adsorbentu) z czym wiąże się lepsza
powtarzalność wyników analizy chromatograficznej.
Próbkę nanosi się na płytkę TLC w postaci roztworu o bardzo małej objętości,
tworząc małą plamkę w punkcie startowym. Płytki umieszcza się w komorze
chromatograficznej (Ryc. 1), w której na dnie znajduje się faza ruchoma. W wyniku
działania sił kapilarnych faza ruchoma wędruje w górę płytki. Jest to proces rozwijania
chromatogramu metodą wstępującą. Oddziaływanie substancji znajdujących się w próbce
z adsorbentem oraz z poruszającym się rozpuszczalnikiem powoduje rozdzielenie się
składników próbki na płytce i poszczególne składniki tworzą oddzielne plamki. Plamki
rozdzielanych składników należy uwidocznić, by ostatecznie zidentyfikować skład próby.
Ryc. 1. Komora chromatograficzna z zanurzoną płytką.
Tok postępowania przy wykonywaniu chromatografii cienkowarstwowej jest następujący:
1.
Przygotowanie płytki
Należy zaznaczyć miękkim ołówkiem grafitowym (ostrożnie, by nie zdrapać adsorbentu)
linię startu, która powinna znajdować się na węższym boku płytki w odległości 8-15 mm
od krawędzi.
2.
Naniesienie substancji na płytkę
Za pomocą specjalnych mikropipet lub kapilar na linii startu nanosi się substancję w
postaci ok. 0.5-3%-ego roztworu (w łatwo lotnym rozpuszczalniku). Zbyt duże ilości
naniesionych substancji prowadzą do pogorszenia efektu rozdzielania, a mianowicie do
tworzenia tzw. „ogonów”. Średnica powstałej plamki powinna być jak najmniejsza (1.5-2
mm, maksymalnie 5 mm) i znajdować się około 15 mm od bocznej krawędzi płytki.
Plamkę naniesionej próbki należy odpowiednio wysuszyć.
3.
Rozwijanie chromatogramu
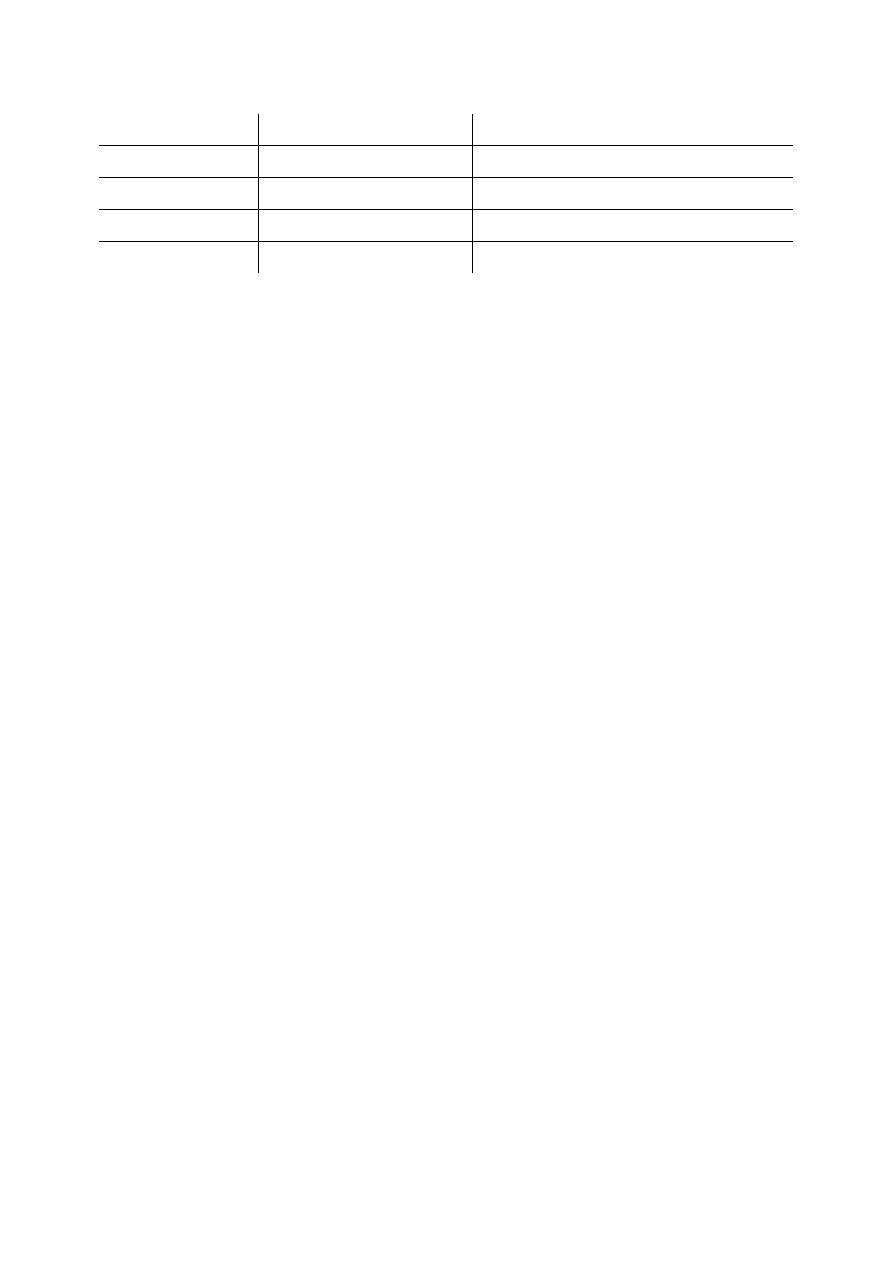
Rozwijanie chromatogramu prowadzi się w specjalnych komorach chromatograficznych,
w ostateczności można używać dużych słoi ze szczelną pokrywką (Ryc. 2).
Ryc. 2. Komory chromatograficzne.
FARMACJA – Chemia organiczna
7
Do komory wlewamy rozpuszczalnik do wysokości ok. 0.5 cm zwracając przy tym uwagę,
aby poziom rozpuszczalnika znajdował się poniżej linii startowej na płytce. Wewnątrz
komory ustawia się bibułę, która nasiąkając rozpuszczalnikiem utrzymuje nasycenie
komory jego parami. Płytkę wstawiamy do komory linią startową do dołu i zakrywamy
szczelnie pokrywą. Gdy rozpuszczalnik osiągnie wysokość ok. 1 cm od górnej krawędzi
płytki, wyjmujemy ją z komory i pozostawiamy do wyschnięcia. Ołówkiem zaznaczamy
linię, do której dotarł rozpuszczalnik („czoło rozpuszczalnika”).
4.
Wywoływanie chromatogramu
Wywoływanie chromatogramów przeprowadza się w przypadku związków barwnych w
świetle widzialnym. Dla związków z grupami chromoforowymi stosuje się naświetlanie
promieniowaniem ultrafioletowym. Związki bezbarwne wywołujemy przez wstawienie
chromatogramu do pojemnika z jodem. Większość związków, z wyjątkiem nasyconych
węglowodorów i chlorowcopochodnych, tworzy z parami jodu barwne kompleksy,
ukazujące się w postaci brunatnych lub fioletowych plam. Niekiedy można
chromatogramy spryskiwać odpowiednimi roztworami substancji, które reagują z
rozdzielanymi związkami (Ryc. 3). W temperaturze pokojowej lub po ogrzaniu pojawiają
się barwne produkty.
Ryc. 3. Przykładowe spryskiwacze stosowane
w chromatografii.
5.
Identyfikacja substancji
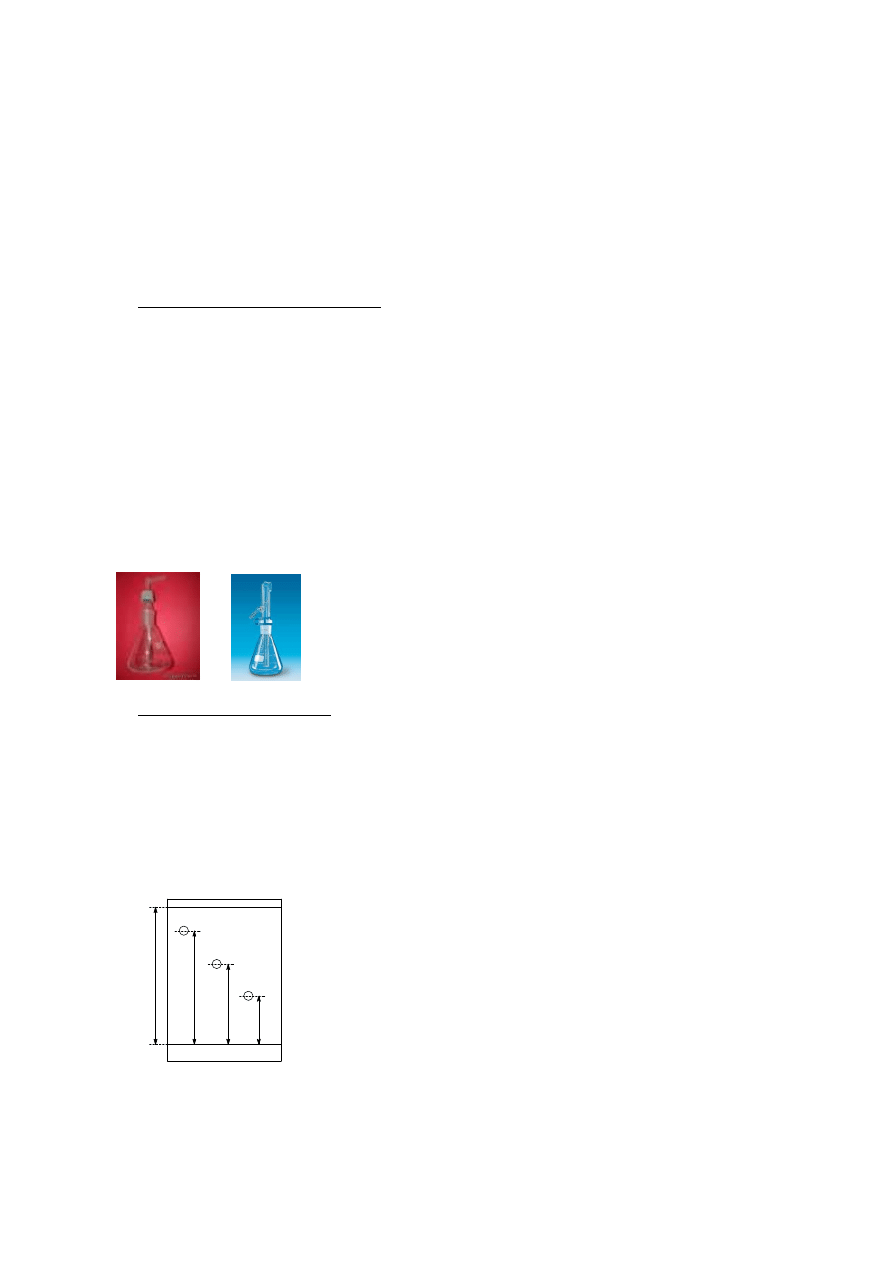
Podstawowym parametrem w chromatografii cienkowarstwowej, który określa położenie
substancji na chromatogramie, jest współczynnik opóźnienia R
f
(ang. retardation factor).
Jest to stosunek drogi migracji substancji (a) do drogi przebytej przez fazę ruchomą (b):
R
f
= a/b. Inaczej mówiąc, substancje rozdzielane identyfikuje się na podstawie stosunku
szybkości
przemieszczania
się
badanej
substancji
do
szybkości
wędrowania
rozpuszczalnika (Ryc. 4).
Ryc. 4. Ilustracja pomiaru współczynnika R
f
:
a = odległość od linii startu do środka plamy;
b = odległość od linii startu do czoła rozpuszczalnika.
Współczynnik R
f
w danych warunkach doświadczalnych oraz w danym układzie
chromatograficznym jest wartością stałą i charakterystyczną dla danej substancji, choć
jako kryterium tożsamości związku nie może być stosowany bezpośrednio, a tylko w
porównaniu z substancją wzorcową, naniesioną na tym samym chromatogramie. Układ
x
x
x
b
a'
a''
a'''

FARMACJA – Chemia organiczna
8
rozwijający (faza ruchoma) musi być tak dobrany, aby była wyraźna różnica pomiędzy R
f
analizowanych związków, aby związki nie zostawały na miejscu nałożenia plamki, oraz
aby nie migrowały z czołem rozpuszczalnika (wtedy wartość R
f
wynosi 1).
W praktyce rzadko udaje się odtworzyć warunki chromatografii tak, by uzyskać
identyczne wartości R
f
, gdyż zależą one od, nawet niewielkich, zmian w następujących
czynnikach:
a.
wymiary ziaren adsorbentu,
b.
skład
rozpuszczalnika
i
stopień
nasycenia
atmosfery
komory
parami
rozpuszczalnika,
c.
aktywacja i warunki przechowywania płytek,
d.
grubość warstwy adsorbentu,
e.
temperatura otoczenia.
Do zalet chromatografii cienkowarstwowej można zaliczyć:
a.
krótki czas wykonania chromatogramu,
b.
dobry rozdział związków,
c.
wygodną obserwację we wszystkich stadiach rozdziału,
d.
dużą
szybkość
przepływu
rozpuszczalnika,
co
skraca
czas
rozwijania
chromatogramu.
Chromatografia cienkowarstwowa znalazła również zastosowanie w preparatyce. W
wersji preparatywnej TLC rozdział mieszaniny prowadzi się na płytkach o grubszej, na
przykład 2 mm, warstwie adsorbentu. Rozdzielaną mieszaninę nanosi się nie punktowo,
ale w linii na długości kilkunastu centymetrów. Po rozdziale warstwę adsorbentu
zawierającą wyodrębniony składnik mieszaniny zeskrobuje się, a sam składnik
ekstrahuje (wypłukuje) rozpuszczalnikiem i po zatężeniu oraz odsączeniu adsorbentu
otrzymuje w stanie czystym.
W ostatnich latach opracowano nowy sposób rozwijania chromatogramów na
cienkich warstwach w pozycji poziomej (Ryc. 5). Sposób ten wymaga mniejszej ilości
układu rozwijającego i umożliwia wielokrotne użycie płytek.
Ryc. 5. Komora pozioma do chromatografii
cienkowarstwowej.
SĄCZENIE MOLEKULARNE
Sączenie molekularne po raz pierwszy zostało wprowadzone w roku 1959 przez
Pera Flodina i Jerkera Poratha. Jest to rodzaj chromatografii cieczowej, w której

FARMACJA – Chemia organiczna
9
wykorzystuje się fizyczne i chemiczne właściwości odpowiednio spreparowanego
polisacharydu znanego pod nazwą Sephadex (SEparation PHArmacia DEXtran). Technika
ta umożliwia analityczny bądź preparatywny rozdział substancji różniących się masą
cząsteczkową.
Sephadex jest handlową nazwą złoża stanowiącego poprzecznie usieciowane
łańcuchy dekstranu (roślinnego polisacharydu glukozy), w którym występują wiązania
α
-1,6-,
α
-1,3-,
α
-1,4-glikozydowe. Żel ten ma postać granulek o średnicy 10-300 µm.
Cząsteczki sefadeksów zawierają liczne grupy hydroksylowe, dlatego substancje te łatwo
pęcznieją w wodzie i roztworach elektrolitów, gdyż cząsteczki wody bez przeszkód wnikają
w przestrzenie sieci molekularnej. Usieciowanie wpływa na zdolność wchłaniania wody,
co decyduje o właściwościach rozdzielczych żelu. Cząsteczki te posiadają trójwymiarową
strukturę sieci przestrzennej. Im więcej tworzy się „oczek” tej sieci, tym są one mniejsze.
Produkowane są złoża, w których stopień usieciowienia określa cyfra znajdująca się przy
dużej literze „G” (od G-10 do G-200), przy czym im większa cyfra tym niższe
usieciowienie. Im mniejszy stopień usieciowania, tym więcej wody wchłania sefadeks. Na
przykład 1 g sefadeksu G-10 wiąże 1 g wody (usieciowanie jest wyjątkowo gęste i
przestrzenie małe). Natomiast 1 g sefadeksu G-200 wiąże 20 g wody, co wskazuje na duże
„oczka” sieci.
Jeśli przez kolumnę wypełnioną sefadeksem przepływa roztwór zawierający
cząsteczki o różnej wielkości, to molekuły większe od największych przestrzeni sieci bez
przeszkód wypływają z kolumny, omijając ziarna żelu. Cząsteczki o mniejszych
rozmiarach przenikają do wnętrza sieci przestrzennej, tym głębiej, im mniejsze są ich
wymiary w porównaniu ze średnicą „oczek”. Usuwanie tych cząsteczek z wnętrza ziaren
sefadeksu jest tym trudniejsze im mniejsze są te cząsteczki. Z tego względu rozdział
składników mieszaniny na sefadeksie przebiega w kolejności malejących rozmiarów
cząsteczek poszczególnych składników, co pokrywa się z ich malejącymi masami
cząsteczkowymi (Ryc. 6).
Ryc. 6. Mechanizm separacji cząsteczek
na podstawie wielkości i kształtu przy
zastosowaniu sączenia molekularnego [1].

FARMACJA – Chemia organiczna
10
Tok postępowania przy wykonywaniu sączenia molekularnego jest następujący:
1.
Przygotowanie żelu
Należy odważyć odpowiednią ilość żelu do żaroodpornego naczynia i dodać roztwór
pełniący rolę eluentu. Całość trzeba ogrzewać do wrzenia przez pewien czas, celem
usunięcia zaadsorbowanego powietrza i napęcznienia żelu, po czym pozostawić do
swobodnego ochłodzenia.
2.
Przygotowanie kolumny
Szklaną rurę należy umieścić pionowo w statywie i zamknąć dolny wylot przy pomocy
polietylenowego wężyka i zaciskacza. Na dno kolumny układa się odrobinę waty, przy
zamkniętym zaciskaczu wlewa niewielką porcję rozpuszczalnika, przez otwarcie
zaciskacza wpuszcza się rozpuszczalnik do przewężenia kolumny, po czym zamyka
zaciskacz. Długą bagietką należy wycisnąć powietrze z waty i następnie wlać jednorodną
zawiesinę żelu do kolumny. Wierzch żelu zabezpieczyć trzeba krążkiem bibuły filtracyjnej,
po czym upakować żel w kolumnie przez otwarcie zaciskacza i przepuszczenie przez
kolumnę porcji rozpuszczalnika o objętości równej objętości złoża żelu.
3.
Naniesienie próbki substancji
Próbkę substancji w postaci roztworu (wskazane jest sporządzenie roztworu w
rozpuszczalniku przeznaczonym do elucji) należy nanieść na powierzchnię żelu za
pomocą odpowiedniej pipety. Trzeba wykonywać to bardzo ostrożnie, tak by nie zburzyć
wierzchniej warstwy żelu (substancja jest wtedy wymywana równomiernie). Otwierając
wylot kolumny należy poczekać do całkowitego wniknięcia próbki w żel, zamknąć wylot i
nanieść niewielką porcję rozpuszczalnika, spłukując resztki substancji z wewnętrznych
ścianek kolumny, znów poczekać aż wniknie, po czym wprowadzić delikatnie kolejną
porcję fazy ruchomej.
4.
Zbieranie frakcji
Od momentu naniesienia substancji oczyszczanej do całkowitego jej wyeluowania należy
zbierać wypływające frakcje w ściśle określonych objętościach do niewielkich naczyń
(probówki, kolby stożkowe).
5.
Wyznaczenie współczynnika podziału – szczególnie w analizie ilościowej mieszanin
związków naturalnych o dużej masie cząsteczkowej, takich jak białka, peptydy, enzymy,
hormony, kwasy nukleinowe, itp.
Pytania sprawdzające:
1.
Wymień techniki chromatograficzne zależne od stanu skupienia fazy ruchomej.
2.
Wymień typy chromatografii zależne od stanu skupienia fazy stacjonarnej.

FARMACJA – Chemia organiczna
11
3.
Podaj rodzaje chromatografii zależne od rodzaju zjawisk odpowiedzialnych za
podział substancji.
4.
Jakie znasz rodzaje chromatografii? Jakie są między nimi różnice?
5.
Wymień znane adsorbenty stosowane w chromatografii.
6.
Podaj szereg aktywności adsorbentów pod względem wiązania związków
organicznych.
7.
Co to jest szereg eluotropowy?
8.
Podaj szereg 5 rozpuszczalników według ich wzrastających zdolności wymywania
adsorbowanej substancji z powierzchni adsorbentu polarnego.
9.
Co to jest współczynnik R
f
? Jak się go wyznacza?
10.
Scharakteryzuj sefadeksy. Co oznaczają symbole G-10 i G-25?
11.
Omów zasadę rozdziału substancji na sitach molekularnych.
12.
Podaj zalety chromatografii cienkowarstwowej.
13.
Jakie są kryteria doboru rozpuszczalnika do chromatografii?
14.
Opisz krótko technikę chromatografii preparatywnej.
Literatura:
[1]
Mariusz Rosiński, Dorota Piasecka-Kwiatkowska, Jerzy R. Warchalewski, Przegląd
metod separacji i oczyszczania białek przydatnych w badaniach i analizie żywności,
ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2005, 3 (44), 5-22.
Wyszukiwarka
Podobne podstrony:
Farmakokinetyka lekow 2014 id 1 Nieznany
blad losowy 02 kwietnia 2014 id Nieznany (2)
IL BiolMed Genetyka2013 2014 id Nieznany
EP wyklad Formy prawne 2014 id Nieznany
projekt sr tr 2014 id 398557 Nieznany
MNM 8 2014 id 304166 Nieznany
matura probna 2014 3 id 288983 Nieznany
Czerwiec 2014 id 128517 Nieznany
Leki przeciwbolowe 2014 id 2661 Nieznany
checklist 2014 id 111321 Nieznany
Kriogenika egzamin 2014 id 250 Nieznany
Opracowane testy 2014 id 337688 Nieznany
blad systematyczny 2014 id 8995 Nieznany (2)
Farmakologia 2014 id 168375 Nieznany
KWDM lab2 2014 id 256084 Nieznany
O CHROMATYZMIE (OKO) id 325855 Nieznany
e 08 2014 01 cz praktyczna id 1 Nieznany
Chromatografia kolumnowa id 116 Nieznany
Instrukcja bhp 2013 2014 id 215 Nieznany
więcej podobnych podstron