
A L K E N Y

Nomenklatura
Alkeny
– węglowodory nienasycone zawierające wiązanie podwójne
C=C
. Nazwy alkenów wg zasad IUPAC tworzy się zamieniając
końcówkę
„an”
w alkanach o takiej samej liczbie atomów węgla na
„en”
.
Jako lokant podwójnego wiązania przyjmuje się niższy numer
atomu węgla w łańcuchu. W alkenach zawierających więcej podwójnych
wiązań zamiast końcówki
„en”
wprowadza się
„adien”
(dla dwóch C=C),
„atrien”
(dla trzech C=C), itp.
Lokanty wskazujące miejsce podwójnego wiązania umieszcza
się pomiędzy literką
„a”
i resztą końcówki, np.
CH
2
=CHCH
2
CH=CHCH
3
heksa-1,4-dien
Nazwy zwyczajowe (powszechnie stosowane): etylen (CH
2
=CH
2
),
propylen, butylen, izobutylen, izopren (CH
2
=C(CH
3
)-CH=CH
2
).

W węglowodorach rozgałęzionych lokalizuje się najdłuższy łańcuch
węglowy zawierający podwójne wiązanie.
2,4,4-trimetylopent-2-en
C
C
CH
3
CH
3
H
C(CH
3
)
3
Obowiązuje zasada najniższego
zestawu lokantów.
CH
2
=CH-
- winyl
CH
2
=CH-CH
2
-
- allil
1
6
2
CH
3
CH
3
1,2-dimetylocykloheks-2-en
4
3
5
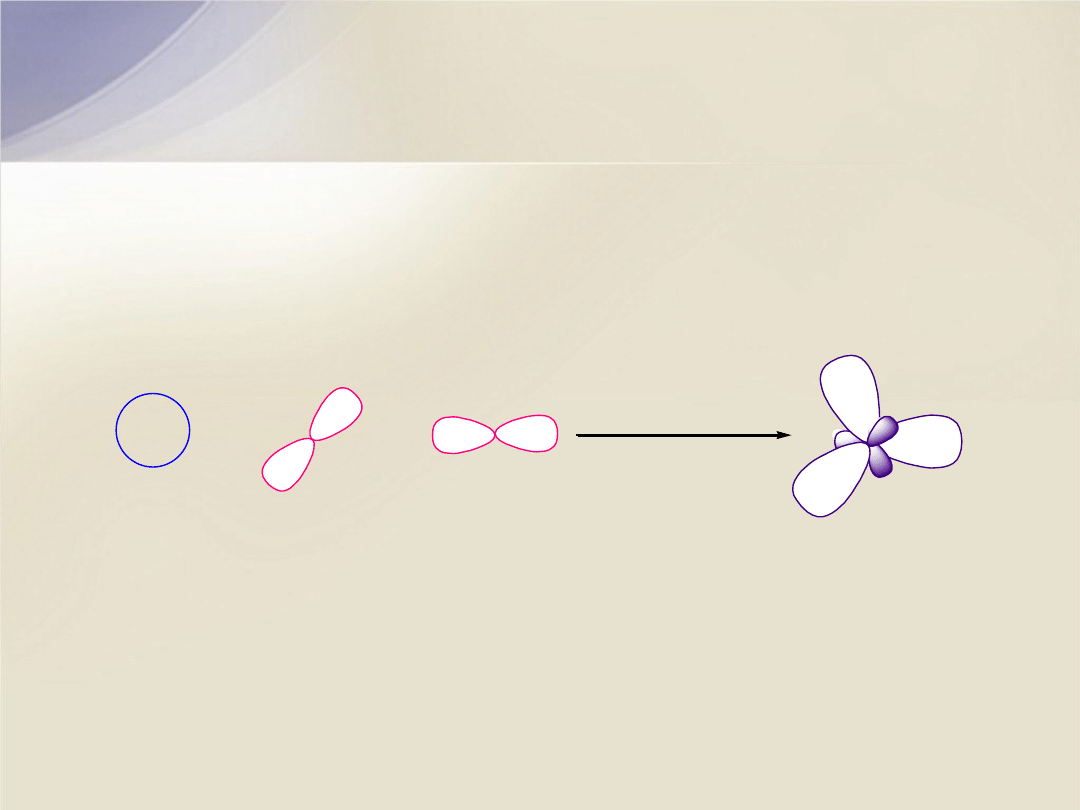
Struktura elektronowa wiązania
C=C
Wiązanie podwójne
C=C
powstaje w wyniku nałożenia się orbitali
atomów węgla, których elektrony walencyjne uległy hybrydyzacji
sp
2
.
+
+
hybrydyzacja
2s
2p
x
2p
y
sp
2
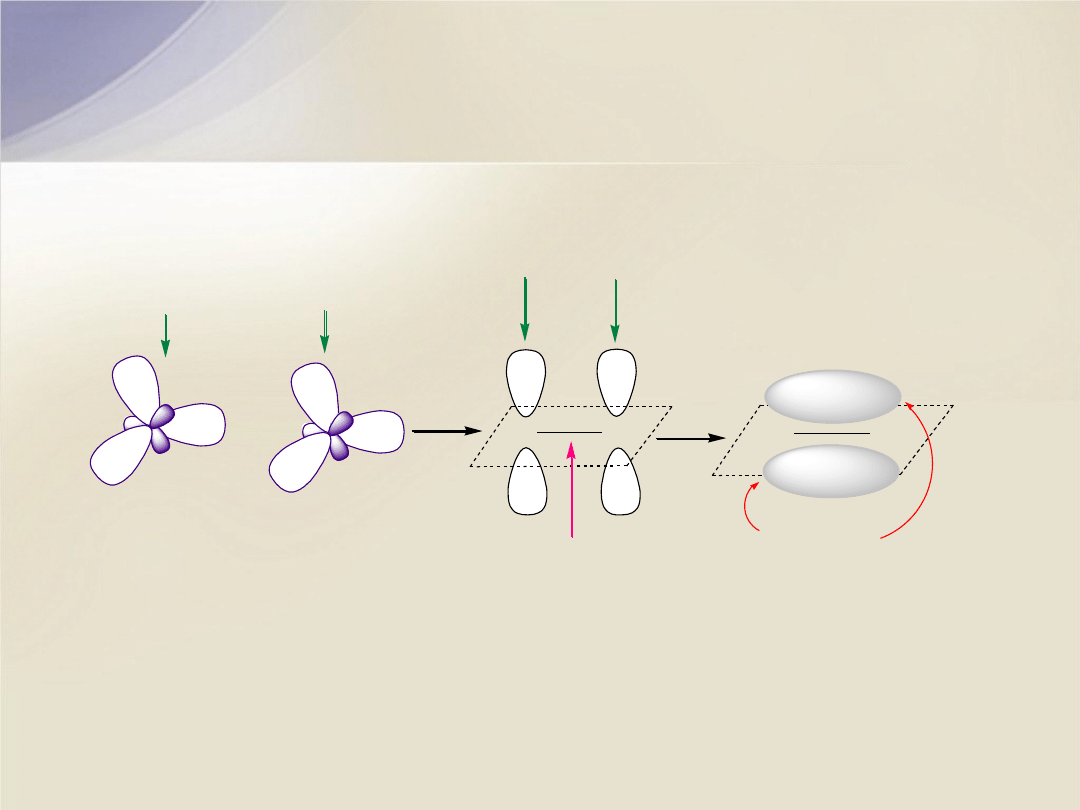
Wiązanie podwójne C=C składa się z wiązania
s
i wiązania
p
.
Hybrydyzacja
sp
2
atomu C
+
2 elektrony na
orbitalach
2p
z
sp
2
sp
2
C
C
C
C
wi
ązanie
s
orbital
p
2p
z
2p
z
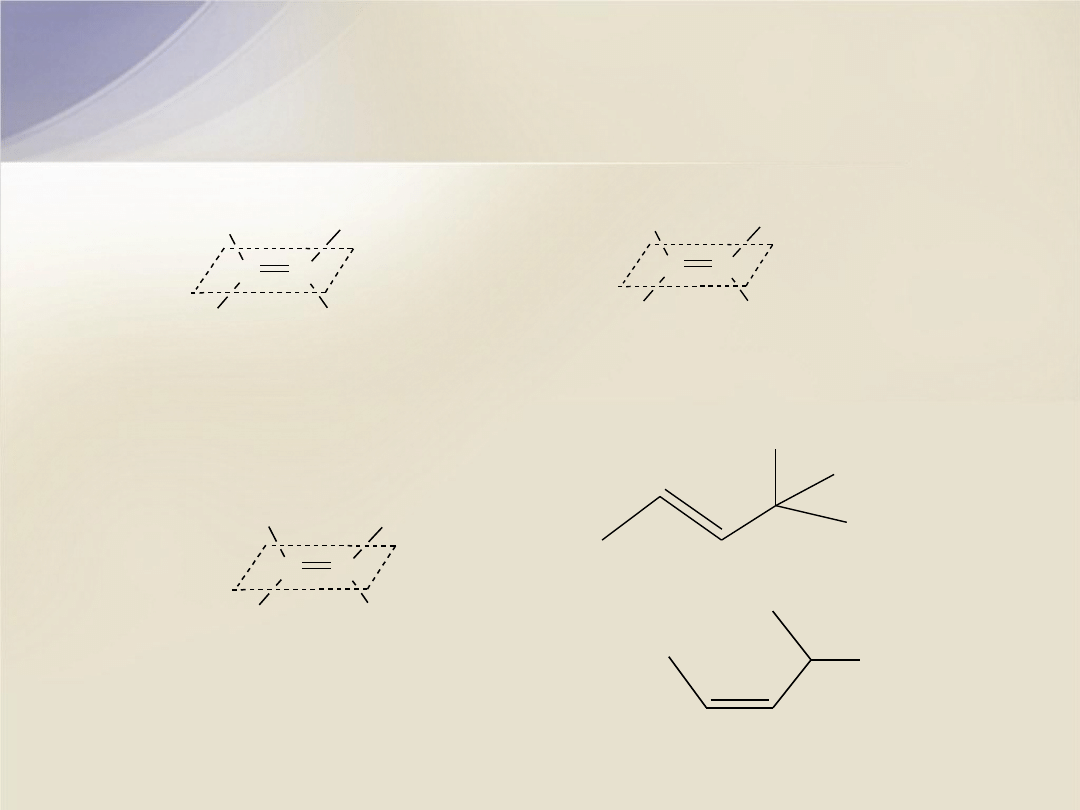
Izomeria
cis/trans
trans
-3-izopropyloheks-2-en
(
E
)-3-izopropyloheks-2-en
C
C
H
3
C
H
CH
2
CH
2
CH
3
CH(CH
3
)
2
1
1
2
2
cis
-2-bromo-1-chloro-1-fluoroeten
(
Z
)-2-bromo-1-chloro-1-fluoroeten
C
C
Br
H
Cl
F
1
1
2
2
cis
-3-izopropyloheks-2-en
(
Z
)-3-izopropyloheks-2-en
C
C
H
3
C
H
CH(CH
3
)
2
CH
2
CH
2
CH
3
1
1
2
2
(
E
)-2,2-dimetylopent-3-en
(
Z
)-2-metylopent-3-en
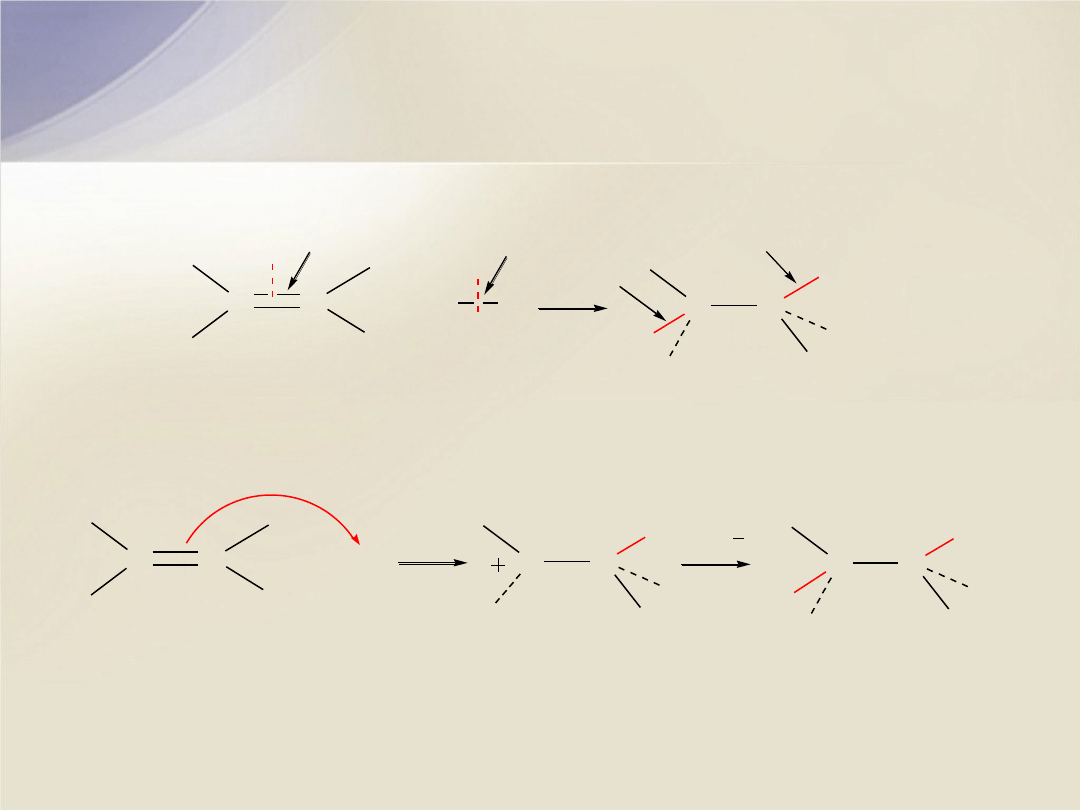
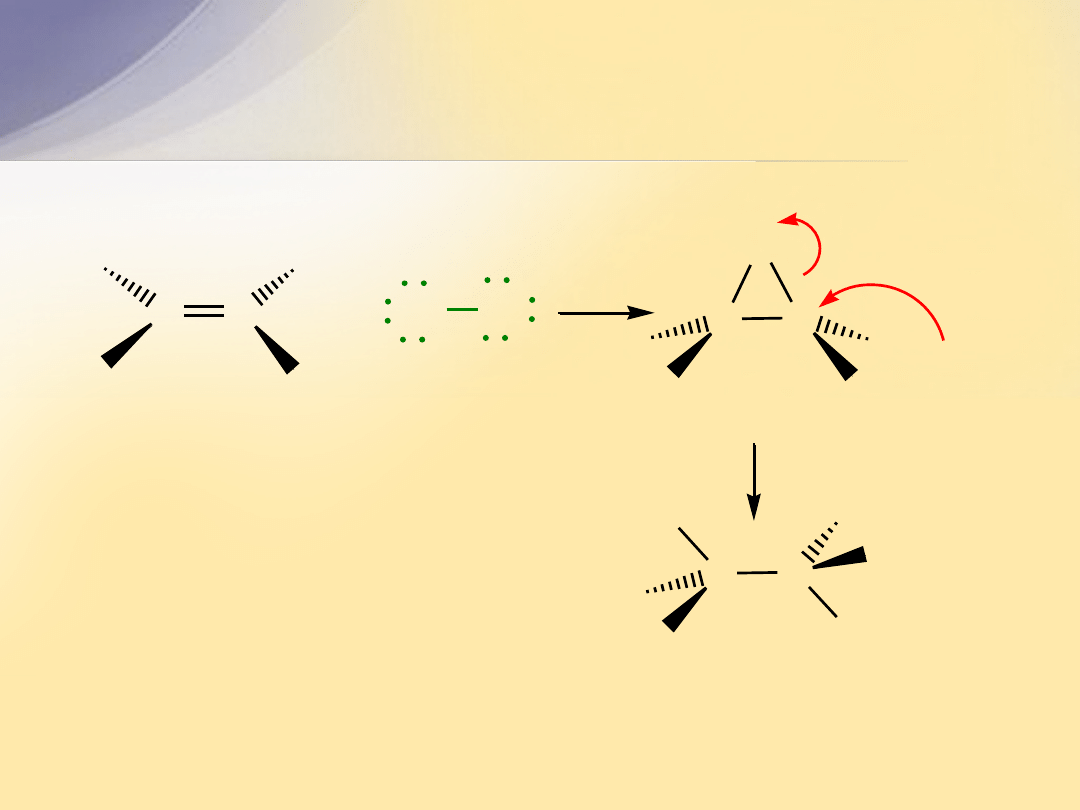
Addycja elektrofilowa (
A
E
)
C
C
p
rozerwanie
wiązania
p
+
X
Y
s
rozerwanie
wiązania
s
C
C
Y
X
s
s
utworzenie dwóch wiązań
s
C
C
+
H
+
C
C
H
karbokation
C
C
H
Cl
chloroalkan
Cl
alken
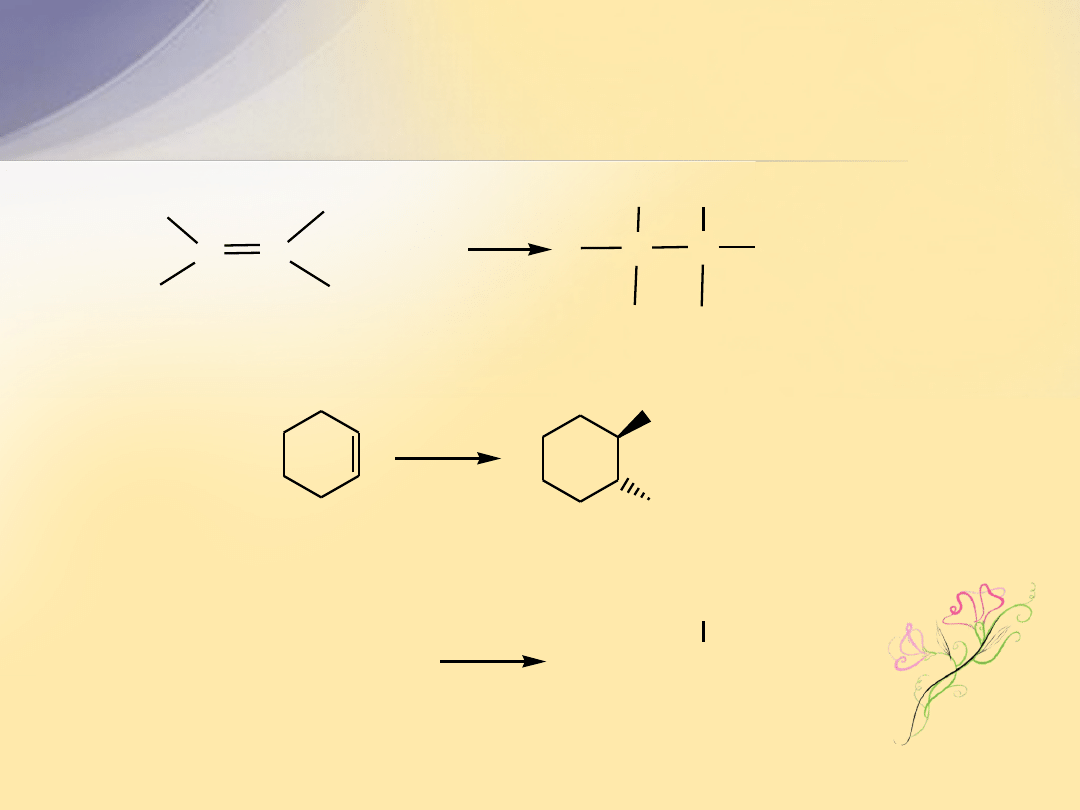
Addycja elektrofilowa halogenów
C
C
+
X
2
C
C
X
X
X
= Cl, Br
Br
2
Br
A
E
cykloheksen
1,2-dichlorobutan
CH
3
CH
2
CH=CH
2
Cl
2
but-1-en
Br
CH
3
CH
2
CH-CH
2
Cl
Cl
1,2-dibromocykloheksan
C
C
Br
Br
C
C
Br
Br
+
Br Br
Br
Br
Br
Br
polaryzacja
jonizacja
H
H
Br
2
/ CCl
4
cyklopenten
H
H
Br Br
H
H
Br
Br
H
H
Br
Br
trans-1,2-dibromocyklopentan
(tworzy się wyłącznie izomer
trans
)
Mechanizm reakcji
C
C
+
A
E
C
C
Br
+
Br
_
C
C
Br
Br
Br
Br
nieklasyczny jon bromoniowy

Reguła Markownikowa (1869 rok)
W reakcji addycji jonowej
H
-X
do podwójnego
wiązania
C=C
w alkenach atom
H
przyłącza się do
tego węgla, przy którym znajduje się więcej atomów
wodoru, zaś
X
do drugiego atomu
C
podwójnego
wiązania.
H
+
C
C
C
H
H
H
3-metylobut-1-en
H
3
C
H
3
C
H
C
C
C
H
H
H
karbokation 2
o
H
3
C
H
3
C
H
przegrupowanie
H
+
C
C
C
H
H
H
karbokation 3
o
CH
3
H
3
C
H
+
H
C
C
C
H
H
H
H
3
C
H
3
C
H
H
Cl
2-chloro-3-metylobutan
Cl
-
C
C
C
H
H
H
H
3
C
H
3
C
Cl
H
H
2-chloro-2-metylobutan
Cl
-
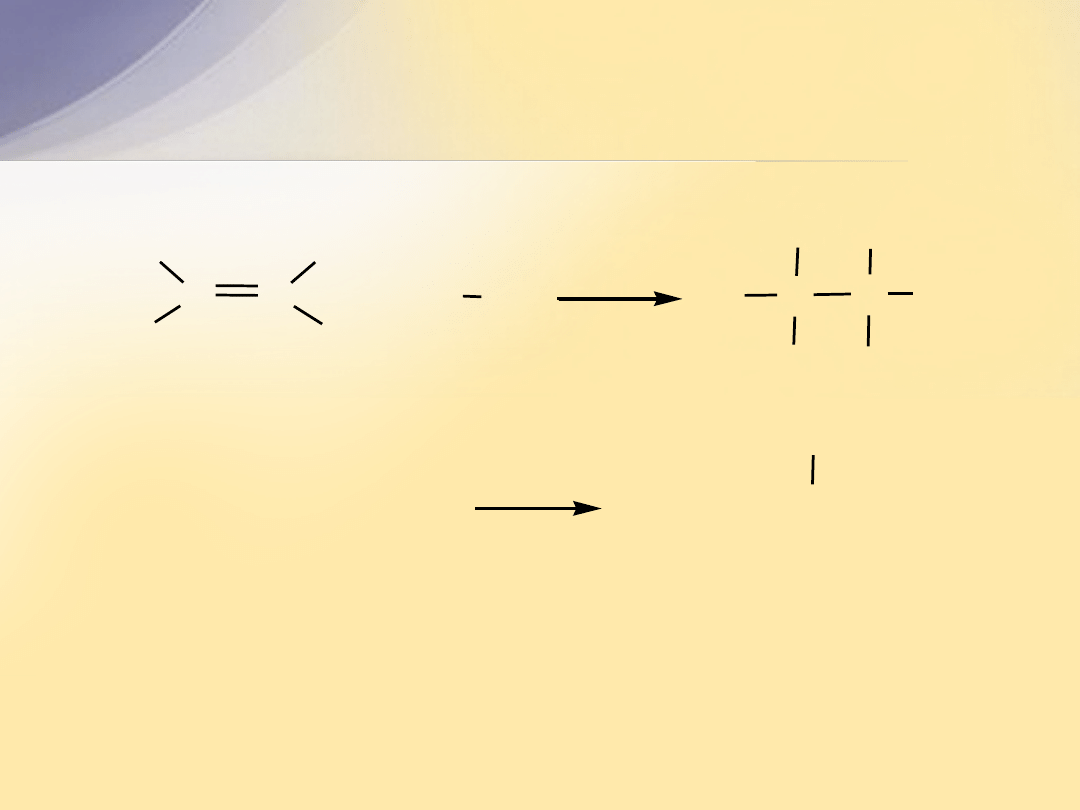
Wolnorodnikowa addycja bromowodoru
Niezgodnie
z regułą Markownikowa
C
C
R
R
H
H
+
H
Br
C
C
H
R
Br
H
R
H
(CH
3
)
2
C=CHCH
3
HBr
(CH
3
)
2
CHCHCH
3
2-bromo-3-metylobutan
2-metylobut-2-en
ROOR
Br
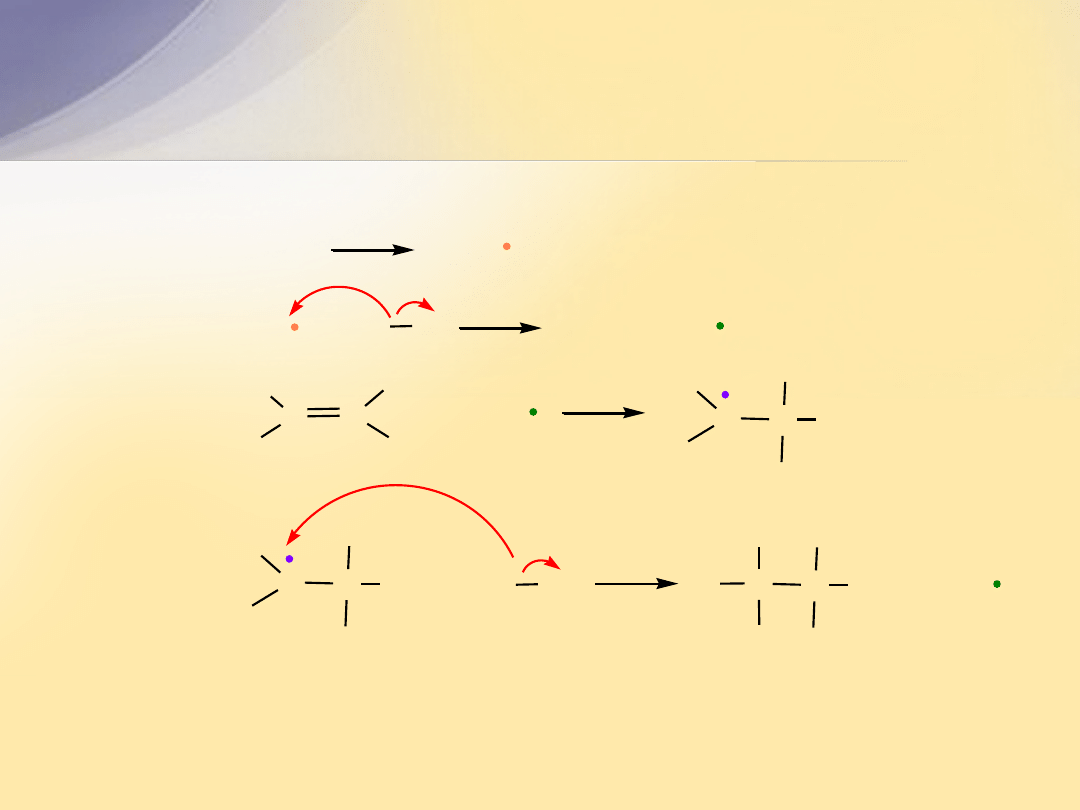
Inicjacja
ROOR
2RO
RO
+
H
Br
ROH +
Br
Propagacja
C
C
R
R
H
H
+
Br
C
C
R
R
H
H
Br
C
C
R
R
H
H
Br
+
H
Br
C
C
R
R
H
H
Br +
Br
H
Mechanizm reakcji
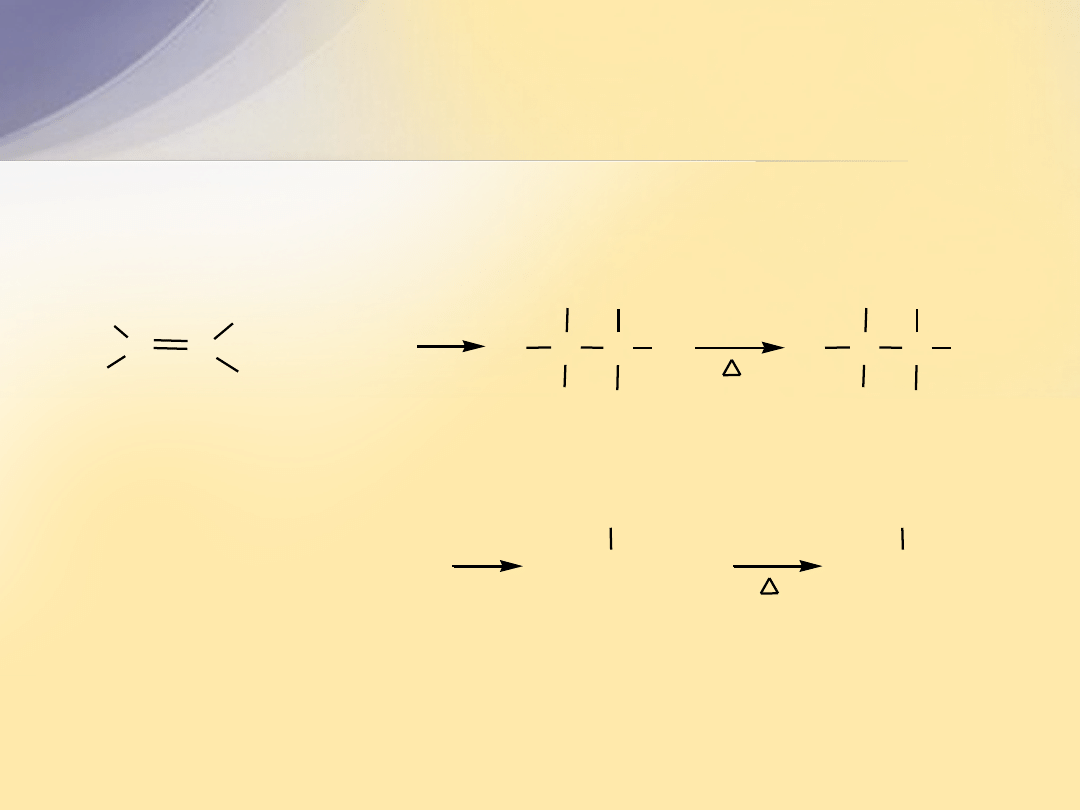
Addycja elektrofilowa kwasu siarkowego.
Tworzenie alkoholi
C
C
H
H
R
R
+
H
2
SO
4
C C
H
H
OSO
3
H
R
H
R
CH
3
CH=CH
2
CH
3
CHCH
3
wodorosiarczan
izopropylu
prop-1-en
C C
H
H
OH
R
H
R
H
2
O
+
H
2
SO
4
OSO
3
H
H
2
O
CH
3
CHCH
3
propan-2-ol
OH
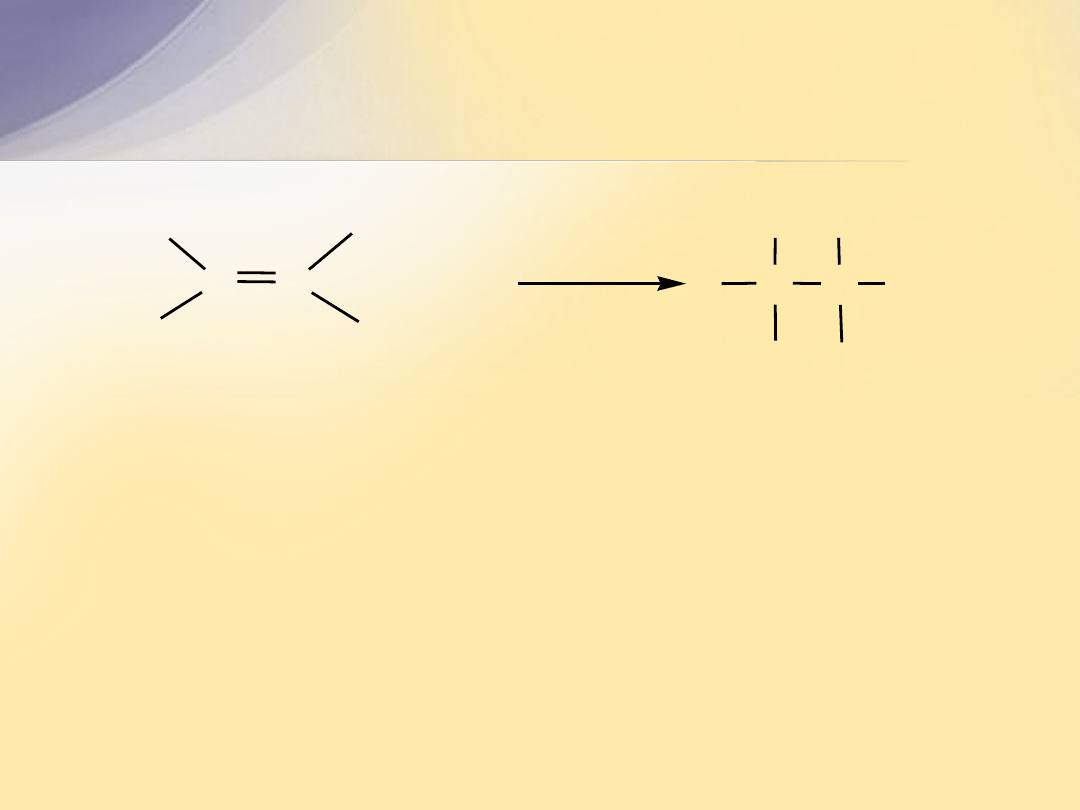
Katalityczne uwodornienie
Uwodornienie alkenów jest reakcją egzotermiczną, ponieważ
tworzące się dwa nowe wiązania
C-H
typu
s
są mocniejsze od
rozrywanych wiązań H-H
(s
) i C-C
(p).
Ilość wydzielonego ciepła
w wyniku uwodornienia 1 mola alkenu nazywa się ciepłem uwodornienia
(ciepłem hydrogenacji). Średnia wartość ciepła uwodornienia 1 mola
C=C
wynosi 30 kcal/mol (126 kJ/mol).
Katalizator obniża energię aktywacji reakcji zwiększając jej szybkość.
W cząsteczkach zaadsorbowanych na powierzchni katalizatora
dochodzi do rozluźnienia wiązań
s
H-H i
p
w C-C, a tym samym ich
rozerwanie i utworzenie nowych wiązań
C-H
staje się łatwiejsze.
C
C
H
2
+
katalizator
C C
H H
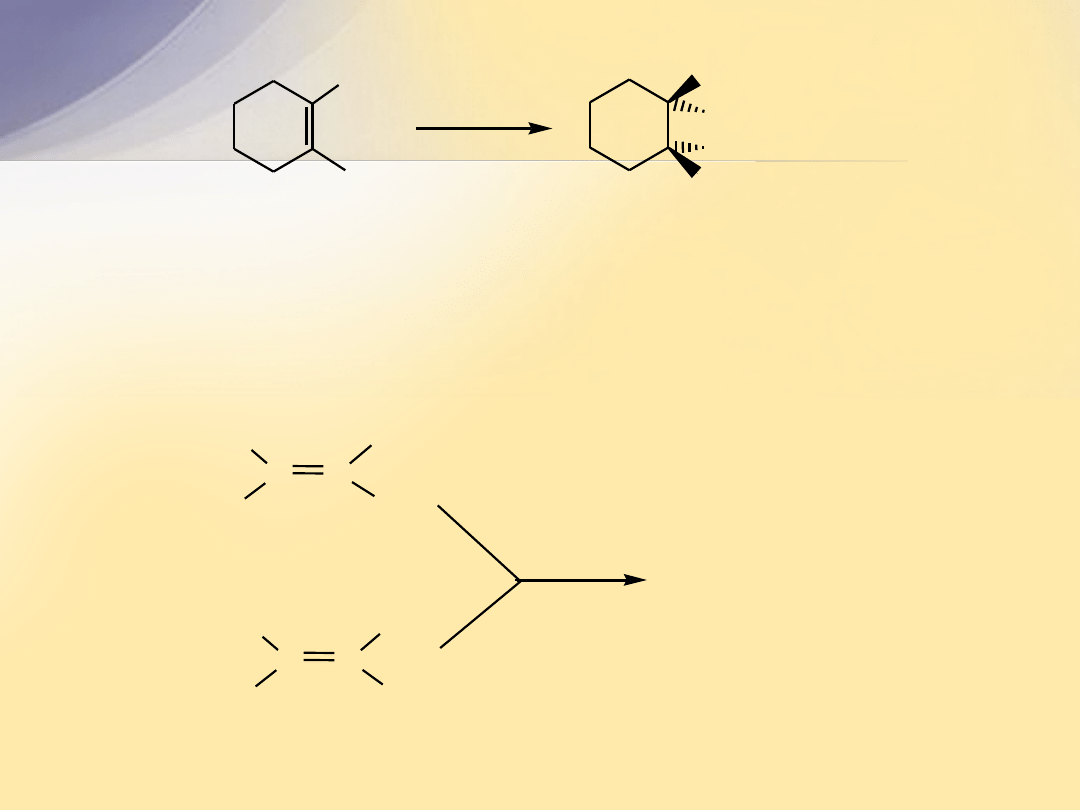
CH
3
1,2-dimetylocykloheksen
H
2
/Pt
CH
3
CH
3
CH
3
H
H
cis-1,2-dimetylocykloheksan
W reakcji uwodornienia
cis
-but-2-enu wydziela się 28,6 kcal/mol,
a
trans
-but-2-enu 27,6 kcal/mol, co oznacza, że izomer
trans
jest
trwalszy od
cis
o 1 kcal/mol. Im bardziej trwały jest substrat, tym mniej
wydzieli się energii cieplnej podczas przejścia od substratu do produktu.
C
C
H
3
C
H
CH
3
H
H
2
/Pt
cis
-but-2-en
CH
3
CH
2
CH
2
CH
3
C
C
H
3
C
H
H
CH
3
trans
-but-2-en
n-butan
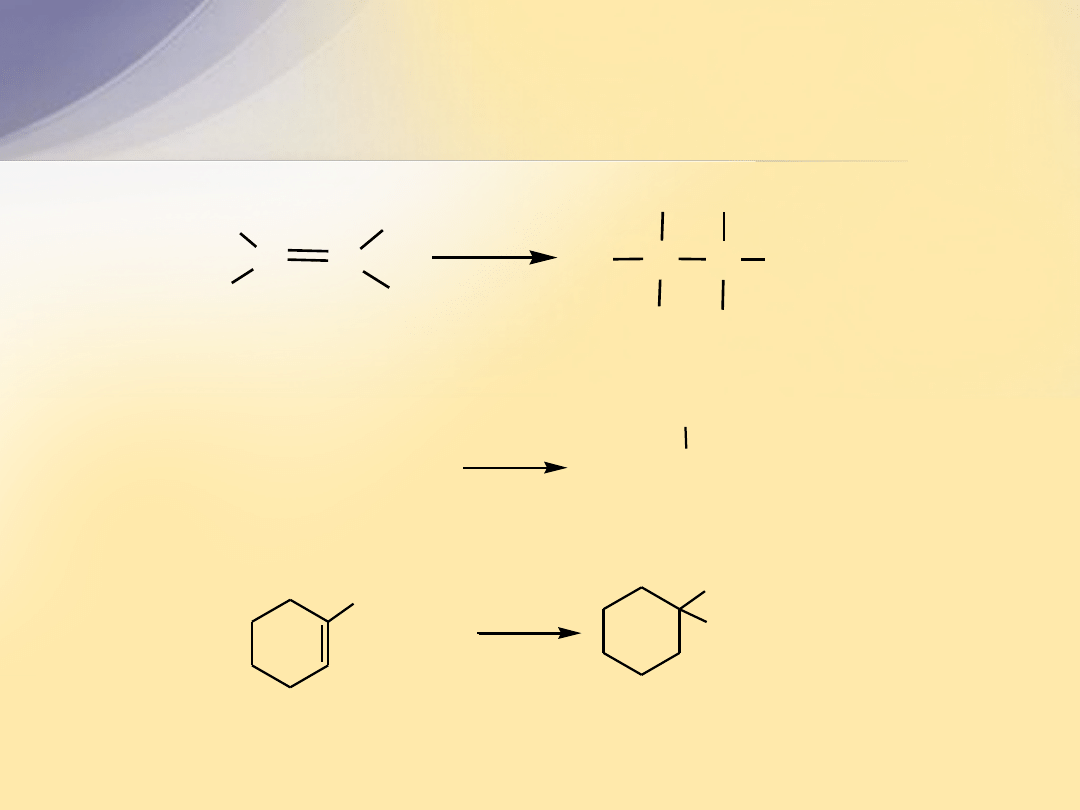
Kwasowo-katalizowana hydratacja alkenów
C
C
H
H
R
R
C C
H
H
OH
R
H
R
H
3
O
+
(CH
3
)
2
C=CH
2
2-metyloprop-1-en
H
3
O
+
(CH
3
)
2
C-CH
3
OH
tert-butanol
CH
2
CH
3
H
3
O
+
CH
2
CH
3
OH
1-etylocykloheksen
1-etylocykloheksanol
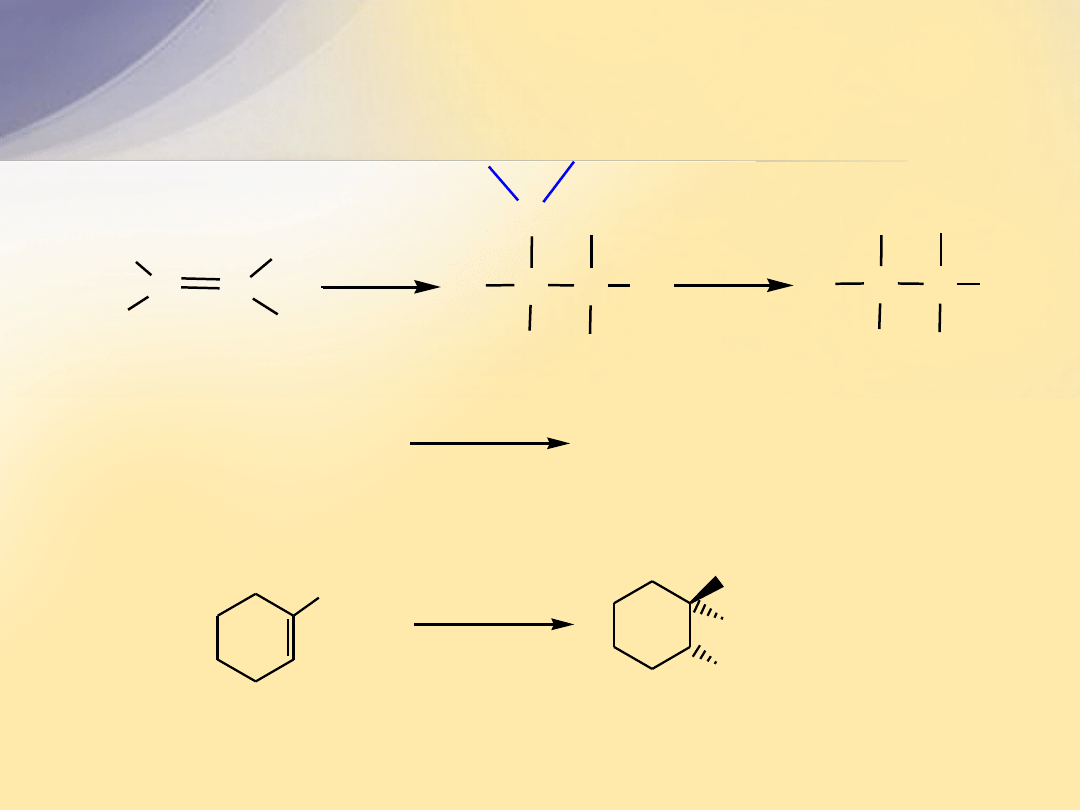
Hydroborowanie z następczym utlenianiem
C
C
H
H
R
R
C C
H
H
R
H
R
B
2
H
6
B
H
2
O
2
OH
-
C C
H
H
R
H
R
OH
(CH
3
)
2
C=CH
2
2-metyloprop-1-en
(CH
3
)
2
CH-CH
2
OH
2-metylopropan-1-ol
CH
3
1-metylocykloheksen
trans-2-metylocykloheksanol
1. B
2
H
6
2. H
2
O
2
, OH
-
1. B
2
H
6
2. H
2
O
2
, OH
-
CH
3
H
OH
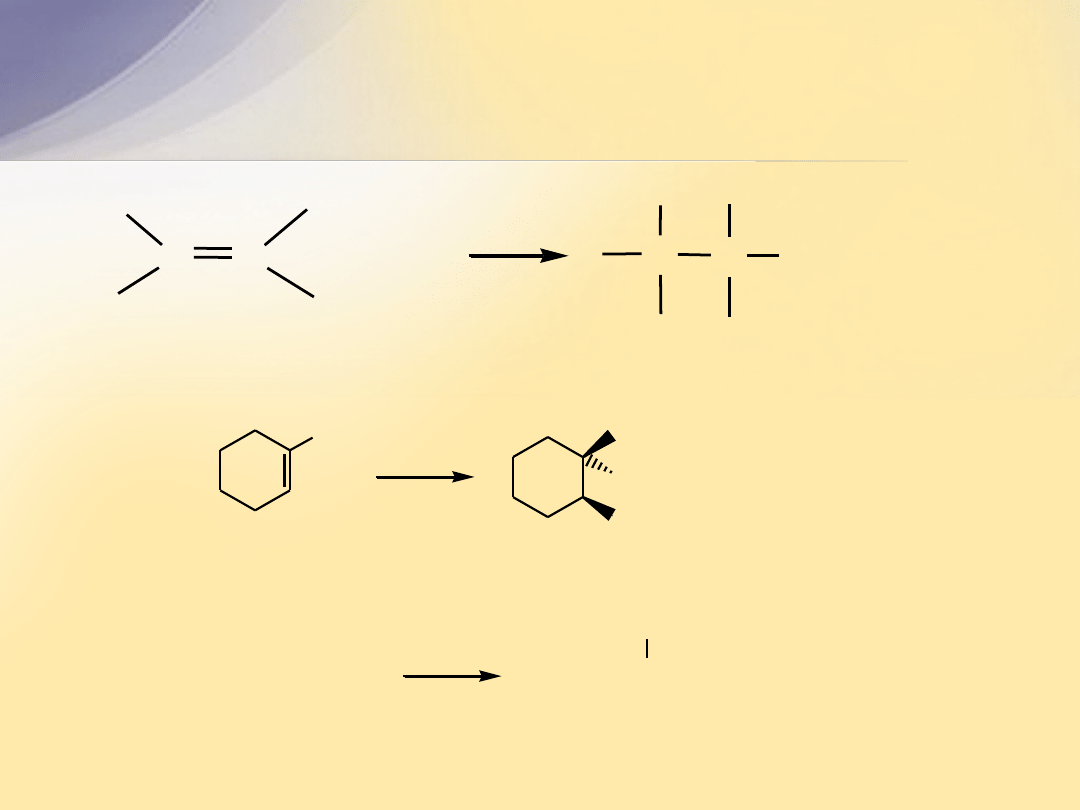
Tworzenie wicynalnych halohydryn
Br
2
CH
3
1-metylocykloheksen
1-chlorobutan-2-ol
CH
3
CH
2
CH=CH
2
Cl
2
but-1-en
Br
CH
3
CH
2
CH-CH
2
Cl
OH
2-bromo-1-metylocykloheksanol
H
2
O
CH
3
H
2
O
+
HCl
+
HBr
OH
C
C
+
X
2
C
C
X
OH
X
= Cl, Br
H
2
O
+
HX
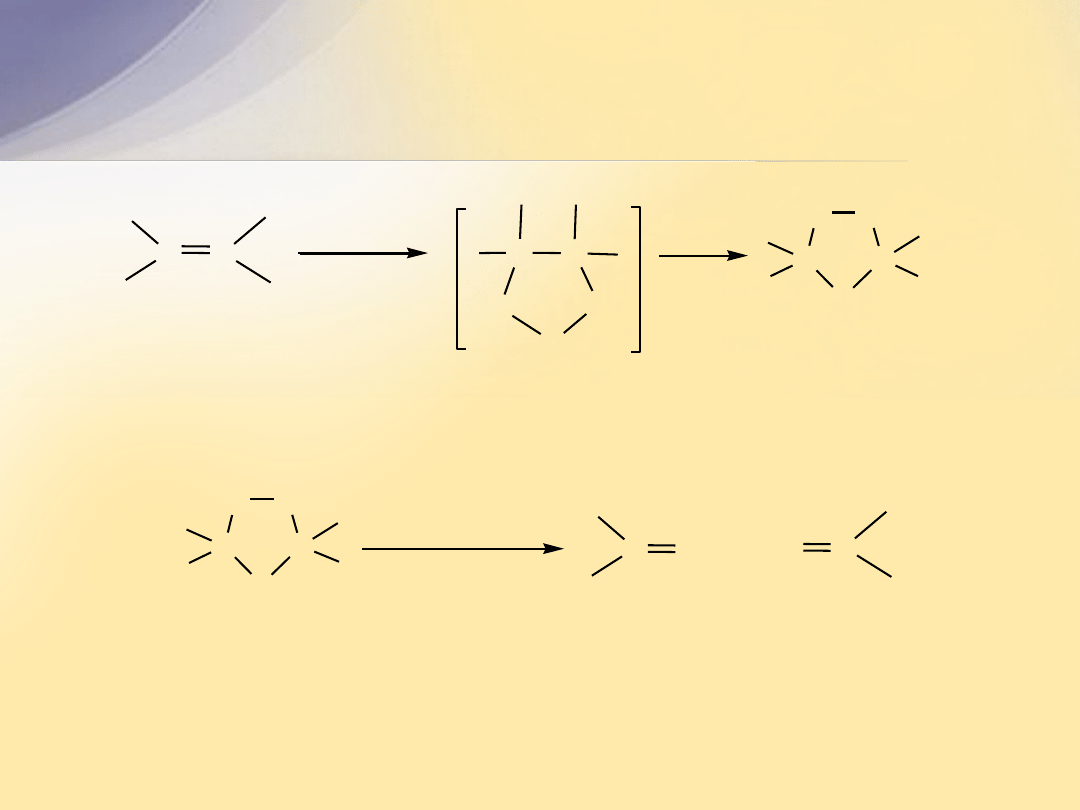
Ozonoliza –
reakcja rozkładu wiązania C=C pod wpływem ozonu
C
C
O
3
,
-78
o
C
CH
2
Cl
2
C
C
O
O
O
molozonek
(bardzo nietrwa
łe i szybko ulegają
przegrupowaniu i przekształcają się w
ozonki
)
C
C
O
O
O
ozonek
Zn/AcOH/H
2
O
C
O
C
C
O
O
O
ozonek
O
C
+
zwi
ązki karbonylowe
(aldehydy lub ketony)
Środowisko redukujące chroni powstające związki karbonylowe
przed dalszym utlenieniem do kwasów karboksylowych.
2. Zn/H
+
/H
2
O
(CH
3
)
2
C=CHCH
3
2-metylobut-2-en
acetaldehyd
CH
3
1-metylocykloheksen
hept-1-al-6-on
1. O
3
C
O
H
3
C
H
3
C
O
C
H
CH
3
+
aceton
2. Zn/H
+
/H
2
O
1. O
3
CH
3
CCH
2
CH
2
CH
2
CH
2
CH
O
O
2. Zn/H
+
/H
2
O
1. O
3
pentano-1,5-dial
HCCH
2
CH
2
CH
2
CH
O
O
cyklopenten
Oksyrtęciowanie alkenów
Octan rtęci ulega przyłączeniu do alkenów w temp. pokojowej, a produkt
reakcji można zredukować do alkoholu, najłatwiej za pomocą
tetrahydroboranu sodu (NaBH
4
).
Reakcja zachodzi zgodnie z regułą Markownikowa.
1.
Hg(OAc)
2
, H
2
O/THF
2. NaBH
4
CH
3
CH
3
1-metylocyklopenten
1-metylocyklopentanol
OH
C
6
H
5
CH=CH
2
1-fenyloetanol
fenyloeten
(styren)
C
6
H
5
CHCH
3
OH
1. Hg(OAc)
2
, H
2
O/THF
2. NaBH
4,
-
OH
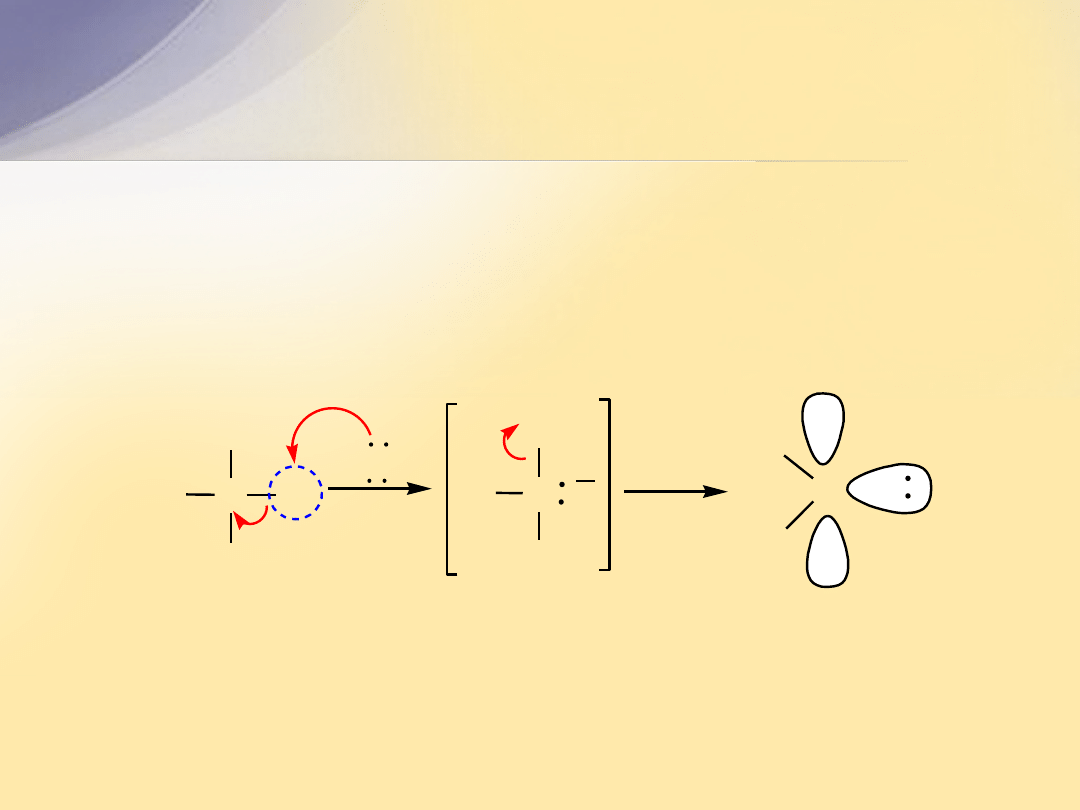
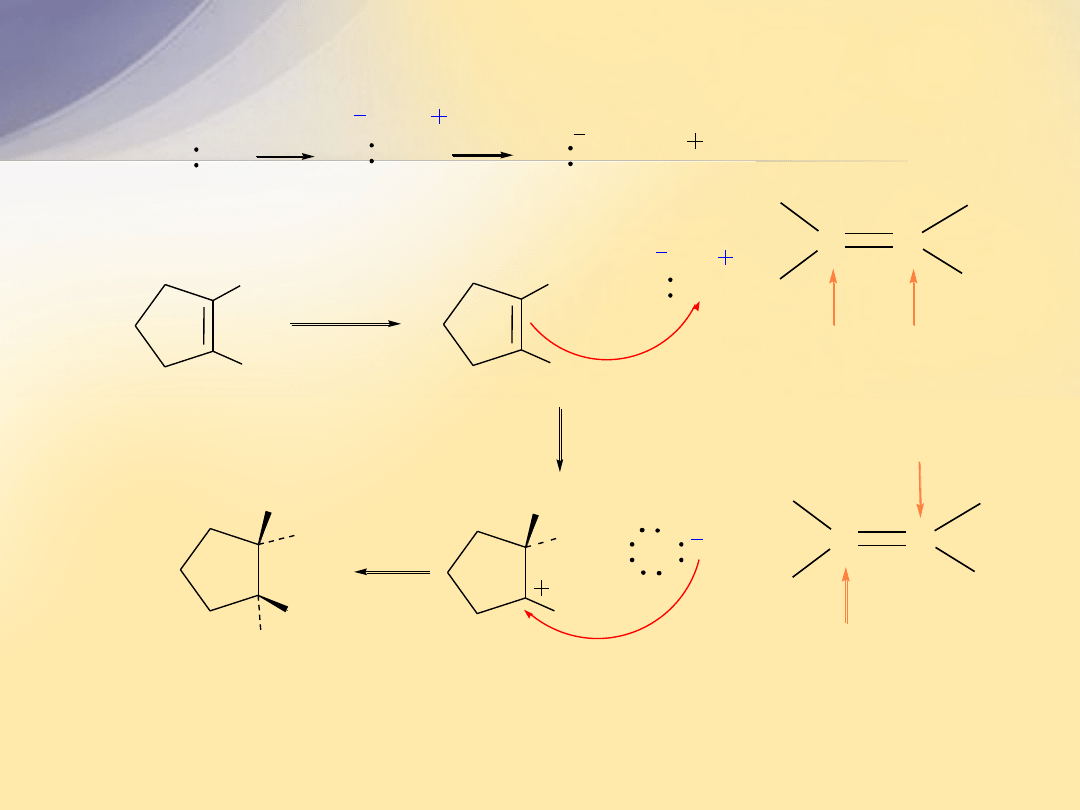
Addycja karbenów do wiązania
C=C
Karben
jest bardzo reaktywnym ugrupowaniem
powstającym w wyniku oderwania przez silną zasadę atomu
wodoru i atomu chloru. Atom węgla w karbenie jest płaski i ma
hybrydyzację
sp
2
. Wolna para elektronów zajmuje orbital
sp
2
,
a
p
jest nieobsadzony.
Karben
tworzy się najczęściej z chloroformu
in situ
w reakcji z KOH.
chloroform
Cl
C
H
Cl
Cl
KOH
- H
+
Cl
C
Cl
Cl
- Cl
-
Cl
C
Cl
p
sp
2
anion
trichlorometylowy
dichlorokarben
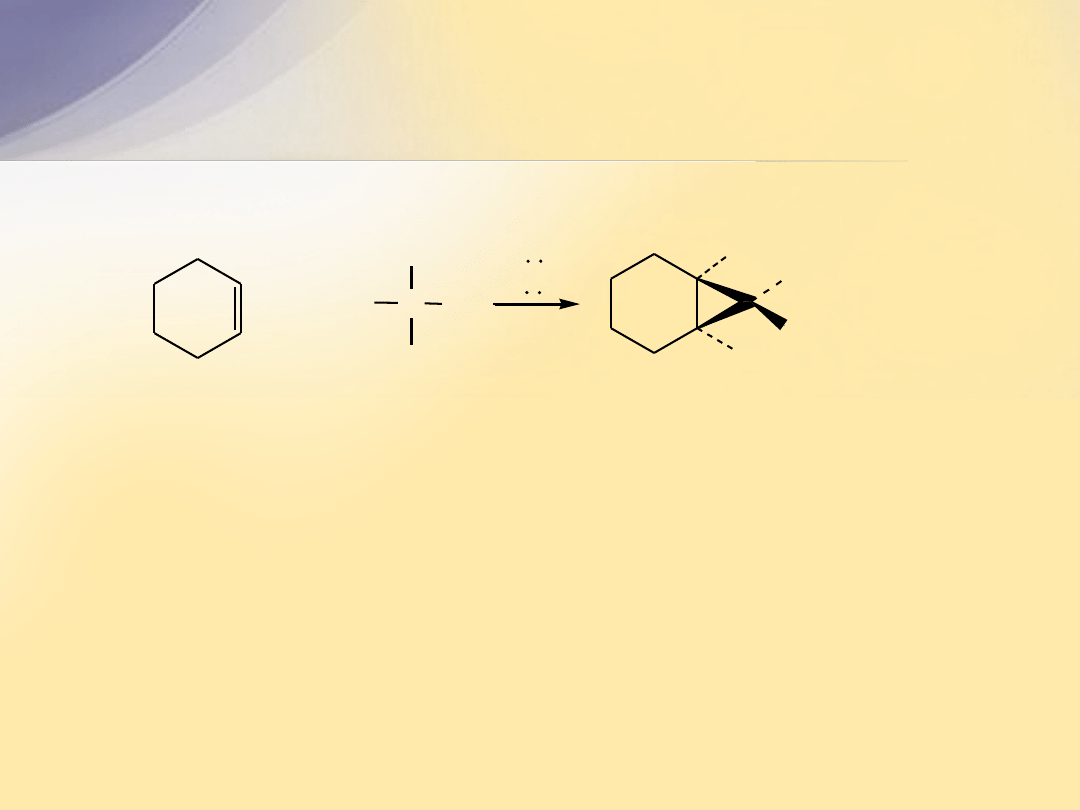
Karben
przyłącza się do alkenów stereoselektywnie
i tworzy się trójczłonowy układ cykliczny.
chloroform
Cl
C H
Cl
Cl
KOH
- H
+
+
cykloheksen
H
H
Cl
Cl
+
KCl
7,7-dichlorobicyklo[4.1.0]heptan
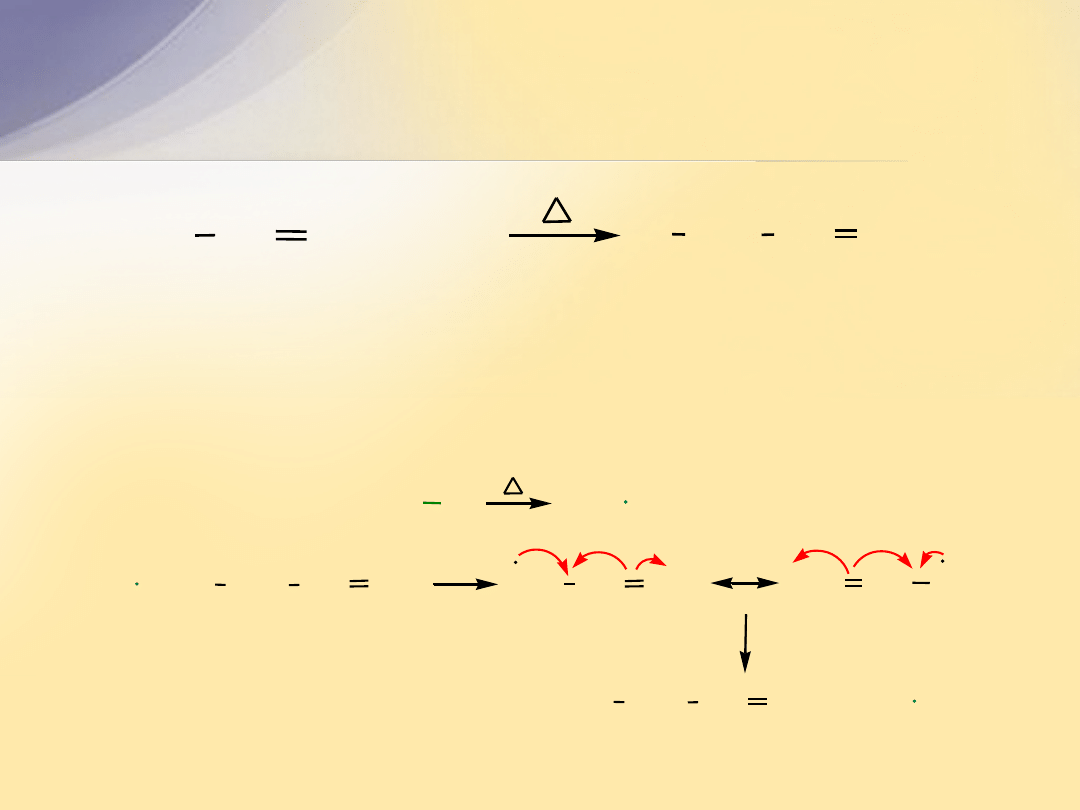
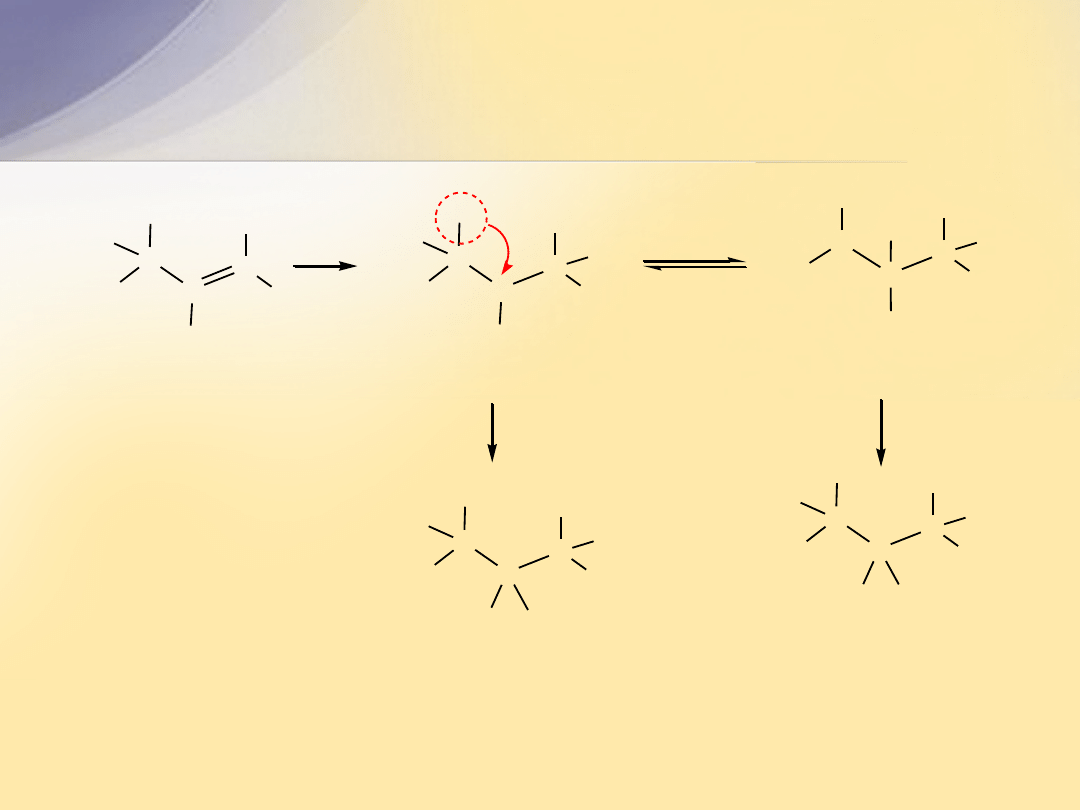
Halogenowanie w pozycji allilowej
Reakcja biegnie mechanizmem rodnikowym. Rodnik chlorkowy przekształca
propen w mezomerycznie stabilizowany rodnik allilowy, który z chlorem
tworzy chlorek allilu i rodnik chlorkowy.
CH
CH
2
CH
3
+
Cl
2
prop-1-en
3-chloroprop-1-en
(chlorek allilu)
CH CH
2
CH
2
Cl
Cl Cl
2 Cl
Cl
+
CH CH
2
CH
2
H
CH CH
2
CH
2
CH CH
2
CH
2
Cl
2
CH CH
2
CH
2
Cl
+
Cl
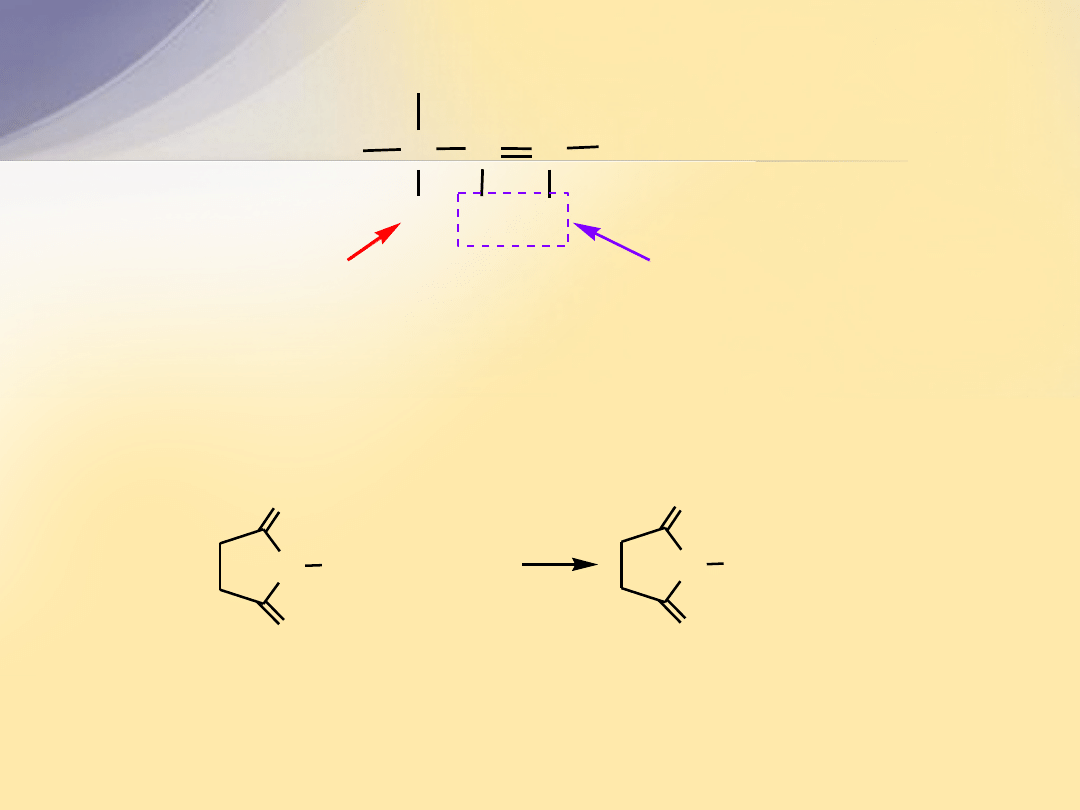
Odczynnikiem służącym do bromowania jest
N
-bromosukcynoimid
(
NBS
). W obecności HBr uwalnia on Br
2
, który ulega
rozszczepieniu na rodniki.
C
C
C
H
H
H
winylowe atomy wodoru,
mało reaktywne
allilowy atom wodoru,
bardzo reaktywny
N-bromosukcynoimid
(NBS)
+ HBr
N Br
O
O
+ Br
2
N H
O
O
sukcynoimid
(imid kwasu bursztynowego))
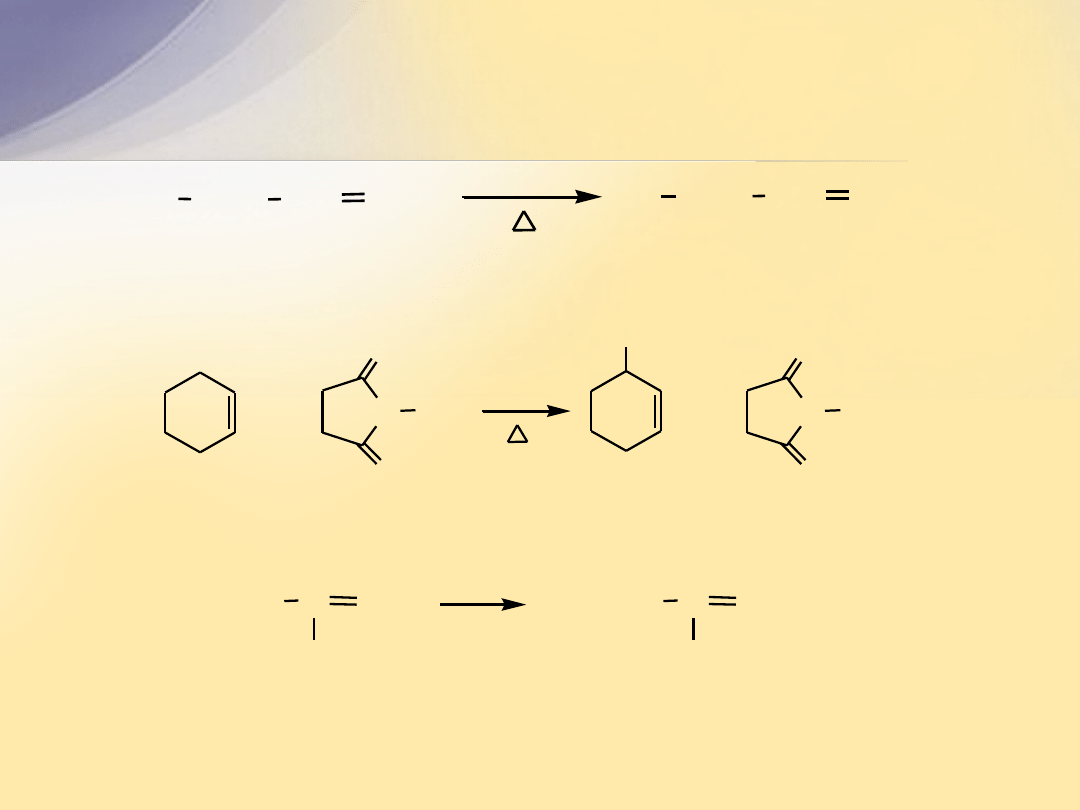
3-bromoprop-1-en
(bromek allilu)
CH CH
2
CH
2
H
CH CH
2
CH
2
Br
NBS
prop-1-en
C
CH
2
(CH
3
)
3
C
2,3,3-trimetylobut-1-en
NBS
CH
3
C
CH
2
(CH
3
)
3
C
CH
2
Br
2-(bromometylo)-3,3-dimetylobut-1-en
+
N Br
O
O
N H
O
O
sukcynoimid
NBS
CCl
4
+
Br
cykloheksen
3-bromocykloheksen
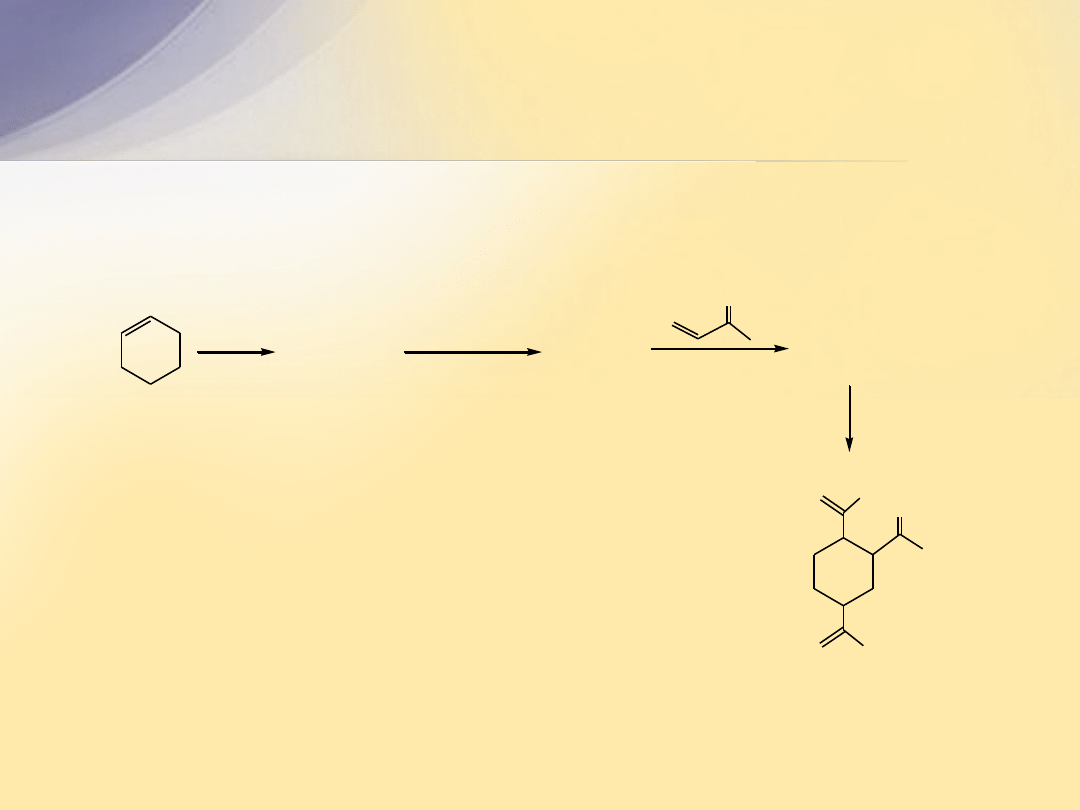
Pytanie
Uzupełnij ciąg reakcji podając wzory strukturalne dla
związków
A
,
B
oraz
C
.
NBS
cykloheksen
CCl
4
A
(C
6
H
9
Br)
(CH
3
)
3
CO
-
K
+
B
(C
6
H
8
)
O
C
(C
10
H
14
O)
1. O
3
2. Zn, H
2
O
H
CH
3
O
O
H
O
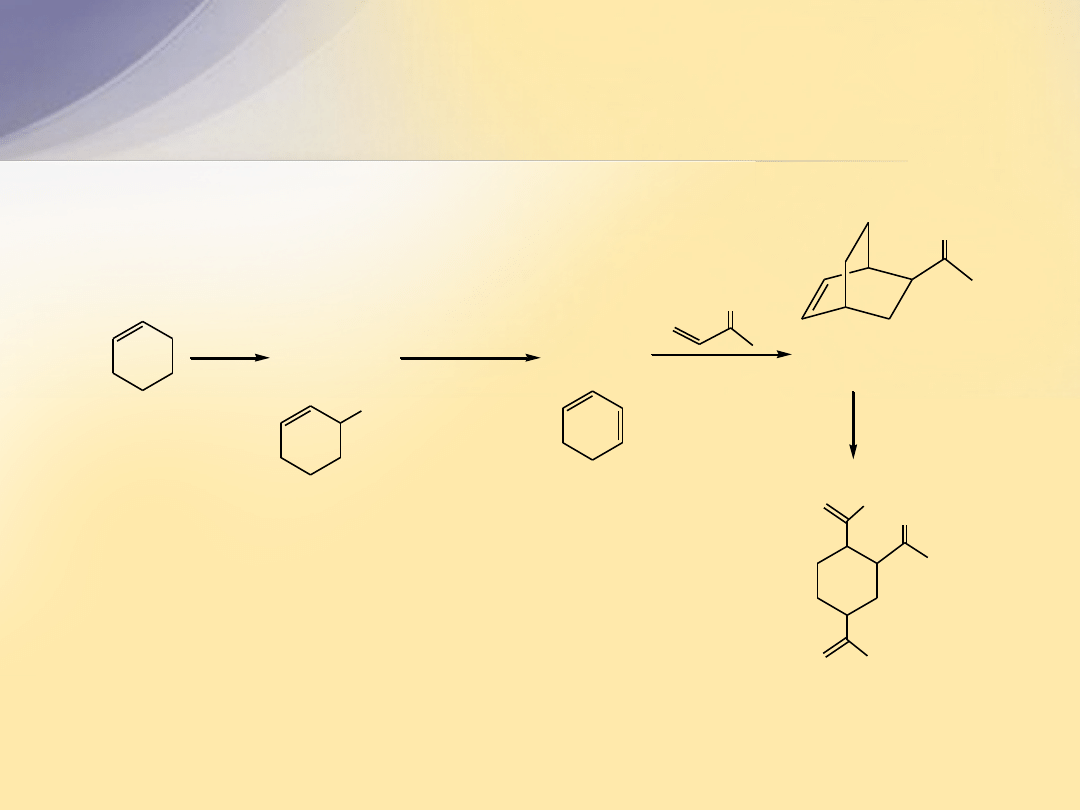
Odpowiedź
NBS
cykloheksen
CCl
4
A
(C
6
H
9
Br)
(CH
3
)
3
CO
-
K
+
B
(C
6
H
8
)
O
C
(C
10
H
14
O)
1. O
3
2. Zn, H
2
O
H
CH
3
O
O
H
O
Br
O
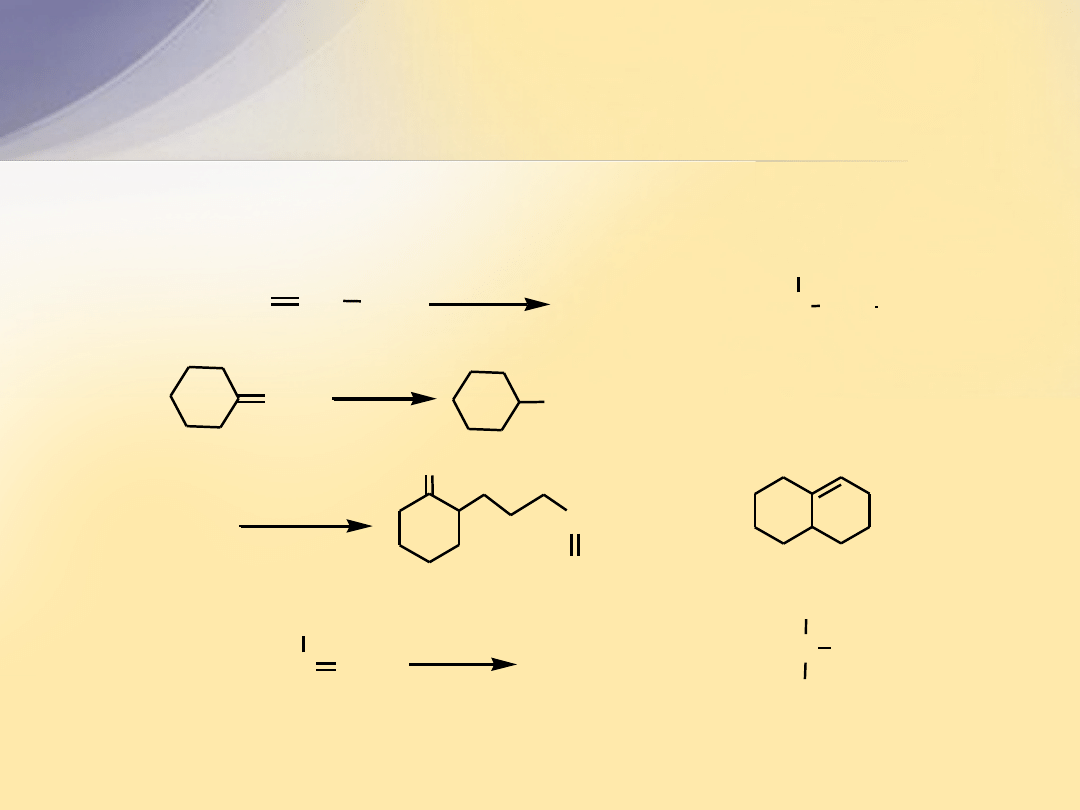
Pytanie
Podaj produkty następujących reakcji:
Odpowiedź
CH CH
3
(CH
3
)
2
C
H
2
SO
4
roz.
b.
a.
?
?
CH
2
CH
2
Br
c.
O
CH
O
?
1. O
3
2. H
2
O, Zn
d.
CH
3
CH
2
C
CH
2
CH
3
Br
2
H
2
O
?
CH
2
CH
3
(CH
3
)
2
C
OH
HBr / nadtlenki
CH
3
CH
2
C CH
2
Br
CH
3
OH

Dziękuję za uwagę
Wyszukiwarka
Podobne podstrony:
Alkeny i alkiny id 58008 Nieznany (2)
Chemia Alkeny
CO 03 W alkeny trzewik
ALKENY
ściągi chemia szereg homologiczny alkany, alkeny, alkiny
Alkeny, Alkiny, Alkeny , Alkiny
II ALKENY
Zadania, alkeny
alkany alkeny alkiny id 57988 Nieznany
Alkany, alkeny, alkiny i SE do aromatu
chemia alkeny i inne
ALKENY I CYKLOALKENY
alkeny
chem2010 zad alkeny odp1pl
chemia Alkeny,Alkany,Alkiny
alkeny
alkeny
więcej podobnych podstron