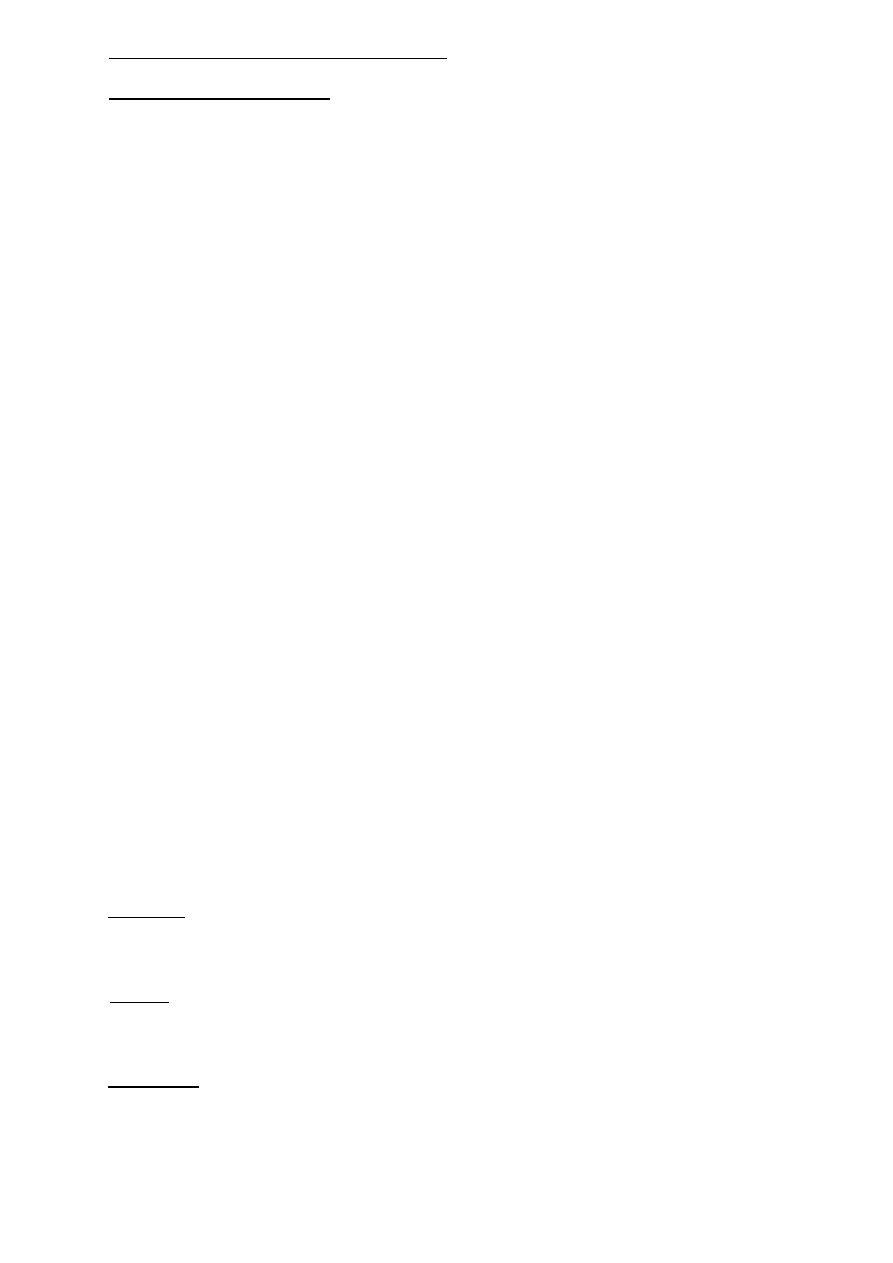
1
Zagadnienia do wykładu z BIOCHEMII
Wprowadzenie do Biochemii
1. Czym zajmuje się biochemia?
BIOCHEMIA – dyscyplina naukowa opisująca składniki chemiczne organizmów (biochemia
statyczna) oraz przemiany tych składników (biochemia dynamiczna). Całość procesów
życiowych tzn. ogół reakcji chemicznych w organizmie żywym nazywamy metabolizmem, a
substancje uczestniczące w tych reakcjach nazywamy metabolitami.
2. Jakimi cechami charakteryzują się reakcje biochemiczne?
*regulowanie ich przebiegu przez biokatalizatory zwane enzymami
*powiązanie z określonymi strukturami komórkowymi
*istnienie precyzyjnych mechanizmów integrujących poszczególne reakcje i procesy
biochemiczne
*wymaganie tzw. fizjologicznych warunków przebiegu reakcji
*skojarzenie z przemianami energetycznymi
Ta ostatnia cecha jest wspólna zarówno reakcjom biochemicznym jak również chemicznym.
3. Co oznacza powiązanie reakcji biochemicznych z określonymi strukturami
komórkowymi?
W
komórce
zachodzą
różnorodne
życiowe
procesy.
Zachodzid
mogą
one
jedynie
w określonych warunkach. Z tego względu w trakcie ewolucji komórka podawana była wielokrotnym
przekształceniom, które prowadziły do wykształcenia struktur specjalistycznych, umożliwiających lub
wspomagających zachodzenie poszczególnych procesów w sposób jak najbardziej efektywny i
energooszczędny.
Budowa określonej struktury, jej właściwości, jak i obecnośd określonych enzymów posiadają ścisły
związek
z
funkcją
przez
nią
pełnioną,
zatem
również
z
zachodzącymi
w niej reakcjami biochemicznymi.
Przykłady:
- cytoplazma jest wielofazowym układem, zmieniającym łatwo własny stan skupienia. Czasem zachowuje
się jak substancja półpłynna (zol), a czasem jak półstała (żel). Dzięki niemal obojętnemu pH, stanowi
skupienia, a także obecności wielu enzymów stanowi środowisko dla większości reakcji biochemicznych.
- lizosomy są małymi, otoczonymi pojedynczą błoną organellami, które mają lityczne zdolności, dzięki
zawartości szeregu enzymów trawiennych rozkładających białka, kwasy nukleinowe, lipidy oraz
węglowodany.
- mitochondria są miejscem oddychania komórkowego.
Błona zewnętrzna mitrochondrium jest gładka, a
wewnętrzna - pofałdowana, posiada tzw. grzebienie po to, by stworzyd więcej miejsca na wytworzenie
energii. W grzebieniach znajdują się kanały białkowe, tzw. oksysomy, na szczycie których powstaje nośnik
energii ATP.

2
4. Jak należy rozumieć „istnienie precyzyjnych mechanizmów integrujących poszczególne
reakcje i procesy biochemiczne”?
Jeżeli organizm funkcjonuje normalnie, każda reakcja, która w nim zachodzi wynika z jego
potrzeb. Jeżeli dana komórka potrzebuje jakiegoś składnika to w zależności od dostępnych
surowców wybiera określony szlak, aby go wytworzyć ( ten składnik).
5. Co to są „fizjologiczne warunki przebiegu reakcji biochemicznych”?
Aby dana reakcja nastąpiła muszą występować odpowiednie warunki: ciśnienie, temperatura,
obecność substratu i enzymów niezbędnych do zajścia danej reakcji.
Dane reakcje mogą zajść tylko w odpowiednich warunkach, a niekiedy także muszą je poprzedzać
odpowiednie procesy, bez których dana reakcja nie może zajść. Fizjologicznymi warunkami
można nazwać te panujące w organizmach żywych i zapewniające trwałość oraz efektywne
działanie enzymów białkowych. Np. temp. około 36,6 st C i pH około 7 w organizmie człowieka.
6. Czym różni się wiązanie jonowe od wiązania atomowego związków chemicznych?
W wiązaniu jonowym atom silnie elektroujemny przejmuje elektron(y) walencyjne atomu słabo
elektroujemnego (elektrododatniego). W wiązaniu jonowym siły elektrostatyczne przyciągania
zapewniają trwałość cząsteczkową.
W wiązanie kowalencyjne (atomowe) polega na uwspólnieniu elektronów walencyjnych przez
parę atomów o jednakowej elektroujemności bądź elektroujemności zbliżonej (wiązanie
kowalencyjne spolaryzowane).
7. Podaj nazwy głównych grup funkcyjnych związków chemicznych
–OH – grupa hydroksylowa
-CO0H – grupa karboksylowa
-CHO – grupa aldehydowa
=CO – grupa ketonowa
-NH
2
– grupa aminowa
-NO
2
– grupa nitrowa
- SO
3
H – grupa sulfonowa
8. Na czym polega izomeria ketoenolowa? W jakich procesach biochemicznych ma ona
znaczenie?
W cząsteczkach zawierających atomy wodoru i spolaryzowaną grupę funkcyjną, może
wystąpić wędrówka protonu w ramach tej samej cząsteczki. Wędrówka taka możliwa jest w
ketonach dzięki obecnej w nich grupie karbonylowej. Odwracalna wędrówka protonu od
węgla do tlenu grupy karbonylowej prowadzi do zaistnienia równowagi dynamicznej dwóch
form tego samego związku, które posiadają dwie różne grupy funkcyjne. Forma I jest
ketonem, a druga II alkoholem (-ol) nienasyconym zawierającym wiązanie podwójne (-en)
czyli „enolem”. Odmiany I i II nazywamy odpowiednio ketonową i enolową.
3
W organizmach żywych dominują związki o konfiguracji R, które prawidłowo spełniają swoje
funkcje biologiczne, izomeria keto-enolowa nie jest specyficzna i powoduje, że pojawia się
pewien procent konfiguracji S, które nie są przez organizm pożądane (uznawane wręcz jako
toksyczne).
9. Na czym polega tautomeria związków organicznych?
TAUTOMERIA – współistnienie obok siebie dwóch odmian cząsteczek łatwo
przekształcających się w siebie.
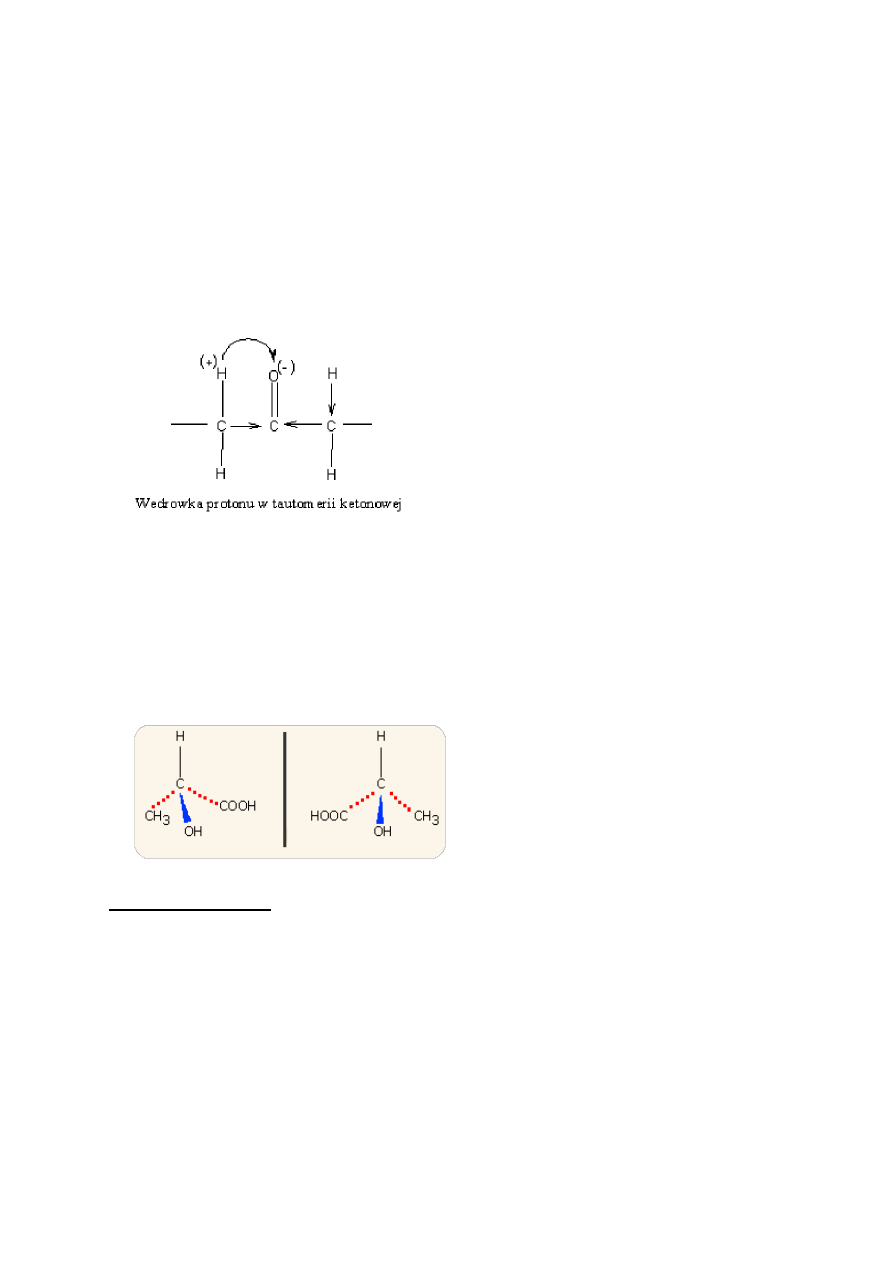
10. Co to są enancjomery?
ENACJOMERY -
izomery optyczne, które są własnymi lustrzanymi odbiciami – jak prawa i lewa
ręka (stąd nazwa „chiralny” dla atomu węgla w cząsteczce enancjomeru). Mogą istnied tylko dwa
enancjomery danego związku chemicznego. Niektóre enancjomery mają zdolnośd do skręcania
płaszczyzny światła spolaryzowanego w prawo + lub lewo - , równo-cząsteczkowa mieszanina
enacjomerów nie wykazuje optycznej czynności i nosi nazwę mieszaniny recemicznej
Aminokwasy i białka
1. Jakie grupy funkcyjne występują w aminokwasach? Jaki charakter nadają one tym
związkom?
Aminokwasy posiadają co najmniej dwie grupy funkcyjne: grupę aminową -NH
2
oraz grupę
karboksylową –COOH. Nadają charakter amfoteryczny, czyli możliwość tworzenia jonów
obojnaczych w roztworach wodnych. Gdy występuje więcej grup –NH2 aminokwas zaliczamy
do zasadowych – np. glutamina, lizyna. Gdy występuje więcej grup –COOH aminokwas jest
kwasowy – np. kw. glutaminowy. W aminokwasach występują także grupy –OH (obojętne),
2. Jak powstaje wiązanie peptydowe?
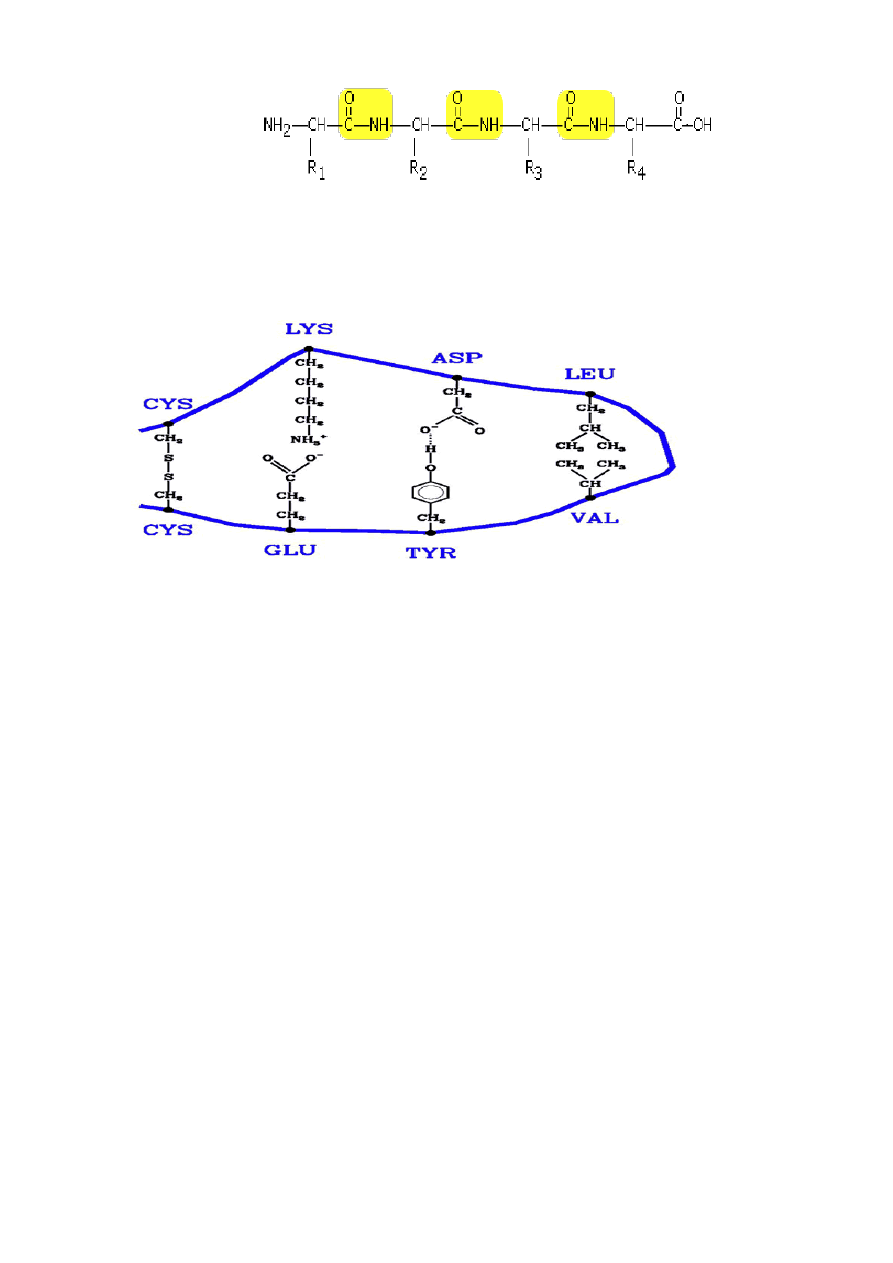
4
WIĄZANIE PEPTYDOWE - powstaje przez połączenie grupy karboksylowej (-COOH)
jednego aminokwasu z grupą aminową (-NH
2
) drugiego aminokwasu z wydzieleniem
cząsteczki wody.
3. Jakie oddziaływania mogą występować pomiędzy łańcuchami bocznymi aminokwasów w
białkach?
Mostki dwusiarczkowe, oddziaływania jonowe, wodorowe i hydrofobowe zilustrowane są
kolejno od lewej do prawej strony
Występują też najsłabsze ze wszystkich wiązania van der Waalsa
4. Na czym polega oddziaływanie wodorowe (powstanie mostku wodorowego)?
Wiązanie wodorowe –
rodzaj stosunkowo słabego wiązania chemicznego polegającego głównie na
przyciąganiu elektrostatycznym między atomem wodoru i atomem elektroujemnym zawierającym
wolne pary elektronowe. Klasyczne wiązanie wodorowe powstaje, gdy atom wodoru jest
połączony wiązaniem kowalencyjnym z innym atomem o dużej elektroujemności (np. tlenem) i w
ten sposób uzyskuje nadmiar ładunku dodatniego. W wyniku tego oddziaływania pierwotne,
kowalencyjne wiązanie wodór – inny atom ulega częściowemu osłabieniu, powstaje zaś nowe,
stosunkowo słabe wiązanie między wodorem i innym atomem (akceptorem wiązania
wodorowego).
5. Co określa struktura pierwszorzędowa białek?
Struktura pierwszorzędowa - określa, w jaki sposób atomy w cząsteczkach białka są z sobą
połączone wiązaniami kowalencyjnymi, czyli jak tworzą się łańcuchy. Inaczej struktura
pierwszorzędowa określa kolejność aminokwasów w łańcuchu białkowym.
Określa, jakie
aminokwasy w cząsteczkach białka są z sobą połączone wiązaniami
peptydowymi, czyli jak tworzą się łańcuchy.
6. Co określa struktura drugorzędowa białek?

5
Określa dwie podstawowe formy występowania łańcuchów polipeptydowych – alfa helisa i
forma harmonijkowa (pofałdowanej kartki), czyli w jaki sposób utworzone łańcuchy są
ułożone w przestrzeni, czyli jakie formy przestrzenne (spirale, arkusze albo kule) tworzą one
za pomocą wiązań wodorowych i innych oddziaływań, łączących różne łańcuchy lub różne
części tego samego łańcucha
7. Co określa struktura trzeciorzędowa białek?
Określa najbardziej korzystne uporządkowanie przestrzenne poszczególnych części cząsteczki
białka z punktu widzenia energetycznego; zależy od oddziaływań między łańcuchami
bocznymi jednej lub większej liczby makrocząsteczek.
8. Co określa struktura czwartorzędowa białek?
Struktura czwartorzędowa - określa sposób przestrzennego powiązania kilku cząsteczek
białkowych w jedną złożoną strukturę białka.
Kataliza enzymatyczna
1. Jak zbudowany jest enzym?
ENZYM - rod
zaj białek występujących naturalnie w organizmach żywych, których działanie
sprowadza się do obniżenia energii aktywacji danych reakcji biochemicznych. Enzymy stanowią
największą grupę tzw. biokatalizatorów.
Jeżeli enzym jest białkiem złożonym, to składa się z:
*części białkowej nazywanej apoenzymem
*części niebiałkowej nazywanej koenzymem lub grupą prostetyczną enzymu(trwale) (w zależności od
rodzaju wiązania łączącego ją z apoenzymem)centrum aktywne.
Enzym (holoenzym) dzieli się na część białkową (apoenzym) i niebiałkową (kofektor), która może być
trwale (grupa prostetyczna) lub nietrwale (koenzym) powiązana z holoenzymem
2. Jaki jest mechanizm katalitycznego działania enzymów?
Reakcja katalizowana przez enzym rozpoczyna się od związania substratów przez centrum
aktywne i powstania przejściowego kompleksu enzym – substrat (E – S). Następnie zachodzi
właściwa reakcja połączenia cząsteczki substratów w produkt reakcji albo rozłożenie substratu
na mniejsze cząsteczki. Reakcja kończy się uwolnieniem produktów przez enzym. Cząsteczka
enzymu nie zużywa się podczas reakcji i po uwolnieniu produktów jest gotowa do
przyłączenia nowych substratów.
6
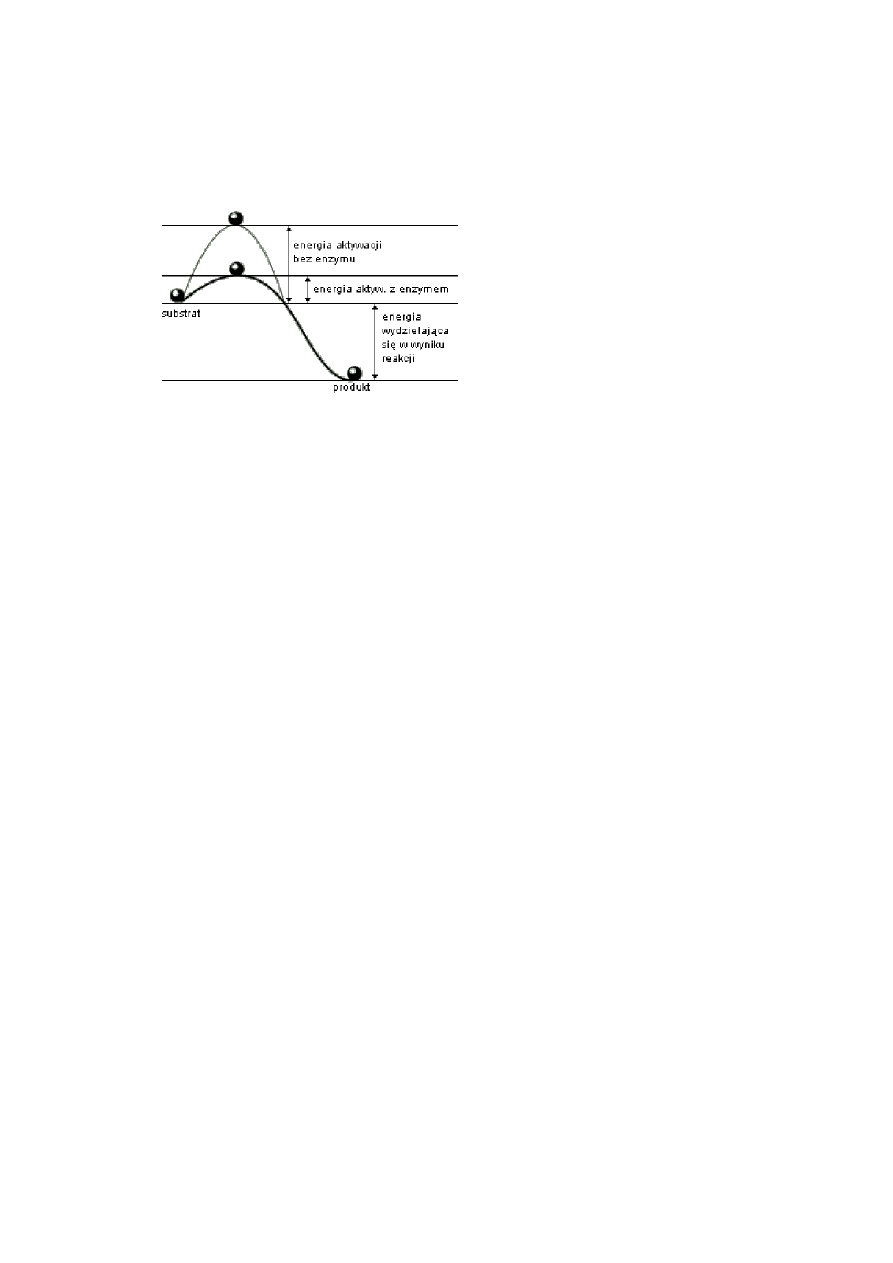
3. Co to jest energia aktywacji?
ENERGIA AKTYWACJI – energia, którą muszą mieć cząsteczki, aby były zdolne do
określonej reakcji chemicznej; energia aktywacji wyraża się zwykle w kilodżulach na mol
(kJ/mol) reagujących cząsteczek; im mniejsza jest energia aktywacji, tym reakcja zachodzi
szybciej.
4. Jak odczyn wpływa na aktywność enzymów?
Do utrzymania aktywności katalitycznej enzymy wymagają odpowiedniego odczynu pH
środowiska. Dla większości enzymów optymalne jest pH 5,5 – 7,4. Znane są jednak enzymy,
które działają najlepiej w środowisku kwaśnym (np. pepsyna w pH 1,5 – 2,7) lub zasadowym
(trypsyna, chymotrypsyna – pH 8-9).
Środowisko silnie kwaśne i silnie zasadowe z reguły działa na enzymy denaturująco, niszcząc
nieodwracalnie ich aktywność. Niewielkie zmiany pH nie dezaktywują enzymu, ale obniżają
szybkość reakcji, ponieważ wpływając na stopień jonizacji enzymu i substratu, zmieniają
warunki tworzenia się kompleksu enzym – substrat. Dla większości enzymów optymalne jest
środowisko obojętne lub słabo kwaśne.
Białkowa struktura enzymów determinuje szereg i podstawowych właściwości oraz uzależnia
ich działanie od tych samych warunków i czynników, które wpływają na stan
fizykochemiczny białek.
*Wartość pH decyduje o stanie jonizacji polarnych grup białka enzymatycznego. Dla każdego
enzymu istnieje odpowiednia wartość pH (optimum), zapewniająca zarówno
najodpowiedniejszy stan jonizacji jego cząsteczki jak też optymalne warunki dla przekształceń
chemicznych substratu. Im pH jest odleglejsze od punktu optymalnego, tym wolniejszy jest
przebieg reakcji enzymatycznej. Przy zbyt niskim lub wysokim pH dochodzić może do
denaturacji białka, czyli zaniku jego właściwości (inaktywacja)
5. Wymień klasy enzymów.
*oksydoreduktazy – katalizujące reakcje utleniania i redukcji
*transferazy – katalizujące reakcje przenoszenia grup funkcyjnych
*hydrolazy – katalizujące reakcje hydrolizy, czyli rozpadu wiązań z udziałem wody
*liazy – katalizujące niehydrolityczne rozrywanie wiązań
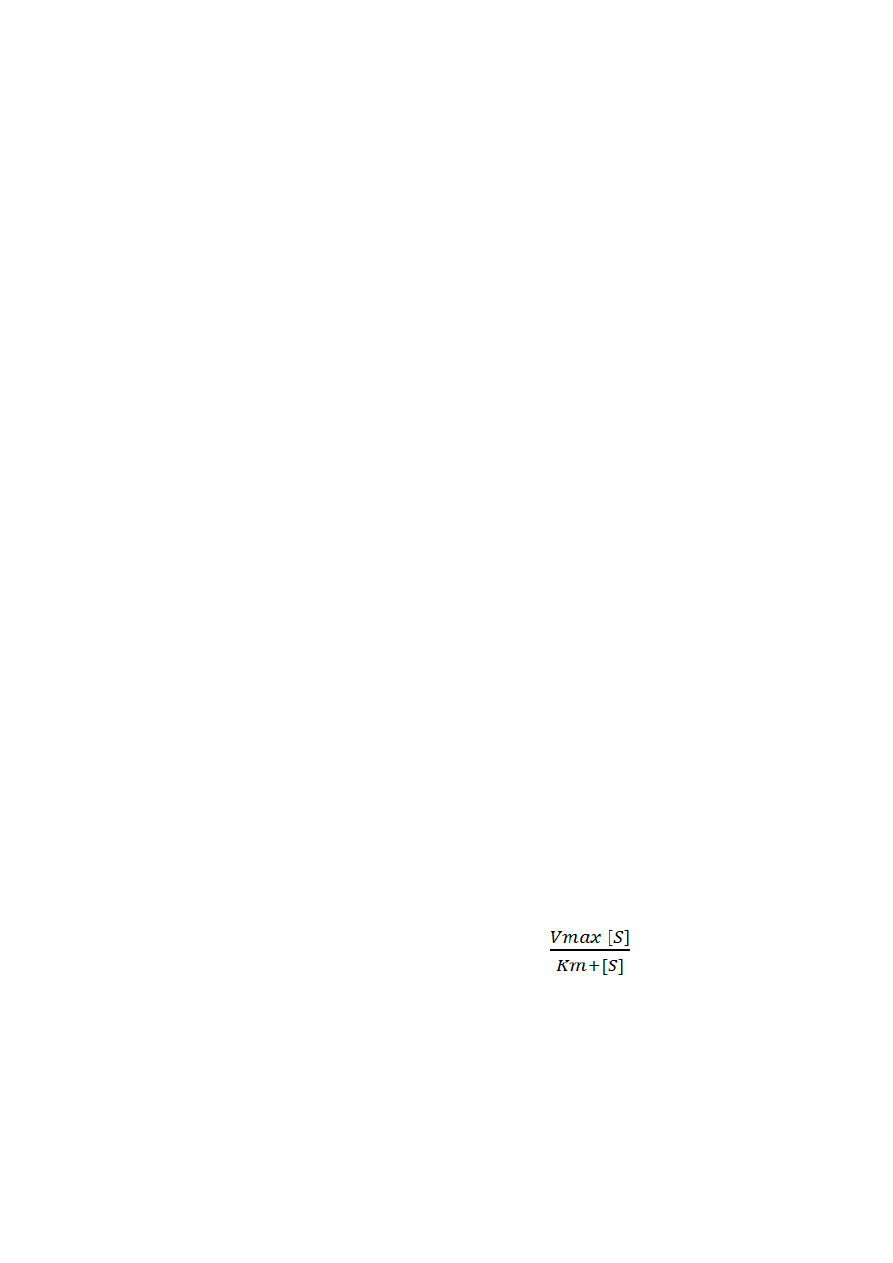
7
*izomerazy – katalizujące reakcje izomeryzacji, czyli przegrupowania
wewnątrzcząsteczkowego
* ligazy – katalizujące tworzenie wiązań połączone z hydrolizą ATP;
6. Jakie reakcje katalizują enzymy klasy ...........?
Oksydoreduktazy enzymy, których funkcja katalityczna polega na odszczepieniu atomów
wodoru z odpowiedniego donora (związku oddającego H+) i przenoszeniu ich na odpowiedni
akceptor (związek przyjmujący H+)
Transferazy enzymy te mają zdolność do przenoszenia pewnych grup atomów (np. grupę
metylowa CH3,karboksylową, acetylowi i inne)
Hydrolazy klasa obejmująca enzymy katalizujące procesy hydrolizy wiązań estrowych,
eterowych i peptydowych. Hydrolityczne rozbijanie tych wiązań zachodzi z równoczesnym
dołączeniem elementów cząsteczki wody H+ i OH-
Liazy enzymy rozrywające wiązania: S-C, C-N, C-O, C-S oraz C-halogen.. w odróżnieniu
od hydrolaz w procesie rozszczepienia wiązań przez liazy nie biorą udziału cząsteczki wody.
Ligazy (syntetazy) katalizują wytwarzanie nowych wiązań kowalencyjnych
7. Co oznacza cząsteczkowość reakcji chemicznej?
CZĄSTECZKOWOŚC REAKCJI – liczba cząsteczek biorących udział w najwolniejszym
stadium reakcji. Cząsteczkowość i rząd reakcji wyznacza się tylko eksperymentalnie nie
można obliczyć ich teoretycznie. Przez cząsteczkowość reakcji rozumiemy także ilość
cząsteczek substratów biorących udział w reakcji elementarnej, ilość cząsteczek, które muszą
się spotkać w jednym miejscu i czasie, by reakcja mogła nastąpić.
8. Co oznacza praktycznie rzędowość reakcji chemicznej?
RZĘDOWOŚĆ REAKCJI CHEMICZNEJ - suma wykładników potęg, w których
występują stężenia reagentów w równaniu opisującym szybkość reakcji chemicznej.
Jest to ilość cząsteczek decydująca o szybkości reakcji.
9. Równanie Michaelisa-Menten i jego interpretacja.
Równanie te opisuje szybkość reakcji enzymatycznej V =
Równanie to pozwala obliczyć kinetyczne parametry reakcji enzymatycznych (Km i Vmax).
Km -> stała Michaellisa odpowiada jakiemu stężeniu substratu [S] przy którym szybkość
reakcji V równa jest połowie szybkości max w Vmax. Stanowi wartość charakterystyczną dla
danego enzymu w odpowiednich warunkach pH i temperatury. Określa powinowactwo dla
danego enzymu do substratu znajdując wartość Km, można tak dopierać stężenia substratu,
aby osiągnąć stan nasycenia enzymu substratem.

8
Przy niskich stężeniach substratów reakcja jest pierwszego rzędu, natomiast przy wysokich
stężeniach substratów reakcja jest rzędu zerowego.
10. Jakie korzyści wynikają z transformacji Lineweavera-Burka i
równania Michaelisa-Menten?
Transformacja LB polega na linearyzacji równania MM i pozwala ona na proste wyznaczenie
stałej Michaelisa i maksymalnej szybkości reakcji (Vmax) przy określonej ilości enzymu.
Równanie MM opisuje zależność szybkości reakcji od stężenia substratu:
Postać K
m
= [S] jest matematycznym zapisem definicji stałej Michaelisa. Analizując równanie
Michaelisa-Menten można dojść do wniosku, iż przy stałym stężeniu enzymu, szybkość reakcji w
pewnych granicach zależy od stężenia substratu, na wykresie zależności szybkości reakcji od stężenia
substratu widać że:
przy niewielkim stężeniu substratu w stosunku do stężenia enzymu, pojawia się zależność
liniowa, między stężeniem substratu a szybkością reakcji, ta sytuacja odpowiada reakcji
kinetycznej pierwszego rzędu opisywanej równaniem v = k[A]
w przypadku dużego stężenia substratu, szybkość reakcji zbliża się do jej maksymalnej
wartości i stężenie substratu nie ma wpływu na szybkość reakcji, sytuacja ta odpowiada
kinetyce zerowego rzędu opisywanej równaniem v = k. Tego typu reakcja ma miejsce w
przypadku całkowitego wysycenia enzymu substratem.
11. Na czym polega inhibicja kompetycyjna?
INHIBICJA KOMPETECYJNA -
sposób hamowania działania enzymu. Cząsteczka będąca
inhibitorem ma podobną budowę do substratu hamowanego enzymu. Inhibitor wchodzi w
centrum aktywne enzymu , blokuje centrum aktywne i uniemożliwia łączenie enzymu z
substratem.
12. Na czym polega inhibicja niekompetycyjna
INHIBICJA NIEKOMPETECYJNA - mechanizm hamowania aktywności enzymu.
Cząsteczka działająca jako inhibitor nie wchodzi w centrum aktywne enzymu, ale przyłącza
się do innego miejsca na cząsteczce enzymu i hamuje jego działanie.
Łańcuch oddechowy
1. Rola łańcucha oddechowego.
Celem łańcucha oddechowego jest dostarczenie komórce energii. Proces ten zachodzi
stopniowo, ponieważ komórka chroni w ten sposób struktury białkowe przed denaturacją.
Wydzielana porcjami energia może być odpowiednio „zagospodarowana”.
2. ATP – budowa i właściwości
Jest to uniwersalny przenośnik energii użytecznej biologicznie adenozynotrifosforan.
Cząsteczka substancji organicznych w których występuje wiązanie
wysokoenergetyczne.(zawierające znaczną ilość energii swobodnej)
ATP pod względem chemicznym jest zmodyfikowanym nukleotydem zbudowanym z
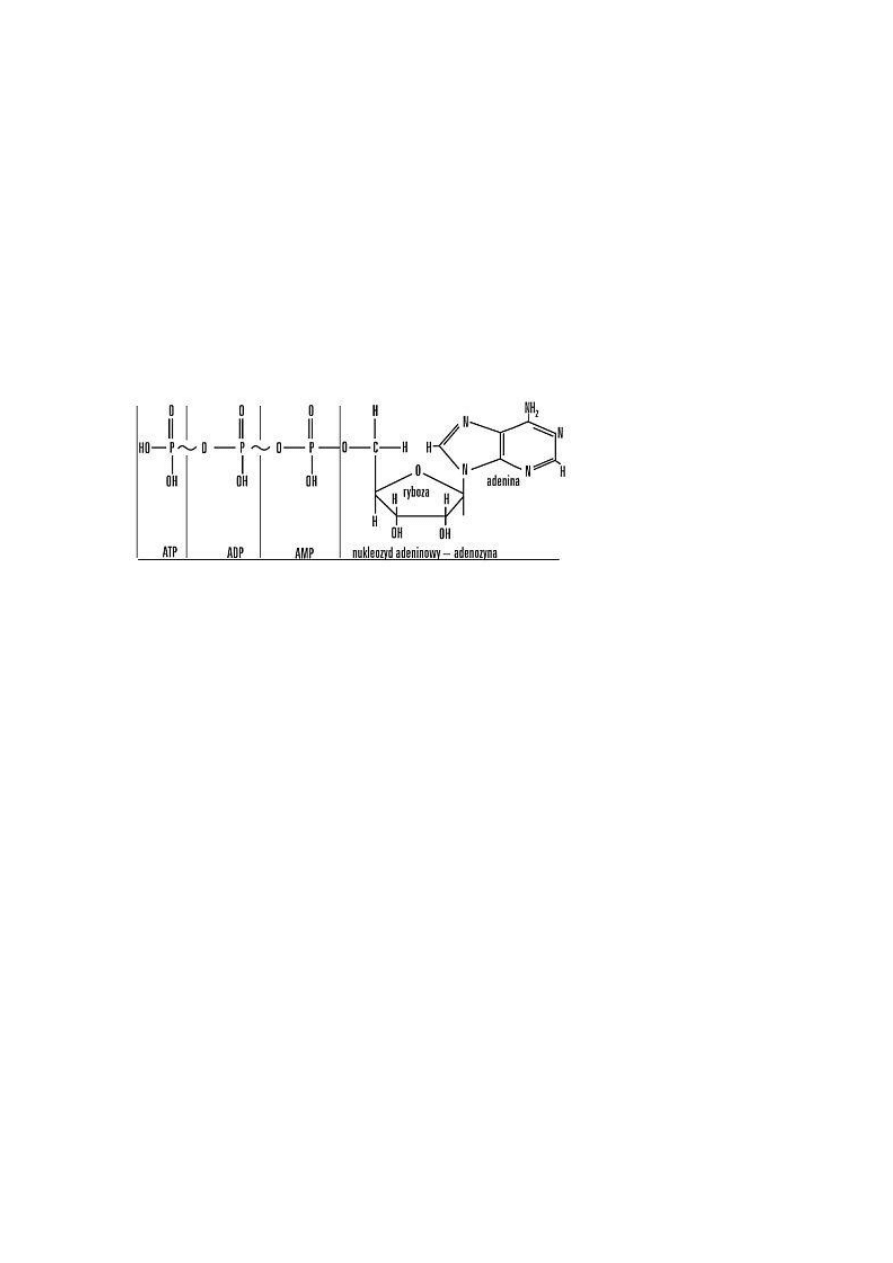
9
zasady azotowej – adeniny,
cukru – rybozy (tworzą one adenozynę) oraz z
trzech reszt fosforanowych.
Między resztami fosforanowymi występują dwa wysokoenergetyczne wiązania
bezwodnikowe, których zerwanie powoduje uwolnienie określonych porcji energii. ATP w
procesie rozpadu – hydrolizy – odłącza jedną resztę fosforanową i przekształca się w ADP –
adenozynodwufosforan; odłączenie jednej reszty fosforanowej powoduje wydzielenie porcji
energii równej 30,5 kJ/mol (7,3 kcal z 1 mola wiązań).
- ATP jest związkiem nietrwałym i nie może być wykorzystany w pracy ciągłej, nie może
być również przenoszony na większe odległości, z jednej komórki do drugiej, ani w obrębie
jednej komórki. W przypadku zwiększonego zapotrzebowania na energię w określonym
rejonie komórki wytworzony ATP jest przenoszony w mitochondriach (wędrówka
mitochondriów).
Rys. Budowa cząsteczki ATP (~ bezwodnikowe wiązanie wysokoenergetyczne)
Cząsteczki będące przenośnikami energetycznymi powinny mieć małą masę cząsteczkową,
być dobrze rozpuszczalne w wodzie i zbudowane ze składników powszechnie występujących
w komórce.
3. Jakie znaczenie ma występowanie szeregu przenośników w łańcuchu
oddechowym(dlaczego procesy te nie są jednostopniowe?).
Przenośniki te pozwalają na stopniowe uwalnianie energii, dzięki czemu wysoka ilość energii
powstająca w reakcji nie prowadzi do denaturacji białek organizmu. Co wyjaśnia nam
wielostopniowość powyższych procesów.
4. Co decyduje o uszeregowaniu poszczególnych przenośników w łańcuchu oddechowym?
Potencjał oksyredukcyjny wyrażający liczbowo powinowactwo poszczególnych
przenośników łańcucha oddechowego do elektronów.
Szlak łaocucha oddechowego jest zlokalizowany w wewnętrznej błonie mitochondriów. Składa się on z
szeregu przekaźników elektronowych (enzymów) zatopionych w błonie. Elektrony pochodzące z
utleniania NADH i FADH
2
zaczynają płynąd (prąd elektryczny) przez przenośniki zawarte w błonie.
Polega to na redukcji kolejnych przekaźników przez poprzednie. O kierunku przepływu prądu decyduje
potencjał oksydoredukcyjny przenośnika, im wyższy potencjał tym łatwiej przekaźnik przyjmuje
elektrony. Enzymy łaocucha oddechowego uszeregowane są w błonach według rosnącego potencjału

10
oksydoredukcyjnego. Koocowy akceptor elektronów to tlen cząsteczkowy, który redukuje się do
wody (stąd w równaniu sumarycznym utleniania po stronie produktów znajduje się woda).
5. Dlaczego oddychanie tlenowe jest bardziej energodajne w porównaniu z procesami
beztlenowymi?
Proces oddychania beztlenowego kończy się na etapie glikolizy oraz przemianie jej
produktów, natomiast oddychanie tlenowe składa się z trzech etapów: glikolizy, cyklu Krebsa
i łańcucha oddechowego.
W procesie oddychania beztlenowego mamy do czynienia z częściowym utlenieniem
substratu oddechowego, natomiast w oddychaniu tlenowym jest to proces całkowity.
Liczba uzyskanych moli ATP z jednego mola glukozy w oddychaniu beztlenowym wynosi 4
ATP, co daje zysk energetyczny równy 2 ATP w przypadku oddychania tlenowego powstaje
38 ATP dających zysk energetyczny równy 36 ATP. Dwa ATP są zorywane na transport
cząsteczek między cytoplazmą gdzie zachodzi glikoliza, a mitochondrium gdzie zachodzi cykl
Krebsa i łańcuch oddechowy.
Metabolizm tłuszczów
1. Czym są tłuszcze z chemicznego punktu widzenia?
Tłuszcze (lipidy)- są estrami wyższych kwasów organicznych (kwasów tłuszczowych) oraz alkoholu
trójwodorotlenowego (gliceryny) lub wyższych alkoholi jednowodorotlenowych. Ich cechą wspólną jest:
1. Względna nierozpuszczalnośd w wodzie
2. Rozpuszczalnośd w rozpuszczalnikach organicznych tj. eter, chloroform, benzen, itp.
2. Jakie kwasy tłuszczowe występują zazwyczaj w tłuszczach właściwych? Podaj ich wzory.
Tłuszcze właściwe (glicerydy) to estry glicerolu i kwasów tłuszczowych. Przykładem takiego
tłuszczu jest tristearynian glicerolu, w którego cząsteczce wszystkie 3 grupy hydroksylowe
glicerolu (gliceryny) zostały zestryfikowane cząsteczkami kwasu stearynowego. W reakcję z
glicerolem mogą jednak wchodzić różne kwasy tłuszczowe i to między innymi decyduje o
różnorodności tłuszczów właściwych.
Najważniejszymi kwasami tłuszczowymi o charakterze nasyconym wchodzącymi w skład glicerydów są:
Kwas palmitynowy CH3(CH2)14COOH
Kwas stearynowy CH3(CH2)16COOH
Kwas masłowy Kwas butanowy CH
3
(CH
2
)
2
COOH
Kwas walerianowy Kwas pentanowy CH3(CH2)3COOH
Kwas kapronowy Kwas heksanowy CH3(CH2)4COOH
Kwas enantowy Kwas heptanowy CH3(CH2)5COOH

11
Kwasami tłuszczowymi o charakterze nienasyconym są:
• kwas oleinowy CH
3
(CH
2
)
7
CH=CH(CH
2
)
7
COOH
• kwas linolowy CH
3
(CH
2
)
4
CH=CH-CH
2
-CH=CH(CH
2
)
7
COOH
• Kwas linolenowy CH
3
CH
2
CH=CHCH
2
CH=CHCH
2
CH=CH(CH
2
)
7
COOH
3. Na czym polega beta-oksydacja (bez rysowania schematu)?
Kwasy tłuszczowe ulegają rozłożeniu w procesie b-oksydacji. Polega ona na cyklicznym
odłączeniu reszty kwasu octowego połączonej z koenzymem A, która zostaje rozłożona w cyklu
Krebsa. Łańcuch jest w ten sposób krótszy o dwa atomy węgla po każdym przebiegu cyklu.
Jeśli kwas tłuszczowy miał parzystą liczbę atomów węgla, to pod koniec ostatniego cyklu acylo-
CoA ma 4 atomy węgla i jest rozszczepiany na 2 cząsteczki acetylo-CoA. W przypadku kwasów
o nieparzystej liczbie węgla, acylo-CoA zawiera 5 atomów węgla i rozszczepia się na
trzywęglowy propionylo-CoA oraz dwuwęglowy acetylo-CoA.
Proces zachodzi w mitochondriach w komórkach eukariotycznych i w cytozolu u prokariotów.
1 Utlenienie
2 Uwodnienie
3 Utlenienie
4 Tioliza
4. Jaki jest pierwszy etap beta-oksydacji?
Utworzenie acylo –SCoA, czyli przeprowadzenie cząsteczki kwasu w postać aktywną,
związaną jako tioester z CoA. Donatorem energii jest tu ATP
5. Jakie koenzymy uczestniczą w odwodorowaniu w procesie betaoksydacji?
NAD
+
i FAD.
6. Jeśli odłączone w beta oksydacji atomy wodoru są wykorzystywane w łańcuchu
oddechowym, to czy występuje różnica efektu energetycznego w zależności od
koenzymów dehydrogenazy?
Tak występuje. Wodór może być odwracalnie przyłączany do przenośników wodorowych,
którymi są NAD i FAD. W przypadku przyłączenia do NAD powstają 3 cząsteczki ATP na
skutek wcześniejszego przyłączenia do łańcucha oddechowego niż w przypadku, FAD , który
daje efekt energetyczni równy 2cz. ATP. Wynika to z różnicy potencjałów red-ox koenzymów
dehydrogenazy.
7. Ile cząsteczek ATP może powstać w wyniku jednego etapu beta oksydacji (skrócenia
acylokoenzymu A o jeden dwuwęglowy fragment)?
5 ATP

12
W jednym etapie tworzy się jedna cząsteczka FADH
2
mogąca dać 2 cząsteczki ATP po
wprowadzeniu do łańcucha oddechowego oraz jedna cząsteczka NADH dające 3 cząsteczki
ATP.
8. Ile cząsteczek ATP może powstać w procesie całkowitego rozkładu kwasu ...... w wyniki
betaoksydacji?
5 ATP razy liczba cykli, przy czym 1 cz. ATP musi zostać zużyta dla zainicjowania reakcji
Przykład kwas palmitynowy CH3(CH2)14COOH to 18 atomów węgla czyli 9 cykli b-
oksydacji to daje 9*5-1 = 44 ATP (NIE JESTEM TEGO PEWNY)
9. Do jakich celów może komórka wykorzystywać odrywane w procesie betaoksydacji
atomy wodoru?
Komórka może wykorzystywać atomy wodoru do procesu oddychania tlenowego, w którym
jest on przenoszony przez przenośniki wodorowe na ostateczny akceptor w łańcuchu
oddechowym, którym jest tlen. Ponadto wodór może być wykorzystywany do uzyskania
energii. Drugie ważne znaczenie to dostarczanie atomów wodoru do procesów redukcyjnych
(biosynteza składników komórkowych)
Mechanizmy adaptacyjne drobnoustrojów
1. Co to są ksenobiotyki?
KSENOBIOTYK –
związek chemiczny występujący w organizmie, który ani go nie produkuje ani
też w normalnych warunkach nie przyjmuje z pożywieniem.
Inaczej mówiąc, jest to substancja
chemiczna niebędąca naturalnym składnikiem żywego organizmu. Inne nazwy to: substancja
obca bądź egzogenna, materiał antropogenny (o ile powstaje w wyniku działalności
człowieka).
2. Czym różni się biotransformacja od biodegradacji?
BIOTRANSFORMACJA – każda przemiana określonej substancji w procesie
biologicznym.
BIODEGRADACJA - to biochemiczny rozkład związków organicznych przez organizmy
żywe (bakterie, pierwotniaki, promieniowce, grzyby, glony, robaki) na prostsze składniki
chemiczne.
3. Co rozumie się przez adaptację drobnoustrojów do rozkładu ksenobiotyków? Do czego
sprowadza się taka adaptacja?
Adaptacja drobnoustrojów do rozkładu ksenobiotyków polega na pozyskaniu przez populację
drobnoustrojów odpowiedniego aparatu enzymatycznego umożliwiającego przemianę tych
związków.
Adaptacja taka sprowadza się do zmiany w genomie organizmu (adaptacja
genomowa), gdyż ksenobiotyki są związkami nie występującymi naturalnie w środowisku
danego organizmu.
4. Czym różni się indukcja enzymatyczna od aktywacji enzymatyczne?

13
INDUKCJA ENZYMATYCZNA – wzrost aktywności
enzymu
pod wpływem induktora,
cząsteczki pochodzącej z metabolizmu komórki lub z zewnątrz; induktor uruchamia proces
ekspresji
odpowiednich genów, a więc transkrypcję i translację, w efekcie czego pojawiają się
nowe cząsteczki białka – enzymu indukcyjnego
AKTYWACJA ENZYMATYCZNA – Wzrost aktywności enzymów pod wpływem
obecności określonej substancji. Przejście enzymu ze stanu nieaktywnego w aktywny pod
wpływem np. jonów H
+
lub innej substancji aktywującej.
5. Co to jest represja enzymatyczna?
REPRESJA ENZYMATYCZNA - zahamowanie ekspresji genu wskutek dołączenia
cząsteczki represora, co uniemożliwia transkrypcję; np. represja kataboliczna - polega na
zahamowaniu ekspresji genów kodujących białko enzymatyczne, katalizujące rozkład
substancji pokarmowych, na skutek wzrostu dostępności innego substratu, którego katabolizm
jest bardziej wydajny energetycznie. Przykładem jest zahamowanie genów operonu
laktozowego u pałeczki okrężnicy w obecności glukozy w pożywce.
6. Na czym polega adaptacja socjologiczna?
ADAPTACJA SOCJOLOGICZNA –Selekcja organizmów posiadających odpowiednie enzymy np.
poprzez dodanie substancji toksycznie działającej, ale należącej do środowiska naturalnego wykrywa
się org. posiadające enzymy rozkładające lub neutralizujące daną substancję.
7. Na czym polega adaptacja fizjologiczna?
ADAPTACJA FIZJOLOGICZNA – synteza odpowiednich enzymów wywołana jest pojawieniem się
określonych substancji zanieczyszczeń środowiska. Jest to sygnał dla komórki, ze ma ona syntetyzować
enzymy, czyli zmienia się fizjologia mikroorganizmów.
Adaptacja polega na syntezie odpowiednich enzymów, o których informacja była zawarta w
kodzie genetycznym, ale wcześniej była nie wykorzystywana.
8. Na czym polega adaptacja genetyczna?
ADAPTACJA GENETYCZNA –
Selekcja mikroorganizmów zmutowanych, które nie
przeżyłyby w nie zmienionych warunkach środowiska. Adaptacja ta prowadzi do zmiany
genotypu organizmu w wyniku substancji lub warunków mutagennych jak obecność
ksenobiotyków czy promieniowanie UV.
9. Który typ adaptacji posiada szczególne znaczenie dla rozkładu ksenobiotyków?
Adaptacja genetyczna – gdyż ksenobiotyki są substancjami obcymi dla organizmu i często
powodują mutacje genetyczne co z kolei prowadzi do pojawienia się organizmów odpornych
na ich obecność w skutek zmiany genomu.
10. Jakie znamy praktyczne metody adaptacji drobnoustrojów?
- hodowla w warunkach skrajnych – polega na stosowaniu już w pierwszym dniu stężenia
danej substancji, do którego chcemy przystosować mikroorganizmy.
- hodowla wieloetapowa - na stosowaniu początkowo małych dawek danej substancji, które są
stopniowo zwiększane. Może okazać się jednak, że pewna dawka jest za duża i trzeba zacząć
przystosowywanie na nowo. Dlatego hodowla ta jest procesem dłuższym niż hodowla w
warunkach skrajnych.

14
Pomiar aktywności mikroorganizmów
1. Do czego mogą służyć pomiary aktywności metabolicznej drobnoustrojów?
- oceny aktualnego stanu fizjologicznego organizmu
- oceny stopnia zaadaptowania mikroorganizmów
- wyznaczania podatności na biodegradację określonych substancji.
- wyznaczania toksyczności poszczególnych substancji.
2. Dlaczego pomiar intensywności procesów zachodzących w łańcuchu oddechowym jest
dobrym sposobem wyznaczania ogólnej aktywności drobnoustrojów?
Gdyż zbiegają się w nim wszystkie szlaki metabolizmu komórkowego . Można wykorzystać
różne miejsca w łańcuchu oddechowym, np. do pomiaru zużycia tlenu wykorzystuje się koniec
tego łańcucha.
W łańcuchu oddechowym zbiegają się wszystkie szlaki metabolizmu komórkowego. Powstają
tam, poprzez utlenienie cząsteczki NAD+ i NADP+, ATP - które jest źródłem energii
mikroorganizmów. Poprzez badanie ttc, albo badanie wykrywania atp można określić
aktywność mikroorganizmów.
Proces utleniania jest zawsze sprzężony z procesem redukcji i odwrotnie, z tego względu tego
typu reakcje są nazywane reakcjami oksydacyjno-redukcyjnymi. Jeśli w środowisku znajduje
się więcej niż jeden układ oksydacyjno-redukcyjny, to będzie przebiegała między nimi reakcja
oksydacyjno-redukcyjna aż do osiągnięcia równowagi chemicznej.
3. Jakie właściwości powinien posiadać związek chemiczny, aby mógł pełnić rolę sztucznego
akceptora elektronów ( i protonów) w łańcuchu oddechowym?
Wnikać do wnętrza komórki i mieć odpowiedni potencjał oksydoredukcyjny. Związek
chemiczny pełniący rolę sztucznego akceptora elektronów (i protonów) powinien przede
wszystkim mieć większe powinowactwo elektronowe w porównaniu z poprzednim
akceptorem elektronów (i protonów). Dzięki temu przyjmuje on od poprzedniego akceptora
elektron.
4. Jakie zabiegi wstępne warunkują poprawne wykonanie testu TTC?
- optymalnie stężenie TTC, co najmniej takie jak ilość transportowanych wodorów w
łańcuchu. Stężenie musi być na tyle wysokie by substancja przeniknęła do miejsca aktywności
dehydrogenaz, a jednocześnie nie posiadała jeszcze właściwości toksycznych.
- wyznaczanie czasu inkubacji w zależności od liniowego przyrostu TTC.
- odtlenianie próbek gdyż w obecności tleny występuje duży rozrzut wyników pomiarów.
- przeprowadzanie procesu w ciemności, ponieważ w warunkach świetlnych powstaje
fotoTTC.
Kwasy nukleinowe
1.
Jakie informacje zawarte są w kodzie genetycznym? Dlaczego właśnie te a nie inne?
W kodzie genetycznym zawarte są informacje dotyczące sekwencji aminokwasów w białku.
Budowa białek decyduje o wszystkich cechach życiowych organizmu. Białka strukturalne
decydują o budowie organizmu, zaś białka enzymatyczne uczestniczą w reakcjach
biochemicznych.
2.
W jaki sposób zapisana jest informacja genetyczna organizmu?
Podstawowa informacja genetyczna obejmuje zapis budowy białek(enzymatycznych). Każda
żywa istota, posiada swój indywidualny zapis genetyczny zawarty w podwójnych niciach
DNA jądra komórkowego. Ten zapis nazywamy genomem. Składa się on z 80 tysięcy genów,
które utworzone są z nukleotydów z charakterystyczną dla każdego z nich kolejnością par
komplementarnych zasad purynowych i pirymidynowych.

15
3.
Dlaczego podstawowa jednostka kodująca składa się z trzech nukleotydów?
Ma to związek z liczbą uzyskanych kombinacji, czyli informacji kodycznych każdych z
aminokwasów. Musi być ona optymalna. Taką liczbą jest: 64, a więc 4 zasady azotowe mogą
wytworzyć 64 kombinacje trójkowe.
4.
Jak kopiowana jest informacja genetyczna?
Proces powielania przebiega w ten sposób, że dwa łańcuchy tworzące cząsteczkę rozkręcają
się po czym każdy z nich dobudowuje sobie łańcuch komplementarny tzn. taki sam z jakim
poprzednio był skręcony.
5.
Jak zbudowany jest rybosom i jakie zachodzą w nim procesy.
Rybosomy - organelle służące do produkcji białek w ramach translacji. Są zbudowane z rRNA
i białek. Katalityczna aktywność rybosomu związana jest właśnie z zawartym w nim rRNA,
natomiast białka budują strukturę rybosomu i działają jako kofaktory zwiększające wydajność
translacji.
Każdy rybosom zbudowany jest z dwóch dopasowanych do siebie podjednostek: małej i dużej.
Obie podjednostki są zbudowane z białek i rRNA (rybosomowy RNA). Podjednostki
rybosomu są ze sobą połączone tylko podczas translacji – po zakończeniu translacji danego
łańcucha białkowego podjednostki rozdzielają się, a podczas inicjacji translacji jakieś blisko
siebie znajdujące się podjednostki (jedna duża i jedna mała) łączą się ze sobą, odtwarzając
rybosom.
6.
Jaka funkcje biologiczną pełni mRNA
Informacyjne RNA. cząsteczki kwasu rybonukleinowego zawierające przepisaną z genów,
zakodowaną informację genetyczną o sekwencji poszczególnych polipeptydów.
Cząsteczki te po przyłączeniu się do rybosomów stanowią matrycę - kolejne trójki
nukleotydów mRNA (tzw. kodony) są rozpoznawane przez odpowiednie fragmenty (tzw.
antykodony) cząsteczek transportujących aminokwasy (tRNA), dzięki czemu w procesie
translacji powstaje właściwa sekwencja peptydu.
7.
Jaka funkcję biologiczną pełni tRNA?
tRNA - transportujący, transferowy RNA - cząsteczki kwasu rybonukleinowego (RNA),
których zadaniem jest przyłączanie wolnych aminokwasów w cytoplazmie i transportowanie
ich do rybosomów, gdzie w trakcie procesu translacji zostają włączone do powstającego
łańcucha polipeptydowego. tRNA cechuje wysoka specyficzność w stosunku do
aminokwasów. Każdy z aminokwasów syntetyzowanego białka może być transportowany
przez jeden, a niektóre przez kilka różnych tRNA
8.
Jaka funkcję biologiczną pełni rRNA?
rRNA - rybosomalny, rybosomowy RNA .Cząsteczki kwasu rybonukleinowego wchodzące w
skład rybosomów, które biorą udział w procesie biosyntezy polipeptydów. rRNA powstaje
w wyniku procesu transkrypcji DNA.
9.
Funkcja biologiczna rRNA w komórce polega na:
- kodowaniu informacji genetycznej
- udziale w biosyntezie białek
- odczytywaniu kodu genetycznego
10.
Uzupełnij sched ilustrujący proces biosyntezy białka:

16
DNA---transkrypcja-----mRNA---translacja---tRNA---zwijanie łańcucha---aktywne białko
11.
Uzupełnij (napisy nad strzałkami) schemat ilustrujący proces biosyntezy białka
DNA---transkrypcja---mRNA---translacja---Białko
Horyzontalny transfer genów (HTG)
1. Czym różni się HTG od wertykalnego (pionowego) transferu genów?
Transfer genów horyzontalny (poziomy) jest to proces polegający na nabywaniu genów przez
organizmy w procesie innym niż otrzymywanie ich od organizmu rodzicielskiego (w procesie
rozmnażania). Jest to przekazywanie informacji genetycznej bez podziału, do drugiego
osobnika dorosłego. W pionowym transferze genów mamy do czynienia z rozmnażaniem,
czyli informacja genetyczna przekazywana jest od osobnika macierzystego do osobnika
potomnego (np. przez podział)
2. Co to są plazmidy?
PLAZMIDY - cząsteczka
DNA
występująca w
komórce
poza
chromosomem
i zdolna do
autonomicznej (niezależnej)
replikacji
. Plazmidy występują przede wszystkim u
prokariotów
,
ale znane są także nieliczne plazmidy występujące u
eukariotów
.
Plazmidy są rozpowszechnione u bakterii. Nośniki pozachromosalnych cząsteczek DNA
(koliście zamknięte, dwuniciowe cząsteczki DNA). Nie są istotne dla wzrostu bakterii w
normalnych warunkach. Nadają komórce gospodarza cechy specyficzne np. plazmidy
odpornościowe na antybiotyki.
3. Jaki jest najczęstszy mechanizm oporności na antybiotyki?
Transformacja antybiotyku do formy nieszkodliwej.
Beta-laktamazy jest to jedna z najczęstszych mechanizmów oporności na antybiotyki.
Wydzielanie tych enzymów jest charakterystyczne zwłaszcza dla
bakterii Gram (-)
i jest to
spowodowane budową tych drobnoustrojów - beta-laktamazy są wydzielane u nich do
przestrzeni peryplazmatycznej, a nie na zewnątrz komórki, jak u
bakterii Gram-dodatnich
.
Każda bakteria Gram (-) odpowiada więc za siebie, natomiast bakterie Gram (+) bronią się
wspólnie, co jest skuteczne dopiero przy większej ich ilości.
U bakterii występują dwa typy oporności na antybiotyki. Naturalny, gdzie struktura bakterii
uniemożliwia działanie leku oraz nabytą powstałą na skutek nabycia genów oporności na
antybiotyki. I ta ostatnia jest najczęstszym i jednocześnie najniebezpieczniejszym
mechanizmem, powodującym szybkie rozprzestrzenianie się genów oporności
umiejscowionych na plazmidach bądź elementach ruchomych takich jak transpozony i
sekwencje inercyjne. Gen zlokalizowany na chromosomie jest przekazywany wertykalnie na
komórki potomne (za pomocą HGT) powodując klonalne rozprzestrzenianie się opornych
szczepów.
4. Na czym polega koniugacyjny HTG?
Polega na bezpośrednim poziomym przekazaniu genów z jednej komórki na drugą.
Charakterystyczny dla przekazywania plazmidów.

17
Plazmidy mogą być przenoszone z komórki bakteryjnej, która je posiada (dawcy), do komórki
pozbawionej tych elementów (biorcy), w wyniku trzech podstawowych mechanizmów:
koniugacji, transformacji i transdukcji. Koniugacja jest procesem horyzontalnego transferu
genów najbardziej charakterystycznym dla plazmidów, gdyż to właśnie plazmidy niosą
determinanty genetyczne tego procesu, a więc warunkują jego zajście.
Koniugacyjny HGT polega na rozprzestrzenianiu się genów poprzez bezpośredni kontakt
dwóch komórek, dawcy i biorcy, pomiędzy którymi wytwarza się specjalny mostek
koniugacyjny służący do transportu nośników DNA, takich jak plazmidy oraz transpozony
koniugacyjne.
5. Na czym polega transformacyjny HTG?
Komórka pobiera wolne odcinki DNA (plazmidy) ze środowiska np. z innych już martwych
organizmów
Transformacja niektórych gatunków może zachodzić w środowisku naturalnym (transformacja
naturalna), ale transformacja większości bakterii wymaga specjalnych zabiegów, możliwych
jedynie w laboratorium.
Transformacyjny HGT polega na pobraniu DNA przez komórkę ze środowiska naturalnego
lub poprzez wprowadzenie go w sposób sztuczny w warunkach laboratoryjnych. Proces
pobierania DNA można podzielić na dwa etapy, pierwszym będzie wiązanie się z
powierzchnią komórki a drugim przechodzenie przez osłony komórkowe. Jednak w trakcie
przechodzenia przez błony cytoplazmatyczne DNA ulega fragmentacji a następnie wśród tych
kawałków degradacji ulega jedna nić a druga, a dokładniej jakiś określony fragment, zostaje
włączony do genomu biorcy. W przypadku transformacji sztucznej proces przebiega na
podobnej zasadzie jednak komórka nie jest sama w stanie pobrać materiału genetycznego
tylko musi zostać do tego pobudzona za pomocą pola elektrycznego lub szoku termicznego.
6. Na czym polega transdukcyjny HTG?
Przekazywanie genów przez bakteriofagi do komórki bakteryjnej.
W kapsydach fagowych może być przenoszony DNA chromosomowy lub plazmidowy. W
pierwszym przypadku przenoszony materiał genetyczny zostaje wbudowany, w wyniku
rekombinacji do chromosomu bakteryjnego lub innych elementów genetycznych znajdujących
się w komórce bakteryjnej i jest przekazywany do komórek potomnych.
7. Czym różnią się plazmidy koniugacyjne od mobilizowanych?
Plazmidy mobilizowane w przeciwieństwie do koniugacyjnych nie mają zdolności do
samoistnego przenoszenia genów, gdyż nie posiadają genów mogących tworzyć połączenia
koniugacyjne.
Plazmidy mobilizowane (często przenoszące geny oporności na antybiotyki) muszą
współdziałać z plazmidami koniugacyjnymi żeby przekazywać jakieś cechy innym
komórkom.
Zagadnienia częśd II:
1.Budowa błon biologicznych

18
Błona biologiczna (błona plazmatyczna) – podstawowa jednostka strukturalna wszystkich błon występujących
w komórce. Składa się z dwuwarstwy cząsteczek fosfolipidów oraz z cząsteczek białka, które są na stałe
wbudowane pomiędzy fosfolipidy albo tylko luźno przymocowane do błony.
Poszczególne błony komórki różnią się od siebie rodzajem białek i lipidów, ale ich ogólny schemat budowy jest
taki sam. Cząsteczki fosfolipidów układają się naprzeciw siebie i tworzą półpłynną dwuwarstwę lipidową, w
której są zakotwiczone białka błonowe. Błona plazmatyczna nie jest strukturą sztywną: fosfolipidy i białka
przez cały czas poruszają się względem siebie. Wszystkie błony biologiczne składają się z dwuwarstwy
lipidowej oraz białek, jednak poszczególne rodzaje błon są zbudowane z różnych białek i lipidów. Na przykład
wewnętrzna błona mitochondrium zawiera inne białka, niż błona komórkowa (błona oddzielająca wnętrze
komórki od płynu zewnątrzkomórkowego)
2. Fosfolipidy – struktura i właściwości
Fosfolipidy - Cząsteczka fosfolipidu składa się z dwóch fragmentów różniących się powinowactwem do wody:
hydrofilowej główki i hydrofobowego ogonka. Hydrofobowy ogonek cząsteczki fosfolipidu jest utworzony
przez dwa łaocuchy kwasów tłuszczowych. W skład hydrofilowej główki fosfatydylocholiny (jednego z
głównych fosfolipidów błon biologicznych) wchodzą:
- reszta glicerolu,
- grupa fosforanowa,
- reszta choliny połączona z grupą fosforanową.
3. Funkcje błon biologicznych
•pełnią funkcje enzymatyczne, katalizując różne reakcje metaboliczne,
•reagują na bodźce chemiczne, termiczne i mechaniczne,
•utrzymują równowagą między ciśnieniem osmotycznym wewnątrz i na zewnątrz komórki.
•regulują transport wybranych substancji z i do komórki,
•chronią komórki przed działaniem czynników fizycznych i chemicznych, a także przed wnikaniem obcych
organizmów, w szczególności chorobotwórczych
4. Białka błonowe, integralne i powierzchniowe
Białka błonowe to białka związane z błonami biologicznymi. Dzielą się na białka integralne, wbudowane na
stałe w błonę i białka powierzchniowe, słabo związane z wewnętrzną albo zewnętrzną powierzchnią błony
białkowo-lipidowej
Białka integralne (transbłonowe) - Białka wbudowane w błonę plazmatyczną. Przynajmniej jeden fragment
białka transbłonowego jest „na stałe” zakotwiczony pomiędzy cząsteczkami fosfolipidów błony
Białka powierzchniowe (peryferyczne) - Luźno połączone z błoną białko, które można łatwo usunąd z
wewnętrznej albo zewnętrznej powierzchni błony biologicznej.

19
5. Białka transportowe
Białko transportowe (przenośnikowe, translokujące, permeazy) - Białko błonowe przenoszące inne cząsteczki
lub jony z jednej strony błony plazmatycznej na drugą. Białka przenośnikowe (zwane także transporterami)
potrafią rozpoznawad i wiązad cząsteczki przeznaczone do przeniesienia przez błonę. Cząsteczka przyłączona
przez transporter jest przenoszona na druga stronę błony biologicznej. Po uwolnieniu przenoszonej cząsteczki
białko przenośnikowe przygotowuje się do transportu następnej cząsteczki. Niekiedy przenoszeniu cząsteczki
przez białko przenośnikowe towarzyszy transport jakiegoś jonu w tym samym kierunku w którym przenoszona
jest cząsteczka (symport) albo w przeciwnym kierunku (antyport).
6. Pinocytoza
Pinocytoza jest to sposób odżywiania się organizmów jednokomórkowych lub wielokomórkowych (np. gąbek).
Jest to nieswoiste pobieranie małych kropel płynu zewnątrzkomórkowego do wnętrza komórek. Błona ulega
wpukleniu do środka tworząc pęcherzyk zawierający pobraną kroplę. Wewnątrz cytoplazmy dochodzi do
enzymatycznej degradacji zawartości pęcherzyka (po rozpuszczeniu otoczki uwalniane są proste związki
organiczne: aminokwasy, cukry, które są włączane do wewnątrzkomórkowych szlaków metabolicznych).
7. Transport prosty i ułatwiony
Transport przez błony biologiczne związków małocząsteczkowych - Cząsteczki różnych substancji mogą
przenikad przez błony białkowo-lipidowe na zasadzie dyfuzji, dyfuzji ułatwionej lub transportu aktywnego.
Proces przechodzenia wody przez błony biologiczne nosi nazwę osmozy.
Osmoza - Przechodzenie cząsteczek wody przez selektywnie przepuszczalną błonę białkowo-lipidową.
Dyfuzja - Proces samorzutnego przenikania cząsteczek jednej substancji pomiędzy cząsteczki drugiej
substancji.
Dyfuzja ułatwiona - Transport cząsteczek przez błonę biologiczną przy użyciu białek transportowych, ale z
zachowaniem gradientu stężeo i bez zużywania energii przez komórkę. Na drodze dyfuzji ułatwionej mogą byd
transportowane cząsteczki niektórych substancji, na przykład aminokwasów. W tym procesie uczestniczą
specjalne białka przenośnikowe wbudowane w błonę plazmatyczną. Białka transportowe biorą udział zarówno
w dyfuzji ułatwionej, jak rownież procesach transportu aktywnego. Dyfuzja ułatwiona jest szybsza od zwykłej
dyfuzji, ponieważ białka transportowe sprawnie wyłapują cząsteczki przeznaczone do przeniesienia przez
błonę. Jednak w przeciwieostwie do transportu aktywnego dyfuzja ułatwiona zawsze odbywa się zgodnie z
gradientem stężeo - cząsteczki są transportowane z tej strony błony, gdzie jest ich więcej, na tę stronę, gdzie
jest ich mniej. Dlatego w tym procesie nie jest zużywana energia zmagazynowana w wysokoenergetycznych
wiązaniach cząsteczek ATP.
8. Transport aktywny
Transport aktywny - Transport przez błonę biologiczną, odbywający się przeciwnie do gradientu stężeo
transportowanej substancji, a więc są one wypompowywane z roztworu, w którym jest ich mniej, do
roztworu, w którym jest ich więcej. Pokonanie gradientu stężeo wymaga zużycia pewnej ilości energii
zmagazynowanej w ATP.
9. Translokacja grupowa

20
Translokacja grupowa - Jest formą transportu aktywnego, ale różni się od typowego tym, że w czasie
wchodzenia do komórki substrat ulega modyfikacji. Natomiast w omówionym wcześniej typowym transporcie
aktywnym, cząsteczka uwalniana w cytoplazmie jest taka sama jak na zewnątrz. A w w translokacji grupowej,
pobrany cukier, dostarczany jest do wnętrza komórki w postaci fosfocukru. Glukoza, fruktoza, mannoza i inne
węglowodany są pobierane za pośrednictwem systemu fosfotransferazowego zależnego od
fosfoenolopirogronianu (PEP). W translokacji grupowej uczestniczą cztery enzymy (schemat). Enzym II jest
integralnym białkiem błony, który tworzy kanał i katalizuje fosforylację cukru. Grupa fosforanowa nie pochodzi
bezpośrednio od PEP, lecz zostaje najpierw przekazana przez enzym I do małego, termostabilnego białka,
zwanego HPr. Ufosforylowana forma HPr (HPr ~ P) reaguje z enzymem peryferycznym białkiem błony(enzym
III), od którego enzym II odbiera grupę fosforanową i przenosi ją na cukier. Enzymy błonowe II i III są swoiste
dla poszczególnych cukrów, podczas gdy enzym I i HPr uczestniczą we wszystkich procesach przenoszenia
(translokacji) cukrów z udziałem PEP. W transporcie niektórych cukrów nie uczestniczy enzym III.
Metabolizm węglowodorów-
1. Glikoliza – przebieg (ogólnie) i znaczenie
Jedną z najważniejszych przemian, jakiej podlega cukry w organizmach żywych jest glikoliza.
Glikoliza zachodzi w cytoplazmie i może przebiegać zarówno w warunkach tlenowych jak i
beztlenowych. Sumarycznie procesy te możemy opisać równaniami:
Przemiana beztlenowa
C6H12O6 --> 2CH3CH(OH)COOH + 57kcal
Przemiana tlenowa
C6H12O6 + 6O2 --> 6CO2 + 6H2O + 677kcal
Glikoliza jest łańcuchem reakcji przekształcających glukozę (cukier prosty) w pirogronian z
jednoczesną produkcją ATP.
Proces ten składa się z szeregu reakcji chemicznych, które można zgrupować w dwa podstawowe
etapy. Pierwszy z nich polega na dwuetapowym przyłączeniu reszt fosforanowych do cząsteczki
glukozy i podzielenie 6-węglowej ufosforyzowanej cząsteczki na dwa 3-węglowe aldehydy 3-
fosfoglicerynowe. Każdy etap fosforylacji glukozy wymaga rozkładu jednej cząsteczki ATP, więc
podwójna fosforylacja jednej cząsteczki glukozy pochłania 2 cząsteczki ATP.

21
Cykl pentozowy - przebieg (ogólnie) i znaczenie
Cykl pentozowy ( szlak pentozofosforanowy, rybulozowy) to utlenianie glukozy na innej
drodze niż szlak glikolityczny. Ma znaczenie w metabolizmie jako źródło czynników
redukujących do wytwarzania NADPH oraz jako mechanizm syntezy i dostarczania pentoz
(cukrów pięciowęglowych). Sumarycznie z sześciu cząsteczek glukozy wchodzących do cyklu
jedna podlega całkowitemu utlenieniu, a pięć regeneruje się i ponownie wchodzi w cykl. Cykl
pentozowy poprzez związki trojwęglowe może łączyć się z cyklem Krebsa. Przemiany w tym
szlaku rozpoczynają się od glukozo-6-fosforanu, który na drodze różnych reakcji przekształca się w
pięciowęglowy cukier: rybulozo-5-fosforan, odgrywający ważną rolę w reakcjach związanych z
fotosynteza, a także jest źródłem pentoz wchodzących w skład nukleotydow i kwasów nukleinowych.
Podobnie jak glikoliza, zachodzi on w całości w cytoplazmie komórki.
Cykl Krebsa
1. Przebieg (ogólnie) i znaczenie cyklu Krebsa
Podczas jednego obrotu cyklu zachodzi pięć reakcji dehydrogenacji, w których wodór
przenoszony jest na NAD+ lub FAD+. Zredukowane koenzymy są dalej utleniane w łańcuchu
oddechowym. Początkową reakcją jest kondensacja acetylo-CoA ze szczawiooctanem,
katalizowana przez syntetazę cytrynianową, gdzie wykorzystywana jest jedna cząsteczka wody i
powstaje kwas cytrynowy i CoA. Kwas cytrynowy jest przekształcany w szczawiooctan w szeregu
reakcji katalizowanych przez kolejne enzymy. Dwa razy zachodzi dekarboksylacja, przy czym
atomy węgla opuszczające cykl (jako CO2) nie pochodzą z grupy acetylowej dołączanej przez
CoA. W wyniku rekcji powstają 3 NADH+ + H+ i 1 FADH2 oraz 1 cząsteczka GTP.
Rola cyklu Krebsa nie ogranicza się do dostarczania energii (bezpośrednio lub pośrednio).
Powstające w nim związki pośrednie są substratami wyjściowymi wielu syntez komórkowych
np. aminokwasów, tłuszczów i węglowodanów.
22
2.W oparciu o podany schemat cyklu Krebsa wylicz liczbę mogących powstać cząsteczek ATP
przy zużyciu jako substratu jednej cząsteczki acetylo-koenzymu A
- 3 cz NADH- każda daje po 3 ATP co się równa 9ATP
- 1 cz FADH
2- równa dwóm cząsteczkom ATP
=2 ATP
- GTP (równoważnik ATP) 1 ATP
- Razem 12 ATP zysku z jednej czasteczki szczawiooctanu tym samym z 1 cząsteczki acetylo-koenzymu A
Metabolizm węglowodorów
1. Oksydazy i oksygenazy – definicja i rola
Oksydazy - stanowią grupę enzymów katalizujących odrywanie się elektronów od utlenionego
substratu i dwu- lub czteroelektronową redukcję cząsteczki tlenu. Po połączeniu się z protonami
powstaje cząsteczka H2O2 lub H2O. Do tego zespołu należą m.in. oksydazy cytochromowe.
W procesy degradacyjne produktów naftowych (w warunkach tlenowych) włączone są głównie
enzymy należące do klasy oksydoreduktaz (oksydazy, oksygenazy, dehydrogenazy), hydrolaz i
liaz (dekarboksylazy).
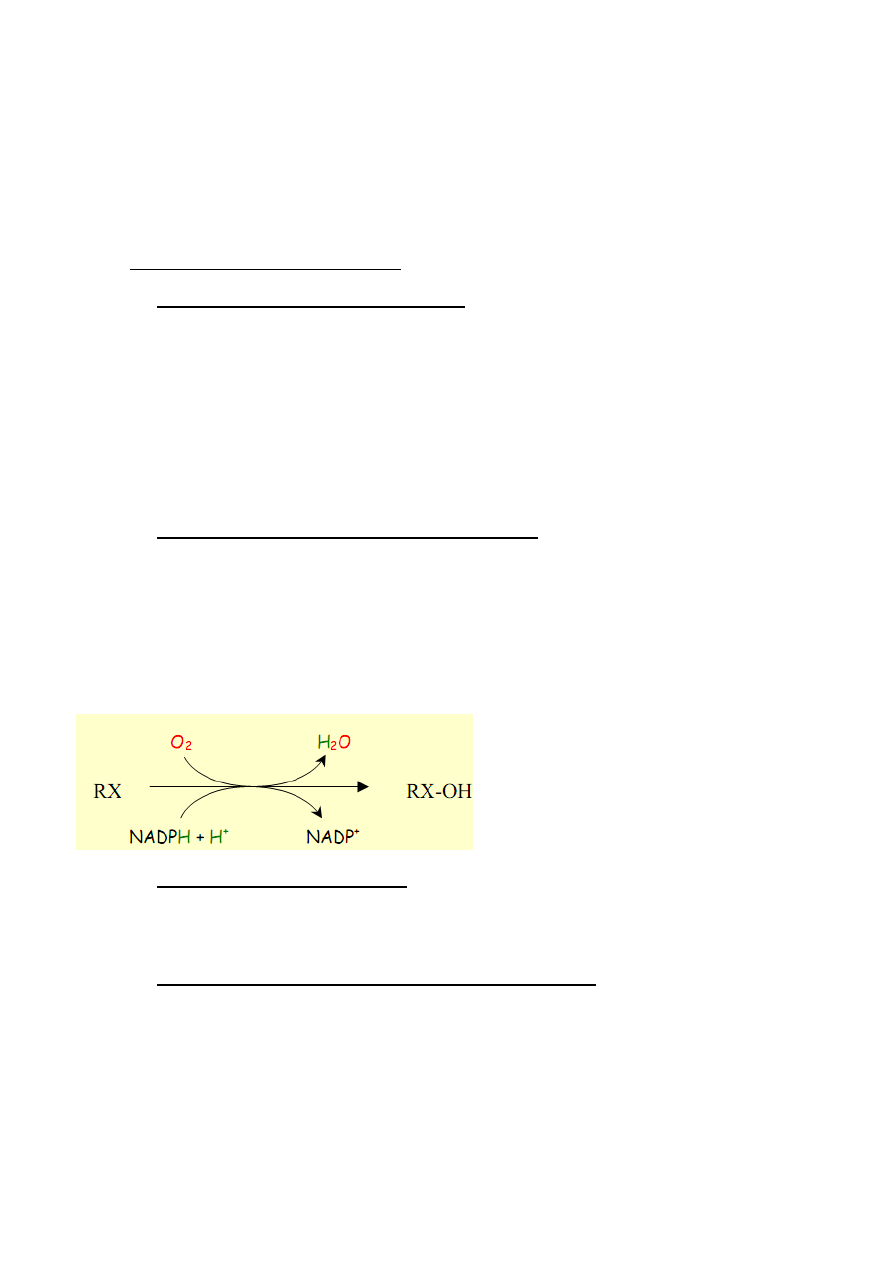
Oksygenazy - katalizują proces wbudowywania tlenu w cząsteczkę. Wyróżnia się oksygenazy
właściwe tj. dioksygenazy oraz monooksygenazy, do których zalicza się hydroksylazy.
2. Dioksygenazy i monooksygenazy – definicja i rola
Dioksygenazy- włączają dwa atomy tlenu do substratu. Istnieją dwa rodzaje diooksygenaz.
Dioksygenazy wymagające udziału NADH i NADPH, katalizujące reakcje hydroksylacji substratu
oraz drugi typ dioksygenaz nie wymagający udziału NAD(P)H, katalizujący rozerwanie
pierścienia aromatycznego
Monooksygenazy – katalizują włączenie jednego z atomów tlenu do hydroksylowanego substratu,
podczas gdy drugi atom tlenu wiązany jest w cząsteczkę wody z udziałem NADH lub NADPH,
zgodnie z równaniem:
1. Dehydrogenazy – definicja i rola
Dehydrogenazy – katalizują odrywanie atomów wodoru od utlenionego substratu i przenoszą
je na inne enzymy czy związki pośrednie. Nie mają zdolności przenoszenia elektronów
bezpośrednio na tlen. Akceptorem atomów wodoru może być: NAD+, NADP+, FMN lub FAD.
2. Oksydacja terminalna, subterminalna i omega-oksydacja
Biorąc pod uwagę strukturę chemiczną związku oraz skład i aktywność flory bakteryjnej - rozkład n-
alkanów może odbywać się na drodze:
• oksydacji terminalnej,
• oksydacji subterminalnej,
• bądź ω- oksydacji.

23
Terminalna oksydacja - Najczęściej włączenie (insercja) aktywnego tlenu następuje przy
końcowym węglu w łańcuchu alkilowym węglowodorów z wytworzeniem alkoholu. Dalsze
utlenienie alkoholi, przez kolejno aldehydy i kwasy organiczne, kończy proces beta oksydacji.
Deiterminalna oksydacja- insercja tlenu następuje na obu końcach łańcucha alkilowego
alkanów, co w efekcie kolejnych reakcji utleniania daje kwas dikarboksylowy.
Subterminalna oksydacja- oksydacja dotyczy atomów węgla położonych subterminalnie w
cząsteczkach węglowodorów i prowadzi do przekształcenia ich w drugorzędowe alkohole a
następnie w ketony i estry.
Omega-oksydacja – jest charakterystyczny dla degradacji alkanów rozgałęzionych. Obecność
podstawników jest czynnikiem hamujących procech beta- oksydacji z tego względu kwasy tłuszczowe
są atakowane na drugim końcowym węglu prowadząc do powstania kwasów dikarboksylowych.
3. Jakie produkty zazwyczaj powstają w pierwszym etapie transformacji związków
aromatycznych w warunkach aerobowych?
Większość spośród związków aromatycznych występujących w przyrodzie, w pierwszym etapie
mikrobiologicznej degradacji ulega oksydacji do katecholu bądź kwasu protokatechowego. Do
katecholu degradowane są pojedynczo lub podwójnie (w pozycji 1,2-) podstawione pierścienie
aromatyczne, np. w fenyloalaninie, toluenie, benzenie itp. Pierścienie aromatyczne podstawione w
pozycjach 1,3- i 1,4- oraz pierścienie podstawione wielokrotnie są przekształcane do kwasu
protokatechowego.
4. Rozszczepienie orto- i meta- pierścienia aromatycznego
Rozszczepienie pierścienia w pozycji orto- (tj. między dwoma sąsiadującymi hydroksylowanymi
atomami węgla) prowadzi do powstania kwasu cis, cis- mukonowego (produkt rozszczepienia
katecholu) bądź kwasu 3-karboksycis, cis- mukonowego (produkt rozszczepienia kwasu
protokatechowego). Produkty tych reakcji ulegają dalszym przemianom metabolicznym poprzez ten
sam związek pośredni tj. kwas 3-oksoadypinowy, a następnie w wyniku aktywacji z udziałem
transferazy-CoA do bursztynylo-CoA i acetylo-CoA, które w końcowym etapie procesu degradacji są
włączane do szlaków metabolizmu pośredniego.
Rozszczepienie pierścienia w pozycji meta- (tj. między hydroksylowanym i niehydroksylowanym
atomem węgla), katalizowane przez dioksygenazy powoduje powstanie semialdehydu kwasu 2-
hydroksymukonowego, który następnie wchodzi w szlaki metabolizmu pośredniego poprzez
pirogronian, aldehyd octowy i inne produkty pośrednie, zależnie od typu podstawienia powstałych
kwasów alifatycznych. Wielopierścieniowe węglowodory aromatyczne, zawierające struktury
skondensowane, rozkładne są przez sukcesywne otwieranie kolejnych pierścieni, a mechanizm
rozszczepiania pierścieni zbliżony jest do mechanizmu rozszczepiania benzenu.
1. Ksenobiotyki – definicja
Pisze w mechanizmy adaptacyjne drobnoustrojów czyli wyżej
2. Kometabolizm – definicja i rola
Kometabolizm - niezależne współdziałanie dwóch organizmów, polegające na tym, że jeden z nich
przypadkowo modyfikuje daną cząsteczkę nie odnosząc przy tym żadnych korzyści. Zmieniona

24
cząsteczka staje się wtedy dostępna dla drugiego organizmu, który odnosi korzyć z jej rozkładu. W
ten sposób jest metabolizowane np.: DDT.
1. Bioaugmentacja – definicja i rola
Jest to rodzaj bioremediacji In situ, czyli technologia usuwania zanieczyszczeń (głównie substancji
ropopochodnych) z gleby i wód podziemnych za pomocą żywych mikroorganizmów w celu
katalizowania, destrukcji lub transformacji różnego rodzaju zanieczyszczeń w formy mniej szkodliwe.
Wprowadzenie dodatkowych mikroorganizmów tzw. szczepienie gleby
1. Biofilmy bakteryjne – etapy formowania
Biofilm jest to trójwymiarowa kolonia bakterii zawartych w macierzy zewnątrzkomórkowych
polimerów wykazujących zdolność adhezji do wilgotnych powierzchni stałych oraz do siebie
nawzajem.
Formowanie się matrycy biofilmu ma na celu ochronę mikroorganizmów przed
degradacyjną działalnością czynników środowiskowych, w tym na działanie antybiotyków.
ETAPY POWSTAWANIA BIOFILMÓW:
1. Swobodnie pływające bakterie osiadają na podłożu i przyczepiają się do niego, tworząc
skupiska -
2. Bakterie tworzące skupisko zaczynają wydzielać lepką substancję pozakomórkową
3. Bakterie przekazują sobie sygnały stymulujące je do rozmnażania się i tworzenia kolonii
4. Powstają gradienty chemiczne umożliwiające współistnienie bakterii różnych gatunków i
znajdujących się w rozmaitych stanach metabolicznych
5. Niektóre komórki opuszczają biofilm, być może po to, by tworzyć nowe skupiska
1. Quorum sensing – definicja i rola w formowaniu biofilmu bakteryjnego
Quorum sensing jest to sposób "porozumiewania się" między sobą bakterii za pomocą cząsteczek
związków chemicznych.
Rola: Gdy hodowla bakteryjna osiągnie duże zagęszczenie, aby nie zginąć z powodu braku pokarmu
lub samozatrucia metabolitami, wytwarza związki chemiczne które informują kolonię o potrzebie
zaprzestania rozmnażania.
Wyszukiwarka
Podobne podstrony:
Opracowane zagadnienie do biochemii(1)
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie ćw 7 zależ
Opracowane zagadnienia do kolokwium, Temat 1
OPRACOWANE zagadnienia do EGZ
edukacja matematyczna w przedszkolu-opracowane zagadnienia do egzaminu, UKW
Opracowane zagadnienia do egz z ped. ogólnej, Pedagogika ogólna
Opracowanie zagadnień do zaliczenia, PWR, Zarządzanie, SEMESTR VI, Informatyczne sys. zarządzania
opracowanie zagadnień do ćwiczenia2 PDLZBX57FORLKTRTS3LPVL263TODFGQJMZYUPNY
Opracowane zagadnienia do kolokwium Temat 5 pomoc? minimis
Etnologia religii opracowane zagadnienia do egzaminu
11 Opracowanie zagadnienia do egzaminu inzynierskiego
Odpowiedzialnosc odszkodowawcza panstw czlonkowskich za naruszenie prawa wspolnotoweg, Pelne opracow
Opracowane zagadnienia do kolokwium Temat 4
Opracowane Zagadnienia Do Egzaminu - Zaawansowana Metodyka Wychowania Fizycznego, 1
Opracowane Zagadnienia Do Egzaminu - Zaawansowana Metodyka Wychowania Fizycznego, 1
więcej podobnych podstron