
Mechanizmy reakcji chemicznych - sposoby obrazowania
Mechanizmy
reakcji chemicznych
to swoiste opisy ich faktycznego przebiegu, razem ze wszystkimi stadiami i
produktami pośrednimi. Niektórzy za integralną część mechanizmu reakcji uważają zapis stanów
energetycznych oraz podstawowych danych kinetycznych (szybkości reakcji i wpływu różnych czynników na
tę szybkość: np. temperatury, ciśnienia, katalizatora). Mechanizm reakcji tłumaczy, jak reagujące cząsteczki
oddziałują ze sobą, tworząc końcowy produkt. Mówi o sposobie i kolejności powstawania podczas reakcji
nowych wiązań i rozrywania starych. Wyjaśnia, co dzieje się z elektronami walencyjnymi w cząsteczkach
biorących udział w reakcji” [1]. „Pokazuje jaka jest względna szybkość każdego etapu. Pełny mechanizm
musi również uwzględnić wszystkie substraty, wszystkie utworzone produkty oraz odpowiednie ilości każdego
z nich” [2].
Typowe równania chemiczne są zwykle tylko sumarycznym zapisem przebiegu reakcji, bez wnikania w jej
kolejne etapy. Większość reakcji obejmuje jednak kilka do kilkadziesiąt etapów pośrednich, w czasie których
dochodzi do rozrywania jednych i tworzenia innych
wiązań chemicznych
. Poszczególne akty zrywania lub
powstawania wiązań nazywa się
reakcjami elementarnymi
. Kompletny zapis wszystkich równań
elementarnych zachodzących w trakcie reakcji jest właśnie tym, co zwykło się nazywać jej mechanizmem.
Znajomość mechanizmu reakcji, oprócz znaczenia czysto poznawczego, ma także ogromne znaczenie
praktyczne. Rozumiejąc mechanizm reakcji można nią świadomie sterować, zmieniając parametry jej
środowiska. Na podstawie mechanizmu wyznacza się także efekty energetyczne reakcji i jej kinetykę, które
to dane są często niezbędne do zastosowania danej reakcji w przemyśle.
Typy mechanizmów reakcji
Jakkolwiek reakcje chemiczne przebiegają na wiele różnych sposobów, typowe mechanizmy zostały dość
dokładnie sklasyfikowane. Nazwy klas mechanizmów reakcji składają się ze skrótów literowo-cyfrowych.
Wielkie litery określają ogólny rodzaj reakcji (eliminacja, substytucja, addycja), małe określają charakter
chemiczny
cząsteczki
„atakującej”, a cyfra określa ile cząsteczek uczestniczy w etapie limitującym szybkość
całej reakcji (czyli najwolniejszym). I tak np.
•
S
N
1 to substytucja nukleofilowa jednocząsteczkowa. W trakcie reakcji przebiegającej według
mechanizmu S
N
1 następuje jednoczesne zerwanie wiązania C-X i utworzenie wiązania między
reaktywnym centrum a atakującym nukleofilem. W stanie przejściowym nukleofil zbliża się do
atakowanej cząsteczki z przeciwnej strony niż grupa odchodząca. Cechą charakterystyczną reakcji
zachodzących według tego mechanizmu jest inwersja centrum reaktywnego. Szybkość reakcji typu
S
N
2 zależy zarówno od stężenia halogenku alkilowego jak i stężenia atakującego nukleofila. Reakcji
tego typu ulegają halogenki 1˚ i 2˚, natomiast halogenki 3˚ reagują bardzo wolno
•
S
N
2 to substytucja nukleofilowa dwucząsteczkowa - jest reakcją dwuetapową, w której szybkość
pierwszego etapu decyduje o szybkości całego procesu. W pierwszym etapie substytucji
nukleofilowej następuje zerwanie wiązania C-X i halogenek opuszcza cząsteczkę jako anion
halogenkowy. Reszta cząsteczki staje się płaskim karbokationem. Jak już nadmieniono szybkość
całej reakcji jest ograniczona szybkością pierwszego etapu, zależy więc ona tylko i wyłącznie od
stężenia halogenku alkilowego. W drugim etapie następuje związanie karbokationu z nukleofilem.
Wynikiem powstania nowego wiązania jest odtworzenie tetraedrycznego centrum o hybrydyzacji sp
3
•
E1 to eliminacja elektrofilowa, jednocząsteczkowa - czyli w kluczowym etapie reakcji uczestniczy
tylko jedna cząsteczka
•
E2 to eliminacja elektrofilowa, dwucząsteczkowa - czyli w reakcji z wyjściowej cząsteczki coś ubywa,
cząsteczka ma w kluczowym etapie charakter
elektrofilowy
i w etapie tym uczestniczy tylko jedna
cząsteczka
•
S
E
1 to substytucja elektrofilowa jednocząsteczkowa
•
S
E
2 to substytucja elektrofilowa dwucząsteczkowa
•
ACN4 to addycja skoordynowana (czasami mówi się też jednoczesna) (Concerted), obojętna
(Neutral) czterocząsteczkowa - czyli w reakcji dochodzi do połączenia się cząsteczek w sposób
skoordynowany, bez powstawania produktów ubocznych, a w kluczowym etapie uczestniczą
wszystkie 4 cząsteczki na raz.
Ustalanie mechanizmów reakcji
Mechanizmy reakcji ustala się na różne sposoby:
•
Najbardziej podstawowym jest zbadanie
kinetyki
danej reakcji. Reakcje chemiczne zachodzące
według jednego z ogólnych typów mają zazwyczaj bardzo zbliżony mechanizm i podobną kinetykę.
Dzięki temu istnieją stablicowane katalogi ogólnych schematów kinetycznych odpowiadających
danemu typowi reakcji. Typ reakcji można więc w dużym stopniu ustalić porównując dane kinetyczne
(
szybkość reakcji
, jej
rząd
względem wszystkich substratów) badanej reakcji ze schematem
przypisanym do danego typu.
•
Drugim sposobem jest próba analizy produktów pośrednich reakcji. Robi się to albo w trakcie samej
reakcji (zwykle metodami
spektroskopowymi
) albo usiłuje się "zatrzymać" reakcję na etapie
pośrednim i wyodrębnić pośrednie produkty.
•
Trzecim sposobem jest bezpośrednia obserwacja przebiegu zrywania i powstawania kolejnych wiązań
chemicznych. Pomocne są tu często tzw. szybkie (tj. możliwe do przeprowadzenia szybciej niż sama
reakcja) techniki analityczne takie jak np.
chromatografia
stop flow.
•
Czwartym jest
izotopowe
śledzenie, co się dzieje z wybranymi fragmentami cząsteczek w czasie
reakcji. Robi się to syntezując najpierw substraty zawierające duże ilości nietypowego izotopu
(izotopu C
14
w określonych ściśle miejscach, a następnie analizując, w których miejscach znalazły się
one w produktach. Wymaga to już jednak posiadania ogólnej koncepcji przebiegu danej reakcji.
•
Ostatnim etapem jest zwykle weryfikacja eksperymentalna proponowanego mechanizmu. Polega ona
na zmianach tych warunków, które według proponowanego mechanizmu powinny mieć istotny
wpływ na nią i badaniu, czy wpływ ten jest rzeczywiście taki, jak to wynika z mechanizmu [3].
Sposoby przedstawiania reakcji
Poniżej przytoczono reakcje z zakresu chemii organicznej w celu pokazania stosowanej w podręcznikach i
książkach statycznej formy zapisu:
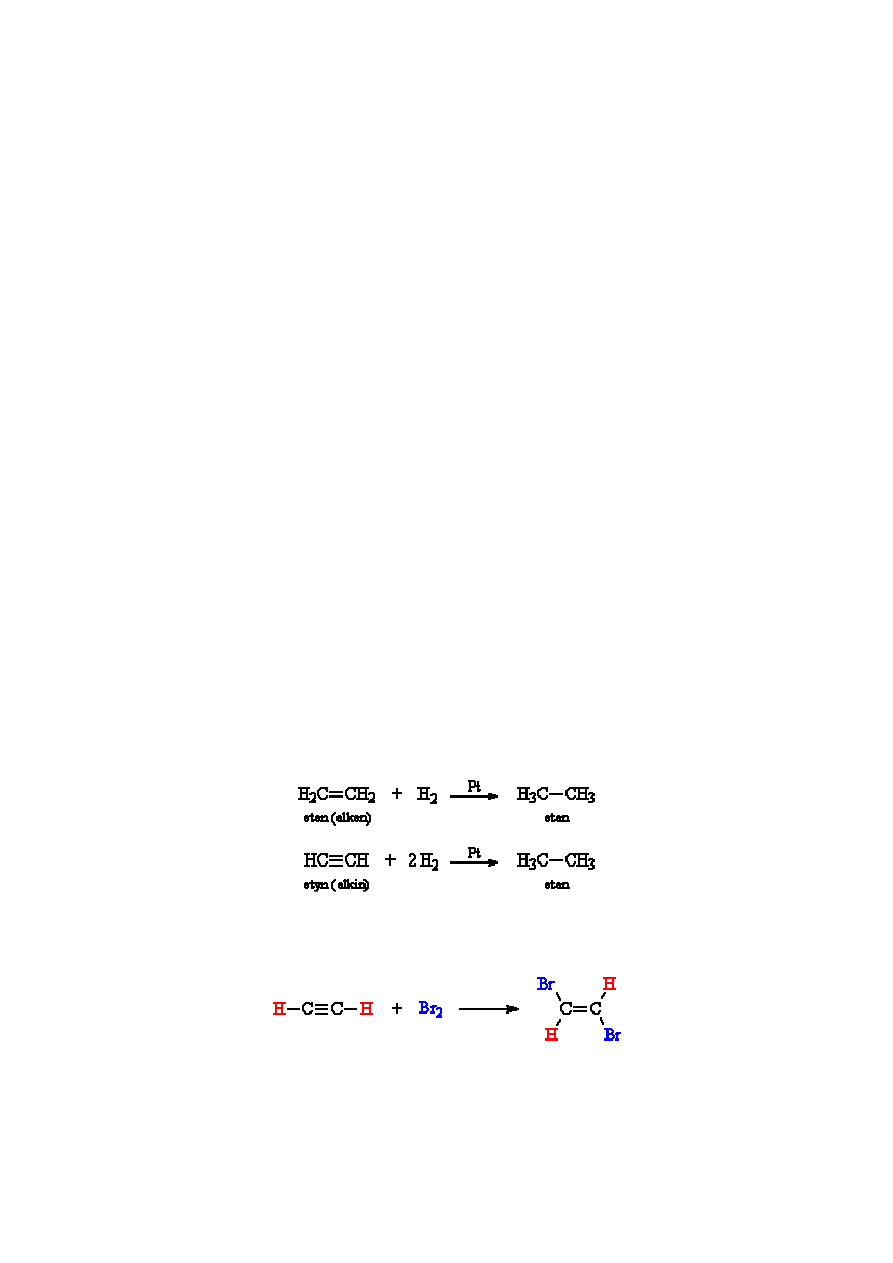
Przykład 1.
Ogólny zapis równania reakcji.
Uwodornienie węglowodorów nienasyconych, czyli przyłączenie wodoru do cząsteczek związków chemicznych
zawierających wiązania nienasycone [4]:
Przykład 2.
Zapis równania reakcji uwzględniający wiązania w postaci kreskowej.
W reakcji przyłączenia bromu do wiązania potrójnego powstaje związek z wiązaniem podwójnym węgiel-
węgiel [5]:
Jeżeli w naczyniu reakcyjnym znajduje się dostateczna ilość bromu, następuje drugi etap reakcji i powstaje
związek z wiązaniem pojedynczym węgiel-węgiel:
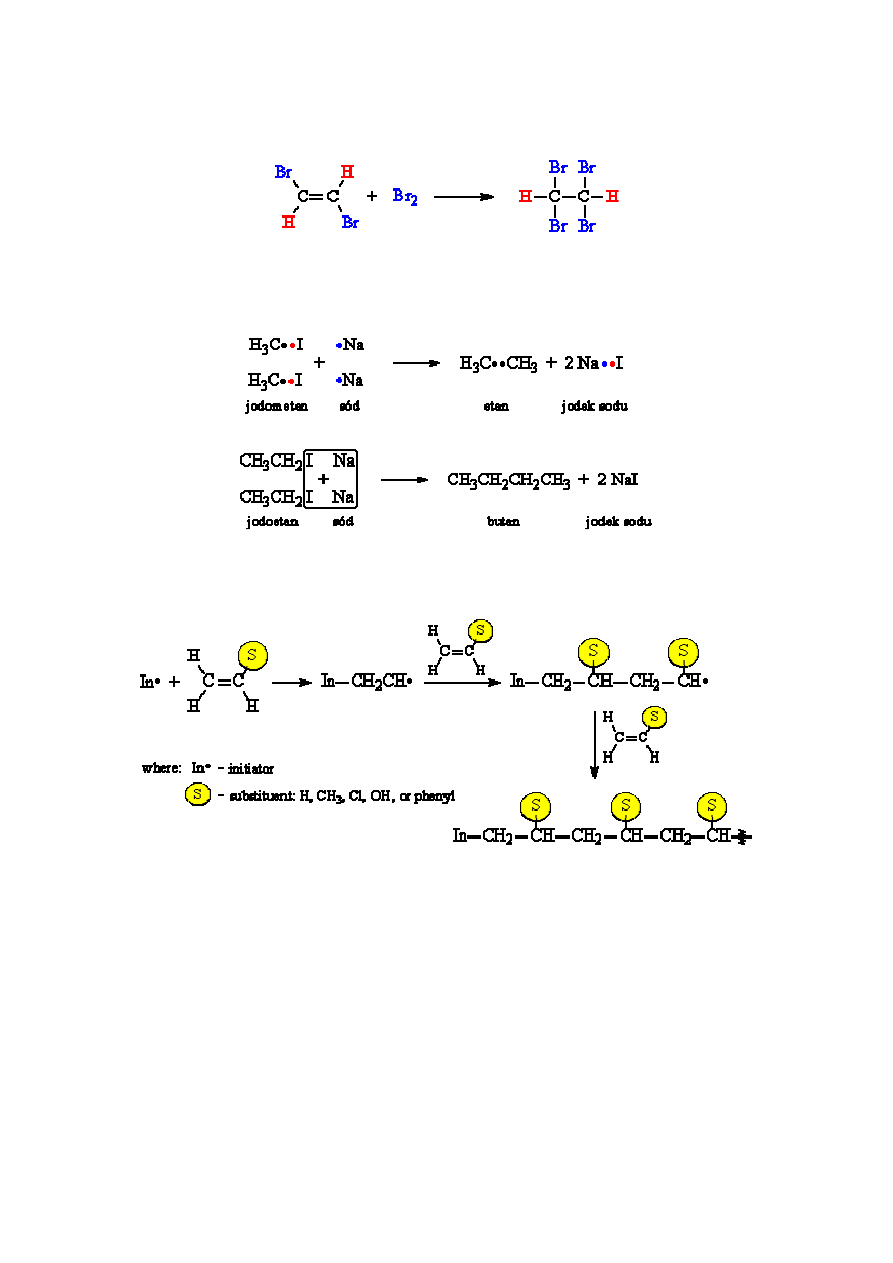
Przykład 3.
Zapis równania reakcji przedstawiający wiązania w postaci kropkowej.
Reakcja Würtza czyli reakcji jednopodstawionych halogenowych pochodnych węglowodorów nasyconych z
metalicznym sodem. W reakcji tej możemy otrzymać etan oraz węglowodory o dłuższym łańcuchu węglowym
[6]:
Przykład 4.
Zapis równania reakcji przedstawiający ogólny mechanizm polimeryzacji alkenów.
Polega na przyłączeniu do podwójnego wiązania inicjatora (In
). Reakcja przebiega w następujący sposób
[7]:
Do najczęściej stosowanych inicjatorów należą nadtlenki, które rozpadają się na wolne rodniki, te zaś
przyłączają się do cząsteczki alkenu wytwarzając jednocześnie inny wolny rodnik, który z kolei przyłączą się
do następnej cząsteczki alkenu. Jest to polimeryzacja łańcuchowa.
Przykład 5.
Mechanizm reakcji addycji bromu do alkenów.
Polega na przyłączeniu do podwójnego wiązania. Na uwagę zasługuje fakt, ze oprócz schematu umieszczono
przestrzenne modele substratów z rozkładem ładunków ( d
+
, d
-
). Reakcja przebiega w następujący sposób
[8]:
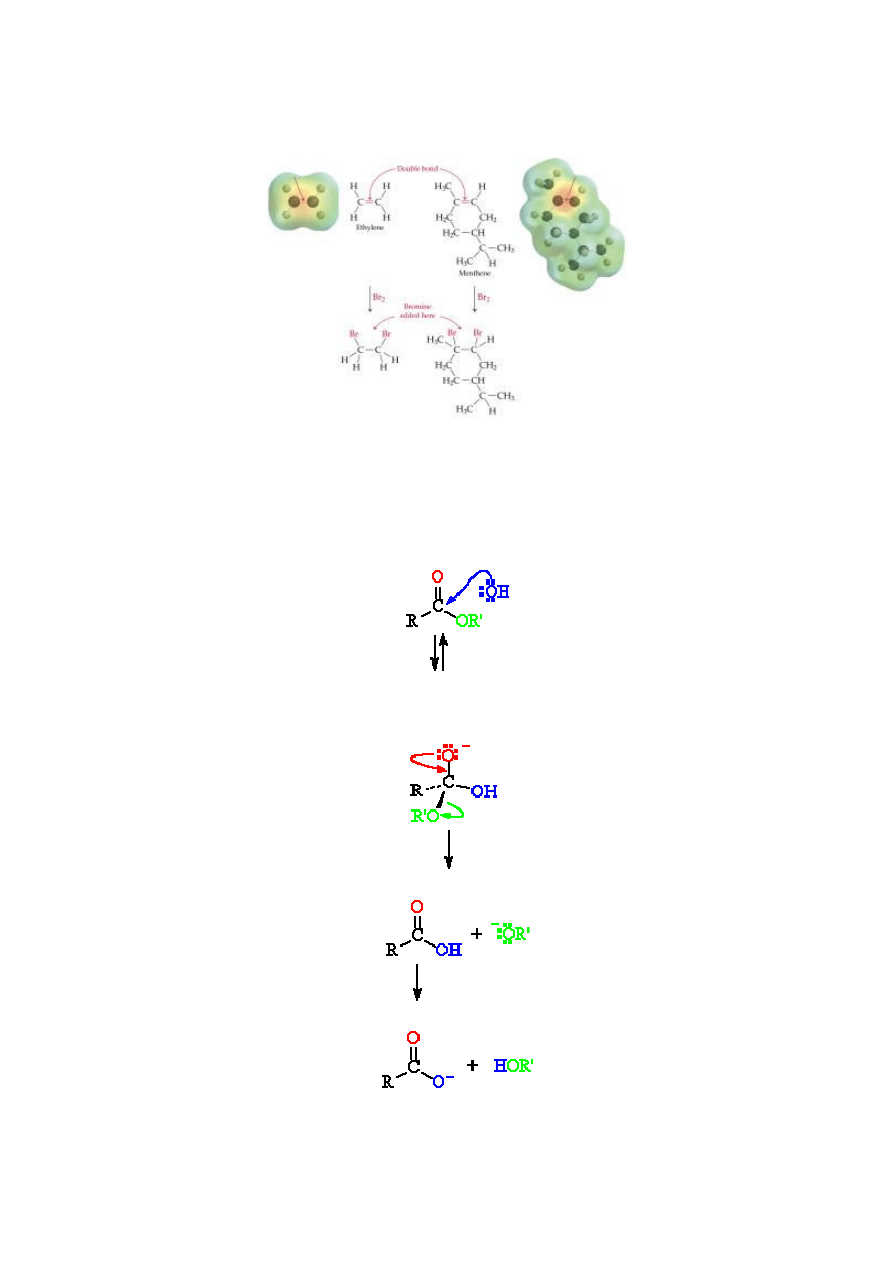
Przykład 6.
Poniżej przytoczono reakcje z zakresu chemii organicznej opierając się na najnowszym wydaniu Chemii
organicznej J. McMurry’ego, w którym to mechanizmy reakcji ujęto w nowatorski sposób stosując zapis
pionowy.
Mechanizm reakcji hydrolizy estrów katalizowanej zasadą nazywanej reakcją zmydlania (saponifikacji).
Hydroliza estru przebiega według typowego mechanizmu substytucji nukleofilowej W reakcji tej jon
hydroksylowy jest nukleofilem, który przyłącza się do atomu węgla grupy karbonylowej w estrze [9]:
Addycja nukleofilowa jonu OH
-
do estrowej grupy karbonylowej prowadzi do powstania typowego
tetraedrycznego produktu pośredniego - alkoholanu:
Eliminacja jonu alkoksylowego generuje następnie kwas karboksylowy:
Jonu alkoksylowy odrywa kwasowy proton z kwasu karboksylowego i tworzy się jon karboksylanowy:
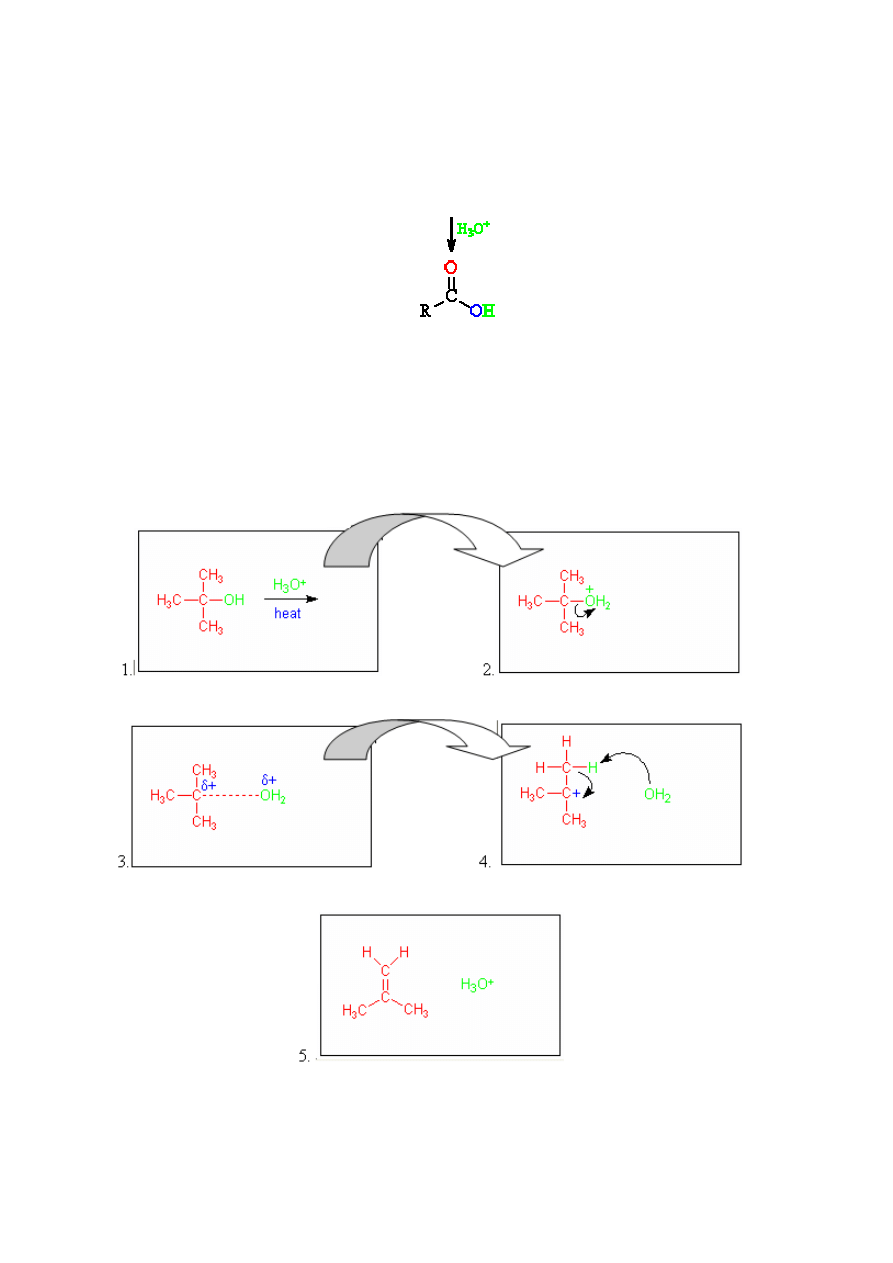
Protonowanie jonu karboksylanowego przez dodanie wodnego roztworu kwasu nieorganicznego daje wolny
kwas karboksylowy:
Mechanizmy reakcji można przedstawić również w formie pół-animowanej w postaci pojawiających się
kolejno obrazów, tzw. GIF-ów.
Przykład 7.
Reakcja eliminacji jednocząsteczkowej.
Obraz pół-animowany składający się z kilku plansz pojawiających się po sobie. Niektóre animacje opatrzone
są napisem w postaci planszy [10].
Przykład 8.
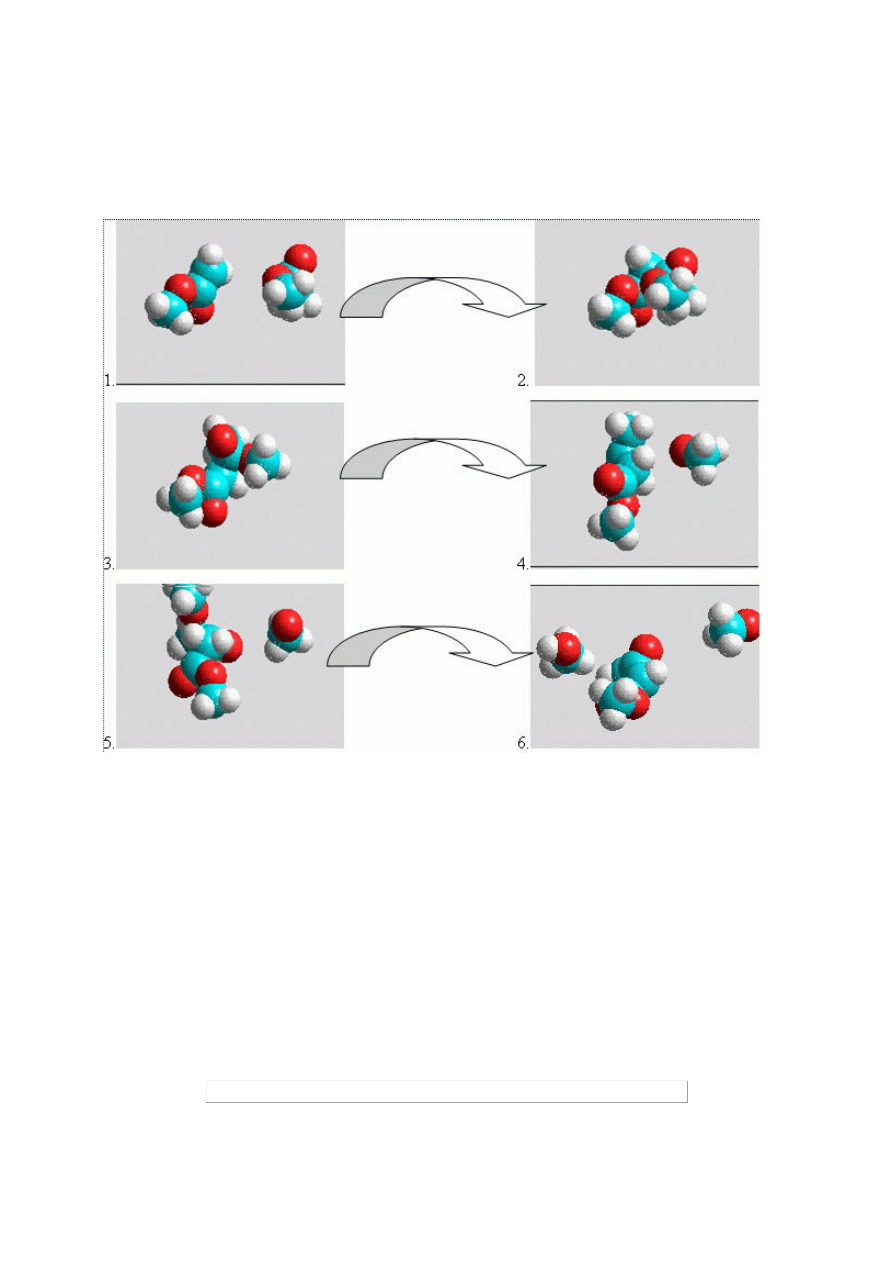
Przykład mechanizmu reakcji ukazany w sposób statyczny, związki chemiczne przedstawione w formie
kulowo-czaszowej
[11].
Przykład 9.
Przykład animacji przedstawiającej mechanizm reakcji otrzymywania etenu (etylenu) przez depolimeryzację
polietylenu. Wyjaśnienie przebiegu reakcji zostało opatrzone komentarzem lektora [12]. W zamieszczonej
poniżej tabeli umieszczono jedynie fragmenty animacji, tzw. zrzuty ekranowe, co z zasady nie oddaje ruchu
charakterystycznego dla animacji, m.in. tworzenia i rozpadania wiązań.
Rodzaj wizualizacji:
Komentarz lektora
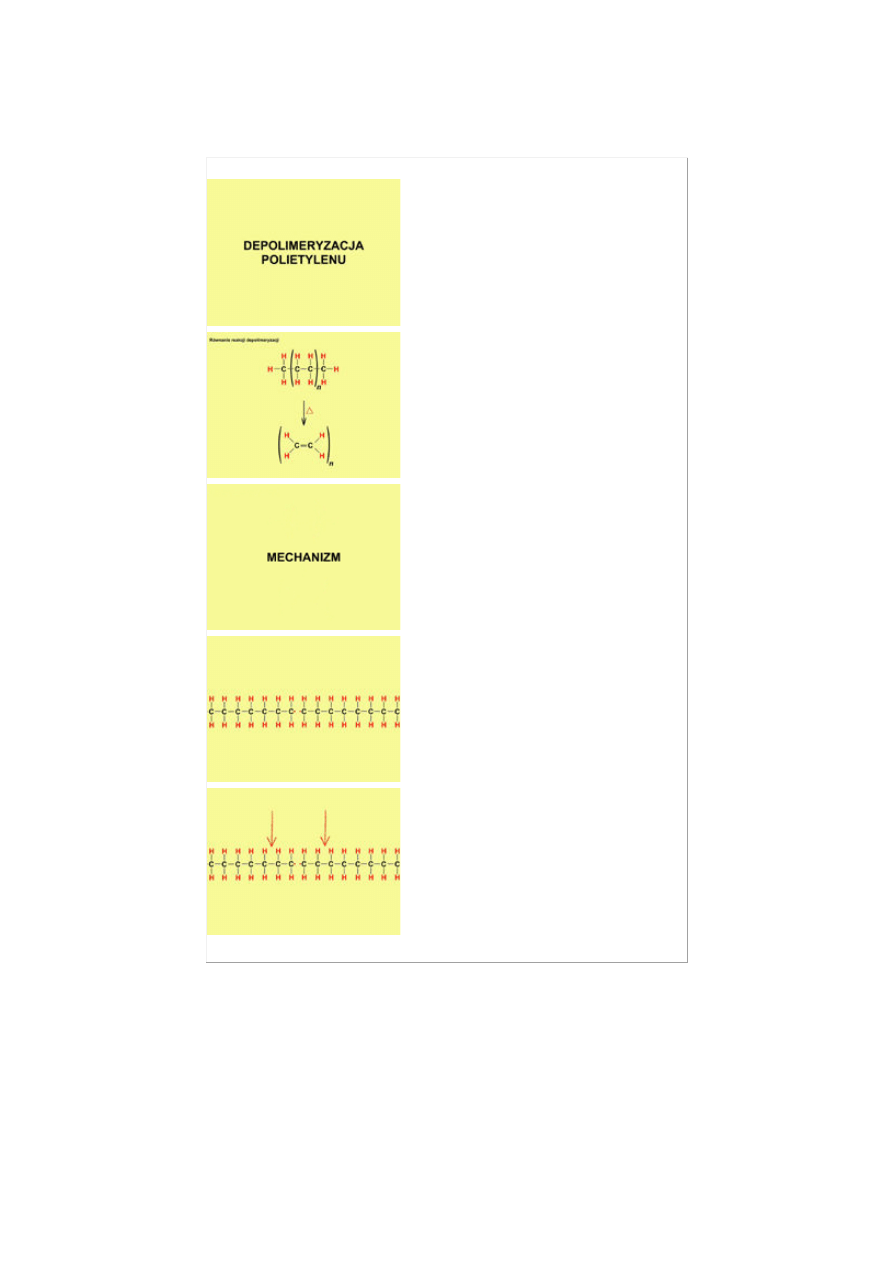
ANIMACJA
Depolimeryzacja polietylenu.
Depolimeryzacja polietylenu polega na
rozkładzie polimeru na pojedyncze
monomery. W tym przypadku eten. Proces
ten zachodzi pod wpływem ciepła.
Prześledźmy teraz dokładniej kolejne etapy
reakcji.
Pod wpływem ciepła następuje rozerwanie
wiązania polimeru z wytworzeniem rodników.
Kolejna porcja ciepła powoduje dalsze
rozrywanie wiązań polimeru. Powstałe rodniki
przekształcają się w eten.
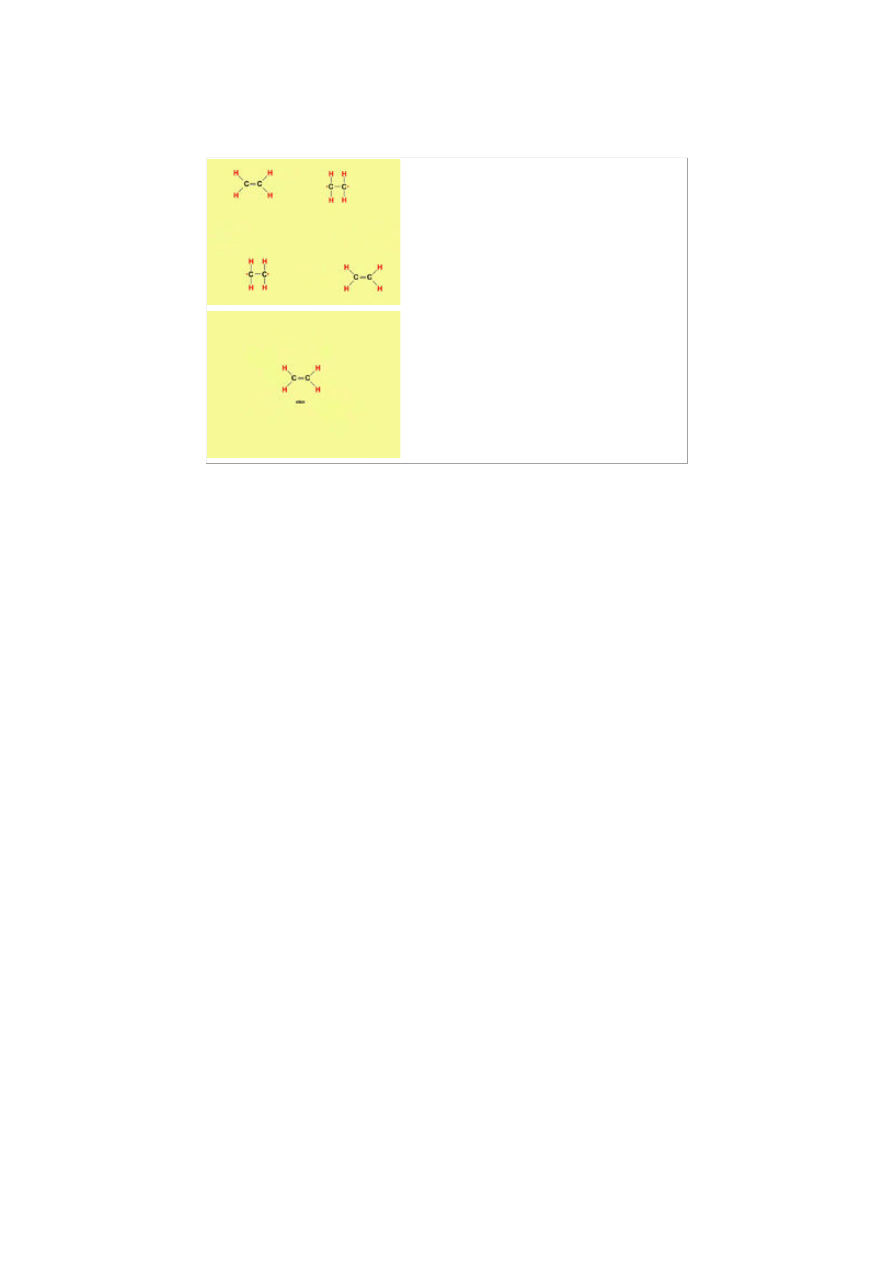
Proces ten powtarza się do czasu
wyczerpania polimeru.
Produktem depolimeryzacji polietylenu jest
eten.
Analiza prostych mechanizmów nie sprawia zazwyczaj kłopotu uczącym się. Jednak z rozumieniem
rozbudowanych mechanizmów jest już znacznie gorzej. I tutaj mogą przyjść z pomocą animacje
multimedialne ilustrując to, czego nie można pokazać za pomocą kartki i ołówka. Przygotowane w Zakładzie
Dydaktyki Chemii UAM w Poznaniu animacje oddziałując na wzrok i słuch jednocześnie, wpływają na lepsze
zrozumienie i zapamiętanie materiału oraz pozwalają pokazać to, co jest niedostrzegalne dla ludzkiego oka
[12]. Sprawiają m.in., że widzimy ruch elektronów walencyjnych, „(...) a właśnie ruch tych elektronów jest
istotą procesów chemicznych” [13].
Wyszukiwarka
Podobne podstrony:
Mechanizmy reakcji chemicznych, Studia, Chemia organiczna i nieorganiczna
szybkość i mechanizm reakcji 6.1L(1), Technologia chemiczna, Chemia fizyczna, laboratorium
w5 wzor reakcja chemiczna ilościowo
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
04 Kinetyka reakcji chemicznych i kataliza
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH
mechanizmy komunikacji chemiczn Nieznany
Jak w prosty sposób zapisać przebieg reakcji chemicznych
Jak uzgadniać równania reakcji chemicznych
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Efekty cieplne reakcji chemicznych
Aminokwasy i ich reakcje chemiczne NOTATKI Z WYKŁADÓW, Biochemia, Biochemia, aminokwasy
biochemia słowniczek, ENZYMY- to białka, ich funkcja to katalizatory, powodujące złożone reakcje che
REAKCJA CHEMICZNA, REAKCJA CHEMICZNA, przemiana chemiczna, przemiana jednych substancji, zw
reakcje chemicznew roztworach wodnych zadania
10 Typy reakcji chemicznychid 11130
2 Reakcje chemiczne sprawozdanie
więcej podobnych podstron