Instrukcja do ćwiczenia 2
BADANIE WŁASNOŚCI BIAŁEK
ZAGADNIENIA DO PRZYGOTOWANIA
●
Budowa, podział i własności amfoteryczne aminokwasów
●
Właściwości białek, białka jako polielektrolity, wpływ pH na ładunek białek i ich rozpuszczalność, właściwości
amfoteryczne. Wiązanie wody i wpływ soli na rozpuszczalność białek
●
Główne frakcje białek osocza – skład, własności i funkcje.
1. Oznaczanie punktu izoelektrycznego (pI) kazeiny
Zasada: Białka są amfoterycznymi polielektrolitami. Ładunek cząsteczki białka zależy od stężenia jonów wodorowych w
środowisku i jego wartość zmienia się wraz ze zmianą pH. Wartość pH, w którym cząsteczka białka zawiera tę samą liczbę
zjonizowanych grup dodatnich i ujemnych, odpowiada punktowi izoelektrycznemu (pI) białka, wówczas jego sumaryczny
ładunek równy jest zero. Białko w tym punkcie nie wędruje w polu elektrycznym, ma najniższą rozpuszczalność i najmniejszą
lepkość, najłatwiej je wtedy wytrącić lub wykrystalizować. Białka w pI wykazują również najmniejsze ciśnienie osmotyczne,
najsłabiej pęcznieją i nie reagują z anionami ani z kationami.
Punkty izoelektryczne (pI) przykładowych białek
Pepsyna 1,0
Albumina osocza 4,8
Insulina 5,3
Globuliny osocza 5,0-7,0
Hemoglobina 6,8
Mioglobina 7,0
Histony 10-11
Trypsyna 10,5
Cytochrom c 10,6
Wykonanie:
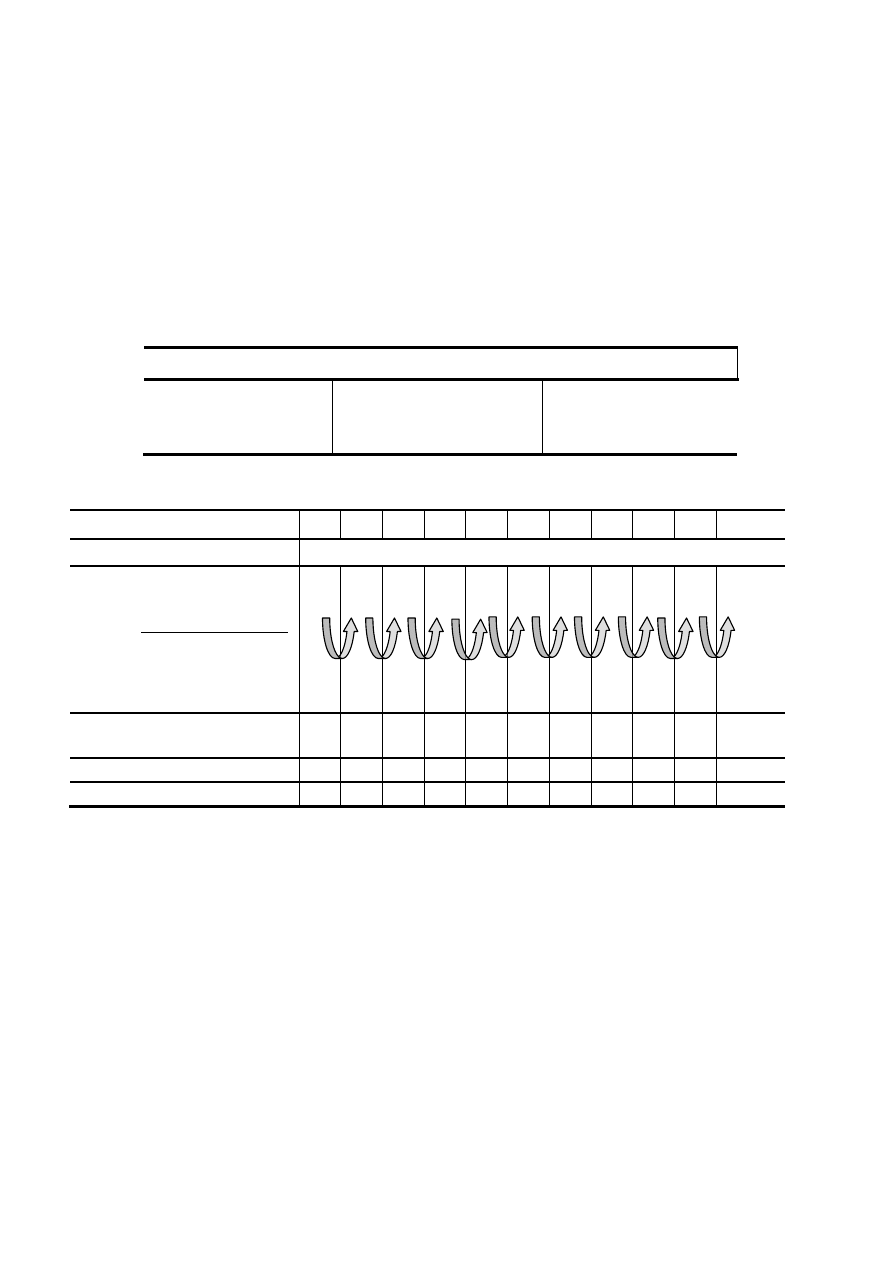
10 probówek (wysokich) w statywie opisz nr od 1 do 10 i wprowadź do nich kolejno roztwory wg instrukcji w tabeli 1:
Numer probówki
1
2
3
4
5
6
7
8
9
10
Roztwór
Dodana ilość (ml)
H
2
O
1,5M CH
3
COOH - tylko do 1
probówki, dalej kolejne rozcieńczanie:
przenosząc 5 ml z poprzedniej do
następnej probówki, po wymieszaniu
0,5% kazeina w 0,1M
CH
3
COONa (wymieszać)
5,5
4,5
1
5
5
1
5
5
1
5
5
1
5
5
1
5
5
1
5
5
1
5
5
1
5
5
1
5
5
1
5 ml
wylać
Stopień wytrącenia, po 20 min.
(w skali od 0 do +5)
Obliczona wartość pH
Zmierzona wartość pH
Ustal pI kazeiny, zinterpretuj uzyskane wyniki.
2. Hydratacja i wysalanie białek
Zasada: Rozpuszczalność białek zależy od zdolności cząsteczek do hydratacji czyli oddziaływania między polarnymi grupami
białka a dipolami wody. Na rozpuszczalność białek wpływa też obecność soli (małych stężeń) oraz wartość pH roztworu. Przez
hydratację zatem należy rozumieć otaczanie się cząsteczek białka płaszczem wodnym. Woda hydratacyjna, nieodłączna część
cząsteczki białka, wpływa na właściwości strukturalne i funkcjonalne białka. Cząsteczka białka wiąże dipole wody przez polarne
grupy hydrofilne łańcuchów bocznych aminokwasów oraz atomy N i O wiązań peptydowych. Białko rozpuszczone w niewielkiej
ilości wody wchłania ją i tworzy galaretowaty żel, w którego przestrzeniach gromadzą się cząsteczki H
2
O. Niewielkie ilości soli
nieorganicznych zwiększają rozpuszczalność białek – jest to wsalanie. Przypuszczalnie jony soli zobojętniają zjonizowane grupy
białek odpowiedzialne za przyciąganie między cząsteczkami. Jeśli jednak stężenie soli będzie wzrastać, korzystny wpływ jonów
soli na rozpuszczalność ustaje i przy dużym stężeniu soli białka rozpuszczalne w wodzie wytrącają się z roztworu, a proces ten
nazywa się wysalaniem białek. W celu wysalania stosuje się sole, których jony łatwo tworzą wodziany i pozbawiają białka
płaszcza wodnego, sprzyja to ich asocjacji w większe agregaty o zmniejszonej rozpuszczalności, dlatego agregaty białkowe
wypadają z roztworu. Stężenie soli potrzebne do wysalania białek zależy od ich właściwości oraz pH środowiska. Najłatwiej
wysolić białko w jego punkcie izoelektrycznym, ponieważ cząsteczki na zewnątrz obojętne łatwo asocjują w większe agregaty
wypadające z roztworu. Do wysalania najczęściej stosuje się (NH
4
)
2
SO
4
, Na
2
SO
4
, MgSO
4
. Wysalanie białek jest procesem
odwracalnym, usunięcie soli, np. przez dializę, sprawia, że wytrącone białko ponownie rozpuszcza się i wykazuje swe biologiczne
właściwości. Wysalanie stosuje się do wstępnego frakcjonowania białek, również osocza. Z osocza wytrąca się fibrynogen przy
25% nasyceniu siarczanem amonu, większość globulin osocza wytrąca się przy 50% nasyceniu siarczanem amonu, natomiast
albuminy i dobrze rozpuszczalne globuliny wysalane są dopiero przy 80% nasyceniu siarczanem amonu.

Wykonanie:
Przygotuj 4 probówki wirówkowe opisane nr od 1 do 4, o składzie podanym w tabeli 2:
Nr probówki
1
2
3
4
Surowica rozc. 5x
(NH
4
)
2
SO
4
nasycony roztwór
2,1 ml
0,9 ml
(30%)
2,1 ml
2,1 ml
(50%)
-
-
-
-
Próby wymieszać, obejrzeć i ocenić stopień wytrącenia bialek (+). Po 5 min.
odwirować przy 3000obr./min. przez 10 min. Zdekantować supernatant, osad osuszyć.
Supernatant z probówki 1
Supernatant z probówki 2
(NH
4
)
2
SO
4
in subst.
-
-
-
-
-
-
1 ml
-
0,6 g
-
1 ml
0,6 g
Próby wymieszać, obejrzeć i ocenić stopień wytrącenia bialek (+). Po 10 min.
odwirować przy 3000obr./min. przez 10 min. Zdekantować supernatant, osad osuszyć.
Próby osadów
osad
osad
osad
osad
H
2
O destylowana
5 ml
5 ml
5 ml
5 ml
Stopień rozpuszczalności białek w
skali od 0 do 5 (+)
Zinterpretuj uzyskane wyniki.
3. Denaturacja białek
Zasada: Denaturacja polega na zniszczeniu struktury drugo-, trzecio- lub czwartorzędowej białka, czyli natywnej konformacji,
czego konsekwencją jest utrata specyficznych biologicznych aktywności białek. Denaturacja białek zachodzi pod wpływem
różnych czynników, zarówno chemicznych jak i fizycznych. Zjawisko to pojawia się pod wpływem wysokiej temperatury,
mocnych kwasów lub zasad nieorganicznych, niektórych kwasów organicznych, rozpuszczalników organicznych, takich jak:
alkohol lub aceton w temperaturze pokojowej i wyższej oraz kationów metali ciężkich.
Denaturacja białek oligomerycznych oraz zmodyfikowanych potranslacyjnie jest praktycznie nieodwracalna. Proces ten może
być odwracalny dla białek niezmodyfikowanych, zbudowanych z pojedynczego polipeptydu takich jak rybonukleaza, która może
ulegać renaturacji po usunięciu czynnika denaturującego, włącznie z odzyskaniem aktywności biologicznej.
Wykonanie:
Przygotuj 4 probówki wirówkowe opisane nr od 1 do 4, o składzie podanym w tabeli 3:
Nr probówki
1
2
3
4
Surowica rozc. 5x
Mleko rozc. 5x
Owoalbumina
1% CH
3
COOH
1 ml
-
-
1 kropla
-
1 ml
-
1 kropla
-
1 ml
-
-
-
-
1 ml
-
Próby wymieszać i wstawić do łaźni wodnej i ogrzać do wrzenia po czym obejrzeć próby,
porównać je i zinterpretować wyniki
Stopień zmętnienia (+/-)
Do próby 1 dodać niewielką ilość NaCl in subst., wyjaśnić zmianę. Próby 1, 2, 4
odwirować przy 3000obr./min. przez 5 min. Zdekantować supernatanty (wylewając je do
zlewu). Do osuszonych osadów wprowadzić po 4 ml H
2
O dest. Próby dokładnie
wymieszać bagietką, obserwując rozpuszczanie osadów. Zinterpretować uzyskane wyniki.
Stopień rozpuszczalności osadów
białek w skali od 0 do 5 (+)
Opracowanie wyników:
1. Podaj wartość wyznaczonego punktu izoelektrycznego kazeiny oraz krótko wyjaśnij na czym opiera się oznaczenie i przedstaw
wnioski wynikające z doświadczenia na podstawie którego pI został wyznaczony.
2. Scharakteryzuj ocenianą ilość wytrąconych białek osocza poddanych wysoleniu (na podstawie ilości znaków +), scharakteryzuj
skład poszczególnych frakcji (probówki 1, 2, 3, 4) pod względem rodzaju białek i ich rozpuszczalności w H
2
O.
3. Porównaj rozpuszczalność białek osocza poddanych wysoleniu i denaturacji i zinterpretuj uzyskane wyniki.
Polecana literatura:
1. Chemia medyczna pod redakcją Iwony Żak, ŚAM Katowice 2001, Rozdziały 13-15.
2. Praktikum z chemii medycznej pod redakcją Iwony Żak, ŚAM Katowice 2001, Rozdział 12.
3. Biochemia Harpera, Murray RR i wsp. PZWL Rozdział: Białka osocza, str. 770-793.
Wyszukiwarka
Podobne podstrony:
bialka id 84760 Nieznany (2)
6 Aminokwasy i bialka id 43565 Nieznany
Aminokwasy i bialka id 59127 Nieznany (2)
bialka 2 id 84880 Nieznany (2)
bialka z neta dobre id 84806 Nieznany (2)
Bialka osocza wyklad id 84800 Nieznany
Bialka i Cukry id 84792 Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
więcej podobnych podstron