
Farmakoterapia chorób alergicznych

Podział reakcji nadwrażliwości wg Gella i Coombsa
:
Typ I – tzw. natychmiastowy lub anafilaktyczny: dotyczy tkanek obfitych w
mastocyty: skóra, spojówki, górne i dolne drogi oddechowe oraz układ
pokarmowy. U podstawy reakcji leży masywny wyrzut histaminy przez komórki
efektorowe: mastocty i bazofile.
Typ II - tzw. cytotoksyczny – antygen znajduje na powierzchni uszkadzanych
komórek lub jest nim zewnątrzpochodny związek chemiczny (hapten) połączony z
białkiem. Mediatorami reakcji alergicznej są immunoglobuliny klasy IgG i IgM
oraz białka układu dopełniacza.
Typ III – związany z powstawaniem kompleksów immunologicznych
(uogólniony: choroba posurowicza lub miejscowy: toczniowe kłębuszkowe
zapalenie nerek, RZS, układowe zapalenie naczyń). Mediatorami reakcji są
rozpuszczalne kompleksy przeciwciał IgG i IgM z antygenem zewnątrz- bądź
wewnątrzpochodnym. W reakcji uczestniczą białka układu dopełniacza, neutrofile
i inne komórki: FcγR+.
Typ IV – tzw. opóźniony lub komórkowy (rumień). Wywoływany przez antygeny
wewnątrzpochodne w chorobach autoimmunizacyjnych, alergeny kontaktowe a
także antygeny drobnoustrojów. Mediatorami reakcji są limfocyty Th1.

Najczęstsze alergeny w Polsce:
pyłki roślin (np. drzew, traw)
pokarmy (alergeny zawarte w cytrusach, mleku krowim, jajach, rybach,
orzechach)
alergeny obecne w organizmach zwierząt (w sierści kota czy psa, jadzie pszczół,
roztoczach kurzu domowego).
najczęściej alergizujące leki to penicylina oraz leki przeciwbólowe
grzyby i pleśnie
Alergeny - podział - sezonowe (dotyczy pyłków roślinnych mających swój
charakterystyczny sezon pylenia) i całoroczne ( w przypadku alergenów
roztoczy kurzu domowego, stale obecnych w naszym otoczeniu).
Reakcje krzyżowe np. brzoza – jabłko, banan - lateks

Rozwój zapalenia alergicznego
wzajemne interakcje ekspozycji alergenowej w połączeniu z predyzpozycją
genetyczną decydują o utrwaleniu odpowiedzi immunologicznej i rozwoju alergii
atopowej
kluczowe dla rozwoju alergii jest zaburzenie równowagi pomiędzy dwiema populacjami
limfocytów Th1 i Th2.
Limfocyty Th2 są źródłem cytokin zdolnych do pobudzania produkcji przeciwciał klasy
IgE (IL-4) oraz promowania rozwoju zapalenia alergicznego (IL-3, IL-5, IL-6, IL-9, IL-
13)
Główne ognisko efektorowe reakcji alergicznej stanowią mastocyty zdolne do wiązania
IgE. Przyłaczenie IgE do mastocytów powoduje aktywację komórki oraz uwolnienie do
otoczenia mediatorów:
mediatory preformowane
: obecne w ziarnistościach mastocytów i uwalniane natychmiast po
stymulacji: histamina, heparyna, tryptaza, chymaza oraz czynniki chemotaktyczne
mediatory wytwarzane przez komórkę po stymulacji: leukotrieny cysteinylowe,
prostaglandyny, tromboksany, PAF, adenozyna i wolne rodniki
cytokiny (TNF-alfa, IL-4) i chemokiny
wydzielane w kilkanaście godzin po stymulacji mastocytów
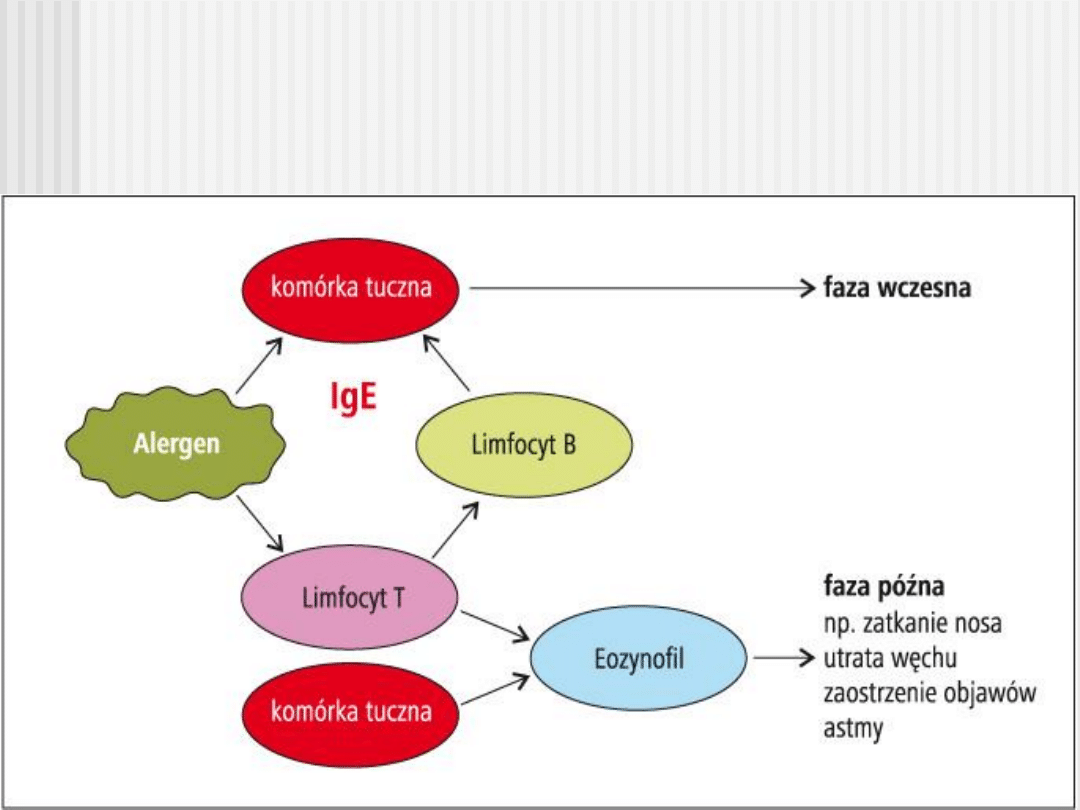
Rozwój zapalenia alergicznego
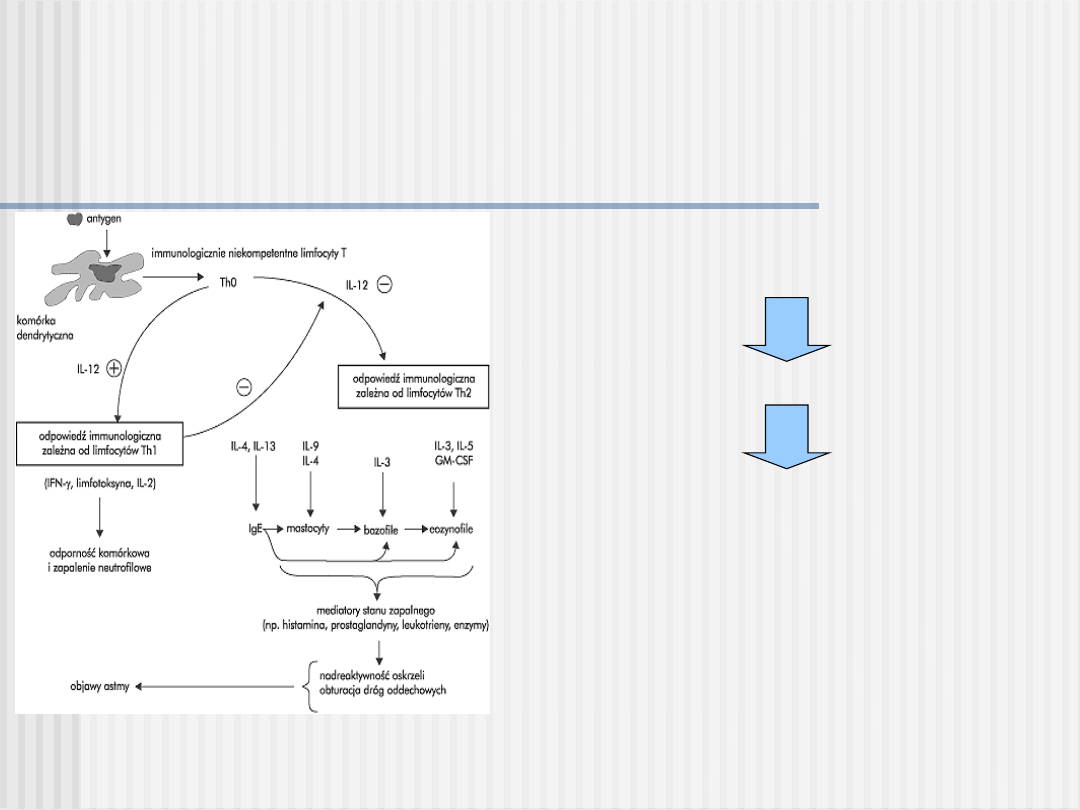
Patogeneza astmy atopowej
PRZWLEKŁY PROCES ZAPALNY
NADREAKTYWNOŚĆ OSKRZELI
EPIZODY OBTURACJI DRÓG
ODDECHOWYCH
- skurcz mięśni gładkich oskrzeli
- wydzielina w świetle drzewa oskrzelowego
- obrzęk błony śluzowej

Astma atopowa
Leczenie przyczynowe (astma atopowa)
- eliminacja alergenu
- immunoterapia swoista
Leczenie objawowe:
- leki rozszerzające oskrzela – leczenie doraźne objawów !
- leki przeciwzapalne – kontrola przebiegu choroby !
β2-MIMETYKI
KRÓTKO- I
DŁUGODZIAŁAJĄCE
GLIKOKORTYKOSTEROIDY
CHOLINOLITYKI
KROMONY
TEOFILINA
LEKI
ANTYLEUKOTRIENOWE
LEKI
ANTYHISTAMINOWE
ROLA POSZCZEGÓLNYCH GRUP
LEKÓW W LECZENIU ASTMY

GLIKOKORTOSTEROIDY
ZNACZENIE W TERAPII CHORÓB DRÓG
ODDECHOWYCH

Glikokortykosteroidy
Przeciwzapalne działanie GKS na układ oddechowy - zmniejszenie
patomorfologicznych i molekularnych wykładników zapalenia w błonie
śluzowej oskrzeli oraz zmniejszenie nadreaktywności oskrzeli
obniżenie liczby eozynofilów
hamowanie napływu mastocytów i bazofili do zmienionej zapalnie błony śluzowej
hamowanie wychwytu i prezentacji antygenów przez komórki Langerhansa
spadek syntezy mRNA dla IL-3, IL-4, IL-5, IL-13, GM-
CSF oraz obniżenie liczby
receptorów
spadek ekspresji cząsteczek adhezyjnych – ICAM, selektyny E
hamowanie uwalniania mediatorów preformowanych oraz hamowanie ich syntezy
de novo
zmniejszenie przepuszczalności naczyń - zmniejszają obrzęk błony śluzowej
oskrzeli
zmniejszenie wydzielania śluzu i poprawa oczyszczania rzęskowego
Dodatkowo:
zwiększają działanie leków β2-mimetycznych poprzez wzrost wrażliwości i
ekspresji receptorów β2

Glikokortykosteroidy wziewne
Wprowadzenie form wziewnych pozwoliło na podawanie leków
bezpośrednio do miejsca toczącego się procesu zapalnego i redukcję
ilości działań niepożądanych.
Przedstawiciele
beklometazon
budezonid
flutikazon
cyklezonid (uaktywniany w miejscu zapalenia do bardziej aktywnego
metabolitu przez lokalne esterazy -
mniej działań niepożądanych!)

Działania niepożądane glikokortykosteriodów wziewnych
zakażenia grzybicze jamy ustnej i zatok - po inhalacji płukać jamę
ustną!!!
p
odrażnienie i uszkodzenie błony śluzowej jamy ustnej
alergia kontaktowa
kaszel i chrypka (miopatia mięśni głosowych krtani)
Czy w dużych dawkach GKS wziewne mogą wystąpić skutki
ogólnoustrojowe ?- sprzeczne dane kliniczne.

Uwagi dotyczące stosowania glikortykosteroidów wziewnych
Stosowane w kontroli astmy, a nie do zniesienia nagłych objawów !
Leki z wyboru w długoterminowym leczeniu astmy przewlekłej! -
empiryczny dobór dawki leku !
astma łagodna - zaleca się przyjmowanie w dawkach nie większych niż 400
mg/24h (budezonid)
astma umiarkowana i ciężka - zaleca się przyjmowanie w dawkach średnio
800 mg/24h maksymalnie do 1500 mg/24h (budezonid)
Sterydy doustne podaje się jedynie wtedy, kiedy maksymalne dawki
sterydów wziewnych w połączeniu z innymi lekami nie przynoszą
zadowalających efektów.

Glikokortykosteroidy podawane systemowo
Najczęściej stosowane
Metyloprednizolon
Prednizolon
Prednizon
Wskazania
krótkotrwałe (3-10 dni) leczenie "uderzeniowe" w celu szybkiego
uzyskania kontroli zaostrzeń astmy
w celu długotrwałego zapobiegania objawom ciężkiej choroby alergicznej
wraz z glikokortykosteroidami w formie wziewnej

Działania niepożądane glikokortykosteroidów
podawanych systemowo
– stosowanie krótkotrwałe
zaburzenia metabolizmu glukozy
wzmożony apetyt
Zatrzymywanie wody w ustroju i przyrost masy ciała
Zmiany nastroju
Nadciśnienie tętnicze
Wrzód trawienny
Jałowa martwica głowy kości udowej ( bardzo rzadko)

Działania niepożądane glikokortykosteroidów
podawanych systemowo
– stosowanie przewlekłe
NT
osteoporoza
hiperglikemia
owrzodzenie żołądka
zaburzenia zachowania, psychozy
zaćma, jaskra
zaburzenia elektrolitowe
otyłość
hirsutyzm
skaza krwotoczna
większe ryzyko zakażeń

LEKI PRZECIWLEUKOTRIENOWE
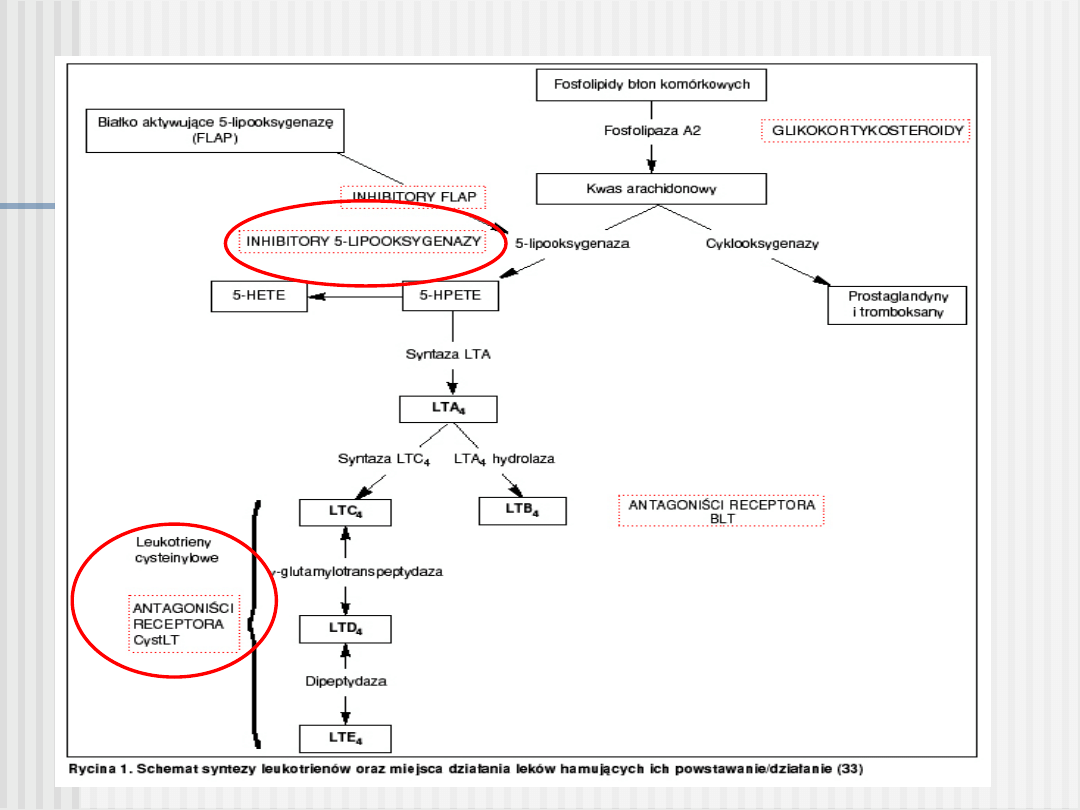

Leukotrieny - rola biologiczna
LTB
4
chemotaksja (najsilniej wobec neutrofili)
stymulacja uwalniania enzymów lizosomalnych oraz rodników nadtlenkowych przez neutrofile
zwiększenie przepuszczalności naczyń oraz przylegania neutrofilów do komórek śródbłonka)
Leukotrieny cysteinylowe (LTC
4
, LTD
4
, LTE
4
)
kurczą centralne i obwodowe drogi oddechowe (około 1000x silniej niż histamina)
zwiększają nadreaktywność oskrzeli
stymulują wydzielanie śluzu przez komórki kubkowe oskrzeli
zwiększają przepuszczalność naczyń (powstawanie przesięku i obrzęk błony śluzowej oskrzeli)
oraz śródbłonka naczyń (ułatwienie migracji komórek zapalnych i nasilenie odpowiedzi zapalnej)
chemotaksja (LTD
4
jest swoistym czynnikiem chemotaktycznym dla eozynofilów)

Podział leków antyleukotrienowych
1. Inhibitory 5-LO
Blokują 5-LO, uniemożliwiając przemianę kwasu arachidonowego do leukotrienów.
zileuton - Zyflo
, genleuton
2. Inhibitory FLAP (specyficzne białko łączące 5-LO)
Blokują FLAP, uniemożliwiając przemianę kwasu arachidonowego do leukotrienów.
3. Antagoniści receptora dla LTD
4
Blokują działanie leukotrienów C
4
, D
4
i E
4
na komórki docelowe mięśni gładkich
oskrzeli i śluzowe w oskrzelach
ablukast, cinalukast, iralukast ,
montelukast - Singulair
, pobilukast, pranlukast,
sulukast, tomelukast , verlukast,
zafirlukast - Accolate
4. Antagoniści receptora dla LTB
4
Blokują działanie LTB
4
na leukocytach, śródbłonku naczyniowym i innych komórkach
docelowych.

Blokery receptorów leukotrienowych
(W Polsce: montelukast i zafirlukast)
Mechanizm działania: selektywnie i kompetycyjnie blokują receptory cysteinylowe -
cysLT1 zmniejszając efekt działania leukotrienów uwalnianych z eozynofili
Efekt kliniczny:
zmniejszenie obrzęku błony śluzowej
zmniejszenie wydzielania śluzu
działanie rozkurczające wobec oskrzeli.
Zastosowanie:
kontrola i zapobieganie objawom astmy lekkiej przewlekłej powyżej 12 roku życia
pyłkowica
atopowe zapalenie skóry

Blokery receptorów leukotrienowych
MONTELUKAST
- podawany doustnie
- biodostępność 60-79%
- metabolizm: CYP3A4 i CYP2C9
- t1/2=3-6h
ZAFIRLUKAST
- podawany doustnie
- biodostępność 90%
- metabolizm: izoenzym wątrobowy CYP2C9
- t1/2=10h
Działania niepożądane:
podwyższenie stężenia enzymów wątrobowych, objawy dyspeptyczne, bóle brzucha, zapalenie
naczyń krwionośnych, bóle i zawroty głowy, ogólnoustrojowa eozynofilia

ZILEUTON
- selektywny inhibitor 5-lipoksygenazy (hamuje powstawanie leukotrienów
cysteinylowych oraz leukotrienu B4 o silnych właściwościach
chemotaktycznych)
- podawany doustnie
- metabolizm: izoenzym wątrobowy CYP3A4 i UDP-glukuronosyltransferazy
- jako inhibitor CYP3A4 hamuje metabolizm terfenadyny, warfaryny i teofiliny.
Przy jednoczesnym stosowaniu teofiliny i zileutonu stężenie teofiliny wzrasta
dwukrotnie.
- t1/2=2,5h
Działania niepożądane:
objawy dyspeptyczne, bóle brzucha, zawroty głowy i gorączka, podwyższona aktywność
AlAT oraz AspAT (4-5% leczonych)

KROMONY

Kromony
Przedstawiciele:
kwas kromoglikanowy (kromoglikan, kromoglikan disodowy)
nedokromil
Mechanizmy działania (działanie przeciwzapalne - blokują wczesną i późną reakcję
na alergen !)
stabilizują błonę komórkową i hamują uwalnianie histaminy i mediatorów zapalenia z
komórek tucznych w trakcie reakcji antygen – przeciwciało
hamują wpływ czynników chemotaktycznych na komórki zapalne
hamują gromadzenie się leukocytów w drogach oddechowych u chorych z astmą
hamują układ przywspółczulny i odruch kaszlowy
kromoglikan posiada dodatkowo działanie przeciwhistaminowe

KROMOGLIKAN DISODOWY
- blokuje kanały wapniowe doprowadzając do zahamowania kaskady
biochemicznej wywołującej uwolnienie histaminy i innych mediatorów
anafilaksji
- uszczelnia drobne naczynia krwionośne oraz hamuje chemotaksję neutrofili.
- podawanie: miejscowo-wziewnie na błony śluzowe oskrzeli, nosa, do
worka spojówkowego oraz doustnie
- wydalany w formie niezmienionej z moczem i żółcią
- t1/2= 1,5h

NEDOKROMIL SODOWY
- blokuje kanały wapniowe, doprowadzając do zahamowania kaskady
biochemicznej wywołującej uwolnienie histaminy i innych mediatorów
anafilaksji
- uszczelnia drobne naczynia krwionośne oraz hamuje chemotaksję eozynofili
- hamuje powysiłkowy skurcz oskrzeli oraz skurcz oskrzeli wywołany
dwutlenkiem siarki, hiperwentylacją oraz zimnym powietrzem
- zmniejsza nasilenie kaszlu astmatycznego
- podawanie: miejscowo na błony śluzowe oskrzeli, nosa, do worka
spojówkowego oraz doustnie
- wydalany w formie niezmienionej z moczem (70%) i żółcią (30%)
- t1/2=5-6 minut.

Kromony - wskazania
Przewlekłe zapobieganie objawom alergii
Doraźnie przed wysiłkiem fizycznym lub ekspozycją na znany alergen
Astma sporadyczna
Alergiczne zapalenie spojówek
Alergiczny nieżyt nosa
Alergie pokarmowe
Uwagi dotyczące stosowania
Efekt terapeutyczny może wystąpić w ciągu 2 tygodni stosowania; ocena skuteczności
leczenia może nastąpić dopiero po 4-6 tygodniach stosowani
Działania niepożądane:
Główną zaletą tych leków jest bezpieczeństwo ich stosowania! Miejscowo mogą
wystąpić ograniczone podrażnienia błon śluzowych, możliwy kaszel przy
podawaniu. Inne (bardzo rzadko): obrzęk i ból stawów, bóle głowy, wysypka,
nudności.

LEKI PRZECIWHISTAMINOWE
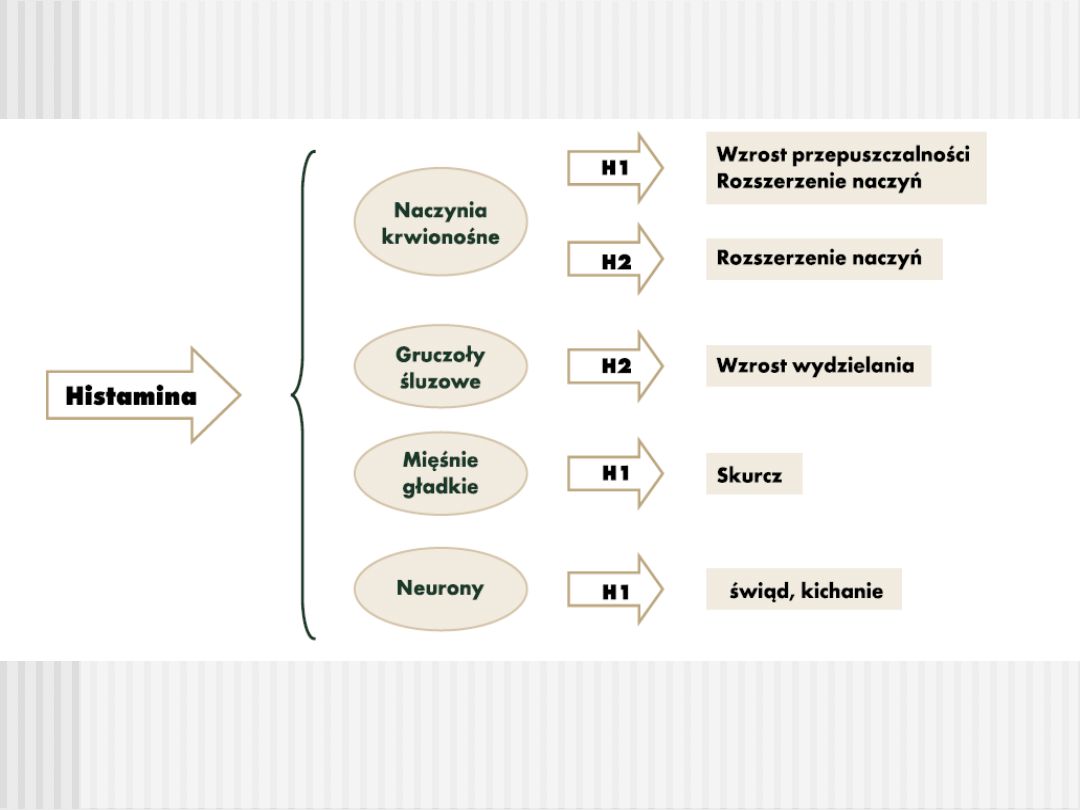

Leki przeciwhistaminowe
– I generacja
ANTAZOLINA
DIFENHYDRAMINA
KLEMASTYNA
DIMETINDEN
PROMETAZYNA
KETOTIFEN
CYPROHEPTADYNA
HYDROKSYZYNA

Leki przeciwhistaminowe
– I generacja
Mechanizm działania:
Nieselektywnie blokują receptory histaminowe, wykazują powinowactwo do receptorów
serotoninergicznych, muskarynowych, alfa-adrenergicznych, dopaminergicznych.
Przechodzą przez barierę krew-mózg!
Działania niepożądane:
-
senność, otępienie, zaburzenia koordynacji ruchowej (działanie antycholinergiczne)
-
suchość w jamie ustnej, trudności w oddawaniu moczu, zaburzenia widzenia związane z
zaburzeniami akomodacji (działanie antycholinergiczne)
- zaburzenia rytmu serca
– (difenhydramina w dużych dawkach)
- uszkodzenie szpiku:
leukopenia, agranulocytoza, niedokrwistość szpikowa
-
drżenia mięśniowe, szum w uszach, zawroty głowy

Wskazania:
r
eakcje alergiczne przebiegające gwałtownie, z zagrożeniem życia (i.v.). w leczeniu przewlekłym
zastąpione przez leki II generacji
Choroba lokomocyjna, mdłości i zawroty głowy (prometazyna, difendramina)
Przeciwwskazania:
jaskra
uszkodzenie szpiku (leukopenia, trombocytopenia, niedokrwistość)
przerost gruczołu krokowego
nadwrażliwość
Leki przeciwhistaminowe - I generacja

Leki przeciwhistaminowe
– II generacja
CETIRIZYNA
LORATADYNA
EBASTYNA
MIZOLASTYNA
AKRIWASTATYNA
LEWOKRABASTYNA
AZELASTYNA
EMEDASTYNA

Leki przeciwhistaminowe
– II generacja
wysoka selektywność – nie wykazują powinowactwa do receptorów
serotoninergicznych, muskarynowych, adrenergicznych, dopaminergicznych
w niewielkim stopniu przechodzą przez barierę krew - mózg.
szybki początek i długi czas działania.
wpływ na kanały potasowe – działanie proarytmiczne: kliniczne wydłużenie
odcinka QT: terfenadyna, astemizol, ebastyna

Leki przeciwhistaminowe
– II generacja
Mechanizm działania:
-
działanie antagonistyczne wobec receptora histaminowego
-
d
ziałanie pozareceptorowe: przeciwzapalne i immunomodulujące określane
jako „stabilizujące komórki zapalne”
1. w
pływ hamujący na uwalnianie mediatorów - histaminy i TNF-alfa z komórek
tucznych (loratadyna); IL-4, IL-
13, histaminy i LTC4 z bazofilów (metabolit
loratadyny
– desloratadyna); histaminy, tryptazy, IL-6, TNF-alfa, IL-8 z
komórek tucznych (azelastyna)
2. w
pływ na migrację eozynofilów: hamowanie chemotaksji i aktywacji
eozynofilów (cetyryzyna, ketotifen)
3. w
pływ na ekspresję czatseczek adhezyjnych ICAM-1 - obniżenie ekspresji
ICAM-1 (cetyryzyna, loratadyna)

Leki przeciwhistaminowe
– III generacja
selektywne, bez wpływu na OUN
brak wpływu na kanały potasowe
dodatkowo działanie przeciwzapalne i immunomodulujace niezwiązane z
blokowaniem receptora H1 jak leki przecwhistaminowe II generacji
DESLORATADYNA
– metabolit LORATADYNY
FEKSOFENADYNA
– metabolit TERFENADYNY
LEWOCETYRYZYNA - izomer CETYRYZYNY

Uwagi dotyczące stosowania leków przeciwhistaminowych
zastosowanie glikortykosteroidów miejscowo spowodowało zmianę pozycji
tych leków na pomocniczą bądź uzupełniajacą w terapii alergii.
Monoterapia lekami przeciwhistaminowymi jest zalecana przy:
alergiczny nieżyt nosa i spojówek (zalecenia ARIA – z wyboru w leczeniu
sezonowego alergicznego nieżytu nosa oraz całorocznego nieżytu nosa bez
dominującej blokady nosa). Łagodzą objawy: kichanie, wodnisty katar,
świąd, łzawienie
atopowe zapalenie skóry
pomocniczo: s
ezonowa, alergiczna astma oskrzelowa, łagodna astma
całoroczna

TERAPIA anty
– IgE (OMALIZUMAB)
Omalizumab
– pierwszy biologiczny lek zatwierdzony do leczenia astmy!
rekombinowane humanizowane przeciwciało monoklonalne anty-IgE
Mechanizm działania
-
wiąże się wybiórczo z epitopem w obrębie fragmentu Fc wolnego IgE
zapobiegając wiązaniu się IgE z receptorami na powierzchni komórek
tucznych i bazofilów.
-
długotrwałe leczenie przeciwciałami anty-IgE prowadzi do zmniejszenia
gęstości receptorów IgE na powierzchni komórek zapalnych
Podawany w postaci wstrzyknięć podskórnych co 2 lub 4 tygodnie
(maksymalna dawka 375 mg co 2 tygodnie)
Nazwa handlowa: XOLAIR (w Polsce preparat nie jest refundowany przez
NFZ, miesięczny koszt terapii to około 3,5 tys. złotych)

TERAPIA anty
– IgE (OMALIZUMAB)
Farmakokinetyka i metabolizm
- biodostępność 60%. max stężenie w surowicy po 6-7 dniach
- t1/2= 26 dni, szybkość klirensu 2,5ml/kg/d
- eliminacja kompleksów omalizumab-IgE zachodzi w układzie
siateczkowo-śródbłonkowym szybciej niż wolne IgG; w niewielkiej
ilości omalizumab w postaci niezmienionej wydalany jest z żółcią
Działania niepożądane
- reakcje w miejscu podania leku: zaczerwienienie i pieczenie (najczęściej)
- uaktywnienie chorób takich, jak gruźlica, stwardnienie rozsiane, chłoniaki
- objawy niepożądane związane z terapią biologiczną (nowotwory, choroby
autoimmunologiczne)

TERAPIA anty
– IgE (OMALIZUMAB)
Wskazania
- przewlekła astma od umiarkowanej do ciężkiej
- alergiczny nieżyt nosa
- alergie pokarmowe
Badania kliniczne

Swoista immunoterapia alergenem
Wskazania:
ciężki przebieg alergii (w przeszłości przebyta reakcja anafilaktyczna)
niemożność wyeliminowania alergenu ze środowiska codziennego
(pyłkowica, niektóre przypadki astmy oskrzelowej)
brak prawidłowej odpowiedzi na leczenie farmakologiczne
Warunki:
gotowość do podjęcia terapii trwającej minimum 3 lata oraz
potwierdzenie alergii testem skórnym lub oznaczeniem swoistych przeciwciał
klasy IgE w surowicy.

Swoista immunoterapia alergenem
Procedura:
Leczenie odczulające może trwać 3-5 lat
Schemat dawkowania jest ściśle ustalony przez producenta szczepionki
Początkowa dawka alergenu jest bardzo mała, następnie w miarę trwania terapii wzrasta.
Po podaniu podskórnym alergenu pacjent pozostaje pod obserwacja przez 60 minut (ryzyko
wystąpienia reakcji anafilaktycznej!)
Przez 6-
8 h po podaniu alergenu pacjent musi unikać znacznego wysiłku fizycznego , uprawiania
sportu, picia alkoholu, gorących kąpieli i ekspozycji na alergen.
Przy wystąpieniu stanów gorączkowych i innych objawów konieczne jest czasowe zmniejszenie
dawki.
Odczulanie na pyłki traw rozpoczyna się kilka miesięcy przed okresem pylenia – w okresie pylenie
dawka powinna być zredukowana.
Najwięcej korzyści przynosi odczulanie jednym alergenem – przy wskazania możliwe odczulanie 2
alergenami
– wtedy iniekcje w dwa oddzielne miejsca.

Swoista immunoterapia alergenem
Przypuszczalne mechanizmy działania:
Początkowe niskie dawki alergenu pobudzają limfocyty B do produkcji
przeciwciał - są to głównie przeciwciała klasy IgA i IgG nazywane
“przeciwciałami blokujacymi” - reagują one z alergenem uniemożliwiając mu
wiązanie się z przeciwciałami klasy IgE.
zahamowanie reakcji z udziałem limfocytów Th2 przy jednoczesnej aktywacji
reakcji z udziałem limfocytów TH1 - zmniejszenie wytwarzania IgE
stymulacja limfocytów T supresorowych, które mają wpływ hamujący na
rozwój reakcji alergicznej.

Swoista immunoterapia alergenem
Wstępna ocena leczenia:
u 7-
17% osób odczulanych na jad owadów błonkoskrzydłych po 1-2 latach
obserwowano nawrót alergii
konieczność powtarzania terapii w przypadku alergii na roztocza i pyłki traw (czy 6
letnia odporność na pyłki roślin po 3 latach terapii to wynik zadowalający ?)
brak zastosowania w alergiach pokarmowych (najczęstsza przyczyna wstrząsu
anafilaktycznego!)
Modyfikacje mające na celu poprawę skuteczności (w trakcie badań)
sprzężenie alergenu z immunostymulującym DNA pochodzenia bakteryjnego
połączenie alergenu z IL-12
szczepionka DNA złożona z DNA komplementarnego z alergenem połączonym z IL-18
Wyszukiwarka
Podobne podstrony:
NT podstawy+leczenie III rok stom
Leczenie alergicznego nieżytu nosa u dorosłych i dzieci, Ratownictwo medyczne, Rozmaitości
Alergia, Alergia i jej skuteczne leczenie, Alergia i jej skuteczne leczenie
LECZENIE ALERGII
Glikokortykosteroidy donosowe w leczeniu alergicznego nieżytu nosa, Ratownictwo medyczne, Rozmaitośc
Objawy i leczenie alergii narządu wzroku
Alergie u psow V rok
Leczenie przeciwkrzepliwe przeciwwskazania ze Szczeklika, IV rok Lekarski CM UMK, Kardiologia, Ćwicz
leczenie dysrytmii, 1.Lekarski, III rok, Chirurgia, Choroby wewnętrzne
Nieoperacyjne leczenie ropnia okołowyrostkowego, V rok, Chirurgia
Leczenie torbieli CHIR STOM ROK V
VI rok leczenie
Leki stosowane w leczeniu astmy okrzelowej, Studia - ratownictwo medyczne, 3 rok, Zawansowane proced
Przeciwskazania do leczenia tombolitycznego, IV rok Lekarski CM UMK, Kardiologia, Ćwiczenia, Prezent
więcej podobnych podstron