
1
NOMENKLATURA ZWIĄZKÓW NIEORGANICZNYCH
Związki chemiczne mogą byd określane za pomocą nazw zwyczajowych np. kwas solny,
sól kamienna) lub w sposób jednoznaczny zgodnie z zasadami nomenklatury
systematycznej. Nad regułami nomenklatury związków chemicznych zarówno organicznych,
jak i nieorganicznych pracuje systematycznie od wielu lat Międzynarodowa Unia Chemii
Czystej i Stosowanej (International Union of Pure and Applied Chemistry, w skrócie IUPAC).
Pierwsze reguły dotyczące nazw związków nieorganicznych zostały opracowane przez IUPAC
już w roku 1938, ostatnie zaś zalecenia IUPAC ukazały się w roku 1990. W Polsce, w 1988 r.,
ukazała się książka Nomenklatura związków nieorganicznych, zawierająca propozycje zmian
w dotychczasowym polskim nazewnictwie związków nieorganicznych oparte na
zaleceniach IUPAC.
Aktualnie istnieje możliwośd wyprowadzenia dwóch a nawet w niektórych wypadkach
trzech poprawnych nazw danego związku chemicznego. Obecnie w nazewnictwie
chemicznych istnieją nazwy systematyczne, dopuszczalne i zwyczajowe np. chlorek
wodoru (systematyczna), kwas chlorowodorowy (dopuszczalna), kwas solny
(zwyczajowa). Często też nazwy dopuszczalne to też nazwy zwyczajowe. Przystępując do
tworzenia nazwy, należy uświadomid sobie fakt, że w każdym połączeniu można wyróżnid
składnik elektrododatni, np. kation oraz elektroujemny np. anion czy tlen w tlenkach. O
ile przy zapisie wzoru czynnik elektroujemny zapisywany Jest na drugim miejscu, o tyle w
nazwie stanowi pierwszy jej człon.
Do określenia ilości atomów lub jonów wchodzących w skład cząsteczki preferuje się
stosowane greckich lub łacioskich afiksów zwielokrotniających. Dopuszcza się Jednak
również stosowanie afiksów polskich.
W okresie przejściowym (w którym się znajdujemy) Komisja Nomenklaturowa Polskiego
Towarzystwa Chemicznego z tych właśnie względów dopuszcza stosowanie niektórych
nazw dotychczasowych. Nowe nazwy systematyczne bardziej szczegółowo opisują wzór
związku, zwłaszcza w przypadku pierwiastków występujących na wielu stopniach utlenienia.
Dobrym tego przykładem są nazwy systematyczne tlenków manganu wg tzw. systemu
Stocka: MnO, Mn
2
O
3
, MnO
2
, MnO
3
i Mn
2
O
7
, które są określone przez kolejne nazwy: tlenek
manganu: (II), (II i IV), (IV), (VI) i (VII). Również za nazwę systematyczną uważa nazwę
podającą ilośd atomów w takim układzie dwuskładnikowym np. Mn
2
O
3
–tritlenek
dimanganu,
MnO
2
–ditlenek maganu, MnO
3
–tritlenek manganu i Mn
2
O
7
-heptatlenek dimanganu.
W tych przypadkach, występująca w starym nazewnictwie, możliwośd użycia odpowiednio
koocówki -awy i -owy nie wystarczą do dokładnego, słownego opisu tych połączeo.
Z uwagi na koniecznośd korzystania często z podręczników chemicznych wydanych
przed dziesięcioma i więcej laty, a także korzystania z literatury chemicznej potrzebna
jest, na poziomie akademickim, znajomośd reguł tworzenia nazw związków według starej
nomenklatury. Poniżej opisano te reguły dla kwasów, zasad i soli, podając zarazem
odpowiednie nazwy obowiązujące obecnie.

2
Nazwy wybranych związków chemicznych
Wzór związku
Nazwa systematyczna (nowa) Nazwa dopuszczalna (stara)
NaCl
chlorek sodu
chlorek sodowy
HCl
aq
chlorek wodoru
kwas chlorowodorowy
HClO
kwas chlorowy(I)
kwas podchlorawy
HClO
2
kwas chlorowy(III)
kwas chlorawy
HClO
3
kwas chlorowy(VII)
kwas nadchlorowy
NaCIO
chloran(I) sodu
podchloryn sodu
H
3
PO
4
kwas ortofosforowy(V)
kwas ortofosforowy
H
2
SO
3
kwas siarkowy(IV)
kwas siarkawy
Na
2
SO
3
siarczan(IV) sodu
siarczyn sodowy
H
2
SO
4
kwas siarkowy (VI)
kwas siarkowy
FeO
tlenek żelaza(II)
tlenek żelazawy
Fe
2
O
3
tlenek żelaza(III)
tlenek żelazowy
Fe
3
O
4
= FeO∙Fe
2
O
3
tlenek żelaza(II i III)
tetratlenek triżelaza
tlenek żelazawo-żelazowy
Połączenia z tlenem
W tlenkach składnikiem elektroujemnym jest tlen (wyjątek stanowi tlenowy związek
fluoru, w którym właśnie fluor posiada większą elektroujemnośd, czyli OF
2
). Tworząc
nazwę tlenku, można za pomocą przedrostka określid ilośd atomów tlenu oraz drugiego
pierwiastka, np. N
2
O
3
-trójtlenek diazotu lub ditlenek triazotu; Fe
3
0
4
-tetratlenek triżelaza.
Zasadę tę można również zastosowad do tworzenia nazw połączeo nie mających
charakteru soli a złożonych z dwóch pierwiastków, np. P
2
S
5
-pentasiarczek difosforu.
Możliwe jest również tworzenie nazw w systemie Stocka, polegającym na wskazaniu
cyfrą rzymską stopnia utlenienia pierwiastka, np. MnO
2
-tlenek manganu(IV),
Cr
2
0
3
-tlenek
chromu(III); Fe
3
O
4
-tlenek diżelaza(III) żelaza(II). W przypadku nadtlenków i ponadtlenków
stosuje się odpowiednie przedrostki, np. BaO
2
-nadtlenek baru lub ditlenek baru. Proszę zwrócid
uwagę, że jeżeli pierwiastek występuje tylko na jednym stopniu utlenienia to w nazwie stopnia
utlenienia nie podaje się.
Nie zaleca się tworzenia nazw tlenków z zastosowaniem dla określenia stopnia utlenienia
pierwiastka koocówek -owy lub -awy.
Połączenia z wodorem
Nazwy połączeo wodoru z pierwiastkami grupy 1, 2 i 3 tworzy się dodając do ogólnego
określenia wodorek nazwę metalu, np. LiH-wodorek litu. Nazwy wodorków lotnych, z
wyjątkiem wodorków fluorowców, tlenu i azotu tworzy się od rdzenia nazwy pierwiastka,
dodając koocówkę -an. Dopuszcza się jednak używanie w wielu wypadkach nazw
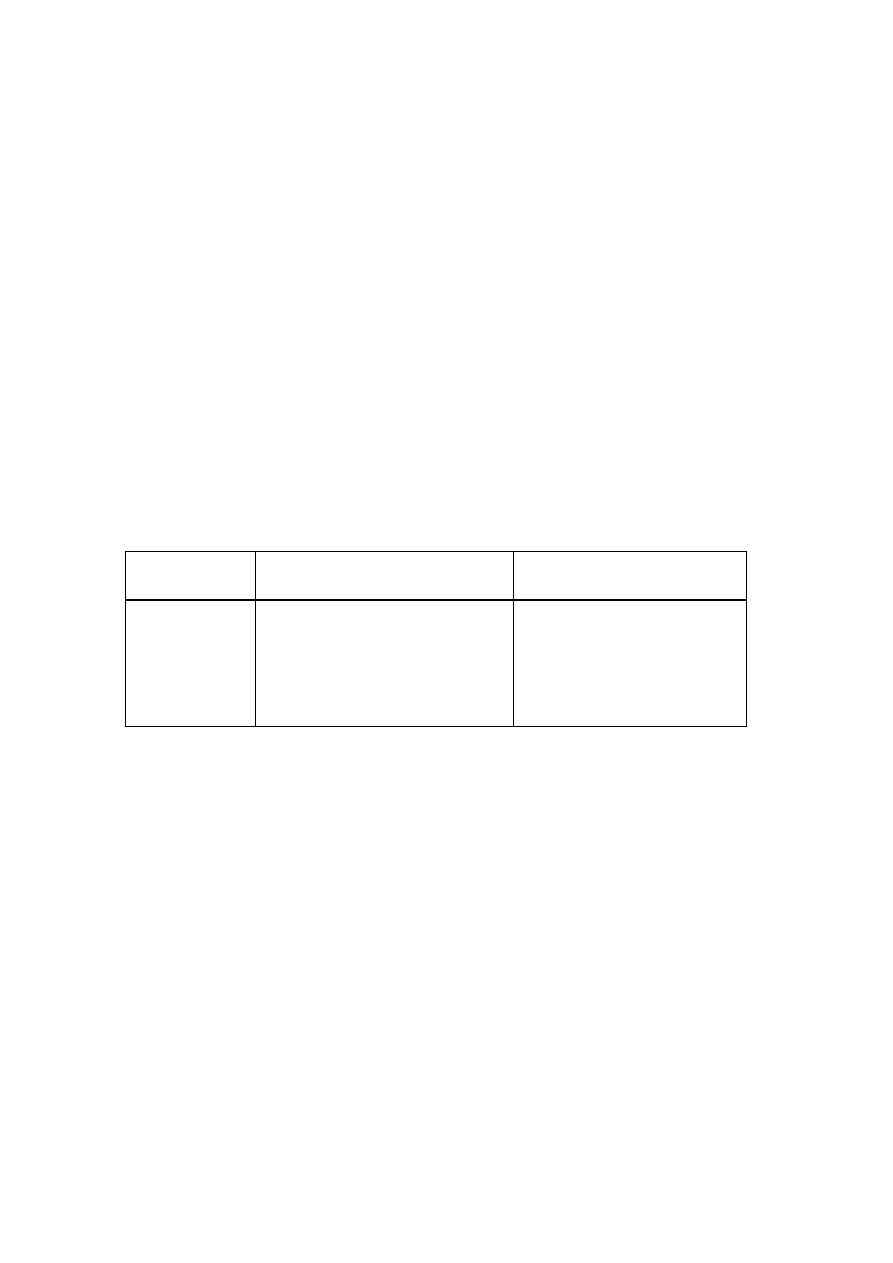
3
zwyczajowych, tak więc: H
2
S-sulfan (dopuszcza się jednak nazwę siarkowodór); PH
3
-fosfan;
NH
3
-amoniak (nazwa systematyczna azan); N
2
H
4
- diazan (lub zwyczajowo hydrazyna);
H
2
O-pozostaje się przy nazwie zwyczajowej woda. Połączenia z fluorowcami jak do tej pory
noszą nazwy fluorowodór, chlorowodór, jodowodór, bromowodór i należy je odróżnid od
nazwy odpowiedniego kwasu beztlenowego.
KWASY BEZTLENOWE
Dopuszczalne w nomenklaturze polskiej nazwy kwasów beztlenowych tworzy się w ten
sposób, że po słowie „kwas" podaje się nazwę niemetalu oraz koocówkę „wodorowy", na
przykład kwas jodowodorowy, skrótowo: jodowodór. Są to wodne roztwory odpowiednich
gazów. Wodny roztwór chlorowodoru nosi historyczną nazwę „kwas solny".
W nomenklaturze systematycznej nazwy kwasów beztlenowych powinny byd tworzone
od nazw anionów tych kwasów, które mają koocówkę -ek np. chlorek wodoru, siarczek
diwodoru, jodek wodoru.
Zestaw najczęściej spotykanych kwasów beztlenowych
Wzór
Nazwa systematyczna
Nazwa dopuszczalna
HF
fluorek wodoru
kwas fluorowodorowy
HCl
chlorek wodoru
kwas chlorowodorowy
HBr
chromek wodoru
kwas bromowodorowy
HI
jodek wodoru
kwas jodowodorowy
H
2
S
siarczek diwodoru
kwas siarkowodorowy
KWASY TLENOWE (Oksokwasy)
W powszechnym użyciu są jeszcze używane nazwy zwyczajowe kwasów. Kwasy tlenowe
zwyczajowo biorą nazwę od nazwy niemetalu, do którego dodaje się koocówkę „owy" na
przykład H
2
CO
3
-kwas węglowy. Jednak większośd niemetali tworzy dwa lub więcej różnych
kwasów; dla kwasu, w którym niemetal występuje w maksymalnym stopniu utlenienia,
zarezerwowana jest koocówka „owy", a dla kwasu, w którym niemetal występuje na
niższym stopniu utlenienia - koocówka „awy", na przykład:
HNO
3
zawiera N(+5) - kwas azotowy,
H
3
PO
4
P(+5) - kwas fosforowy,
HNO
2
zawiera N(+3) - kwas azotawy,
H
3
PO
3
P(+3) - kwas fosforawy
Powyższe kwasy nazywane są odpowiednio w systemie Stocka: kwas azotowy(V), kwas
fosforowy(V), kwas azotowy(III) i kwas fosforowy(III), gdzie w nawiasie pisanym
bezpośrednio za nazwą podaje się stopieo utlenienia atomu centralnego.

4
Znane są jednak trzy kwasy fosforowe, w których fosfor na +5 stopniu utlenienia ; dla
odróżnienia w tym przypadku dajemy przed nazwą kwasu przedrostek: meta, piro lub
orto (:
HPO
3
kwas metafosforowy - kwas fosforowy(III)
H
4
P
2
O
7
kwas pirofosforowy - kwas difosforowy(V)
H
3
PO
4
kwas ortofosforowy - kwas fosforowy(V)
Rzeczywista różnica między tymi kwasami polega na związaniu różnej liczby cząsteczek
wody (różny stopieo hydratacji) przez cząsteczkę bezwodnika kwasowego, P
2
O
5
:
H
2
O + P
2
O
5
2HPO
3
2H
2
O + P
2
O
5
H
4
P
2
O
7
3H
2
O + P
2
O
5
2H
3
PO
4
Pewne trudności istniały z ustaleniem nazw dla kwasów, w których niemetal występuje
w trzech i więcej stopniach utlenienia:
H
2
MnO
3
zawiera Mn(+4) kwas manganawy – kwas manganowy(IV)
H
2
Mn0
4
zawiera Mn(+6) kwas manganowy – kwas manganowy(VI)
HMn0
4
zawiera Mn(+7) kwas nadmanganowy – kwas maganowy (VII)
Cząsteczki kwasów mogą zawierad różne ilości atomów tlenu. Z tego powodu w
trudnych przypadkach, o ile nie istnieje odpowiednie nazewnictwo zwyczajowe, stosuje
się człon "-okso-" do podania liczby atomów tlenu w związku (inaczej mówiąc - traktuje
się dany związek jak związek kompleksowy z ligandami tlenowymi).
W tym przypadku kwasów tlenowych (oksokwasów) tworzy się nazwy anionu
kompleksowego z pierwiastkiem występującym jako atom centralny i dodaje się do niego
określenie kwas. Zazwyczaj jednak istnieją odpowiednie nazwy zwyczajowe, których
można używad jako nazw systematycznych.
Tego systematycznego nazewnictwa kwasów prawie się nie używa, pomimo
racjonalności nowych nazw które podają ilości poszczególnym atomów w cząsteczce
Oto poniżej kilka przykładów nazw kwasów:
HNO
3
kwas triooksoazotowy(V) (kwas azotowy(V))
trioksoazotan wodoru
H
2
SO
4
kwas tetraoksosiarkowy(V) (kwas siarkowy(VI))
tetraoksosiarczan diwodoru
HClO
3
kwas tetraoksochlorowy(V) (kwas chlorowy(V))
tetraoksochloran wodoru
H
5
IO
6
kwas heksaoksojodowy(VII)
heksaoksojodan pentawodoru
H
4
P
2
O
7
kwas heptaoksodifosforowy(V)
heptaoksodifosforan tetrawodoru
H
2
B
4
O
7
kwas heptaoksotetraborowy
heptaoksotetraboran diwodoru
H
4
SiO
4
kwas tetraoksokrzemowy
tetraoksokrzemian tetrawodoru
Proszę zwrócid uwagę na podobieostwo nowych nazw oksokwasów do nazw soli.
ZASADY
Są to związki, które w roztworze są zdolne do dysocjacji na anion wodorotlenowy i kation
reszty zasadowej (w przypadku zasad nieorganicznych kationem jest najczęściej metal lub
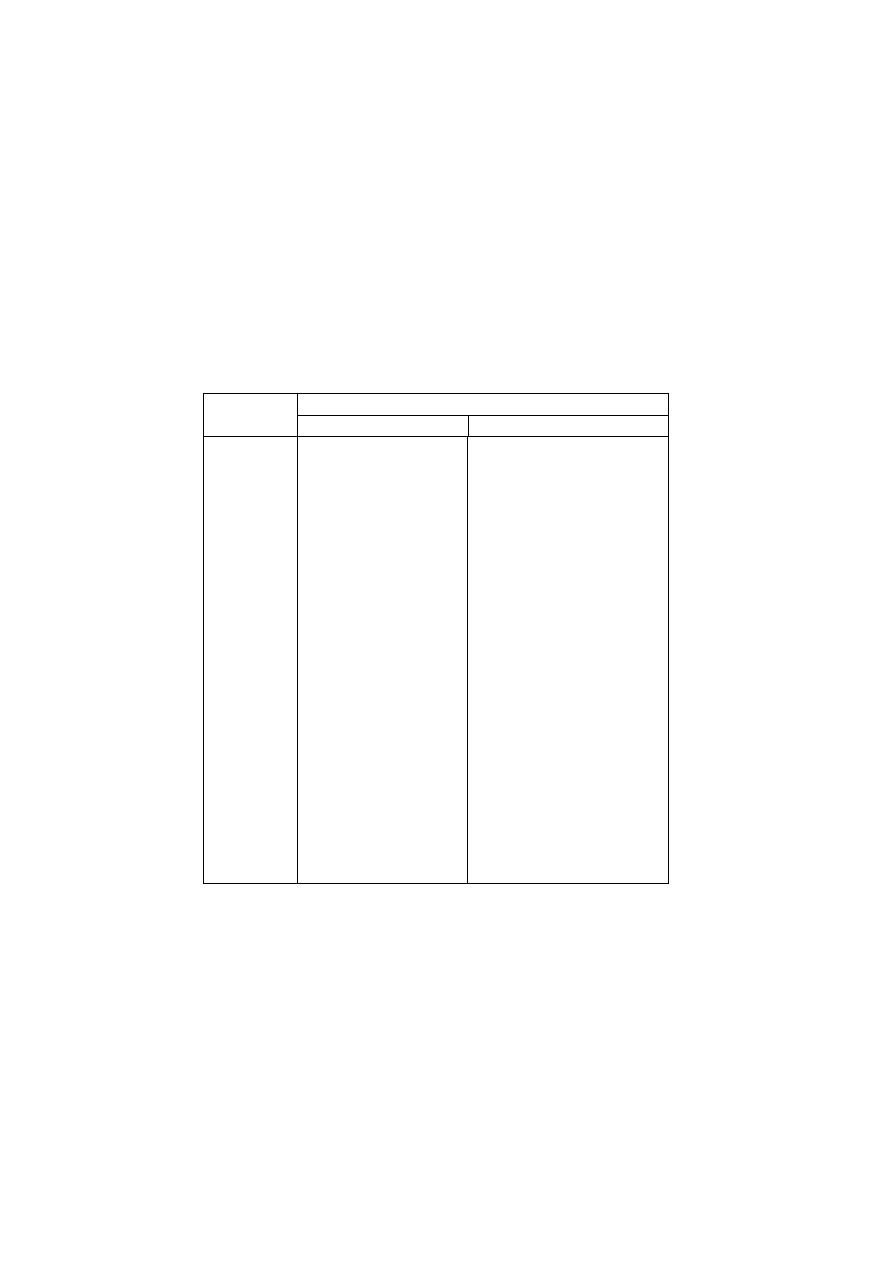
5
grupa amonowa). Grupa wodorotlenowa — OH jest jednowartościowa. W nomenklaturze
handlowej i technicznej zasady nazywa się również ługami.
Jeśli metal występuje zawsze tylko w jednym stopniu utlenienia (jak to zachodzi u
potasowców i wapniowców), to po słowie „wodorotlenek" stawiamy nazwę metalu z
koocówką -owy, na przykład wodorotlenek sodowy, wodorotlenek kadmowy, chod
można też mówid: wodorotlenek sodu, kadmu. Jeśli jednak metal może występowad w
różnych wartościowościach, to dla niższej wartościowości metalu w wodorotlenku stosowana
jest koocówka -awy, a dla wyższej wartościowości metalu - koocówka owy (wodorotlenek
cynawy - wodorotlenek cynowy, wodorotlenek żelazawy - wodorotlenek żelazowy).Bardzo
często potocznie zasady nazywane są wodorotlenkami. Jednak trzeba wyraźnie zaznaczyd,
że zasadami można nazwad tylko te wodorotlenki, które są rozpuszczalne w wodzie. Nie są
zasadami takie wodorotlenki, jak: Al(OH)
3
, Fe(OH)
3
, Sn(OH)
2
i wiele innych
Wodorotlenek
Wzór
nazwa dotychczasowa
nazwa obecna
NaOH
sodowy
sodu
KOH
potasowy
potasu
LiOH
litowy
litu
NH
4
OH
amonowy
amonu
Mg(OH)
2
magnezowy
magnezu
Ca(OH)
2
wapniowy
wapnia
Sr(OH)
2
strontowy
strontu
Ba(OH)
2
barowy
baru
Sn(OH)
4
cynowy
cyny(IV)
Pb(OH)
2
ołowiawy
ołowiu(II)
Zn(OH)
2
cynkowy
cynku
Cd(OH)
2
kadmowy
kadmu
AgOH
srebrowy
srebra(I)
Cu(OH)
2
miedziowy
miedzi(II)
Mn(OH)
2
manganawy
manganu(II)
Cr(OH)
3
chromowy
chromu(III)
Fe(OH)
2
żelazawy
żelaza(II)
Fe(OH)
3
żelazowy
żelaza(III)
Ni(OH)
2
niklawy
niklu(II)
Ni(OH)
3
niklowy
niklu (III)
Co(OH)
2
kobaltawy
kobaltu(II)

6
SOLE
Sole tworzą się, gdy działamy kwasem na zasadę (reakcja zobojętniania):
HCl + NaOH NaCl + H
2
O
lub gdy rozpuszczamy metal w kwasie
Zn + H
2
SO
4
ZnSO
4
+ H
2
a także przez połączenie tlenku metalu z bezwodnikiem kwasowym
CaO + CO
2
CaCO
3
Rozpuszczone w wodzie sole dysocjują na kation i anion - kationem jest tu jon metalu
lub grupa amonowa (w każdym razie nie jon wodorowy), anionem jest reszta kwasowa (a
nie grupa wodorotlenowa). Wzory soli związków nieorganicznych piszemy zawsze w ten
sposób, że na pierwszym miejscu piszemy kation, za nim resztę kwasową, na przykład:
K
2
CO
3
- węglan potasowy; w nazwie podajemy jednak najpierw nazwę reszty kwasowej.
Podobnie jak w nazwach wodorotlenków za pomocą koocówek -awy i -owy.
W nowej nomenklaturze podajemy najpierw nazwę reszty kwasowej z koocówką -an,
pisząc w nawiasie stopieo utlenienia pierwiastka centralnego oraz nazwę metalu i w
nawiasie jego stopieo utlenienia, np.
Fe(NO
2
)
2
azotyn żelazawy lub azotan(III) żelaza(II)
Fe(NO
3
)
3
azotan żelazowy lub azotan (V) żelaza (III)
Sole kwasów beztlenowych mają koocówkę -ek.
Sole wywodzące się z kwasów
tlenowych mają koocówkę -an - jeśli odpowiedni kwas miał koocówkę -owy; nazwa soli ma
koocówkę -yn (lub -in ), jeśli odpowiedni kwas miał koocówkę -awy.
Kwasy takie jak na przykład:
kwas chlorowodorowy HCl,
kwas jodowy HIO
3
,
kwas azotowy
HNO
3
mają tylko jeden atom wodoru zdolny do wymiany na metal. Kwasy te dają jeden typ
soli.
Wzór kwasu, z
Nazwa soli
Wzór soli
którego wywodzi
nazwa
nazwa
się sól
dotychczasowa
obecna
NaF
HF
fluorek sodowy
fluorek sodu
NH
4
Cl
HCl
chlorek amonowy
chlorek amonu
AlBr
3
HBr
bromek glinowy
bromek glinu
Snl
2
HI
jodek cynawy
jodek cyny (II)
Snl
4
HI
jodek cynowy
jodek cyny (IV)
K
2
S
H
2
S
siarczek potasowy
siarczek potasu
CdS
H
2
S
siarczek kadmowy
siarczek kadmu
Takie kwasy, jak na przykład: kwas siarkowy H
2
SO
4
, kwas węglowy H
2
CO
3
, kwas
manganowy H
2
MnO
4
mają dwa atomy wodoru, które można wymienid na metal. Mogą
one tworzyd dwa szeregi soli: obojętne i kwaśne, na przykład: kwas siarkowy H
2
SO
4
to kwas
dwuwodorowy - jego sole: Na
2
SO
4
siarczan sodu - sól obojętna, NaHSO
4
kwaśny węglan

7
sodu - czyli wodorosiarczan sodu. Kwasowośd takich soli jest opisana w nazwie
odpowiedniej soli poprzez dodatek typu wodoro-; dwuwodoro-. Na przykład kwaśny węglan
wapnia, Ca(HCO
3
)
2
, nazywamy wodorowęglanem wapnia lub wodorowęglanem wapniowym.
Kwasy trójwodorowe (na przykład ortofosforowy, arsenowy, antymonowy) tworzą trzy
szeregi soli:
NaH
2
PO
4
dwuwodorofosforan sodu, Na
2
HPO
4
wodorofosforan sodu, Na
3
PO
4
ortofosforan trójsodu.
Nazwa „dwuwodorofosforanu sodu" oznacza, że w kwasie ortofosforowym jeden atom
wodoru został zastąpiony atomem sodu; odpowiednio „wodorofosforan sodu" - dwa atomy
wodoru w kwasie ortofosforowym zostały zastąpione atomami sodu, „ortofosforan sodu" -
trzy atomy wodoru
z kwasu ortofosforowego zostały zastąpione atomami sodu. Jeśli więc
mamy napisad wzór dwuwodorofosforanu wapniowego, musimy pamiętad, że jeden atom
wodoru w kwasie ortofosforowym ma byd zastąpiony atomem wapnia, a więc pozostała
reszta H
2
PO
4
-
łączy się z + 2 wartościowym atomem wapnia, dając związek Ca(H
2
PO
4
)
2
.
Ortofosforan trójmetaliczny można nazywad też obojętnym, na przykład Cu
3
(PO
4
)
2
- obojętny
ortofosforan miedziowy.
Analogicznie do kwasów jedno-, dwu- i trójwodorowych istnieją także zasady jedno-,
dwu- i trójwodorotlenowe, na przykład:
NaOH,
Ca(OH)
2
,
Al(OH)
3
.
Jeśli sól zawiera
niezobojętnione grupy wodorotlenowe zasady, jest to sól zasadowa, na przykład:
Cu
2
(OH)
2
CO
3
dwuhydroksywęglan miedziowy *miedzi (II)]
Bi(OH)Cl
2
hydroksychlorek bizmutawy [bizmutu (III)]
Bi(OH)
2
Cl
3
dwuhydroksychlorek bizmutowy [bizmutu (V)]
Chcąc napisad poprawnie wzór soli zasadowej, włączamy grupy wodorotlenowe do
kationu i obliczamy wartościowośd, na przykład dwuhydroksysiarczan glinu:
Al(OH)
2
= Al
3+
(OH)
2
-
= [Al(OH)
2
]
+
współczynnik dla kationu i anionu obliczamy metodą „na krzyż":
[Al(OH)
2
]
1+
- SO
4
2-
, stąd
[Al(OH)
2
]
2
SO
4
Ponieważ jednak nawiasy kwadratowe stosujemy zwykle dla soli kompleksowych,
zatem można dla odróżnienia wzór ten napisad w postaci:
Al
2
(OH)
4
SO
4
(Al(OH)
2
)
2
SO
4
.
8
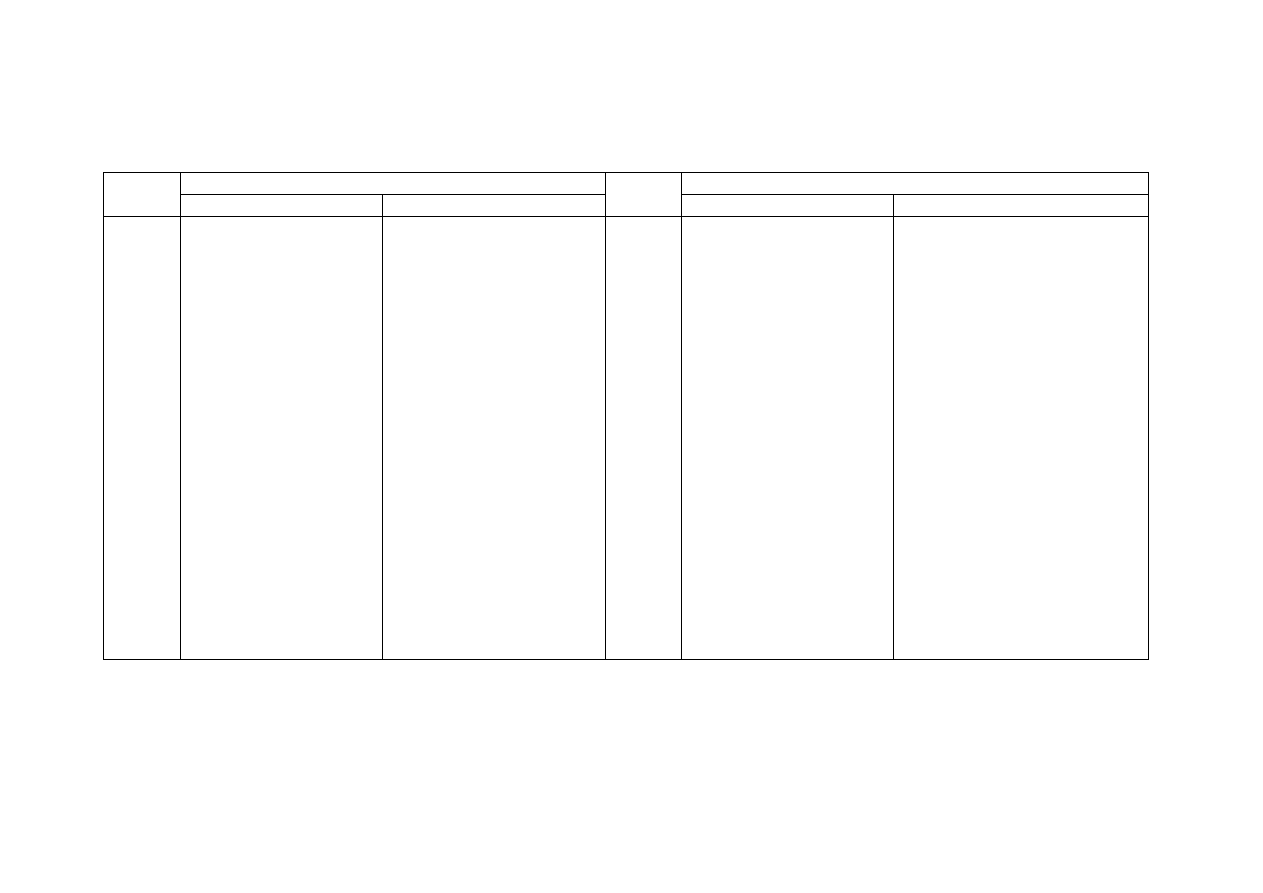
Wzory i nazwy kwasów tlenowych oraz wzory i nazwy odpowiadających im soli
Wzór
Nazwa
kwasu
Wzór
Nazwa soli
kwasu
dotychczasowa
obecna
soli
dotychczasowa
obecna
HClO
kwas podchlorawy
kwas chlorowy(I)
NaCIO
podchloryn sodowy
chloran(I) sodu
HC1O
2
kwas chlorawy
kwas chlorowy(III)
KClO
2
chloryn potasowy
chloran(III) potasu
HCIO3
kwas chlorowy
kwas chlorowy(V)
NH
4
ClO
3
chloran amonowy
chloran(V) amonu
HClO
4
kwas nadchlorowy
kwas chlorowy(VII)
Mg(ClO
4
)
2
nadchloran magnezowy
chloran(VII) magnezu
HBrO
kwas podbromawy
kwas bromowy(I)
Ca(BrO)
2
podbromin wapniowy
bromian(I) wapnia
HBrO
2
kwas bromawy
kwas bromowy(III)
Sr(BrO
2
)
2
bromin strontowy
bromian(III) strontu
HBrO
3
kwas bromowy
kwas bromowy(V)
Ba(BrO
3
)
2
bromian barowy
bromian(V) baru
HIO
kwas podjodawy
kwas jodowy(I)
KIO
podjodyn potasowy
jodan(I) potasu
HIO
2
kwas jodawy
kwas jodowy(III)
Mg(IO
2
)2
jodyn magnezowy
jodan(III) magnezu
HIO
3
kwas jodowy
kwas jodowy(V)
Zn(IO
3
)
2
jodan cynkowy
jodan(V) cynku
HIO
4
kwas nadjodowy
kwas jodowy(VII)
Cd(IO
4
)
2
nadjodan kadmowy
jodan(VII) kadmu
H
2
SO
3
kwas siarkawy
kwas siarkowy(IV)
Na
2
SO
3
siarczyn sodowy
siarczan(IV) sodu
H
2
SO
4
kwas siarkowy
kwas siarkowy(VI)
PbSO
4
siarczan ołowiawy
siarczan(VI) ołowiu (II)
H
2
S
2
O
7
kwas pirosiarkowy
kwas dwusiarkowy(VI)
K
2
S
2
O
7
pirosiarczan potasowy
dwusiarczan (VI) potasu
H
2
SO
5
kwas nadtlenosiarkowy
kwas nadtlenomonosiarkowy(VI) Al
2
(SO
5
)
3
nadtlenosiarczan glinowy
nadtlenomonosiarczan(VI) glinu
H
2
S
2
O
8
kwas nadtlenodwusiarkowy
kwas nadtlenodwusiarkowy(VI)- NiS
2
O
8
nadtlenodwusiarczan niklawy
nadtlenodwusiarczan(VI) niklu (II)
H
2
S
2
O
3
kwas tiosiarkowy
kwas tiosiarkowy(VI)
K
2
S
2
O
3
tiosiarczan potasowy
tiosiarczan(VI) potasu
HNO
2
kwas azotawy
kwas azotowy(III)
LiNO
2
azotyn litowy
azotan(III) litu
HNO3
kwas azotowy
kwas azotowy(V)
Cu(NO
3
)
2
azotan miedziowy
azotan(V) miedzi (II)
H
3
PO
3
kwas ortofosforawy
kwas ortofosforowy(III)
(NH
4
)
3
PO
3
fosforyn amonowy
ortofosforan(III) amonu
H
3
PO
4
kwas ortofosforowy
kwas ortofosforowy(V)
Ca
3
(PO
4
)
2
ortofosforan wapniowy
ortofosforan(V) wapnia
9
HPO
3
kwas metafosforowy
kwas metafosforowy(V)
Fe(PO
3
)
2
metafosforan żelazawy
metafosforan(V) żelaza(II)
H
4
P
2
O
7
kwas pirofosforowy
kwas pirofosforowy(V)
Fe
4
(P
2
O
7
)
3
pirofosforan żelazowy
pirofosforan(V) żelaza(III)
H
3
AsO
3
kwas ortoarsenawy
kwas ortoarsenowy(III)
K
3
As0
3
ortoarsenin potasowy
ortoarsenian(III) potasu
H
3
AsO
4
kwas ortoarsenowy
kwas ortoarsenowy(V)
Ag
3
AsO
4
ortoarsenian srebrowy
ortoarsenian(V) srebra(I)
H
3
Sb0
3
kwas ortoantymonawy
kwas ortoantymonowy(III)
(NH
4
)
3
Sb0
3
ortoantymonin amonowy
ortoantymonian(III) amonu
H
3
SbO
4
kwas ortoantymonowy
kwas ortoantymonowy(V)
Mg
3
(SbO
4
)
2
ortoantymonian magnezowy
ortoantymonian(V) magnezu
H
2
CO
3
kwas węglowy
kwas węglowy
NiCO
3
węglan niklawy
węglan niklu(II)
H
2
Si0
3
kwas metakrzemowy
kwas metakrzemowy
Al
2
(Si0
3
)
2
metakrzemian glinowy
metakrzemian glinu
H
2
Sn0
2
kwas cynawy
kwas cynowy(II)
Na
2
SnO
2
cynin sodowy
cynian(II) sodu
H
2
SnO
3
kwas cynowy
kwas cynowy(IV)
BaSnO
3
cynian barowy
cynian(IV) baru
H3BO3
kwas borowy
kwas borowy
Na
3
BO
3
boran sodowy
boran sodu
H
2
Mn0
3
kwas manganawy
kwas manganowy(IV)
K
2
Mn0
3
manganin potasowy
manganian(IV) potasu
H
2
Mn0
4
kwas manganowy
kwas manganowy(VI)
K
2
Mn0
4
manganian potasowy
manganian(VI) potasu
HMnO
4
kwas nadmanganowy
kwas manganowy(VII)
KMnO
4
nadmanganian potasowy
manganian(VII) potasu
HCrO
2
kwas chromawy
kwas chromowy(III)
Fe(CrO
2
)
2
chromin żelazawy
chromian(III)żelaza(II)
H
2
CrO
4
kwas chromowy
kwas chromowy(VI)
PbCrO
4
chromian ołowiawy
chromian(VI) ołowiu(II)
H
2
Cr
2
0
7
kwas dwuchromowy
kwas dwuchromowy(VI)
K
2
Cr
2
0
7
dwuchromian potasowy
dwuchromian(VI) potasu

10
Nazwy związków binarnych, czyli dwuskładnikowych
Najłatwiej jest nazwad związki binarne, czyli związki składające się tylko z
dwóch składników. We wzorach związków binarnych po lewej strome znajduje się
pierwiastek elektro-dodatni, a po prawej - pierwiastek elektroujemny. Natomiast
w nazwie związku najpierw wymieniany jest pierwiastek elektroujemny z
koocówką -ek, a potem pierwiastek elektrododatni w dopełniaczu.
NaCl chlorek sodu
CaO
tlenek wapnia
K
2
S
siarczek potasu
Mg
3
N
2
azotek magnezu
W związkach jonowych nazywany jest zatem najpierw anion, a potem kation.
Koocówkę -ek mają również niektóre aniony kilkuatomowe, stanowiące ważne
wyjątki:
O
2
2-
nadtlenek (jon nadtlenkowy)
O
2
-
ponadtlenek (jon ponadtlenkowy)
CN
-
cyjanek (jon cyjankowy)
NH
2
-
amidek (jon amidkowy)
OH
-
wodorotlenek (jon wodorotlenkowy)
Przy zastosowaniu tego nazewnictwa do związków z wiązaniem atomowym
wychodzi się z założenia, że w układzie okresowym pierwiastki elektrododatnie
zajmują miejsce po lewej
stronie wewnątrz okresu, natomiast wewnątrz grupy u
dołu. Zatem pierwiastki znajdujące się w układzie okresowym po lewej stronie lub
na dole, w nazwie związku binarnego podaje się jako drugie:
SiC węglik krzemu (koocówka -ik w nazwie węglik jest wyjątkiem)
CO tlenek węgla
ClF fluorek chloru
Tlen jest bardziej elektroujemny niż chlor, ale bardziej elektrododatni niż fluor,
dlatego:
CIO
2
ditlenek chloru, lecz
OF
2
difluorek tlenu
Nazwy kationów i anionów wieloatomowych (kompleksowych)
Związki nieorganiczne zbudowane z więcej niż dwóch pierwiastków, w których
występują składniki: elektrododatni i elektroujemny, w nazewnictwie traktuje się
jak związki binarne. W ich nazwach i wzorach, w miejscu jonów prostych
(niezłożonych) występują aniony i kationy kompleksowe. Poniżej podano schemat
nazewnictwa związków kompleksowych:

11
liczba ligandów
nazwa ligandów
nazwa jonu centralnego
Podobnie jak w związkach binarnych, jon centralny w kationach kompleksowych
nazywany jest polską nazwą pierwiastka. W anionach nazwa ta ma koocówkę -an
Przykłady związków o kompleksowych kationach:
siarczan(VI) tetraaminamiedzi(II)
[Cu(NH
3
)
4
SO
4
chlorek heksaakwaglinu
[Al(H
2
O)
6
]Cl
3
Przykłady związków o kompleksowych anionach:
heksacyjanożelazian(II) potasu
K
4
[Fe(CN)
6
]
heksahydroksoglinian sodu
Na
3
[Al(0H)
6
]
Stopieo utlenienia jonów centralnych podaje się po nazwie jonu, za pomocą cyfr
rzymskich w nawiasie okrągłym wtedy, kiedy jest to niezbędne do rozróżnienia
związków:
heksacyjanożelazian(II) potasu
K
4
[Fe
II
(CN)
6
]
heksacyjanożelazian(III) potasu
K
3
[Fe
III
(CN)
6
]
heksacyjanożelazian(II) żelaza(III)
Fe
4
III
[Fe
II
(CN)
6
]
3
W ostatnim przykładzie żelazo jest trójdodatnie w kationie i dwudodatnie w anionie.
Nazwy ligandów tworzy się według następujących reguł:
Aniony występujące jako ligandy: do nazwy anionu dodaje się koocówkę -o, nazwę
odmienia się zgodnie z polskimi zasadami odmiany
SCN- jon tiocyjanianowy jako ligand: tiocyjaniano-
F- jon fluorkowy
jako ligand:
fluoro-
CN-jon cyjankowy
jako ligand:
cyjano-
Wyjątkami są: jon tlenkowy, wodorkowy oraz wodorotlenkowy, odpowiednie ligandy
noszą bowiem nazwy pochodzące od nazw łacioskich:
H
-
jon wodorkowy jako ligand:
hydrydo-(hydro-)
O
2-
jon tlenkowy jako ligand:
okso-
OH
-
jon wodorotlenkowy jako ligand:
hydrokso-
Dla cząsteczek występujących jako ligandy przyjęto nazwy szczególne:
H
2
O woda jako ligand:
akwa-
NH
3
amoniak jako ligand:
amina-
Inaczej tworzy się nazwy kationów kompleksowych z wodorem jako ligandem,
dodając koocówkę -oniowy do łacioskiej nazwy pierwiastka występującego jako jon
centralny:
[PH
4
+
] jon fosfoniowy
[H
3
S]
+
jon sulfoniowy
[H
3
O]
+
jon oksoniowy, dawniej hydroniowy
Wyjątkiem od tej reguły jest nazwa jonu amonowego *NH
4
]
+
wyprowadzona nie
od pierwiastka azotu, ale od związku amoniaku NH
3
.
Wyszukiwarka
Podobne podstrony:
Nomenklatura nieorganiczna
Nomenklatura związków nieorganicznych wyk 3
Nomenklatura chemii nieorganicznej
nomenklatura chemiczna, Farmacja, Chemia ogólna i nieorganiczna
nieorganiczna 02
11 Stereochemia i podstawowa nomenklatura sacharydów i polisacharydów
CHEMIA NIEORGANICZNA 2
zwiazki nieorg 1 cz2
Chemia nieorganiczna zadania 4 Nieznany
Chemia nieorganiczna zadania 7 Nieznany
KationyV, Farmacja, I rok, Chemia nieorganiczna
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
KARBOKSYLOWE KWASY, Nieorganiczna, chemia, chemia - liceum, chemia - liceum, lekcja
egz 2010-pytania spisane(1), Chemia nieorganiczna- egzmain
Tlenowce(1), Chemia, Chemia nieorganiczna
więcej podobnych podstron