
Mateusz
Franckowiak
Fizyka metali – laboratorium
25.03.2013
Rok 1 magisterski
Odlewnictwo 1
Badanie ciepła właściwego metali i stopów
Ocena:
L 2
1. Cel ćwiczenia
Celem ćwiczenia jest zapoznanie się z metodą wyznaczenia ciepła właściwego dla metali
z zastosowaniem zasady bilansu cieplnego.
2. Wstęp teoretyczny
W termodynamice całkowitą energię układu nazywamy energią wewnętrzną U. Energia
wewnętrzna -jest sumą wszystkich udziałów energii, zarówno kinetycznej jak i potencjalnej,
wszystkich atomów, jonów, cząsteczek tworzących układ.
Rys.1. a) Praca w ujęciu molekularnym (stanowi przepływ energii, który powoduje uporządkowany
ruch atomów w otoczeniu), b) Ciepło (jest przepływem energii, który powoduje chaotyczny
ruch atomów w otoczeniu lub jest nim spowodowany).
Doświadczalnie stwierdzono, że energię wewnętrzną układu można zmieniać przez:
wykonanie na nim pracy, albo przez jego ogrzanie. Gdy dostarcza się energię do układu przez
ogrzanie lub przez wykonanie na nim pracy, energia ta zostaje zmagazynowana w postaci
dodatkowej energii kinetycznej i potencjalnej cząsteczek (np. w gazie poruszają się one
szybciej). Podobnie, gdy układ traci energię - cząsteczki zmniejszają swoją energię kinetyczną
lub potencjalną (np. w gazie poruszają się wolniej). W praktyce nie znamy i nie możemy
zmierzyć wartości energii wewnętrznej (U), do której wchodzi też energia kinetyczna
i potencjalna wszystkich elektronów i składników jąder atomowych. Jest to jednak bez

znaczenia dla rozpatrywania jej zmian (ΔU) gdyż zmiany te możemy rejestrować jako energię
dostarczoną lub utraconą przez układ na sposób pracy lub ciepła. Energię wewnętrzną, ciepło
i pracę mierzymy w tych samych jednostkach, J (dżulach).
I zasada termodynamiki - zasada zachowania energii
Układ izolowany
Doświadczalnie wykazano, że jeżeli układ jest izolowany (oddzielony zarówno
mechanicznie jak i termicznie od otoczenia), to układ taki nie może. ani wykonać pracy, ani
przekazać ciepła. Czyli nie następuje zmiana jego energii wewnętrznej. Stąd:
U = const
dU = 0
Dowodem na tę właściwość układu izolowanego jest to. że nie udało się zbudować
poruszającej się ciągle maszyny , która nie pobierałaby energii z zewnętrznego źródła, (czyli
perpetuum mobile pierwszego rodzaju).
Układ zamknięty.
W układzie zamkniętym, zmiana energii układu jest równa energii, która przepływa przez
jego granicę, na sposób ciepła (Q) i pracy (W). Czyli:
ΔU = Q + W
Stwierdzenie to stanowi treść 1 zasady termodynamiki dla układu zamkniętego,
a powyższe równanie, jest jej matematycznym zapisem.
Pierwsza zasada termodynamiki zwana zasadą zachowania energii, ma fundamentalne
znaczenie dla chemii, gdyż większości Trakcji chemicznych towarzyszy wydzielanie lub
pobranie energii. Prawo to uświadamia nam. ze w przyrodzie: dokonuje się jedynie przemiana
jednej formy energii w inną. a nie można jej ani wytworzyć (z niczego) ani zniszczyć (bez
śladu).
Pojemności cieplna jest to ilości energii cieplnej wymienionej z otoczenie o jeden
kelwin [K]
Δ
Δ
[J/K]
gdzie:
- zmiana ciepła
- zmiana temperatury

Ciepło właściwe jest to ilości ciepła potrzebna do zmiany temperatury 1 kilograma
substancji o 1
C.
Δ
[J/kg*K]
gdzie:
Q – dostarczone ciepło;
m – masa ciała;
ΔT – przyrost temperatury
3. Przebieg ćwiczenia
Do wyznaczenia bilansu cieplnego posłużono się kalorymetrem, którego chce mat
ukazano na rysunku 2. Składa się z dwóch, różniących się wielkością naczyń (większy
z tworzywa sztucznego, mniejszy z aluminium).
W górnej części naczynia większego (1), zwanego płaszczem kalorymetru, znajduje się
pierścień dystansowy, na którym zamieszczono naczynie mniejsze (2) – właściwy kalorymetr.
Kalorymetr ma pokrywę (3) z tworzywa sztucznego. Na środku tej pokrywy znajduje się otwór,
w którym umieszczono termometr (4) za pomocą gumowego korka (5). Przez drugi mniejszy
otwór w pokrywie jest przetknięty pręt mieszadła (6) z izolatorem cieplnym. Trzeci otwór
standardowo zaślepiony korkiem (7) służy do wprowadzania substancji, której ma być
określone ciepło właściwe.
Rys.2. Schemat stanowiska pomiarowego
W doświadczeniu wyznaczono ciepło właściwe dla żelaza armco. Przed wykonaniem
pomiarów oczytano temperaturę pokojową, następnie zważono środkowe naczynie kalorymetru
z mieszadłem oraz badany materiał. Następnie zważono kalorymetr wraz z zagotowaną wodą
i wyznaczono masę wody. Odczekano, aż temperatura w wody ustabilizowała się i oczytano jej
wartość. Kolejnym etapem było umieszczenie badanego metalu w układzie pomiarowym,
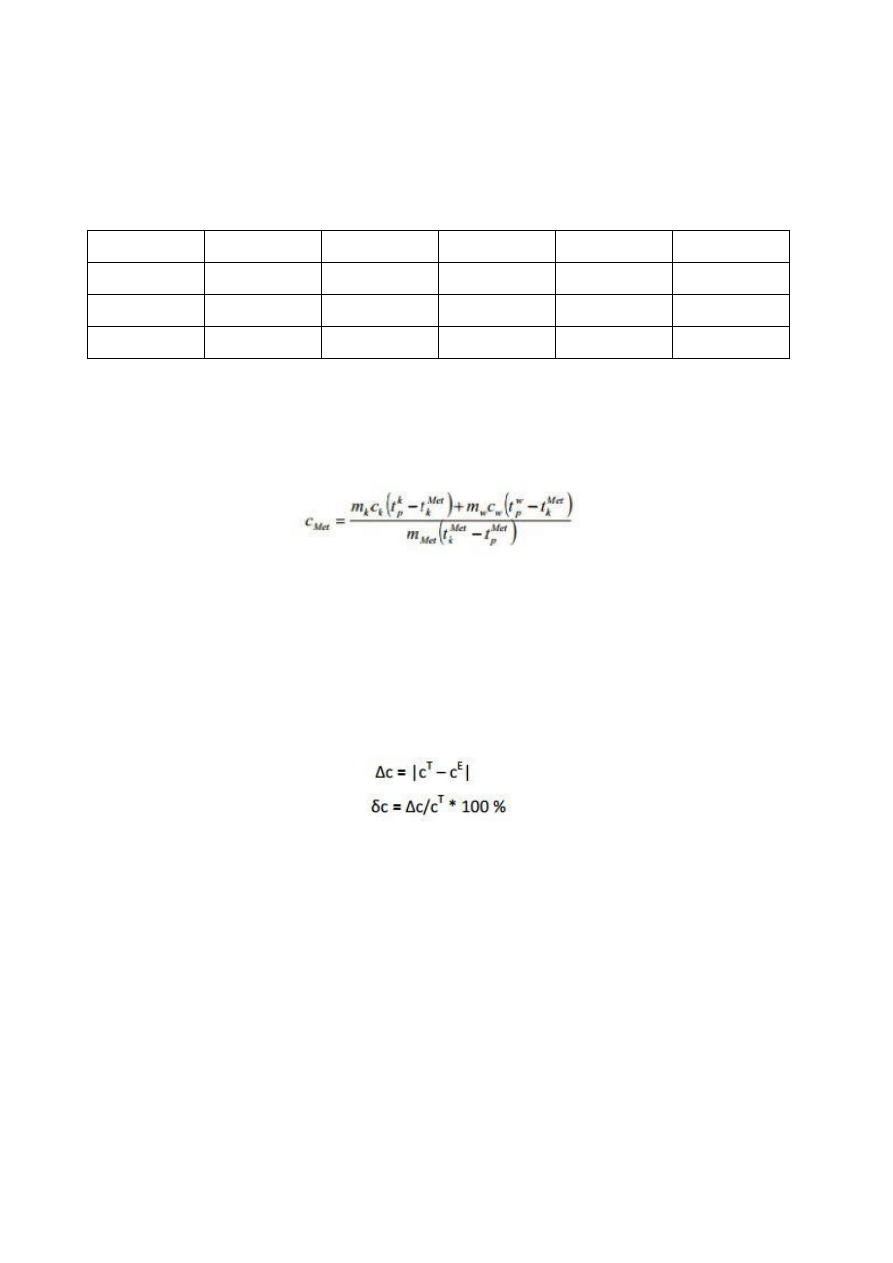
odczekano 5 minut przy intensywnym wieszaniu, aż do ustabilizowania temperatury
i odczytaną ją. Wszystkie pomiary wykonano trzykrotnie.
4. Dane pomiarowe
Odczytane dane zestawiono w tabeli 1
t
p
Met
m
k
m
Met
m
w
t
p
k
= t
p
w
t
k
Met
24
180
281,62
186,95
78
74,5
24
180
281,62
187,11
78
74,5
24
180,01
281,62
186,77
78
74,5
5. Obliczenia
Obliczenia potrzebne do wyliczenia ciepła właściwego wykonano na podstawie
poniższego wzoru:
Po podstawieniu wartości (c
w
przyjęto 4190 J/kgK, a c
k
900 J/kgK) otrzymano
następujące wartości ciepła właściwego:
1) 232,64 J/kgK
2) 232,81 J/kgK
3) 232,46 J/kgK
Następnie wyliczono błąd pomiarowy korzystając z dwóch wzorów:
gdzie:
c
T
– wartość tablicowa przyjęta 449 J/kgK
c
E
– wartość wyliczona
Otrzymano następujące wyniki:
1) 48,2%
2) 48,1%
3) 48,2%

6. Wnioski
Na podstawie przeprowadzonych badań i wyliczonych błędów pomiarowych można
sformułować następujące wnioski:
1. Metoda badawcza jest ograniczona dużym błędem pomiarowym.
2. Błąd pomiarowy ma związek z odczytem temperatury w kalorymetrze po umieszczeniu
badanego metalu.
3. Błąd przy odczycie temperatury może mieć związek z problemami, jakie grupa miała
przy zamknięciu układu pomiarowego po umieszczeniu badanego metalu.
7. Literatura
1. Stypuła
B.:
Wykłady
z
chemii
fizycznej,
wersja
elektroniczna
2003, http://galaxy.uci.agh.edu.pl/~stypula/
2. Olejnik E., Sikora G.: Fizyka metali - laboratorium 2. Wyznaczenie ciepła właściwego
c
w
metali i stopów, http://www.kisiko.agh.edu.pl/pliki/fizm_L2.pdf
Wyszukiwarka
Podobne podstrony:
Fizyka metali L2
Fizyka metali L5
Fizyka metali L6
FIzyka metali, FIZYKA2, tyui
FIzyka metali, Spr 6 - Analiza spektralna, ZSE w Rzeszowie
FIzyka metali, sprawozdanie5, Zakarczmenny Antoni
Fizyka metali L6
FIzyka metali, sprawozdanie4, Szklanny Paweł 1MDT
Fizyka metali, ćwiczenie 5 moje, Fizyka metali:
wyklad20-1, STUDIA, Fizyka metali, Defekty punktowe
Fizyka metali L4
FIzyka metali, FIZYKA3, tyui
FIzyka metali, sprawozdanie3, Szklanny Paweł 1MDT
Fizyka metali, sprawozdanie 4 moje, Temat:
FIzyka metali, FIZYKA1, 1. WSTĘP
FIzyka metali, FIZYKA5, tyui
FIzyka metali, sprawozdanie2, Fizyka metali - laboratorium
Fizyka metali L1
więcej podobnych podstron