Notatki z Nom.
Grupy materiałów:
Metale i ich stopy
opony ze stalowym kordem
Kompozyt
beton zbrojony, cermetale
Polimery
CFRP GRFP
Ceramiki i szkła
Polimery z wypełnieniem
Rodzaje właściwości:
a) Ekonomiczne (cena, dostępność);
b) Mechaniczne właściwości obj. (gęstość, współ. tłumienia, granica plastyczności,
wytrzymałość na rozciąganie, twardość, odporność na pękanie, wytrzymałość
zmęczeniowa, odporność na zmęczenie, odporność na pełzanie);
c) Niemechaniczne właściwości obj.(cieplne, optyczne, magnetyczne, elektryczne);
Powierzchni (utlenianie, korozja, tarcie, ścieralność, zużycie)
Produkcyjne (łatwość wykonania, łączenia części, wykończenia)
Estetyczne (wygląd, powierzchnia, dotyk)
Projektowanie inżynierskie:
Właściwości
wynikające ze struktury
uwarunkowane czynnikami związanymi z
produkcją
mechaniczne właściwości
cena
Projektowanie
niemechaniczne właściwości
cechy produkcyjne, łatwość
wytwarzania
właściwości powierzchni
walory estetyczne, wygląd
Nauka o materiałach i inżynieria materiałowa
Materiałoznastwo
Nauka o materiałach-tworzenie nowych materiałów, wyjaśnianie zjawisk, definiowaniepojęć
Inżynieria materiałowa- wytwarzanie, modyfikacja, dobór
Skorupa ziemska- najwięcej tlenu i krzemu, żelazo, aluminium
Energochłonność materiałów:
Np. aluminium 300GJ/t, tworzywa sztuczne 100GJ/t, węgiel 29GJ/t, cement GJ/t
Cechy użytkowe
Sposób wytwarzania
Właściwości
Struktura
Pełzanie- powolna zmiana kształtu materiału (odkształcenie) wskutek działania stałych,
długotrwałych obciążeń , mniejszych od granicy sprężystości materiału.
Siły spójności materiałów:
Siły spójności
Kohezji międzyatomowe kohezji międzycząsteczkowej kohezji międzycząsteczkowej
I rzędu
II rzędu
III rzędu
-jonowe
–van der Waalsa
-van der Waalsa
-atomowe
-mostki wodorowe
-mostki wodorowe
-atomowe spolaryzowane
-koordynacyjne
-metaliczne
(o rząd wielkości mniejsze od
międzyatomowych, są to siły
addytywne-sumują się i mogą
być większe niż pierwszego rzędu)
Wytrzymałość- odporność na działanie sił zewnętrznych, zostaje przekroczona gdy materiał
traci spójność.
Układy materiałów:
1. Zwarte- w obrębie kilku rodzajów materiałów, występują siły spójnośći w materiałach
A i B, a także w spoiwie
Siły przyczepności
2. Rozproszone-(tworzą go kompozyty) działają siły przyczepności na granicy faz,
spójność kruszywa ( warstwy rozproszonej) i warstwy ciągłej, a także przyczepność
między I i II fazą
Przyczepność- między różnymi ciałami, na granicy faz (adhezja)
Kohezja- spójność w obrębie jednego materiału
A
S
B
faza rozproszona
faza ciągła
Typy zniszczeń materiału:
a) Korozja
b) Zużycie
c) Pękanie
d) Zmęczenie
Mechanizmy pękania
e) Erozja
plastyczne rozrywanie
kruche pękanie
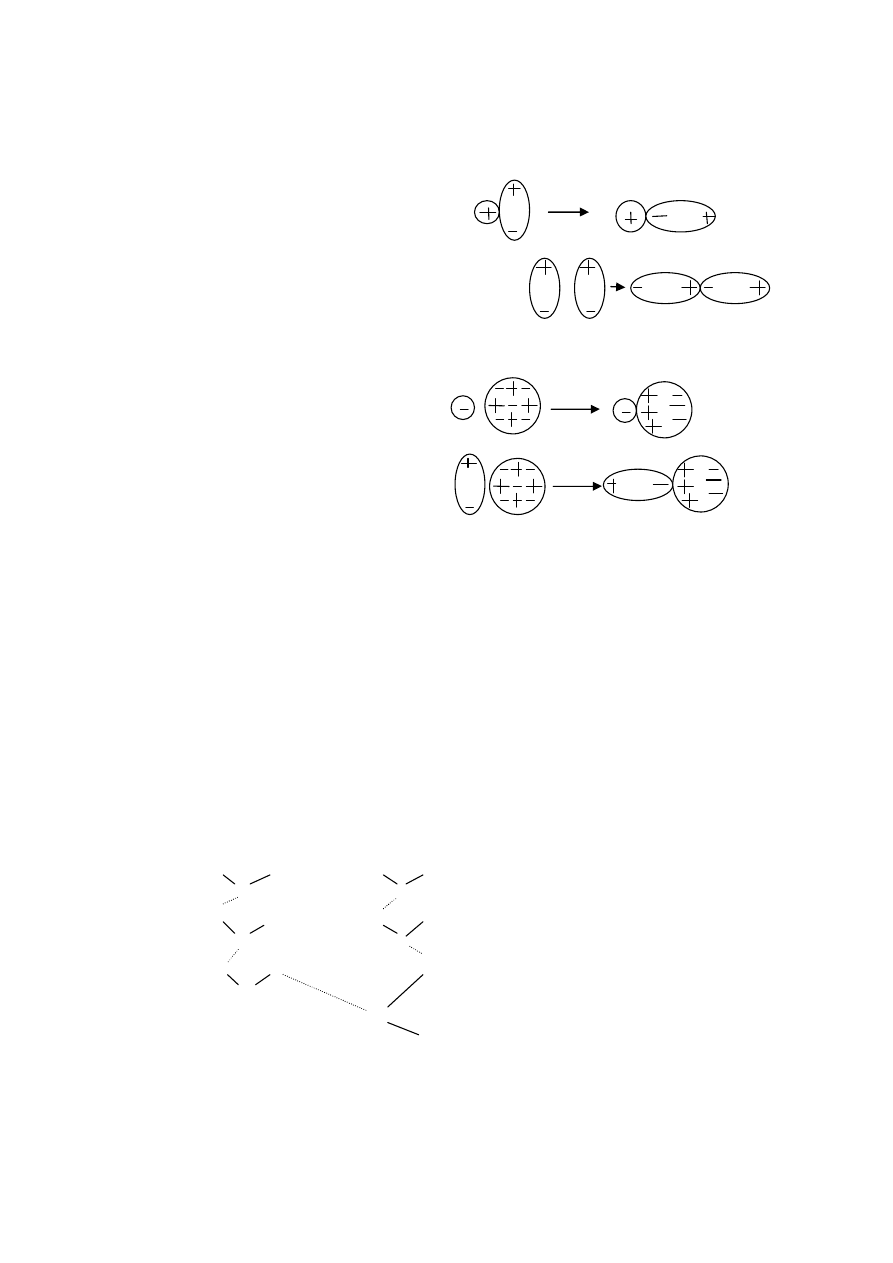
Wiązania jonowe:
Łączą się atomy, różniące się liczbą elektronów
Przyciąganie się różnie naładowanych jonów( różnoimienne ładunki, oddawanie,
przyjmowanie elektronów)
Siły oddziaływania elektrostatycznego (coulombowskiego) są nie wiem
Najczęściej powstają między metalem a niemetalem
Powstaje pod wpływem przyłożonej siły
przyłożona siła
jony odpychają się,
materiał traci spójność
Materiały kruche! Wykazują kruche pęknięcia
Wiązania mocne
Rozpuszczają się w wodzie, ulegają dysocjacji
Różnica elektroujemności w skali Paulinga >1,7
Wiązania atomowe:
Wiązanie symetryczne, pary elektronów, wspólne użytkowanie przez oba atomy tego
samego rodzaju
Każdy atom oddaje do użytku wspólnego 1, 2, 3 elektrony, następuje współdzielenie
elektronów
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
+
-
+
-
+

Dla takich samych pierwiastków!
H + H H-H
Wiązanie atomowe spolaryzowane:
Jeżeli atomy wiążą się elektroujemnością, para elektronów przesunięta w stronę
atomu bardziej elektroujemnego np. HCl w kierunku chloru
Dipol ma niesymetryczny rozkład ładunku, cząsteczka powstająca w wyniku wiązania
atomowego spolaryzowanego.
Moment dipolowy- charakteryzuje wszystkie cząsteczki, w których występuje
nierównomierny rozkład elektronów, jeden atom silnie przyciąga do siebie elektrony
wiążące, środek ciężkości ładunku dodatniego nie pokrywa się z środkiem ciężkości ładunku
ujemnego
Wiązania koordynacyjne (donorowo-akceptowalne)
Para elektronów wiążących pochodzi od 1 atomu (donoru) a drugi z atomów
(akceptor) przyjmuje je tylko do swojego obwodu orbitalnego
Rodzaj kowalencyjnego wiązania chemicznego
H
H
N
H+
H
wiązanie koordynacyjne
Wiązania metaliczne:
Występują w grupie metali, nadają im charakterystyczne właściwości, jedyne jakie dla
nich występują
Tworzy się gaz elektronów z elektronów walencyjnych (elektrony walencyjne oddane
są do wspólnego użytkowania, powstaje gaz elektronowy)
Powstają dodatnio naładowane jony metali ( w chmurze)
Tworzą się wiązania metaliczne( dzięki oddziaływaniom coulumbowskich)
Swobodny ruch elektronów- przewodnictwo prądu elektrycznego
Pod wpływem przyłożonej siły nigdy nie nastąpi spotkanie 2 kationów, nie wystąpi
odpychanie, stąd plastyczność a nie kruchość i pękanie
Dzięki gazowi elektronowemu metale są świetnymi przewodnikami
W metalach nie ma innych sił, tylko wiązanie metaliczne
Siły międzycząsteczkowe II rzędu
+1
+1
Nie występują w metalach
Siły Van der Waalsa
a) Siły orientacji:
Najsilniejsze
Pomiędzy jonem a dipolem trwałym
Lub między dipolem trwałym a dipolem trwałym
Energia 20kJ/mol
b) Siły indukcji (słabsze)
Jon-dipol trwały
Dipol trwały-dipol indukowany
Energia 4kJ/mol
c) Siły dyspersji
Nie występują w materiałach w stanie stałym np. w cieczach łatwo lotnych
Na wskutek ruchu drgającego cząstek indukowane są dipole (chwilowe)
Mostki wodorowe
Mocniejsze od Van der Waalsa
H
2
0- wiązanie spolaryzowane w kierunku tlenu
Woda tworzy asocjaty ( cząsteczki wody połączone są ze sobą mostkami
wodorowymi)
Im wyższa temp. tym słabsze wiązanie
Stała cieplność organizmu człowieka jest związana z parowaniem wody (wysoka
temp)
H
H
H
H
O
O
H
H
H
H
O
O
H
H
H
O
O
H
1. Metale – wiązanie metaliczne (plastyczne, przewodniki prądu)
2. Mineralne (szkło ceramika)- dominują przede wszystkim wiązania jonowe, atomowe,
wiązania II rzędu, o właściwościach decyduje wiązanie jonowe, są kruche!!!

3. Orgarniczne ( bitumy, materiały polimerowe, drewno) – wiązanie atomowe, a o
właściwościach decydują siły II rzędu, nie ulegają działaniu wody, nie są rozpuszczalne
w rozpuszczalnikach organicznych.
Wytrzymałości materiałów są znacznie mniejsze niż wynika to z energii wiązań (defekty
struktury pojawiające się w danych materiałach, wyjątek nanomateriały)
Rodzaje ciał stałych:
1. Krystaliczne
2. Amorficzne (bezpostaciowe)
3. Polikrystaliczne
Kryształ- uporządkowany geometrycznie, stabilny układ atomów jonów lub cząsteczek
Budowę polikrystaliczną mają metale
Ciała amorficzne:
Szkła, żywice, tłuszcze, niektóre proszki
Nie wykazują żadnych regularnych płaszczyzn ograniczających
Nie można w nich wskazać żadnego prawidłowego ułożenia cząstek. Każdy kierunek
jest równoważny pod względem własności fizycznych(izotropowość)
Kryształy (monokryształy)-ciała organiczne płaszczyznami i których własności fizyczne (np.
sprężystość, przewodnictwo cieplne, elektryczne) są zależne od kierunku (anizotropowość)
Ciała krystaliczne –większość materiałów, można sobie wyobrazić jako powstające w
przestrzeni identyczne bryły geometryczne
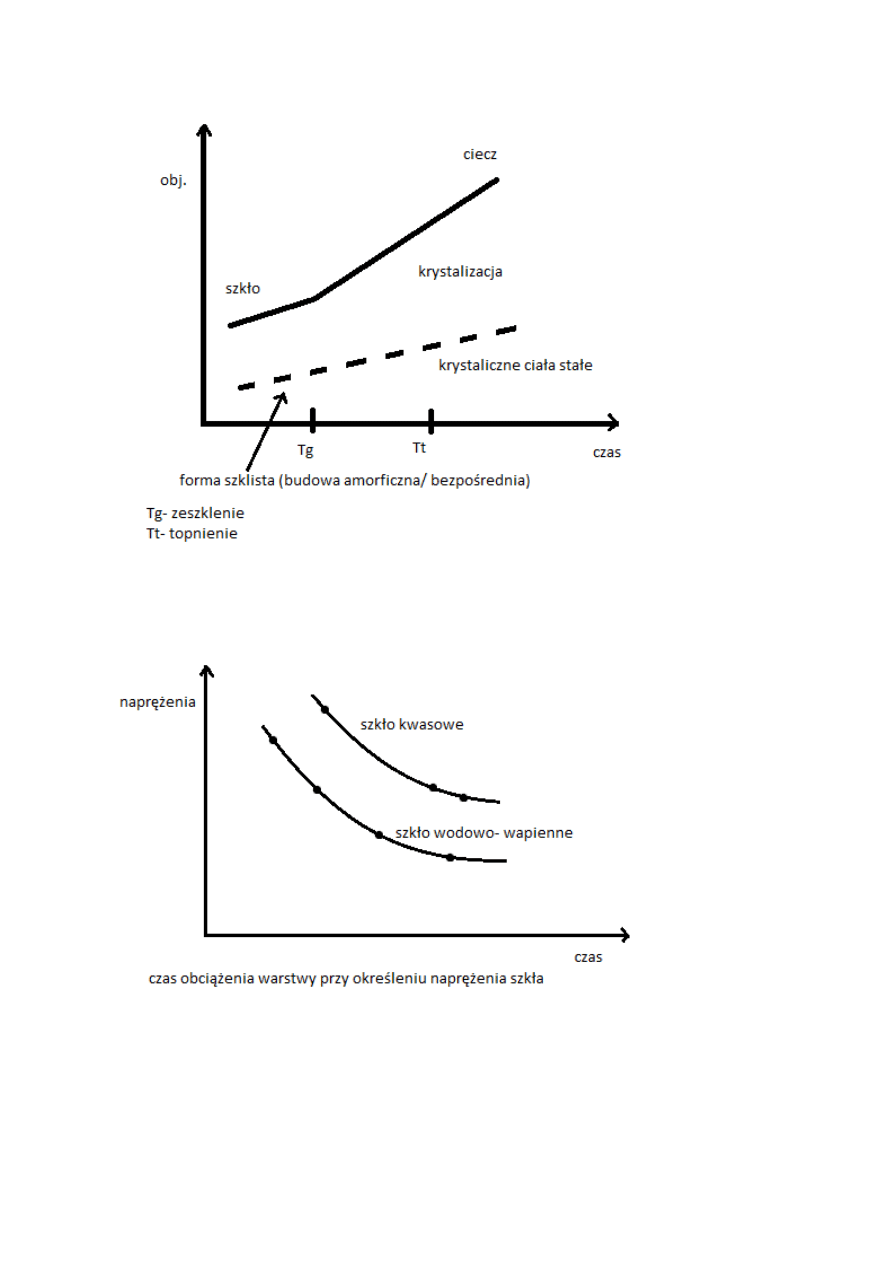
Ciała amorficzne najpierw miękną, poźniej dopiero przechodzą w stan ciekły. Znacznie w
większym stopniu zwiększają swoje właściwości pod wpływem ciepla (opis za pomocą funkcji
temperatury).
Objętość
ciecz
ciecz przechłodzona
szkło
krystalizacja
Tg-temp. zeszklenia
Tt-temp. topnienia
krystaliczne
ciało
stałe
Tg
Tt
Temperatura

Istnieje bardzo dużo struktur krystalicznych związanych min. z 100 różnych pierwiastków,
4950 związków dwuskładnikowych etc.
Krystalofizyka- ustala zależności między właściwościami fizycznymi a budową kryształów
Krystalochemia- określa prawidłowości między składem chemicznym a właściwościami
chemicznymi materiału.
Krystalografia- nauka o kryształach. Składa się ona na krystalografie geometryczną,
strukturalna.
Definicja komórki prymitywnej: odpowiadającej jej bazy atomowej
Najmniejsza bryła atomowa, która po translacjach o wszystkie możliwe kombinacje
wektorów wypełnia całą przestrzeń bez dziur i nakładanie się.
Baza- atomowa sieć najmniejszy powtarzający się element struktury np. pojedynczy atom,
grupa atomów, jon.
Węzły sieci przestrzennej- są tam osadzone cząsteczki
Sieci krystaliczne
Więzy sieciowe- zbiory punktów mających takie samo otoczenie
Sieć otrzymana w wyniku równoległego przemieszczenia dowolnego węzła sieci krystalicznej.
Opis sieci przestrzennej-POJEBANE!
a) Układ uwspól. krystalograficznych
b) Komórka sieciowa
Dla danej substancji są charakterystyczne długości krawędzi( długości przypisane do
kryształu- tablice krystalograficzne, opisy na podstawie badań)
Układy krystalograficzne:
Układparametry sieciowe
1) Regularny – sześcian
2) Tetragonalny- prostopadłościan o podstawie kwadratu
3) Rombowy- prostopadłościan o podstawie prostokąta
4) Trygonowy
5) Heksagonalny
6) Jednoskośny
7) Trójskośny
Kryształy molekularne:
Zbudowane z cząsteczek
Dość nietrwałe mechanicznie

Topiące się w stosunkowo niskich temperaturach <300C , ze względu na małe siły
tworzące wiązania krystaliczne ( Van der Waalsa)
Należy tu najwięcej związków organicznych
Kryształy jonowe
Kryształy związków nieorganicznych, elektrolitów podlegających dysocjacji
elektrolitycznej)
Siły wiążące jony- oddziaływanie elektrostatyczne
Przykład gazy szlachetne, NaCl
Kryształy metaliczne:
Czyste metale i ich stopy
Materiały plastyczne
Duze przewodnictwo cieplne i elektryczne
Silnie odbiegają właściwościami od pozostałych typów
Zbudowane z kationów metalu tworzących sieć krystaliczną oraz pochodzących z
powłok walencyjnych elektronów tworzących gaz elektronowy
Struktura krystaliczna metali
a) Regularna, ściennie scentrowana- sposób w jaki ułożone są kationy metalu zajmują
wierzchołki i środki ścian sześcianu np. Cu, Al, Ni, Ag, Au, Pb, żelazo gamma
b) Regularna, przestrzennie scentrowana( w środku i na wierzchołkach) np. Mo, żelazo
alfa
c) Heksagonalna zwarta- Mg, Zn, Ti,kationy metalu tylko w narożach bryły
Kryształy kowalencyjne:
Mają osadzone atomy w węzłach sieci krystalicznej. Pomiędzy nimi są wiązania
atomowe kowalencyjne, tworząc makrocząstki np. diament
Diament:
Konfiguracja tetra cos tam, układ regularny, komórka elementarna sześcian
Cechy: trwałość, odporność chemiczna, szczególne właściwości optyczne
Grafit:
Ma budowę warstwową
Silne wiązania atomowe
Pomiędzy warstwami siły II rzędu- łatwo coś tam
Wzdłuż wiązań I rodzaju ciężko
Polimorfizm:
Ta sama substancja może wystąpić w kilku odmianach krystalicznych, różniących się
najczęściej właściwościami fizycznymi, optycznymi (np. diament i grafit)
Izomorfizm:
Występowanie różnych substancji prawie w tych samych strukturach sieci
krystalicznej
Ze względu na podobieństwo struktur tworzących przez nie kryształów (kierunki i
wymiary wiązań sieci krystalicznej) mogą tworzyć kryształy mieszane
Cząsteczki jednej substancji mogą zastępować w budowie kryształu drugiej cząsteczki
Zjawisko rzadziej występujące od poliformizmu
Defekty struktury krystalicznej (zmniejszają wytrzymałość, odporność chemiczną)
a) Występowanie luk w sieci przestrzennej –koncentracja napięcia w tym miejscu po
przyłożeniu siły, kryształ niszczy się, kruszy, pęka
b) Wbudowywanie w sieć krystaliczną obcych materiałów
Koncentracja naprężeń
Silnie rzutuje to na właściwości materiału, gdy jest ich więcej
Zanieczyszczenia, zaburzają odporność chemiczną
c) Wbudowanie atomu w pozycji międzysieciowej
Bardzo silnie obniża się odporność chemiczna np. w węzłach siarki
Wady struktury krystaliczne
Punktowe
Liniowe
Ziarnowe
-wakanse luki (wolne
dyslokacje:
granice ziaren
miejsca w sieci kryst)
-krawędziowe
-obcy atom w węźle
-śrubowe
-obcy atom międzywęzłowy
-atom międzywęzłowy
-proces dyfuzji
-odkształcenia plastyczne
-właściwości wyt. i mag.
-umocznienie roztworów
-umocznienia
stałych
Powielanie tych defektów powoduje obniżenie wytrzymałości mechanicznej. Chemicznej
Metale i ich stopy:
Wszystkie metale z wyjątkiem rtęci to ciała stałe, metaliczny połysk, dobra
przewodność cieplna i elektryczna (odkształcają a nie pękają) możliwość
obróbki plastycznej (walcowanie, kucie, wyciskanie, ciągnienie, tłoczenie)
Wysokie cechy wytrzymałościowe, zwłaszcza na rozciąganie
Wiele metali w wyniku działania atmosfery tworzy warstwy pasywne

Stopy mają korzystniejsze właściwości w stosunku do zwykłych metali, bardzo
zróżnicowana temperatura topnienia
Podział ze względu na gęstość
a) Metale lekkie (<5000kg/m3) np. Li, Mg, Al
b) Metale ciężkie (>5000kg/m3) np. Fe Cr Ni Sn Pb
Podział ze względu na temperaturę topnienia:
a) Metale trudnotopliwe np. Fe Cr N Ni (>700C)
b) Metale łatwo topliwe np. Sn Zn Pb (<700C)
Cecha niekorzystna dla metali to to, że w obecności tlenu mogą się utleniać
Warstwy pasywne- na miedzi różnią się barwami
Cuo(czarna, tylko w temp >50C), Cu
2
O (czerwono brunatna)
Jeżeli atmosfera nie jest zanieczyszczona tlenkami siarki powstaje zielona pałyna (złożona z
zasadowego węglanu miedzi) Jeśli jest szara warstwa- siarczany miedzi
Plastyczność- trwałe odkształcenie plastyczne, może wynosić kilkadziesiąt%, co umożliwia
obróbke plastyczną metali: walcowanie kucie tłocznienie
Warstwy pasywne:
1. Miedź
Czarna- Cu0- suche powietrze, wysoka temp
Czerwonobrunatna- Cu
2
0- suche powietrze
Zielona Cu
2
[(OH)
2
CO
3
] – atmosferyczne powietrze
Szara Cu
2
(OH)
2
SO
4
2. Cynk- bardzo reaktywny metal, szybko utlenia się, warstwa pasywna bardzo mocna,
zabezpiecza przed zniszczeniem, barwa szara ZnO+Zn
2
[(OH)
2
CO
3
]
3. Glin –szara Al
2
O
3
4. Magnez –biała matowa- Mg
2
[(OH)
2
CO
3
]
Możliwość trwałego łączenia na gorąco
Spawanie- stopnienie krawędzi łączonych z ewentualnym uzupełnieniem ziaren
spoiwem o składzie zbliżonym do łączonych metali
Zgrzewanie- rozgrzanie stykających się powierzchni tak, aby przeszły one w stan
plastyczny i dociśnięcie, uplastycznieniu ulega tylko niewielka objętość na granicy
styku
Lutowanie- łączenie elementów za pomocą spoiny (lutu), wypełnionej metalem o
temp topnienia niższej od metali łączonych, gdzie spoina jest nakładana w postaci
stopionej, podczas gdy lączone elementy pozostają cały czas w stanie stałym

1
SIECI KRYSTALICZNE METALI
1) Regularna, ściennie centrowana: Al., Cu, gamma-Fe, Ag, Au, Pb
2) Regularna, przestrzennie centrowana: α-Fe, Cr, Mo, W, V, Nb
3) Heksagonalna zwarta?: Mg, Zn, Cd, T
PODZIAŁ METALI:
1) Żelazne, żelazo i jego stopy
2) Nieżelazne (metale kolorowe) i ich stopy
Ad 1. 2 odmiany alotropowe żelaza możliwość tworzenia różnych struktur gamma-Fe, alfa-Fe
- możliwość kształtowania wielu struktur w stopach
-90% zastosowań metali w technice stopy żelaza!
-żelazo występuje w postaci tlenków, siarczków, siarczanów w przyrodzie
-temp topnienia żelaza ok. 1000 stopni C- nie stanowi barier do otrzymywania stopów (jego obróbki)
- stopy te dzieli się na stale i żeliwa
Ad. ?
-granicą oddzielającą stale od żeliw jest max rozpuszczania węgla w gamma-Fe
-stale zawierają 2,1%
-żeliwa od 2,11%-3,8%
-w Fe występują 2 przemiany fazowe (2 odmiany poliformowe?), co umożliwia tworzenia batrdzo
wielu mikrostruktur, które mają zróżnicowane właściwości fizyczne.
Faza- jednolita, wyodrębniona część układu oddzielona powierzchniami granicznymi
WYSTĘPOWANIE FE
-hematyt Fe
2
O
3
- tlenek
-magnetyt Fe
3
O
4
-tlenek
-syderyt FeCO
3
- węglan
-limonit -węglan
-piryt FeS
2
-asenolit?

OTRZYMYWANIE
Fe
2
O
3
+ 3C= 2Fe + 3CO redukcja węglem lub tlenkiem węgla
Fe
2
O
3
+ 3CO= 2Fe + 3CO
2
C + CO
2
= 2CO
Fe
3
O
4
+2C= 3Fe +2CO
2
1. FAZY STOPOWE
Stop – tworzywa składające się z metalu, do którego wprowadzono co najmniej 1 pierwiastek (metal
lub niemetal) w celu zmiany jego właściwość w żądanym kierunku.
W stanie ciekłym składniki stopów rozpuszczają się zwykle bez ograniczeń tworząc roztwory ciekłe
(fazy po temp topnienia ciekłe) o nieograniczonej rozpuszczalności.
Faza – fizycznie odrębna, chemicznie jednorodna i teoretycznie dająca się oddzielić część materiału
Roztwór stały- jednorodna faza złożona z co najmniej z 2 rodzajów atomów (cechy –ma typ struktury
krystalicznej składu stanowiącego podczas roztworu?? rozpuszczanie ???)
Stopy mogą być zbudowane z następujących faz
-fazy proste (czyli pierwiastki-brak rozpuszczalności składników)
-roztwory stałe (rozpuszczalność składników)
-fazy międzymetaliczne (żelazo i węgiel)
Roztwór stały- jednorodna faza złożona z co najmniej 2 rodzajów atomów
-roztwór ma typ struktury krystalicznej składnika stanowiącego podstawę roztworu-rozpuszczalnika
-wyróżnia się roztwory stałe różno węzłowe (a) i międzywęzłowe (b)
Roztwór-stanowi fazę homogeniczną (jednorodna) mieszanina co najmniej 2 składników
a) Różnowęzłowe substancja rozpuszczona osadza się w węzłach sieci krystalicznej
Rysunek
b) Międzywęzłowe węgiel osadza się pomiędzy węzłami
rysunek

Roztwór stały- jego struktura krystaliczna zależy od podstawy roztwory- taka jak jego struktura, jego
składnikiem jest substancja występującą w nadmiarze, substancję rozpuszczoną jest ta w 2 fazie.
Roztwory różnowęzłowe- tworzą się w wyniku zbliżonych promieni? Atomowych składników
Roztwory węzłowe- tworzą metale przejściowe (np. Fe, Ti) z pierwiastkami niemetalicznymi o bardzo
małych promieniach atomowych (H, CN?)
Zniekształcenia sieci i napięcie wewnętrzne w roztworze są powodem:
-mniejszej elastyczność, plastyczności
-większej wytrzymałości
-mniejszej przewodności elektrycznej w porównaniu z rozpuszczalnikiem
Fazy międzymetaliczne- struktura i właściwości pośrednie miedzy roztworami stałymi i związkiem
chemicznym.
Cechy charakterystyczne:
- struktura krystaliczna odmienna od struktury skład
- uporządkowane rozmieszczenie atomów składników w sieci stała proporcja atomów Fe
3
C i węglik
żelaza
-wiązanie metaliczne
-uporządkowane rozmieszczenie atomów składników w sieci, stała proporcja atomów
Wykresy fazowe- (układów równowagi faz stopowych)
-pokazują budowę fazową, strukturę stopów danego układu w funkcji składu chemicznego i temp
UKŁADY- wszystkie możliwe stopy utworzone przez te same składniki np. układ Fe-C, czyli wszystkie
stopy utworzone przez Fe i C
STAL WĘGLOWA
-surówka-stop żelaza z węglem, krzemem, manganem, siarką, fosforem, tlenem, azotem i innymi do
ok. 10%--> otrzymuje się ją w piecu
-podlega ona okresowej obróbce w piecach stalowniczych, podczas której utlenia się znaczna część
domieszek (nie przekracza ona wtedy ??)
powstaje stal węglowa

Stopy żelaza – klasyfikacja
Żelaza: Stopy żelaza:
-wysokiej czystości (100% Fe) -surówki, stale, żeliwa, żelazostopy, staliwa(odlewnicze)
-żelazo technicznej czystości
Stal- stop żelaza z węglem i innymi dodatkami stopowymi zawartość do ok. 2% węgla, otrzymamy w
procesach stalowniczych, przeznaczony na półwyroby: wyroby przerabiane plastyczne.
Stal węglowa (zwykła-niestopowa) –nie zawierająca specjalnie wprowadzonych dodatków
stopowych, jedynie węgiel i ograniczone ilości pierwiastków pochodzących z rudy, procesu
hutniczego np.
Stal stopowa- zawierająca pierwiastki stopowe wprowadzone w celu zmiany właściwości w
określonym kierunku np. stal nierdzewna
Staliwo- stop żelaza z węglem i innymi dodatkami stalowymi zawierającymi do ok. 2% węgla,
otrzymany w procesach stalowniczych przeznaczonych na odlewy
Pierwiastki występujące w stalach: (stal nierdzewna dodatek chrom)
a) składniki zwykłe-odtlenianie stali: Mn, Si, Al. (uspakajanie stali-usuwanie tlenu. Tlen obniża
właściwości wytrzymałościowe przy obróbce)
b)zanieczyszczenia- usuwanie nieopłacalne: S, P, O, N, H
c) pierwiastki stopowe- Ni, Cr, Mo, Mn, Si, N, V, Cu i B wprowadzamy je celowo, aby uzyskać stal
stopową o lepszych właściwościach
Wpływ węgla na właściwości stali:
-maksymalna wytrzymałość-wraz ze wzrostem do ok. 0,8% zawartość węgla wzrasta po przekroczeniu
1% maleje
-wytrzymałość(stan graniczny plastyczności)-jak wyżej?
-twardość stali (określana w stopniach…)
-odporność na pękanie-spada wraz ze wzrostem zawartości węgla
Na podstawie wykresu:
-wraz ze wzrostem zawartości węgla w stali rośnie jej twardość

-Rm –wytrzymałość stali, wraz ze wzrostem zawartości (do 0,8%) również wzrasta, po przekroczeniu
ok. 0,8% maleje. To samo dotyczy wytrzymałości granicy plastyczności
-Re rośnie do ok. 0,1%-później maleje bo wzrasta kruchość stali. Wraz z zawartością węgla (maleje
odporność na pękanie)
Na podstawowe właściwości stali rzutuje zawartość węgla
WPŁYW NA WŁAŚCIWOŚCI STALI (wpływ składu chem na własności stali)
Węgiel
-podwyższa właściwości wytrzymałościowe stali przy obniżeniu właściwości plastycznych
-wytrzymałości i granica plastyczności wzrastają jedynie do zawartości 0,8% węgla, ponieważ
obecności cementytu (Fe
3
C) wtórnego powoduje kruchość stali
Mangan
-występuje w postaci roztworu stałego w ferrycie
-podwyższa właściwości wytrzymałościowe nie wpływające na plastyczność
-korzystnie wpływa na zgrzewalność stali
Krzem
-pogarsza zgrzewalność (np. pogarsza spawanie)
-również w postaci ciała stałego
-podnosi właściwości wytrzymałościowe stali, w tym granicę sprężystości
Fosfor
-zwiększa kruchość stali zmniejsza plastyczność, podwyższa temp przy której stal staje się krucha,
powodując jej kruchość w zimne
-domieszka ochronna
Siarka
-najbardziej szkodliwa domieszka
-reagując min. z Mn
-silnie wpływa na odporność stali na korozję
-siarczki zwiększają kruchość
-stal łatwiej pęka i staje się krucha

Miedź
-w postaci roztworu stałego w ferrycie?, odporność na korozję
Nikiel
-ułatwiony jest proces hartowania stali (obniża temp w której stal przechodzi w stan kruchy)
-9% stal odporna na korozje i żaroodporna
-3-9% duża temp przejście w stan kruchy
Chrom
- 10,55< zapewnia odporność na korozje i utlenianie np. w stalach nierdzewnych (droga bo dużo
domieszek metali szlachetnych)
Molibden
-zwiększa hartowność, twardość i odporność na korozję
-opóźnia mięknienie stali przy wzroście temp
Wolfram
-zapewnia wzrost odporność na ścieranie
Kryteria klasyfikacji stali:
Kryterium podziału
Przykładowe rodzaje grupy stali
Skład chem
Niestopowa(węglowa), stopowa
Podstawowe zastosowanie
Konstrukcyjna, narzędziowa, o szczególnych
właściwościach np. stal magnetyczna
Jakość min. stężenie
Jakościowa, specjalna ograniczona zawartość
fosforu i ołowiu
Sposób wytwarzania
Stal martenowska, elektryczna, ..
Sposób odtlenienia
Uspokojna, półuspokojona i nieuspokojona
Rodzaje produktów
Blachy, pręty, druty…
Postać
Lana, kuta, walcowana np.. gorąco walcowana
zimną
Stan kwalifikacyjny
Surowy, wywarzony…?
Stal nieuspokojona - gdy tlen nie jest związany, silne „burzenie” – duże wydzielenie tlenu; zalety:
wysoka wydajność; wady: silna segregacja, występowanie pęcherzy gazowych, skłonność do starzenia
się,
Stal odtleniona tylko manganem we wlewku niespokojnie, wydzielają się gazy (zjawisko wrzenia)

Stal uspokojona - stal odtleniona krzemem, i częściowo glinem, przy krzepnięciu nie zachodzą żadne
reakcje i wydzielenie się gazu; zalety: nieznaczna segregacja, brak wyraźnego starzenia się stali,
lepsze własności plastyczne; wady: mniejsza wydajność.
Stale węglowe(niestopowe) – zawartość węgla decyduje o właściwościach mechanicznych
Pozostałe pierwiastki znajdujące się w tych stalach pochodzą z przerobu hutniczego (krzem, mangan,
aluminium) z zanieczyszczenia ( fosfor, siarka, tlen, wodór , azot)
Stal stopowa – stale, do których celowo wprowadza się pierwiastki stopowe, by nadał im
wyznaczone właściwości, zdarza się, że słabym dodatkiem jest azot,
Żelaza – 2 odmiany alotropowe: i ; żelazo - termodynamiczne, trwałe od niskich temperatury do
912 st. ( w 912 st- w równowadze), oraz od temp. 1390-1534 st. Ma strukturę krystaliczną, o sieci
regularnej przestrzennie centrowanej, żelazo - termodynamiczne, trwałe w temp. 912-1390st. Ma
strukturę krystaliczną o sieci ścienno centrowanej,
Stal półuspokojona – stal odtleniona manganem, niewielką ilością krzemu, wlewek krzepnie bez
wrzenia, lecz wydzielają się pęcherze wewnętrzne, w miarę duży uzysk( 8-15%); wady: pośredni
stopień segregacji i ilości pęcherzy.
Cementyt – faza międzymetaliczna (międzywęzłowa),zawiera 6,7% węgla, krystalizująca w temp.
1252 st. Twardość: 700 MB – 10x większa od żelaza A= 0%
Stopy żelaza z węglem – traktujemy jako dwuskładnikowe, mimo ze zawierają też inne pierwiastki,
Niskostopowe – o zawartości pierwiastka stopowego poniżej 5%
Wysokostopowe – o zawartości przynajmniej 1 pierwiastka stopowego powyżej 5%
Stale węglowe (niestopowe) – do 0,6% węgla
Żelazo techniczne – 0,2% domieszek
Żeliwo – stop żelaza z węglem, zawierający ponad 2% węgla
W układzie równowagi żelazo-cementyt (zależnie od temperatury i zawartości węgla)
Występują fazy:
a) Ferryt – roztwór stały węgla w -Fe [Fe
(C)], graniczna zawartość węgla od 0,008% do 0,02%,
właściwości fizyczne i mechaniczne zbliżone do -Fe
b) Austenit – roztwór węgla międzywęzłowy w - Fe, graniczna zawartość węgla (jednocześnie
graniczna w stalach), duża plastyczność
c) Cementyt – węglik żelaza, krystalizuje się w układzie rombowym, stosunek żelaza do węgla
3:1
Składniki strukturalne – w stopach żelazo – cementyt mogą wystąpić następujące strukturalne
składniki jednofazowe:
Ferryt, austenit i cementyt oraz składniki dwufazowe: perlit i ledeburyt
Perlit – (Fe
(C) + Fe
3
C)
Stale perlityczne służą do budowy szyn,

Mieszanka faz: ferrytu i cementytu,
Budowa pasmowa
MB=220-260 Rm=700-800 MPa A10~7%
Ledeburyt
Roztwór ciekłego LC w temperaturze 1147 st,
Mieszanina euktektyczna faz: austenitu i cementytu,
Poniżej 723 st. Ledeburyt stanowi mieszaninę perlitu i cementytu, struktura taka nosi nazwę
ledeburyt przemieniony
Ferryt- budowa komórkowa, może mieć budowę iglastą
Na właściwości stali maja wpływ:
Skład chemiczny technologia wytwarzania mikrostruktura [ najlepiej drobnoziarnista
(najmniejsze szanse na wady strukturalne) i jednorodna] właściwości
Zależność między twardością a odpornością na ścieranie i wraz ze wzrostem twardości maleje
odporność na ścieranie.
Zwiększamy odkształcalność ( przy dodatkach stopów i składników) zmniejsza się wytrzymałość
Obróbka termiczna stali
Stale niestopowe- wyżarzane,
Mikrostruktura po wyżarzaniu: drobnoziarnista, jednorodna na przekroju,
Właściwości mechaniczne po wyżarzaniu: wyższa granica plastyczności, udarności, niewielki
wzrost pozostałych właściwości,
Cel
Usunięcie skutków przegrzania,
Ujednorodnienie struktury wyrobów hutniczych,
Ujednorodnienie struktury w wyrobach spawanych,
Zapewnienie powtarzalności wyników obróbki cieplnej w produkcji seryjnej,
Hartowanie – składa się z 2 faz:
I faza: nagrzewanie się do temperatury 750 st,
II faza: szybkie schładzanie, szybkie schładzanie musi być takie, by z austenitu nie zdążył
wydzielić się cementyt,
Stal w niższych temperaturach staje się krucha, dlatego podlega wyżarzaniu
Martenzyt ( faza drobnokrystaliczna) – korzystnie zmienia si właściwość stli, podnosi twardość i
wytrzymałość stali,

Jest to metastabilna faza stopu Fe i powstała podczas szybkiego schładzania austenitu,. Polega na
przebudowie sieci krystalicznej, sieć krystaliczna ścienno centrowana na sieć tetraponalną
przestrzennie centrowaną,
Ferryt
międzywęzłowy roztwór stały węgla w żelazie Fe
(C),
graniczna zawartość węgla w stanie równowagi, w temperaturze 20st. – 0,008% i wzrasta, w
temperaturze 723 st. – 0,02%,
budowa komórkowa, może mieć budowę iglastą, bardziej rozdrobniony,
właściwości fizyczne i mechaniczne zbliżone do żelaza,
80 MB (twardość ) Rm – ok. 300 MPa (wytrzymałość) A10 – ok. 40% (odkształcalność)
Austenit
Struktura komórkowa, bardziej regularna niż ferryt,
Charakterystyczne dla struktury austenitu jest występowanie rekrystalizacyjnych kryształów
bliźniaczych,
Międzywęzłowy roztwór węgla w żelazie Fe
(C)
Graniczna zawartość węgla 1147 st. - 2,06% - równocześnie duża plastyczność, wyższa
gęstość niż ferryt,
Cementyt
Występowanie w stopach w postaci cementytu pierwszo, drugo lub trzeciorzędowego ( w
zależności od węgla),
Cementyt pierwszorzędowy – ponad 4,3% węgla,
Cementyt wtórny – wydziela się z austenitu C>0,8%, na skutek zmniejszającej się ze spadkiem
temperatury rozpuszczalność węgla w żelazie ,
Cementyt trzeciorzędowy – wydziela się z ferrytu, na skutek zmniejszającej się ze spadkiem
temperatury rozpuszczalności węgla w żelazie ; w stalach o małej zawartości węgla,
powstaje na granicy ziaren ferrytowych,
Perlit
Mieszanka 2 faz: ferrytu i cementytu,
0,8 % zawartości węgla
Tworzy się w temperaturze 723 st.,
Ma budowę pasemkową – składa się z płytek ferrytu i cementytu i ułożonych na przemian,
obecność perlitu daje wysoką wytrzymałość dla stali,
Ledeburyt
Eutektyk o zawartości 4,3% węgla, tworząca się z roztworu ciekłego LC w 1147 st.,
Eutektyk – mieszanina, układ 2 fazowy, który nie daję się rozdzielić,
Mieszanina eutektyczna 2 faz: austenitu i cementytu
Poniżej temperatury 723 st. Ledeburyt stanowi mieszaninę perlitu i cementytu, struktura ma
wtedy nazwę ledeburytu przemiennego,
Struktury stali węglowych
W temperaturze otoczenia w zależności od zawartości węgla, struktury stali węglowych są
następujące:
Przy zawartości węgla teoretycznie nie przekraczającej 0,0087 występuje struktura
ferrytyczna (czyste żelazo),
Przy zawartości węgla 0,008-0,027% żelazo techniczne ( na granicy fazy ferrytu wydziela się
cementyt trzeciorzędowy,

Stale o zawartości do 0,8% węgla noszą nazwę stali podeutektoialnych, ich struktura składa
się z 2 składników (ferrytu i perlitu), przy czym w miarę wzrostu zawartości węgla w stali
wzrasta zawartość perlitu w strukturze,
Stal o zawartości 0,8% węgla ma strukturę perlityczną i nosi nazwę eutektoidalną
Stale o zawartości 0,8-2,06% węgla nazywają się stalami nadeuktetoidalnej i maja strukturę
składającą się z perlitu i cementytu wtórnego, w miarę wzrostu zawartości węgla wzrasta
ilość cementytu w strukturze, granica zawartości węgla 2,06% wynosi wtedy 20%.
Wpływ węgla na mikrostrukturę stali: (obrazek)
Stal podeutektoidalna
Ferryt- jasne obszary
Pereit- ciemne,
Stal eutektoidalna
100% ferrytu
Jednorodna
Stal nadeutektoidalna
Pereit – ciemne obszary
Struktura budowy – gruboziarnista
Podsumowanie:
Najwyższą wytrzymałość i najwyższą plastyczność ma stal o strukturze ferrytycznej
Wzrasta zawartość węgla rośnie zawartość i wytrzymałość stali przy jednoczesnym
obniżaniu się pasywności,
Maksymalna wytrzymałość stal eutektoidalna (0,8%C)
Dalszy wzrost zawartości węgla powoduje podwyższenie twardości, gdyż w strukturze
pojawia się cementyt wtórny, jednocześnie maleje wytrzymałość stali (jest mało pasywna)
Klasyfikacja stali (wg PN-EN 100020:2003)
Opiera się na analizie wytopowej ( zawartość pierwiastków) i zależy od ich minimalnej
zawartości
Klasyfikacja znaków stali:
1)wskazujące na zastosowanie oraz mechaniczne lub fizyczne właściwości stali
2)wskazujące na skład chemiczny stali
Ważniejsze znaki wskazujące na zastosowanie oraz mechaniczne właściwości stali:
Oznaczenie literowe
Oznaczenie cyfrowe
S - stale konstrukcyjne
P – pracujące pod ciśnieniem
L – na rury przewodowe
E – stale maszynowe
Liczba równa min. granicy plastyczności
[N/mm
2
] dla najmniejszej grubości wyrobu
B - stale do zbrojenia betonu
Charakterystyczna granica plastyczności
N/mm
2
]
Y - stale do betonu sprężonego
Minimalna wytrzymałość na rozciąganie
N/mm
2
]
R – stal na szyny lub w postaci szyn
Minimalna wytrzymałość na rozciąganie
N/mm
2
]
H - wyroby płaskie walcowane na zimno ze
stali o podwyższonej wytrzymałości do
kształtowania na zimno
Minimalna granica plastyczności [N/mm
2
]
T – j.w.
Minimalna wytrzymałość na rozciąganie
N/mm
2
]
D - wyroby ze stali miękkich do
kształtowania na zimno (poza tymi ze
znakiem H)
M – stale elektrotechniczne
Przykłady oznaczeń stali :
S185 – stal konstrukcyjna o Re=185 [MN/m
2
] (N/mm2
2
);
S 355JR- stal konstrukcyjna o Re=355 [MN/m
2
] (N/mm2
2
), o udarności w temp. +20
o
C w wysokości
min. 27 [J].
Stale wysokostopowe
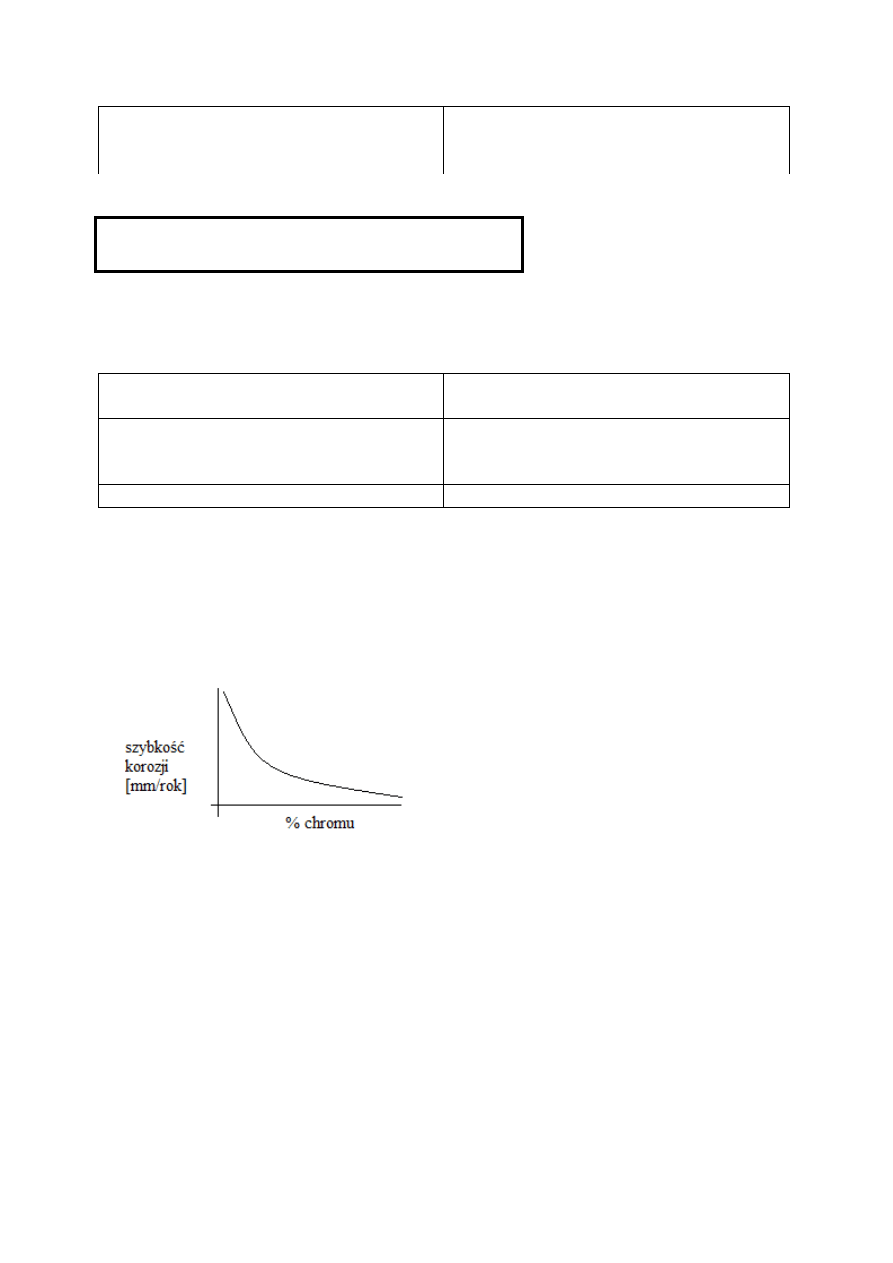
-pasywacja stali stopowych
Chrom - niezbędny dodatek stopowy
Stal odporna na korozje – warunki pasywności
-min. zawartośc chromu Cr: 10,5%
-max. Zawartośc węgla C:1,2%
-Pasywność się poprawia gdy: zawartość chromu wynosi ~17%
-Większość stali wysokostopowych zawiera 17-19% Cr
-utrudniona obróbka stali
-odpornośc korozyjna zależy od obecności warstwy pasywnej
- realne oszczędności - Możliwa optymalizacja do eksploatacji w różnych środowiskach dzięki
dodatkom stopowych np. Ni, Mo, N, Cu….
Stale odporne na korozję:
Rodzina stali wysokostopowych:
-Ferrytyczne
-Austenityczne
-Martenzytyczne
-Martenzytyczno-austenityczne
-Ferrytyczno-austenityczne
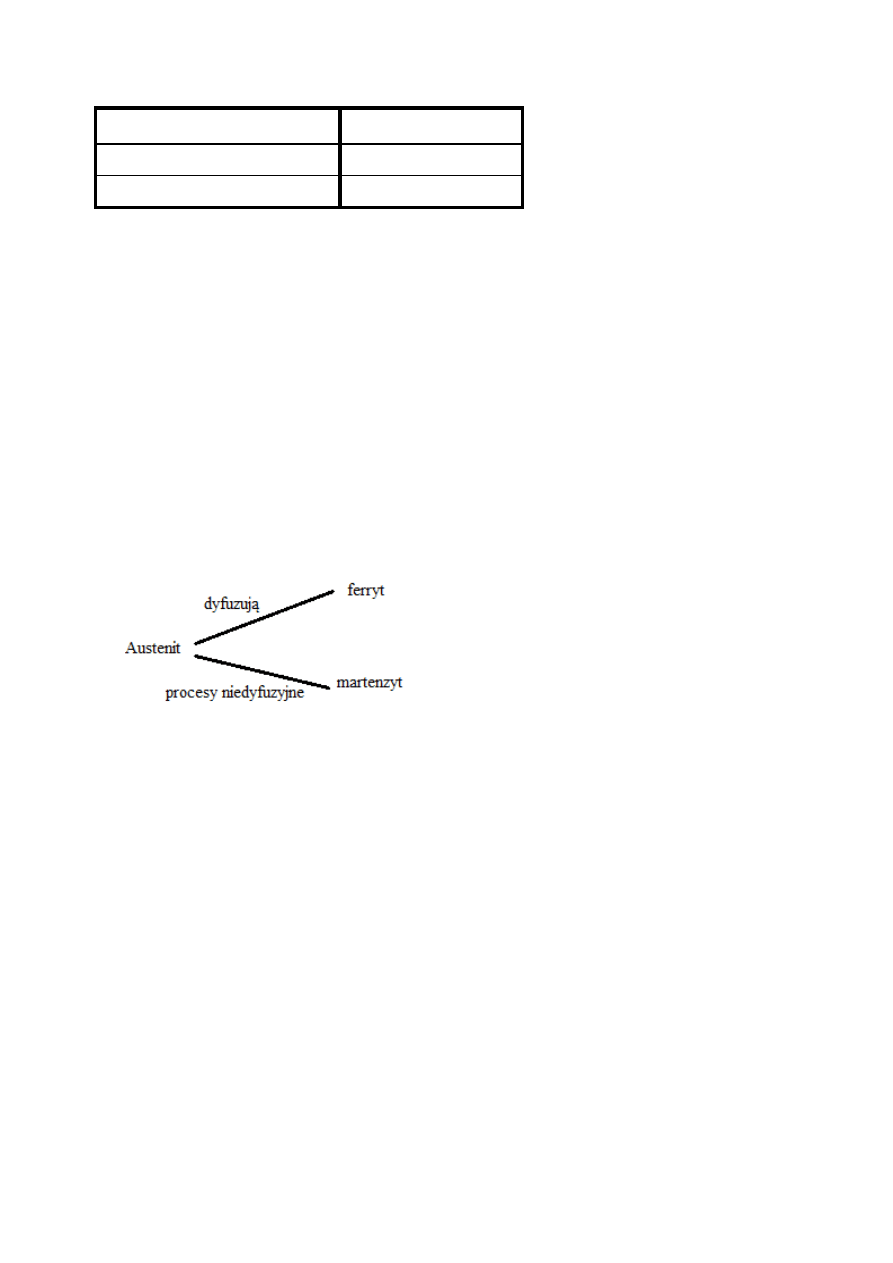
Żelazo może być stabilne w trzech formach krystalograficznych:
-Ferryt
-Austenit
-Martenzyt
•
Żelazo stabilne jest kiedy:
–
austenit ponad 914°C
–
ferryt poniżej 914°C.
–
Martenzyt i ferryt poniżej 550°C
Wpływ dodatków stopowych:
-Poprawa stabilności austenitu w niskich temperaturach.
-Zwiększanie intensywności formowania się martenzytu poprzez ograniczanie transformacji w ferryt.
według zawartości niklu:
nierdzewne:
-Ni<2.5 %
-żaroodporne
-Ni >2.5 %
-żarowytrzymałe
•
Dodatki stopowe zmianiają zarówno odporność korozyjną jak i mikrostrukturę.
•
Dodatki stopowe mogą stabilizować austenit jak i ferryt.
•
Stabilność faz zależy od zawartość składników
Dlaczego skład fazowy jest tak bardzo ważny:
•
Ferryt, austenit i martenzyt ma bardzo różne właściwości z uwagę na formę krystalograficzną.
•
Na przykład:
–
Ferromagnetyzm,
–
Rozszerzalność cieplna,
–
Przewodnictwo cieplne,
–
Odporność.
–
Mechaniczne właściwości.
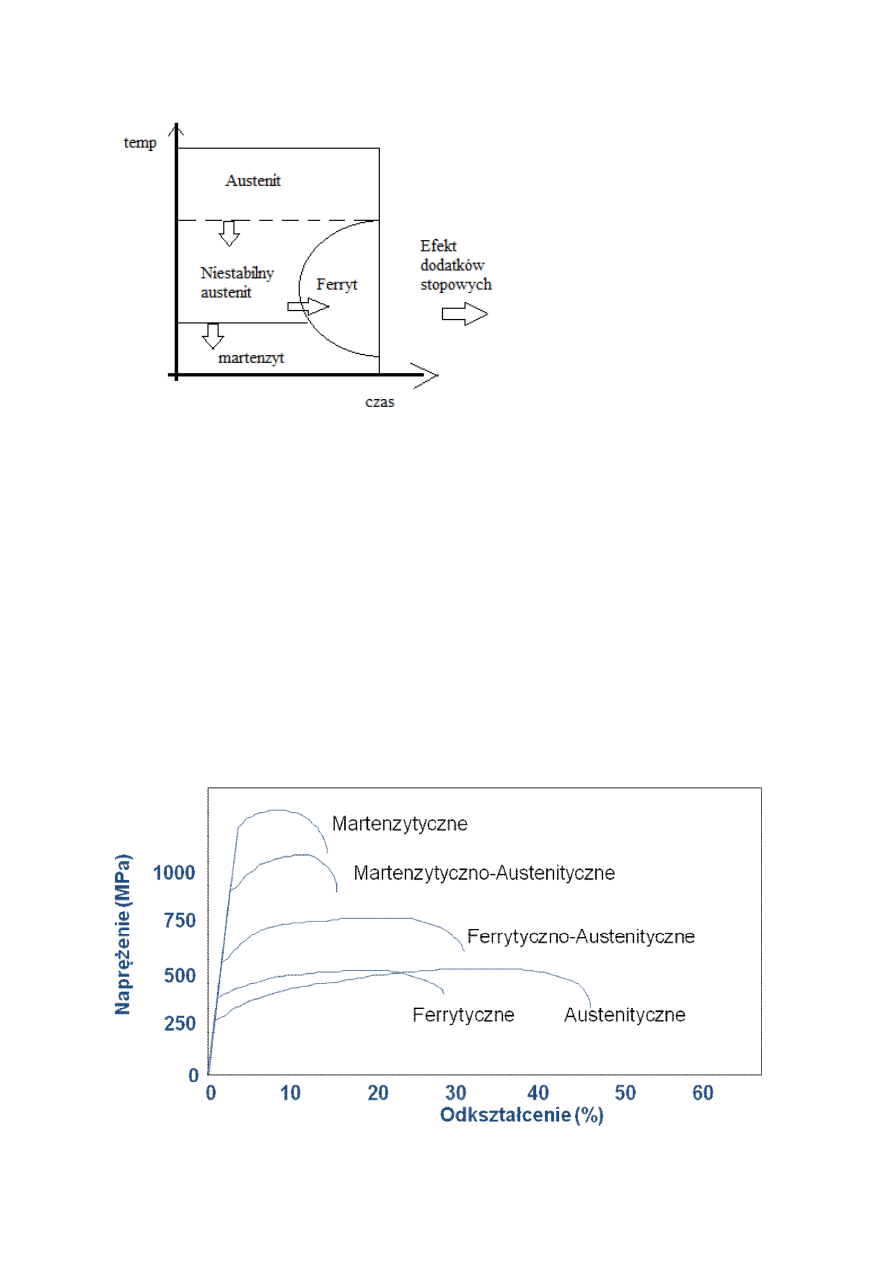
Stale wysokostopowe:
Wykres przedstawiający odpornośc na naprężenia i właściwości plastyczne:

WTRĄCENIA:
-stale wysokostopowe nie są odporne na wysokie temperatury:
a)Węgliki i azotki (550°C - 800°C). szybkie chlodzenie obniża wartośc
-Dyfuzja do wszystkich faz. azotków i węglików
-Obniżają odporność korozyjną i udarność.
b)Wtrącenia międzymetaliczne (700°C - 900°C).
-Ferryt i austenit (>17% Cr & Mo). szybko schłodzić
-Obniżają odporność korozyjną i udarność.
c)475°C Kruchość (350°C - 550°C). należy unikać tych temperatur
-ferryt i martenzyt (>15% Cr).
-Obniża udarność.
-Rzadko występuje.
Stale ferrytyczne [Typowy skład: 15-30%Cr, < 0.1%C, < 1%Mo]
-Dobra odporność korozyjna (również w środowiskach zawierających jony chlorkowe)
-Wytrzymałość na naprężenia słaba do średniej.
-Średnia udarność
-Średnia wytrzymałość
-Średnia formowalność.
-Słaba do średniej spawalność.
-Średni koszt
Zastosowanie stali ferrytycznych:
•
Rury, wymienniki ciepła, zbiorniki.
•
Przemysł spożywczy, chemiczny, papierniczy.
•
Środowiska zaw. jony chlorkowe
•
Wysokie temperatury, zw. siarki
Stale martenzytyczne: [Typowy skład: 12-17%Cr, 0.1-1%C]
-Wysoka wytrzymałość.
-Średnia odporność korozyjna.
-Średnia odporność na utlenianie
-Średnia udarność
-Średnia wytrzymałość
-Średnia formowalność.
-Słaba do średniej spawalność
Zwiększając zawartość węgla rośnie wytrzymałość, ale spada udarność,
formowalność, spawalność

Zastosowanie stali martenzytycznych:
-0.1%C
•
Przemysł chemiczny, turbiny, sprężarki
-0.3%C
•
Skrzynie biegów, przekładnie.
-0.6%C
•
żyletki .
-1%C
•
Instrumenty medyczne, konstrukcje pracujące w wysokich temperaturach
Stale martenzytyczno-austenityczne posiadają podobne zastosowania (większa udarność)
Stale austenityczne [Typowy skład: 18%Cr, >8%Ni, <0.1%C]:
-Znakomita odporność korozyjna (Oprócz środowisk zawierających jony chlorkowe)
-Dobra odporność na utlenianie.
-Wysoka udarność.
-Wytrzymałość na naprężenia słaba do średniej.
-Dobra formowalność.
-Dobra spawalność.
-Wysoki koszt.
Mała zawartość węgla lub dodatek tytanu przeciwdziała uczuleniu
Molibden poprawia odporność korozyjną, jednak wymaga stosowania większej ilość niklu do
stabilizacji austenitu
Zastosowanie stali austenitycznych:
•
Szeroki zakres zastosowania.
–
Rury, wymienniki ciepła, zbiorniki – kontakt z żywnością, przemysł chemiczny,
farmaceutyczny, przemysł papierniczy, naftowy.
•
Większa zawartość stopowych dla bardziej agresywnych środowisk.
Dobra odporność na pełzanie i utlenianie w wysokich temperaturach
Nie ma właściwości magnetycznych
Stale ferrytyczno-austenityczne (Duplex)[
Typowy skład: 22%Cr, 5%Ni, 0.03%C, 0.08%N]
-Znakomita odporność korozyjna (W środowiskach zawierających chlorki)
-Wysoka udarność
-Wytrzymałość średnia do wysokiej.
-Dobra formowalność .
-Dobra spawalność
-Wysoki koszt

Wytrzymałość około 2 x lepsza niż stale austenityczne przy porównywalnej odporności
Zastosowanie stali typu Duplex:
•
Zamiennik stali austenitycznych – praca w większych obciążeniach.
–
Wysoka wytrzymałość obniża wagę i koszt
•
Rury, zbiorniki, pompy w środowiskach chlorków.
–
Przemysł naftowy, papierniczy,
•
Konstrukcje wymagającej dużej odporności na korozję zmęczeniową
–
Elementy maszyny papierniczej
–
Pompy wody morskiej – platformy wiertnicze
Stopy żelaza z węglem:
-stale węglowe – wszystkie stopy żelaza z węglem (od 0,02-2,06% C)
-żelazo techniczne - <0,02% zawartości węgla
-żeliwo - >2,06% zawartości węgla
Podsumowanie:
-najniższa wytrzymałość i najwyższa plastyczność w temp pokojowej ma stal o strukturze ferrytycznej
-w miarę wzrostu zawartości węgla a więc również wzrostu zawartości perlitu w strukturze, rośnie
wytrzymałośc i twardośc stali, przy jednoczesnym obniżaniu się plastyczności
-maksymalną wytrzymałość w stanie wyżarzonym ma stal
Eutektoidalna (0,8% C)
-dalszy wzrost zawartości węgla powoduje podwyższanie twardości, gdyż w strukturze pojawia się
cement wtórny, równocześnie jednak maleje efektywna wytrzymałość stali, ponieważ staje się ona
mało plastyczna.
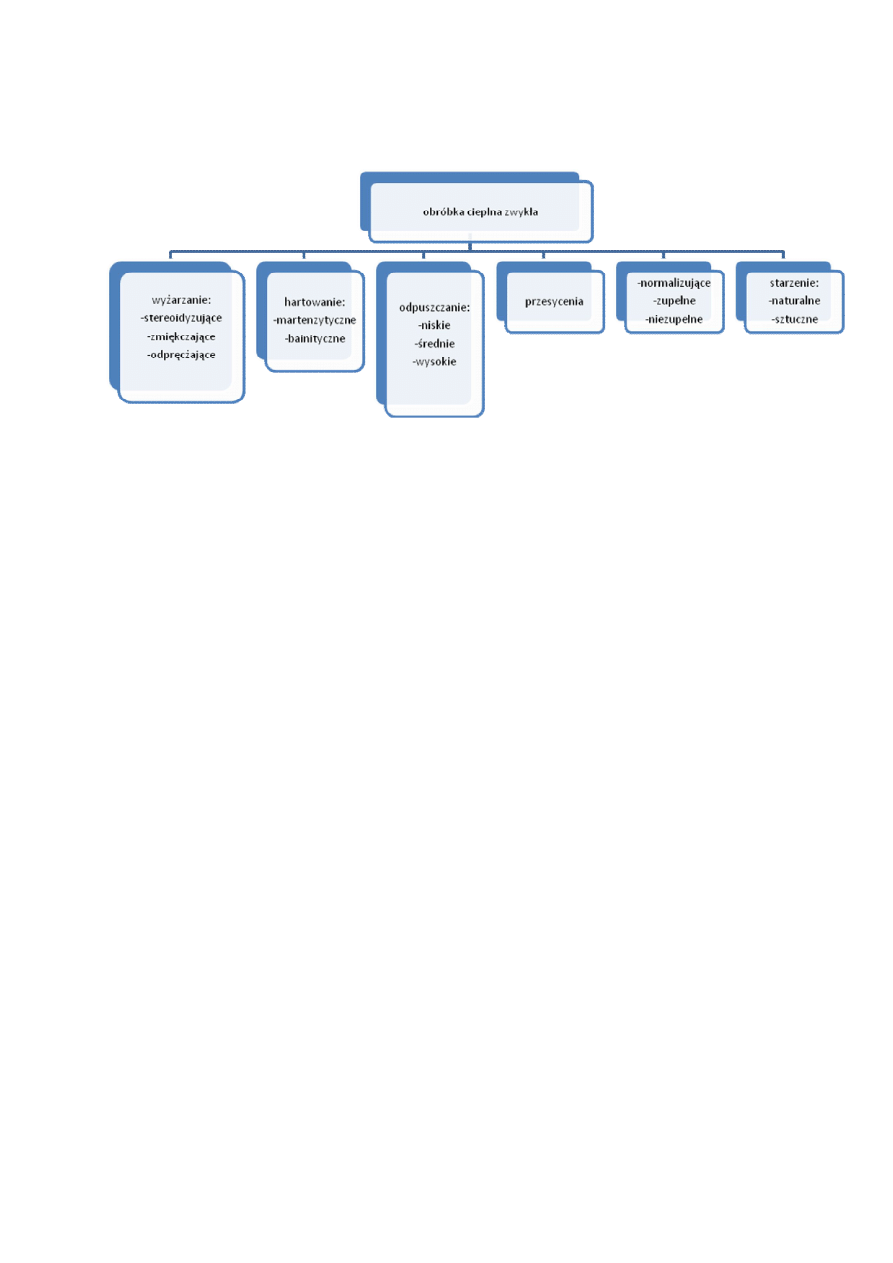
Obróbka cieplna- chemiczna- polega na nasyceniu borem pow. Warstwy przedmiotów. Skutek-
zwiększenie odporności na działanie kwasów (w tym solnego), nadanie właściwości antykorozyjnych,
twardości.
Metody borowania
W ośrodkach stałych (w tym w proszkach i pastach)
W ośrodkach ciekłych (z pododmianą borowania)
Stale niestopowe- konstrukcyjne
Spawanie
Im większa zawartość C, tym większa jest granica plastyczności i zdolność stali do
przenoszenia obciążeń
Np. 0,20%- części rowerowe
0,2-0,35%- konstrukcje mostów, budynków
Stale niestopowe- narzędziowe
Do wyrobu narzędzi, zużycie w temperaturze pokojowej do 250°C
Twardość, odporność na ścieranie
Większa zawartość niż w stalach niestopowych konstrukcyjnych
STALE STOPOWE
Konstrukcyjne
Narzędziowe
O szczególnych właściwościach
Stale stopowe konstrukcyjne

Niskostopowe (ok 5% przerw? Stopowych)
Poddawanie obróbce cieplnej np. hartowanie
Stale stopowe narzędziowe
Na narzędzie do pracy na gorąco (do 600°C)
Pierwiastki stopowe zapewniają dużą hartowność i twardość
Stale stopowe o szczególnych właściwościach
Stale odporne na korozję (Cr>13%)
1. Stale trudno rdzewiejące (szybkość korozji silnie spowolniona)
2. Stale odporne na korozję
Podział ze względu na skład chemiczny
Wysokochromowe
Chromowo- niklowe
Chromowo- niklowo- manganowe
Wpływ składu chemicznego na strukturę stali
?Wykres Schafflera
ŻELIWA
Def. Odlewnicze stopy żelaza z węglem o zawartości> 2,1% C oraz zawartości Mn, P, Si, S.
zastosowanie: elementy, które otrzymuje się z odlewania form.
Skład chemiczny:
2,1- 3,8% C
0,5- 3,5% Si- do odtleniania
0,2- 1% Mn- do odtleniania
0,05- 0,8% P- zanieczyszczone
0,02- 0,15% S- zanieczyszczone
Cechy:
Niewielki skurcz? Odlewniczy 1-2%
Łatwość wypełniania form
Dobra obrabialność
Żeliwo, dzięki wysokiej zawartości C, posiada wysoką odporność na korozję
Fazy węgla
Występowanie konkretnej fazy węgla zależy od szybkości schładzania (ze stanu ciekłego na stały)

Wolne schładzanie- sprzyja wydzielaniu się grafitu
Wpływ dodatków stopowych:
1. Si powoduje skłonność do wydzielenia się grafitu
2. Mn o zaw powyżej 0,8% sprzyja powstawaniu zabarwień? (Fe
3
C)
3. P zwiększa zarówno zawartość jak i wymiary wydzieleń? Grafitu
4. S utrudnia grafiztyzację
Podział:
Żeliwo białe
1. Cały węgiel związany Fe
3
C (cementyt)
2. Żelazo twarde, kruche, słabo obrabiane
Żeliwo szare
1. Węgiel w postaci grafitu
2. Grafit płatkowy, sferoidalny, kłaczkowe
Żeliwo sferoidalne
1. Ciekłe żeliwo
2. Znacznie większa wytrzymałość od innych żeliw ( od Rr= 900mPa)
Żeliwo ciągliwe
1. Z żeliwa białego przez obróbkę cieplną
2. Zwiększona wytrzymałość i odkształcalność
Żeliwo szare
Dobra wytrzymałość na ściskanie
Dobra zdolność tłumienia drgań
Bardzo dobra skrawalność
Odporność na ścieranie
Tani materiał
Łatwość badawcza kształtów
Żeliwo białe
Bardzo twarde i kruche (ze względu na zawartość cementytu
Słabo obrabialne
Po długotrwałym wyważaniu- żeliwo ciągliwe
Żeliwo zmodyfikowane
Dodaje się do 15% modyfikantów. Najczęściej: żelazokrzem, stop żelazokrzemu z wapniem,
magnezem itp.
Aby struktura była bardziej drobnoziarnista- lepsze właściwości odlewnicze
Żeliwo stopowe- z krzemem, niklem, chromem, molibdenem, aluminium
Typy:
Odporne na korozję

Kwasoodporne
Żaroodporne
1. Sillal- wysoka kruchość, najbardziej popularny, jeden z tańszych od odlewów?
2. Nicrosilal- bardziej wytrzymały
3. Niresist- odporność na korozję
STOPY METALI NIEZALEŻNYCH (kolorowych)
Wspólne metody badawcze i techniki obróbki dla metali żelaznych
Cecha metali niezależnych- bardzo duża ilość i zróżnicowanie właściwości (bo duże
zróżnicowanie chemiczne)
Do metali kolorowych zalicza się m. in. Cu, Al, Su, Pb
Miedź
Metal miękki (duża plastyczność), łatwo poddaje się obróbce
Stop miedzi z cyną- brąz (większa twardość od miedzi)
Charakterystyczne czerwonawe zabarwienie
Bardzo dobry przewodnik elektryczności (lepsze tylko srebro)
Wysoka przewodność cieplna
Duża odporność na korozję (obecność patyny)
Niskie własności wytrzymałościowe
Stopy miedzi:
Mosiądze (stopy miedzi z cynkiem do 45%)
Mosiądze wieloskładnikowe (oprócz cynku inne dodatki), (1-4%) np. aluminium- poprawa
odporności na korozje atmosferyczne, wody morskiej.
Inne: mangan, krzem, żelazo
Struktura mosiądzów uzależniona głównie od zawartości cynku
Do 38% Zn- roztwór stały (duża plastyczność i wytrzymałość)
Powyżej 38% Zn- dwufazowa struktura (stop kruchy, niska wytrzymałość)
Podział mosiądzów
Odlewanie (zwykłe dwufazowe- do obróbki na gorąco)
Do obróbki plastycznej (zwykle jednofazowe- do obróbki na zimo)
Przykłady mosiądzów do obróbki plastycznej:
Np. mosiądz dwuskładnikowy (CuZn
10
), mosiądz ołowiowy (CuZn
36
P
3
), mosiądz wieloskładnikowy
Brązy- stopy na bazie miedzi (podział ze względu na dodatek stopowy)
Aluminiowe

Cynkowe
Krzemowe
Odlewnicze bądź do obróbki plastycznej
Mosiądze wysokoniklowe- argentan (5% miedzi, 7%cynku, 8%niklu)
Wyglądem, barwą, przypominają srebro (srebro ma jednak większą gęstość)
Są to stopy miedzi z niklem i cynkiem
Przemyśl maszynowy, chemiczny, etc.
Stopy miedzi- też stopy monetarne
Czysta Cu- czerwona
Cu+Zn- żółta
Cu+Ni- srebrzysta
Zastosowanie metali kolorowych
Instalacje elektryczne, telekomunikacyjne, wody ciepłej i zimnej, grzewcze.
Fosforobrązy- wytwarzane przez dodanie do 0,5%P do brązu o zawartości 85-90% Cu
Zawartość p<0,3%- stop sprężysty i niemagnetyczny
Zawartość p>0,3%- znacznie twardszy
Spiż- odmiana brązu zawierająca cynk. Zawiera 88% miedzi, 8-10% cyny oraz 2-4% cynku. Np. do
produkcji ???
Spiż niklowy zawiera do 5% niklu.
Alunele- stopy aluminium z krzemem
Stopy Ni z Cr (chromem)
Nichromy- żarowytrzymałe 10-20% Cr, 0-10% Fe, 2-4% Mn
Nimoniki- turbiny
Cynk- stopy cynku np. z aluminium o zawartości 3,5- 30% Al.
Układ Zu-Al, Cu-Zu
Stosowane w postaci odlewów i obrabiane plastycznie
Stopy Ni z Cu:
Monele- z miedzą 20-40%, żelazem i manganem Rm do 400 Pa, antykorozyjne w temp do
500°C; stosowane głównie jako stopy odporne na korozję można poddawać je obróbce na
zimno i gorąco a także spawać. Np. łopatki turbin parowych, druty oporowe, wyroby
galanteryjne

Nowe srebro- 20-30% Ni, 45-60% Cu, 20-35% Zn. Np. wyroby galanteryjne, sztućce (algentan,
dipole).
Brązy ołowiowe
-dla łożysk, które muszą wytrzymać duże prędkości obrotowe i ciśnienie
Spiż
-odmiana brązu zawierająca cynk
-stosuje się go w różnych elementach, min. W architekturze, a także do odlewu dzwonów
Brąz aluminiowy
-stop miedzi i aluminium
-nie zawiera cyny
-ma duża wytrzymałość mechaniczna
-odporny na korozję , działanie rozcieńczonych kwasów
Mosiądz
-stop miedzi i cynku
-często dodaje się : Si, Pb, Al
-dawniej do instrumentów pomiarowych, dziś zastąpiony stalą nierdzewną i innymi stopami
-zastosowanie : rury cienkościennie
Mosiądz wysokoniklowy (argentan)
-przypomina szlachetny metal do produkcji ?
Glin (aluminiowy)
-mała gęstość 13 x lżejsza od Fe [7,81] – jeden z najcięższych metali
-duża plastyczność

-odporny na korozję ( warstwa pasywna – tlenek glinu)
-dobre właściwości odlewnicze
-duże przewodnictwo cieplne i elektryczne
-można go malować
-boksyt – otrzymuje się z niego aluminium
Stopy aluminium
-1xxx czyste aluminium (czystość min. 99%)
-2xxx stopy aluminium - miedź
-3xxx stopy aluminium – mangan
-4xxx stopy aluminium – krzem
-5xxx stopy aluminium – magnez
-6xxx stop aluminium – magnez – krzem
Duraluminium
-utwardzenie aluminium
-lekki i wytrzymujący stop
-zastosowanie przy produkcji profili budowlanych, samolotów
-stop aluminium i miedzi podgrzewa się do temp 500 stopni Celsjusza i ochładza
Nowoczesne stopy aluminiowo – litowe ( Al-Li)
-w lotnictwie ( teraz już zamieniany na materiały kompozytowe )
-odporność na zmęczenie
-duża wytrzymałość i udarność
Siluminy
-stopy zawsze zawierają krzem

-na odlewy o skomplikowanych kształtach ale niezbyt obciążonych
Zastosowanie aluminium
-przewody elektryczne
-folie spożywcze
-do budowy aparatury chemicznej
Cynk
-metal błękitno – biały
-kruchy
-na powietrzu podlega pasywacji ( podobne do aluminium)
-bardzo reaktywny zarówno w środowisku kwasowym i zawodowym
Cynk dzielimy na:
-rektyfikowany (N)
-elektrolityczny €
-rafinowany (R)
Zastosowanie :
-ochrona anodowa stali ( przeciwkorozyjna )
-największa wytrzymałość : ZnAl10Cu
Znale – stopy cynku i aluminium
Tytan
-mała gęstość : 4507kg/m3
-dobra wytrzymałość : plastyczność

-traci niewiele wytrzymałości wraz ze wzrostem temp.
-odporny na korozję atmosferyczna, w wodzie morskiej i kwasach organicznych
-tytan jako dodatek do stali
-używany min. Do implanty chirurgiczne ( jest dobrze tolerowany przez organizm)
Nikiel
-metal srebrzysto-biały, połyskliwy
-trudno korodujący, odporny na ścieranie
-gęstość = 8908kg/m3, temp topnienia 1455 stopni Celsjusza
-zastosowanie – do tworzenia połyskujących powłok galwanicznych
-stopy niklu, zastosowanie do wwyrobu monet
Stopy niklu i miedzi
-20%-40% Cu
-wysokie właściwości wytrzymałościowe i antykorozyjne
-zastosowanie: druty oporowe, łopatki turbin parowych, elementy guzików
Nowe srebra
-stopy Cu i Zn
-zastosowanie w wyrobach galanteryjnych
Nichromy ( stopy Ni z Cr)
-żarowytrzymałe
-elementy grzewcze prętów
Nimoniki
-wieloskładnikowe stopy niklu

-żarowytrzymałe
-do łopatek turbin gazowych
Alumel
-stop 95% niklu, 2% manganu, 2% aluminium, 1% krzemu,
-stosowany do przewodów kompensacyjnych do termopar
Kobalt
-ma właściwości ferromagnetyczne
-metal lśniący, srebrzysty
-stopy niklu i kobaltu – nie tracą wytrzymałości w wysokiej temperaturze (tzw. Nadstopy)
-zastosowanie : w silnikach odrzutowych, łopatki i wirniki turbin
Metale Szlachetne
-złoto
-srebro
-platyna oraz platynowe : ruten, rod,pallad, iryd
Srebro, złoto, platyna nie utleniają się
Rozpuszczają się jedyniem w wodzie królewskiej – mieszanina kwasu azotowego i solnego.
Złoto – Au
-19 300 kg/m3 - gęstość bardzo duża
-bardzo dobry przewodnik ciepła i elektryczności ( największa przewodność )
-w biżuterii – stopy główne z miedzią (wieksza twardość)
-Ilość karatów (k) – oznacza wagową ilość części złota na 24 częsci stopu
Srebro – Ag

-występuję najwięcej w postaci minerałów np. argentyt lub tez jako domieszka innych nadmetali np.
ołowiu, cynku, miedzi. Zastosowanie : flety
-bardzo dobra kowalność i plastyczność
-10,49 g/cm3 = 10490 kg/m3 – gęstość
-związki srebra, najczęściej nie rozpuszczalne w wodzie
-srebro metal przejściowy o dobrej przewodności cieplnej i elektrycznej
Platyna – Pt
-gęstość = 21 090 kg/m3, temperatura topnienia 1768 stopni Celsjusza
-bardzo ciężki, srebrzysty metal
-do wyrobu sprzętu laboratoryjnego, w medycynie, także do wyrobu biżuterii
- nie utlenia się w powietrzu
-odporna na działanie kwasów
Ołów – Pb
- gęstość = 11 340 kg/m3
-odtrutki – witaminy z grupy B – B1, B2 etc.
-ołownica – choroba
Ołów metaliczny i wszystkie jego związki są silnie trujące i wywołują zmiany w układzie nerwowym i
krwionośnym
-utlenia się w powietrzu
WYKRES!~
Materiały ceramiczne – obróbka polega na przemianach termicznych :
-materiały tlenkowe ( ceramika tradycyjna , ceramika wielko tonażowa) główne składniki : tlenki
-materiały inżynierskie ( ceramika nowoczesna) np. azotki, borki, węgliki, wapno, magnezan glinu (
połączenia jonowe, jonowoatomowe)

W materiałach ceramicznych istnieją:
-wiązanie jonowe lub jonowoatomowe
Uzyskiwane w odpowiedzi sposób wypalanie glinu tradycyjne
Obecnie wszystkie tworzywa nieorganiczne i niemetaliczne, w których ważnym procesem jest
obróbka cieplna ( prażenie, wypalanie, sprężanie)
Materiały ceramiczne – drobne ziarna wypalane, stopnienie się minerałów – powstanie fazy ciekłej
Ceramika
-ceramika szlachetna
-materiały budowlane
-materiały ogniotrwałe
-materiały wiążące np. cement, gips
-szkło i dewitryfikatory
-materiały ścierne
-emalie ( do zabezpiecznia stali )
-ceramika konstrukcyjna : A
a
O
y
, ZrO
3
, Si
2
N
4
, SiC
-ceramika funkcjonalna, elektroniczna, ciekłotechniczna, magnetyczna, jądrowa
-nanoceramika –ceramika inżynierska
Ceramika:
Ceramika inżynierska :
Ceramika tradycyjna:
Jednoskładnikowa
Szkło
Wieloskładnikowa
Wyroby Garmażeryjne
Surowce Ilaste: będące składnikami glinu:
-podstawowe znaczenie dla przemysłu ceramicznego
Ze względu na zastosowanie można wyróżnić:
-gliny wypalające się na biało stosowane do produkcji elementów fugowanych i porcelanowych.

-gliny ogniotrwałe o wysokiej temperaturze topnienia powyżej 1580 stopni C ,które po wypaleniu są
przeważnie żółte.
-gliny wypalające się na czerwono lub brunatno.
-gliny o małej plastyczności i dużej zawartości związków żelaza-wyroby ceglarskie.
Skalenie-glinokrzemiany
6.1
Surowce ceramiką są zazwyczaj polimineralne i nie można określić , który z nich decyduje o
właściwościach.
Kaolinit-surowiec ogniotrwały podnosi temperatura spiekania , illit potas.
Smektyt- odpowiedzialne za plastyczność, zwiększają wrażliwość na suszenie,obniżają wytrzymałość,
snektyty należą do grupy materiałów ilastych.
Przybliżony skład ceramiki i krzemianów:
(trójkąt)
Sio2
Cement
Glina
Cao
Al2O3
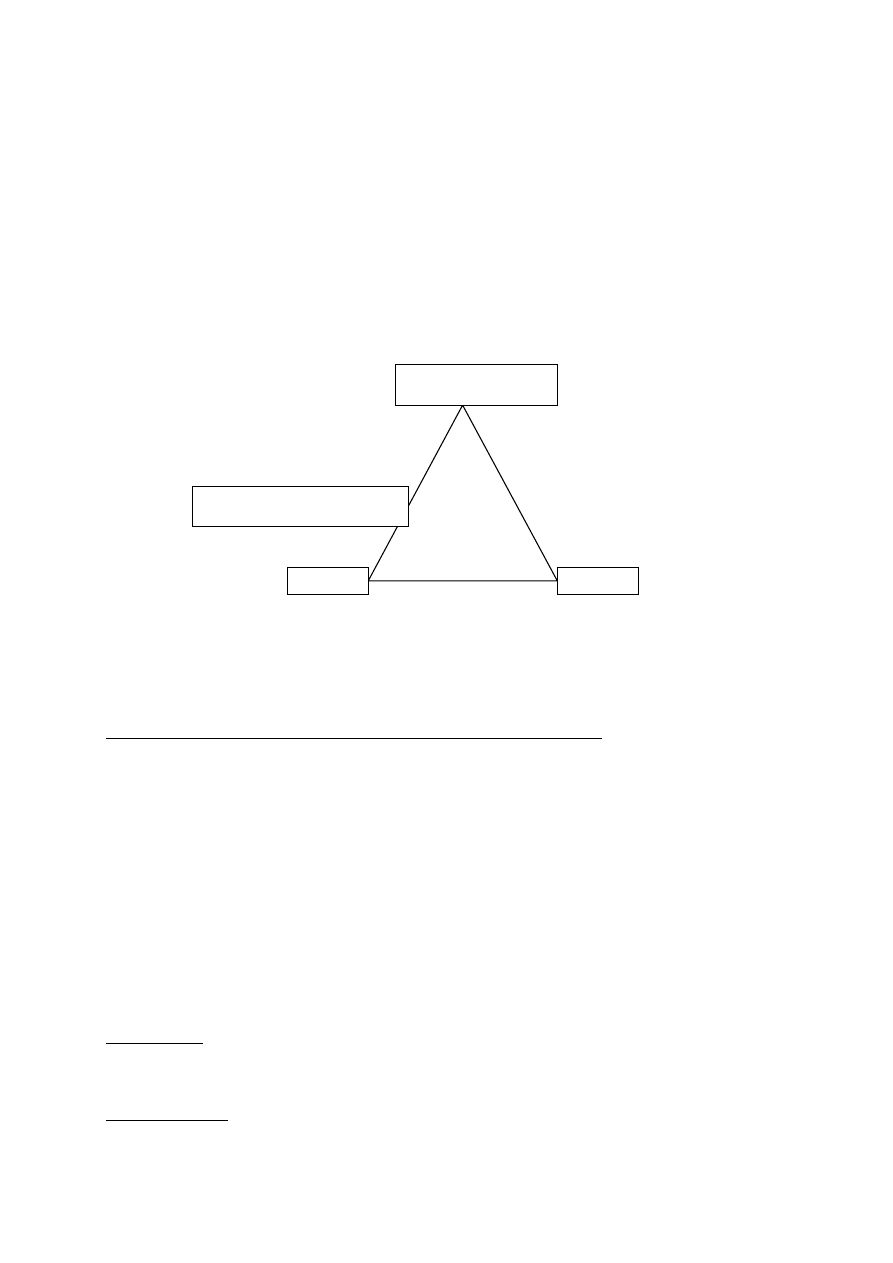
Minerały w wyrobach z gliny
Reakcje wysoko i nisko temperaturowe zachodzące w minerałach ilastych:
*dehydratacja
*dehydroksylcja
*utlenianie
*witryfikacja-zeszklenie
*synteza nowych faz
Dehydratacja: usuwanie wody z powierzchni międzypakietowej (100-400 stopni)
Dehydroksylacja: wydzielenie wody w postaci grupy OH- (400-100 stopni )
Krzemionka Si02
Porcelana plastyczne
Skaleń
Glina

Utlenianie: z wydzieleniem CO2,związki żelaza Fe2+ do Fe 3+ (600-900 stopni)
Witryfikacja: zeszklenie pojawia się faza ciekła która przyspiesza reakcję pomiędzy składnikami (>900
stopni)
Proces produkcji cementu:
Dokładne wymieszanie, uformowanie wysuszenie lub wypalenie składników-kontroluje się ilość
tlenu.Temperatura 900-2000 stopni –charakterystyczne dla ceramiki inżynierskiej.
Ceramika porowata:
-produkty z gliny ;
a)porcelana,fajans,panelit
b)kamionka,terakota,klinkier
c)dachówki cegła
*Materiały ogniotrwałe i wykładanie pieców :kwasowe,zasadowe,obojętne
*cement
*ceramika porowata charakteryzuje się 5-15% udziałem porów, po wypaleniu w wysokiej
temperaturze, stosowanym w celu odprowadzenia wody. W skład ceramiki porowatej zaliczany jest
również cement oraz beton, wytwarzane w wyniku wypalenia, przemielenia uzyskanego w ten
sposób klinkieru w drobny proszek i następnego tężenia i twardnienia, po zmieszaniu z wodą i
drobnoziarnistym piaskiem – w przypadku zaprawy cementowej, lub z wodą, piaskiem i kruszywem –
w przypadku betonu.
Porcelana:
1)twarda-dekoracyjna,z kaolitu,kwarcu,skalenia
2)miękka-z mulitu,kwarcu,skalenia
3)nieszkliwiona-850-1000 stopni
4)szkliwiona-1280-1320 stopni
5)twarda-1350-1450 stopni
Porcelana-zastosowanie:
-stołowa
-chemiczna
-elektrotechniczna:
a)izolatory niskiego napięcia
b) izolatory niskiego napięcia-odatek związków
-dentystyczna
Fajans
-twardy
-40% kwarcu +inne składniki(np.kaolin,margiel,skaleń,kreda,dolomit)
-porowatość-z niewielkimi ilościami substancji szklistych
-wytrzymałość na zginanie 23 Mpa
-wypalony dwukrotnie 1250 stopni
Porcelit
-mniejsza porowatość,większa wytrzymałość
-substancja ilasta :kwarc, skaleń
Fajans,porcelit-umywalki,wanny
Kamionka:
-z gliny krzemionkowej (SiO2,Al2O3,Fe2O3)
-wytrzymałość na ściskanie 800 Mpa,na zginanie ok.90 Mpa
-do rur kanalizacyjnych i aparaturze chemicznej i laboratoryjnej
Terakota:
-z gliny ogniotrwałej,skalenia,piasku,tlenków metalu
-wypalana w temperaturze 1200-1300 stopni
-wytrzymałość na ścieranie
Klinkier:
-z glin żelazistych i wapienno żelazistych.
-duża wytrzymałość i udarność,mała porowatość i nasiąkliwość
-wypalany w temperaturze 1300 stopni
Ceramika inżynierska:
*Proces spiekania-powierzchnia ceramiczna ro<ro surowców wyjściowych
Jest usuwana woda na skutek wypalania .Czasami pokrywa się szkliwem by uzyskać materiał szczelny
.
Materiały super twarde:
-diament 7000HV
-azotek baru 4700HV
-węglik krzemu 2500-3700HV
-węglik baru
-tlenek glinu 2080 HV
Funkcje tworzyw ceramicznych:
1)termiczne
-izolacje termiczne,promieniowanie
2)mechaniczne

-wirniki
-komory spalania
-łożyska
-dysze palników
3) biologiczne
-sztuczne korzenie zębów
-kości i stawa
-sztuczne zastawki serca
4)chemiczne
-katalizatory
-nośniki enzymów
-elektrody
-czynniki gazów
5)nuklearne
-paliwa nuklearne
-materiały na osłony i ekrany
6)optyczne
-świetlówki
-lasery
7)magnetyczne
-magnezy
-rdzenie pamięci
8)elektryczne
-kondensatory
-podłoża elektryczne
-ogniwa słoneczne
-elementy czynników temperaturowych

Właściwości materiałów ceramicznych
-brak ciągliwości
-kruche
-silne wiązania jonowe i jonowo-kowalencyjne
-charakterystyczna różnica między ceramiką a innymi materiałami leży w wytrzymałości na
wzrastające naprężenia (ciągliwość)
Ceramika
-twarde i odporne na ścieranie
-odkształcenia plastyczne i ruchy dyslokacji są niemożliwe
-kowalencyjny :jonowy charakter wiązań
-kruche-kruche pękanie
-wysoka temperatura topnienia (umożliwia wysoka temperature pracy)
-mała przewodność cieplna i elektryczna
-dobra stabilność chemiczna i cieplna
-bardzo dobra wytrzymałość na rozciąganie , małą na ściskanie
*Kruche pękanie-rozpoczyna się na wadach materiałów(pustki,pory,rysy,defekty sieci)
Wytrzymałość ceramiki może się zmniejszać z upływem czasu ( bez działania naprężeń
cyklicznych),(zmęczenie statyczne-silnie zależne od środowiska)
Kruchość-defekt struktury powoduje...zmiany,a jednak w korozji naprężeniowej tworzącej ciągłe
pękniecia do zniszczenia wyrobu w trakcie exploatacji .
Kruchość-kruche pękanie powodują obciążenia mechanicze,skok termiczny (ceramika tradycyjna)
-Właściwości mechaniczne są możliwe do oceny metodami statystycznymi
Ceramika
Lita
Porowata

Ceramika(uporządkowanie struktury)
Jednofazowa
wielofazowa
Ceramika
Drobnoziarnista
Gruboziarnista
Dla zastosowań Inżynierskich:dominuje ceramika lita,drobnoziarnista, wielofazowa.
W kompozytach stosowana jako faza ciągła i zbrojenia(produkcja włókien do wzmocnień
kompozytów)
Ceramika inżynierska
-dla elektrotechniki na urządzenia skrawające
-stosowana w przemyśle jądrowym dla celów medycznych
Ceramika inżynierska wg.funkcji:
*funkcja mechaniczne(elementy maszyn o dużej trwałości),wytrzymałośc na ścieranie
Przykłady:tlenek glinu, azotek tytanu, węglik tytanu ,borek tytanu
*funkcje cieplne:-powłoki pieców ,elektrody spawalne
Przykłady:weglik tytanu,krzemu tlenki ;
Materiały do zastosowania w opływie na lampy próżniowe ,lasery: tlenek glinu , magnezu i krzemu ,
siarczek cynku , kadmu .
Funkcje nuklearne:-odporność na promieniowanie ,termoodporność(paliwo jądrowe, osłony przed
promieniowaniem, tlenek uranu, węglik uranu, krzemu, tlenek glinu.

Funkcje inżynierskie:
Ceramiki inżynierskie -> wykorzystane na przewodniki, oscylatory, pamięć komputerowa. Ze
względu na izolacyjność, przewodność, właściwości magnetyczne, elektryczne.
Przykłady: ferryty, tlenek cynku, krzemu, beryl, węglik krzemu.
Funkcje chemiczne lub biologiczne:
absorpcyjność różnych składników (gazowych),
odporne chemicznie,
katalizatory (substancje, które są składnikami przyspieszającymi procesy chemiczne)
np.: filtry, endoprotezy.
Przykłady: materiały pochodzenia naturalnego: tlenek glinu, magnezu, cynku.
Struktura zróżnicowana.
Piramida twardości.
CERAMIKA WSPÓŁCZESNA
Ceramika – nieorganiczne i niemetaliczne materiały otrzymywane w wyniku procesu
termicznego.
Materiały ceramiczne:
wyroby z glinu,
zaawansowane materiały ceramiczne,
materiały ogniotrwałe,
materiały ścierne.
Krzemiany: glinokrzemiany – ok. 800 minerałów krzemianowych (kamienie szlachetne,,
ozdobne).
Podstawowymi elementami strukturalnymi są równo ułożone obok siebie 4 aniony tlenu.
Szkło – ceramika niekrystaliczna.
Zmiany w strukturze w trakcie procesu cieplnego:
proszek -> formowanie -> spiekanie
ceramika szlachetna:
materiały ogniotrwałe,
m. bezołowiowe,
m. wiążące,
szkło i dewitryfikaty,
m. ścierne,
ceramika konstrukcyjna: Al2O3, ZrO2, Si3N4, SiC, AlN
nowa ceramika,

ceramika funkcjonalna:
elektroniczna
elektrotechniczna
jądrowa
bioceramika – kosmiczna.
Rodzaje szkła:
sodowo-wapienne
potasowe
kwarcowe
ołowiowe
bezpieczne
wodne
artystyczne
lodowe.
Sodowo-wapienne – niska temp. topnienia. Składa się głównie z sodu, wapnia, krzemu.
Wyroby codziennego użytku: szklanki, naczynia.
Potasowe – tlenek potasu, tlenek wapnia, krzemu. Trudno topliwe. Do użytku w laboratoriach
chemicznych.
Kwarcowe – głównie tlenek krzemu. Trudno topliwe. Odporne na zmiany temp. Dobra
przepuszczalność promieni widzialnych.
Ołowiowe (kryształowe) – tlenek ołowiu, tlenek krzemu, tlenek wapnia, tlenek glinu. Wysoki
współczynnik załamania światła, największa gęstość.
Szkło artystyczne – kształtuje się na gorąco w masie płynnej.
Szkło bezpieczne – w wyniku hartowania, po rozbiciu rozpada się na małe kawałki o
zaokrąglonych, nie tnących krawędziach.
Szkła budowlane:
okienne
zbrojone
refleksyjne
elektroprzewodzące
nieprzezroczyste
ceramiczne
zespolone.
Właściwości szkła:
dobrze przepuszcza promienie widzialne,
substancja bezpostaciowa, nie ma uporządkowanej budowy wewnętrznej,
nie posiada temp. topnienia,
materiał izotropowy,
słaby przewodnik elektryczny.
Właściwości mechaniczne szkła budowlanego:
skala Mohsa -> twardość 5-7,
gęstość 2400-2600 kg/m3,
wytrzymałość na zginanie 30-50 MPa,
wytrzymałość na ściskanie 800-1000 MPa,
moduł Younga.
Światłowody -> dzięki wewnętrznemu odbiciu wykonane ze szkła kwarcowego, medium
transmitujące stanowi rdzeń.
Dodatek do betonów – materiał przeświecający, 96% betonu, 4% światłowodów, gęstość
2100-2300.
Z czego robić szkło: surowce szkłotwórcze (wykazują zdolność tworzenia stopu o różnych
właściwościach), topniki, modyfikatory, surowce pomocnicze.
Szkło – ceramika niekrystaliczna. Główny składnik to kwarc (nieorganiczny materiał, który
został schłodzony do stanu stałego, bez krystalizacji).
Dobrze wykształcone kryształy kwarcu:
cytryn,
kryształ górski.
Krzemiany wapniowo-sodowe.
Rola tlenków w tworzeniu szkieł:
Tworzące szkieł
Modyfikujące
Stabilizujące
Sio2
Na2O
Al2O3
Bi2O3
K2O
ZrO2
GeO2
CaO
TiO2
R2O5
MgO
BeO
V2O5
BaO
PbO
ZnO
Modyfikatory – związki modyfikujące właściwości szkła.
Inżynieria materiałowa szkła – czynniki decydujące o właściwościach szkła:
skład
struktura

powierzchnia
modyfikowanie warstwy nanoszonej na powierzchnię.
Powierzchnia jest najsłabszym elementem szkła. Na niej powstają mikropęknięcia, które
przemieszczają się w głąb.
Szkło fotochromatyczne zawiera AgCl lub AgI, równomiernie rozłożone na objętości szkła.
Pod wpływem światła zachodzi redukcja Ag. Atomy srebra absorbując światło zmieniają
szkło. Proces ten jest szybki. Gdy oświetlenie znika srebro jest utleniane (zamieniane tylko na
powierzchni).
Wady -> kruchość – mikropęknięcia na powierzchni. Jakość powierzchni decyduje o
wytrzymałości na wewnętrzne ciśnienie. Wewnętrzna powierzchnia decyduje o
wytrzymałości na uderzenie.
Wzmocnienie szkła:
poprawia jakość powierzchni,
chemiczna modyfikacja powierzchni,
nanoszenie odpowiednich warstw, laminowanie.
Hartowanie – wewnętrzne naprężenie szkła na zewnątrz powierzchni ściśnięta, wewnętrzna
rozciąga się. Szkło grzeje się. Ochładza się w powietrzu lub oleju. Powierzchnia ochładza się
szybciej niż wnętrze.
Chemiczne hartowanie – wymiana Janów Na
+
na K
+
na powierzchni. Większe jony K
+
rozpychają zewnętrzną powierzchnię. Szkło umieszcza się w stopionej soli zawierającej K
+
.
Dyfuzja prowadzi wymianę jonów sodowych na potasowe. 2-4 krotnie zwiększa się
wytrzymałość szkła -> wzmocnienie.
Laminowanie – wzmocnienie warstwy polimeru pomiędzy warstwami szkła. Szkło
kuloodporne -> wiele warstw połączonych ze sobą w wysokiej temp.
Technika „zol-żel” – synteza szkieł poprzez reakcje żelu (prowadzi do zmiany zolu w żel) w
temp. zbliżonej do temp. pokojowej.
układ PbO2/SiO2 – światłowody
układ ZnO/SiO2 – dyski optyczne
układ TiO2/SiO2 – lasery, koncentratory światła słonecznego.
TWORZYWA SZTUCZNE – materiały, których podstawowym składnikiem są polimery.
Polimer – związek wielocząsteczkowy organiczny, tworzony przez wiele makrocząsteczek
(łańcuchów polimerowych), otrzymywany na drodze polimeryzacji lub przez modyfikację
naturalnych składników mineralnych.

Polireakcje:
a) polimeryzacja,
b) polimeryzacja kondensacyjna – łączą się różne monomery -> powstają produkty
uboczne; polimery o małych masach cząsteczkowych.
c) polimeryzacja addycyjna – w wyniku przeskoku wodoru z jednej cząsteczki do
drugiej.
Struktura:
liniowa (polimery w czasie polimeryzacji),
słabo usieciowiona (polimery kondensacyjne i addytywne),
silnie usieciowiona (guma).
Polimery tworzą bardzo duże cząsteczki – molekuły.
Ad. a) polimeryzacja – łączenie się jednakowych cząstek niskocząsteczkowych w jedną
wysokocząsteczkową.
nH2C=CH2 -> [H2C-CH2-CH2-CH2]n
monomer polimer
Materiały - ciała stałe:
metale
ceramika
tworzywa polimerowe: termoplasty, duroplasty, elastomery.
Polimery:
wszystkie nierozpuszczalne w wodzie!
Czynniki wpływające na właściwości polimerów:
Masa molowa
Właściwości? Sił działających między cząsteczkami!
Podatność łańcucha na wyginanie (im większa podatność łańcucha tym bardziej jest
elastyczny)
Struktura: stopień krystaliczności (jego wielkość?) -> im większy tym lepiej ; rozgałęzienie,
usieciowanie -> stopień dotwardzenia tworzyw (silne usieciowanie->mniej odkształcene)
Temperatura
Masa molowa polimerów:
Brak info
Siły działające między molekułami:
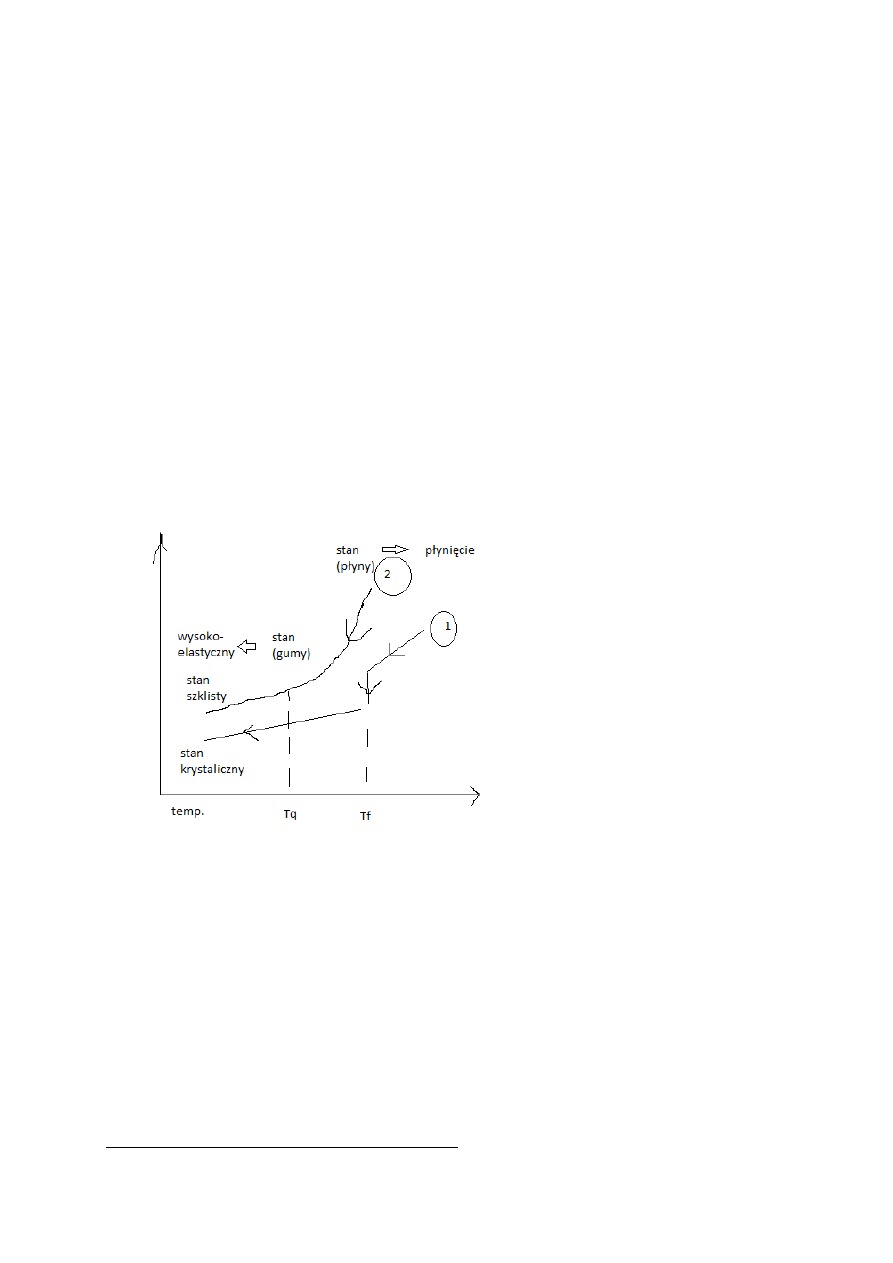
o
Wewnątrz łańcucha: siły kowalencyjne
o
Pomiędzy łancuchami: wodorowe, van der waalsa
Podatnośc łańcucha ?? na wyginanie zależy od:
Wiązań, stopnia usieciowania
Stopnia krystalizacji
Temperatury
Rodzaju i właściwości grup bocznych
Stopień krystalizacji -> struktura polimerów jest najczęściej amorficzna, ale może być też krystaliczna
Temperatura
T
f
- temp. zeszklenia
T
q
- temp. płynięcia
Polimery użytkowane w stanie gumy -> elastomery (charakteryzują się dużymi odkształceniami).
Różne grupy polimerów ze względu na właściwości?:
Elastomery
Polimery usieciowane
Polimery termo.-chemiczno utwardzalne
Cechy tworzyw sztucznych:
o
Łatwość formowania wyrobow w skomplikowanych kształtach
o
Stosunkowo duża odporność chemiczna (nie są uwikłane przez wodę) ->np. farby
antykorozyjne
o
Dobre wł. Mechaniczne i często wł. Elektryczne
o
Mała gęstość -> korzystny stosunek wytrzymałości właściwej (mechanicznej do gęstości)
o
Do wyrobów o estetycznym wyglądzie (łatwość wykonania)
o
Możliwość barwienia i uzyskiwania wyrobów przezroczystych
o
Możliwość stosowania w różnorodnej postaci: tworzywa konstrukcyjne, materiały
powłokowe, spoiwa (właściwości adhezyjne -> przyczepnośc), kleje, kity, włókna syntetyczne
o
Odznaczają się niższą wytrzymałością mechaniczną i mniejsza twardością ( w porównaniu z
metalami)
o
Pod mniejszym obciążeniem mogą się odkształcać (zjawisko pełzania)
o
Niezadowalająca odporność cieplna
Tworzywa sztuczne zwierają zwykłe składniki dodatkowe.
Np. napełniacze (wzmacniają), stabilizatory (daje się je w niewielkiej ilości, zwiększają odporność na
starzenie materiału), barwniki, plastyfikatory (zwiększają odkształcalność tworzyw, przede wszystkim
dla polimerów termoutwardzalnych)
Polimery -> materiał organiczny ulega starzeniu pod wpływem prom. UV i tlenu
W zależności od rodzaju użytego polimeru tworzywa sztuczne dzieli się na:
a) Termoplastyczne – w podwyższonej temp. Obróbka -> gdy przekroczą ten stan – topią się
b) Termoutwardzalne – w podwyższonej temp. Po uformowaniu określonego kształtu, stają się
nietopliwe i nierozpuszczalne
c) Chemoutwardzalne – pod wpływem określonych czynników chemicznych usieciowują się
przestrzennie, przy czym stają się nietopliwe i nie rozpuszczalne
Tworzywa termo- i chemoutwardzalne duroplasty
Tworzywa termoplastyczne termoplasty
Duroplasty: brak info
Termoplasty: w temp. pokojowej znajdują się w stanie zeszklenia.
Polimery termoplastyczne
Akryle np. plexiglas -> okna samolotowe
acrylonitrile butadiene styrene (ABS) np. części samochodowe

fluoropolimery (PTFE) np. teflon
polianiony np. nylon
poliwęglany np. CD, kaski
poliestry np. butelki, filmy do aparatów
polietylen (PE)
Polipropylen PP
Polichlorek winylu PCV
Przykłady tworzyw:
PET poli
tereftalan etylenu -> np. butelki
LDP miękki polietylen – mała gęstość ->np. folia do wszystkich miękkich opakować, torby na
zakupy
HDPE twardy polietylen – duża gęstość ->np. nakrętki do butelek, opakowania do jogurtu
PCV polichlorek winylu: miękki lub twardy -> np. obrusy, i coś??
PP polipropylen -> np. torebki na chipsy
PS polistyren -> np. tacki do pakowania mięsa, kubki do gorących napojów
PC poliwęglan -> np. płyty CD
Syntetyczne metale tworzywa sztuczne przewodzące prąd elektryczny.
Lakiery – roztwory lub zawiesiny środków powłokotwórczych. Podstawową różnicą między lakierami i
farbami jest niewielkie stężenie pigmentów lub całkowity ich brak oraz często mniejsza lepkość w
porównaniu do farby.
Lakiery posiadają nikłą zdolność do tzw. Krycia, lecz posiadają dobre właściwości błonotwórcze.
Lakiery – zastosowanie:
Uzyskanie połyskowej i gładkiej powierzchni z jednoczesnym zachowaniem faktury materiału
Zabezpieczenie powierzchni przed warunkami zewnętrznymi z zachowaniem oryginalnej
barwy powierzchni
Jako ostatnia warstwa malarska (nadają połysk i zabezpieczaja)
Zwilżanie – działanie wodą na powierzchnię materiału
Kąt zwilżania – sernik z brzoskwiniami :D
Pierwsze zabezpieczenie przed korozją działania mające na celu uniknięcia zwilżania metalu
(hydrofobizacja).
Farba
Produkowana na bazie

Kleje:
Dla polimerów mające właściwości adhezyjne
Bez obróbki termicznej i mechanicznej potrafi łączyć różne elementy
Polimery ciekłokrystaliczne
o
Zdolne do wytwarzania faz krystalicznych
o
Zawierają ugrupowanie o kształcie zbliżonym do pręta lub dysku
o
Podwyższona odporność mechaniczna w stosunku do ciekłych kryształów opartych na
związkach wielocząsteczkowych
Zastosowanie wskaźniki temperatur
Tworzywa sztuczne cd.
Zastosowanie w budownictwie- polichlorek winylu (dominuje) z udziałem 47% w łącznej masie
wyrobów stosowany do produkcji rur, kabli, okien i drzwi oraz wykładzin podłogowych.
Inne:
Polietylen (2 odmiany)
Polistylen
Polipropylen
Zalety:
Stosunkowo łatwe przetwórstwo, łatwość formowania przedmiotów o skomplikowanych
kształtach
Trwałość
Odporność na korozję
Gładkość powierzchni
Mała gęstość- lekkie!
Korzystny stosunek wytrzymałości mechanicznej do ciężaru właściwego (tzw. Wytrzymałości
właściwej)
Duża żywotność bez konieczności konserwacji (np. liny podtrzymujące most)
Wady:
Skłonność do przechodzenia w stan kruchości podczas dłuższego oddziaływania zmiennych
temperatur (szczególnie niskich)
Mała stabilność kształtu, wynikająca z małej aktywności
Zastosowanie :
Drzwi i okna
Ocieplane ścian, stropów i elewacji
Pokrycia dachowe
Ogrzewanie i wentylacja
Instalacje elektryczne
Posadzki
Ściany i sufity
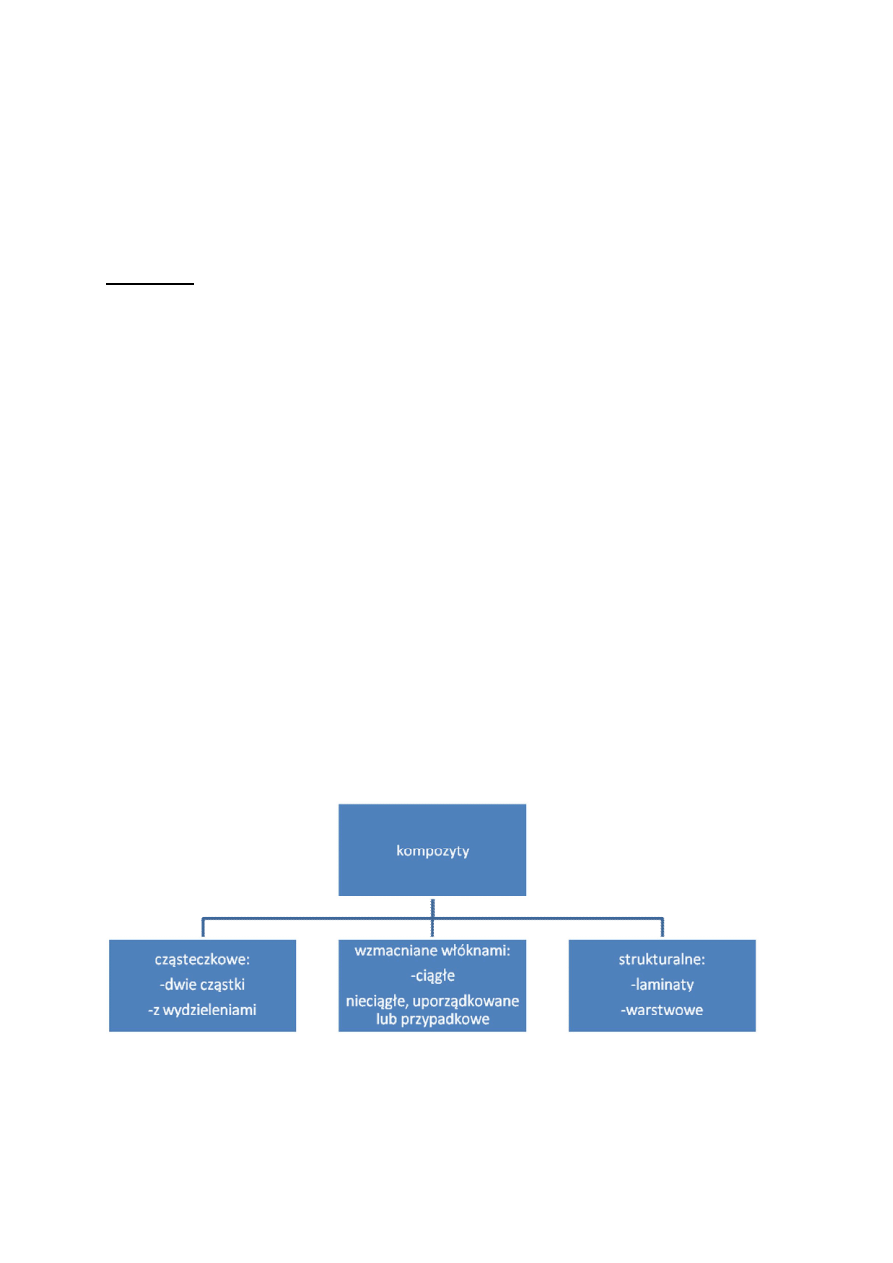
KOMPOZYTY
Kompozyt- materiał złożony, utworzony z co najmniej 2 komponentów, o różnych właściwościach, w
taki sposób, że ma lepsze lub nowe w stosunku do komponentów właściwości.
Jest materiałem zewnętrznie monolitycznym, jednakże z widocznymi grantami między fazami
Istotna cecha- możliwość przewidywania z dość dużą dokładnością wykonania żądanych właściwości
Podstawowy problem przy projektowaniu: ???
Naturalny kompozyt- drewno, tkanka kostna, ścięgno złożone z włókien celulozy w ligninie- faza
ciągła i hemicelulozie.
Tkanka kostna- ścięgno- złożona z apatytu w związkach proteinowych
Podział kompozytów:
Pochodzenie (naturalne, stworzone przez człowieka)
Przeznaczenie (konstrukcyjne, szczególnie wł. Fizyczne, chemiczne)
Rodzaj osnowy
Zbrojenia
Laminaty

Zastosowanie: mała masa a duże właściwości wytrzymałościowe, przemysł wtórny
Mechanizm wzmocnienia
a) Dyspersyjny
Obciążenie przenosi osnowa,
Cząstki przeciwstawiające się ruchowi w matrycy obniżenie skłonności materiału
do pełzania
Dla d=0,01-0,1mikrometry 1-15%
b) Cząstki np. w betonie
Obciążenie przenosi zarówno osnowa jak i inkluzja,
Twarde cząstki ograniczają odkształcenie osnowy
zniszczenie gdy wartość naprężeń przekracza 3x granicę plastyczności
c) włókna
od kilku do 70% objętości
najbardziej efektywne wzmocnienie,
twarde cząstki ograniczają odkształcenia osnowy
podział wiskery (monokryształy) włókna
Wiskery – cienkie monokrzyształy o dużym stosunku długości średnicy z najmocniejszymi materiałami
Wytrzymałość kompozyta rośnie ze wzrostem l/d włókna
Projektowanie kompozytu
Osnowa+ zbrojenie podstawowa koncepcja budowy
Cel: przekazywanie obciążeń zewnętrznych na wytrzymałe włókna
Włókna szklane: ogólnego oraz specjalnego zastosowania (typu E)
Rodzaje włókien specjalnych:
E niska przewodność elektryczna,
S wysoka wytrzymałość,
C wysoka odporność chemiczna
M wysoka sztywność
A wysokozasadowe,
D niska wytrzymałość elektryczna
Do wzmocnienia kompozytów na osnowie polimerowej stosuje się włókna szklane typu E
lepsze włókna elektryczne,
duża wytrzymałość mechaniczna,
umiarkowany koszt produkcji,
Wpływ temperatury na wytrzymałość na rozciąganie włókien szklanych typu E spada silnie powyżej
350 st., wraz ze wzrostem temperatury
Niekorzystna cecha włókien jest ich wrażliwość na działanie wody, wypłukuje ona sole metali
alkaicznych
Największe zastosowanie:
materiały kompozytowe z matryca polimerowa,
matryca: żywica syntezowa 30-70% obj. Spoiwa ochronne włókien,
włókna 30-70%

Klasyfikacja FRB
CFRP z włóknami węglanowymi – najbardziej ( temperatura topnienia 3500 st. W lotnictwie)
GFRP z włóknami szklanymi
AFRP z włóknami aramidowymi
Układ włókien w kompozycie:
-równoległy
- tkanina splot prostopadły i ukośny
Żywice najcześciej używane do produkcji FRP:
-epoksydowa
-poliestrowa
-fenolowa
1982 – zastosowanie włókien węglowych w samolotach Boeing
1967 – zastosowanie włokien węglowych w silnikach odrzutowych marki Rolls Royce
Technologia wytwarzania włokien węglowych
-utlenianie 200-300 stopni Celsjusza
-karbonizacja
-grafityzacja
Wyroby z CFRP:
-Taśmy
-maty
Wyroby z FRC:
-budownictwo – maszty słupy zbiorniki
-elementy nowoczesnych lekkich konstrukcji (samoloty wojskowe, elementy dla lotnictwa
pasażerskiego)
Zastosowanie kompozytów:
-przemysł samochodowy (opony, uszczelki, paski, kable
-przemysł elektryczny (przewody)
-sport: narty i piłki
-przemysł lotniczy
-łodzie i jachty
Airbus A380 – 52% kompozytu
1931r – pierwszy patent na otrzymanie włokien szklanych
1943 – pierwsze poróby zastosowania kompozytów do celów wojskowych
1961 – pierwsze włokna węglowe(2 rodzaje)
Kompozyt – składa się z osnowy i umieszczonego w niej drugiego składnika (zbrojenie) o znacznie
lepszych właściwościach mechanicznych
Osnowa
- zabezpiecza zbrojenie przed mechanicznym uszkodzeniem
- zatrzymuje rozprzestrzenianie się pęknięć
-nadaje wyrobowi kształtu

Przykłady:
-najczęściej polimer (np. poliester)
-metal – żelazo, miedź, glin, stopy metali
-ceramika – tlenek glinu, tlenek krzemu
ZBROJENIE:
-proszkowe
-włókniste (cięte, ciągłe)
Kompozyty wzmacniane cząstkami:
- wzmacniane dużymi czastkami (np. beton)
-metale utwardzane dyspersyjnie (część zbrojenia ma średnicę co najmniej 0,01mm)
-nanokompozyty
Kompozyty wzmacniane dyspersyjnie:
-obciążenie przenosi osnowa
-część kompozytu … przeciwstawiają 0.05 ruchów
Przykład:
Al –> tlenek glin- w reaktorach nuklearnych
Be -> BeO – w reaktorach , kosmonautyka
Th -> ThO
2
– materiału magnetyczne odporne na pełzanie
Pb -> PbO – płyty akumulatorowe
Kompozyty wzmacniane czastkami :
- obciążenie zew. przenosi zarówno osnowa jak i inkluzja
-twarde cząstki ograniczają odkształcanie tworzywa
SKAŁY
Właściwości:
-wytrzymałośc na ściskanie – 300MPa
-niska porowatość - <1,5%
-zmiany objętości
-odporność na korozję chemiczną i fizyczną np. mróz
Tunel pod kanałem la Manche
- wytrzymałość i twardość betonu – 120lat, >45MPa
W przypadku betonów ściernych w przypadku pożaru beton kruszy się eksplozywnie (wydala się
wodór, woda). Dodaje się teraz tworzywa polimerowe, dające ucieczkę dla wodoru.
Składniki betonu:
-kruszywo – grube/drobne
-cement
-woda
-domieszki chemiczne – np. plastyfikatory
- dodatki mineralne np. pył krzemowy
Kompozyty włókniste
- włokna - mocne, sztywne, lekkie
-podział – Piskery, włókna
-wiskery – monokryształy pozbawione wad w sieci krystalicznej
Wytrzymałość kompozytu równa ze wzrostem l/d włókna
Rola osnowy:
-chroni włókna przed uszkodzeniem powierzchownym, wynikłymi z kwasu lub reakcji chemicznej z
otoczeniem
-rozdziela włókna
-spaja razem włókna i działa jako ośrodek przenoszący obciążenia zewnętrzne włókien
Osnowa:
a) Polimery utwardzone np. poliestry, fenoplasty
b) Polimery termoplastyczne: bardziej ciągliwe, mniejsza odpornośc na temperature
c) Metale i ich stopy: glin lekki!
d) Ceramika
WŁÓKNA
a) Szklane – wysoka wytrzymałość, mała sztywność, duża gęstość, najmniejsze koszty
b) Węglowe – wysoka wytrzymałość, wysoki moduł sprężystości, mniejsza gęstość niż szkła
c) Borowe – wysoka wytrzymałość, duża sztywność, duża gęstość, najwyższy koszt, wewnątrz
włokna wolframowe
d) Ar amidowe – np. kevlar, największy stosunek wytrzymałości do gęstości, wysoki koszt
e) Inne włókna – poliamidowe
Różna orientacja włokien – wpływa na wytrzymałość
Szczególne wymagania stawiane wiązaniu matrycy
- nie mogą być zbyt słabe ->włokna zostaną wyciągnięte z osnowy
-nie mogą być zbyt silne: materiał zachowuje się tak jakby był jednolity, nie ma obsorbcji energii
mechanicznej
- optymalnie: najpierw pęka osnowa, później odwraca się od włokien? Na koniec pękają włokna
Projektowanie kompozytów:
- włókna musza wykazywać adhezję do matrycy?
-współczynniki rozszerzalności cieplnej zbliżone
-osnowa powinna dokladnie wypełniać przestrzeń miedzy włóknami

-krytyczna długość włókna: Lk = Rm*d/łk?
-wzrost zawartości włokien – wzrost wytrzymałości i sztywności kompozytu
Wpłów rodzaju inkluzji na właściwości kompozytów z matrycy polimerowej:
-Al2O3 płytkowy: odporność chemiczna i temperaturowa stabilność wymiarowa.
-Al2O3 cząstki: izolacyjność elektryczna, sztywność
-Al proszek: przewodność elektryczna i cieplna????
-sadza – odporność na temperaturę, stabilność wymiarowa, sztywność, przewodność elektryczna i
cieplna
-celuloza
Kompozyty konstrukcyjne:
a) Laminaty – wiele dwuwymiarowych warstw różnie zorientowanych względem siebie
b) Kompozyty warstwowe (kanapkowe??)
Laminaty – we wszystkich kierunkach porównywalne właściwościa nie jak na przykład drewno które
ma większą wytrzymałośc wzdłuż włókine
Kompozyty warstwowe – 2 silne warstwy zewnętrzne rozdzielone warstwą słabszego mniej gęstego
materiału (rdzeń)
Używa się w konstrukcji dachów, ścian, skrzydeł samolotów np. dreamliner
Rolą rdzenia jest przeciwdziałanie deformacji
Materiały komórkowe – można zaliczyć do kompozytów, właściwości:
- dźwiękochłonne, odporne na uderzenia,
-wytrztymałośc mechaniczna przy ściskaniu
Pierwowzór – drewno, pień drzewa zbudowany z długich piustyc w środku komórek. Ściany komórek-
kompozyt włóknisty
Drewno sosnowe ma większą wytrzymałośc właściwą (wytrzymałość/ gęstość materiału) niż stal.
Kevlar
Otrzymany w wyniku reakcji polikondencji chlorowodorków kwasów di karboksylowych z aminami
chromatycznymi
Niezwykłe właściwości kevalru wynikają z budowy włókien: bardzo jednorodne w warstwach
Nomex:
-włokna otrzymywane wskutek reakcji kwasu izofranowego i m-ponylenodiaminy ???
- można go stosować w temp powyżej 200 C
-Do ubiorów strażackich i kierowcó samochodów ……………
-powyżej temp. Rozkładu przekształca się w grafit zachowując właściwości ochronne
Włókna karbonizowane:
a) Węglowe – 90-96%C nie w pełni zorientowana struktura
b) Grafitowe – powyżej 96%C o krystalicznej budowie
Kompozyty Węgiel-węgiel:
-włókna węglowe umieszczone w matrycy węglowej
-nie tracą właściwości w przypadku wysokich temperatur
- wysoka temp topnienia 3000K
- bardzo mała gęstość – 1,8 g/cm3 [stal- 7,8g/cm3]
Stosuje się je w tarczach hamulcowych w samolotach i niektórych samochodach

Problem – w temp ok. 500C mogą ukegac utlenianiu ( stosuje się antyutleniacze np. MoSi)
Kompozyty przyszłosci – włókna ceramiczne – Nano kryształy o średnicy 1mm
Klasy kompozytów włóknistych :
-metale
-ceramika
-polimery
Nanomateriały – rozmiar ( lub rozmiar elementów strukturalnych ) przynajmniej w 1 element
o wymiarze < 100nm
Nanotechnologie – sposoby i techniki tworzenia struktur o rozmiarach nanometrycznych
Nanometria – dziedzina nauki zajmująca się badaniem materiałów
1 nanometr to 10 atomów wodoru ułożonych jeden za drugim ( 1 nanometr to jedna
tysieczna dł,. Bakterii)
10
-9
– nanometr
10
-6
- mikrometr
Np. włos ludzki 50 um.
Przeciwpancerne pociski z nanokrystalicznego wolframu wiele lepsze właściwości
przebijania powietrza niż uran.
Nanotechnologia łączy:
-mechanikę
-chemię
-mechanikę kwantowa ( zjawiska kwantowe )
-biologię

Dlaczego stosujemy :
-mniejsze zużycie energii
-mniejsze zużycie materiałów
-nowe właściwości materii’
-nowe możliwości : medycyna ( komórki, jądra komórkowe, naczynia krwionośne )
-materiały na rakiety tenisowe, ramy rowerów, kije golfowe
Produkcja nanodiamentów najlepsze materiały utwardzające inne materiały, duża
biozgodność (np. do produkcji zastawek serca)
Przykłady nanomateriałów:
o
Kosmetyka, farmacja – transport i uwalnianie witamin
o
Nanocząstki srebra – pokrywanie powierzchni (pralki, lodówki)
o
Okulary – filtry UV, warstwy odporne na zarysowanie
o
Do kamizelek kuloodpornych
o
Lakiery samochodowe odporne na zarysowanie (krzemionki ?? )
o
Głowice drukarek atramentowych
o
Nano kompozyty
Właściwości:
Nanorurki węglanowe – większy moduł sprężystości 1000-5000GPa (większy od diamentów) i
-ciężar właściwy: 0,6g/cm
3
(stal 7,8g/cm
3
), wytrzymałość na rozciąganie 20 000 Mpa (stal<2000)
Umożliwia to wytwarzanie super wytrzymałych i lekkich
stopów np. konstrukcje lotnicze
Najważniejsze rodzaje:
Nano materiały metaliczne
Nan. Ceramiczne i szklano-ceramiczne
Nan. Polimerowane ? (najczęściej)
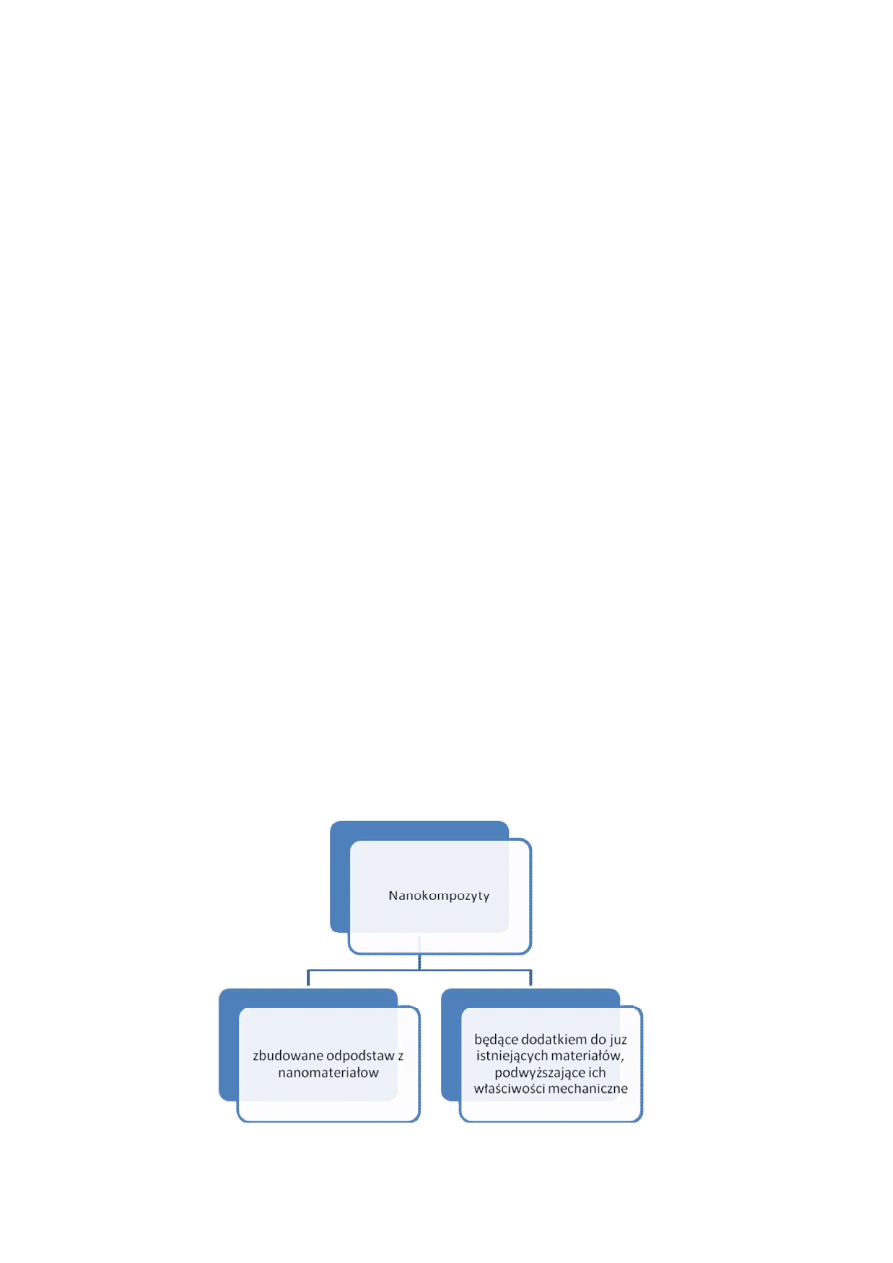
Nanoceramika – mniej krucha, bardziej odkształcalna
Nanokrystaliczne metale – bardziej wytrzymałe.
Do najczęściej stosowanych metali w nanokompozytach polimerowanych (jako faza rozproszona):
srebro, złoto, miedź, mat. Ceramiczne. Zmniejszenie wielkości ziaren związków międzymetalicznych
do skali nanomateriałow powoduje pojawienie się zjawiska superplastyczności.
Nanozłoto – potrafi zmieniać kształt białek i formy nieuporządkowanej w uporządkowaną. Może być
pomocne przy leczeniu choroby choroby nowotworowej.
Nanosrebro – najczęściej stosowane, posiada właściwości bakterio i grzybobójcze (np. w świerkach).
Powoduje przedłużenie trwałości białka (np. mleko). Do produkcji niektórych antybiotyków.
Nanoplatyna – katalizatory w ogniwach wodorowych i kat. Samochodowe
Spieki tlenków metali – nanoceramika, ceramiczne nie ulegają prawom ścierania
Tlenek tytanu – powszechnie stosowany do farb kryjących
Dodatek Nano – „silnie krzywe”???, samooczyszczanie farby, zdolność do pochłaniania
nieprzyjemnych zapachów, bakteriobójczy.
Również do produkcji szkła.
Nanocząsteczki glinokrzemowe nanowypełniacze. Wprowadzone do polimeru powodują jego
większą odporność termiczną, większą elastyczność.

Podział nanokompozytów polimerowych
o
Jednowymiarowe
o
Dwuwymiarowe
o
Trzywymiarowe
Nanododatki i ich wpływ na właściwości materiałów:
1) Montmorylonity (do glinokrzemianów) – niwelują zapach, wilgoć, ogien?
2) Fulereny, nanorurki – wzrost właściwości mechanicznych, elektrycznych oraz
trwałości
3) Krzemionka – wzrost wł. Mech i odporności termiczne
4) Metale i ch związki – podwyższa przewodność elektryczną i cieplną, katalizatory
5) Nanopory (zamknięte) – zmniejszenie masy, zwiększenie wytrzymałości
6) Modyfikatory właściwości przetwórczych i ściernych:
o
Twarde nanocząstki (zwiększenie tarcia)
o
Smar molekularny (zmniejszenie tarcia)
W przemyśle samochodowym Toyota często stosuje nanomateriały
Folie opakowanie efekt labiryntu
Ograniczona przenikalność tleny i pary wodnej.
Fulereny – zamknięta budowa klatkowa, składają się z kilkudziesięciu do kilkunastu set atomów
węgla. Silnie wpływają na wzrost wytrzymałości materiałów.
Ważne: W zastosowaniach wojskowych jako absorbet promieniowania radiacyjnego oraz fal
radiowych, inne np. do produkcji opon.
W medycynie – jako nośniki leków, nie wpływające na krzepliwość krwii. Uwalniają lek co jakiś czas
(kiedy potrzeba) np. w lekach na cukrzycę (insulina) i przeciwko AIDS.
Węgiel powoduje migrację krwinek czerwonych, fulereny nie!
Nanorurki węglowe:
Kształt np. zwinięta płaszczyzna, wieloosiowe cylindry etc. ( mogą przyjmować różne formy)
Używane w chipach komputerowych, szybko przewodzą sygnały elektryczne. Również w
telefonach komórkowych.
Wytrzymałość odniesiona do gęstości wyższa niż stali
Umożliwiają bardzo szybki przepływ cieczy w membranach (prawie nie powodują tarcia)
Dodawane do matrycy polimerowej kompozyty mogą stać się przewodnikami
elektrycznymi.

Nanorurki
Do znakowania samochodów (znaki, numery, widoczne tylko w świetle UV)
Ryzyko dotyczące nanocząstek (a nie materiałów do których ich zużyto)
Nanocząsteczki mogą zachowywać się w sposób nieprzewidywalny (ze względu na swój
rozmiar)
Mogą występować techniczne problemy: utylizacja, transport
Unikanie kontaktu nanocząstek z ludzkim mózgiem
Monitorowanie pracowników mających kontakt z materiałami
Nanomateriały mogą przenikać przez fizjologiczne bariery do komórek i m. in. Uszkodzeń
narządów wewnętrznych.
KONIEC
Opracowali: Vaffanculo
JEBAĆ NIEMCÓW
POZDRO DLA KUMATYCH
TE PUTA MADRE PENDEJOS
Wyszukiwarka
Podobne podstrony:
Mikroekonomia notatki całość
Horney - Nerwica a rozwój człowieka - stare notatki z całości, nerwica
Calosc nom
Aktualne problemy kultury języka - notatki - całość, Polonistyka, Stylistyka i stylizacja jezykowa -
EKONOMIA - mini, Studia UPH Siedlce - Bezpieczeństwo Narodowe 2011-2014, I rok, Ekonomia, notatki ca
ćwiczenia teoria wychowania notatki całość, notatki różne
ćwiczenia teoria wychowania notatki całość, Pedagogika, Teoria wychowaia
STRUKTURALIZM - notatki całość, Etnologia i Antropologia kultury, Strukturalizm
Calosc nom, Politechnika Poznańska ZiIP, II semestr, nom
Mikroekonomia notatki całość
historia notatki całosc
pedeutologia całość, Egzaminy notatki
Ściąga psychologia całość, Administracja-notatki WSPol, podstawy psychologii
notatki, Wyklady calosc Prawo Administracyjne
metody TEAT ! CAŁOŚĆ, Notatki Rolnictwo, 4 rok, IV rok, METODY TESTY
więcej podobnych podstron