AMINY ALIFATYCZNE I AROMATYCZNE - REAKCJE
1. Zasadowość amin
R-NH
2
+ H-A R-NH
3
+ A
Aminy są bardziej zasadowe od alkoholi i wody. Aminy alifatyczne są silniejszymi zasadami od amin aromatycznych.
Zależność zasadowości i rzędowości aminy nie jest jednoznaczna i zależy od warunków. Aminy alifatyczne drugorzędowe
są nieco silniejszymi zasadami od amin 1
0
i 3
0
(wpływ efektu indukcyjnego +I oraz korzystna solwatacja). Podstawniki
elektronodonorowe zwiększają moc amin jako zasad, elektronooakceptorowe obniżają zasadowość amin.
2. Alkilowanie amin alifatycznych
R-NH
2
+ R-X
S
N
2
B
-
R
2
NH
amina 2
0
R
2
NH + R-X
S
N
2
B
-
R
3
N
amina 3
0
R
3
N + R-X
S
N
2
B
-
R
4
N
+
X
-
czwartorzędowa sól amoniowa
Reakcje alkilowania amin 1
0
i 2
0
są trudne do kontrolowania i prowadzą do mieszniny produktów
3. Acylowanie amin alifatycznych
O
R
X
R-NH
2
O
R
NH
R
amid
reagują chlorki kwasowe i bezwodniki
reakcję można prowadzić z aminami 1
0
, 2
0
i amoniakiem
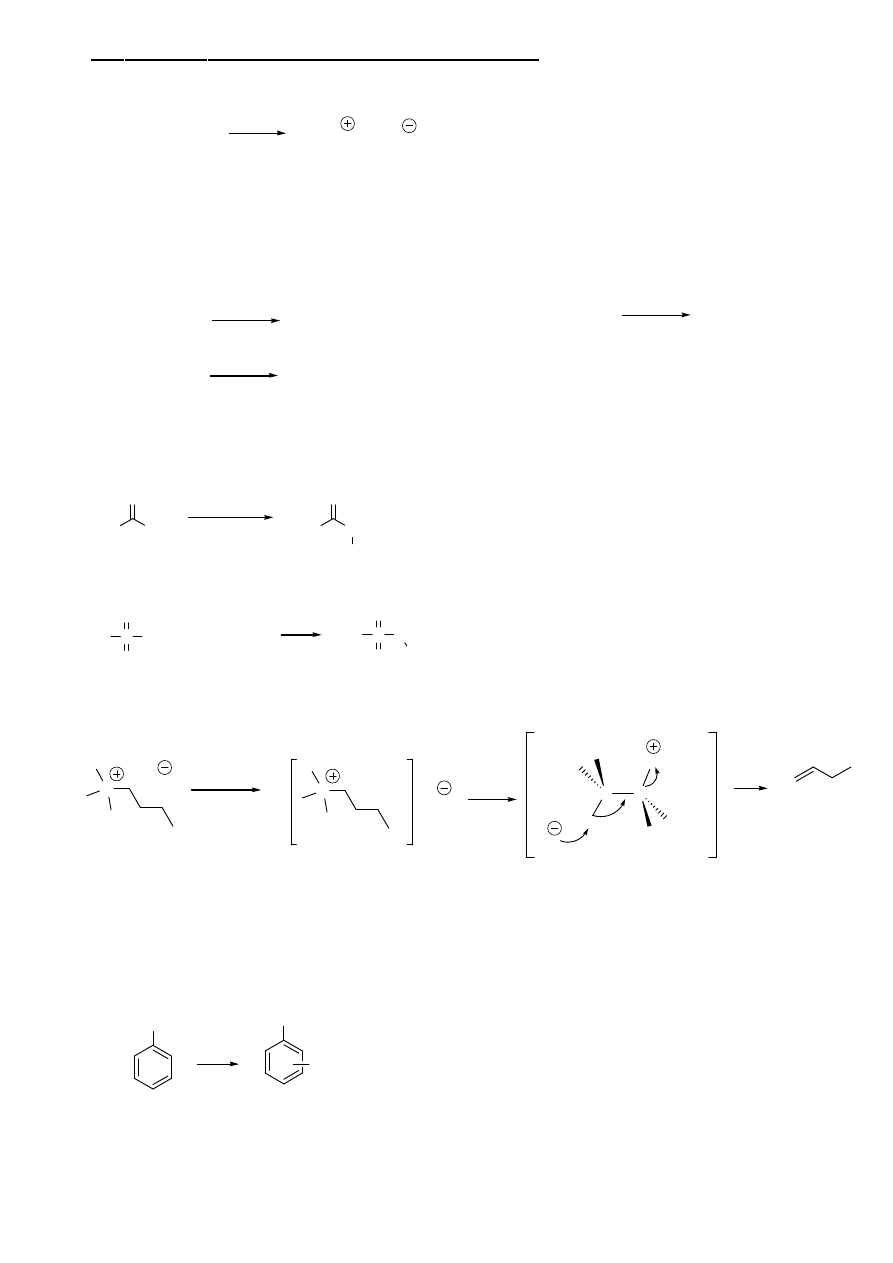
5. Reakcja eliminacji Hofmanna (aminy
alifatyczne)
N
I
czwartorzędowa sól
amoniowa
Ag
2
O
H
2
O, ogrzew.
N
OH
H
C
C
N(CH
3
)
3
OH
+ N(CH
3
)
3
W reakcji powstają alkeny mniej podstawione - inaczej niż w klasycznej reakcji E2. Związane jest to z istnieniem zawady
sterycznej. Ze względu na duży rozmiar trialkiloaminowej grupy opuszczającej, zasada odrywa wodów od strony najlepiej
dostępnej z położenia najmniej zasłoniętego.
E2
6. Reakcje aromatycznej substytucji elektrofilowej amin aromatycznych
NH
2
NH
2
P
Grupa aminowa jest grupa silnie aktywującą, kieryujacą podstawniki w
połozenie orto i para. Ze względu na silną aktywacje czesto powstają
produkty polipodstawione (di i tri)
4. Przemiana w sulfonamidy
R S
O
O
Cl
+ R
1
-NH
2
R S
O
O
NH
R
1
N-podstawiony sulfonamid
chlorek sulfonylu
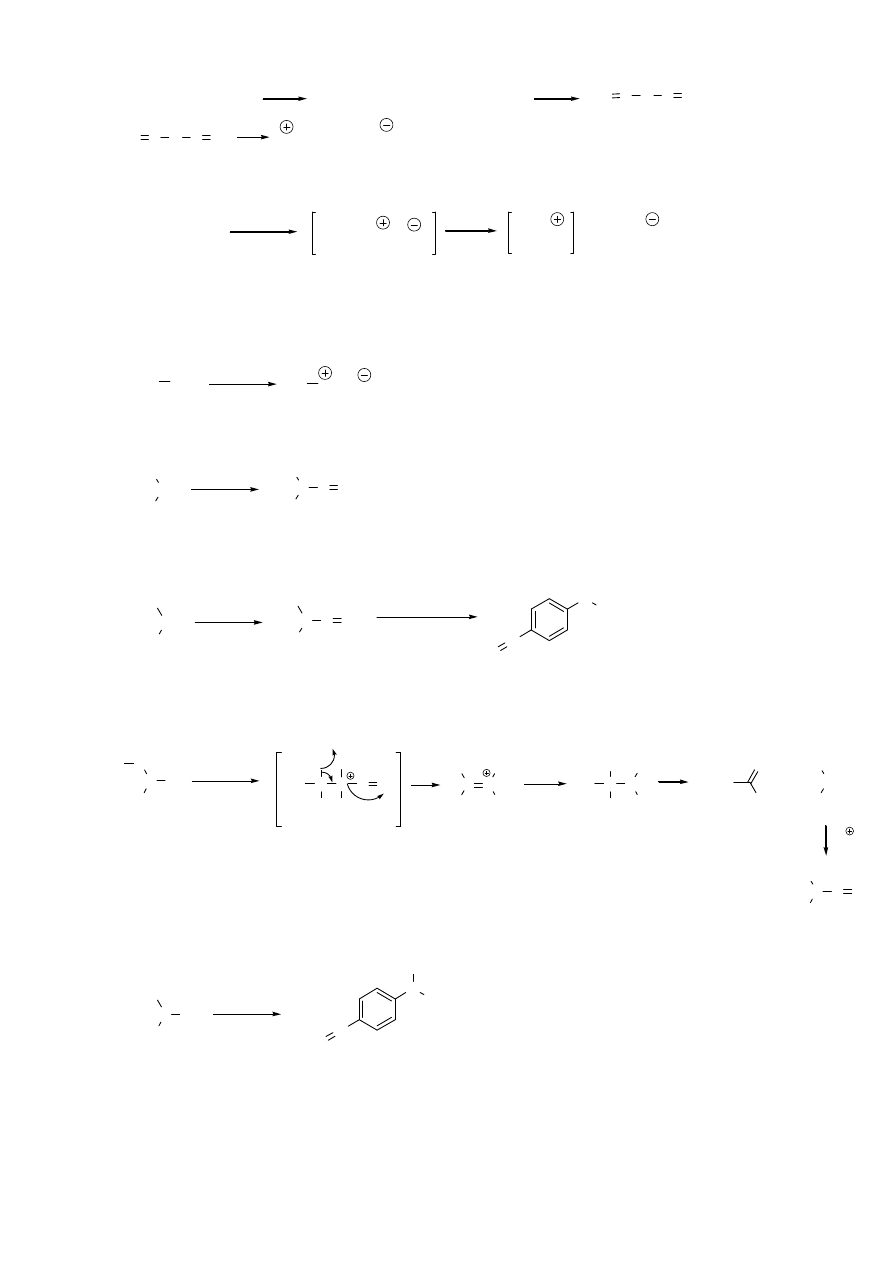
Ar
NH
2
NaNO
2
HCl
Ar
N
2
Cl
sól diazoniowa (trwała w temp. 0
0
C)
7. Reakcje amin z kwasem azotawym
a. 1
0
aminy alifatyczne
NaNO
2
+ HCl
HNO
2
+ NaCl
2 HNO
2
O N O N O
+ H
2
O
O N O N O
N=O + NO
2
jon nitrozoniowy
R-CH
2
-NH
2
NaNO
2
HCl
Cl
sól diazoniowa
(nietrwała)
R-CH
2
-N
2
R-CH
2
+ N
2
+ Cl
karbokation 1
0
- moze ulegać dalszym reakcjom, prowadząc do
różnych produktów (np. alkoholi, alkenów)
b. 1
0
aminy aromatyczne
c. 2
0
aminy alifatyczne
NH
R
2
R
1
NaNO
2
HCl
N
R
2
R
1
N O
N-nitrozoamina o charakterystycznym żółtym lub czerwonym zabarwieniu
d. 2
0
aminy aromatyczne
NH
R
Ar
NaNO
2
HCl
N
R
Ar
N O
N-nitrozoamina
H
N
N
R
O
p-nitrozoamina
przegrupowanie
c. 3
0
aminy alifatyczne
N
R
2
CH
2
NaNO
2
HCl
d. 3
0
aminy aromatyczne
N
R
Ar
NaNO
2
HCl
N
N
R
O
p-nitrozoamina
R
R
R
R
1
R
N
C
N
R
2
O
R
1
H
H
C N
R
2
R
H
R
1
H
2
O
C N
R
2
R
H
R
1
OH
R
1
H
O
+
NH
R
2
R
NO
N
R
2
R
N O
W reakcji powstaje mieszanina produktów: aldehydów (ketonów), amin 2
0
i nitrozoamin

8. Zastosowanie soli arenodiazoniowych
a. Reakcja Sandmeyera
Ar-N
2
+
X
-
HX
CuX
Ar-X
X = Cl, Br, CN
b. Reakcja Gattermana
Ar-N
2
+
X
-
HX
Cu
Ar-X
X = Cl, Br, CN
jodki - bez dodatku kataliaztora (CuI), działając
bezpośrednio na sól diazoniową za pomocą HI
c. Reakcja Schiemanna
Ar-N
2
+
X
-
NaBF4
Ar-F
Ar-N
2
+
BF
4
-
ogrzew.
d. Synteza fenoli
Ar-N
2
+
X
-
Ar-OH
H
2
O
Reakcja zachodzi wolno nawet w oziębionym roztworze soli diazoniowej.
Po jego ogrzaniu może stanowić główną drogę reakcji
e. Redukcja soli diazoniowych
Ar-N
2
+
X
-
Ar-H + N
2
H
3
PO
4
f. Reakcje sprzęgania - synteza zwiazków azowych
Ar-N
2
+
X
-
P
+
N N Ar
P
Reakcja substytucji elektrofilowej. W pierścieniu
ulegającym atakowi soli diazoniowej muszą byc
obecne podstawniki silnie aktywujace (-OH, -NR
2
,
-NHR lub -NH
2
). Atak nastęuje najczęściej w
pozycji para.
Wyszukiwarka
Podobne podstrony:
Aminy Reakcja z kwasem azotowym(III)
chemia, DIAZOWANIE, DIAZOWANIE- reakcja zachodząca pomiędzy kw azotawym HNO2, a solą pierwszorzędowe
Aminy katecholowe i ich rola w reakcjach stresowych organizmu (wpływ metaboliczny i narządowy)x
Czynności obronne i reakcje stresowe
CZLOWIEK I CHOROBA – PODSTAWOWE REAKCJE NA
Aminy analityka
W15 reakcje utlenienia redukcji
psychologiczna reakcja na katastrofy
06 Kinetyka reakcji enzymatycznych
w5 wzor reakcja chemiczna ilościowo
Reakcje jądrowe
wyk12 aminy
aminy 4
Opor jako reakcja na wplyw spoleczny
więcej podobnych podstron