1
Sprawozdanie z ćwiczenia nr 21:
Wyznaczanie masy cząsteczkowej metodą
ebuliometryczną.
1. Wstęp teoretyczny:
Pośród rozlicznych właściwości roztworów istnieje jedna ich grupa, której wspólną cechą jest ich
zależność od liczby cząsteczek (moli) substancji rozpuszczonej. Do tych, koligatywnych, właściwości
roztworów zaliczamy: obniżenie temperatury krzepnięcia roztworu w stosunku do czystego rozpuszczalnika,
podwyższenie temperatury wrzenia roztworu w stosunku do czystego rozpuszczalnika oraz ciśnienie
osmotyczne roztworów. Właściwości te wynikają z faktu, że w procesie tworzenia roztworu obniża się jego
entalpia swobodna.
Rozważmy przykładowo zjawisko zmiany temperatury krzepnięcia substancji przez dodatek substancji
rozpuszczonej. Metoda fizykochemiczna oparta na tym zjawisku nosi nazwę kriometrii.
Niech roztwór dwuskładnikowy o składzie (x
1
, x
2
) w stanie ciekłym ma temperaturę początkową T
p
, gdzie
x
1
oznacza ułamek molowy rozpuszczalnika. Przy obniżaniu temperatury, w temperaturze T
k
rozpocznie się
wydzielanie z roztworu czystego rozpuszczalnika. Zgodnie z regułą faz Gibbsa, liczba stopni swobody (n) w
tym dwuskładnikowym (
α
= 2) i dwufazowym (
β
= 2) układzie wynosi 2:
n =
α
-
β
+ 2 = 2
Jednym z nich jest ciśnienie, drugim zaś temperatura lub skład. Ponieważ ciśnienie jest ustalone (p = const)
zatem jedynym stopniem swobody jest temperatura lub skład. Te dwa parametry nie mogą więc być niezależne
- musi istnieć równanie podające zależność temperatury krzepnięcia od składu roztworu. Znajdźmy to
równanie.
Potencjał chemiczny wydzielającego się w temperaturze T
k
czystego rozpuszczalnika jest równy
standardowemu potencjałowi chemicznemu w tej temperaturze:
0(s)
1
(c)
1
µ
µ
=
Potencjał chemiczny rozpuszczalnika w roztworze (faza ciekła) zależy od jego aktywności a
1
:
1
0(c)
1
(c)
1
RTlna
µ
µ
+
=
W stanie równowagi te potencjały chemiczne są sobie równe:
1
0(c)
1
0(s)
1
RTlna
µ
µ
+
=
lub
1
0(c)
1
0(s)
1
RTlna
µ
µ
=
−
Różnica (
0(c)
1
0(s)
1
µ
µ
−
) jest równa zmianie entalpii swobodnej krystalizacji jednego mola czystego
rozpuszczalnika
∆
G
k
w temperaturze T
k
:
1
0(c)
1
0(s)
1
k
RTlna
µ
µ
∆
G
=
−
=
Zgodnie z II zasadą termodynamiki:
T
∆
H
∆
G
∆
S
T
∆
G
k
k
k
p
k
−
=
−
=
∂
∂
(1)
zaś różniczkując powyższe równanie obustronnie względem temperatury mamy:
1
p
1
p
k
Rlna
T
lna
RT
T
∆
G
+
∂
∂
=
∂
∂
(2)
Przyrównanie prawych stron równań (1)i (2) prowadzi do zależności:
2
k
p
1
RT
H
-
T
lna
∆
=
∂
∂
(3)
w której
∆
H
k
oznacza zmianę entalpii w procesie krystalizacji 1 mola rozpuszczalnika.
Całkowanie równania (3) uzależnione jest od zakresu temperatur. Dla temperatur T
k
niezbyt odległych od
temperatury krystalizacji czystego rozpuszczalnika T
o
, można przyjąć entalpię krystalizacji
∆
H
k
za wielkość
stałą, niezależną od temperatury. Przy takim założeniu całkowanie równania (3) począwszy od temperatury
krystalizacji czystego rozpuszczalnika T
o
(w której a
1
= 1) do temperatury krystalizacji roztworu T
k
(w której
aktywność rozpuszczalnika w roztworze wynosi a
1
) prowadzi kolejno:
k
o
1
T
T
k
a
1
1
T
1
R
∆
H
lna
⋅
+
=
(4)
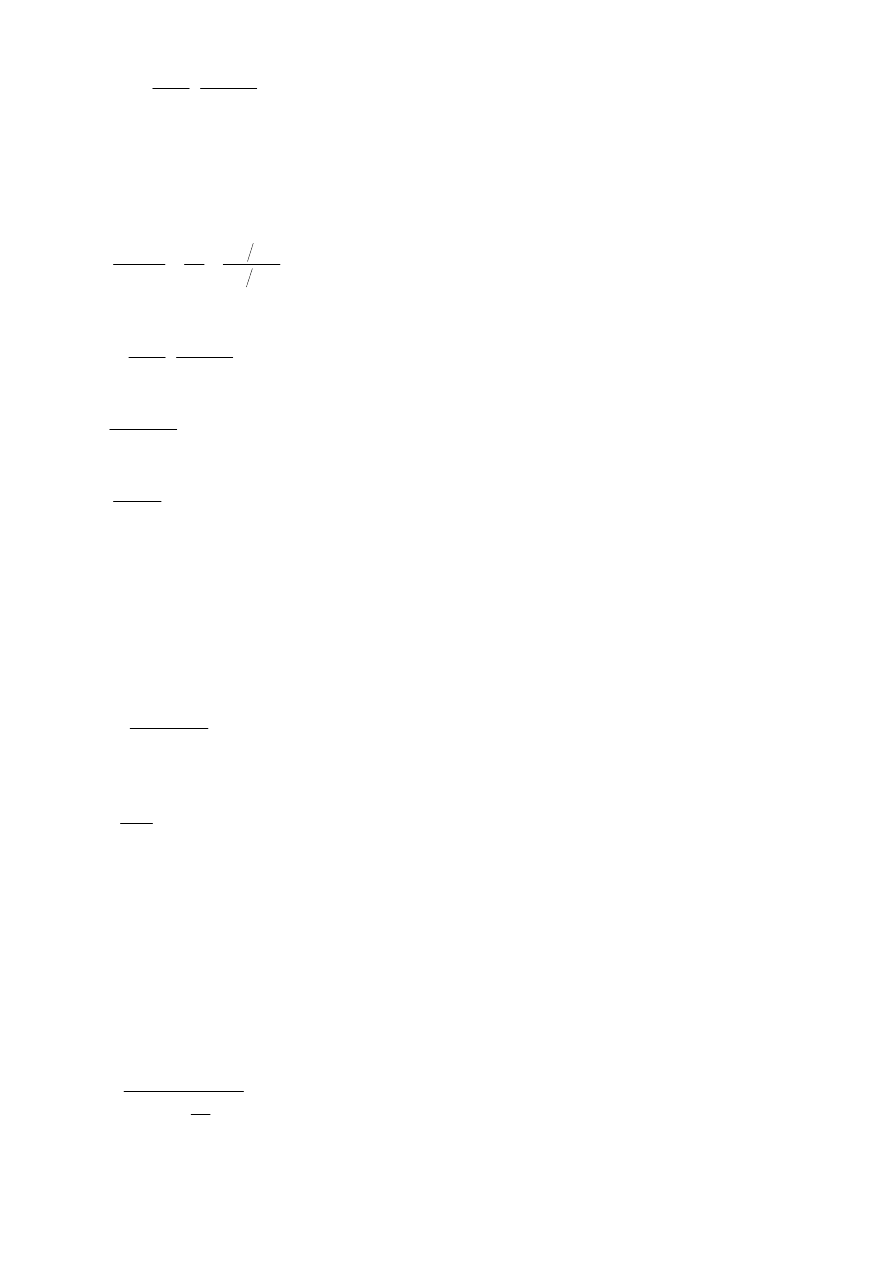
2
do równania:
k
o
k
o
k
1
T
T
T
T
R
∆
H
lna
⋅
−
⋅
−
=
−
(5)
Jeżeli roztwór jest ponadto dostatecznie rozcieńczony, to aktywność rozpuszczalnika można zastąpić przez
jego ułamek molowy x
1,
a ponieważ:
x
1
= 1 – x
2
zatem dla małych wartości x
2
:
-lnx
1
= -ln(1 – x
2
) = x
2
gdzie x
2
jest ułamkiem molowym substancji rozpuszczonej:
2
1
2
2
1
2
2
1
1
2
M
m
M
m
n
n
n
n
n
x
=
≅
+
=
(6)
W równaniu tym m
1
i m
2
oznaczają masy rozpuszczalnika i substancji rozpuszczonej, zaś M
1
i M
2
odpowiednie masy cząsteczkowe. Zatem równanie (5) przyjmie postać:
k
o
k
o
k
2
T
T
T
T
R
∆
H
x
⋅
−
⋅
−
=
(7)
Wyrażając stężenie roztworu w skali molarności m [mol/l000 g] rozpuszczalnika mamy:
1
2
2
m
M
1000
m
m
⋅
⋅
=
(8)
a stąd i z równania (6):
1000
M
m
x
1
2
⋅
=
(9)
Oznaczając obniżenie temperatury krzepnięcia roztworu w stosunku do temperatury krzepnięcia czystego
rozpuszczalnika przez
∆
T
k
:
∆
T
k
= T
o
- T
k
oraz przyjmując, że:
2
o
k
o
T
T
T
≅
⋅
otrzymujemy z równań (7) i (9):
∆
T
k
= K
k
m (10)
gdzie stała K
k
zwana stałą kriometryczną zawiera wszystkie wielkości stałe:
k
1
2
o
k
∆
H
1000
M
T
R
K
⋅
⋅
⋅
−
=
(11)
Znak „-„ w równaniu na stalą krioskopową pochodzi stąd, że w rozważaniach posłużono się entalpią
krystalizacji, a nie jak zwykle ciepłem topnienia (
∆
H
k
<
0).
m
T
K
k
k
∆
=
(12)
Stała kriometryczna jest równa obniżeniu temperatury krzepnięcia roztworu zawierającego w 1000 g
rozpuszczalnika 1 mol substancji rozpuszczonej. Jest to wielkość charakterystyczna dla rozpuszczalnika.
Przyjęte założenia ograniczają stosowalność równania (10) jedynie do roztworów rozcieńczonych. Przy
roztworach bardziej stężonych założenia te należy odrzucić.
Zgodnie z prawem Kirchhoffa entalpię krystalizacji rozpuszczalnika w temperaturze krzepnięcia roztworu
T
k
należy przedstawić za pomocą równania:
∆
H
k
=
∆
H
o
+
∆
C
p
(T
k
– T
o
) =
∆
H
o
–
∆
C
p
*
∆
T
k
(13)
w którym
∆
H
o
oznacza entalpię krystalizacji rozpuszczalnika w temperaturze krystalizacji czystego
rozpuszczalnika T
o
, zaś
∆
C
p
jest różnicą ciepeł molowych stałego i ciekłego rozpuszczalnika. Wprowadzając
równanie (13) dorównania (5) oraz rezygnując z przybliżenia
2
o
k
o
T
T
T
≅
⋅
otrzymuje się:
k
o
k
2
o
k
p
o
1
∆
T
T
T
RT
∆
T
∆
C
∆
H
lna
⋅
−
=
(14)
Utrzymując założenie o idealnym zachowaniu rozpuszczalnika można równanie (14) doprowadzić do
postaci:
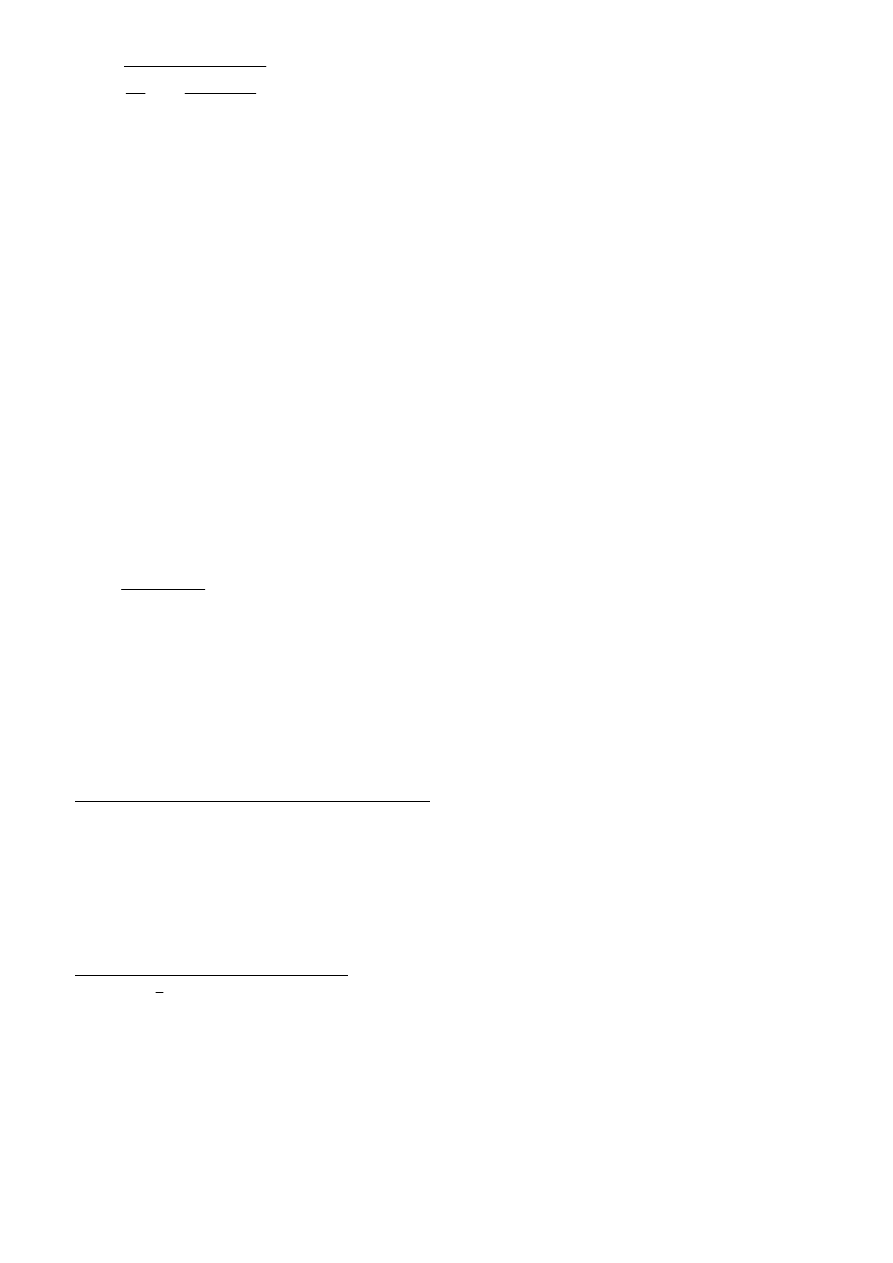
3
⋅
−
⋅
⋅
=
o
k
p
k
o
k
k
∆
H
∆
T
∆
C
1
T
T
K
m
∆
T
(15)
w której mianownik określa poprawkę w stosunku do równania (10). Jeżeli
∆
T
k
jest rzędu 2 - 3°, to błąd
wynikający z nieuwzględnienia wyrażenia w mianowniku nie przekracza 1 - 2 %.
Podstawowe równanie kriometrii (10) spełnione jest jedynie przez idealne roztwory nieelektrolitów. W
rozcieńczonych roztworach mocnych elektrolitów w miejsce molarności we wzorze (10) należy stosować
iloczyn l*m, gdzie l jest liczbą jonów tworzących się w wyniku dysocjacji cząsteczki elektrolitu. W
rozcieńczonych roztworach słabych elektrolitów należy uwzględnić dysocjację; w miejsce stężenia molarnego -
dla słabego elektrolitu binarnego - należy wstawić wartość m(1 +
α
), gdzie
α
jest stopniem dysocjacji.
W bardziej stężonych roztworach elektrolitów należy uwzględnić współczynniki aktywności.
Termodynamiczną konsekwencją procesu tworzenia roztworu (dodania substancji rozpuszczonej do
rozpuszczalnika) jest spadek entalpii swobodnej roztworu. Spadek entalpii swobodnej prowadzi w przypadku
roztworów doskonałych i większości roztworów rzeczywistych do obniżenia prężności par rozpuszczalnika nad
roztworem w stosunku do prężności par nad czystym rozpuszczalnikiem. Konsekwencją tego zjawiska jest
obniżanie temperatury krzepnięcia roztworu w stosunku do temperatury krzepnięcia czystego rozpuszczalnika,
a także podwyższanie temperatury wrzenia roztworu w stosunku do temperatury wrzenia czystego
rozpuszczalnika. Na zjawisku podwyższania temperatury wrzenia roztworu oparta jest fizykochemiczna metoda
badawcza zwana ebuliometrią.
Podobnie jak w kriometrii, wielkość podwyższenia temperatury wrzenia w ebuliometrii (
∆
T
w
) związana
jest ze stężeniem roztworu (m). Rozważanie analogiczne, jak przy wyprowadzeniu równania (10) prowadzi do
równania:
∆
T
w
= K
E
m (16)
Stała ebuliometryczna K
E
występująca w tym równaniu określona jest równaniem analogicznym do (11):
w
1
2
o
E
∆
H
1000
M
T
R
K
⋅
⋅
⋅
=
(17)
w którym T
o
jest odpowiednio temperaturą wrzenia czystego rozpuszczalnika, zaś
∆
H
w
molowym ciepłem
parowania. Stała ebuliometryczna podająca podwyższenie temperatury wrzenia obserwowane dla roztworu 1
molarnego, jest – podobnie jak stała kriometryczna wielkością charakterystyczną dla rozpuszczalnika i
niezależną od rodzaju substancji rozpuszczonej.
Zastrzeżenia czynione przy wyprowadzaniu równania (10) słuszne są także dla podstawowego równania
ebuliometrii (17).
2. Opracowanie wyników:
Masy próbek obliczam z następującej zależności:
k
pk
s
m
m
m
−
=
gdzie: m
s
– masa substancji; m
pk
– masa kolby z naważką substancji; m
k
– masa pustej
kolby.
-
naważka I: m
s
= 54,3815 – 51,3645 = 3,017 g
-
naważka II: m
s
= 53,3608 – 51,8085 = 1,5523 g
-
naważka III: m
s
= 49,2515 – 47,1826 = 2,0689 g
-
naważka IV: m
s
= 48,9855 – 46,8677 = 2,1178 g
Równanie termistora jest następujące:
T
b
e
R
R
−
∞
⋅
=
z równania termistora można obliczyć temperaturę wrzenia rozpuszczalnika i roztworów
(
∞
lnR = -9,2872
±
0,0571; b = -3573,2239
±
21,2883):
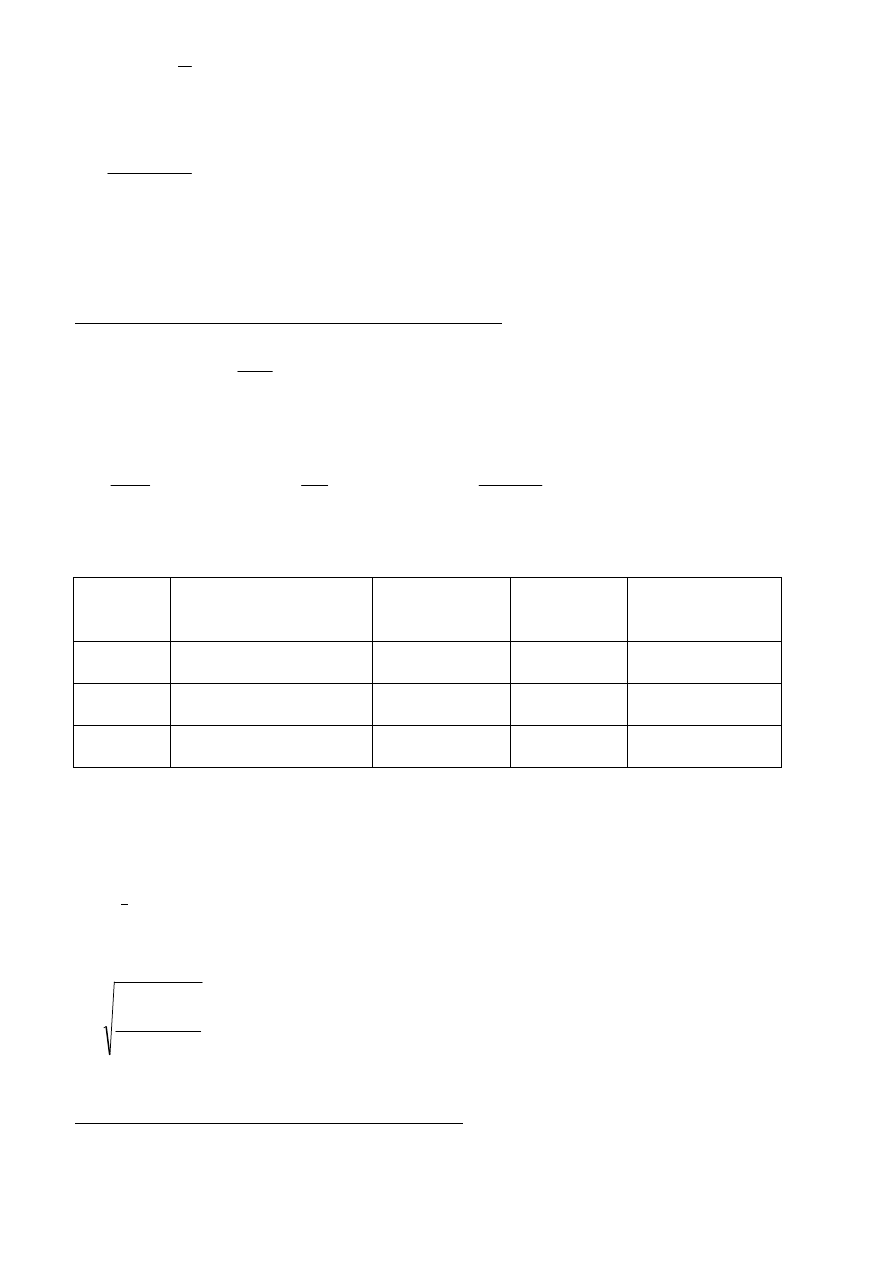
4
(
)
lnR
lnR
b
T
b
lnR
lnR
T
b
TlnR
TlnR
T
b
lnR
lnR
−
=
=
−
−
=
−
=
∞
∞
∞
∞
Temperatura wrzenia (R = 1,371 k
Ω
) dla czystego rozpuszczalnika (H
2
O) wynosi: T
wrz.(w)
= 372,10 K.
Temperatura wrzenia (R = 1,361 k
Ω
) dla roztworu z naważką I wynosi: T
wrz.(1)
= 372,39 K.
Temperatura wrzenia (R = 1,355 k
Ω
) dla roztworu z naważką I, II i III wynosi: T
wrz.(2)
= 372,56 K.
Temperatura wrzenia (R = 1,352 k
Ω
) dla roztworu z naważką I, II, III i IV wynosi: T
wrz.(3)
= 372,65 K.
Molarność badanych roztworów i masa molowa substancji:
Molarność roztworów obliczyć można z następującej zależności:
E
w
E
w
K
∆
T
m
m
K
∆
T
=
⇒
⋅
=
gdzie:
∆
T
w
– przyrost temperatury wrzenia (
∆
T
w
= T
wrz.(x)
– T
wrz.(w)
; x –
oznacza odpowiedni pomiar: 1, 2, 3); K
E
– stała ebuliometryczna wody (K
E
= 0,521 [K*kg/mol]); m –
molarność roztworu.
Masa molowa substancji:
rozp
s
s
rozp
s
s
rozp
s
rozp
s
m
m
m
M
m
m
M
m
m
m
n
m
n
m
⋅
=
⇒
⋅
=
⇒
⋅
=
⇒
=
gdzie: m – molarność roztworu; n
s
–
liczba moli substancji; m
rozp
– masa rozpuszczalnika [kg]; m
s
– masa substancji w roztworze [g]; M
s
– masa
molowa substancji.
Pomiar
Masa substancji w
roztworze m
s
[g]
Przyrost
temperatury
∆
T
w
[K]
Molarność
roztworu
[mol/kg]
Masa molowa
[g/mol]
1
naważka I
m
s
= 3,017
0,29
0,5566
54,20
2
naważka I + II + III
m
s
= 6,6382
0,46
0,8829
75,19
3
naważka I + II + III + IV
m
s
= 8,756
0,55
1,0557
82,94
Ś
rednia masa molowa substancji wynosi 70,78 [g/mol]
W przypadku małej liczby pomiarów średnia może różnić się dość znacznie od wartości prawdziwej.
Dlatego wygodniej jest wtedy określić przedział, w którym wartość rzeczywista znajduje się z dużym
prawdopodobieństwem. Taki przedział nazywamy przedziałem ufności. Wyznaczam przedział ufności dla
prawdopodobieństwa 95% (p = 0,95 ;
α
= 0,05)
µ
= X
+
t * s
gdzie: X – średnia arytmetyczna; t – wartość funkcji Studenta, wartość współczynnika „t” dla
prawdopodobieństwa 95% (dla 3 pomiarów), t = 4,303 dla K = n – 1 = 2
s – odchylenie standardowe średniej arytmetycznej, obliczane ze wzoru:
s =
(
)
(
)
1
n
n
x
x
1
2
i
−
−
∑
=
n
i
gdzie: x
i
– kolejne wyniki; x – średnia arytmetyczna wyników; n – ilość wyników (n=5).
s = 8,39
36,10
4,303
8,39
t
s
=
⋅
=
⋅
⇒
Masa molowa substancji wynosi 70,78
±
36,1 [g/mol]
Porównanie z wartością tablicową: masa molowa tiomocznika wynosi 76,1226 [g/mol] zaś wartość
eksperymentalna wynosi 70,78 [g/mol] a błąd procentowy wynosi 7,02 %.

5
3. Wnioski:
Cel ćwiczenia (wyznaczenie masy molowej substancji) został osiągnięty. Wartość pojemności jonitu
wyznaczona przeze jest obarczona błędem 7,02 %. Przedział ufności jest bardzo duży ponieważ wartości masy
molowej są bardzo rozbieżne. Rozbieżność wartości może być spowodowane niedokładnościami w czasie
pomiarów.
Wyszukiwarka
Podobne podstrony:
chemia fizyczna wyklady nasze id 112221
Chemia fizyczna sprawozdanie (6 1) id 112219
chemia fizyczna lab id 112228 Nieznany
chemia fizyczna egzamin id 1122 Nieznany
Chemia fizyczna sciaga id 112218
kartk. - masa czasteczkowa i prawo stałości składu, chemia, kartkówki
Chemia fizyczna Loska id 112215
oznaczanie średniej wiskozymetrycznej masy cząsteczkowej polimerów, Chemia fizyczna, laboratorium, C
Chemia fizyczna notatki id 1122 Nieznany
Chemia fizyczna sprawozdanie (6 1) id 112219
chemia fizyczna lab id 112228 Nieznany
chemia fizyczna egzamin id 1122 Nieznany
wyklad z czwartku chemia fizycz dnia19 marca
Chemia fizyczna wykład 11
chemia fizyczna38
chemia fizyczna07
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
więcej podobnych podstron