
ROZPORZ
ĄDZENIE KOMISJI (WE) NR 712/2005
z dnia 11 maja 2005 r.
zmieniaj
ące załączniki I i II do rozporządzenia Rady (EWG) nr 2377/90 ustanawiającego
wspólnotow
ą procedurę określania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia zwierzęcego w odniesieniu do
lasalocidu i amonu oraz soli sodowych bituminosulfonianów
(Tekst maj
ący znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzgl
ędniając Traktat ustanawiający Wspólnotę Europejską,
uwzgl
ędniając rozporządzenie Rady (EWG) nr 2377/90 z dnia
26 czerwca 1990 r. ustanawiaj
ące wspólnotową procedurę
okre
ślania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia
zwierz
ęcego (
1
), w szczególno
ści jego art. 2 i 3 oraz art. 4
akapit trzeci,
uwzgl
ędniając opinie Europejskiej Agencji ds. Leków wydane
przez Komitet ds. Weterynaryjnych Produktów Leczniczych,
a tak
że mając na uwadze, co następuje:
(1)
Wszystkie substancje czynne farmakologicznie, które s
ą
stosowane we Wspólnocie w produktach leczniczych
przeznaczonych do podawania zwierz
ętom służącym
do produkcji
żywności, powinny być oceniane zgodnie
z rozporz
ądzeniem (EWG) nr 2377/90.
(2)
Substancja lasalocid powinna zosta
ć włączona do załącz-
nika I w odniesieniu do drobiu z wyj
ątkiem zwierząt,
których jaja przeznaczone s
ą do spożycia przez ludzi.
(3)
Substancje amon i sole sodowe bituminosulfonianów
w
łączono do załącznika II w odniesieniu do wszystkich
ssaków s
łużących do produkcji żywności, z wyjątkiem
zwierz
ąt, których mleko jest przeznaczone do spożycia
przez ludzi. Wpis dla tych substancji powinien zosta
ć
rozszerzony, tak aby obejmowa
ł bydło mleczne.
(4)
Rozporz
ądzenie (EWG) nr 2377/90 powinno zostać
odpowiednio zmienione.
(5)
W celu uwzgl
ędnienia przepisów niniejszego rozporzą-
dzenia, przed stosowaniem niniejszego rozporz
ądzenia
nale
ży przewidzieć odpowiedni okres, aby umożliwić
Pa
ństwom Członkowskim dokonanie wszelkich dosto-
sowa
ń, które mogą okazać się konieczne w świetle
niniejszego rozporz
ądzenia, dotyczących zezwoleń na
wprowadzenie do obrotu wymienionych weterynaryjnych
produktów leczniczych wydanych zgodnie z dyrektyw
ą
2001/82/WE Parlamentu Europejskiego i Rady z dnia 6
listopada 2001 r. w sprawie wspólnotowego kodeksu
odnosz
ącego się do weterynaryjnych produktów leczni-
czych (
2
).
(6)
Środki przewidziane w niniejszym rozporządzeniu są
zgodne z opini
ą Stałego Komitetu ds. Weterynaryjnych
Produktów Leczniczych,
PRZYJMUJE NINIEJSZE ROZPORZ
ĄDZENIE:
Artykuł 1
Za
łączniki I i II do rozporządzenia (EWG) nr 2377/90 zostają
zmienione zgodnie z Za
łącznikiem do niniejszego rozporzą-
dzenia.
Artykuł 2
Niniejsze rozporz
ądzenie wchodzi w życie trzeciego dnia po
jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporz
ądzenie stosuje się od dnia 11 lipca 2005 r.
Niniejsze rozporz
ądzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich
Pa
ństwach Członkowskich.
Sporz
ądzono w Brukseli, dnia 11 maja 2005 r.
W imieniu Komisji
Günter VERHEUGEN
Wiceprzewodniczący
PL
12.5.2005
Dziennik Urz
ędowy Unii Europejskiej
L 120/3
(
1
) Dz.U. L 224 z 18.8.1990, str. 1. Rozporz
ądzenie ostatnio zmie-
nione rozporz
ądzeniem Komisji (WE) nr 75/2005 (Dz.U. L 15
z 19.1.2005, str. 3).
(
2
) Dz.U. L 311 z 28.11.2001, str. 1. Dyrektywa ostatnio zmieniona
dyrektyw
ą 2004/28/WE (Dz.U. L 136 z 30.4.2004, str. 58).
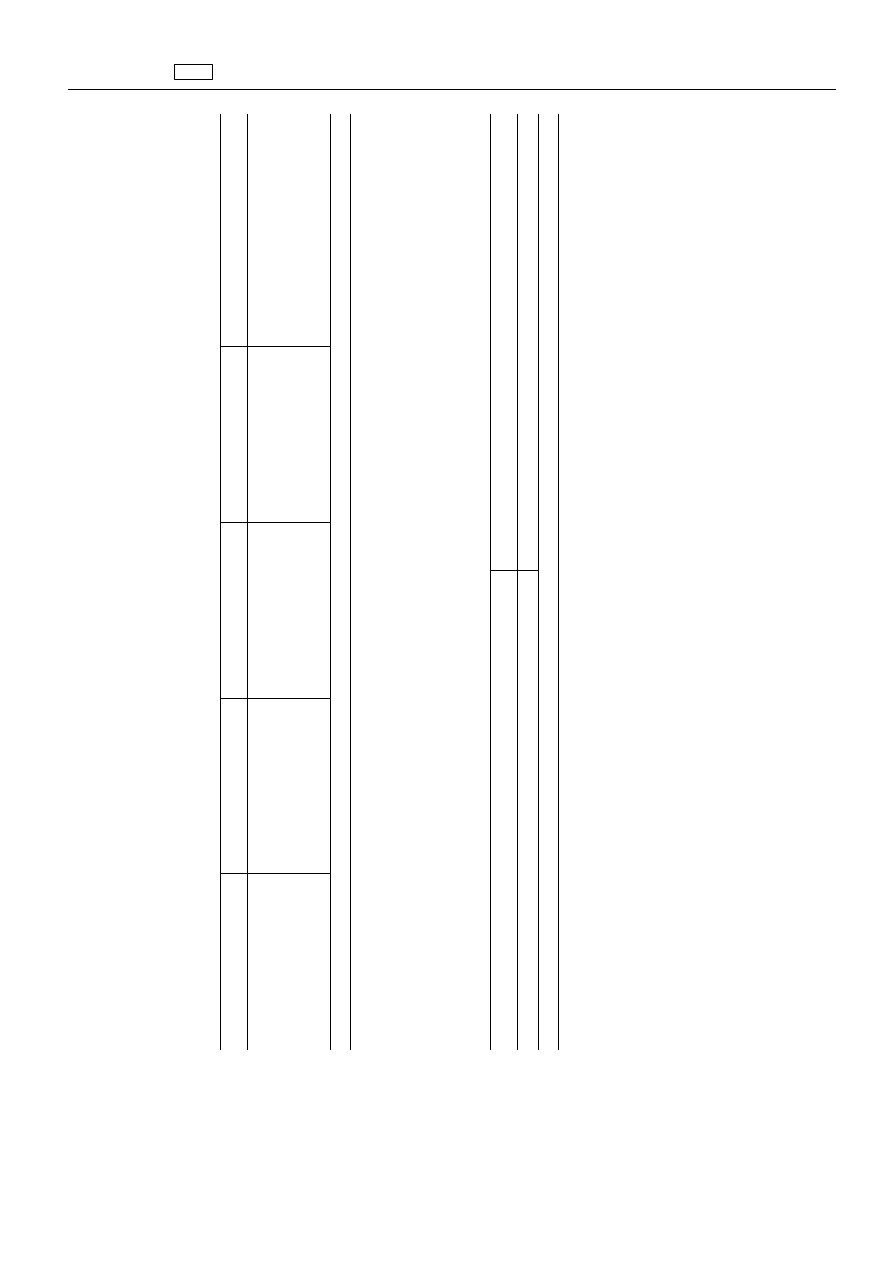
ZA
ŁĄ
CZNIK
A.
Do
za
łą
cznika
I
do
rozporz
ądzenia
(EWG)
nr
2377/90
wprowadza
się
nast
ępuj
ące
substancje
2.
Środki
przeciw
paso
żytom
2.4.
Środki
dzia
łaj
ące
przeciw
pierwotniakom
2.4.4.
Jonofory
Substancja
czynna
farmakologicznie
Pozosta
ło
ść
znacznikow
a
Gatunki
zwierz
ąt
Maksymalne
limity
pozosta
ło
ści
Tkanki
docelowe
„Lasalocid
Lasalocid
A
Drób
(
1
)2
0
μg/kg
Mi
ęś
nie
100
μg/kg
Skóra
+
tł
uszcz
100
μg/kg
W
ątroba
50
μg/kg
Nerki
(
1
)
Nie
stosowa
ć
u
zwierz
ąt,
których
jaja
są
przeznaczone
do
spo
życia
przez
ludzi.
”
B.
Do
za
łą
cznika
II
do
rozp
orz
ądzenia
(EWG)
nr
2377/90
wprowadza
się
nast
ępu
ją
ce
substancje
2.
Zwi
ązki
organiczne
Substancja
czynna
farmakologi
cznie
Gatunki
zwierz
ąt
„Bituminosulfoniany,
amon
i
sole
sodowe
Wszystkie
ssaki
sł
użą
ce
do
produkcji
żywno
ści
(
1
)
(
1
)W
yłą
cznie
do
stosowania
miejscowego.
”
PL
L 120/4
Dziennik Urz
ędowy Unii Europejskiej
12.5.2005
Wyszukiwarka
Podobne podstrony:
Dz U 2005 225 1934 wersja 05 12 01
Sadownictwo ćw 09.12.2005 i 05.01.2006, SADOWNICTWO
Murarz 712[06] 1997 05 12
Ściskanie sprawko 05 12 2014
05 12 2011
ei 2005 05 s050
ei 2005 05 s092
2005 05 R odp
finansowość zarządcza 05 05 12
2005 05 44
2005 04 12
ei 2005 05 s008
1386217 05 12 19raportanalitycznysokow sopkołow
ei 2005 05 s022 id 154158 Nieznany
ei 2005 05 s024
Ortografia 8 05 12
05,12,14
więcej podobnych podstron