
OSTRE ZESPOŁY
WIEŃCOWE
Katedra Patofizjologii Collegium Medicum
Uniwersytetu Jagiellońskiego


• Ostre
zespoły
wieńcowe
(OZW)
są
konsekwencją
nagłego
zaburzenia
równowagi pomiędzy zapotrzebowaniem
mięśnia sercowego na tlen a podażą tlenu.
• Najczęstszą ich przyczyną jest nagłe
ograniczenie drożności tętnicy wieńcowej
przez zakrzep powstający na uszkodzonej
blaszce miażdżycowej.

I.
Ostry zespół bez uniesienia ST
A. Niestabilna dławica piersiowa
(UA – unstable angina)
B. Zawał mięśnia sercowego bez uniesienia ST
(NSTEMI – Non - ST Elevation Myocardial Infarction)
II.
Zawał mięśnia sercowego z
uniesieniem ST
(STEMI – ST Elevation
Myocardial Infarction)

Ostry zespół bez uniesienia ST
• Świeże
lub
narastające
ograniczenie
przepływu krwi przez tętnicę wieńcową
(UA), doprowadzając u części chorych do
martwicy
małych
obszarów
mięśnia
sercowego
(NSTEMI)
ze
wzrostem
stężenia markerów martwicy (troponiny
sercowe)
we
krwi,
bez
świeżego
uniesienia odcinka ST w EKG.

Niestabilna dławica piersiowa
(UA – unstable angina)
• Okres znacznego klinicznego nasilenia
choroby niedokrwiennej, będącym stanem
bezpośredniego zagrożenia wystąpieniem
zawału serca lub nagłym zgonem.
• U chorych z rozpoznaniem dusznicy
niestabilnej ocenia się ryzyko takiego
rokowania. Gdy ryzyko jest średnie lub
duże pacjent powinien być leczony na
oddziale intensywnej opieki.

Zawał mięśnia sercowego bez uniesienia ST
(NSTEMI – Non - ST Elevation Myocardial Infarction)
• Martwica
małych
obszarów
mięśnia
sercowego
ze
wzrostem
stężenia
markerów martwicy we krwi.

• Ból nie ustępuje w ciągu 5 min. po
zakończeniu
działania
czynnika
wywołującego lub po przyjęciu nitrogliceryny
podjęzykowo, lecz trwa dłużej i może się
pojawiać w spoczynku.
• W
szczególnych
przypadkach
mogą
wystąpić objawy nietypowe lub słabo
nasilone
(chorzy
z
cukrzycą,
z
niewydolnością nerek, w podeszłym wieku
oraz u kobiet)!!!

Zawał mięśnia sercowego z uniesieniem ST
(STEMI – ST Elevation Myocardial Infarction)
• Zespół kliniczny spowodowany nagłym
zmniejszeniem lub ustaniem przepływu
krwi przez tętnicę wieńcową w wyniku jej
zamknięcia,
co
prowadzi
do
niedokrwienna
a
następnie
martwicy
mięśnia sercowego.

Etiologia i patogeneza
I.
Zakrzep rozwijający się na podłożu zmian
miażdżycowych (85%),
II.
Zator w krążeniu wieńcowym,
III. Zapalenie, uraz lub tętniak w tętnicach
wieńcowych,
IV. Wrodzone anomalie tętnic wieńcowych,
V. Stenoza zastawki aortalnej,
VI. Skurcz tętnicy wieńcowej,
VII. Zwiększona gęstość i lepkość krwi,
VIII. Leki naczynioskurczowe
(dopamina, A, NA)
.
I. Zakrzep na podłożu zmian miażdżycowych (85%)
A. Blaszka miażdżycowa
B. Zwiększona miejscowa skłonność do zakrzepicy
C. Skurcz naczyń wieńcowych
Uszkodzenie mechanizmów
chroniących przed zakrzepicą
Nasilenie mechanizmów
sprzyjających powstawaniu zakrzepu
pękanie blaszki
miażdżycowej z odsłonięciem
kolagenu i aktywacją
krzepnięcia,
turbulentny przepływ krwi z
uszkodzeniem i degranulacją
trombocytów,
zaburzenie produkcji
substancji rozszerzających
naczynia (NO, PGI) oraz
przeciwzakrzepowych (t-PA,
PGI, siarczanu heparanu,
trombomoduliny).
TXA2 uwalniany z rozpadających
się trombocytów,
zaburzenie produkcji substancji
rozszerzających naczynia (NO, PGI)

II. Zator w krążeniu wieńcowym
zapalenia wsierdzia z odsłonięciem
włókien kolagenowych,
zniszczenia zastawek serca,
wszczepienia sztucznych zastawek.

VI. Skurcz tętnicy wieńcowej
efekt
rozwoju
blaszki
miażdżycowej:
TXA2 uwalniany z rozpadających się
trombocytów
+
zaburzenie
produkcji
substancji rozszerzających naczynia (NO,
PGI),
kokaina.

VII. Zwiększona gęstość i lepkość krwi
czerwienica prawdziwa,
nadkrwistości,
trombocytemia lub trombocytoza.

Mechanizmy komórkowe zawału mięśnia sercowego
• Zamknięcie naczynia wieńcowego doprowadza do
przejścia metabolizmu tlenowego na beztlenowy w
zaopatrywanym przez to naczynie miokardium.
• Beztlenowa glikoliza jest przyczyną nagromadzenia
kwasu mlekowego, w wyniku tego obniżenia pH, co
już po 2 minutach od początku niedokrwienia
zmniejsza
kurczliwość
i
podatność
mięśnia
sercowego.
• Zmiana metabolizmu miokardium wiąże się ze
spadkiem stężenia wewnątrzkomórkowego ATP
(dysproporcja między nadmiernym zużyciem a małą produkcją ATP)
.
To z kolei przez upośledzenie funkcjonowania pomp
jonowych
doprowadza
do
istotnych
zmian
elekrolitowych.

Niedobór ATP:
1. upośledzona funkcja przezbłonowej Na
+
/K
+
ATP-azy
(wzrost Na
+
wewnątrzkom. i K
+
zewnątrzkom.
(zaburzenia przezbłonowego potencjału elektrycznego
);
2. wzrostu stężenia wapnia wewnątrzkom.
(upośledzenie
funkcji ATP-azy wapniowej, aktywacja pompy Na
+
/Ca
2+
w efekcie
wzrostu stężenia Na
+
wewnątrzkom., uwalnianie Ca
2+
z retikulum
endoplazma- tycznego)
;
3. wzrostu stężenia Na
+
i Ca
2+
wewnątrzkom.
(prowadzi do
obrzęku komórki) - wysokie stężenie wapnia we wnętrzu komórki poza
nasilaniem
jej
obrzęku
aktywuje
enzymy
(proteazy,
lipazy)
uszkadzające struktury komórkowe.

• Zawał mięśnia sercowego, a zwłaszcza reperfuzja, są
przyczyną powstania w miejscu niedokrwienia typowego
ogniska zapalnego.
• Komórkami o silnym działaniu destrukcyjnym w tym
obszarze są aktywowane granulocyty obojętnochłonne -
mają one istotny wpływ na ostateczny obszar martwicy.
• Czynnikiem aktywującym granulocyty jest komplement,
głównie jego składowa C5. Aktywowane granulocyty migrują
w kierunku ogniska zapalnego lub ulegają masywnej adhezji
i agregacji w świetle drobnych naczyń krwionośnych. Mogą
nawet prowadzić do ich niedrożności, co oczywiście nasila
niedokrwienie.
• W przebiegu reperfuzji zjawisko to ulega nasileniu, gdyż
udrożnione
naczynie
umożliwia
napływ
kolejnych
granulocytów do segmentów o znacznej koncentracji
aktywowanych składowych dopełniacza.

• Toksyczność
aktywowanych
granulocytów
obojętnochłonnych
wynika
z
faktu,
że
uwalniają one szereg substancji o działaniu
destrukcyjnym:
- wolne rodniki tlenowe,
- proteazy lizosomalne
(elastaza, kolagenaza,
katepsyna, mieloperoksydaza)
,
- poch. kw. arachidonowego
(TXA2
–
naczynioskurczowe
dz.,
LTB4
–
naczynioskurczowe + chemotaktyczne),
- czynnik aktywujący płytki (PAF),
- czynnik martwicy nowotworów (TNFalfa)
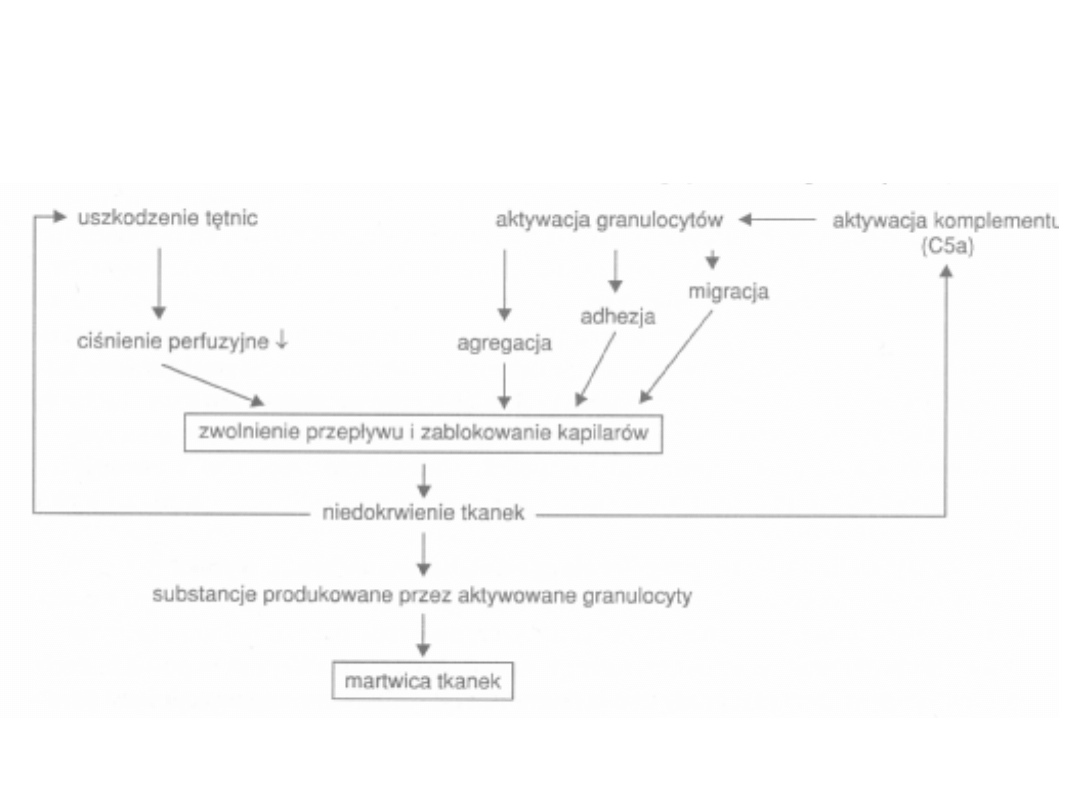
Rola granulocytów w zawale mięśnia
sercowego i reperfuzji

Zawał serca
• Głównie LK, również PK, w przedsionkach lub przegrodzie.
• Zawał PK:
prawa tętnica wieńcowa lub dominująca gałąź
okalająca lewej tętnicy wieńcowej,
wysokie ciśnienie napełniania PK + często ostra
niedomykalność zastawki trójdzielnej + obniżona
objętość minutowa,
zawał prawej komory powinien być brany pod uwagę
u każdego chorego z zawałem ściany tylno-dolnej,
obniżonym ciśnieniem lub wstrząsem i zwiększonym
wypełnieniem żył szyjnych.

• Zawał
pełnościenny
obejmuje
całą
grubość ściany mięśnia od nasierdzia do
wsierdzia,
z
wykształceniem
w
EKG
patologicznego, tj. głębokiego i szerokiego
załamka Q.
• Zawał
podwsierdziowy
nie
obejmuje
ściany na całej jej grubości i zmiany w EKG
ograniczone są do zaburzeń w zakresie
odcinka
ST
i
załamka
T.
Obejmuje
wewnętrzną część mięśnia, gdzie napięcie
ściany jest największe, a przepływ krwi
najbardziej
wrażliwy
na
zmiany
mechaniczne cyklu sercowego.

• Anatomiczny zakres martwicy nie może być
klinicznie określony,
zawał klasyfikowany
jest na podstawie obrazu EKG jako zawał
„z załamkiem Q” lub „bez załamka Q”.
• Rozległość zawału można ocenić pośrednio
na
podstawie
wysokości
i
czasu
utrzymywania się podwyższonego stężenia
kinazy kreatynowej (CK) oraz jej frakcji
sercowej (CK-MB).

• Zdolność
serca
do
utrzymania
swojej
czynności
mechanicznej jest bezpośrednio zależna od rozległości
uszkodzenia mięśnia. U chorych, którzy zmarli z powodu
wstrząsu kardiogennego, obszar zawału lub kombinacji
blizny i nowego zawału wynosił więcej niż
50%
lewej
komory.
• Zawały ściany przedniej zwykle są większe i mają gorsze
rokowanie niż zawały dolno-tylne.
• Zawał ściany przedniej jest zwykle następstwem zamknięcia
lewej tętnicy wieńcowej,
a w szczególności gałęzi
międzykomorowej przedniej.
• Zawały dolno-tylne spowodowane są zamknięciem prawej
tętnicy wieńcowej lub dominującej gałęzi okalającej lewej
tętnicy wieńcowej.

Rozległość obszaru zawału:
• masy mięśnia zaopatrywanej przez zamknięte naczynie,
• wydolności krążenia obocznego,
• zapotrzebowania niedokrwionej tkanki na tlen.
Diagnostyka zawału
wywiad z charakterystycznym bólem w klatce piersiowej,
badanie fizykalne,
zapis EKG,
diagnostyka enzymatyczna.

Objawy kliniczne w
zawale mięśnia
sercowego
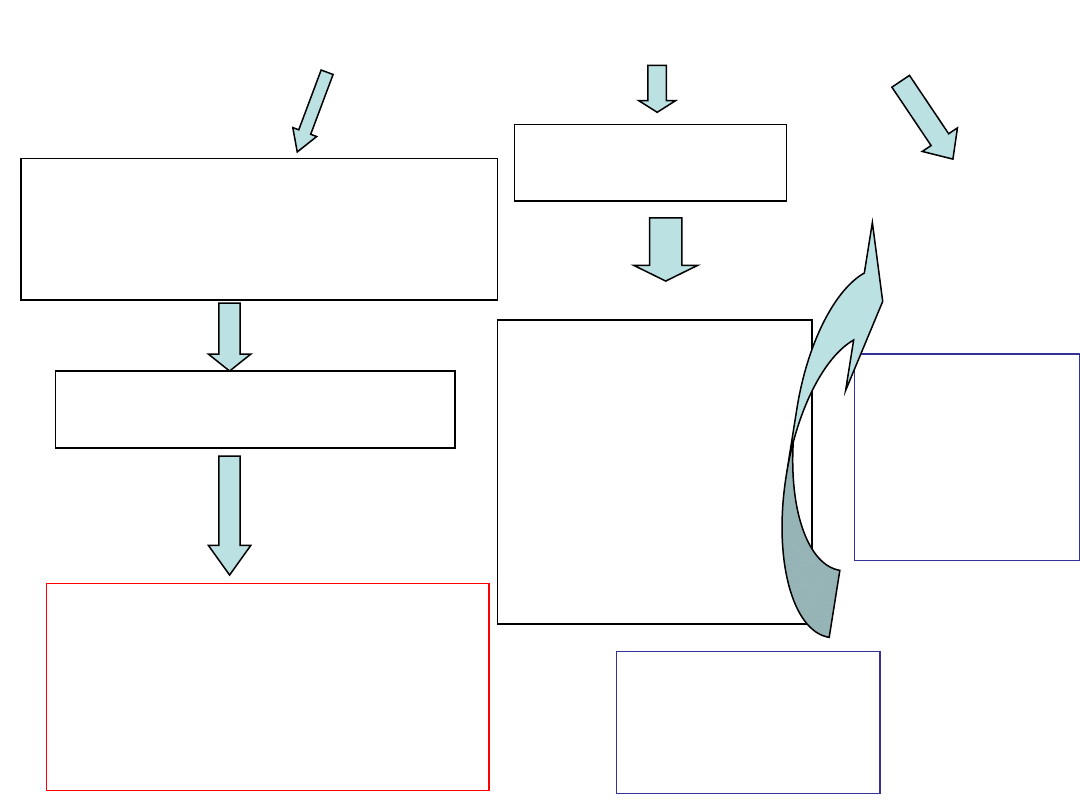
Zawał mięśnia sercowego
Metabolity niedotlenionego mięśnia
(kwas
mlekowy,
adenozyna),
K
+
uwalniany z komórek mięśniowych
oraz mediatory procesu zapalnego
Pobudzenia chemoreceptorów
bólowych
ból za mostkiem, promieniujący
do karku, żuchwy, lewego barku
i ramienia, lewej kończyny
górnej, utrzymujący się w
spoczynku i po podaniu
nitrogliceryny
pobudzenia układu
współczulnego
bladość, silna potliwość,
wymioty, osłabienie, lęk,
aktywowanego przez
ból wieńcowy oraz
odbarczenie
baroreceptorów
tętniczych w wyniku
spadku rzutu
minutowego serca
zaburzenia
rytmu serca
MIGOTANIE
KOMÓR
Zjawisko
mikroreentry wokół
uszkodzonej
mięśniówki
uszkodzenie
układu
przewodzącego,
pobudzenie
układu
współczulnego
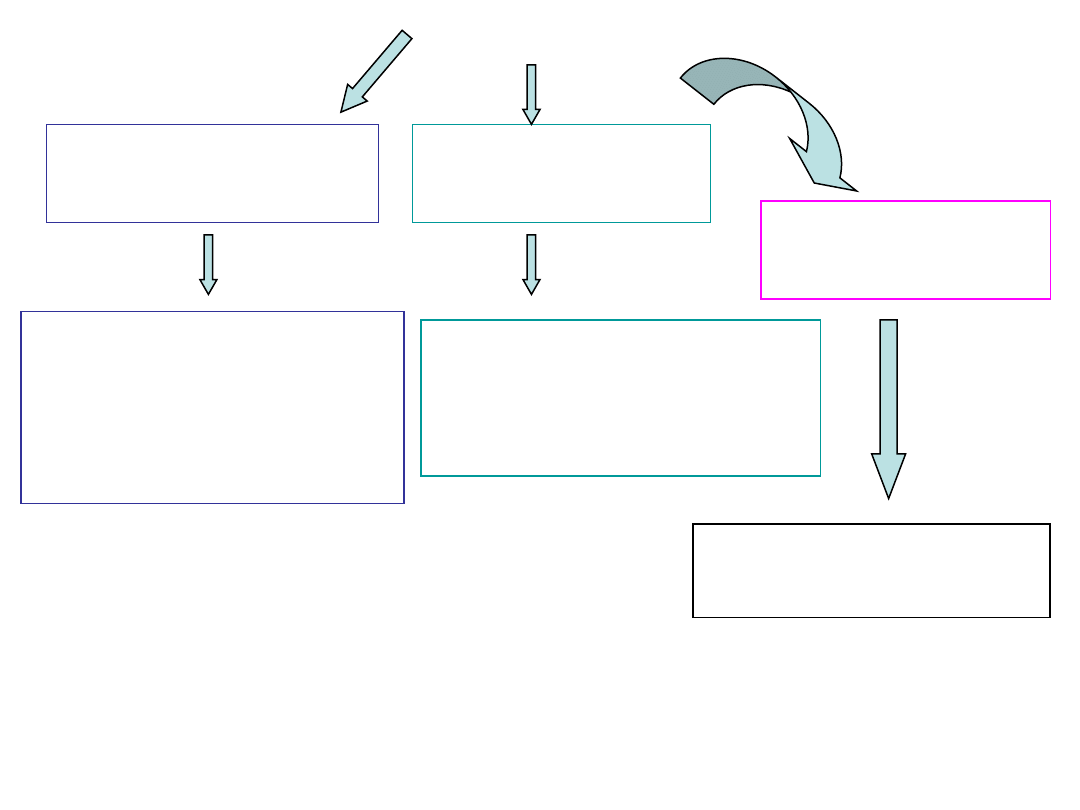
Zawał
Niewydolność
rozkurczowa LK
obrzęk płuc (duszność,
tachypnoe, rzężenia u
podstawy płuc, kaszel z
odkrztuszaniem pienistej
plwociny).
Niewydolność
skurczowa LK
u chorych z zawałem:
spadek CTK oraz wzrost
CTK po pobudzeniu układu
współczulnego
Niewydolność
PK
Niewydolność LK, zawał
PK, zawał ściany dolnej
obrzęki na podudziach,
wypełnienie żył szyjnych

• Zawał serca może powodować wystąpienie
objawów
ogólnoustrojowego
zapalenia
wywołanych
obecnością
martwych
włókien
mięśniowych, które aktywują uwalnianie II-1 i
TNFalfa oraz aktywację układu dopełniacza
przez makrofagi ściany naczyń, gorączkę,
osłabienie,
↑
OB,
↑
leukocytozy
(obraz
przesunięty w lewo), ↑ glikemii.
• Osłabienie, nudności, wymioty – aktywacja
układu przywspółczulnego.

Diagnostyka elektrokardiograficzna
1. Pierwsze godziny — uszkodzenie niedokrwienne mięśnia
sercowego bez martwicy
• uniesienie odcinka ST, wysoki i symetryczny załamek T,
• możliwe obniżenie załamka R.
2. Pierwsza doba — pojawia się strefa martwicy
• fala Parde’ego,
• maleje amplituda załamka R.
3. Druga doba — martwica obejmuje całą grubość ściany
• obniżenie odcinka ST, odwrócenie załamka T,
• patologiczny załamek Q o czasie > O,04s i amplitudzie > 1/4 załamka R.
4. Po kilku dniach
• patologiczny załamek Q,
• brak załamka R (zespół QS),
• odcinek ST w linii izoelektrycznej.
5. Zawal niepełnościenny
• uniesienie lub obniżenie odcinka ST,
• odwrócenie załamka T.
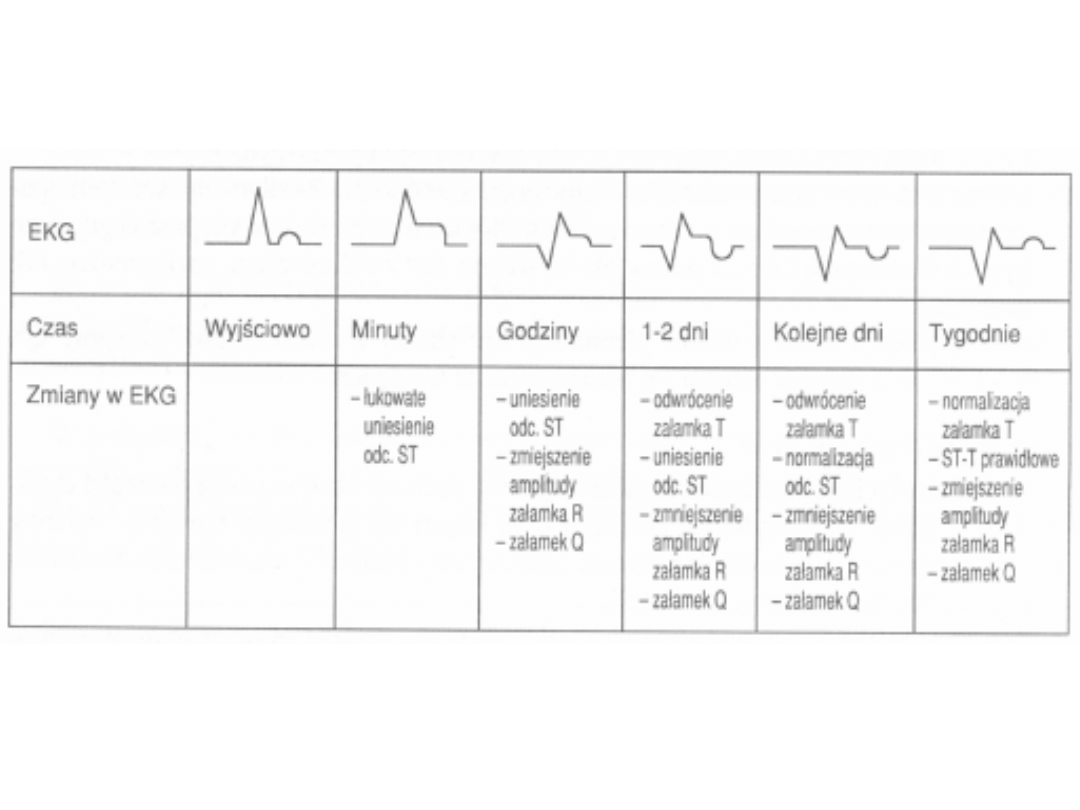
Ewolucja zawału mięśnia sercowego

Zmiany odcinka ST
•
W warunkach fizjologicznych komórki warstwy podnasierdziowej mają potencjał
czynnościowy, który rozpoczyna się poźniej i trwa krócej od potencjału komórek warstwy
podwsierdziowej. To warunkuje kierunek depolaryzacji komór od wsierdzia do
nasierdzia oraz odwrotny kierunek repolaryzacji.
•
Zmiany odcinka ST są nąjbardziej charakterystyczną zmianą obserwowaną w zapisie EKG
w czasie niedokrwienia. Ich przyczyną jest zmiana potencjału czynnościowego
niedokrwionych komórek.
•
W okresie rozkurczu niedokrwione komórki cechują się patologiczną przepuszczalnością
dla jonów, co prowadzi do ich częściowej depolaryzacji. W wyniku tego potencjał
spoczynkowy uszkodzonych komórek jest mniej ujemny niż komórek zdrowych. Ta różnica
potencjałów między uszkodzonym i zdrowym obszarem miokardium warunkuje tzw.
rozkurczowy prąd uszkodzenia, którego wektor skierowany jest od obszaru uszkodzenia
(obszar uszkodzenia mniej ujemny, czyli dodatni w stosunku do zdrowego miokardium).
•
Rozkurczowy prąd uszkodzenia ma bezpośredni wpływ na zmiany odcinka TP.
•
Natomiast wcześniejsza repolaryzacja komórek niedokrwionych (wcześniej uzyskują
ujemny potencjał błonowy) jest przyczyną tzw. skurczowego prądu uszkodzenia o wektorze
skierowanym w stronę uszkodzenia.
•
Skurczowy prąd uszkodzenia ma bezpośredni wpływ na zmiany odcinka ST.
•
Ostatecznie kierunek przemieszczenia odcinka ST zależy od lokalizacji niedokrwienia
(niedokrwienie podnasierdziowe lub podwsierdziowe).

•
Niedokrwienie podnasierdziowe:
a) w czasie rozkurczu występuje rozkurczowy prąd uszkodzenia od
nasierdzia do wsierdzia (komórki podnasierdziowe mają potencjał
mniej ujemny). Z tego powodu odcinek TP znad tego obszaru jest
przesunięty ku dołowi;
b) w czasie skurczu występuje skurczowy prąd uszkodzenia od wsierdzia
do nasierdzia wywołując uniesienie odcinka ST.
•
Niedokrwienie podwsierdziowego: sytuacja odwrotna!
a) w czasie rozkurczu między uszkodzonymi komórkami warstwy
podwsierdziowej a komórkami zdrowymi powstaje prąd uszkodzenia
skierowany od wsierdzia do nasierdzia, czyli w stronę elektrod EKG,
powodując przesunięcie ku górze odcinka TP;
b) w czasie skurczu występuje skurczowy prąd uszkodzenia o kierunku
od nasierdzia do wsierdzia prowadząc do obniżenia odcinka ST.
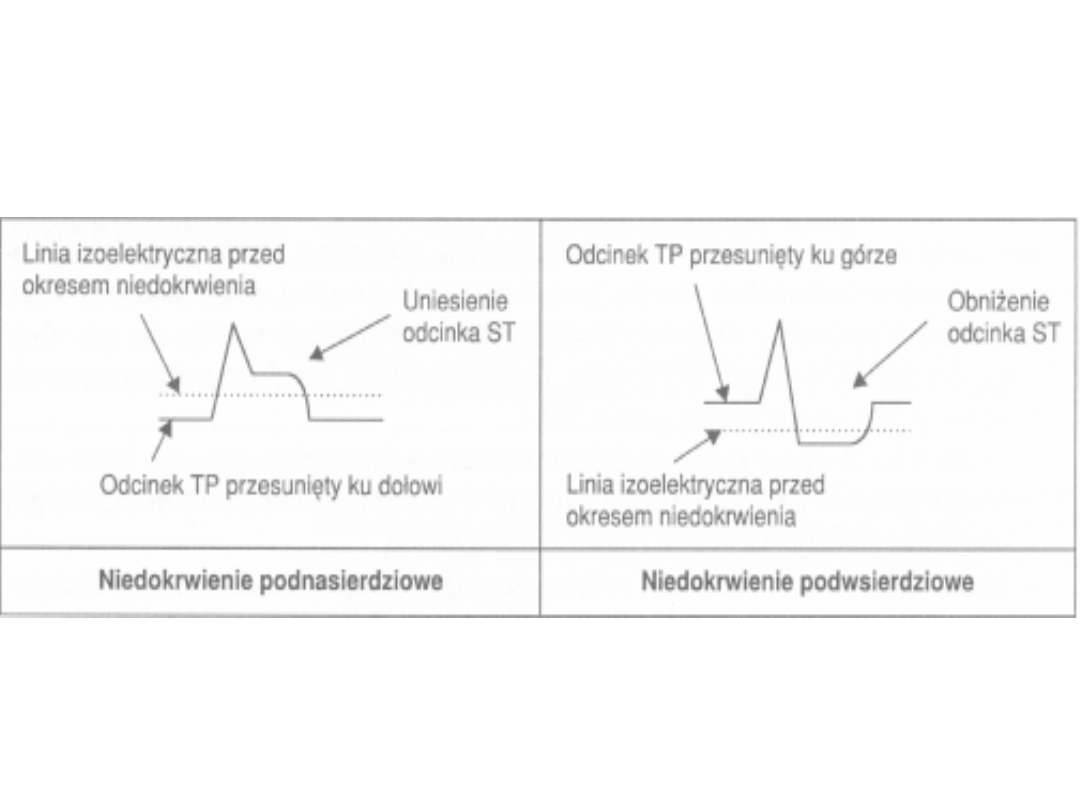
Mechanizm powstawania zmian ST-T w niedokrwieniu
podnasierdziowym i podwsierdziowym

• W przypadku zawału mięśnia sercowego
obejmującego całą grubość miokardium
zmiany w EKG odcinka ST są takie, jak w
niedokrwieniu
podnasierdziowym,
a
uniesienie
odcinka
ST
wypukłością
skierowane ku górze, obserwowane w
pierwszych godzinach zawału, określane
jest jako
fala Pardee’go
.

Markery uszkodzenia mięśnia sercowego
• Troponiny
- czuły wskaźnik jego uszkodzenia.
Troponina C składa się z troponiny I i troponiny T.
Wzrost: 3 h do 14 dni.
• Wzrost
frakcji sercowej kinazy kreatynowej CK-MB
pojawia się we
krwi po około 6 h od powstania martwicy mięśnia. Podwyższona
aktywność enzymu utrzymuje się 36-48 h.
• Dehydrogenaza kwasu mlekowego (LDH)
wzrasta później i
utrzymuje się dłużej (7-9 dni) w surowicy niż CK-MB.
• Obecność
mioglobiny
uwalnianej z uszkodzonych miocytów w
surowicy można stwierdzić kilka godzin po zawale. W warunkach
klinicznych istnieją trudności z jej oznaczeniem, ponieważ wzrost
poziomu w surowicy nie utrzymuje się dłużej niż 24 godz.
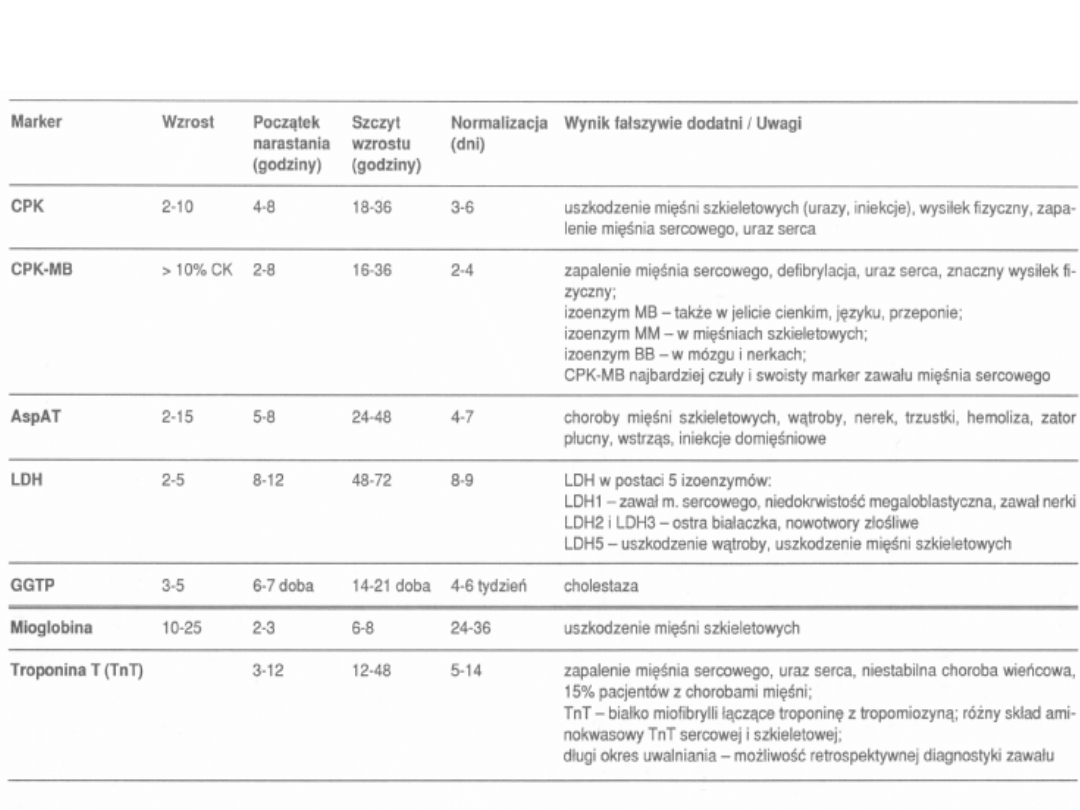
Diagnostyka laboratoryjna zawału mięśnia sercowego

Konsekwencje niedokrwienia mięśnia sercowego
• W świeżym zawale LK występuje dysfunkcja lewej
komory, która może być spowodowana: martwicą
mięśnia
sercowego,
ogłuszeniem
żywotnego
mięśnia sercowego pozostałego w obszarze
zawału
(utrzymującym
się
upośledzeniem
kurczliwości
mimo
poprawy
perfuzji)
oraz
hibernacją
żywotnego
mięśnia
sercowego
(upośledzenie
kurczliwości
spowodowane
niedokrwieniem,
które
może się cofnąć po
reperfuzji).

Ogłuszenie mięśnia sercowego
STUNNING (1)
•
Opóźnienie powrotu pełnej sprawności mięśnia sercowego po okresie
niedokrwienia.
•
W
sytuacji:
ostrego
epizodu
niedokrwienia,
skutecznego
leczenia
trombolitycznego, po zabiegu kardiochirurgicznym, gdy przepływ wieńcowy
powraca do normy.
•
Spontaniczne ustępowanie zaburzeń kurczliwości może trwać do 60 min., kilku
godzin, a nawet do kilku tygodni, pomimo szybkiego przywrócenia przepływu.
•
W praktyce klinicznej możemy to zjawisko obserwować u chorych z niestabilną
chorobą wieńcową, w dławicy naczynioskurczowej (angina Printzmetala), po
operacjach
kardiochirurgicznych
z
kardioplegią,
skutecznej
terapii
trombolitycznej, po rewascularyzacji wieńcowej metodą angioplastyki (PTCA)
oraz w świeżym zawale serca w pierwszych godzinach od wystąpienia bólu
zawałowego.

• Patomechanizm tego zjawiska nie jest w pełni
poznany.
Opóźnienie
powrotu
czynności
mechanicznej, pomimo przywrócenia przepływu
wieńcowego,
stanowi
prawdopodobnie
formę
ogłuszenia, wynikającą z połączenia uszkodzenia
miocytów, wywołanego przez wolne rodniki, głównie
nadtlenkowe, powstające w trakcie reperfuzji oraz
przeładowania komórki jonami Ca
++
, w czasie
niedokrwienia lub reperfuzji, ze zmniejszeniem
wrażliwości miofibrylli na wapń (
teoria wapniowa
).
Ogłuszenie mięśnia sercowego
STUNNING (2)

Zamrożenie mięśnia sercowego
HIBERNATION (1)
• Część mięśnia sercowego potencjalnie niedokrwiona ze
względu na zwężenie naczynia jakby zasypia i budzi się po
zabiegu rewaskularyzacyjnym.
• W
zamrożeniu
mięsień
sercowy
jest
przewlekle
niedokrwiony, a przepływ krwi wystarcza jedynie dla
podtrzymania żywotności komórek.
• Patomechanizm tego zaburzenia polega na tym, że mięsień
sercowy w niedokrwionym obszarze, w walce o przetrwanie,
dla
zachowania
integralności
komórki,
umożliwienia
kontynuowania
pracy
ATP-zależnej
pompy
sodowo-
potasowej oraz enzymów, uruchamia aktywne mechanizmy
adaptacyjne,
kosztem
zmniejszenia
wydatków
energetycznych na pracę mechaniczną mięśnia. W ten
sposób dochodzi do jego zamrożenia.

• Teorie wyjaśniające zjawisko zamrożenia. Utrzymujący się
przewlekle niedostateczny przepływ krwi może powodować
zmniejszenie kurczliwości m. sercowego i zwiększać reakcje
ochronne.
• Zamrożony
mięsień
sercowy
może
być
poddawany
kolejnym epizodom niedokrwienia, po których po reperfuzji
następuję ogłuszenie miocardium. Duża liczba kolejnych
epizodów ogłuszenia ulega zsumowaniu, prowadząc do
zamrożenia mięśnia.
• Powrót kurczliwości zamrożonego m. sercowego po
wykonaniu
skutecznego
zabiegu
rewascularyzacji
i
przywróceniu odpowiedniej perfuzji określonego obszaru
miocardium.
Zamrożenie mięśnia sercowego
HIBERNATION (2)
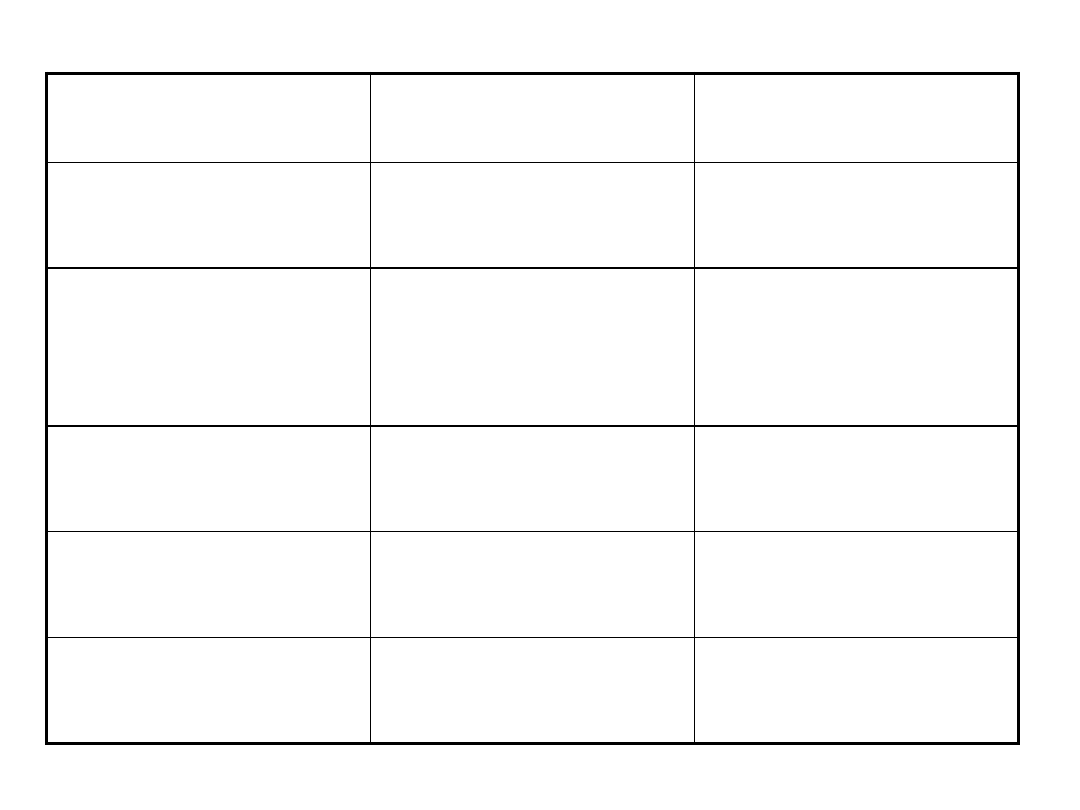
Ogłuszenie
Zamrożenie
Żywotność mięśnia
sercowego
Zachowana
Zachowana
Zaburzenia
kurczliwości
Spontanicznie
odwracalne
Odwracalne po
rewaskularyzacji
Rezerwa
skurczowa
Zachowana
Zachowana
Przepływ
wieńcowy
Prawidłowy
Upośledzony
Metabolizm
glukozy
Bez zmian
Podwyższony

• Reperfuzja
w
czasie
20-30
min.
umożliwia
powrót
prawidłowej
czynności
mięśnia,
z
okresem
zaburzeń
kurczliwości
(ogłuszone
miokardium), w wyniku: przejściowej
hiperkalcemii
wewnątrzkomórkowej,
generacji wolnych rodników tlenowych
(↑ Ca
++
, ↑ napływu 0
2
), upośledzenia
mechanizmów oksydoredukcyjnych.

• Odległą konsekwencją niedokrwienia mięśnia sercowego, a zwłaszcza
martwicy mięśnia sercowego jest
zjawisko remodelingu (przebudowy)
serca
.
• Jest to przerost objętościowy komór serca, wskutek przyrostu włókien
mięśniowych na długość bez ich pogrubienia oraz bez zmiany długości
sarkomerów oraz procesu włóknienia mięśnia sercowego.
• Patogeneza tego zjawiska jest związana ze wzrostem aktywacji konwertazy
angiotenzyny i nadmiernym wytwarzaniem angiotensyny II. Angiotensyna II
pobudza fibroblasty do produkcji kolagenu oraz zwiększa uwalnianie
czynników wzrostowych w mięśniu sercowym (TGF-beta1, VEGF, Il-1beta,
Il-2, TNFalfa)).
• W patogenezie tego zjawiska nie można pominąć roli układu współczulnego,
którego aktywacja prowadzi do zmniejszenia przepływu nerkowego i w
konsekwencji wzrostu uwalniania reniny przez kłębuszki nerkowe.

Powikłania zawału
mięśnia serca

1. Zaburzenia rytmu serca
2. Wstrząs kardiogenny
3. Ostra niewydolność lewokomorowa
4. Ostra hipotonia
(odruchowa wagotonia z bradykardią,
hipowolemia, zawał PK)
5. Powikłania mechaniczne zawału
6. Zespół pozawałowy
7. Ponowny zawał
8. Zastoinowa niewydolność krążenia
9. Nagła śmierć sercowa

• Zaburzenia rytmu i przewodnictwa mogą być wyrazem uszkodzenia
węzła zatokowego, węzła A-V lub tkanki przewodzącej.
• Zaburzenia czynności węzła zatokowego występują wtedy, gdy
zamknięcie
tętnicy
powoduje
niedokrwienie
węzła
zatokowego,
zwłaszcza u osób w podeszłym wieku, z uprzednią niedomogą węzła.
• Niemiarowości zagrażające życiu - główna przyczyna śmierci w ciągu
pierwszych 72 h zawału - obejmują tachykardię, która obniża objętość
minutową i ciśnienie krwi, pobudzenia przedwczesne komorowe, bloki A-
V, częstoskurcz komorowy, a zwłaszcza migotanie komór. Blok A-V z
wolnym rytmem komór jest zwykle objawem masywnego zawału ściany
przedniej.
• Utrzymująca się tachykardia zatokowa jest na ogół niepomyślnym
objawem, oznaczającym często niewydolność LV i małą objętość
wyrzutową.

• Przedwczesne pobudzenia przedsionkowe, migotanie przedsionków i
trzepotanie przedsionków występują u około 10% chorych z zawałem serca i
mogą być oznaką niewydolności LK lub zawału obejmującego prawy
przedsionek.
Przedwczesne
pobudzenia
przedsionkowe
są
często
zapowiedzią utrwalonej niemiarowości przedsionkowej.
• Zaburzenia przewodnictwa A-V: ważne jest dokładne elektrokardiograficzne
ustalenie
mechanizmu
występujących
bloków
A-V.
Zaburzenia
przewodzenia typu Mobitz I (periodyka Wenckebacha) występują często,
szczególnie w zawale ściany dolnej, obejmującym obszar tylnej ściany lewej
komory. Blok typu Mobitz II z wypadaniem pobudzeń komorowych lub blok
A-V z wolną pracą komór i szerokimi zespołami komorowymi są zwykle
niepomyślnym objawem rozległe go zawału ściany przedniej.

• Komorowe pobudzenia przedwczesne występują u większości
chorych w ostrej fazie zawału serca. Komorowe pobudzenia
przedwczesne, zwłaszcza z krótkim czasem sprzężenia,
wieloogniskowe lub w salwach są niebezpieczne, ponieważ
mogą przejść w utrwaloną niemiarowość komorową -
tachykardię lub migotanie komór.
• Zatrzymanie
krążenia
w
następstwie
częstoskurczu
komorowego lub migotania komór.
• Niewydolność serca po ostrym zawale serca zwykle dotyczy
LK. Objawy kliniczne zależą od rozległości zawału, stopnia
zwiększenia
obciążenia
wstępnego,
obniżenia
objętości
wyrzutowej. Śmiertelność jest wprost proporcjonalna do stopnia
niewydolności LK.

•
Hipoksemia wynika z zaburzeń stosunku wentylacja/przepływ płuc i związana jest
ze śródmiąższowym obrzękiem płuc oraz nagromadzeniem się płynu
przesiękowego w pęcherzykach płucnych.
•
Obniżone ciśnienie krwi w świeżym zawale serca może być następstwem
zmniejszonego powrotu żylnego lub osłabienia siły skurczu mięśnia. Zmniejszone
napełnianie lewej komory jest najczęściej spowodowane zmniejszonym
napływem żylnym w następstwie małej objętości krwi, szczególnie u chorych
intensywnie leczonych diuretykami pętlowymi, ale także może być skutkiem
zawału prawej komory, który charakteryzuje się wysokim ciśnieniem w prawym
przedsionku, małą objętością minutową i obniżeniem ciśnienia krwi.
•
Wstrząs kardiogenny charakteryzuje się spadkiem ciśnienia tętniczego krwi,
tachykardią, zmniejszeniem diurezy, zaburzeniami świadomości, wzmożonym
poceniem się, zimną i wilgotną skórą. Jest to ciężki stan o poważnym rokowaniu.
Śmiertelność wynosi 65%. Wstrząs kardiogenny jest najczęściej powikłaniem
rozległego zawału ściany przedniej, gdy utrata czynnego mięśnia lewej komory
przekracza 50%.

Nawracające niedokrwienie
• Bóle zamostkowe w czasie zawału przeważnie
ustępują w ciągu 12-24h. Utrzymujący się dłużej
niż 24h ból może być objawem zapalenia
osierdzia, zatoru płucnego lub innych powikłań.
• Zwykle nawracającemu niedokrwieniu towarzyszą
odwracalne zmiany w zakresie załamka T i odcinka
ST w EKG oraz podwyższenie ciśnienia tętniczego.
• Utrzymujące się objawy niedokrwienia po zawale
wskazują na dalsze zagrożenie i wymagają
leczenia jak w przypadku dławicy niestabilnej.

• Dysfunkcja mięśni brodawkowatych (35%).
Częste
osłuchiwanie
w
czasie
pierwszych godzin zawału może ujawnić
przejściowy późnoskurczowy szmer nad
koniuszkiem
serca
spowodowany
niedomykaniem
się
płatków
zastawki
mitralnej
w
następstwie
niedokrwienia
mięśnia brodawkowatego.

Uszkodzenia mięśnia serca (pęknięcie serca)
I.
pęknięcie mięśnia brodawkowatego
… ostra,
ciężka niedomykalność zastawki mitralnej …
nagłe
pojawienie
się
głośnego
szmeru
skurczowego nad koniuszkiem serca i obrzęku
płuc
II. pęknięcie
przegrody
międzykomorowej
(częściej niż I) … nagłe pojawienie się głośnego
szmeru
skurczowego,
z
towarzyszącym
spadkiem CTK i niewydolnością LK
III. pęknięcie zewnętrzne (wolnej ściany)
… nagły
spadek CTK i objawy tamponady serca.

Asynergia komór
• Wynik uszkodzenia mięśnia.
• Odcinki określane jako hipokinetyczne charakteryzują się
zmniejszoną
amplitudą
skurczową
i
częściowym
upośledzeniem ruchu dośrodkowego.
• U niektórych chorych stwierdza się rozlane obniżenie
kurczliwości mięśnia.
• W obrazie klinicznym dominują objawy niewydolności serca
z zastojem w płucach. Stan ten określa się jako
kardiomiopatię niedokrwienną.
• Obszar
dyskinetyczny
wykazuje
paradoksalny
ruch
odśrodkowy.

• Tętniak serca
jest częstym powikłaniem szczególnie w rozległych
pełnościennych zawałach serca (ściana przednia). Tętniak może się
rozwinąć w ciągu kilku dni lub tygodni
• Tętniaki mogą powodować nawracające komorowe zaburzenia rytmu i
zmniejszenie rzutu minutowego. Skrzepliny przyścienne w tętniaku lewej
komory stanowią potencjalne źródło zatorów.
• Skrzepliny przyścienne
powstają w około 20% zawału mięśnia serca.
Częstość ich występowania rośnie w rozległych zawałach ściany
przedniej. Największe ryzyko istnieje w ciągu pierwszych 10 dni, ale
utrzymuje
się
przez
około
3
miesiące.
Stosowanie
leków
przeciwzakrzepowych zmniejsza ryzyko zatorów.

• Zapalenie osierdzia
- przy częstym osłuchiwaniu u części
chorych z zawałem pełnościennym wykrywane jest tarcie
osierdziowe. Zwykle słyszalne jest w ciągu pierwszych 24-
96 h zawału. Zapalenie osierdzia w przebiegu zawału
zwykle ustępuje w ciągu 3-5 dni. Aspiryna lub inne
niesterydowe
leki
przeciwzapalne
powodują
zwykle
złagodzenie objawów.
• Zespół pozawałowy (zespół Dresslera)
- u niektórych
chorych w kilka dni, tygodni lub miesięcy po zawale rozwija
się zespół, który charakteryzuje się gorączką, zapaleniem
osierdzia z tarciem osierdziowym, wysiękiem opłucnej i
bólami
stawów.
Zespół
ten
jest
schorzeniem
autoimmunologicznym
rozwijającym
się
wtórnie
do
uszkodzenia mięśnia serca i osierdzia.

Patofizjologiczne podstawy leczenia ostrych
zespołów wieńcowych
• Cele leczenia różnią się w zależności od tego czy są to
zespoły z uniesieniem ST, czy też nie.
• U
chorych
z
UA
i
NSTEMI
główne
cele
to
przeciwdziałanie niedokrwieniu mięśnia sercowego,
leczenie
przeciwzakrzepowe,
stabilizacja
blaszki
miażdżycowej oraz prewencja wtórna.
• W STEMI celem leczenia jest przywrócenie przepływu
krwi przez tętnicę nasierdziową odpowiedzialną za
zawał i przywrócenie perfuzji mięśnia sercowego.

Leki
A. Nitrogliceryna:
rozszerzenie
naczyń
wieńcowych
oraz
naczyń
obwodowych ( ↓ obciążenia następczego).
B. Kwas acetylosalicylowy:
hamowanie powstawania TXA2 w trombocytach
… zakrzepu płytkowego i skurczu tętnic wieńcowych.
C. Heparyna:
hamowanie powstawania zakrzepu włóknikowego na drodze
aktywacji fizjologicznej antytrombiny III, blokującej czynniki Xa i IIa.
D. Beta-bloker:
hamowanie rozszerzania się strefy niedokrwiennej, spadek
zapotrzebowania m. sercowego na tlen (↓ pracy serca), wydłużenie fazy
rozkurczu (wzrost przepływu wieńcowego).
E. Trombolityk (tPA):
rekanalizacja t. wieńcowej przy udziale aktywatora
przekształcenia plazminogenu w plazminę.
F. Inhibitory konwertazy angiotenzyny (ACEi):
hamowanie remodelingu i
włóknienia mięśnia sercowego poprzez hamowanie wzrostu włókien
mięśniowych (↓ TGFbeta1) oraz samego procesu włóknienia (↓ aktywności
fibroblastów)

Dziękuję za uwagę
Wyszukiwarka
Podobne podstrony:
Ostre zespoły wieńcowe[1] popr
BIEGUNKI OSTRE popr
BIEGUNKI OSTRE popr
ostre stany w alergologii wyklad 2003
Ostre stany w otorynolaryngologii
Med Czyn Rat1 Ostre zatrucia Materialy
Ostre zapalenie wyrostka robaczkowego(1)
7 Pielegniarstwo popr
KRUS Wies Miasto
Ostre stany zagrozenia zycia w chorobach wewnetrznych
ostre białaczki 24 11 2008 (kurs)
ostre stany w endokrynologii
Ostre Zatrucie Związkami Rtęci
Ostre zapalenie otrzewnej u noworodków i niemowląt
Relacja lekarz pacjent w perspektywie socjologii medycyny popr
ostre stany w anestezjologii
ostre stany okoloporodowe
więcej podobnych podstron