
Prof. Krystyna Fabianowska - Majewska
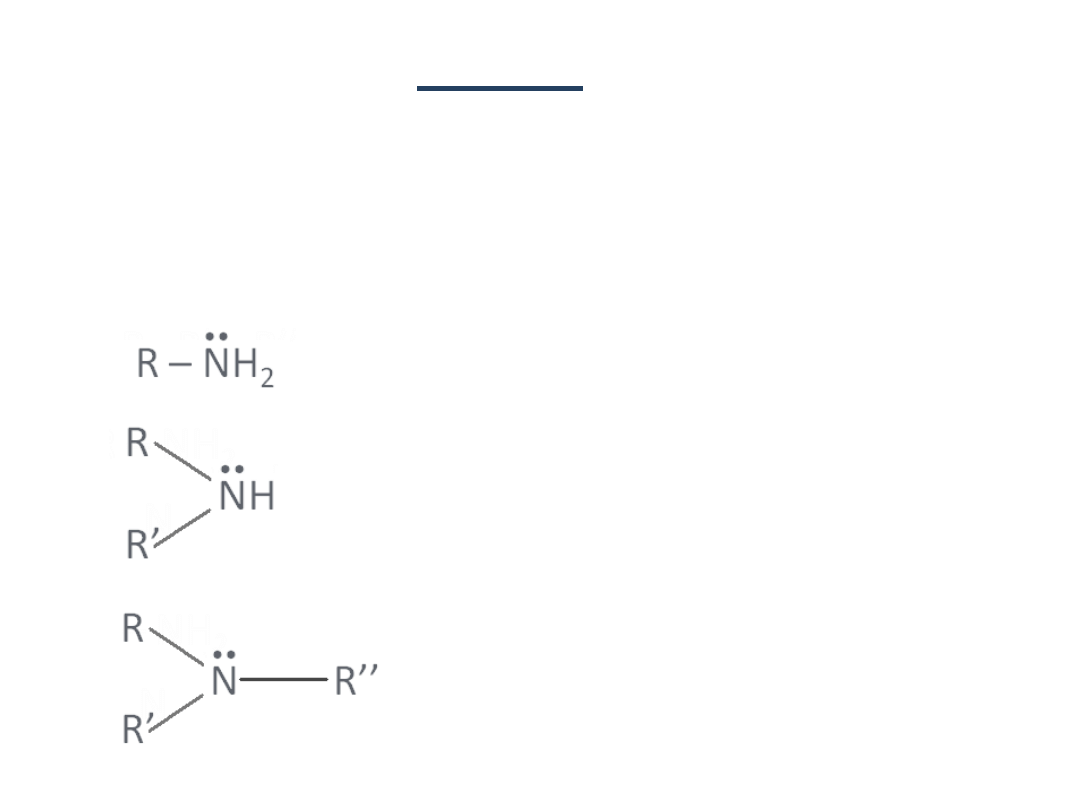
Aminy
Grupa aminowa
―NH
2
;
Aminy, to pochodne amoniaku (NH
3
), w
którym atomy
wodoru
są zastępowane rodnikami alkilowymi;
- amina I-
rzędowa;
- amina II-
rzędowa;
- amina III-
rzędowa.
Aminy
1) Otrzymywanie amin
amoniak (lub amina I-rz. lub II-rz.) + halogenek alkilowy → amina;
2) Właściwości fizyczne amin
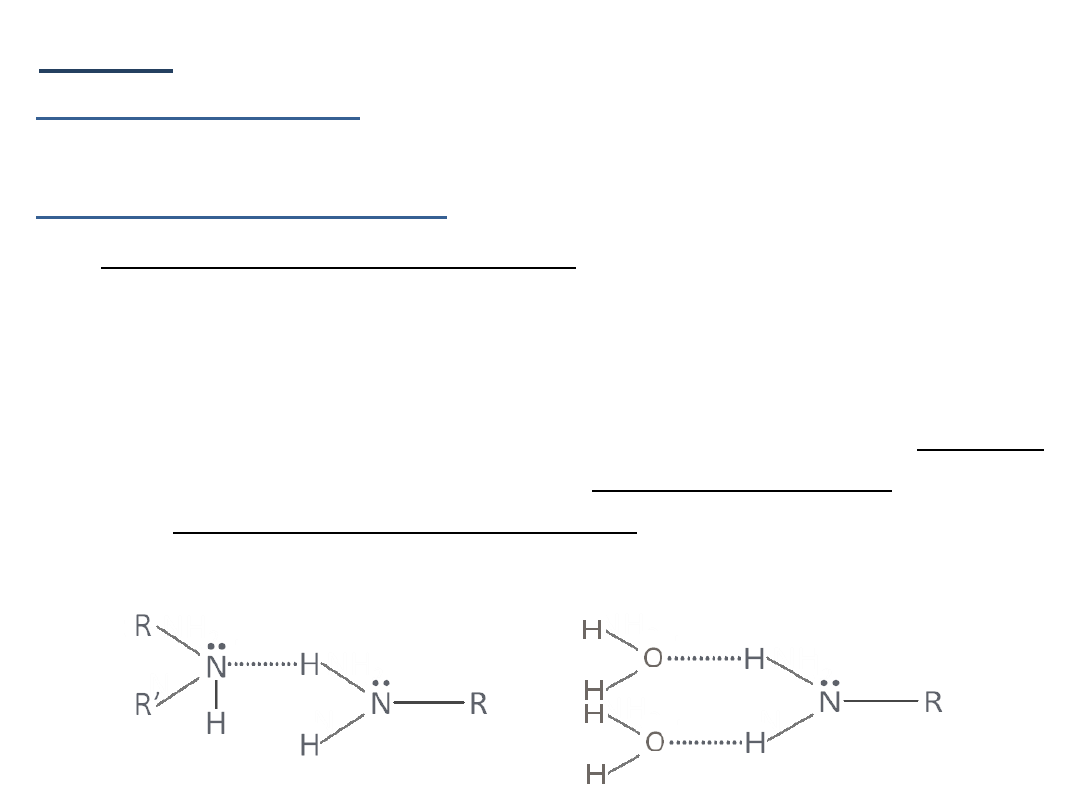
1.
Tworzenie wiązao wodorowych (nie dotyczy amin III-rz. – brak
atomu wodoru związanego z azotem);
N―H∙∙∙∙∙∙∙N to wiązanie słabsze od O―H∙∙∙∙∙∙∙O lub F―H∙∙∙∙∙∙∙F,
ponieważ atom azotu jest mniej elektroujemny niż O lub F.
2.
Konsekwencją powstawania wiązao wodorowych jest asocjacja
amin I i II-rz., czego skutkiem jest zmniejszenie lotności tych amin
oraz dobra rozpuszczalnośd w wodzie amin o krótkich łaocuchach
alkilowych
Aminy
3) Właściwości chemiczne amin
1.
Zasadowośd amin:
Moc amin:
NH
3
K
b
= 1,8 x 10
-5
(pKa = 9,25)
CH
3
NH
2
I rz. K
b
= 4,4 x 10
-4
(pKa = 10,64)
(CH
3
)
2
NH II rz. K
b
= 9,8 x 10
-4
(pKa = 10,71)
(CH
3
)
3
N III rz. K
b
= 5,1 x 10
-4
(pKa = 9,77)
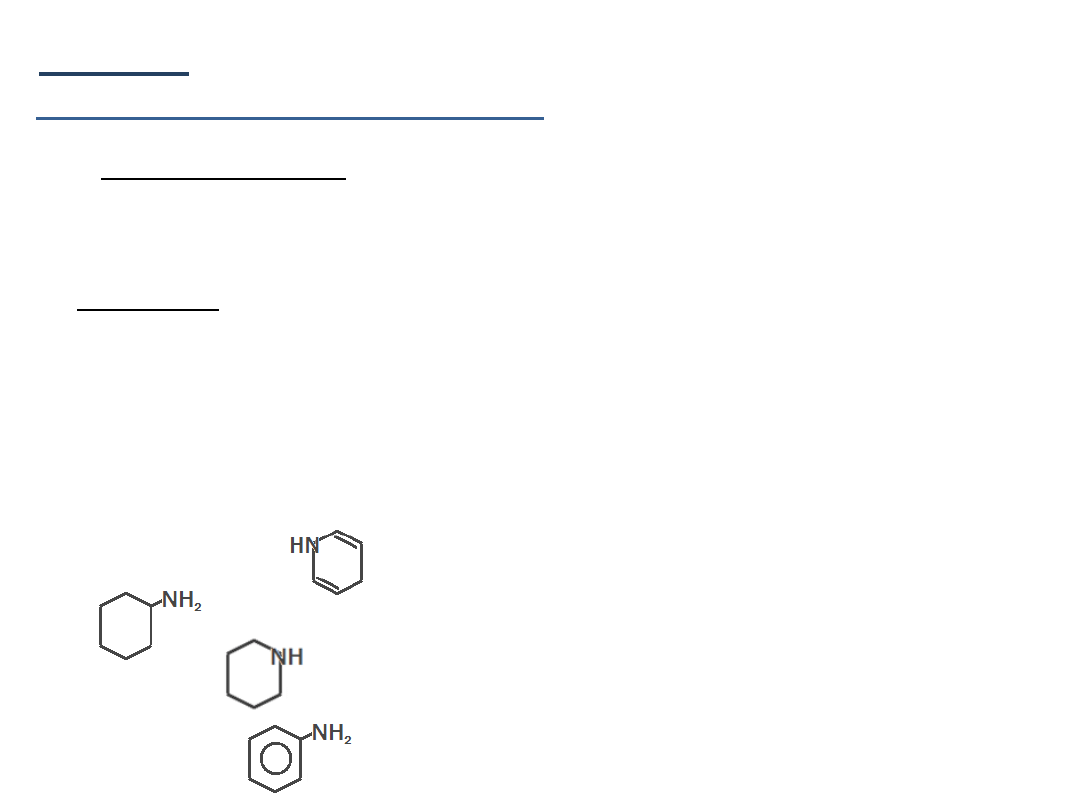
aminy alifatyczne
K
b
= 10
-4
pirydyna
K
b
= 1,8 x 10
-9
cykloheksyloamina
K
b
= 6,3 x 10
-5
piperydyna
K
b
= 1,6 x 10
-3
anilina
K
b
= 3,8 x 10
-10
R―NH
2
+ H
2
O → R―N
+
H
3
+ OH
-
••

Aminy
3)
Właściwości chemiczne amin
2.
Tworzenie soli w reakcji z kwasami:
3.
Acylowanie amin:
4.
Reakcje kondensacji ze
związkami karbonylowymi:
R―NH
2
+ HCl → *R―N
+
H
3
]
Cl
-
chlorek alkiloamoniowy
••
amina +
→
amid (związek obojętny chemicznie)
bezwodnik kwasowy
1
chlorek acylu
ester
C = O + R―NH
2
→ C = NH
imina (zasada Schiffa)
/
\
/
\
C = O +
2
HN―NH
2
→ N = NH
hydrazon
/
\
/
\
C = O + HO―NH
2
→ C = N – OH
hydroksyimina
/
\
/
\

Aminy
3)
Właściwości chemiczne amin
5.
Reakcje amin z kwasem azotowym (III):
amina I.rz + HNO
2
→ wydziela się azot
amina II.rz + HNO
2
→ R
2
N – N = O
( związki nitrowe, żółte,
nierozpuszczalne w wodzie)
Aminokwasy
Źródła aminokwasów:
pula
białek ustrojowych, które po procesach rozkładu
dostarczają aminokwasów potrzebnych do syntezy białek w
komórkach;
białka pokarmowe pozyskane w wyniku procesów trawienia
i
wchłaniania;
Biosynteza
niektórych
aminokwasów
z
kwasów
organicznych w procesie transaminacji.
Rola
aminokwasów:
synteza
białek – materiał budulcowy;
synteza innych
związków biologicznie aktywnych (enzymy,
hormony);
źródło energii, po uprzedniej deaminacji (po wyczerpaniu
innych
źródeł energii – węglowodanów i wolnych kwasów
tłuszczowych.
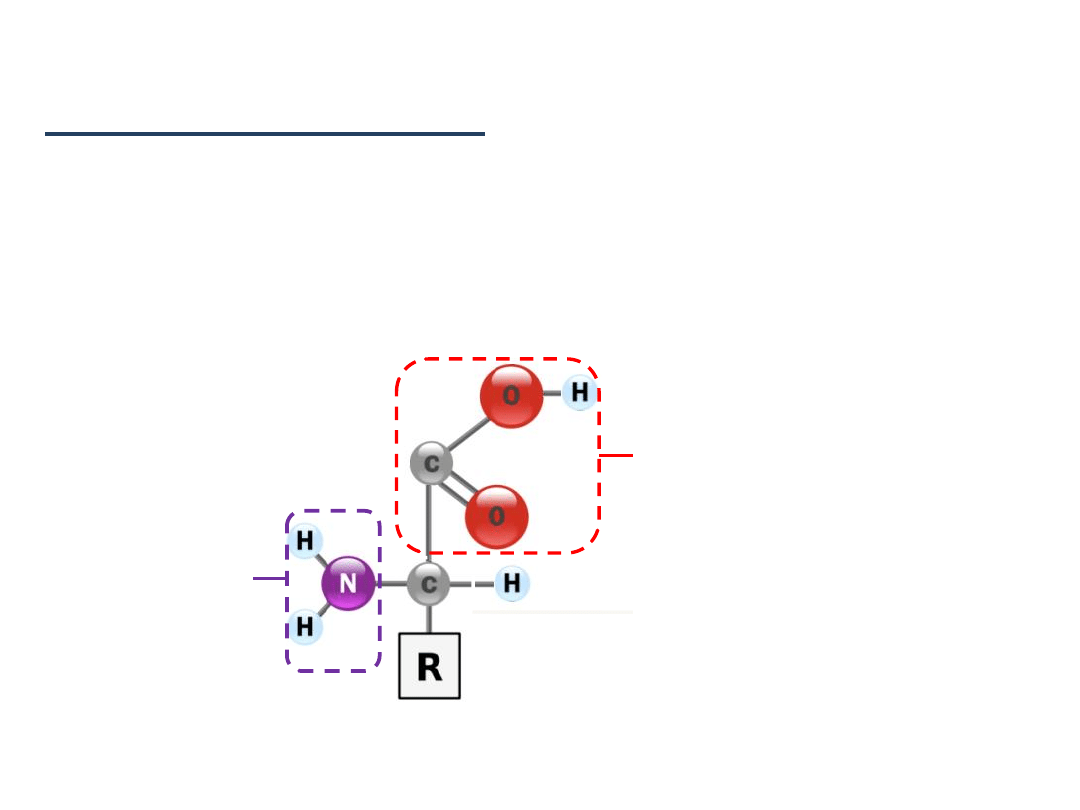
Aminokwasy
Budowa
aminokwasów:
Skład pierwiastków:
C (węgiel)
50 – 55 %
H (wodór)
6 – 7 %
O (tlen)
20 – 23 %
N (azot)
12 – 19 %
S (siarka)
0,2 – 3 %
P (fosfor)
0 – 6 %
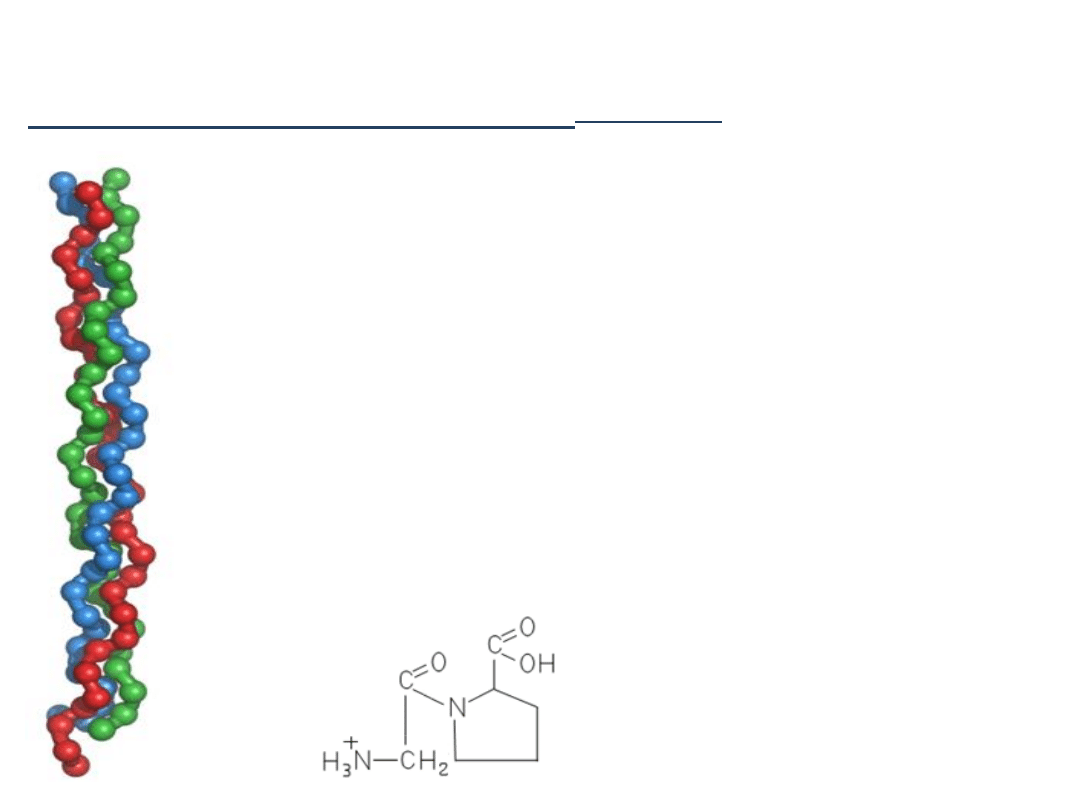
L - α - aminokwas
grupa karboksylowa
PROTONODAWCA !
α
grupa aminowa
PROTONOBIORCA !
węgiel α

Aminokwasy
Podział aminokwasów:
Egzogenne
(niezbędne, 8 aminokwasów), których organizm nie
potrafi
syntetyzować i które muszą być dostarczone z
pożywieniem tj.:
leucyna, izoleucyna, lizyna, metionina, fenyloalanina, treonina,
tryptofan, walina;
tzw.
Względnie
egzogenne
(warunkowo
niezbędne),
są
syntetyzowane
w
szczególnych warunkach (szybki wzrost,
choroba) tj.:
histydyna, arginina, seryna;
Endogenne
(nie
niezbędne) mogą być syntetyzowane w
komórkach ze związków węglowych w procesie transaminacji tj.:
alanina,
cysteina,
cystyna,
glicyna,
kwas
asparaginowy,
asparagina, kwas glutaminowy, glutamina, prolina, tyrozyna,
hydroksyprolina, hydroksylizyna.
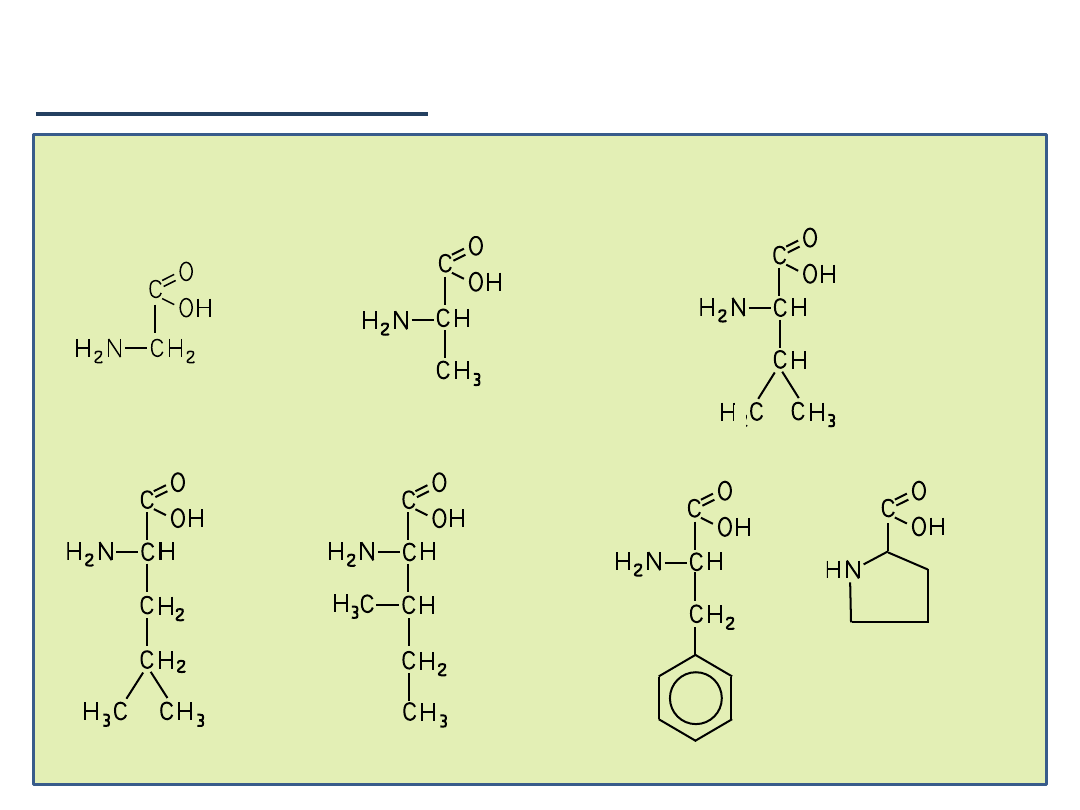
Aminokwasy
Podział aminokwasów:
1)
Aminokwasy z apolarnym łaocuchem bocznym (R):
3
Glicyna (Gly)
Alanina (Ala)
Walina (Val)
Leucyna (Leu)
Izoleucyna (Ile)
Fenyloalanina (Phe)
Prolina (Pro)
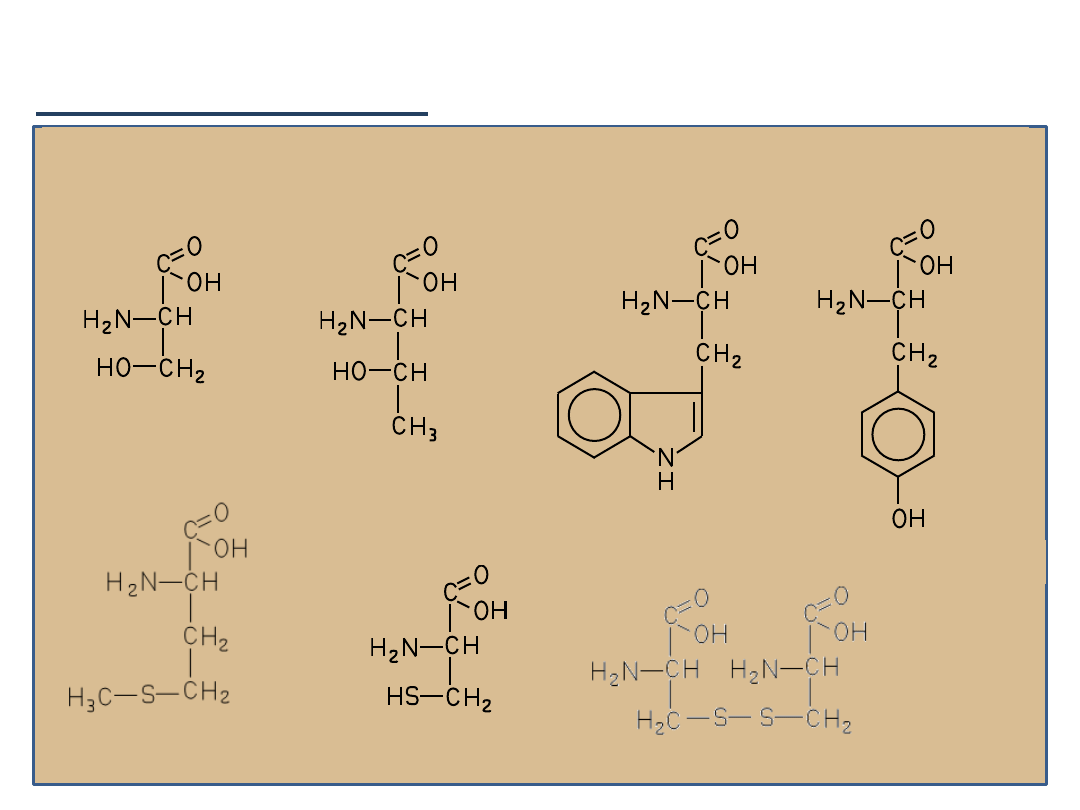
Aminokwasy
Podział aminokwasów:
2)
Aminokwasy z łaocuchem bocznym zawierającym grupę polarną,
nie ulegającą jonizacji:
Seryna (Ser)
Treonina (Thr)
Tyrozyna (Tyr)
Cysteina (Cys)
Cystyna
Metionina (Met)
Tryptofan (Trp)
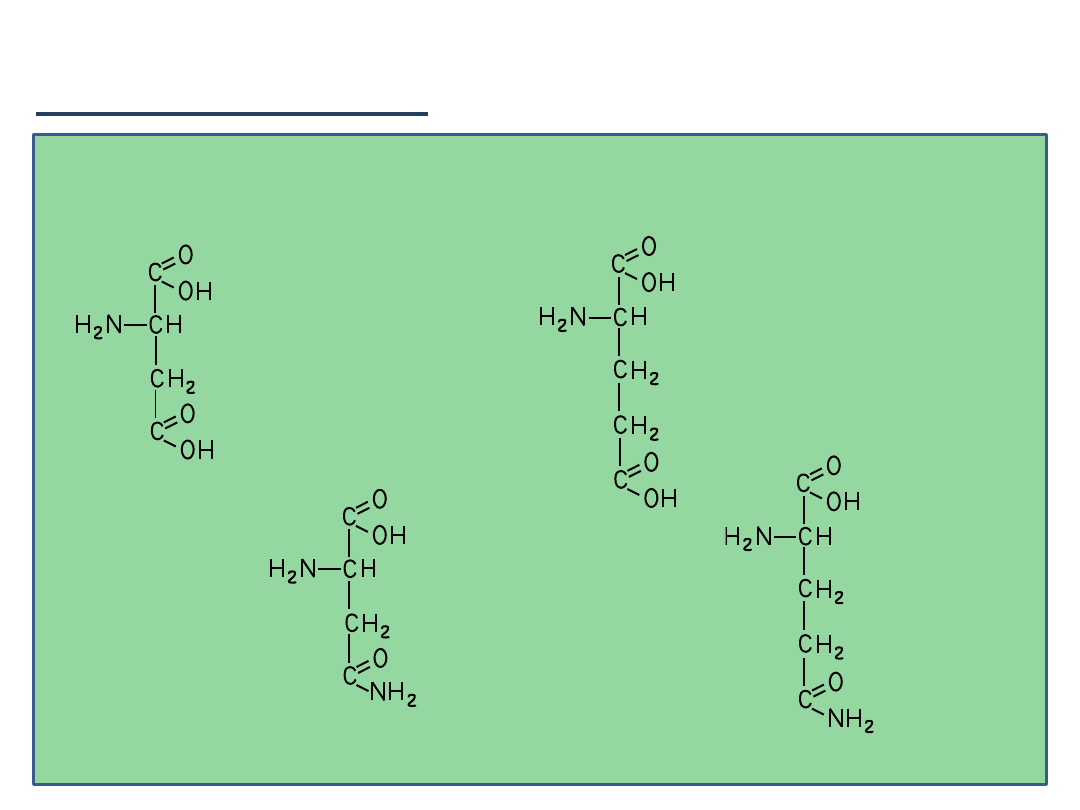
Aminokwasy
Podział aminokwasów:
Kwas asparaginowy (Asp)
Glutamina (Gln)
Asparagina (Asn)
3)
Aminokwasy zawierające drugą grupę karboksylową w łaocuchu
bocznym:
Kwas glutaminowy (Glu)
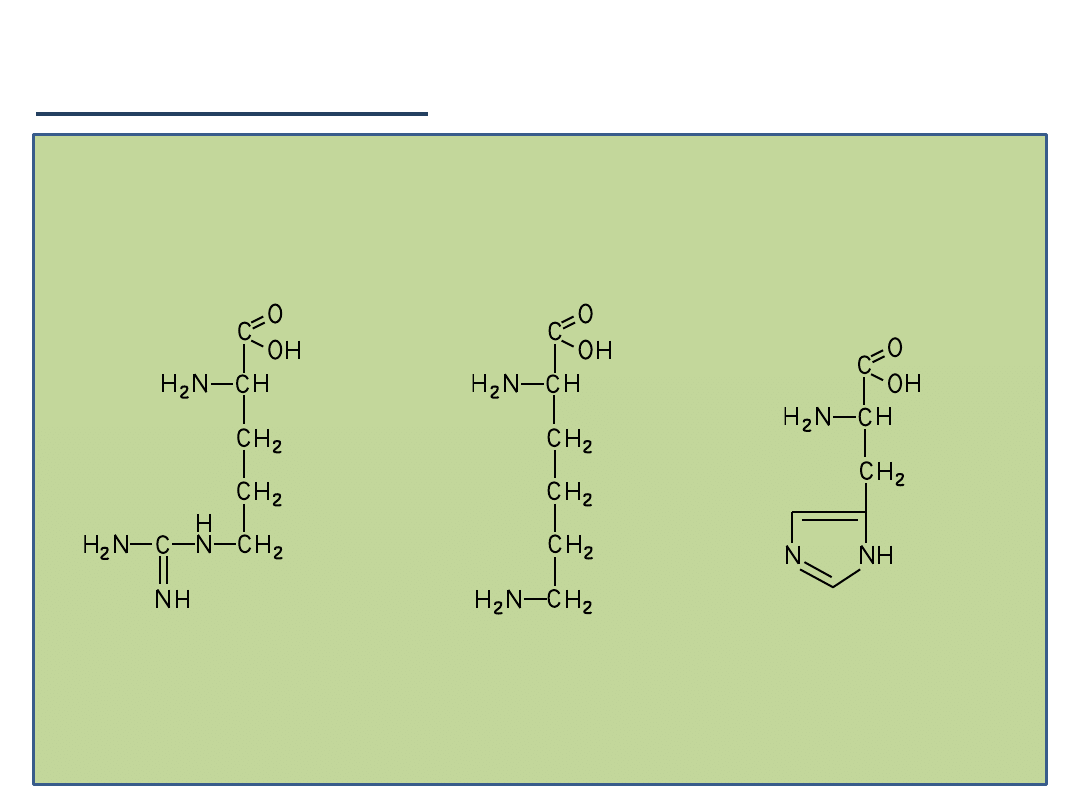
Aminokwasy
Podział aminokwasów:
Histydyna (His)
Arginina (Arg)
4)
Aminokwasy zawierające drugą grupę aminową w łaocuchu
bocznym:
Lizyna (Lys)
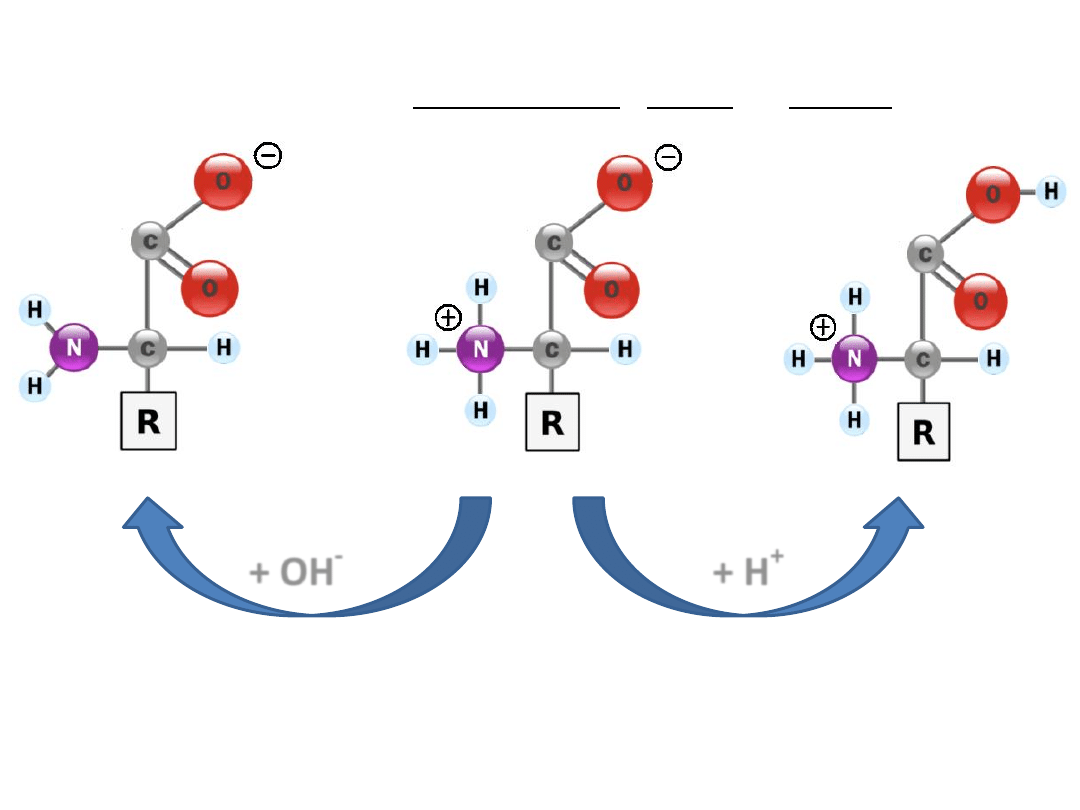
Każdy aminokwas posiada właściwości związku amfiprotycznego,
występuje jako jon obojnaczy, anion lub kation.
+ OH
-
+ H
+
Jon obojnaczy
w polu elektrycznym nie migruje ani w
stronę katody ani w stronę anody
(najmniejsza rozpuszczalnośd)
pH r-ru jonu obojniaczego to PUNKT IZOELEKTRYCZNY
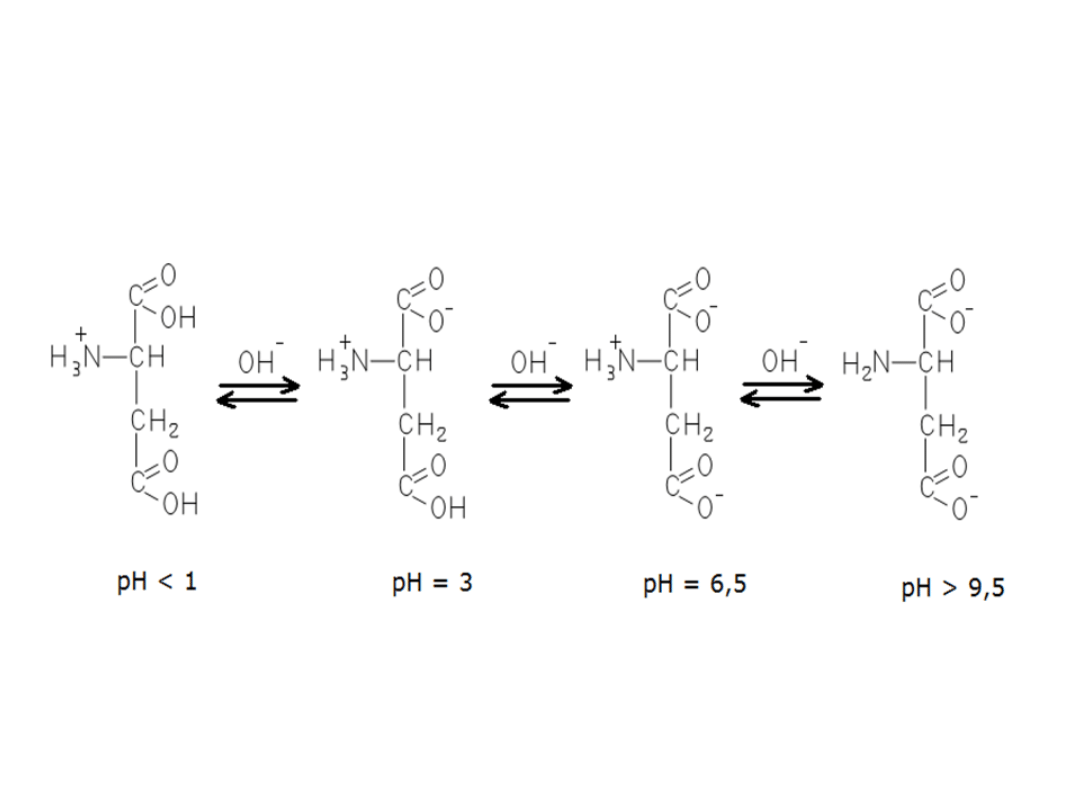
Aminokwasy
Jonizacja
aminokwasów zależy od pH roztworu (zawsze
jednak jest to forma jonowa):
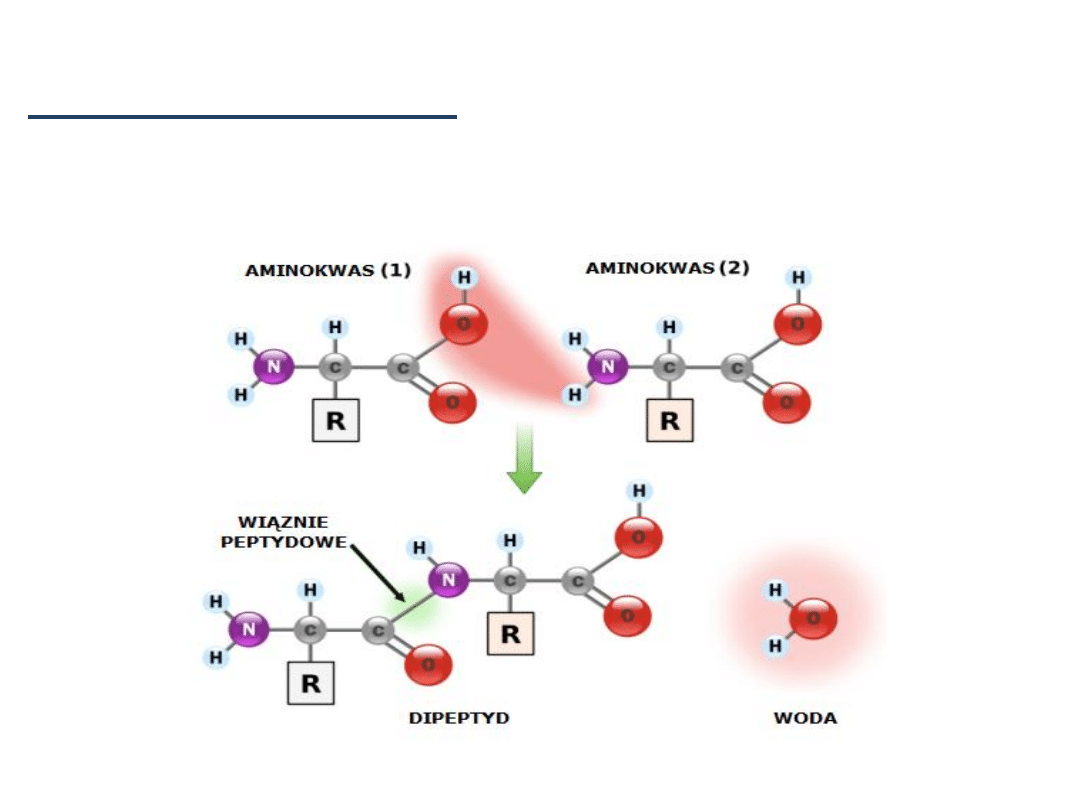
Peptydy i białka
Reakcja otrzymywania:
GRUPA KARBOKSYLOWA + GRUPA AMINOWA = AMID
(KWAS) (AMINA)
Schemat powstawania wiązania peptydowego
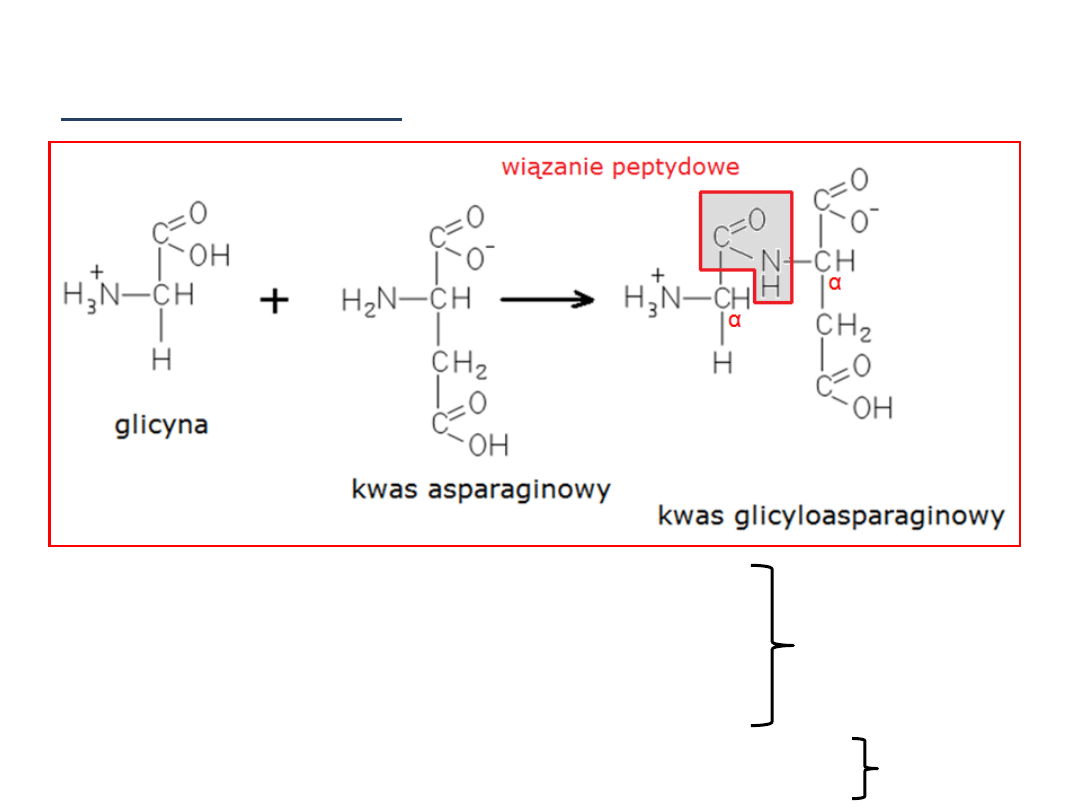
Peptydy i białka
Tworzenie dipeptydów
alanina + walina → alanylowalina (H – Ala – Val – OH)
walina + alanina → waliloalanina (H – Val – Ala – OH)
cysteina + lizyna → cysteinylolizyna (H – Cys – Lys – OH)
lizyna + metionina → lizylometionina (H – Lys – Met – OH)
DIPEPTYDY
leucyna + histydyna + fenyloalanina → leucylo-histydylo-fenyloalanina
(H – Leu – His – Phe – OH)
TRIPEPTYD
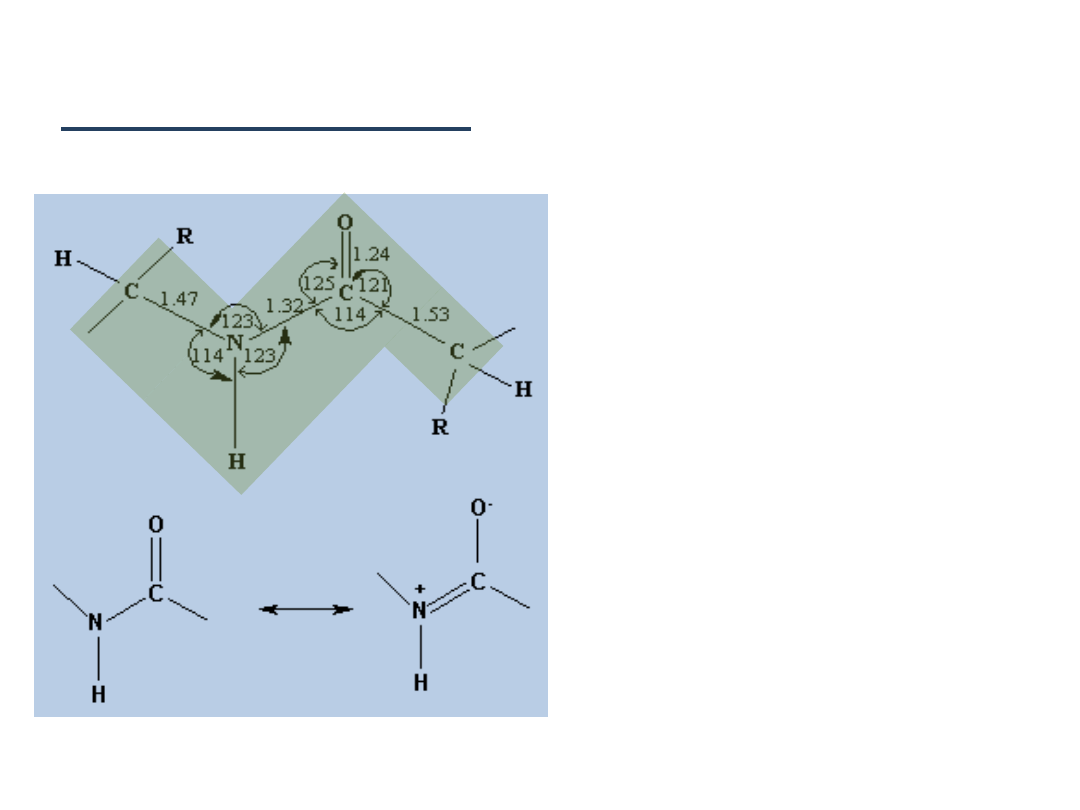
Peptydy i białka
Wiązanie peptydowe
α
α
Wiązanie peptydowe ma
charakter planarny
– płaski,
atomy wyróżnione
ciemniejszym kolorem płożone
są w jednej płaszczyźnie.
Jest to wynik mezomerii
(przemieszczenia chmury
elektronowej) w wiązaniu
peptydowym (amidowym).
α
α

Białka
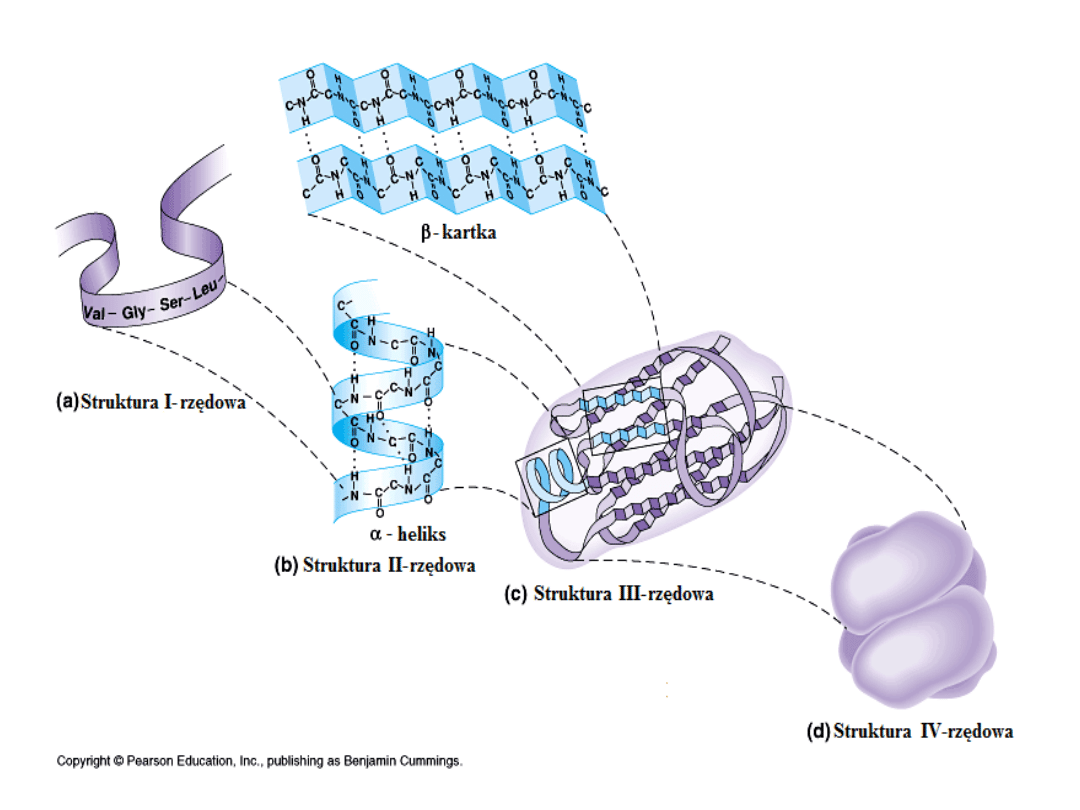
Struktura białka
•
Struktura I
–rzędowa:
sekwencja
aminokwasów –
kolejność ich ułożenia w łańcuchu polipeptydowym
(kolejność wiązań kowalencyjnych);
Strukturę tą warunkują wiązania peptydowe.
Struktura I-
rzędowa
Białka
Struktura białka
•
Struktura II
–rzędowa:
przestrzenne
ułożenie wiązań
peptydowych.
Strukturę tę utrzymują wiązania wodorowe pomiędzy
atomami
tworzącymi wiązania peptydowe.
1. Struktura
α – helisy;
2. Struktura
β – fałdowa
(inaczej nazywana strukturą
β–keratyny, β-harmonijki lub
β – kartki)
;
3. Struktura kolagenu.

Białka
Struktura II-
rzędowa białka – helisa
α
1.
Wiązania
wodorowe
pomiędzy
atomami
wiązań
peptydowych
C=O∙∙∙∙H−N tego samego łańcucha (co
czwarte
wiązanie);
2.
Każde wiązanie peptydowe zaangażowane w wiązanie
wodorowe;
3.
Węgle α aminokwasów w pozycjach „trans”;
4.
Wiązania wodorowe równoległe do osi walca;
5. Skok
śruby 0,54 nm, średnica walca 0,36 nm;
6.
Helisę destabilizują:
− reszty kwasowe (Asp i Glu);
− reszty zasadowe (Arg i Lys);
− załamanie helisy: prolina i hydroksyprolina.
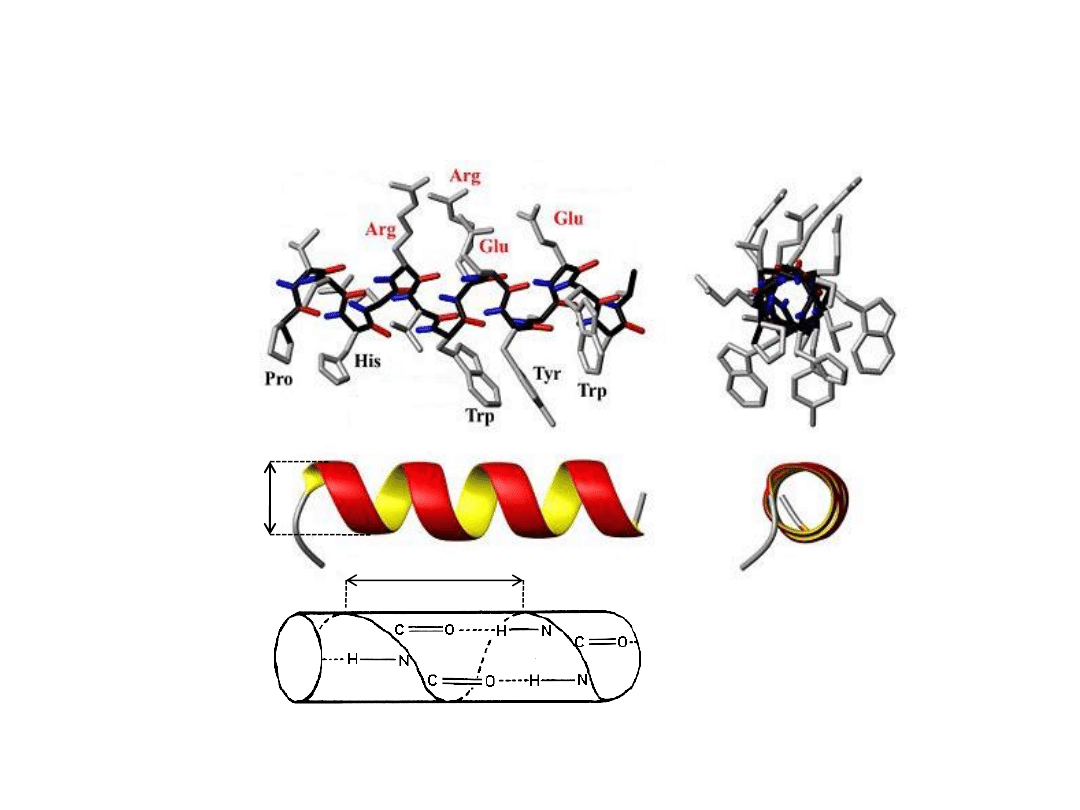
Białka
Struktura II-
rzędowa białka – helisa
α
N-koniec
C-koniec
0,36 nm
0,54 nm

Białka
Struktura II-
rzędowa białka – harmonijka
β
1.
Wiązania
wodorowe
pomiędzy
atomami
wiązań
peptydowych
C=O∙∙∙∙H−N
dwóch
łańcuchów
polipeptydowych;
2.
Wiązania
wodorowe
prostopadłe
do
łańcuchów
polipeptydowych;
3.
Najczęściej łańcuchy polipeptydowe ułożone równolegle
-
współbieżne;
− ale np.: w fibroinie jedwabiu łańcuchy przeciwbieżne –
antyrównoległe;
4. W
łańcuchach polipeptydowych tworzących tą strukturę
przeważająca obecność glicyny (Gly), alaniny (Ala),
seryny (Ser) i tyrozyny (Tyr)
~ 90 %.
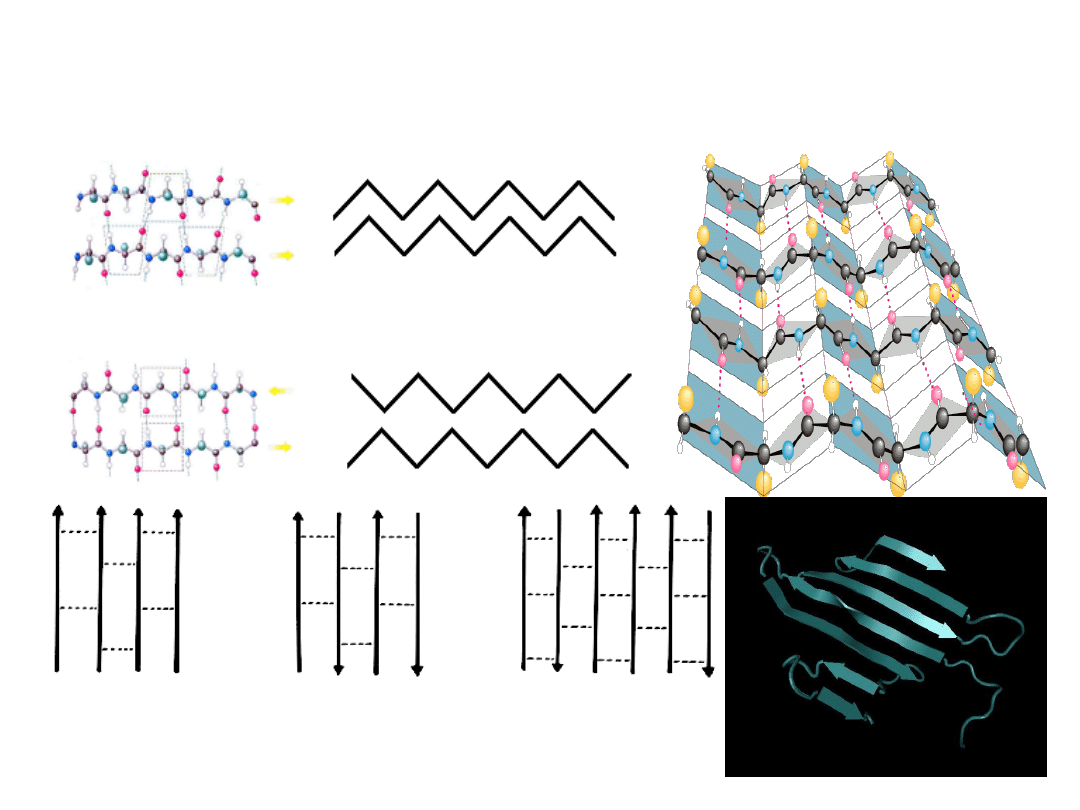
Białka
Struktura II-
rzędowa białka – harmonijka
β
współbieżne przeciwbieżne mieszane
(równoległe) (antyrównoległe)
łańcuchy równoległe
łańcychy antyrównoległe
Białka
Struktura II-
rzędowa białka – kolagen
1.
Potrójny heliks, zbudowany z trzech
łańcuchów polipeptydowych;
2. Skok
śruby 0,86 nm;
3.
Skład aminokwasowy:
– glicyna 33 %;
– prolina i hydroksyprolina 21 %;
– alanina 11 %;
co trzeci aminokwas to glicyna
– bardzo
giętka struktura.
Prolina nie może tworzyć wiązań
wodorowych (brak wodoru przy „N” po
utworzeniu wiązania peptydowego)
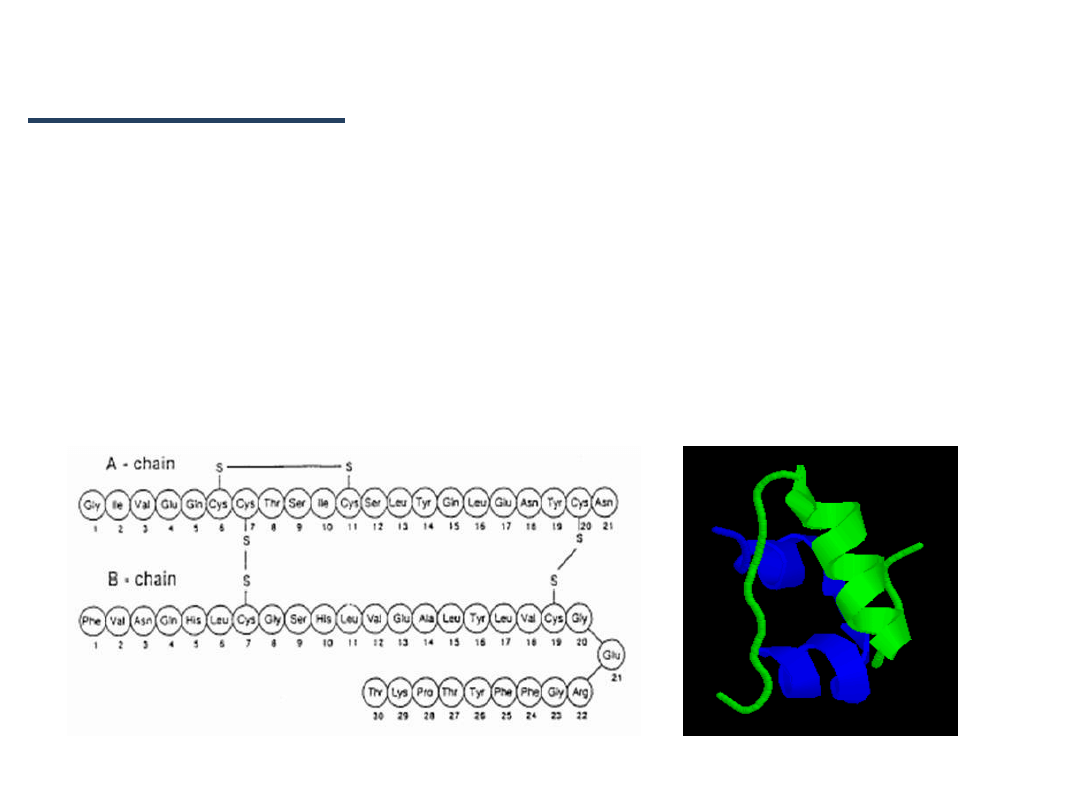
Białka
Struktura białka
•
Struktura III
–rzędowa:
przestrzenne
ułożenie łańcucha
polipeptydowego.
Struktura ta jest stabilizowana przez
wiązania:
– wodorowe;
– disiarczkowe –S–S– (mostki disulfidowe);
– jonowe;
– hydrofobowe.
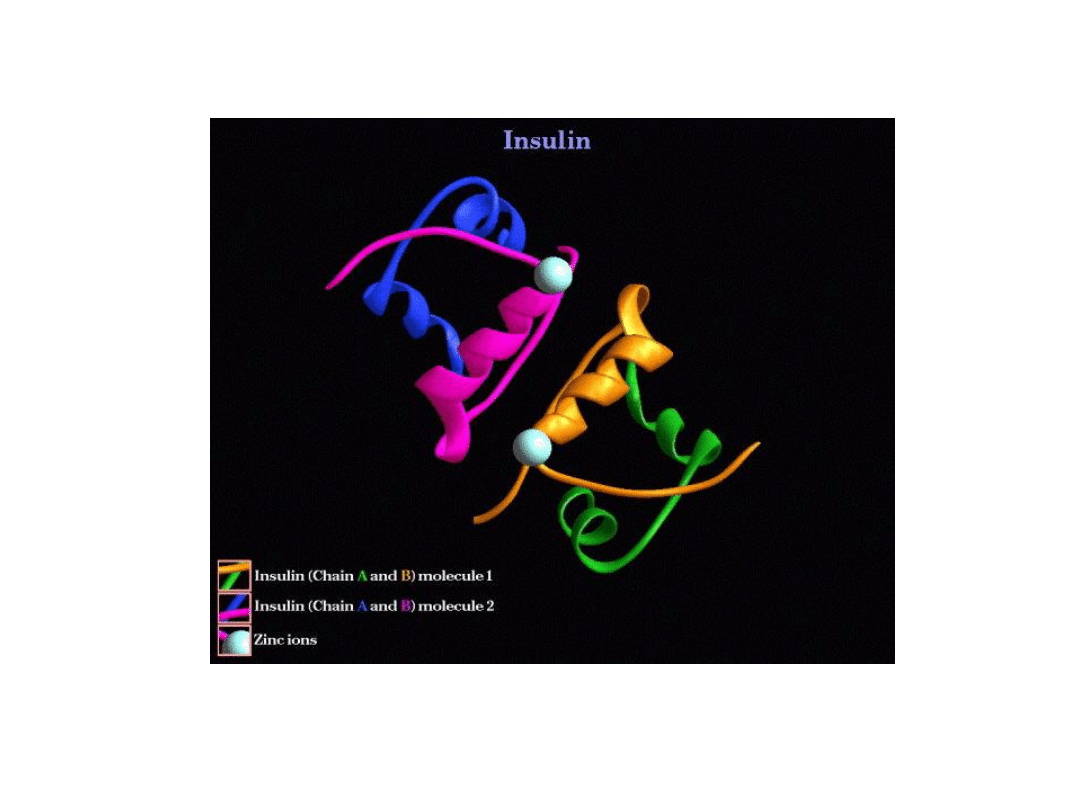
Trzeciorzędowa struktura insuliny
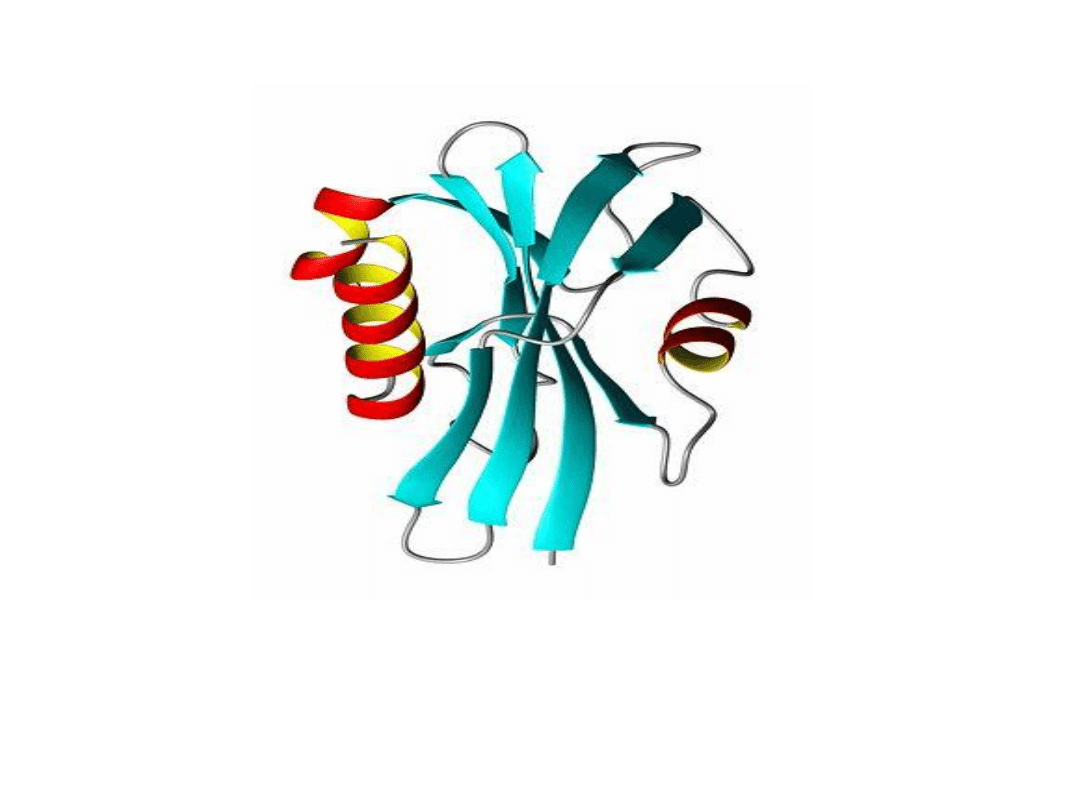
Trójwymiarowa struktura białka P13,
widoczne obszary α-helikalne i β-fałdowe
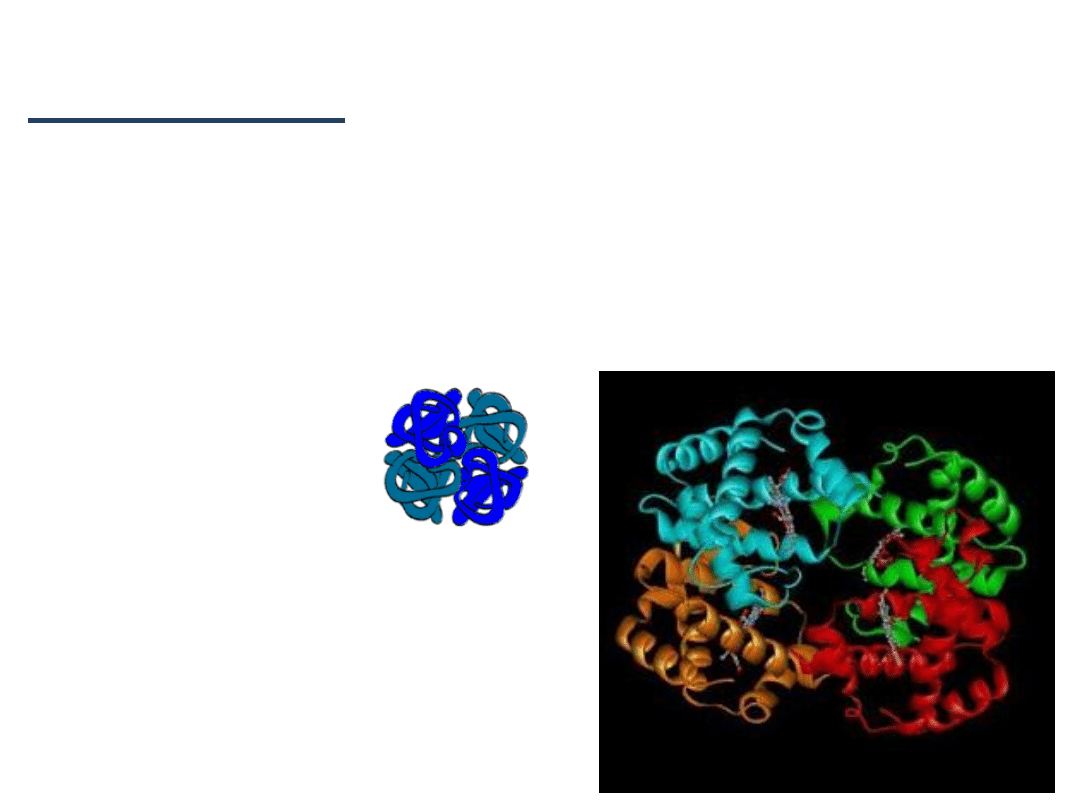
Białka
Struktura białka
•
Struktura IV
–rzędowa:
wzajemne przestrzenne
ułożenie
kilku
łańcuchów
polipeptydowych
budujących
białko
(podjednostek). Przy czym podjednostki te nie
muszą być
identyczne.
Struktura ta jest stabilizowana przez
wiązania:
– wodorowe;
– jonowe;
– disiarczkowe;
– hydrofobowe.
Trójwymiarowa struktura cząsteczki
hemoglobiny
tetramer
– zbudowany z dwóch par
białkowych podjednostek, z których
każda zawiera cząsteczkę hemu (kolor
szary).

Białka
Denaturacja i hydroliza białka
Denaturacja
białka
–
zniszczenie
struktury
II-,
III-,
i
IV-
rzędowej,
powodujące
utratę
właściwości
natywnych
(biologicznych).
Denaturacja
trwała (nieodwracalna), białko zostaje trwale
pozbawione
właściwości biologicznych, natywnych.
Denaturacja
odwracalna,
możliwa
jest
renaturacja
i
przywrócenie właściwości funkcjonalnych.
Hydroliza
białka
– zniszczenie struktury I-rzędowej.

Białka
Denaturacja białka
Czynniki
denaturujące:
1. Fizyczne:
- wysoka temperatura (denaturacja termiczna);
-
ultradzwięki;
- promieniowanie
jonizujące (UV);
2. Chemiczne:
- kwasy i zasady (zmiana pH
– zerwanie wiązań
jonowych i wodorowych);
-
jony metali ciężkich (zerwanie wiązań
disiarczkowych);
- detergenty (
zerwanie wiązań jonowych i wodorowych);
- mocznik
(rozerwanie wiązań wodorowych);
- rozpuszczalniki organiczne
(rozerwanie wiązań
hydrofobowych).
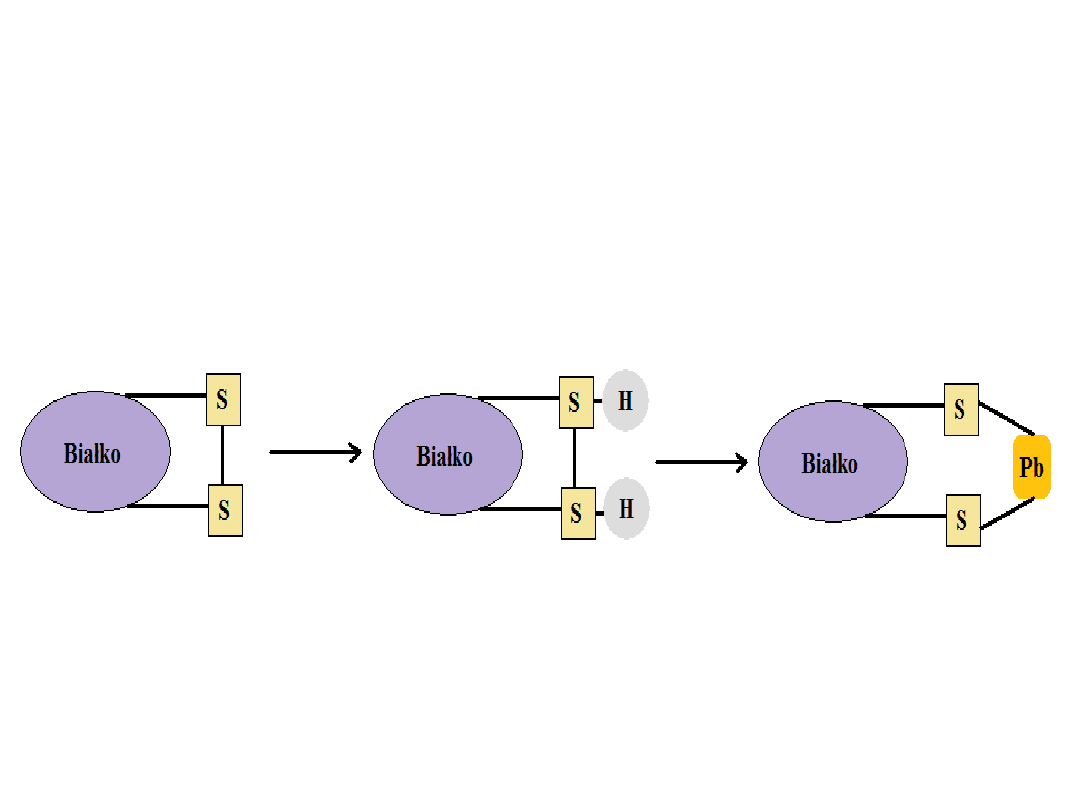
Chemiczna denaturacja białka – jony metali ciężkich
- zrywanie
mostków disiarczkowych (wiązanie kowalencyjne),
tworzenie
związków typu soli (siarczków)
Białka
postać utleniona postać zredukowana

Białka
Potranslacyjne
modyfikacje białek:
1. Rozerwanie
wiązań chemicznych (gł. peptydowych):
a)
odszczepienie od
końca N jednego (np. metioniny) lub dwóch
aminokwasów (jak w białku C26);
b) hydroliza
wewnątrzłancuchowych wiązań peptydowych, np.
przekształcenie preprobiałek i probiałek w produkty ostateczne
(np. preprokolagen lub preproinsulina, w
której następuje
odcięcie od N końca łańcucha sekwencji sygnalnej 24-
aminokwasowej);
2. Modyfikacja grupy
α-aminowej lub α-karboksylowej:
a)
głównie acylowanie np. N-formyloglicyna lub N-acyloseryna (są
to procesy niodwracalne);
b) modyfikacje grupy
α-karboksylowej:
-
przekształcenie w α-amidową pochodną,
- ADP-rybozylacja lizyny w histonie 1,
-
związanie tyrozyny z grupą α-karboksylową.

Białka
Potranslacyjne
modyfikacje białek cd:
3. Modyfikacja
łańcuchów bocznych aminokwasów
a) acetylacja (reakcja odwracalna, obejmuje
głównie białka jądrowe,
np. N-acyloseryna);
b) fosforylacja
– na atomie azotu w grupie aminowej (arginina,
histydyna, lizyna) lub na atomie tlenu asparaginianu oraz
aminokwasów hydroksylowych (seryna, tyrozyna, treonina);
c) metylacja
– atomów azotu w aminokwasach zasadowych i
glutaminie lub atomu tlenu w asparaginie;
d) racemizacja L-asparaginianu w D-asparaginian;
e) ADP-rybozylacja;
f)
hydroksylacja (proliny i lizyny);
g) glikozylacja (asparagina, seryna, treonina, cysteina);
h) kondensacja aldolowa (aldehydolizyny);
i)
ubikwitynacja.

Wartość odżywcza białek:
Białka
pełnowartościowe
zawierające
wszystkie
niezbędne aminokwasy, w ilościach zaspokajających pełne
zapotrzebowanie,
także do syntezy białek ustrojowych;
np.:
mięso zwierząt, ryb i drobiu
(z
wyjątkiem żelatyny i
fibryny,
które są ubogie w tryptofan),
jaja, mleko i produkty
mleczne.
Białka
niepełnowartościowe
nie
są
w
całości
wykorzystywane do syntezy
białek ustrojowych;
np.:
białka roślinne
(ubogie w
lizynę, tryptofan, metioninę i
walinę).
Zapotrzebowanie na białko w mg/kg masy ciała/dzień =
800mg.
Białko powinno pokrywać 12 % zapotrzebowania
kalorycznego.
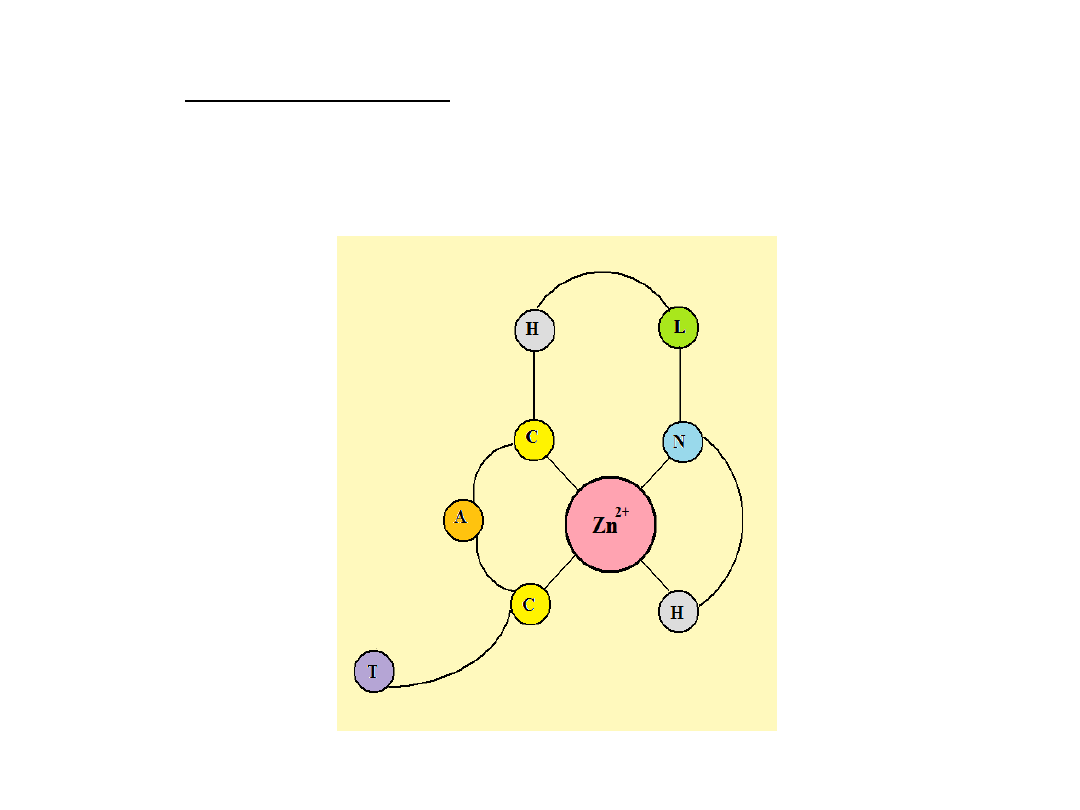
Tzw. palec cynkowy
– białka zawierają cynk związany
pomiędzy łańcuchem polipeptydowym.
Np.
białka biorące udział w syntezie (transkrypcji białek).
Wyszukiwarka
Podobne podstrony:
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
Aminokwasy i białka
Aminokwasy i białka 2
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
Aminokwasy i białka Koagulacja i?naturacja białek
Aminokwasy i białka Reakcje charakterystyczne białek reakcja biuretowa
pros 1 Aminokwasy Białka
AMINOKWASY I BIAŁKA BUDOWA WLASCIWOSCI I FUNKCJE
ĆWICZENIE 1 aminokwasy, białka, sacharydy
Aminokwasy bialka hydroksykwasy - 1, 1p
AMINOKWASY I BIAŁKA
6 Aminokwasy i bialka id 43565 Nieznany
02 BIOCHEMIA aminokwasy i bialka
W1 Aminokwasy, Białka
9 aminokwasy i białka materiały
AMINOKWASY BIALKA - AM, Technologia żywności i żywienia człowieka, Biochemia
więcej podobnych podstron