1
RJC
Addycje Nukleofilowe do
Grupy Karbonylowej
Addycje Nukleofilowe do
Addycje Nukleofilowe do
Grupy Karbonylowej
Grupy Karbonylowej
Slides 1 to 29
C
O
R
H
Nu
Nu
C
OH
R
H
Nu
C
O
R
H
+H
2
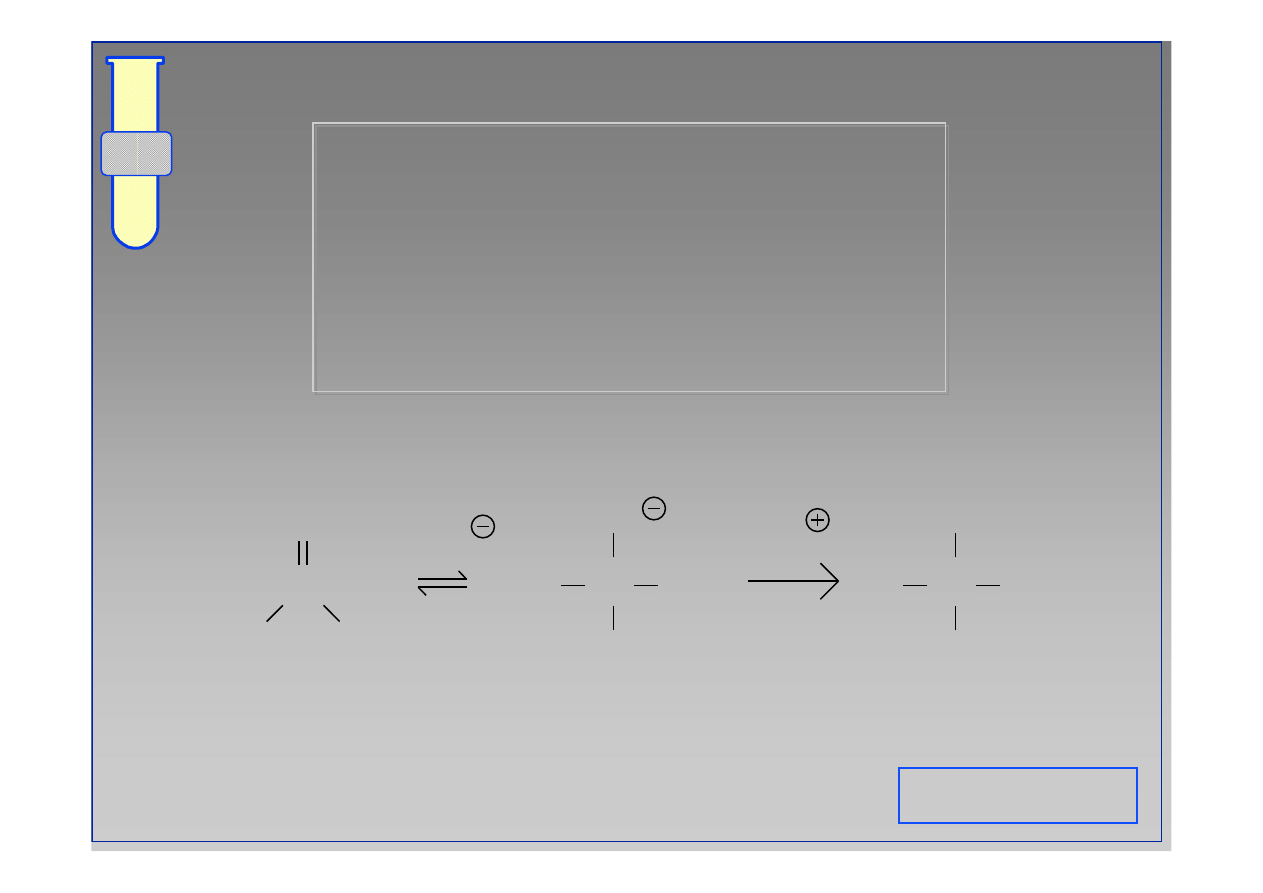
RJC
Addycja vs Substytucja
Addycja vs Substytucja
Atom C w grupie karbonylowej (
Atom C w grupie karbonylowej (
δ
δ
+
+
) jest podatny
) jest podatny
na atak odczynnika nukleofilowego Nu; w
na atak odczynnika nukleofilowego Nu; w
zale
zale
ż
ż
no
no
ś
ś
ci od substratu, reakcja mo
ci od substratu, reakcja mo
ż
ż
e prowadzi
e prowadzi
ć
ć
albo do addycji, albo do substytucji.
albo do addycji, albo do substytucji.
C
O
δ
+
δ
-
Nu
X
R
C
O
Nu
R
C
OH
R
X
Nu
add
n
sub
n
3
RJC
Addycje Nukleofilowe : X=H
Addycje Nukleofilowe : X=H
Poniewa
Poniewa
ż
ż
atom H nie mo
atom H nie mo
ż
ż
e stabilizowa
e stabilizowa
ć
ć
ł
ł
adunku
adunku
ujemnego, jest on bardzo z
ujemnego, jest on bardzo z
łą
łą
grup
grup
ą
ą
odchodz
odchodz
ą
ą
c
c
ą
ą
.
.
Atak odczynnika Nu prowadzi do powstania
Atak odczynnika Nu prowadzi do powstania
produktu addycji.
produktu addycji.
C
O
R
H
Nu
Nu
C
OH
R
H
Nu
C
O
R
H
+H
4
RJC
Addycje Nukleofilowe : X = R
Addycje Nukleofilowe : X = R
Poniewa
Poniewa
ż
ż
podstawniki typu R (alkil, aryl) nie
podstawniki typu R (alkil, aryl) nie
stabilizuj
stabilizuj
ą
ą
ł
ł
adunku ujemnego
adunku ujemnego
,
,
to takie grupy s
to takie grupy s
ą
ą
bardzo z
bardzo z
ł
ł
ymi grupami odchodz
ymi grupami odchodz
ą
ą
cymi; atak
cymi; atak
odczynnika Nu prowadzi do powstawania
odczynnika Nu prowadzi do powstawania
produkt
produkt
ó
ó
w addycji.
w addycji.
C
O
R
R
Nu
Nu
C
OH
R
R
Nu
C
O
R
R
+H
5
RJC
Nukleofile z
Nukleofile z
Ł
Ł
adunkiem Ujemnym
adunkiem Ujemnym
Nukleofile mog
Nukleofile mog
ą
ą
stanowi
stanowi
ć
ć
cz
cz
ą
ą
steczki na
steczki na
ł
ł
adowane
adowane
ujemnie (aniony).
ujemnie (aniony).
jon hydroksylowy
jon bromkowy
jon metoksylanowy
HO
Br
CH
3
O
••
•
•
••
••
•
•
••
••
•
•
••
•
•
C
O
R
R
Nu
Nu
C
OH
R
R
Nu
C
O
R
R
+H
6
RJC
Nukleofile bez
Nukleofile bez
Ł
Ł
adunku (Oboj
adunku (Oboj
ę
ę
tne)
tne)
Nukleofile oboj
Nukleofile oboj
ę
ę
tne, po addycji do grupy
tne, po addycji do grupy
karbonylowej trac
karbonylowej trac
ą
ą
jon H
jon H
+
+
; w ten spos
; w ten spos
ó
ó
b daj
b daj
ą
ą
produkty oboj
produkty oboj
ę
ę
tne (bez
tne (bez
ł
ł
adunku).
adunku).
woda
amoniak
metanol
H
2
O
••
••
CH
3
OH
••
••
••
NH
3
C
O
R
R
NuH
Nu
C
OH
R
R
NuH
C
O
R
R
7
RJC
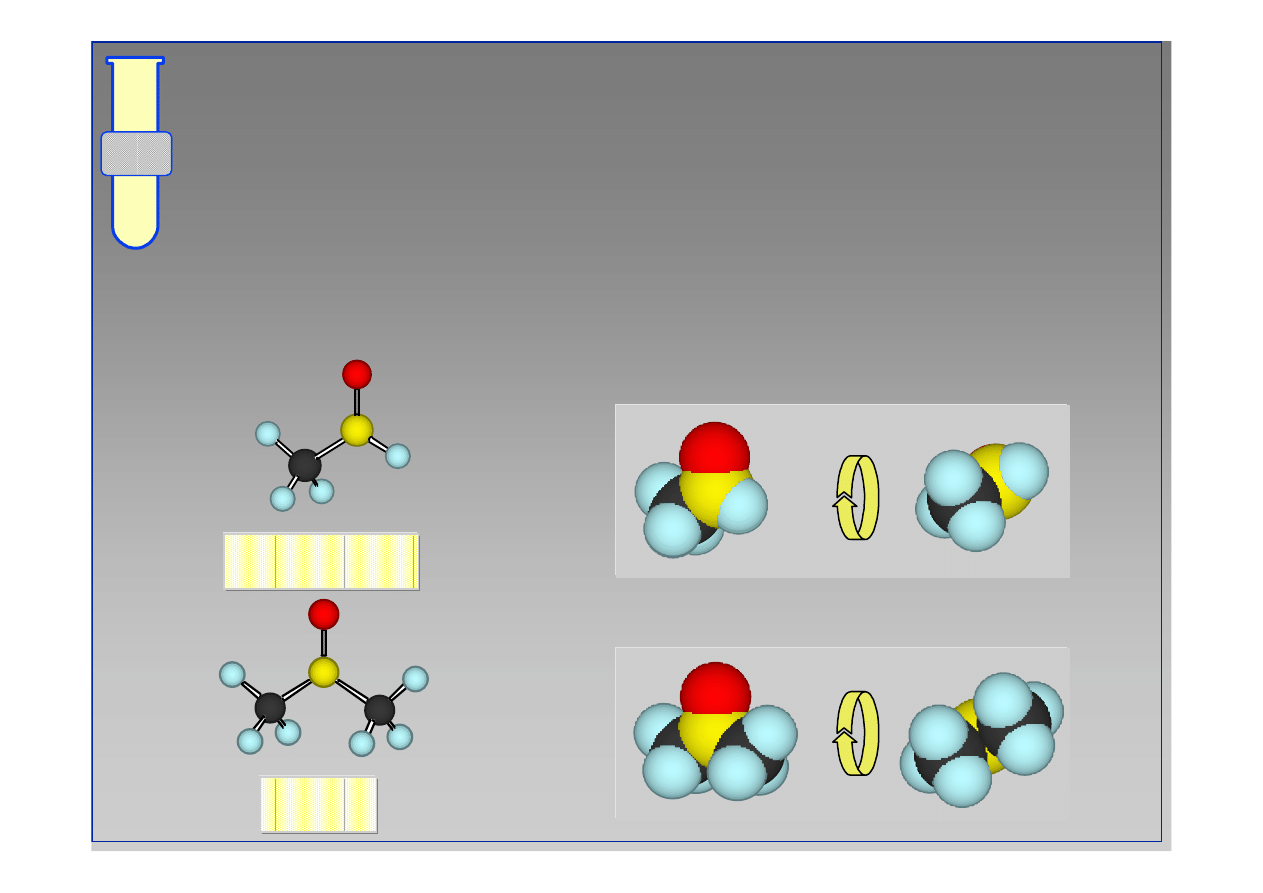
Aldehydy vs Ketony
Aldehydy vs Ketony
Aldehydy s
Aldehydy s
ą
ą
bardziej reaktywne ni
bardziej reaktywne ni
ż
ż
ketony;
ketony;
powodem jest zmniejszona zawada steryczna
powodem jest zmniejszona zawada steryczna
(przestrzenna) w aldehydach (
(przestrzenna) w aldehydach (
ł
ł
atwiejsze
atwiejsze
podej
podej
ś
ś
cie nukleofila).
cie nukleofila).
acetaldehyd
aceton
90°
90°
8
RJC
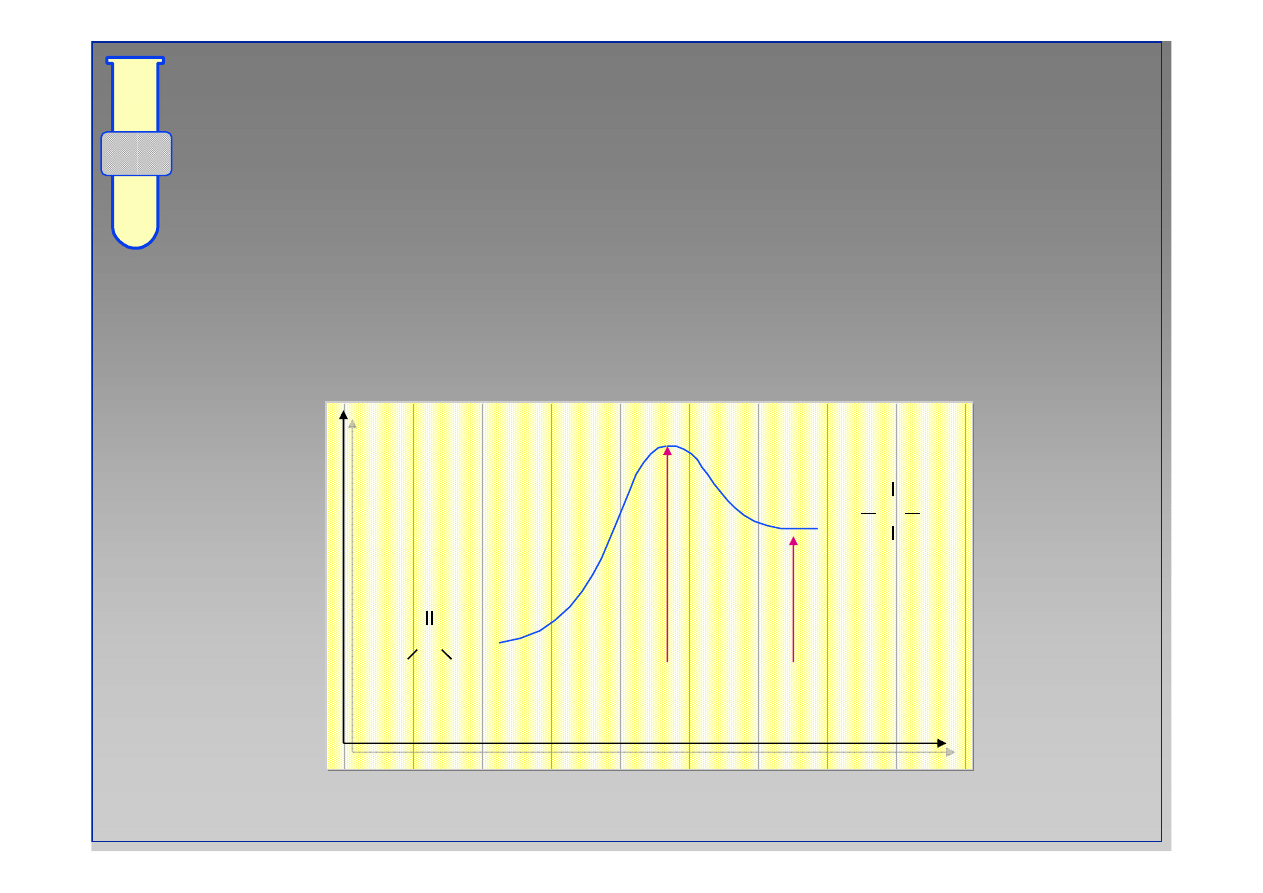
Diagram Energetyczny Reakcji
Diagram Energetyczny Reakcji
Szybko
Szybko
ść
ść
reakcji jest zdeterminowana przez
reakcji jest zdeterminowana przez
warto
warto
ść
ść
energii aktywacji
energii aktywacji
∆
∆
G
G
‡
‡
; r
; r
ó
ó
wnowaga
wnowaga
pomi
pomi
ę
ę
dzy produktami i substratami jest okre
dzy produktami i substratami jest okre
ś
ś
lona
lona
energi
energi
ą
ą
ko
ko
ń
ń
cowych produkt
cowych produkt
ó
ó
w (wzgl
w (wzgl
ę
ę
dem
dem
substrat
substrat
ó
ó
w), czyli warto
w), czyli warto
ś
ś
ci
ci
ą
ą
∆
∆
G
G
o
o
.
.
Energia
Postęp reakcji
C
O
R
R
Nu
C
OH
R
R
∆
G
o
∆
G
‡
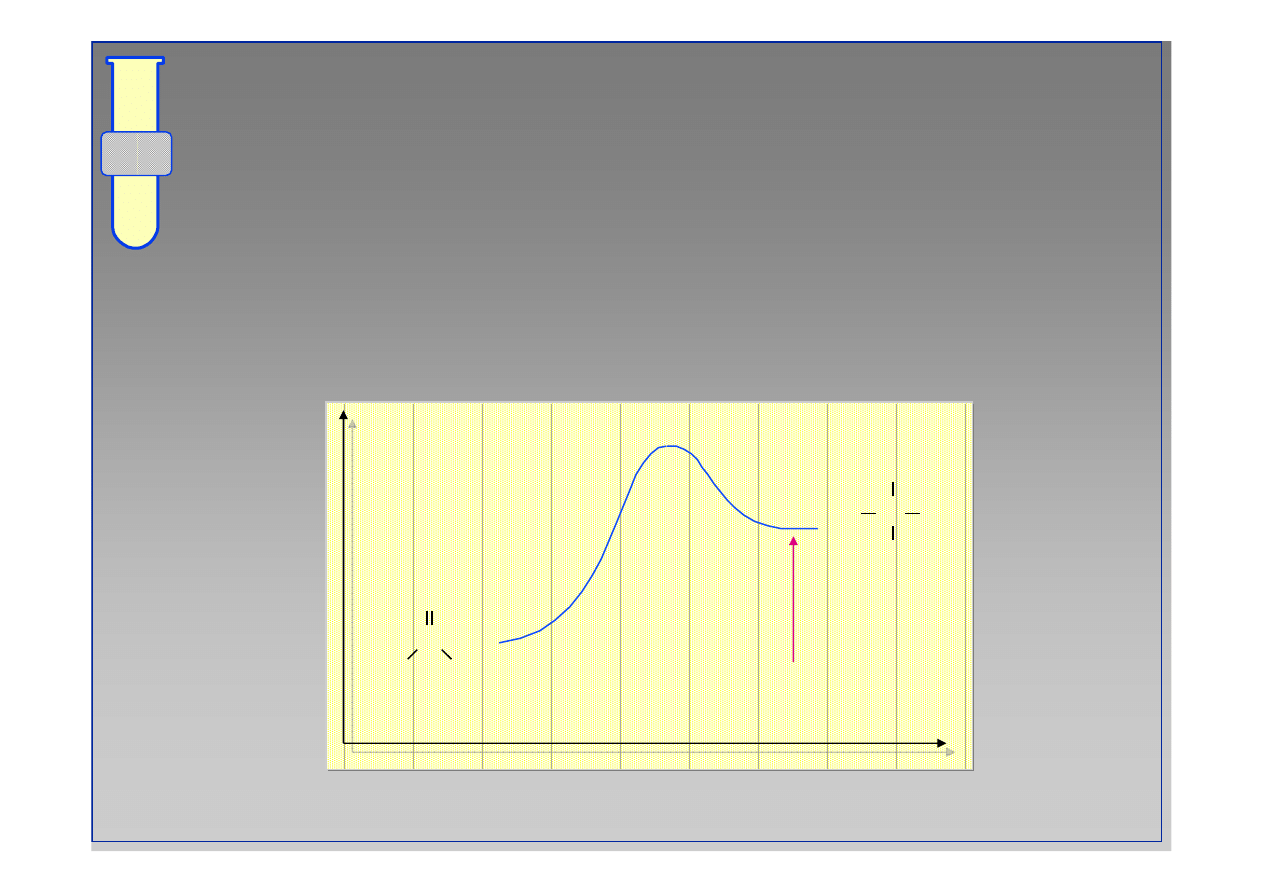
9
RJC
Na Przyk
Na Przyk
ł
ł
ad ... Aceton
ad ... Aceton
Dodatnia warto
Dodatnia warto
ść
ść
+
+
∆
∆
G
G
o
o
oznacza reakcj
oznacza reakcj
ę
ę
endotermiczn
endotermiczn
ą
ą
, w kt
, w kt
ó
ó
rej, w stanie r
rej, w stanie r
ó
ó
wnowagi,
wnowagi,
preferowane s
preferowane s
ą
ą
substraty.
substraty.
energia
postęp reakcji
C
O
CH
3
CH
3
Nu
C
OH
CH
3
CH
3
∆
G
o
10
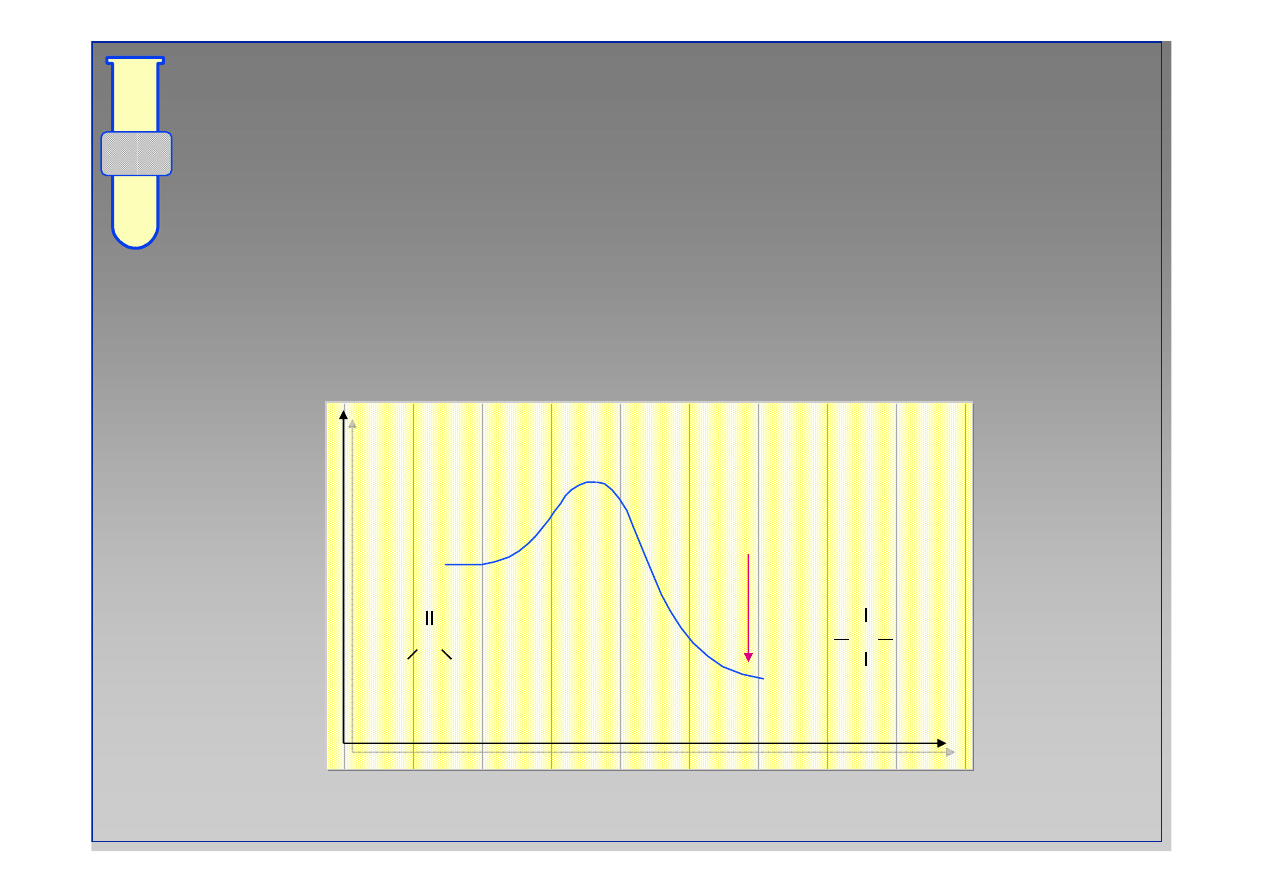
RJC
Na Przyk
Na Przyk
ł
ł
ad ... Formaldehyd
ad ... Formaldehyd
Ujemna warto
Ujemna warto
ść
ść
-
-
∆
∆
G
G
o
o
oznacza reakcj
oznacza reakcj
ę
ę
egzotermiczn
egzotermiczn
ą
ą
, w kt
, w kt
ó
ó
rej stan r
rej stan r
ó
ó
wnowagi preferuje
wnowagi preferuje
produkty.
produkty.
−∆
G
o
energia
postęp reakcji
C
O
H
H
Nu
C
OH
H
H

11
RJC
Wp
Wp
ł
ł
yw pH na Szybko
yw pH na Szybko
ść
ść
Reakcji
Reakcji
Szybko
Szybko
ść
ść
reakcji addycji nukleofilowej do grupy C=O jest
reakcji addycji nukleofilowej do grupy C=O jest
uzale
uzale
ż
ż
niona od warto
niona od warto
ś
ś
ci pH.
ci pH.
Warunki obojętne
: brak aktywacji
Warunki kwasowe
: aktywują substrat
karbonylowy
Warunki zasadowe
: aktywują nukleofil
12
RJC
Odczyn Oboj
Odczyn Oboj
ę
ę
tny
tny
Ani nukleofil, ani substrat karbonylowy nie
Ani nukleofil, ani substrat karbonylowy nie
ulegaj
ulegaj
ą
ą
aktywacji.
aktywacji.
C
O
R
R
Nu
Nu
C
OH
R
R
Nu
C
O
R
R
+H
13
RJC
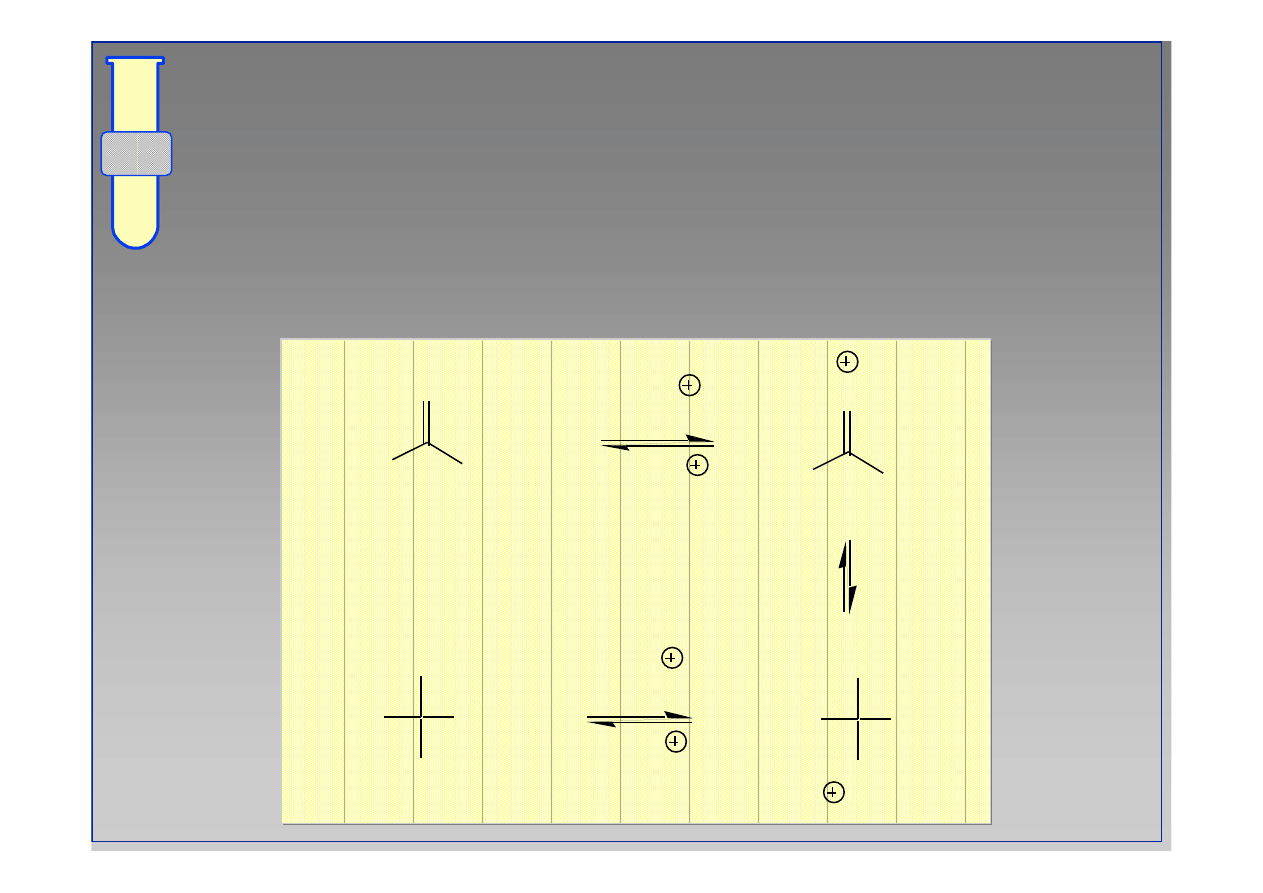
Odczyn Kwasowy
Odczyn Kwasowy
Atom tlenu w grupie C
Atom tlenu w grupie C
=
=
O jest
O jest
protonowany
protonowany
,
,
wskutek czego staje si
wskutek czego staje si
ę
ę
ona
ona
‘
‘
uaktywniona
uaktywniona
’
’
wobec
wobec
odczynnika nukleofilowego (bardziej podatna na
odczynnika nukleofilowego (bardziej podatna na
atak nukleofila).
atak nukleofila).
+H
C
O
R
R
C
O
H
R
R
C
O
H
R
R
Nu
14
RJC
Na Przyk
Na Przyk
ł
ł
ad ... Aceton
ad ... Aceton
Aktywacja kwasowa powoduje,
Aktywacja kwasowa powoduje,
ż
ż
e woda jako
e woda jako
s
s
ł
ł
aby nukleofil reaguje z acetonem daj
aby nukleofil reaguje z acetonem daj
ą
ą
c jego
c jego
hydrat.
hydrat.
CH
3
O
CH
3
CH
3
O
H
CH
3
CH
3
O
H
CH
3
OH
2
CH
3
O
H
CH
3
OH
+H
+H
2
O
+H
-H
-H
-H
2
O
15
RJC
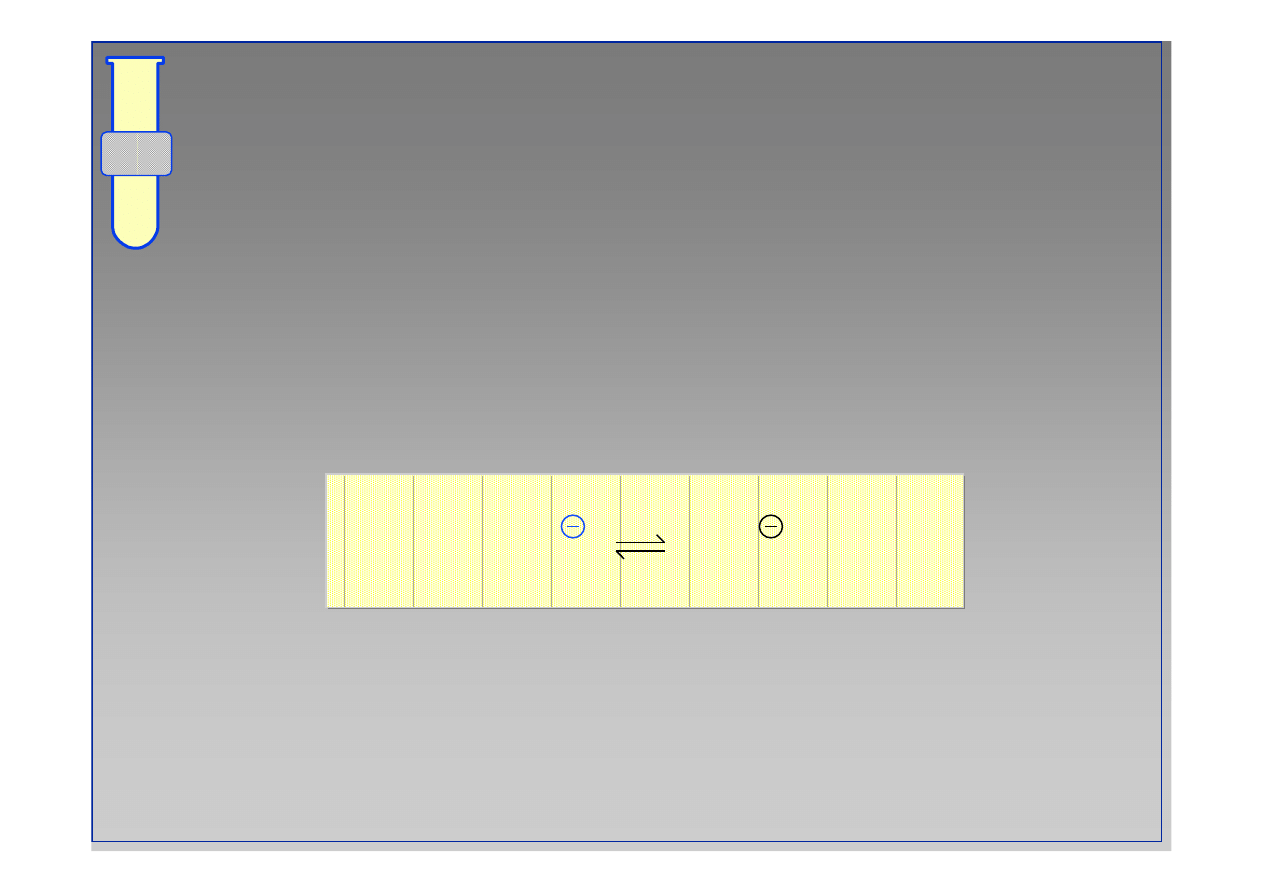
Odczyn Zasadowy
Odczyn Zasadowy
S
S
ł
ł
abe nukleofile mog
abe nukleofile mog
ą
ą
ulec deprotonowaniu przez
ulec deprotonowaniu przez
zasad
zasad
ę
ę
,
,
daj
daj
ą
ą
c lepsze (bardziej aktywne) nukleofile
c lepsze (bardziej aktywne) nukleofile
anionowe.
anionowe.
NuH +
B
Nu +
BH
16
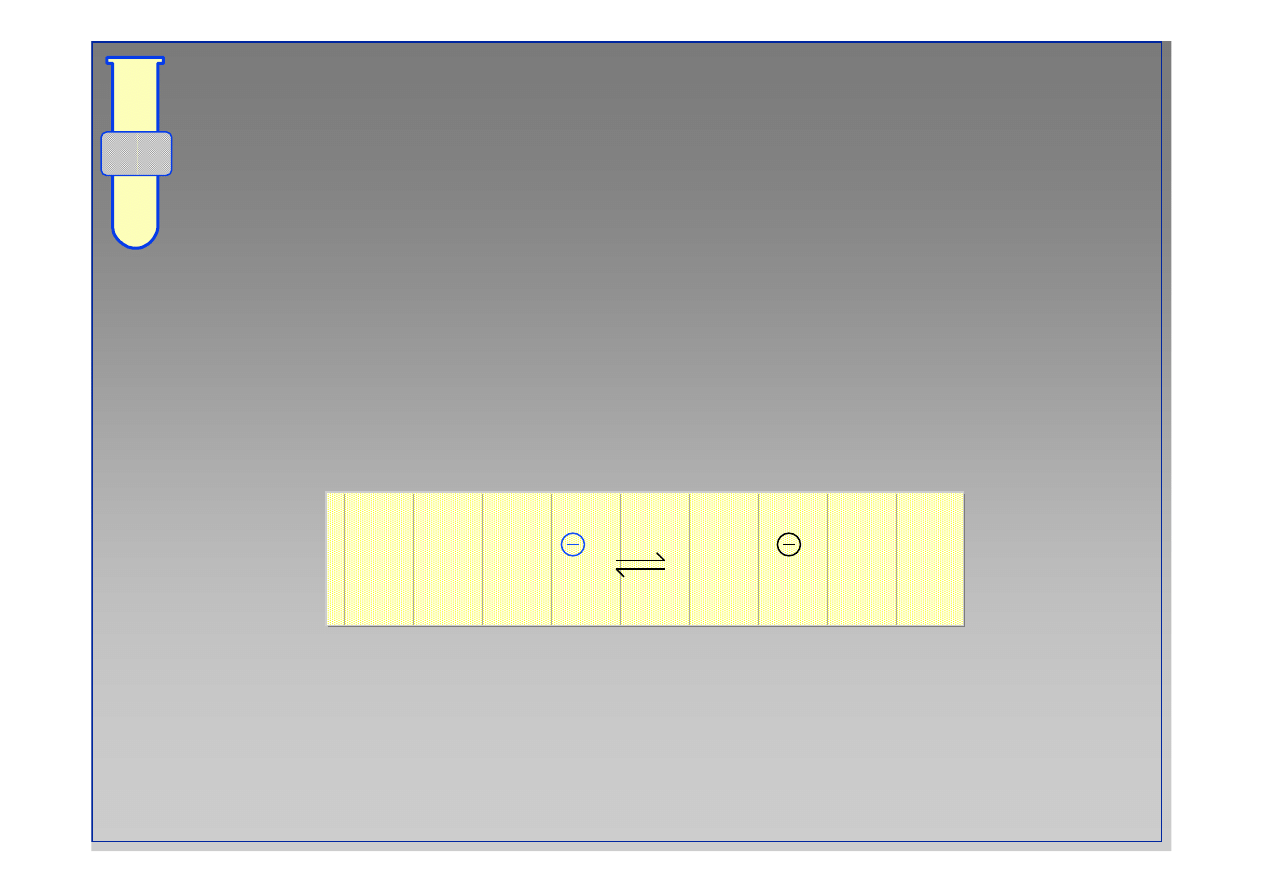
RJC
Na Przyk
Na Przyk
ł
ł
ad ...
ad ...
S
S
ł
ł
aby nukleofil H
aby nukleofil H
2
2
O mo
O mo
ż
ż
e zosta
e zosta
ć
ć
przeprowadzony
przeprowadzony
w silniejszy
w silniejszy
nukleofil
nukleofil
,
,
jakim jest anion
jakim jest anion
hydroksylowy HO
hydroksylowy HO
-
-
.
.
H
2
O +
B
HO +
BH
17
RJC
Reakcje Prowadz
Reakcje Prowadz
ą
ą
ce do Utworzenia
ce do Utworzenia
Wi
Wi
ą
ą
zania C
zania C
-
-
C
C
Reakcje prowadz
Reakcje prowadz
ą
ą
ce do utworzenia wi
ce do utworzenia wi
ą
ą
zania
zania
σ
σ
C
C
-
-
C maj
C maj
ą
ą
wyj
wyj
ą
ą
tkowe znaczenie w syntezie
tkowe znaczenie w syntezie
organicznej; addycje nukleofilowe do grupy
organicznej; addycje nukleofilowe do grupy
karbonylowej s
karbonylowej s
ą
ą
jednym z najlepszych rozwi
jednym z najlepszych rozwi
ą
ą
za
za
ń
ń
tego problemu;
tego problemu;
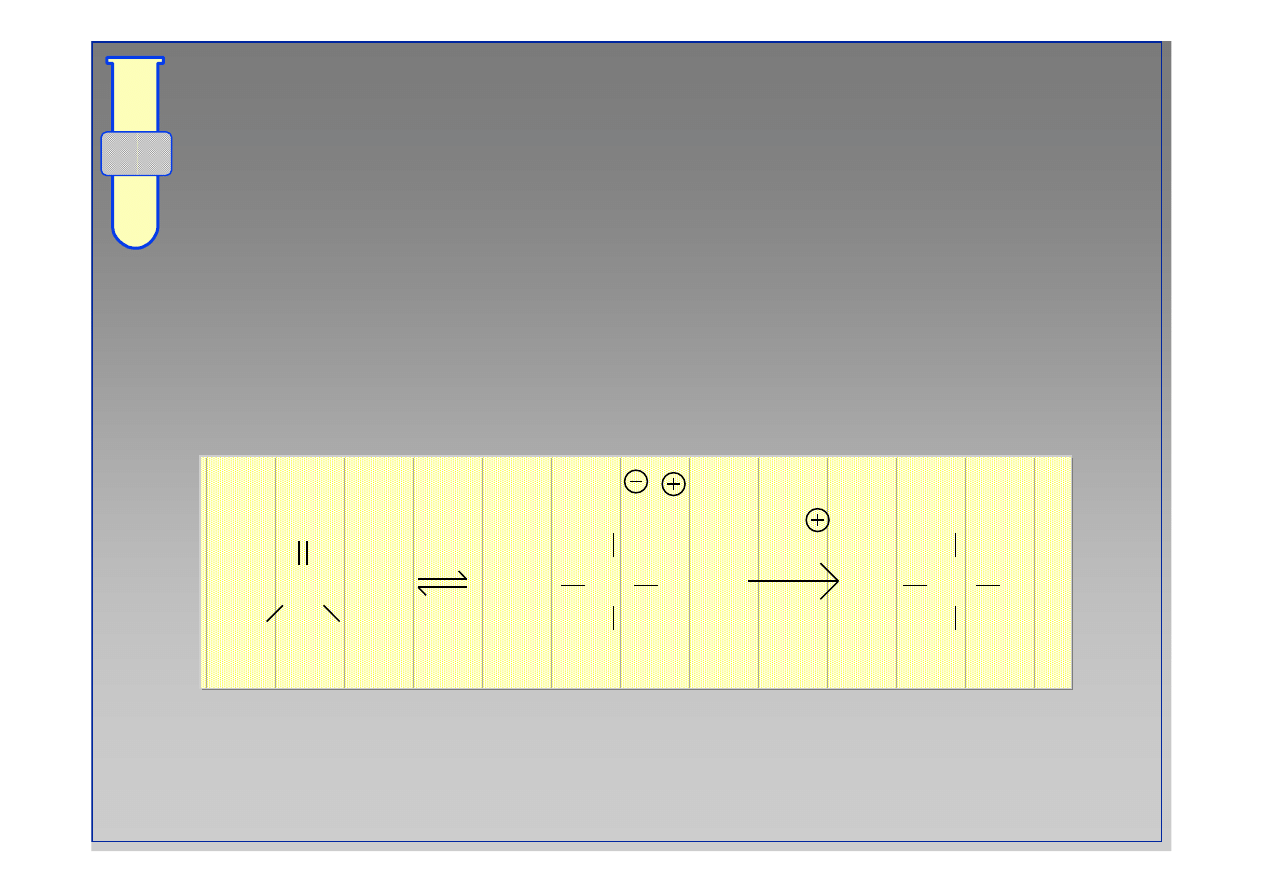
Otrzymywanie Cyjanohydryn
Reakcje z Odczynnikami Grignarda
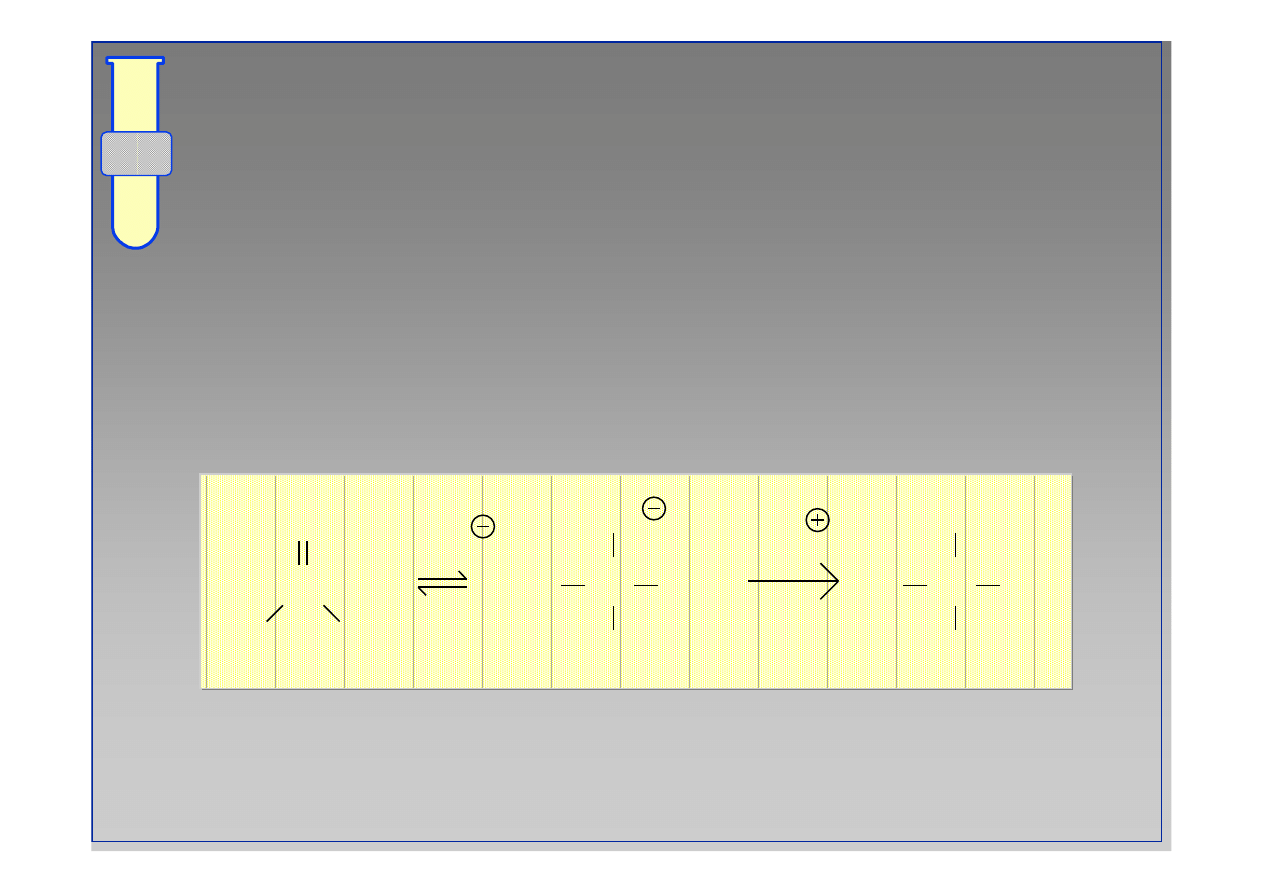
18
RJC
Cyjanohydryny
Cyjanohydryny
Anion cyjankowy reaguje z aldehydami oraz
Anion cyjankowy reaguje z aldehydami oraz
niezat
niezat
ł
ł
oczonymi ketonami daj
oczonymi ketonami daj
ą
ą
c produkty addycji
c produkty addycji
w postaci odpowiedniej cyjanohydryny.
w postaci odpowiedniej cyjanohydryny.
C
O
R
R
CN
CN
C
OH
R
R
CN
C
O
R
R
+H
19
RJC
Cyjanohydryny jako Wa
Cyjanohydryny jako Wa
ż
ż
ne Substraty w
ne Substraty w
Syntezie Organicznej
Syntezie Organicznej
Hydroliza cyjanohydryn prowadzi do otrzymania
Hydroliza cyjanohydryn prowadzi do otrzymania
kwasu karboksylowego, kt
kwasu karboksylowego, kt
ó
ó
ry w wyniku dalszej
ry w wyniku dalszej
redukcji mo
redukcji mo
ż
ż
e zosta
e zosta
ć
ć
przeprowadzony w inne
przeprowadzony w inne
pochodne.
pochodne.
CN
C
OH
R
R
CO
2
H
C
OH
R
R
CH
2
OH
C
OH
R
R
20
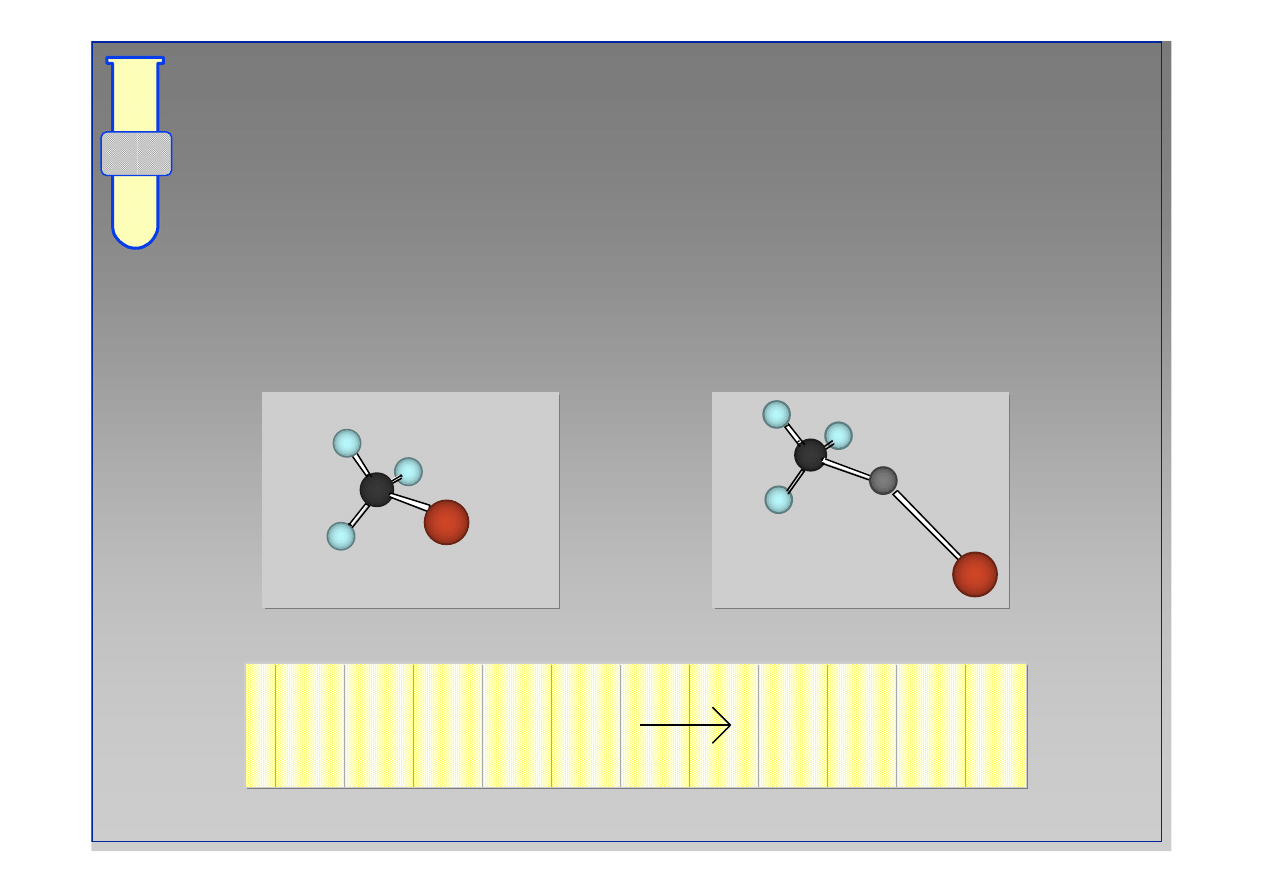
RJC
Odczynniki Grignarda
Odczynniki Grignarda
Halogenki alkilowe (r
Halogenki alkilowe (r
ó
ó
wnie
wnie
ż
ż
arylowe) reaguj
arylowe) reaguj
ą
ą
z Mg
z Mg
w warunkach bezwodnych (najlepiej w absolutnym
w warunkach bezwodnych (najlepiej w absolutnym
eterze dietylowym lub THF) daj
eterze dietylowym lub THF) daj
ą
ą
c tzw.
c tzw.
‘
‘
odczynniki
odczynniki
Grignarda
Grignarda
’
’
(zwi
(zwi
ą
ą
zek magnezoorganiczny).
zek magnezoorganiczny).
CH
3
Br + Mg CH
3
MgBr
21
RJC
Addycje Nukleofilowe Odczynnik
Addycje Nukleofilowe Odczynnik
ó
ó
w
w
Grignarda
Grignarda
Odczynniki Grignarda reaguj
Odczynniki Grignarda reaguj
ą
ą
z aldehydami oraz z
z aldehydami oraz z
ketonami daj
ketonami daj
ą
ą
c odpowiednio alkohole II
c odpowiednio alkohole II
-
-
lub III
lub III
-
-
rz
rz
ę
ę
dowe. Reakcja z formaldehydem (aldehydem
dowe. Reakcja z formaldehydem (aldehydem
mr
mr
ó
ó
wkowym) prowadzi do alkoholu I
wkowym) prowadzi do alkoholu I
-
-
rz
rz
ę
ę
dowego
dowego
C
O
R
R
CH
3
MgBr
CH
3
C
OH
R
R
CH
3
C
O
R
R
+H
MgBr

22
RJC
Pochodne Azotowe Zwi
Pochodne Azotowe Zwi
ą
ą
zk
zk
ó
ó
w Karbonylowych
w Karbonylowych
Aldehydy oraz ketony s
Aldehydy oraz ketony s
ą
ą
cz
cz
ę
ę
sto cieczami; w celu
sto cieczami; w celu
charakteryzacji cz
charakteryzacji cz
ę
ę
sto s
sto s
ą
ą
one przeprowadzane w
one przeprowadzane w
krystaliczne pochodne, takie jak:
krystaliczne pochodne, takie jak:
Semikarbazony
Oksymy
2,4-Dinitrofenyhydrazony
23
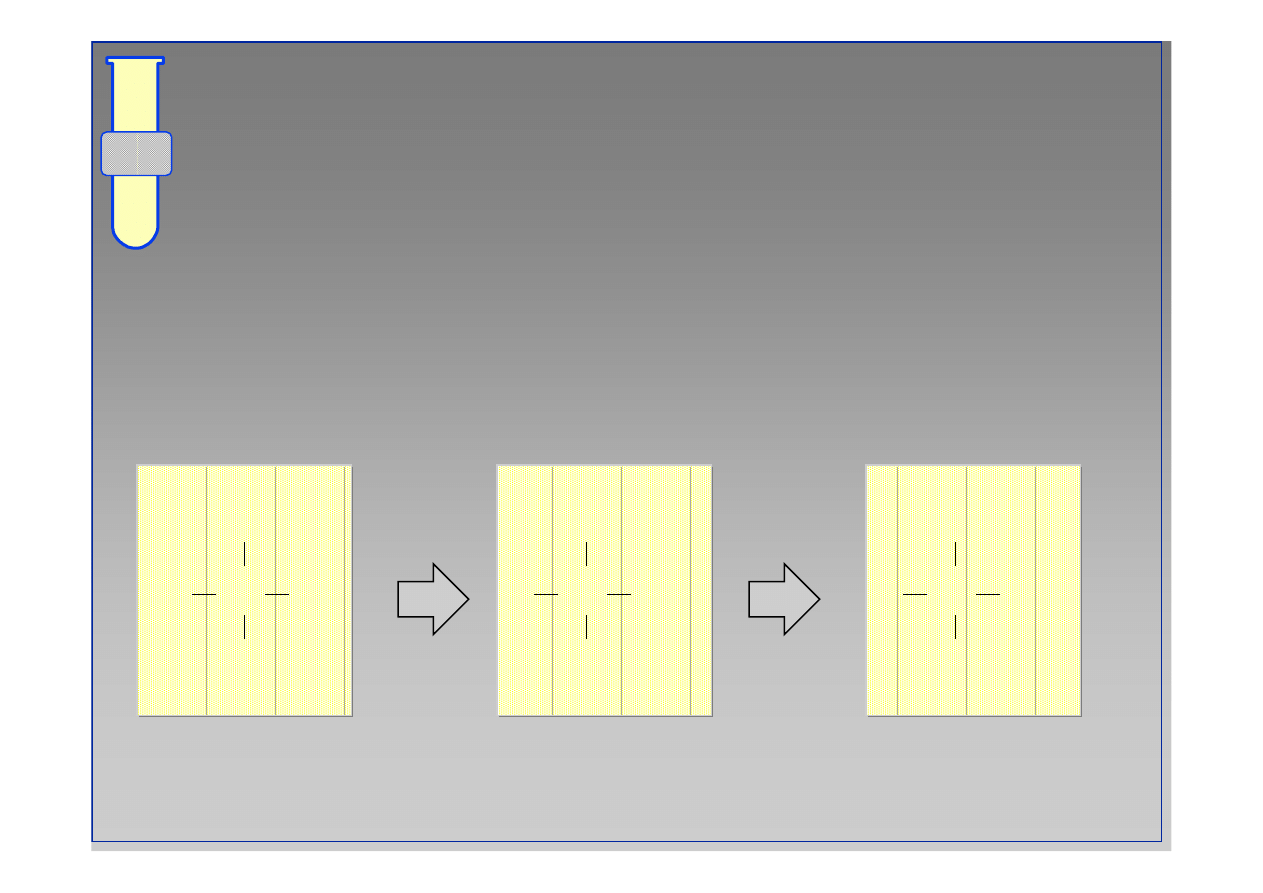
RJC
Semikarbazony
Semikarbazony
Semikarbazyd (zaznaczony na niebiesko)
Semikarbazyd (zaznaczony na niebiesko)
ł
ł
atwo
atwo
reaguje z ketonami oraz aldehydami daj
reaguje z ketonami oraz aldehydami daj
ą
ą
c jako
c jako
produkty addycji (z nast
produkty addycji (z nast
ę
ę
pn
pn
ą
ą
eliminacj
eliminacj
ą
ą
wody)
wody)
krystaliczne semikarbazony.
krystaliczne semikarbazony.
NH
2
NHCNH
2
O
C
O
R
R
C
R
R
N-NHCNH
2
O
+
-H
2
O
24
RJC
Oksymy
Oksymy
Hydroksylamina NH
Hydroksylamina NH
2
2
OH reaguje z ketonami oraz
OH reaguje z ketonami oraz
aldehydami daj
aldehydami daj
ą
ą
c, w podobny spos
c, w podobny spos
ó
ó
b, czyli wg
b, czyli wg
schematu addycja/eliminacja) oksymy
schematu addycja/eliminacja) oksymy
(charakterystyczna grupa funkcyjna C=NOH).
(charakterystyczna grupa funkcyjna C=NOH).
NH
2
OH
C
O
R
R
C
R
R
N-OH
+
-H
2
O
25
RJC
2,4
2,4
-
-
Dinitrofenylohydrazony
Dinitrofenylohydrazony
2,4
2,4
-
-
dinitrofenyhydrazyna reaguje z ketonami oraz
dinitrofenyhydrazyna reaguje z ketonami oraz
aldehydami daj
aldehydami daj
ą
ą
c krystaliczne pochodne
c krystaliczne pochodne
nazywane 2,4
nazywane 2,4
-
-
dinitrofenyhydrazonami.
dinitrofenyhydrazonami.
C
O
R
R
+
NH-NH
2
NO
2
NO
2
C
R
R
N-NH
NO
2
NO
2
-H
2
O

26
RJC
Inne Pochodne Zawieraj
Inne Pochodne Zawieraj
ą
ą
ce Atom Azotu
ce Atom Azotu
Ketony oraz aldehydy reaguj
Ketony oraz aldehydy reaguj
ą
ą
z alkilo
z alkilo
-
-
lub arylo
lub arylo
-
-
aminami (I
aminami (I
-
-
oraz II
oraz II
-
-
rz
rz
ę
ę
dowymi) daj
dowymi) daj
ą
ą
c jako
c jako
produkty addycji/eliminacji iminy (z amin I
produkty addycji/eliminacji iminy (z amin I
-
-
rz
rz
ę
ę
dowych) lub enaminy (z amin II
dowych) lub enaminy (z amin II
-
-
rz
rz
ę
ę
dowych)
dowych)
Iminy
Enaminy
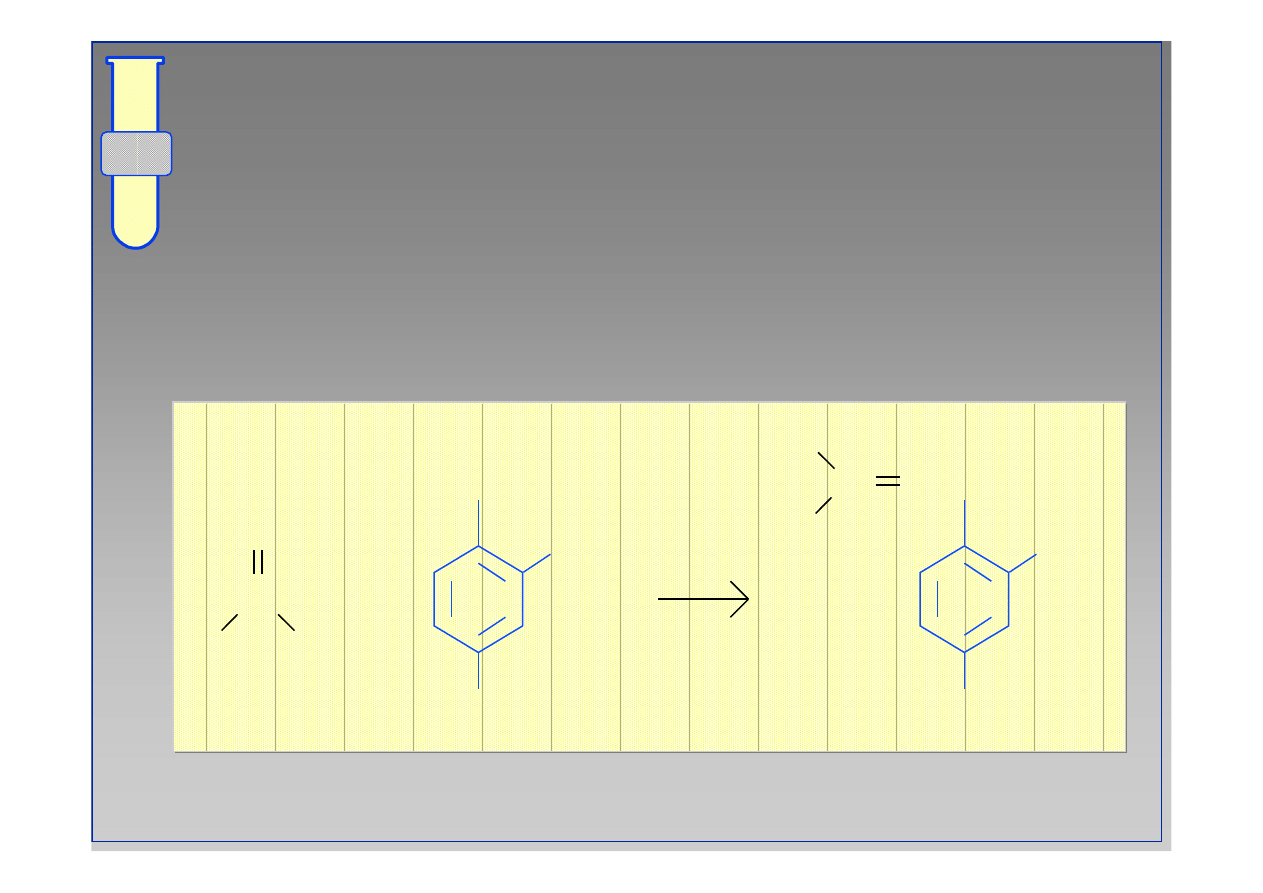
27
RJC
Iminy
Iminy
S
S
ą
ą
produktami powstaj
produktami powstaj
ą
ą
cymi z aminy I
cymi z aminy I
-
-
rz
rz
ę
ę
dowej
dowej
oraz ketonu lub aldehydu.
oraz ketonu lub aldehydu.
R-NH
2
C
O
R
R
C
R
R
N-R
+
-H
2
O
28
RJC
Enaminy
Enaminy
S
S
ą
ą
produktami reakcji ketonu lub aldehydu z
produktami reakcji ketonu lub aldehydu z
aminami II
aminami II
-
-
rz
rz
ę
ę
dowymi. Warunkiem ich
dowymi. Warunkiem ich
powstawania jest obecno
powstawania jest obecno
ść
ść
atomu wodoru w
atomu wodoru w
pozycji
pozycji
α
α
, w cz
, w cz
ą
ą
steczce zwi
steczce zwi
ą
ą
zku karbonylowego
zku karbonylowego
R
2
NH
C
O
CH
3
R
C
R
CH
2
N
+
-H
2
O
R
R

29
RJC
Podsumowanie
Podsumowanie
Addycje nukleofilowe do grupy C=O
Nukleofile z ładunkiem vs nukleofile obojętne
Rola zawady sterycznej
Szybkość reakcji a wartość pH, równowagi
Otrzymywanie cyjanohydryn oraz ich wykorzystanie
Reakcje grupy C=O z odczynnikami Grignarda
Semikarbazony oraz oksymy
2,4-Dinitrofenylohydrazony
Iminy oraz enaminy
Addycje nukleofilowe do grupy C=O
Nukleofile z ładunkiem vs nukleofile obojętne
Rola zawady sterycznej
Szybkość reakcji a wartość pH, równowagi
Otrzymywanie cyjanohydryn oraz ich wykorzystanie
Reakcje grupy C=O z odczynnikami Grignarda
Semikarbazony oraz oksymy
2,4-Dinitrofenylohydrazony
Iminy oraz enaminy
Wyszukiwarka
Podobne podstrony:
aldehydy i ketony addycja nukleofilowa
Addycje Nukleofilowe do Grupy Karbonylowej
aldehydy i ketony addycja nukleofilowa
Gor±czka o nieznanej etiologii
02 VIC 10 Days Cumulative A D O Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
45 sekundowa prezentacja w 4 ro Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
Mechanika Plynow Lab, Sitka Pro Nieznany
katechezy MB id 233498 Nieznany
2012 styczen OPEXid 27724 Nieznany
metro sciaga id 296943 Nieznany
Mazowieckie Studia Humanistyczn Nieznany (11)
cw 16 odpowiedzi do pytan id 1 Nieznany
perf id 354744 Nieznany
DO TEL! 5= Genetyka nadci nieni Nieznany
Opracowanie FINAL miniaturka id Nieznany
więcej podobnych podstron