
Rów
now
agi
kwa
sow
o-za
sad
owe

Kwas - substancja odszczepiająca w roztworze wodnym
jony wodorowe
HNO
3
→ H
+
+ NO
3
−
Zasada - substancja odszczepiająca jony wodorotlenowe
NaOH → Na
+
+ OH
−
Pojęcie kwasu i zasady
1. Teoria Arrheniusa:
Kwas - donor protonów
Zasada - akceptor protonów
reakcje kwas zasada - reakcje sprzężonych par:
kwas
1
+ zasada
2
→ kwas
2
+ zasada
1
2. Teoria Brǿnsteda i Lowry’ego:

wiąże pojęcia kwasu i zasady z przyłączaniem lub
oddawaniem pary elektronów
Kwas - związek będący akceptorem 1 lub więcej par
elektronów
Zasada - związek będący donorem elektronów
Pojęcie kwasu i zasady
3. Teoria Lewisa:
Stanowi uogólnienie poprzednich teorii
Kwas - substancja tworząca z zasadami sole,
odszczepiająca kationy lub przyłączająca elektrony
Zasada - substancja zobojętniająca kwasy,
odszczepiająca aniony lub oddająca elektrony
4. Teoria Usanowicza:
Teoria Brǿnsteda
Jeżeli w roztworze istnieje kwas
1
zdolny do reakcji:
kwas
1
zasada
1
+ proton
HA
A
−
+
H
+
oraz zasada
2
zdolna do reakcji:
zasada
2
+ proton
kwas
2
B + H
+
BH
+

Teoria Brǿnsteda
To między nimi może zajść reakcja:
kwas
1
+ zasada
2
zasada
1
+ kwas
2
HA + B
A
−
+ BH
+
Przeniesienie protonu
- zdolne do przyłączania lub oddawania protonów
- zdolne do autoprotolizy:
2 HSo
H
2
So
+
+ So
−
np:
2 H
2
O
H
3
O
+
+ OH
−
2 CH
3
COOH
CH
3
COOH
2
+
+ CH
3
COO
−
Rodzaje rozpuszczalników
1. Rozpuszczalniki protolityczne:
- niezdolne do reakcji z protonem
np:
węglowodory,
pochodne chlorowcowe węglowodorów
2. Rozpuszczalniki aprotyczne:
Podział rozpuszczalników protolitycznych
1a. protonoakceptorowe (protonofilowe):
1b. protonodonorowe (protonogenne)
C
5
H
5
N + H
+
C
5
H
5
NH
+
OHCN(CH
3
)
2
+ H
+
OHCNH(CH
3
)
2
+
NH
3
+ H
+
NH
4
+
bezwodny CH
3
COOH
CH
3
COO
−
+ H
+
bezwodny HCOOH
HCOO
−
+ H
+
kwas
1
+ rozp. protonofilowy zasada
1
+ rozp. w postaci kwasowej
zasada
1
+ rozp. protonogenny kwas
1
+ rozp. w postaci zasadowej
Podział rozpuszczalników protolitycznych
1c. amfoteryczne (amfiprotyczne):
H
2
O + H
+
H
3
O
+
+ OH
−
H
2
O
OH
−
+
H
+
C
2
H
5
OH + H
+
C
2
H
5
OH
2
+
C
2
H
5
OH
C
2
H
5
O
−
+ H
+
kwas
1
+ zasada
2
kwas
2
+ zasada
1
HCl
+
H
2
O
H
3
O
+
+
Cl
−
H
2
PO
4
−
+
H
2
O
H
3
O
+
+
HPO
4
−
H
2
O
+
CH
3
NH
2
CH
3
NH
3
+
+
OH
−
H
2
O
+
Al(H
2
O)
5
OH
2+
Al(H
2
O)
6
+
OH
−
Podział rozpuszczalników
Innym kryterium podziału rozpuszczalników jest ich
względna przenikalność elektryczna ε (stała dielektryczna)
a) rozpuszczalniki o dużej stałej dielektrycznej ε>40
(np. woda, HCOOH, H
2
SO
4
, amidy)
b) rozpuszczalniki o średniej stałej dielektrycznej 15<ε<40
(np. NH
3
, CH
3
OH, C
2
H
5
OH, CH
2
N(CH
3
)
2
)
c) rozpuszczalniki o małej stałej dielektrycznej ε<15
(np. C
5
H
5
N, dioksan, węglowodory i ich
chlorowcopochodne)
dysocjacja praktycznie nie zachodzi
ponieważ wartości [H
2
O] i są stałe (w danej temperaturze):
O
H
2
a
Iloczyn jonowy wody
2 H
2
O
H
3
O
+
+ OH
−
stechiometryczna (stężeniowa)
termodynamiczna
stała równowagi:
stała równowagi:
2
2
3
'
w
O]
[H
]
][OH
O
[H
K
−
+
=
2
O
H
OH
O
H
a'
w
2
-
3
a
a
a
K
⋅
=
+
stechiometryczna (stężeniowa)
termodynamiczna
stała równowagi:
stała równowagi:
]
][OH
O
[H
K
3
w
−
+
=
-
3
OH
O
H
a
w
a
a
K
⋅
=
+
Iloczyn jonowy wody
Iloczyn jonowy wody
po zlogarytmowaniu równania na K
w
:
Iloczyn jonowy wody
ze względu na duże rozcieńczenie jonów w roztworze :
]
][OH
O
[H
K
3
w
−
+
=
-
3
OH
O
H
a
w
a
a
K
⋅
=
+
- w temperaturze 22
o
C
K
w
=
= 1· 10
-14
- w temperaturze 0
o
C
K
w
=
= 0.11· 10
-14
- w temperaturze 100
o
C
K
w
= = 49· 10
-14
a
w
K
a
w
K
a
w
K
logK
w
= log([H
3
O
+
][OH
−
])
log(
a· b
)= log
a
+ log
b
logK
w
= log[H
3
O
+
] + log[OH
−
]
przyjmując -logK
w
= pK
w
oraz -log[H
3
O
+
]=pH i -log[OH
−
]=pOH otrzymujemy:
pK
pK
w
w
=
=
pH
pH
+
+
pOH
pOH
i analogicznie dla termodynamicznej wartości:
Iloczyn jonowy wody
OH
p
H
p
pK
a
a
a
w
+
=
Ponieważ K
w
= const. w danym rozpuszczalniku i w danej T
- w czystej wodzie (w temp 22
o
C) wynosi K
w
= 1· 10
-14
pH
pH
=
=
pOH
pOH
=
=
p
p
a
a
H
H
=
=
p
p
a
a
OH
OH
= 7
= 7
10
1
K
a
a
]
[OH
]
O
[H
7
-
w
OH
O
H
-
3
-
3
⋅
=
=
=
=
=
+
+
odczyn roztworu dla którego [H
3
O
+
]=[OH
−
] nazywa się obojętnym

Iloczyn jonowy wody
gdy [H
3
O
+
] > [OH
−
] - roztwory kwasowe 0 < pH < 7
(
kwaśne
)
gdy [H
3
O
+
] < [OH
−
] - roztwory zasadowe 7 < pH < 14
(
alkaliczne
)

Obliczanie pH
Jakie jest pH
a) krwi ludzkiej, w której stężenie jonów H
3
O
+
wynosi 4.0· 10
-8
mol/L,
b) 0.015 molowego HCl
?
a) [H
3
O
+
] = 4.0· 10
-8
mol/L
pH = -log (4.0· 10
-8
) = 7.40
b) [H
3
O
+
] = 0.015 mol/L
pH = -log 0.015 = 1.82
Obliczanie pH
Zadanie
pH soków żołądkowych człowieka wynosi około 1.7. Jakie
jest stężenie jonów H
3
O
+
w żołądku ?
pH = 1.7
[H
3
O
+
] = 10
-1.7
= 0.020 mol/L = 2.0· 10
-2
mol/L
Zadanie
pH soku z trzustki, pomagającego trawić pokarm po opuszczeniu
ż
ołądka wynosi 8.2. Jakie jest stężenie jonów [H
+
] w soku z
trzustki?
pH = 8.2
[H
3
O
+
] = 10
-8.2
=6.3· 10
-9
mol/L
Kwasy i zasady
W przypadku mocnych kwasów ich dysocjacja w rozcieńczonych
roztworach wodnych jest praktycznie całkowita, a więc mamy do
czynienia z równowagą:
HA + H
2
O
A
−
+ H
3
O
+
pH takiego roztworu zależeć
będzie w praktyce od stężenia
wprowadzonego do roztworu
kwasu
pH = -log c
HA
Uwaga !!!
Oczywiście gdy rozcieńczenie będzie bardzo duże na wartości pH
wpływ będą miały jony H
3
O
+
pochodzące z autodysocjacji wody.
Dla roztworów bardzo stężonych trzeba rozważyć wielkość f.
Obliczanie pH
Zadanie
Obliczyć pH i pOH w roztworze Ba(OH)
2
o stężeniu 2· 10
−
4
mol/L
[OH
−
] = 2· (2· 10
−
4
)
mol/L
pOH= -log (4 · 10
−
4
) = 3.40
Ba(OH)
2
→ Ba
2+
+ 2 OH
−
pH = 14.0 - 3.40 = 10.60
Kwasy i zasady
Gdy zmierzymy pH 0.10 M kwasu octowego okaże się że jest ono
wyższe (mniej jonów H
3
O
+
) od pH zmierzonego dla roztworu HCl.
kwas
zasada
sprzężony
sprzężona
kwas
zasada
możemy uważać
za stałe
CH
3
COOH + H
2
O
H
3
O
+
+
CH
3
COO
−
Równowagi przeniesienia protonu opisane są stałymi równowagi
O]
COOH][H
[CH
]
COO
][CH
O
[H
K
2
3
3
3
c
−
+
=
COOH]
[CH
]
COO
][CH
O
[H
K
3
3
3
a
−
+
=
stała
kwasowości
dla CH
3
COOH K
a
= 1.8· 10
-5
pK
a
= 4.75

Kwasy i zasady
Im większa wartość stałej K
a
tym większa jest moc
protodonorowa kwasu (mocniejszy kwas)
Im większa jest wartość stałej zasadowości K
b
tym większa
moc protonoakceptorowa zasady (mocniejsza zasada)
Podobne rozważania można przeprowadzić dla zasad
otrzymujemy wtedy stałą zasadowości K
b
Jak powiązana jest moc kwasu ze sprzężoną z nim zasadą?
Im mocniejszy kwas tym słabsza sprzężona z nim zasada
Im mocniejsza zasada tym słabszy sprzężony z nią kwas
Jak interpretować wartości stałych?
Kwasy i zasady
Rozważmy równowagę przeniesienia protonu do zasady NH
3
K
a
· K
b
= K
w
NH
3
+ H
2
O NH
4
+
+
OH
−
oraz równowagę reakcji przeniesienia protonu od kwasu NH
4
+
:
NH
4
+
+
H
2
O NH
3
+
H
3
O
+
]
[NH
]
][NH
O
[H
K
4
3
3
a
+
+
=
]
[NH
]
][OH
[NH
K
3
-
4
b
+
=
]
][OH
O
[H
]
[NH
]
][OH
[NH
]
[NH
]
][NH
O
[H
K
K
-
3
3
-
4
4
3
3
b
a
+
+
+
+
=
=
⋅
Uwaga !!!
ta zależność odnosi się do wszystkich sprzężonych par kwas-zasada

Mocny Kwas
Bardzo Słaba Zasada
jodowodorowy
HI
I
-
jon jodkowy
chlorowy(VII)
HClO
4
ClO
4
-
jon chloranowy(VII)
bromowodorowy
HBr
Br
-
jon bromkowy
chlorowodorowy
HCl
Cl
-
jon chlorkowy
siarkowy(VI)
H
2
SO
4
HSO
4
-
jon wodorosiarczanowy
chlorowy(V)
HClO
3
ClO
3
-
jon chloranowy(V)
azotowy(V)
HNO
3
NO
3
-
jon azotanowy(V)
jon oksoniowy
H
3
O
+
H
2
O
woda
jon wodorosiarczanowy HSO
4
-
SO
4
2-
jon siarczanowy
fluorowodorowy
HF
F
-
jon fluorkowy
azotowy(III)
HNO
2
NO
2
-
jon azotanowy(III)
octowy
CH
3
COOH
CH
3
COO
-
jon octanowy
węglowy
H
2
CO
3
HCO
3
-
jon wodorowęglanowy
siarkowodorowy
H
2
S
HS
-
jon wodorosiarczkowy
jon metyloamoniowy
CH
3
NH
3
+
CH
3
NH
2
metyloamina
woda
H
2
O
OH
-
jon wodorotlenowy
amoniak
NH
3
NH
2
-
jon amidkowy
wodór
H
2
H
-
jon wodorkowy
metan
CH
4
CH
3
-
anion metylowy
jon wodorotlenkowy
OH
-
O
2-
jon tlenkowy
Bardzo Słaby Kwas
Mocna Zasada
Obliczanie pH (mocny kwas + mocna zasada)
Zadanie
Do 100 ml roztworu HCl o pH = 0.3 dodano 100 ml 1% ługu sodowego.
Obliczy
ć
pH roztworu.
H
+
+ Cl
−
+ Na
+
+ OH
−
→ Na
+
+ Cl
−
+ H
2
O
obliczamy ilości moli H
+
i OH
-
pH
HCl
= 0.3
[H
3
O
+
] = 10
-0.3
= 0.5 mol/L
mol
0.05
5mol/L
.
L
.
n
O
H
3
=
⋅
=
+
0
100
0
pH= - log0.125 = 0.9
0.125mol/L
0.200L
0.025mol
0.100L
0.100L
0.025mol
-
0.050mol
v
v
n
-
n
]
O
[H
-
3
-
3
OH
O
H
OH
O
H
3
=
=
+
=
+
=
+
+
+
1% NaOH
w 100 g roztworu znajduje się 1 g NaOH
mol
0.025
40g/mol
1g
n
NaOH
=
=
pH roztworów słabych kwasów i zasad
Aby wyznaczyć pH roztworu słabego kwasu musimy
rozważyć równowagę pomiędzy tym kwasem HA a
sprzężoną z nim zasadą A
-
:
Jeśli dysocjacja cząsteczek HA jest jedynym źródłem jonów H
3
O
+
i jonów A
−
to:
HA + H
2
O H
3
O
+
+
A
−
[HA]
]
][A
O
[H
K
-
3
a
+
=
[H
3
O
+
] = [A
−
]
stężenie zaś niezdysocjowanego kwasu:
[HA] = c
HA
- [H
3
O
+
]
c
HA
- całkowite stężenie
rozpuszczonego kwasu
stosunek liczby (lub st
ęż
enia) cz
ą
steczek zdysocjowanych
do liczby (st
ęż
enia) wszystkich cz
ą
steczek wprowadzonych
do roztworu nosi nazw
ę
stopnia dysocjacji
α
c
]
O
[H
HA
3
+
=
α
!!!
pH roztworów słabych kwasów i zasad
Po podstawieniu tych danych do równania na stałą
dysocjacji kwasowej:
po przekształceniu otrzymujemy równanie kwadratowe:
]
O
[H
-
c
]
O
[H
[HA]
]
][A
O
[H
K
3
HA
2
3
-
3
a
+
+
+
=
=
[H
3
O
+
]
2
+ K
a
[H
3
O
+
] - K
a
c
HA
= 0
którego rozwiązanie pozwala nam znaleźć wartości [H
3
O
+
]
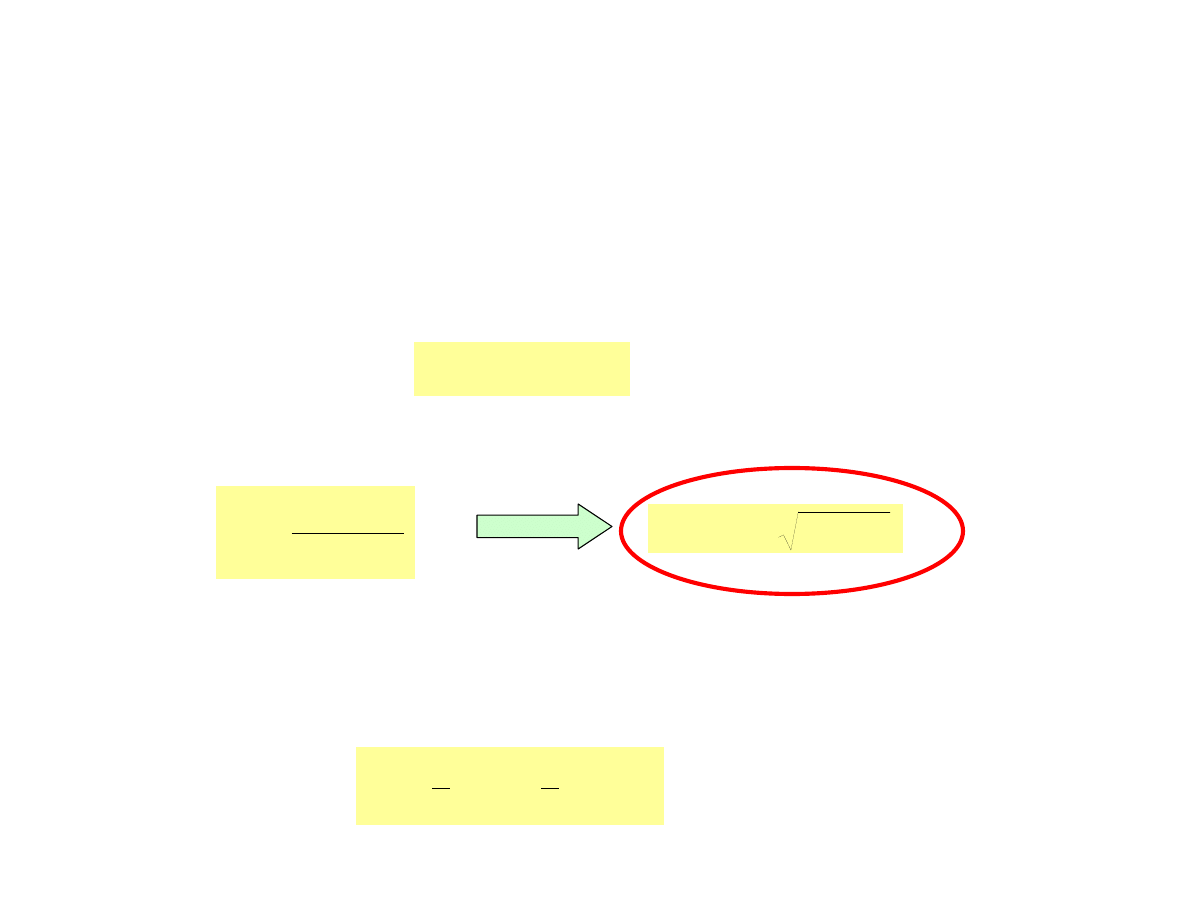
wzór do wykorzystania dla dowolnych roztworów słabych
kwasów za wyjątkiem roztworów bardzo rozcieńczonych
2
c
K
K
K
-
]
O
[H
HA
a
2
a
a
3
4
+
+
=
+
pH roztworów słabych kwasów i zasad
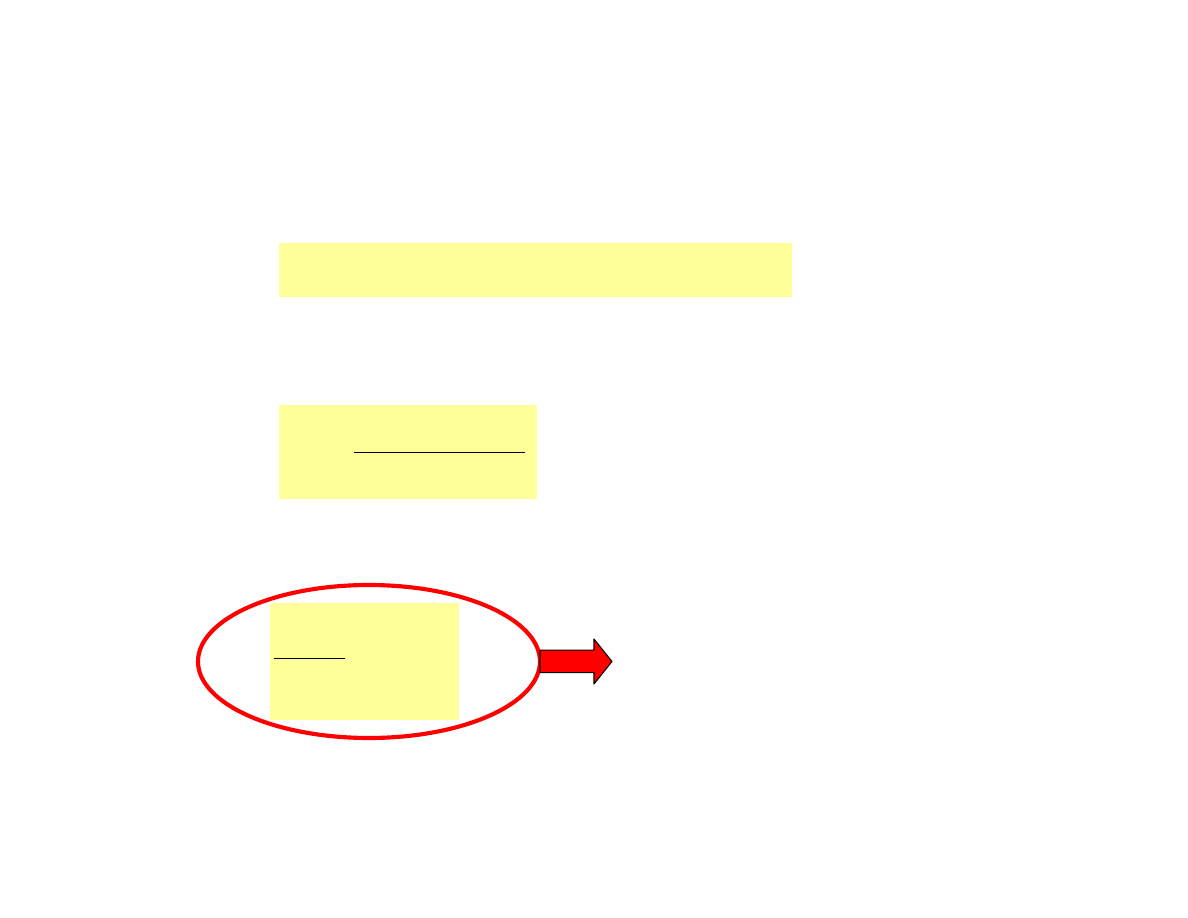
Jeżeli kwas jest słabo zdysocjowany -
ubytek stężenia formy niezdysocjowanej względem
całkowitego stężenia nie przekracza 5% wówczas:
a zatem :
c
]
O
[H
K
HA
2
3
a
+
=
[HA] ≅ c
HA
lub w postaci logarytmicznej:
c
K
]
O
[H
HA
a
3
=
+
HA
a
c
log
2
1
pK
2
1
pH
−
=
pH roztworów słabych kwasów i zasad
mamy tu więc inne kryterium
stosowalności uproszczonego
wzoru na obliczanie stężenia
jonów [H
3
O
+
]
gdy:
[H
3
O
+
] = [A
−
] ≤ 0.05 c
HA
wówczas dla równania :
]
O
[H
-
c
]
O
[H
K
3
HA
2
3
a
+
+
=
otrzymujemy zależność:
400
K
c
a
HA
≥

pH roztworów słabych kwasów i zasad
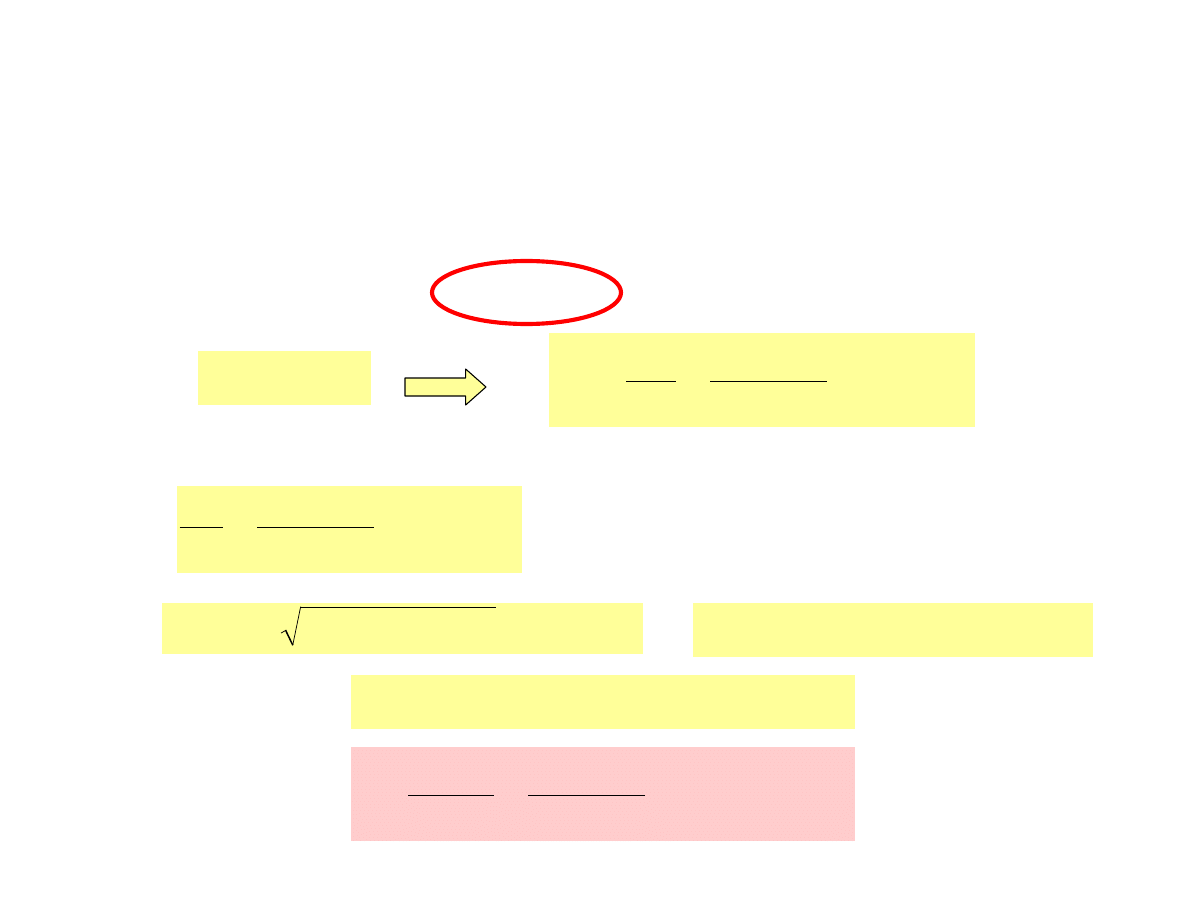
Zadanie
Obliczyć pH roztworu kwasu mlekowego o stężeniu 0.20 mol/L,
wiedząc że K
a
tego kwasu wynosi 8.4· 10
-4
.
pH=-log[H
3
O
+
] = -log0.0126 = 1.90
!!!
sprawdzamy który z wzorów możemy zastosować:
0.20
K
c
a
HA
238
10
4
.
8
4
=
⋅
=
−
wartość < 400 tak więc musimy
zastosować pełne równanie
0126
.
0
2
4
=
=
⋅
⋅
⋅
+
⋅
+
⋅
=
+
0.0251
2
0.20
10
8.4
)
10
(8.4
10
8.4
-
]
O
[H
4
-
2
4
-
4
-
3
pH roztworów słabych kwasów i zasad
Zadanie
Obliczyć pH oraz stopień dysocjacji pirydyny w jej roztworze o
stężeniu 0.20 mol/L. K
a
(
C
5
H
5
NH
+
)=2.3· 10
-9
.
pH=pK
w
- pOH= 14-3.03=10.97
!!!
sprawdzamy który z wzorów możemy zastosować:
0.20
K
c
b
B
4
6
10
7
.
4
10
3
.
4
⋅
=
⋅
=
−
wartość >> 400 tak więc możemy
zastosować uproszczone równanie
4
10
3
.
9
.
4
−
−
⋅
=
⋅
⋅
=
10
3
0.20
]
[OH
6
-
pOH= -log(9.3· 10
-4
)=3.03
%
47
.
0
%
100
10
3
.
4
=
⋅
⋅
=
=
−
−
0.2
9
c
]
[OH
B
α
K
a
· K
b
=K
w
6
9
14
a
w
b
10
4.3
10
2.3
10
K
K
K
−
−
−
⋅
=
⋅
=
=

pH roztworów mieszanin
W mieszaninie kwasów o pH decyduje stężenie H
3
O
+
z
najmocniejszego kwasu
!!!
oczywiście stwierdzenia te są słuszne dla układów
znacznie różniących się od siebie wartościami pK
a
i o
podobnych stężeniach.
!!!
W mieszaninie zasad o pH decyduje stężenie OH
−
z
najmocniejszej zasady
Wyszukiwarka
Podobne podstrony:
7 Instytucjonalne teorie przedsiebiorstwa
TEORIE PIELĘGNIARSTWA 6
TEORIE 6 2013 R
19 Teorie porównanie
Trzy teorie osobowosci Trzy punkty widzenia
Teorie komunikowania masowego wyklad 1
TEORIE 1 2013 IIR
Teorie algorytmow genetycznych prezentacja
Teorie handlu zagranicznego wykład I
Teorie7r
Teorie handlu reszta H O S
BIOLOGICZNE TEORIE FIRMY prezentacja
poznawcze komponenty i teorie osobowosci1
Temat 3 Teorie handlu częsc 2
więcej podobnych podstron