
Krawczyk Aneta
Kocur Justyna
Przybyłowska Marta
Tracz Anna
Diagnostyka i chemioterapia
zakażeń wirusowych
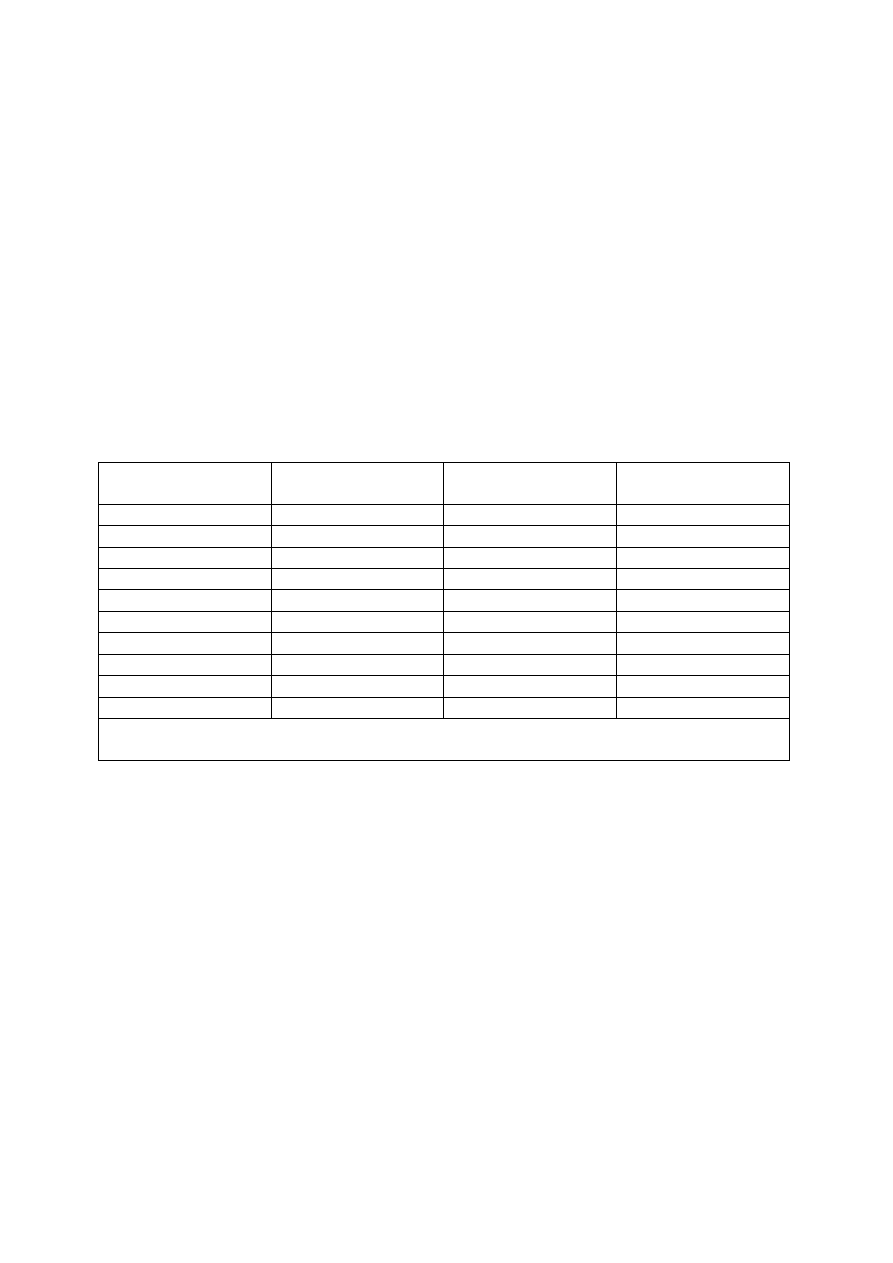
DIAGNOSTYKA ZAKAŻEŃ WIRUSOWYCH
Podstawową metodą diagnostyczną zakażeń wirusowych jest izolacja i
identyfikacja wirusa. Jest to metoda referencyjna dla wszystkich innych metod
diagnostycznych. Inną grupę metod stanowią te, które umożliwiają wykazanie
antygenów wirusowych w płynach ustrojowych, tkankach lub wydalinach i
wydzielinach.
W niektórych zakażeniach wirusowych poza metodami bezpośrednimi
mają zastosowanie metody pośrednie, wykazujące obecność przeciwciał
przeciwwirusowych u chorych. Diagnostyka serologiczna niektórych zakażeń
wirusowych może być tylko jedyną dostępną metodą w wielu laboratoriach
klinicznych.
Grupa wirusów
Wykrycie antygenu
Izolacja wirusa
(hodowla)
Serologia
Adenowirusy
+
++
++ (2 surowice)
Enterowirusy
-
++
-
virus Epsteina-Barr
+
++
++
Paramykowirusy
+
++
++
Rotawirusy
++
-
-
Rabies
++*
++*
++*
Togawirusy
-
+
++
RSV
++
++
++
HBV
++
-
++
CMV
-
+
++
++ metody podstawowe + rzadko stosowane
++* tylko w referencyjnych laboratoriach - nie stosowano
METODY IZOLACJI I IDENTYFIKACJI WIRUSÓW
Techniki zmierzające do izolacji i identyfikacji wirusów są stosowane w
laboratoriach referencyjnych. Ogólne zasady sprowadzają się do pobrania
materiału od chorego, jego transportu, a następnie wyboru odpowiedniej
techniki dla wzrostu (namnożenia) wirusa, obserwacji zmian w hodowli i
dokonania identyfikacji wirusa.
Próbki materiałów pobierane od chorych
Materiałami do badań mogą być: krew, płyn mózgowo-rdzeniowy,
wydzieliny układu oddechowego (plwocina, popłuczyny z nosa lub oskrzeli,
wymaz z gardła, materiał pobrany w czasie bronchoskopii, aspirat z nakłucia
przeztchawiczego), mocz, kał lub wymaz z odbytu, materiał ze zmian skórnych
(ropa, zeskrobiny, płyn pęcherzykowy, itp.).

Materiał powinien być uzyskany z miejsca, gdzie obserwowany jest
proces chorobo
wy. Należy pamiętać jednak o tym, że większość wirusów wnika
do organizmu przez drogi oddechowe lub przewód pokarmowy, gdzie wstępnie
się namnażają, a podstawowe objawy kliniczne występują w narządach dalej
położonych. W takich przypadkach właściwe jest pobieranie próbek materiałów
z kilku miejsc, niezależnie od miejsca chorobowego. Jest to użyteczne, kiedy
trudno jest uzyskać próbkę z narządu wewnętrznego lub gdy wirus jest trudny
do izolacji z docelowego narządu.
Próbki świeże powinny natychmiast być wykorzystywane do posiewów,
mogą być przechowywane w lodówce w stanie zamrożenia (-70°C). Przy
dłuższym transporcie zaleca się stosowanie podłoży transportowych, często z
dodatkiem antybiotyków w celu zahamowania wzrostu bakterii oraz przesyłanie
w termostatach (+ 4°C).
Techniki izolacji wirusów
Wirusy namnażają się
wyłącznie w żywych wrażliwych
komórkach. W warunkach
laboratoryjnych izolacja wirusa
jest
możliwa
dzięki
zastosowaniu
zwierząt
laboratoryjnych, zarodków
kurzych oraz tzw. hodowli
tkankowych lub komórkowych
prowadzonych w warunkach
sztucznych in vitro
. Używane są
hodowle pierwotne, linie
komórkowe diploidalne oraz
ustalone linie komórkowe –
heteroploidalne.

Typ hodowli
Charakterystyka
Przykłady
Podstawowe
wykorzystanie
Pierwotna
diploid, komórki
mieszanych typów, 1
lub 2 pasaże
pierwotna
nerki małpiej
Influenza,
Parainfluenza,
niektóre enterowi
rusy
Linie komórkowe
diploid, fibroblasty,
ograniczona liczba
pasaży (<50-70)
ludzkie, diploidalne
fibroblasty (WI-38,
MRC-5, HEL)
HSV, CMV, VZV,
Rhinovirus
Ustalone (ciągłe)
linie komórkowe
heteroploid, ciągłe
pasaże in vitro
HeLa, Hep-2
RSV, Adenovirus
Do hodowli ciągłej (ustalonej) używa się tkanek nowotworowych
pasażowanych przez wiele lat. Często używa się tkanek:
- HeLa – z nowotw
oru nabłonkowego szyjki macicy
- KB –
z nowotworu nabłonkowego jamy ustnej i języka
- FL –
tkanka ludzka z błony owodniowej
Linie komórkowe do izolacji wirusów stanowią najczęściej fibroblasty
mysie (L) lub fibroblasty ludzkie (WI-38, MRC-
5, HEL); są to tkanki
prawidłowe.
Wybór odpowiedniego typu hodowli tkankowej lub komórkowej zależy
od powinowactwa wirusa do
takich komórek. W celu izolacji
wirusa HIV stosowane są
specjalne hodowle limfocytów T
CD4 pochodzenia ludzkiego.
Wyizolowanie wirusa
polega na pobraniu
odpowiedniego
materiału
i
wstrzyknięciu
wrażliwemu
zwierzęciu lub zakażeniu zarodka
kurzego, czy też hodowli
tkankowej.
W
zakażonych
narządach lub tkankach po określonym czasie obserwuje się zmiany - efekty
cytopatyczne (CPE).
Liczne wirusy zawie
rają na powierzchni składniki, które mają zdolność
aglutynowania krwinek czerwonych różnych gatunków zwierząt i/lub
człowieka. Zjawisko to jest nazywane hemaglutynacją czynną (HA). Niektóre
wirusy adsorbują się tylko na powierzchni krwinek czerwonych, nie powodując
ich aglutynacji –
zjawisko to nazywane jest hemadsorpcją (HAd). Zjawiska HA
i HAd mogą występować z różnymi krwinkami i w różnych temperaturach
inkubacji. Służą one do dalszej lub jedynej (np. wirus grypy) identyfikacji
wirusów. Dla ostatecznej
identyfikacji wirusów stosuje się swoiste grupowo lub
typowo surowice odpornościowe.

Wykorzystywane są odczyny serologiczne:
1.
Odczyn neutralizujący wirusa.
2.
Odczyn wiązania dopełniacza (grupowe antygeny ortomyksowirusów).
3. Odczyn zahamowania hemaglutynacji czynnej – polega na dodaniu
surowicy odpornościowej do hodowli wirusów, które w ten sposób
związane zostają ze swoistymi przeciwciałami i pozbawione wolnych
receptorów biorących udział w połączeniu z krwinką, co w konsekwencji
daje zahamowanie hemaglutynac
ji; np. określane typów serologicznych
wirusa grypy.
4. Odczyn zahamowania hemadsorpcji –
wykorzystuje się hodowlę
kontrolną i zakażoną wirusami. Na powierzchni komórek zakażonych
wirusami adsorbują się krwinki czerwone, Dodanie surowicy
odpornościowej hamuje to zjawisko; zastosowanie w identyfikacji
myksowirusów.
5.
Immunofluorescencja bezpośrednia dla wielu wirusów jest ostatnio
końcowym etapem identyfikacji.
Do identyfikacji wirusów wykorzystywane jest również mikroskop
elektronowy. Swoiste antygeny w hodowli
coraz częściej są identyfikowane za
pomocą przeciwciał monoklonalnych w testach immunofluorescencji i
immunoenzymatycznych oraz neutralizacji wirusa. Coraz szersze wykorzystanie
ma również hybrydyzacja in situ.
BEZPOŚREDNIE WYKAZANIE WIRUSÓW W PRÓBKACH
MATERIAŁÓW
Mikroskop świetlny:
1.
Preparat
bezpośredni
barwiony
barwnikami
do
barwienia
histopatologicznego –
wykazanie obecności ciałek wtrętowych i/lub
komórek olbrzymich
2.
Preparat bezpośredni barwiony metodą immunoperoksydazową (PAP) –
metody immunohistochemiczne
3.
Mikroskopowa faza stała EIA

Mikroskop luminescencyjny:
1.
Technika immunofluorescencji bezpośredniej ze znakowanymi FITC
surowicami odpornościowymi
2.
Techniki immunofluorescencyjne w różnych odmianach (mikroskopowa
faza stała)
Mikroskop elektronowy:
1. Wy
kazanie cząstek wirusa w próbkach kału (Rotavirus, Norwalk,
adenowirusy jelitowe, HAV)
Metody immunologiczne do wykazania antygenów wirusowych:
1.
Różne odmiany metod immunoenzymatycznych (EIA, ELISA, dot-
ELISA) z przeciwciałami monoklonalnymi (np. RSV, Influenzavirus A,
B, Parainfluenza 1-3, HSV, VZV, CMV, Rotavirus)
2. Aglutynacja lateksowa (Rotavirus)
3.
Immunoelektroforeza przeciwprądowa (CIE) (Rotavirus)
4. Western blot (HIV)
Techniki molekularne:
1. Hybrydyzacja in situ
w skrawkach tkanek lub w teście probówkowym:
Adenovirus, CMV, HSV, HPV – sondy genetyczne znakowane
radioaktywnie
2. Hybrydyzacja in situ – sondy nieradioaktywne
a) sondy biotynylowane: handlowe odczynniki Enzo dla wirusów: HSV
1/2, CMV, HBV, HPV-1, EBV, HAV, JC, BK, SV-40, Adenovirus typ
5
b) sondy oligonukle
otydowe znakowane bezpośrednio za pomocą
fosfatazy alkalicznej dla: HSV-1, HSV-2, HSV1/2, HBV-sAg i HBV-
cAg
c) sondy molekularne znakowane chemiluminescencyjnie – gotowe
zestawy handlowe
3. Metody PCR

DIAGNOSTYKA SEROLOGICZNA ZAKAŻEŃ WIRUSOWYCH
W diagnostyce chorób wirusowych wykorzystywana jest rutynowo
diagnostyka serologiczna. Najczęściej wykonywane są testy umożliwiające
wykrycie obecności swoistych przeciwciał wobec określonych antygenów
wirusowych.
Stosuje się również testy wykrywające obecność rozpuszczalnych
antygenów wirusowych krążących we krwi.
Przeciwciała i antygeny wykrywane w surowicy nazywane są znacznikami
określonego zakażenia wirusowego. Potwierdzenie istniejącego czynnego
zakażenia wirusowego ma miejsce wówczas, gdy wykazywany jest antygen lub
swoiste przeciwciała IgM albo obserwowana jest serokonwersja ( wzrost 4-
krotny w kolejnym badaniu )
dla przeciwciał klasy IgG.
Przejściowe występowanie swoistych przeciwciał klasy IgM u noworodków
lub niemowląt wskazuje na zakażenie wrodzone lub okołoporodowe . Swoiste
IgM przeciwciała u dorosłych wskazują na kontakt pierwotny z antygenem lub
reaktywacją zakażenia bezobjawowego. Czterokrotne lub większe obniżenie
stężenia przeciwciał IgG , IgA wskazuje na przebyte zakażenie , bez
możliwości określenia czasu. Przeciwciała skierowane wobec licznych
antygenów wirusowych pozostają w organizmie przez miesiące , a nawet lata .
Wielokrotne badania serologiczne , najmniej dwóch próbek surowic , w okresie
2-
3 tygodni , mają zatem znaczenie diagnostyczne.
Do wykrywania obecności przeciwciał w surowicy stosowane są testy tj.:
- test neutralizacji (NT)
-
wiązanie dopełniacza (CF)
-
immunofluorescencji pośredniej (HF)
- zahamowanie hemaglutynacji (IH)
- metody immunoenzymatyczne (EIA)
CHEMIOTERAPIA ZA
KAŻEŃ WIRUSOWYCH.
Istniejecie
wiele
leków,
które
odpowiadałyby
kryteriom
chemioterapeutyków przeciwwirusowych. Oznacza to, że chemioterapeutyk
przeciwwirusowy powinien wykazywać hamujące (wirostatyczne) działanie na
swoiste funkcje wirusa, bez oddziaływania na metabolizm komórki gospodarza,
w której się namnaża. Zastosowanie w lecznictwie znalazły preparaty skuteczne
w zakażeniach wywołanych wirusami z rodziny Herpesviridae, Retroviridae
oraz u chorych z ciężkimi postaciami wirusowego zapalenia wątroby, rzadziej
grypą czy innymi zakażeniami. Spośród naturalnych substancji o działaniu
przeciwwirusowym zastosowanie terapeutyczne znalazły interferony. Hamują
one syntezę białek wirusowych. Uzyskanie drogą inżynierii genetycznej

interferonów r
ekombinowanych stworzyło możliwość ich zastosowania
praktycznego u chorych z przewlekłym wirusowym zapaleniem wątroby typu B
i C. Od lat 80, w związku z pojawieniem się problemu AIDS, prace nad nowymi
lekami przeciwwirusowymi koncentrowały się nad preparatami skutecznymi w
leczeniu zakażeń retrowirusowych. Obecnie stosowane, syntetyczne związki
przeciwwirusowe, ze względu na ich mechanizm działania można podzielić na:
I.
Hamujące proces odpłaszczania i uwalniania genomu do cytoplazmy
(amantadyna i rymantadyna).
II.
Hamujące wirusową polimerazę DNA, enzym który umożliwia przyłączenie
kolejnych nukleozydów, czyli reakcję polimeryzacji (widarabina,
idoksyurydyna, triflurydyna, cidofowir). Związki te są analogami naturalnych
nukleozydów, które wbudowują się do łańcucha DNA, uniemożliwiając dalszą
syntezę kwasu nukleinowego. Mają czasem groźne działania niepożądane, gdyż
mogą wbudowywać się także do DNA komórki gospodarza. Niektóre z nich
można stosować tylko miejscowo.
III. Analogi nukleozydów aktywowane przez wirus (acyklowir, walacyklowir,
pencyklowir, famcyklowir, gancyklowir) –
są pochodnymi guanozyny. Ich
mechanizm działania jest podobny do acyklowiru, różnią się biodostępnością i
znajdują zastosowanie w leczeniu zakażeń herpeswirusowych.
IV. Inhibitory rewertazy HIV –
hamujące odwrotną transkryptazę, enzym
kluczowy w procesie replikacji wirusa, przepisujący informację zawartą w RNA
na komplementarną nić DNA. Związki należące do tej grupy ze względu na
strukturę chemiczną dzieli się na nukleozydowe (np. zidowudyna, zalcytabina,
stawudyna, lamiwudyna, didanozyna) i nienukleozydowe (np. delawirydyna,
efawirenz, newirapina).
V. Inhibitory proteaz (np. amprenawir, indinawir, nelfinawir, sakwinawir,
ritonawir). Ta grupa leków blokuje miejsce aktywne enzymu, który jest
niezbędny w procesie dojrzewania i formowania cząstek wirusa HIV.
Unieczynnienie tego enzymu zatrzymuje proces namnażania wirusa w komórce.
VI
. Związki o szerokim zakresie działania (rybawiryna, foskarnet) – hamują
polimerazy wirusowe, a prz
ez to namnażanie zarówno DNA, jak i RNA
wirusów m.in. grypy, paragrypy, bunyawirusów, arenawirusów, retrowirusów,
adenowirusów.
VII.
Związki hamujące uwalnianie potomnych wirionów (zanamiwir i
oseltamiwir) – to niedawno odkryte selektywne inhibitory neuraminidazy wirusa
grypy typu A i B. Stosuje się także z dobrym skutkiem, szczególnie w
przypadkach osób zakażonych HIV, a ostatnio HBV i HCV, leczenie skojarzone
kilkoma lekami. Terapia HAART (ang. highly active anti–retroviral therapy)
polega na podawaniu
zazwyczaj 3 leków antyretrowirusowych o różnych
mechanizmach działania. Celem terapii HAART jest maksymalne obniżenie
poziomu wirusa we krwi, ochrona lub odbudowa układu immunologicznego,
poprawa jakości życia chorych, opóźnienie wystąpienia AIDS i wydłużenie
czasu życia zakażonych. Całkowita eradykacja HIV przy obecnych
możliwościach chemioterapii nie jest możliwa.
Największą grupę przebadanych związków stanowią inhibitory syntezy kwasów
nukleinowych, będące analogami nukleozydów. Odpowiedniki nukleozydów
mogą hamować funkcje enzymów uczestniczących w metabolizmie puryn lub
pirymidyn, polimerazy biorącej udział w replikacji kwasu nukleinowego, lub
mogą blokować syntezę kwasów nukleinowych poprzez wbudowanie się do
cząsteczki kwasu.
W lecznictwie znalazły praktyczne zastosowanie tylko:
- idoksurydyna
- widarabina
- triflurydyna
- rybawiryna
- acyklowir
- gancyklowir
- zydowudyna
Z wyjątkiem acyklowiru, gancyklowiru i zydowudyny analogi nukleozydów są
inhibitorami niespecyficznymi komórkowej i wirusowej replikacji. Tylko w.w.
związki charakteryzują się selektywnym działaniem wobec enzymów
wirusowych.
Idoksurydyna-
analog tymidyny działa na Hermes- i poxvirusy. Nie działa
wybiórczo. Mechanizm działania polega na hamowaniu syntezy DNA.
Stosowany miejscowo w pryszczkowym zapaleniu rogówki.
Widarabina-
działa na wirus opryszczki, Epsteina-Barr, ospy wietrznej, HBV.
Działanie polega na inhibicji syntezy DNA wirusa. Możliwość stosowania
doustnego.
Triflurydyna-
Działa na HSV 1 i 2, CMV, działa też na komórki gospodarza.
Mechanizm działania polega na hamowaniu syntezy DNA. Stosowany w
opryszczkowym zapaleniu rogówki.
Rybawiryna
stosowany w ciężkich zakażeniach wirusem RSV, wirusem HCV
(w połączeniu z interferonami alfa-2) i w innych infekcjach wirusowych.
Rybawiryna jest analogiem nukleozydów
purynowych. Jej działanie polega na
hamowaniu replikacji RNA i DNA niektórych wirusów, takich jak:
•
•
•
•
•
adenowirusy
•
•
niektóre pokswirusy
Lek stosowany jest w leczeniu przewlekłej formy wirusowego zapalenia
wątroby typu C w połączeniu z interferonem alfa-2a lub alfa-2b oraz z
peginterferonem alfa-2a lub alfa-2b (peginterferony to inaczej interferony
pegylowane
czyli z dołączoną cząsteczką glikolu polietylenowego
). Lek należy
zawsze łączyć z interferonem, ponieważ rybawiryna podawana w monoterapii u
chorych zakażonych HCV jest nieskuteczna. Ponadto rybawirynę stosuje się
podając wziewnie w ciężkich zakażeniach wirusem RSV u dzieci.
Acyklowir
Jest kompetytywnym inhibitorem polimerazy DNA-wirusa HSV
(opryszczki) i wirusa półpaśca (VZV). W komórkach zakażonych wirusem jest
aktywowany przez enzym wirusowy –
kinazę tymidynową, ulega fosforylacji do
monofosforanu,
z którego pod wpływem enzymów komórki powstaje
trójfosforan. Hamuje on wybiórczo nukleotydylotransferazę DNA- wirusa
zapobiegając jego namnażaniu. Wykazuje również słabsze działanie wobec
wirusów nie kodujących kinazy tymidynowej tj. EBV i CMV. Wśród wirusów
opryszczki spotyka się szczepy oporne na acyklowir, dotyczy to szczepów
mutantów niesyntetyzujących własnej kinazy tymidynowej. Lek wchłania się
dobrze z nabłonka rogówki, błony śluzowej nosa i z przewodu pokarmowego.
Podawany może być miejscowo, doustnie i dożylnie.
Gancyklowir
Swoisty inhibitor polimerazy wirusa cytomegalii (CMV). Wykazuje
również skuteczność w leczeniu zakażeń przewodu pokarmowego, zapalenia
płuc oraz objawów mononukleozy zakaźnej. Ze względu na wysoką toksyczność
( hamowanie funkcji szpiku) zastosowanie w.w. leku jest ograniczone do
przypadków zagrażających życiu.
Zydowudyna
Jest odpowiednikiem tymidyny, który ulega fosforylacji w zakażonych i
nie zakażonych komórkach do trójfosforanu tj. aktywnej zydowudyny. W takiej
postaci j
est wbudowana za pomocą odwrotnej transkryptazy (rewertazy), gdyż
silnie i selektywnie neutralizuje wirusową rewertazę. Mimo dużej toksyczności
lek stosowany jest w leczeniu HIV.
W leczeniu zakażeń wirusowych oraz innych chorób, zwłaszcza u
pacjentów z im
munosupresją, mają zastosowanie także różne leki o
właściwościach immunomodulujących. Duże nadzieje wiązane są z
wykorzystaniem rekombinowanych interferonów i innych cytokin oraz
przeciwciał monoklinalnych swoistych dla antygenów wirusowych, receptorów
komórkowych lub inhibitorów indukowanych przez wirusy.
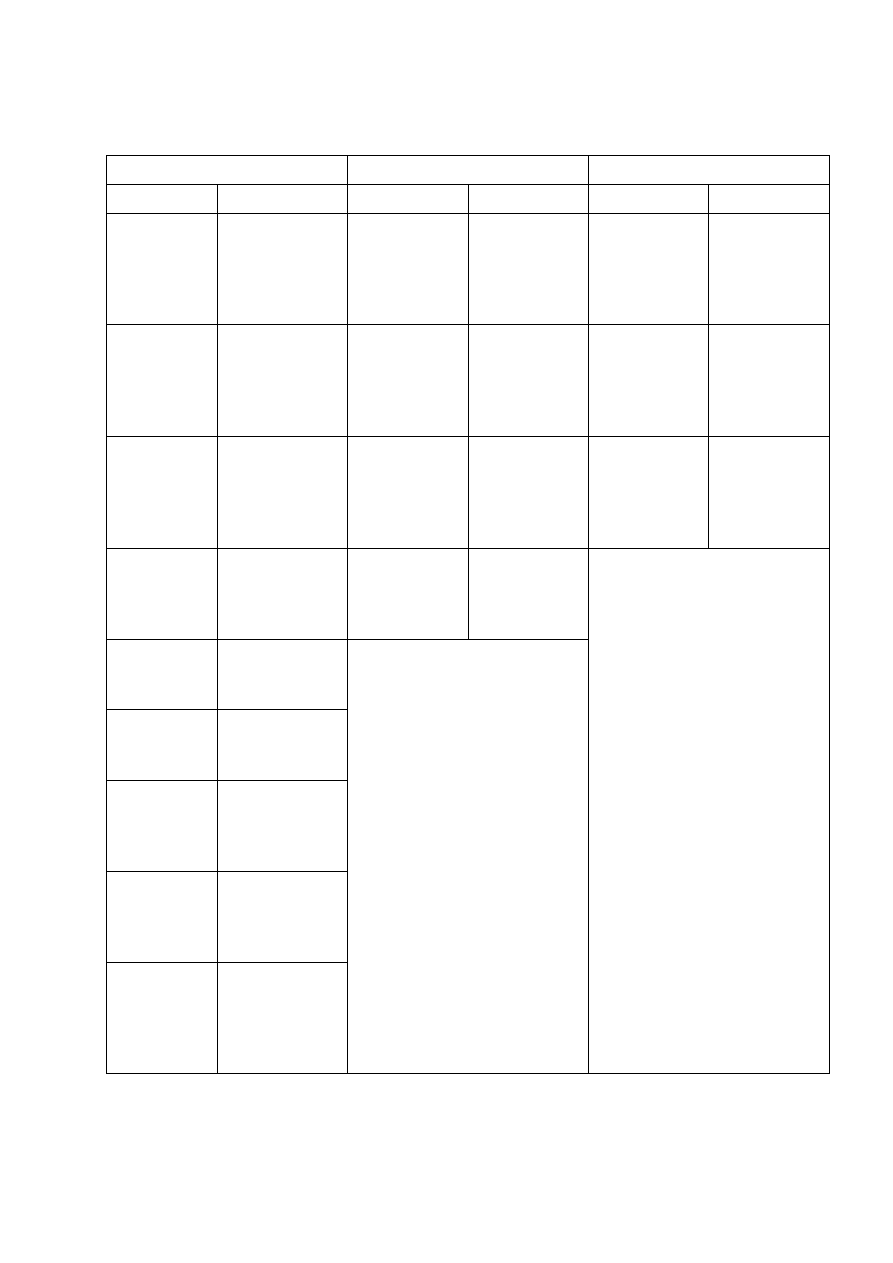
Zakażenia herpeswirusowe
Zakażenia układu oddechowego Wirusowe zapalenia wątroby
Preparat
Zastosowanie
Preparat
Zastosowanie
Preparat
Zastosowanie
Idoksyurydyn
a
HSV –
zapalenie
rogówki (tylko
miejscowo)
Amantadyna
Wirus grypy
typu A
Lamiwudyna
Wirus
zapalenia
wątroby typu B
Triflurydyna
HSV –
zapalenie
rogówki (tylko
miejscowo)
Rymantadyna
Wirus grypy
typu A
Rybawiryna
Wirus
zapalenia
wątroby typu C
Widarabina
HSV –
zapalenie
rogówki (tylko
miejscowo),
Rybawiryna
Wirus grypy
typu A i B,
wirus RS
Interferon
Wirus
zapalenia
wątroby typu B
i C
Acyklowir
Zakażenia
wywołane przez
HSV i VZV
Zanamiwir
Wirus grypy
typu A i B
Walacyklowir
Zakażenia
wywołane przez
HSV i VZV
Pencyklowir
Zakażenia
wywołane przez
HSV i VZV
Gancyklowir
Zakażenia
wywołane przez
CMV
Foskarnet
Zakażenia
wywołane przez
CMV
Cidofowir
Zakażenia
wywołane przez
CMV, a także
HSV, VZV,
EBV
Document Outline
Wyszukiwarka
Podobne podstrony:
DIAGNOZOWANIE NIESPRAWNOSCI INF Nieznany
diagnoza id 135226 Nieznany
1 Diagnostyka ukladu oddechoweg Nieznany (2)
IV diagnostyka hipo i hipergli Nieznany
Diagnostyka molekularna niedobo Nieznany
20 Diagnozowanie i naprawa ukla Nieznany
arkusz diagnozy n kl 2 (1) id 6 Nieznany
DIAGNOSTYKA ROZNICOWA ZAPALENIA Nieznany
Diagnostyka i niezawodnosc urza Nieznany
B Diagnostyka id 167979 Nieznany (2)
Diagnozowanie przyczyn nieprawi Nieznany
Podwojna diagnoza u osob uzalez Nieznany
Dofinansowanie pracownikowi zak Nieznany
Narzedzia diagnostyczne do ocen Nieznany
Diagnoza dojrzalosci szkolnej i Nieznany
Diagnoza psychopedagogiczna id Nieznany
więcej podobnych podstron