
Alkilowanie
ketonów
Wykonała
Joanna Puszcz
ALKILOWANIE
Jest to reakcja, w której traktujemy jon enolanowy
halogenkiem alkilowym.
Możliwe jest wprowadzenie grupy alkilowej zarówno przy
atomie tlenu, jak i przy atomie węgla.
Reakcja pozwala na wprowadzenie grup alkilowych przy
atomach węgla
α aldehydów i ketonów.
Jeżeli w cząsteczce są dwa węgle
α, przy których obecne
są protony, możliwe jest przeprowadzenie reakcji
alkilowania w dwóch różnych pozycjach.
WAŻNE ASPEKTY WSZYSTKICH
REAKCJI ALKILOWANIA
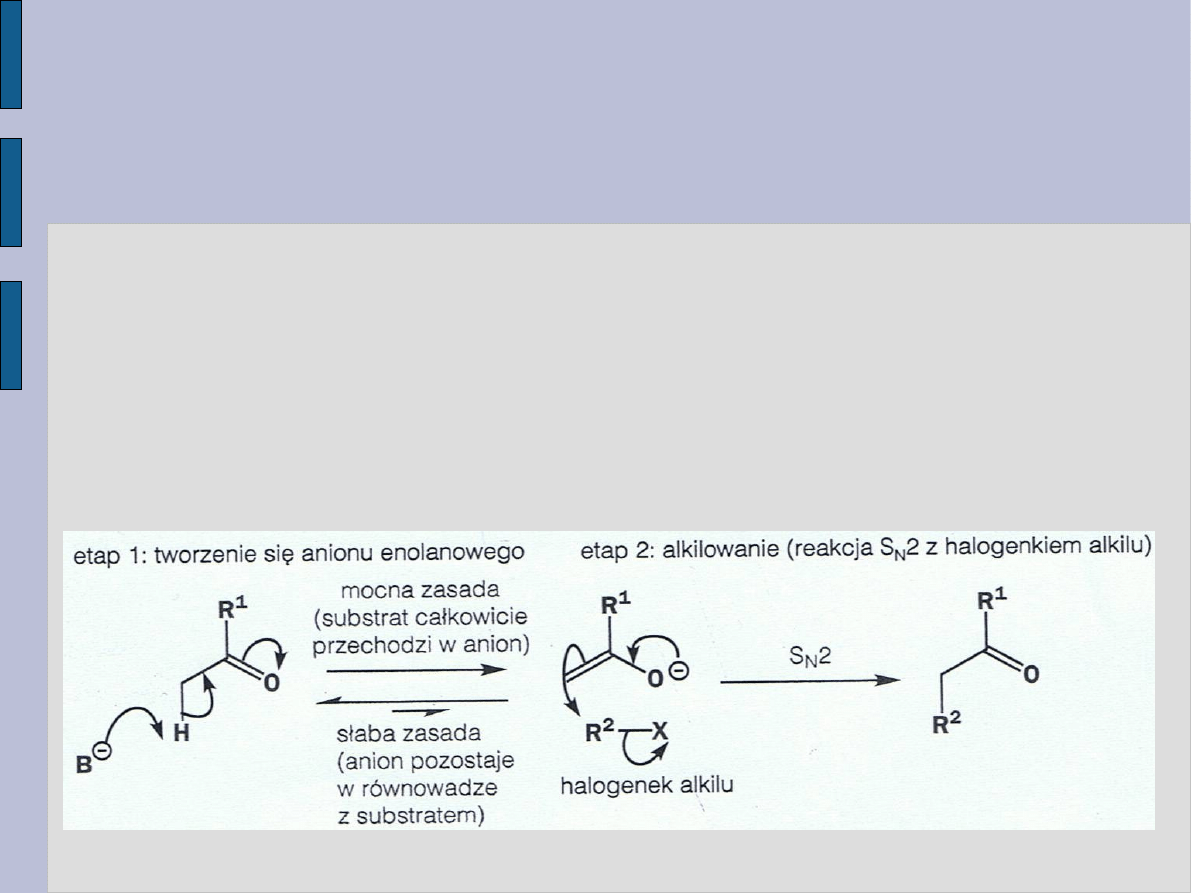
Reakcja ta składa się z dwóch etapów:
1) Otrzymanie trwałego anionu – przeważnie jonu enolanowego –
w wyniku deprotonowania za pomocą zasady.
2) Reakcja substytucji – atak nukleofilowego anionu na
elektrofilowy halogenek alkilu.

ALKILOWANIE KETONÓW
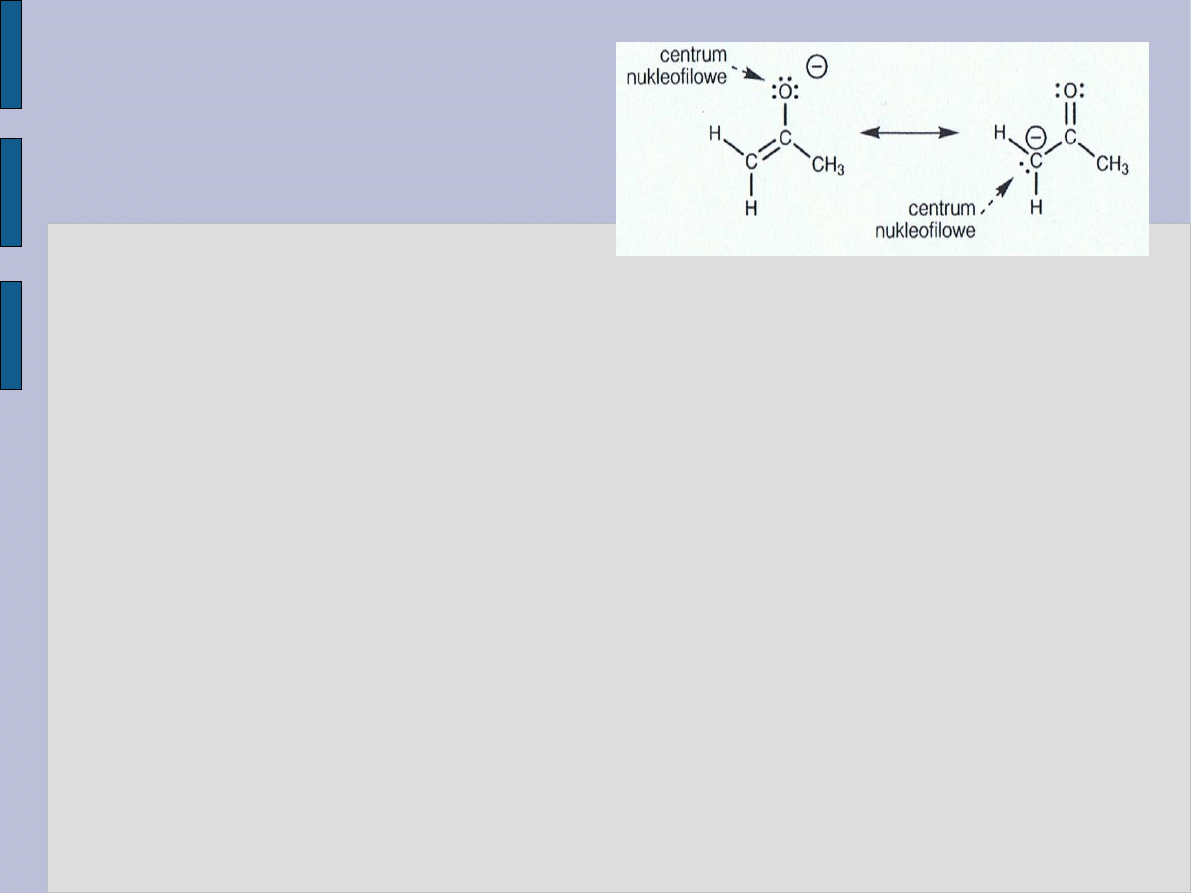
Sumaryczny wynik reakcji – zamiana protonu
α na grupę alkilową.
Centra nukleofilowe i elektrofilowe w jonie enolanowym i w
cząsteczce jodku metylu.
ALKILOWANIE KETONÓW
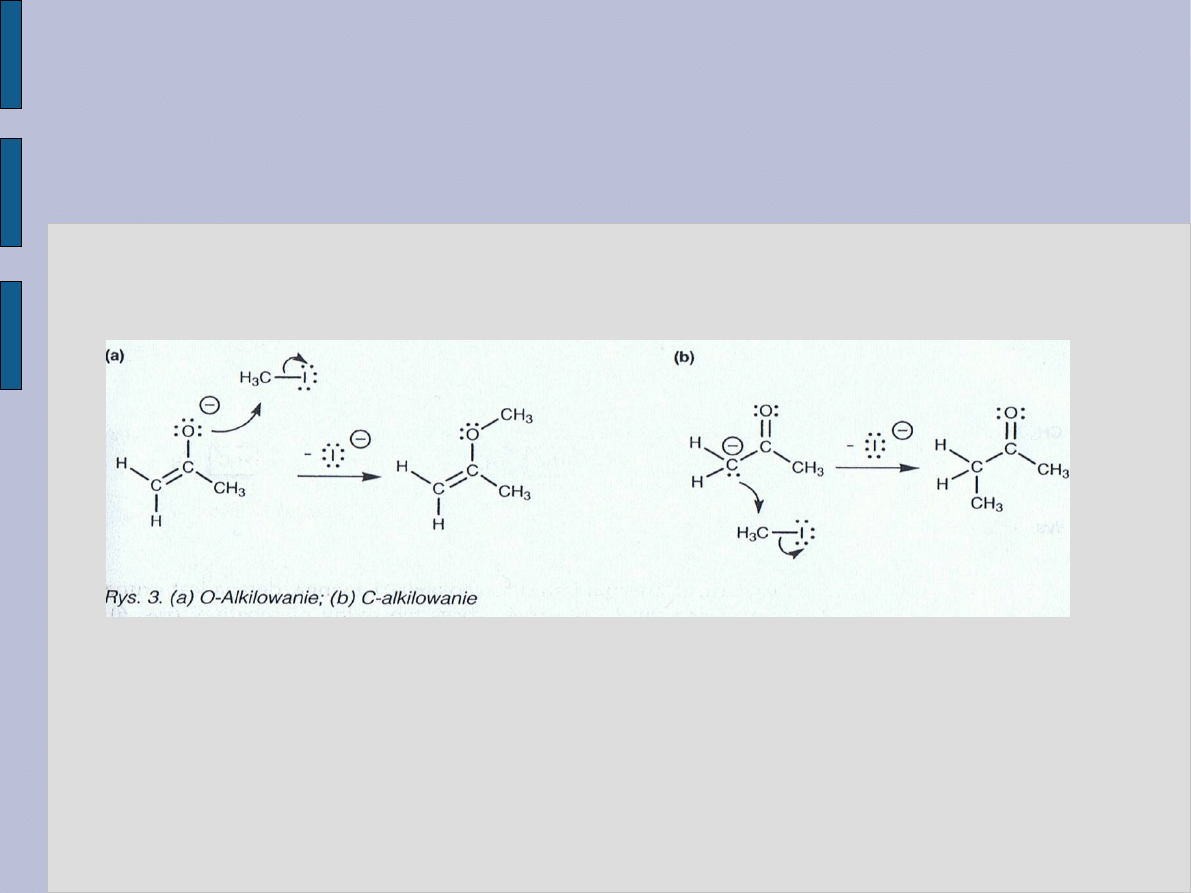
Możliwe jest wprowadzenie grupy alkilowej zarówno przy atomie
tlenu, jak i przy atomie węgla.
Druga reakcja ma większe znaczenie praktyczne, ponieważ powstają
w niej nowe wiązania węgiel – węgiel, co pozwala na otrzymanie
związków o rozbudowanym szkielecie węglowym.
ALKILOWANIE KETONÓW
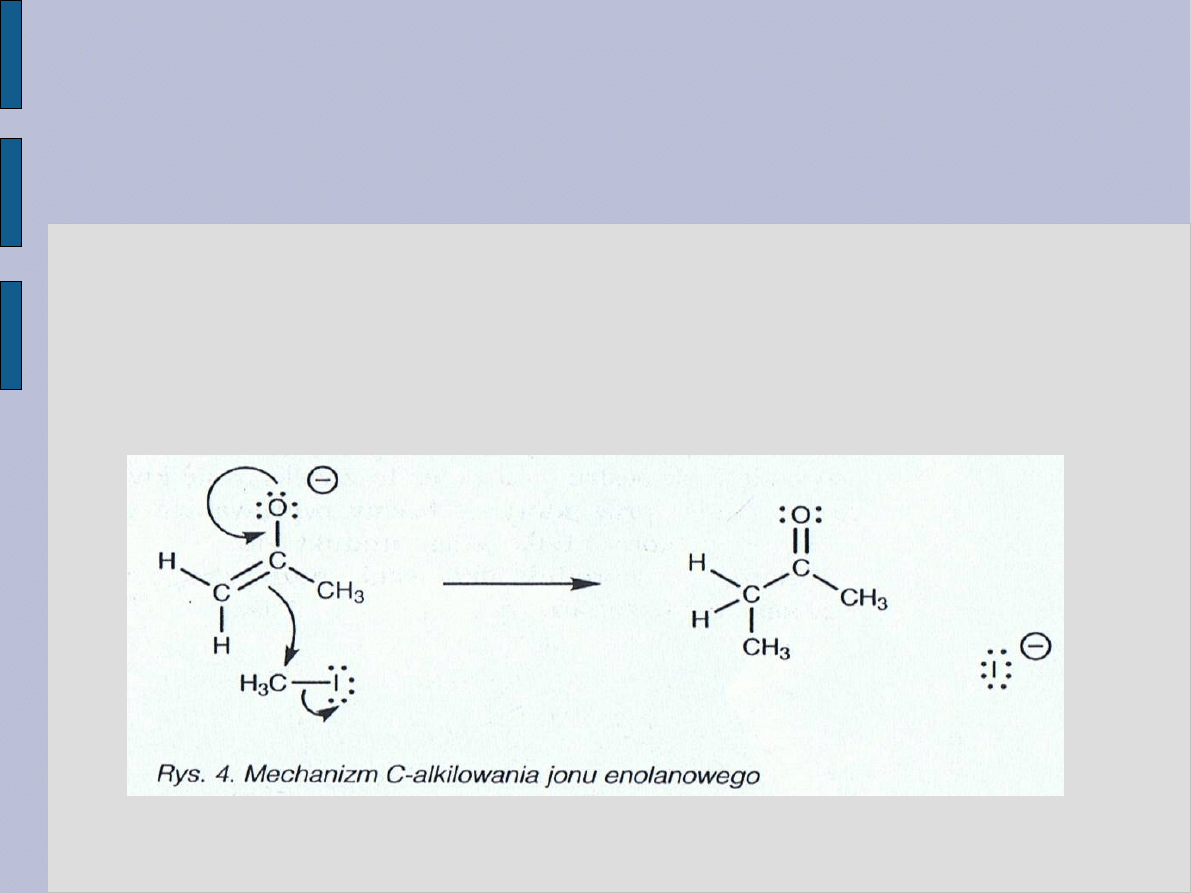
Jon enolanowy jest bardziej stabilny niż karboanion, ponieważ
ładunek ujemny znajduje się w nim na atomie elektroujemnego tlenu;
jest więc bardziej prawdopodobne, że reakcja będzie przebiegała
według podanego na rysunku 4 mechanizmu.
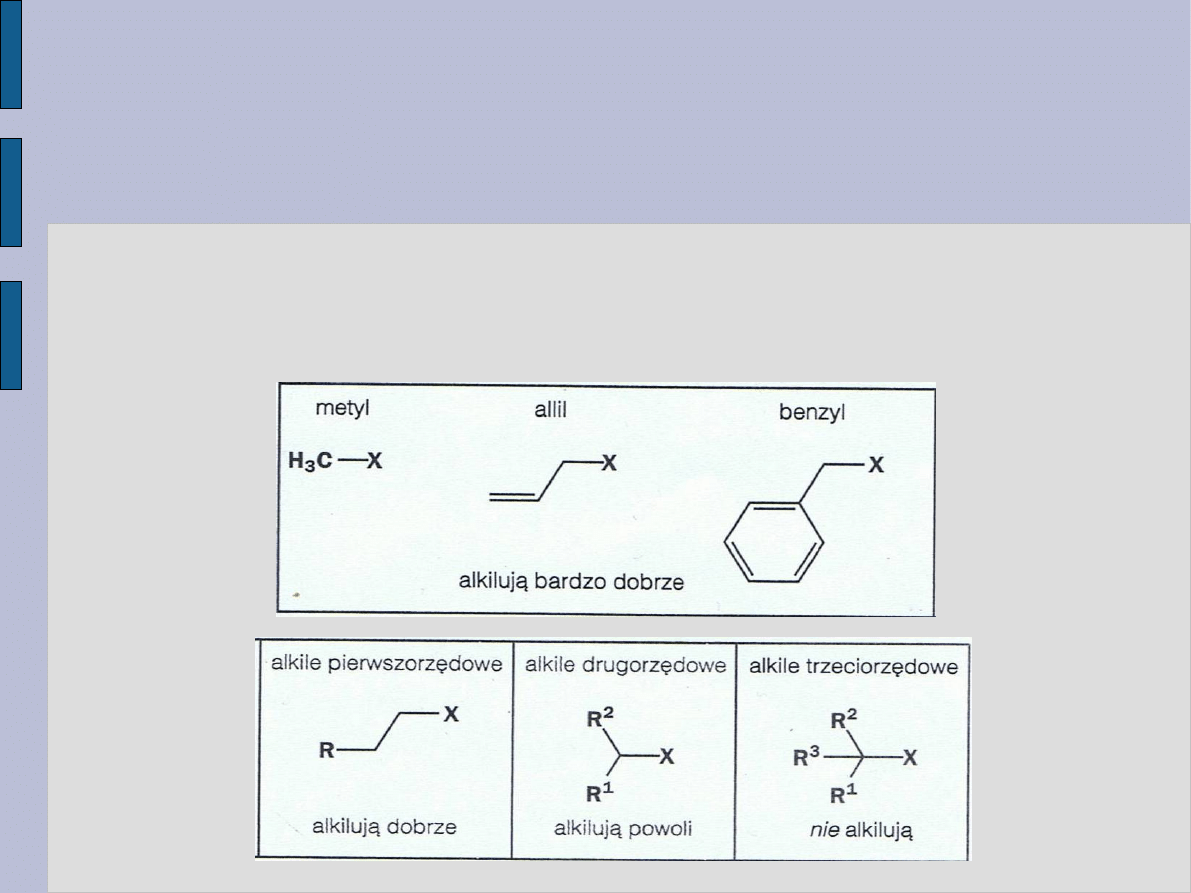
WYBÓR ELEKTROFILA W
PROCESIE ALKILOWANIA
Istnieją ograniczenia co do typu halogenku alkilowego, który
może zostać użyty w reakcji alkilowania. Konieczne jest użycie
elektorfila wykazującego skłonność do ulegania reakcji SN2.
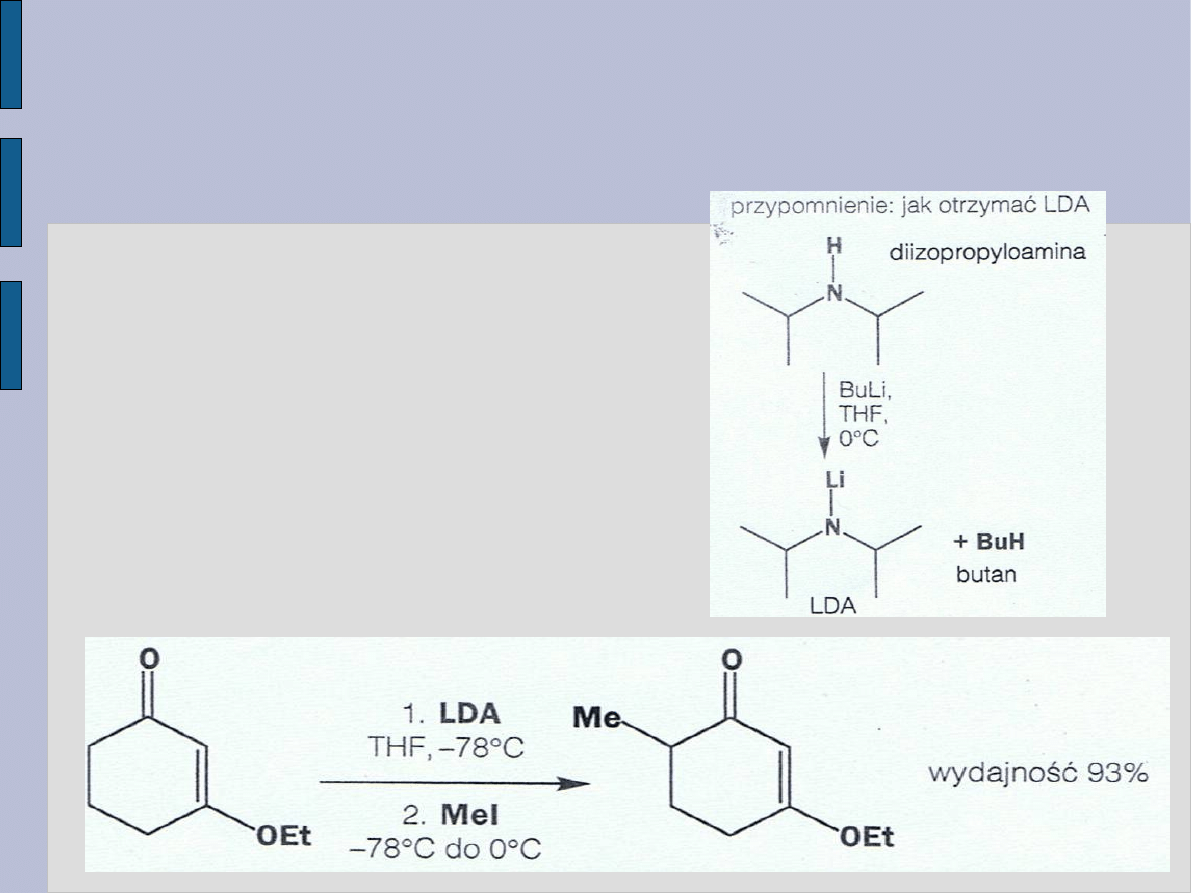
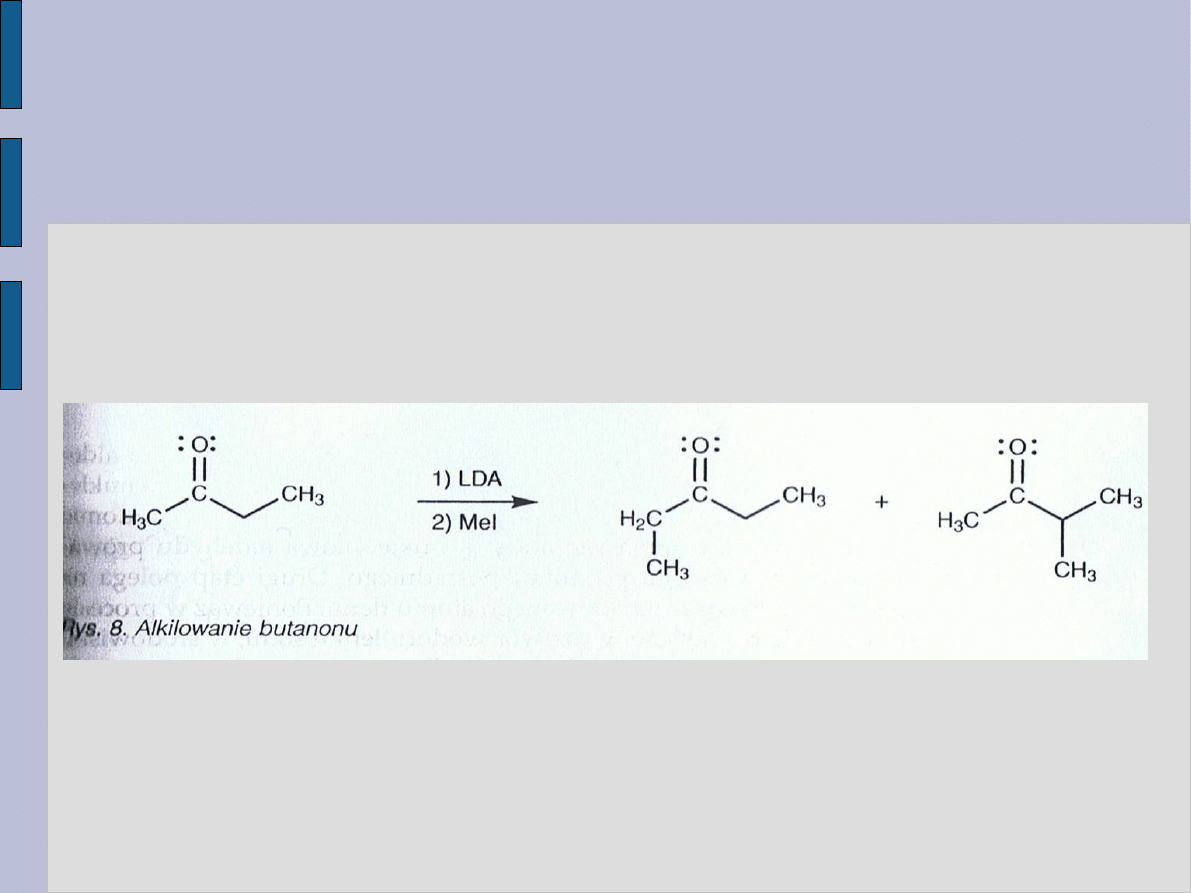
WYBÓR ZASADY W PROCESIE
ALKILOWANIA
Protony
α w katonie (w takim
jak propanon) są słabo
kwasowe, zatem do
utworzenia jonu enolanowego,
niezbędnego do zajścia reakcji
alkilowania, trzeba użyć
mocnej zasady np.
diizopropyloamidku litu – LDA.
WYBÓR ZASADY W PROCESIE
ALKILOWANIA
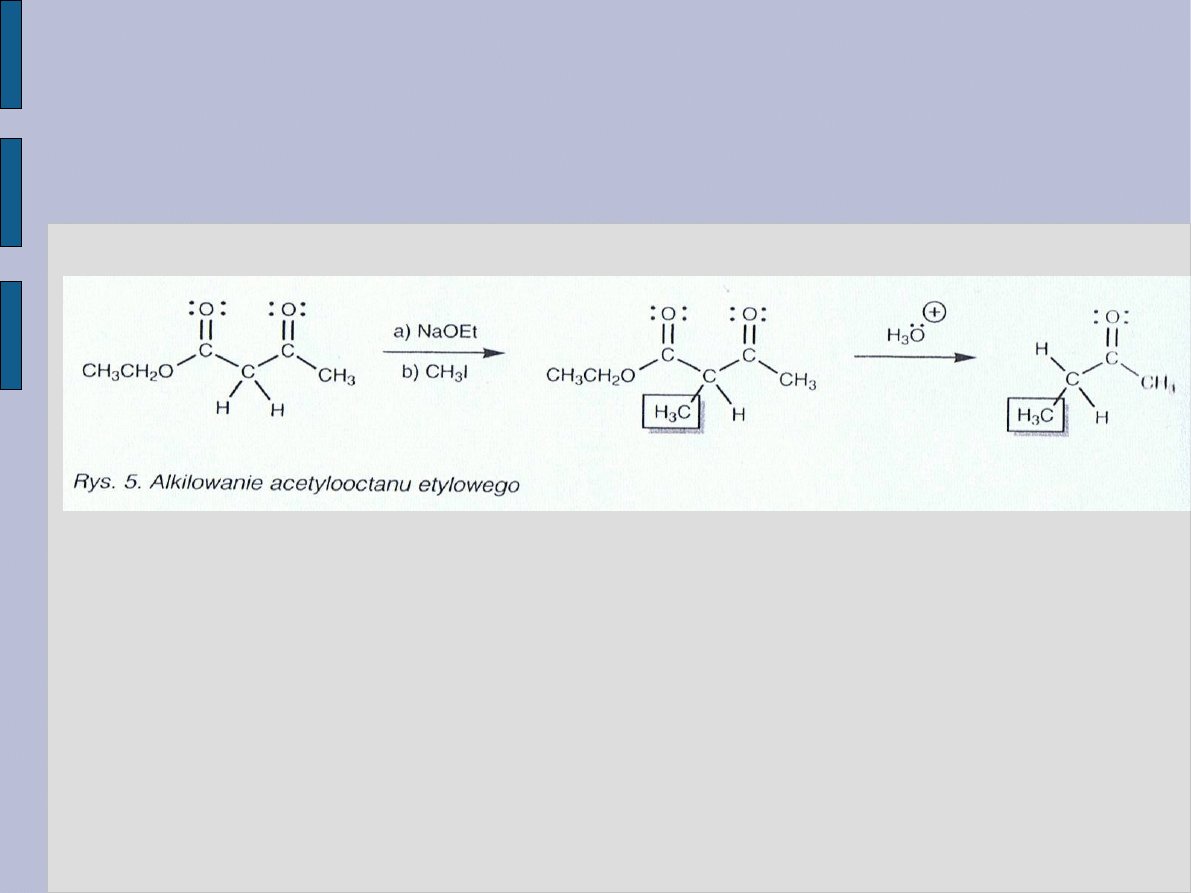
WYKORZYSTANIE
β – OKSOESTRÓW
Protony
α w acetylooctanie etylowym są bardziej kwasowe,
ponieważ po obu stronach węgla
α występują grupy
karbonylowe. W rezultacie jon enolanowy może powstawać
przy użyciu słabszej zasady takiej jak etanolan sodu (NaOEt).
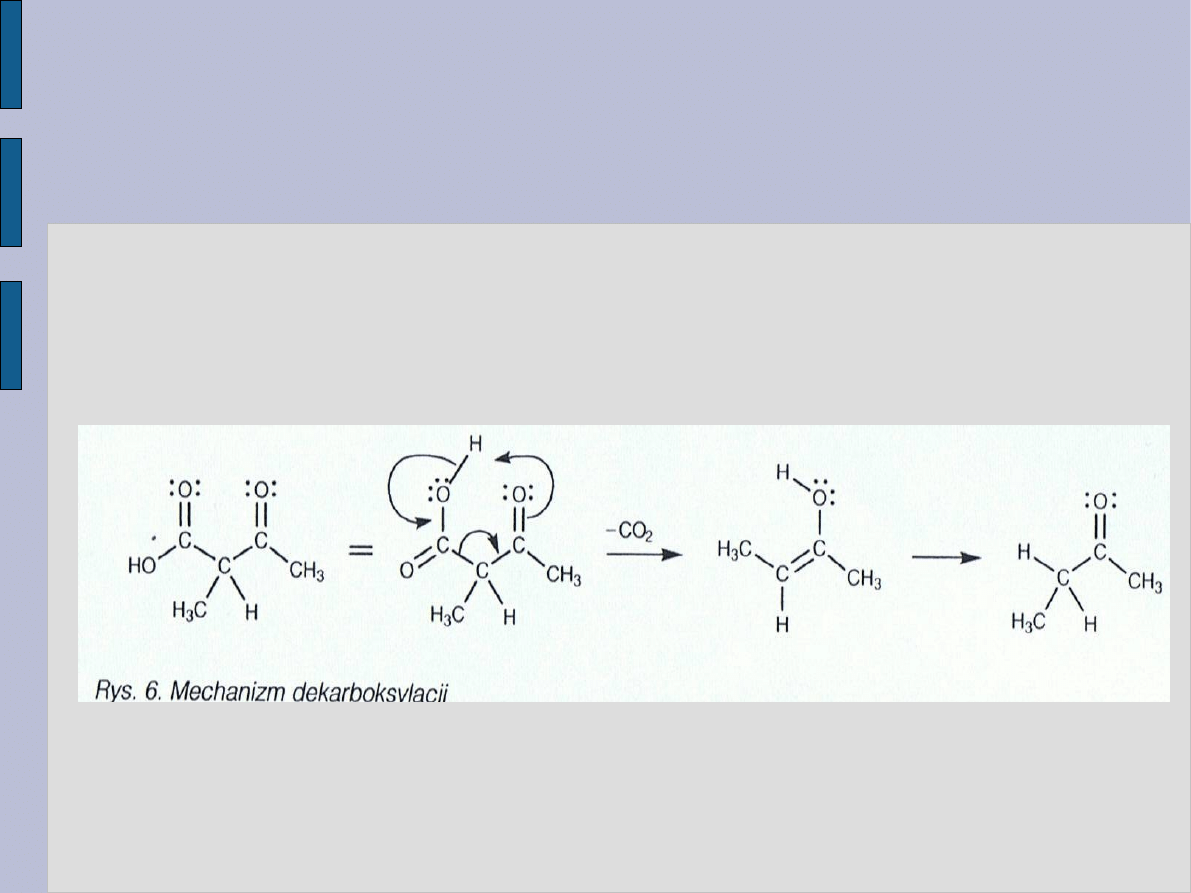
WYKORZYSTANIE
β – OKSOESTRÓW
Po zakończeniu alkilowania jonu enolanowego grupę estrową
można poddać hydrolizie i dekarboksylacji przez ogrzanie w
wodnym roztworze chlorowodoru.
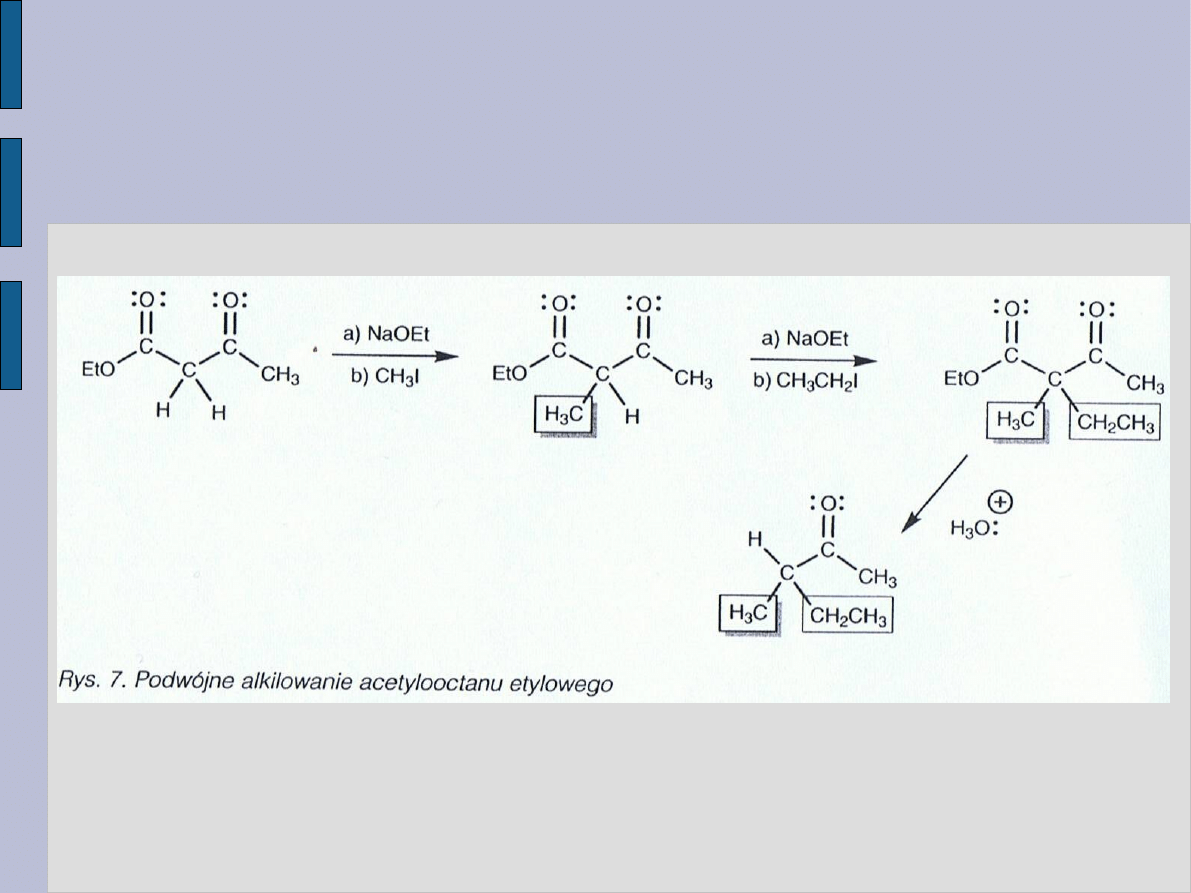
PODWÓJNE ALKILOWANIE
ACETYLOOCTANU ETYLOWEGO
WYKORZYSTANIE
β – OKSOESTRÓW
Jeżeli w cząsteczce są dwa węgle
α, przy których obecne są
protony, możliwe jest przeprowadzenie reakcji alkilowania w
dwóch różnych pozycjach.
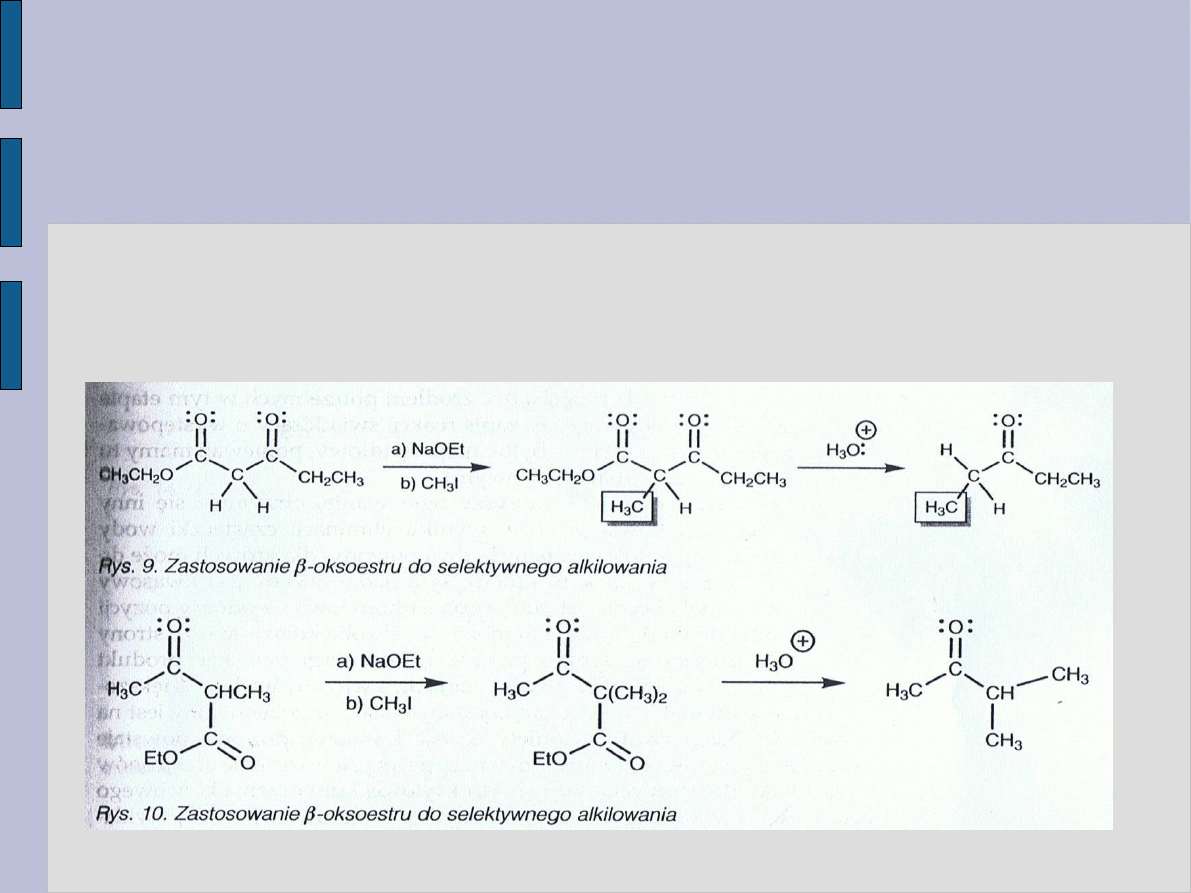
WYKORZYSTANIE
β – OKSOESTRÓW
Β – oksoestry pozwalają ominąć niedogodności, jakie
napotykamy przy alkilowaniu niesymetrycznych ketonów.
Document Outline
- Slajd 1
- Slajd 2
- Slajd 3
- Slajd 4
- Slajd 5
- Slajd 6
- Slajd 7
- Slajd 8
- Slajd 9
- Slajd 10
- Slajd 11
- Slajd 12
- Slajd 13
- Slajd 14
Wyszukiwarka
Podobne podstrony:
Alkilowanie ketonów
halogenki alkilowe
Anamnesis57 5c str 100 102
REAKCJA ALKILOWANIA IV-RZĘDOWYCH SOLI AMONIOWYCH, Uczelnia PWR Technologia Chemiczna, Semestr 5,
Praktyczne programowanie, R 5c-04, Szablon dla tlumaczy
S 3 4 jednofunkcyjne do ketonów
CCNA1 lab 10 3 5c pl
ŚrodkiTransportu Dalekiego wykład 5c
materialy 5c
5C tekst
08 Alkilowanie 2005
halogenowanie i alkilowanie
Ćwiczenie 5C R
Czesc 5c Slupy scisk osiowo
lab 10 3 5c
Zadania z reakcji substytucji nukleofilowej i eliminacji w halogenkach alkilowych
więcej podobnych podstron