
GRAWIMETRIA

GRAWIMETRIA
Zastosowanie reakcji strącania osadów
•
analiza wagowa (grawimetria)
•
miareczkowanie strąceniowe (precypitymetria)
•
rozdzielanie
•
wydzielanie i wzbogacanie śladowych ilości
wielu pierwiastków (współstrącanie)
GRAWIMETRIA
Zasada oznaczenia:
•
analit strąca się ilościowo w postaci
trudnorozpuszczalnego osadu;
•
oddzielony osad zazwyczaj przeprowadza się
w jednoznacznie zdefiniowany związek
chemiczny;
•
z masy ważonego osadu obliczamy zawartość
analitu w analizowanej próbce
m=m
os
·F · V
k
/V
p

GRAWIMETRIA
Cechy osadu w analizie wagowej:
1) właściwości fizyczne (zależne od analityka):
•
mała rozpuszczalność R
os
< 10
-6
mol /dm
3
2) właściwości chemiczne (niezależne od
analityka):
•
określony skład chemiczny w warunkach
ważenia
•
mały udział analitu w masie osadu
3) właściwości strukturalne (zależne od
analityka):
•
czysty
•
dogodny do sączenia
Osad trudnorozpuszczalny
Jedynie sensownie możemy mówić o pojęciach,
które można zmierzyć (dotyczy nauk ścisłych)
Nils Bohr
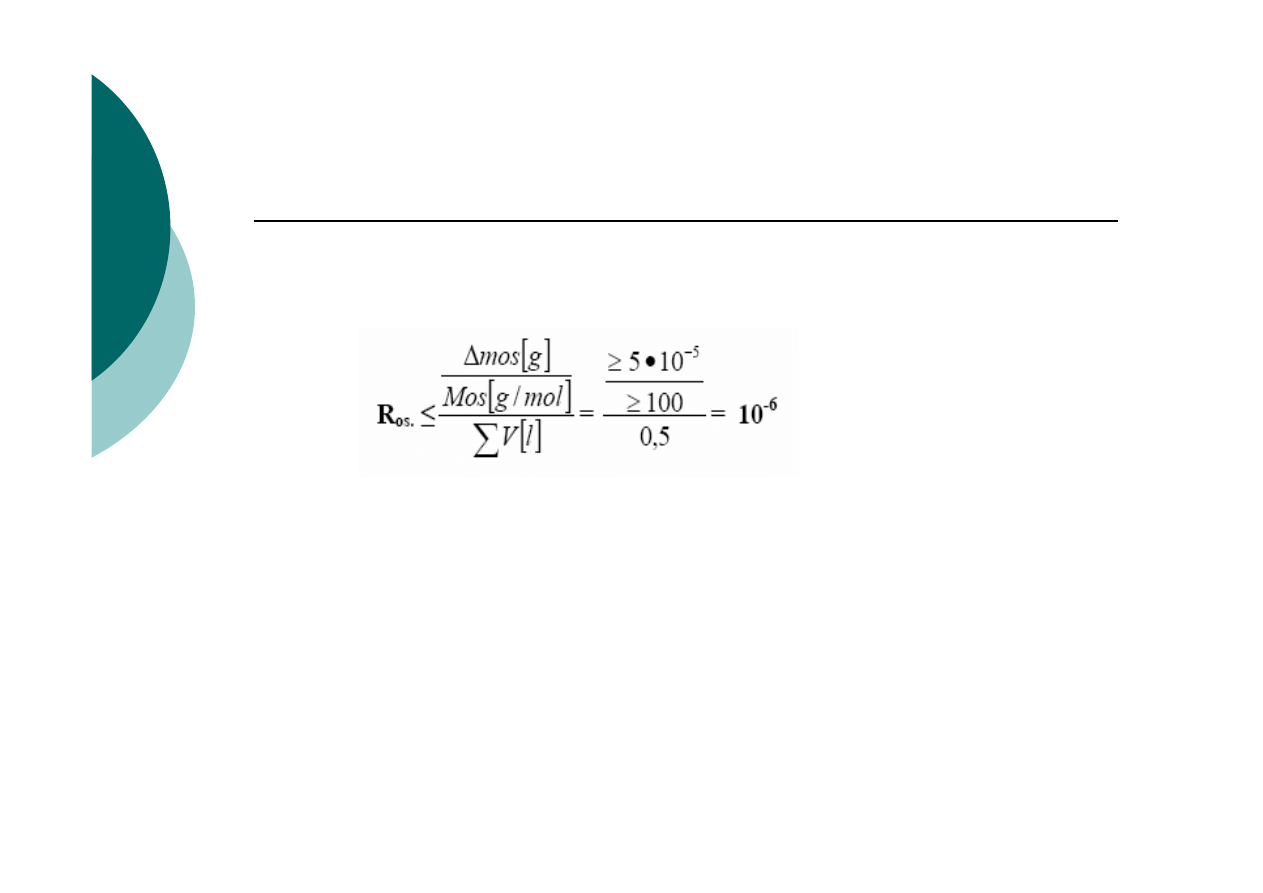
1. Pojęcie osad trudnorozpuszczalny zależy od klasy
wagi, a więc i skali oznaczeń.
2. Waga analityczna
∆m
os
≥0,05 mg=5· 10
-5
g
3. W przeciętnych warunkach analizy w skali
decygramowe (makroanalitycznej)
∑v
≅ O,5 l
4. Masa molowa strącanego osadu
M
os
≥100 g⁄mol
Osad trudnorozpuszczalny
5. Osiągamy stan nasycenia. Strata osadu nie powinna
być większa niż dokładność ważenia
[mol/l]
Uwaga:
BaSO
4
(K
SO
≈10
-8
); AgCl (K
SO
≈10
-10
);
PbSO
4
(K
SO
≈10
-8
)
R
os
jest rzędu 10
-5
- 10
-4
mol/l
Wykorzystać efekt wspólnego jonu (nadmiar)

Rozpuszczalność osadu
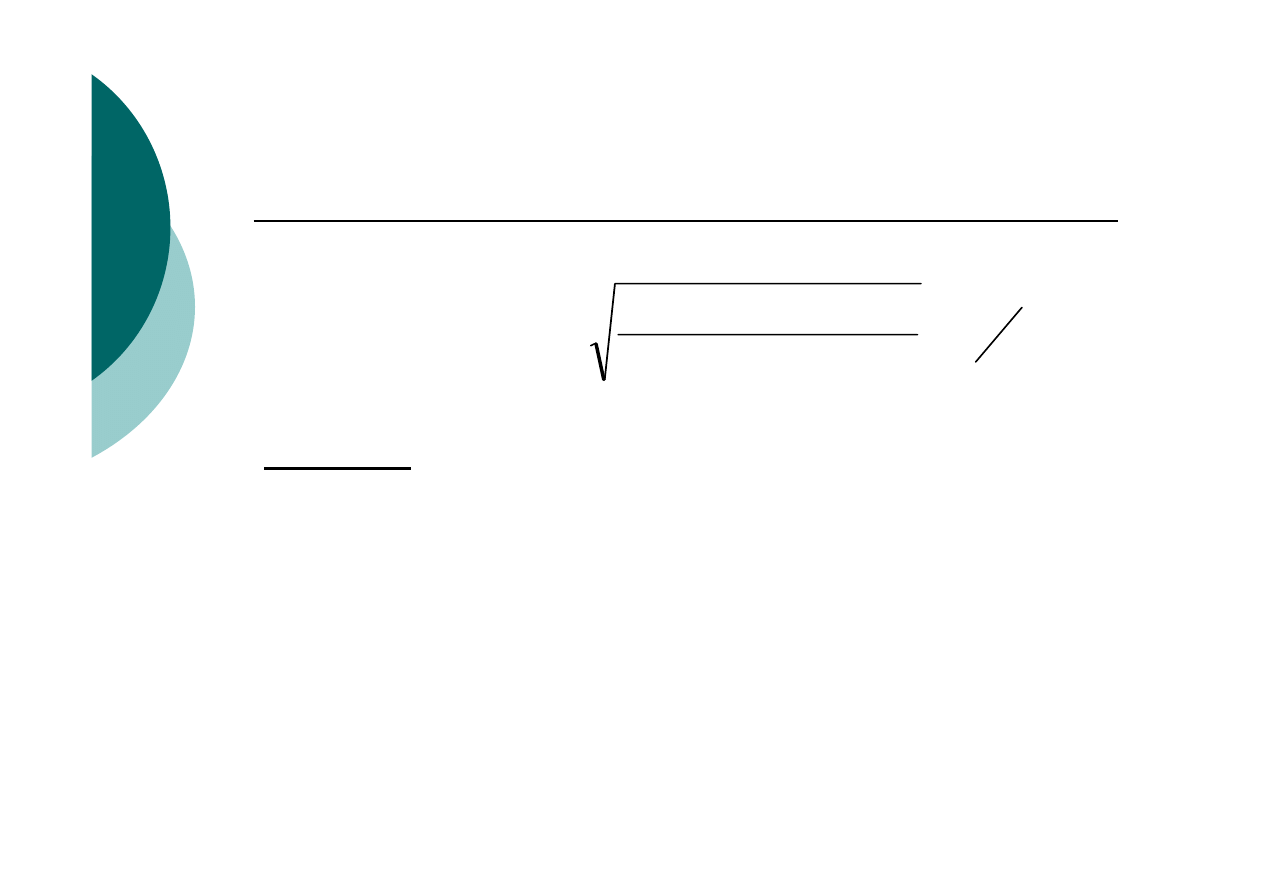
Rozpuszczalność osadu:
z R moli osadu o wzorze A
m
B
n
po rozpuszczeniu w
roztworze powstaje:
- mR moli jonów [A
n+
] oraz nR moli jonów [B
m-
]
czyli
K
a
SO
= [mR]
m
·[nR]
n
·f
m
A
·f
n
B
= R
m+n
·(m
m
·n
n
) ·f
m
A
·f
n
B
GRAWIMETRIA
Stąd:
Wnioski: Przy tej samej wartości K
a
So
dla osadów
o różnym wzorze
•
o rozpuszczalności R osadu decyduje suma
współczynników we wzorze chemicznym
(m+n);
•
im niższe m+n tym mniejsza rozpuszczalność
[
]
l
mol
f
f
n
m
K
R
n
m
B
n
A
m
n
m
SO
a
AmBn
a
+
⋅
⋅
⋅
=
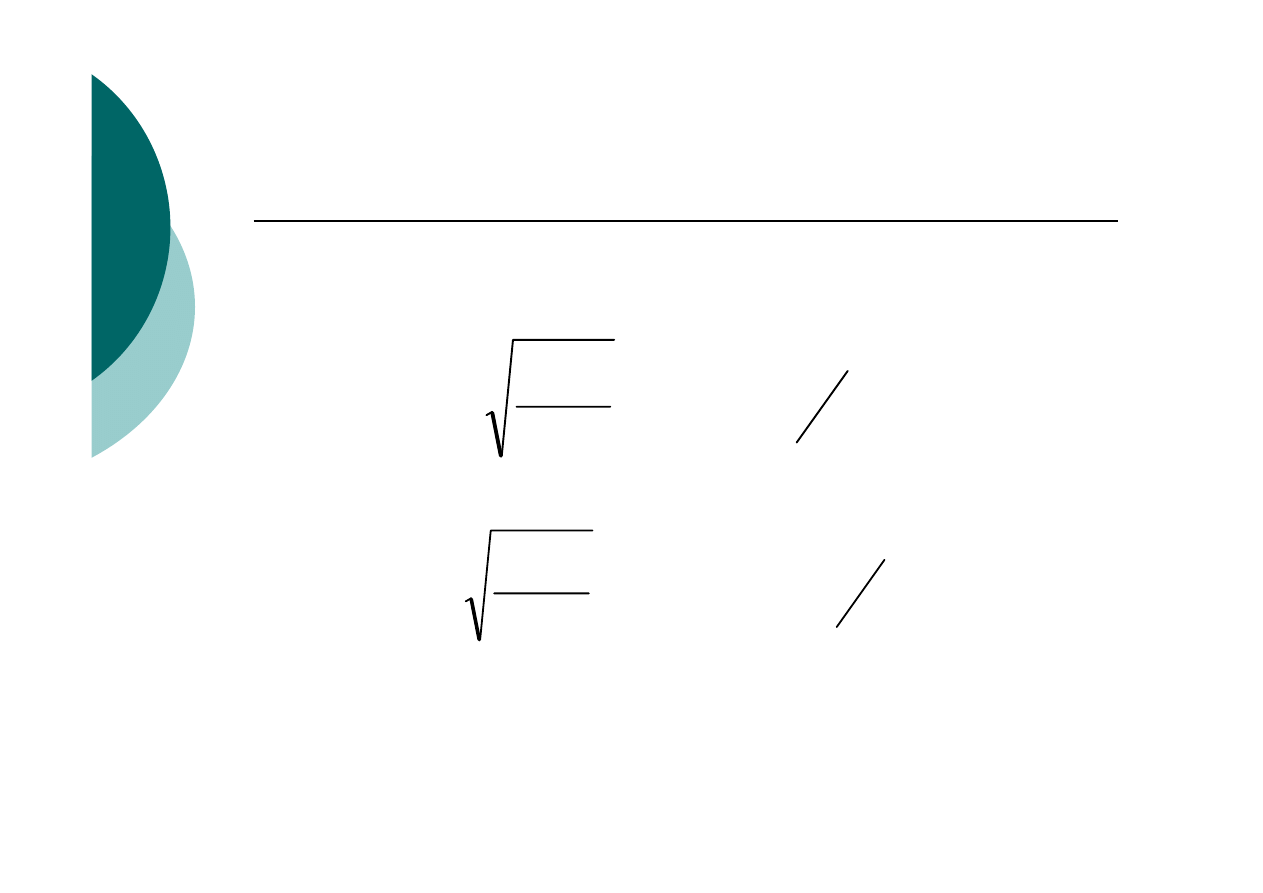
GRAWIMETRIA
Przykład: K
SOAgBr
≅ K
SOAg2CrO4
≅ 10
-12
[ ]
l
mol
R
AgBr
6
2
1
1
12
10
1
1
10
−
−
=
⋅
=
[ ]
l
mol
R
CrO
Ag
5
3
1
2
12
10
3
,
6
1
2
10
4
2
−
−
⋅
=
⋅
=

GRAWIMETRIA
Wniosek
Aczkolwiek R
so
= f(K
so
) to jednak bez
uwzględnienia współczynników we
wzorze chemicznym osadu nie można na
podstawie K
so
bezpośrednio
wnioskować o rozpuszczalności (stracie)
osadu analitycznego.
Należy korzystać z wartości R
so
.

GRAWIMETRIA
Czynniki wpływające na rozpuszczalność
osadu
1.
Współczynniki we wzorze chemicznym
osadu (wartościowość jonów)
2. Efekt wspólnego jonu
3. Efekt matrycowy
4. pH roztworu

GRAWIMETRIA
Ad 1)
mA
n+
+ nB
m-
⇆ A
m
B
n
gdzie: f - współczynniki aktywności
K
a
SO AmBn
= [A
n+
]
m
·[B
m-
]
n
·f
m
A
·f
n
B
= const
GRAWIMETRIA
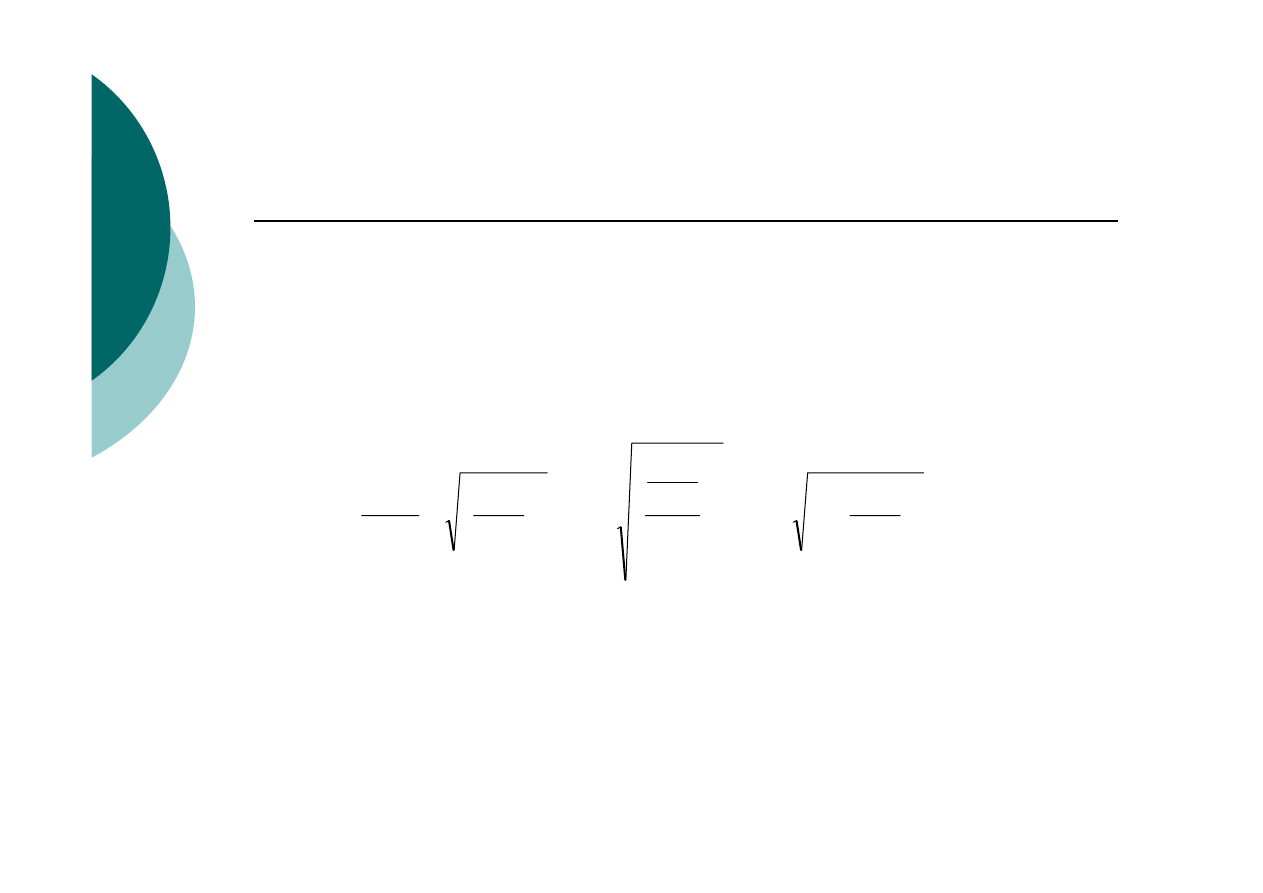
Wpływ mnożnika analitycznego F na
czułość metody i niepewność wyniku
1.
Mała wartość F zmniejsza niepewność
wyniku
(pierwsza pochodna wielkości mierzonej
względem oznaczanej)
....
2
2
2
2
+
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛ Δ
=
+
⎟
⎟
⎟
⎟
⎠
⎞
⎜
⎜
⎜
⎜
⎝
⎛ Δ
=
+
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛ Δ
=
Δ
ozn
os
ozn
os
os
os
ozn
ozn
m
m
F
F
m
m
m
m
m
m
K
K

GRAWIMETRIA
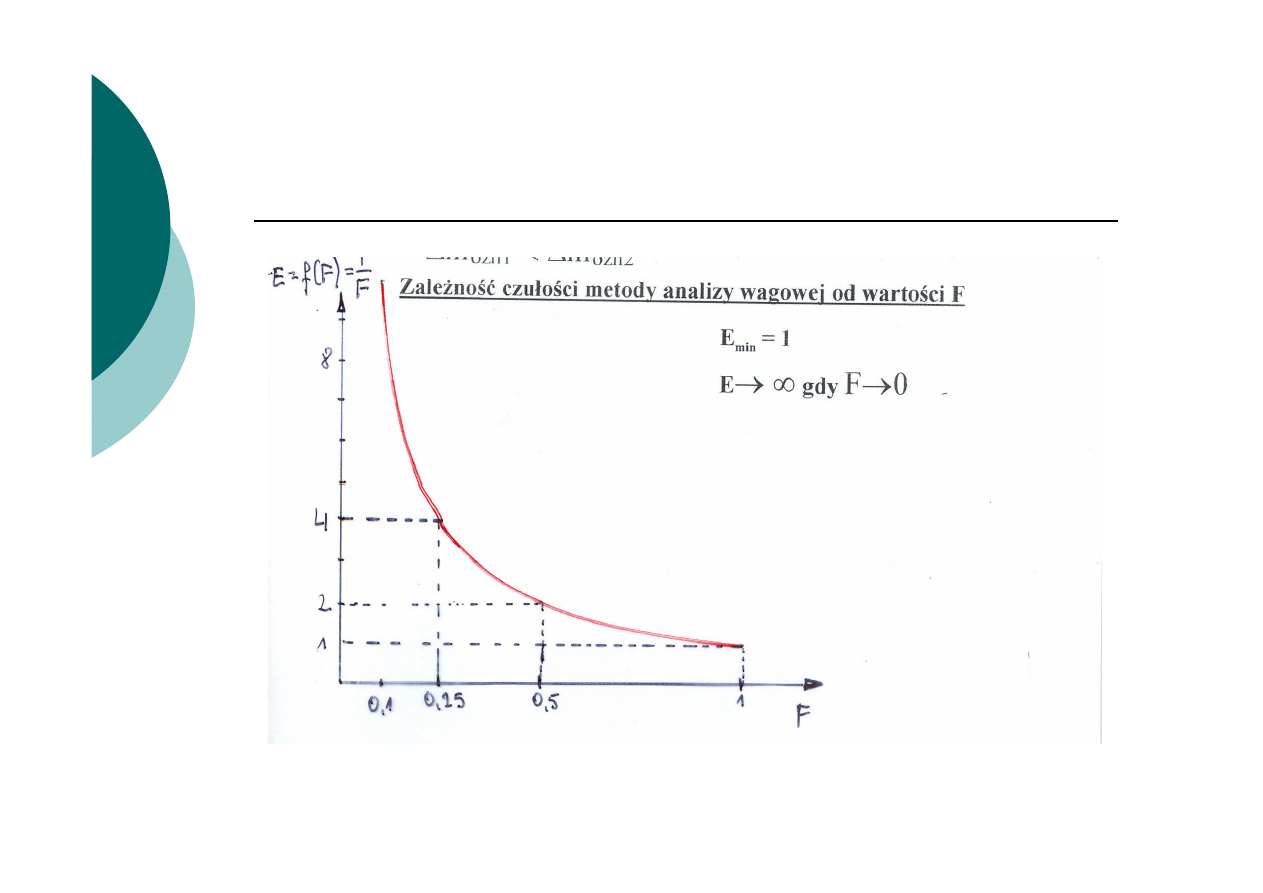
Wpływ mnożnika analitycznego F na czułość metody
i niepewność wyniku
1/F – miara czułości metody analizy wagowej
Dla dwóch różnych metod o różnym F
- dla tego samego błędu ważenia ∆m
os1
= ∆m
os2
- przy F
1
<F
2
- ∆m
ozn1
< ∆m
ozn2
α
tg
F
dm
dm
dx
dy
E
n
oz
os
=
=
=
=
1
GRAWIMETRIA
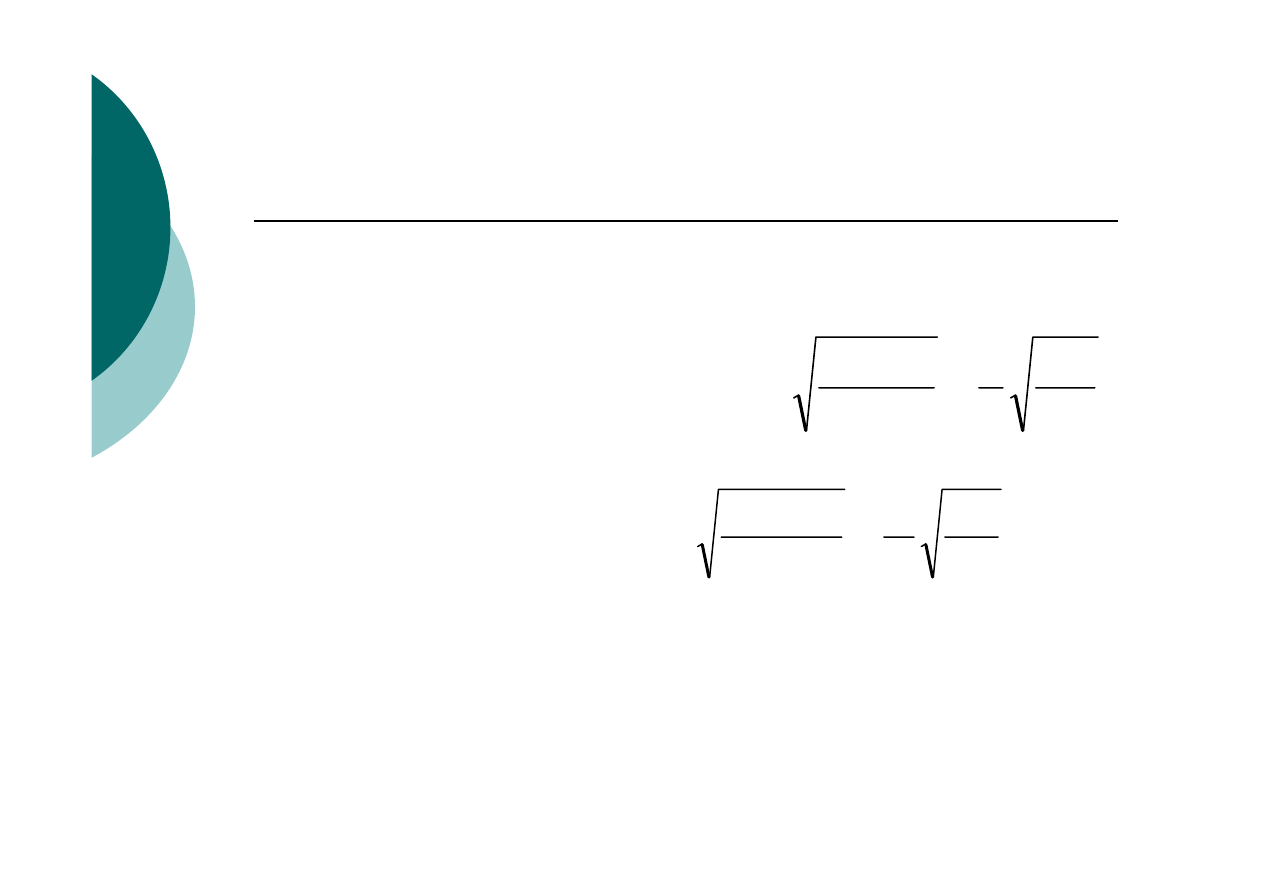
GRAWIMETRIA
ad 2/ Efekt wspólnego jonu
Zał. f
(A)(B)
= 1 Operujemy K
SO
a) nadmiar kationu A
n+
K
SO
=(mR
AmBn
+c
A
)
m
[nR
AmBn
]
n
b) nadmiar anionu B
m-
Wniosek: Na zmniejszenie R bardziej wpływa jon o
większej wartości współczynnika we wzorze
chemicznym osadu.
n
A
m
so
n
A
m
n
so
a
c
K
n
c
n
K
R
1
=
⋅
=
m
B
n
so
m
B
m
m
so
B
c
K
m
c
m
K
R
1
=
⋅
=

GRAWIMETRIA
3
). Efekt matrycowy
gdzie:
c
i
- stężenie i-tego jonu w roztworze
Z
i
- wartościowość i-tego jonu w roztworze
4) Wpływ pH
∑
=
2
2
1
i
i
z
c
I

Wpływ siły jonowej roztworu na rozpuszczalność
osadów
1. Obecność wszystkich jonów wpływa na
zmianę współczynników aktywności jonów
(stężenie i wartościowość)
2. Przy tym samym stężeniu o sile jonowej
decyduje wartościowość (dlatego strącamy
najpierw Fe
3+
, a potem SO
4
2-
.
3. Wraz z malejącymi wartościami f rośnie
wartość R (rozpuszczalność).

Wpływ siły jonowej roztworu na rozpuszczalność
osadów
4. Przy analizie układów rzeczywistych uwzględnia
się zmiany f w zależności od stężenia oznaczanego
składnika oraz rodzaju i stężenia składników
matrycy:
a) dla I < 0,01 ( <0,1) wzór graniczny równania
Deby'a Hückel'a
-log f = 0,5 z
A
z
B
√ I
b) dla I<0,1 ( <0,3 ) rozszerzone równanie Deby'a
Hückel'a
c) dla I > 0,1( >0,3) półempiryczne równanie
Davies'a
I
I
z
z
f
B
A
+
=
−
1
5
,
0
log
⎟
⎠
⎜
⎝ + I
B
A
1
⎟
⎞
⎜
⎛
−
=
−
I
I
z
z
f
2
,
0
5
,
0
log
I
I
I

Wpływ siły jonowej roztworu na
rozpuszczalność osadów
Wnioski:
5. Przy dużych stężeniach składników
matrycy, a jednocześnie stosunkowo
dużym K
SO
osadu należy usunąć
składniki lotne
(odparowanieH
2
SO
4
przy oznaczaniu
ołowiu)
6. Najpierw wydzielamy lub wzbogacamy
oznaczany składnik przed strąceniem
osadu.
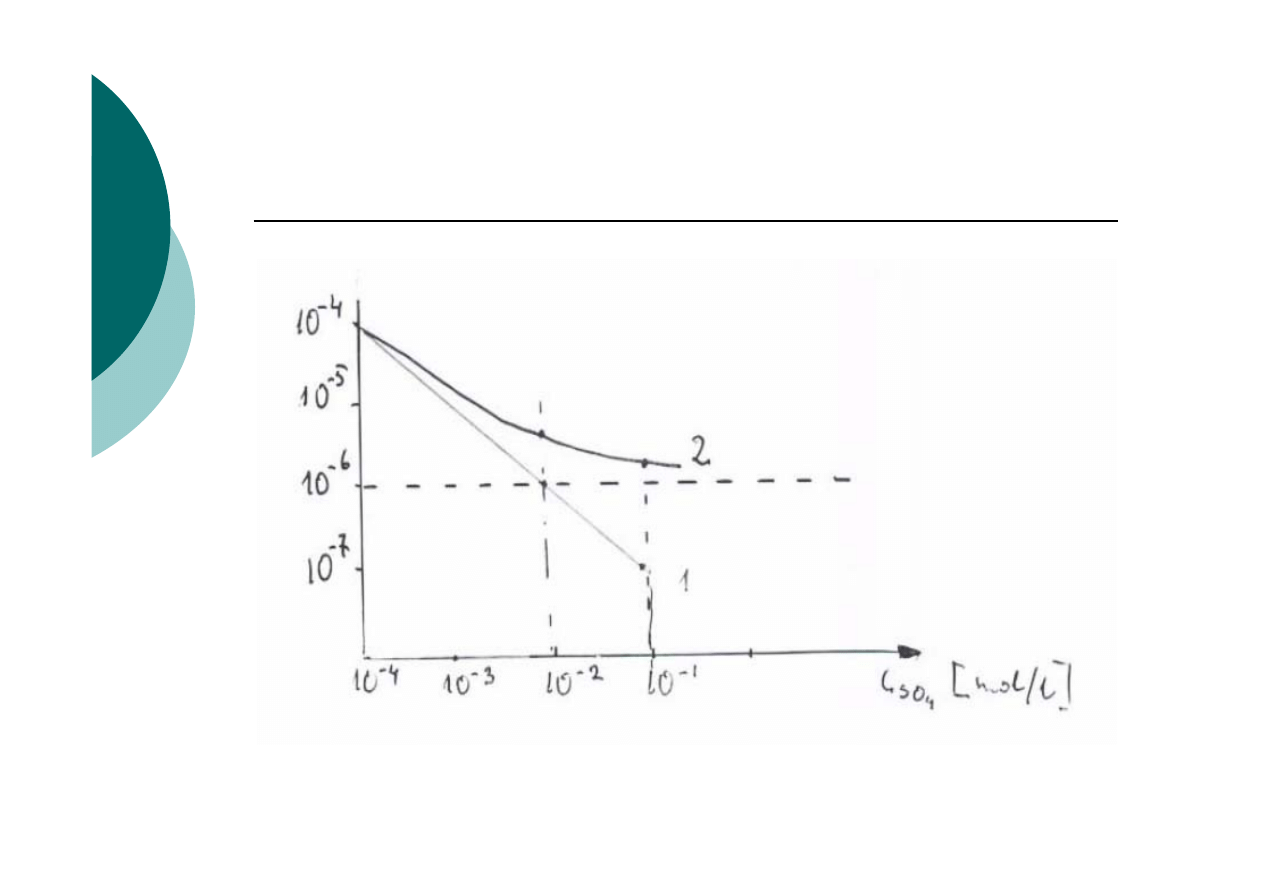
Wpływ jonu wspólnego z osadem (SO
4
2-
) oraz
wpływ siły jonowej
roztworu na rozpuszczalność PbSO
4
R

Wpływ jonu wspólnego z osadem (SO
4
2-
) oraz
wpływ siły jonowej
roztworu na rozpuszczalność PbSO
4
1
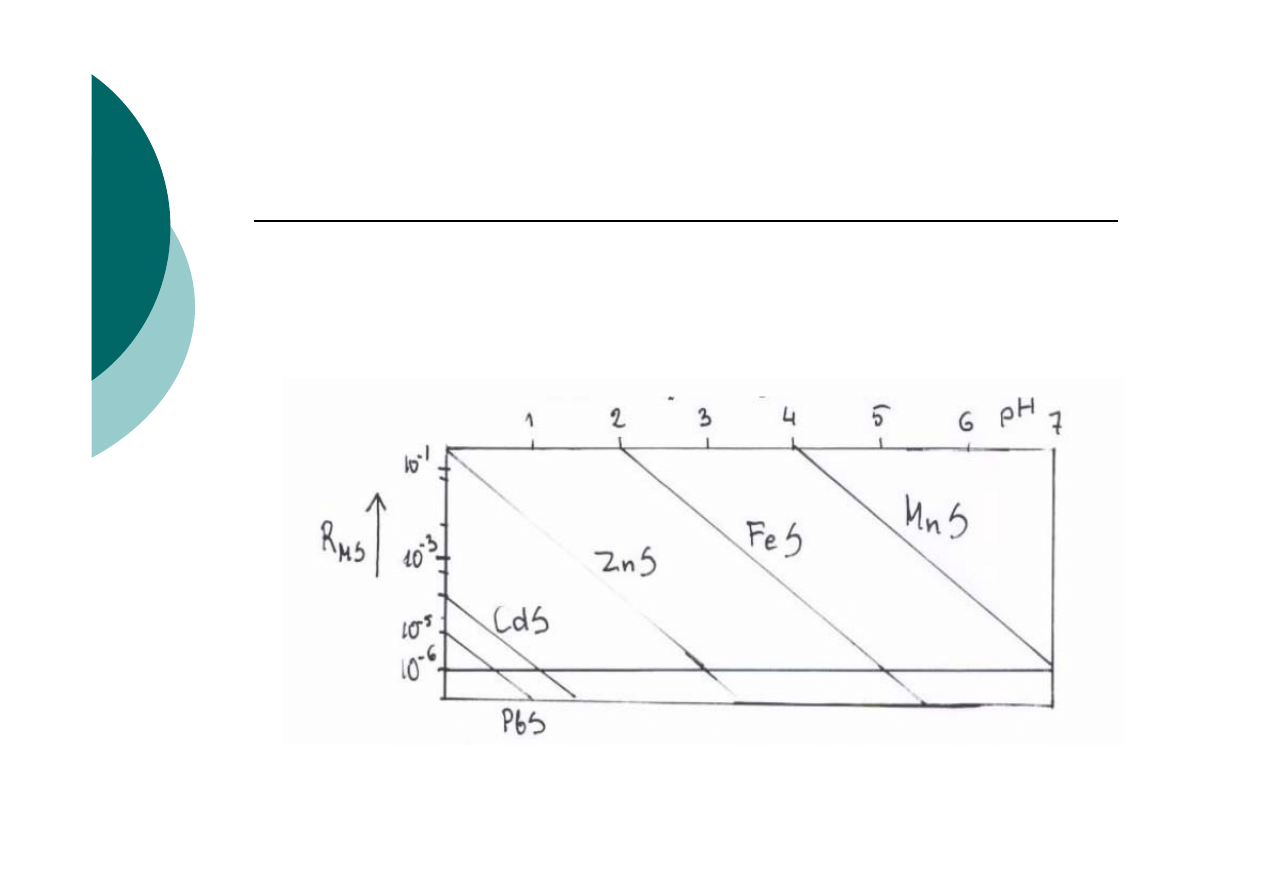
Zależność rozpuszczalności siarczków M(II) od
pH w nasyconym roztworze H
2
S w temperaturze
20
0
C
Wpływ pH na rozpuszczalność
osadów

Wpływ pH na rozpuszczalność
osadów
Wnioski
1. Dla osiągnięcia ilościowego strącenia
osadów w postaci siarczków lub
wodorotlenków należy przestrzegać
wymaganej wartości pH tak, aby R≤10
-6
2. Wpływ pH na rozpuszczalność osadów
siarczków lub wodorotlenków można
wykorzystać do ilościowego rozdzielenia
metali w roztworze
a) Zn od Mn
b) Pb od Fe i lub Mn

GRAWIMETRIA
Cechy wynikające z właściwości chemicznych
osadu
1.
Określony i stały skład chemiczny w
warunkach ważenia osadu
mnożnik analityczny:
o
teoretyczny
o
empiryczny
2. Możliwie mały udział składnika oznaczanego w
masie osadu (czułość, błąd)
const
M
M
F
AB
A
=
=

Czystość osadu oraz łatwość jego sączenia
Zjawiska wpływające na czystość osadów:
a) współstrącanie
adsorpcja
okluzja
kryształy izomorficzne lub mieszane (roztwory
stałe)
izoterma Freundlicha
c
ads
= k·c
n
c
ads
- m/w
m - masa zanieczyszczeń (adsorbatu)
w - powierzchnia osadu (adsorbentu)
c - stężenie substancji ulegającej adsorpcji
k i n - stałe dla danego układu i temperatury

GRAWIMETRIA
Wnioski:
należy zmniejszyć powierzchnię osadu
należy zmniejszyć stężenie
zanieczyszczeń (strącenie podwójne,
strącanie z roztworów rozcieńczonych,
strącanie z roztworów
homogenicznych)
podwyższenie temperatury

GRAWIMETRIA
Czynniki wpływające na strukturę osadu
a) szybkość tworzenia się zarodków
krystalicznych
w = k·(Q - R
os
)/R
os
b) szybkość wzrostu zarodków
V = k'·(Q - R
os
)
gdzie: R
os
- rozpuszczalność osadu
Q - przesycenie - stężenie roztworu
bezpośrednio nad osadem
k i k' - stałe empiryczne

GRAWIMETRIA
a więc:
9
możliwie małe przesycenie (unikanie
lokalnych przesyceń - mieszanie);
9
możliwie duża rozpuszczalność w
chwili strącania (podgrzewanie);
9
małe stężenie roztworu i odczynnika
strącającego (rozcieńczanie).

Starzenie osadów (dynamiczna równowaga)
a)
strącanie następcze (postrącanie - adsorpcja
obcych jonów na powierzchni osadu);
b)
restrukturyzacja osadu
gdzie:
- R
r
- rozpuszczalność kryształu osadu o promieniu r;
- R
os
- rozpuszczalność osadu;
- R - stała gazowa;
- T - temperatura;
- σ- napięcie powierzchniowe na granicy faz ciało
stałe/ciecz;
- V
M
- objętość molowa fazy stałej.
⎟
⎠
⎞
⎜
⎝
⎛
⋅
⋅
⋅
+
≅
T
R
r
V
R
R
M
os
r
σ
2
1

GRAWIMETRIA
Ilościowe oddzielenie osadu
sączki bibułowe (bezpopiołowe);
tygle z dnem porowatym;
ultrawirówki.

GRAWIMETRIA
Szybkość sączenia (filtracji) - wzór Poiseille'a
[cm
3
(przesączu)·s
-1
]
gdzie:
F - powierzchnia filtru [cm
2
];
∆ P - różnica ciśnień w porach sączka [g·cm
-1
·s
-2
];
r - średnica porów filtru (1-5 µm)
η - (eta) - lepkość dynamiczna roztworu [g·cm
-1
·s
-1
];
l - średnia długość porów (kapilarek) filtru [cm]
l
r
P
F
v
⋅
⋅
⋅
Δ
⋅
=
η
8
2

Optymalne warunki strącania osadów
w analizie wagowej
1.Osad strąca się z roztworów
rozcieńczonych:
- zmniejszenie stężenia zanieczyszczeń
w roztworze
- uniknięcie dużych przesyceń
2. Odczynnik strącający dodawać
stopniowo i powoli
3. Mieszać roztwór przy dodawaniu
odczynnika strącającego
4. Odczynnik strącający dodawać w
nadmiarze (nie przesadnym)

Optymalne warunki strącania osadów
w analizie wagowej
5. Strącanie prowadzić na gorąco gorącym
roztworem odczynnika strącającego
Postępując zgodnie z pkt. 2, 3 i 4 uzyskujemy
- uniknięcie dużych lokalnych przesyceń,
otrzymanie małej ilości zarodków, małej
okluzji, a więc duże i czyste kryształy
-
wymogi te spełnia strącanie z roztworów
homogenicznych, kiedy odczynnik strącający
jest stopniowo generowany równocześnie w
całym roztworze
6. Poddać osad starzeniu, ale tylko w przypadku,
gdy nie zachodzi postrącanie

Odczynniki do strącania osadów analitycznych
z roztworów jednorodnych (homogenicznych)
CH
3
CSNH
2
+ 2 H
2
O
→ CH
3
COO
-
+ NH
4
+
+
H
2
S
tioacetamid
strącanie siarczków
(CH
3
)
2
C
2
O
4
+ 2 H
2
O
→ 2 CH
3
OH + 2 H
+
+
C
2
O
4
2-
szczawian dimetylowy strącanie szczawianów
CO(NH
2
)
2
+ H
2
O (wolniej)
→ CO
2
+
2 NH
3
mocznik
strącanie wodorotlenków

Odczynniki do strącania osadów analitycznych
z roztworów jednorodnych (homogenicznych)
CH
3
CONH
2
+ H
2
O (szybciej)
→ CH
3
COO
-
+
NH
4
+
acetamid
strącanie wodorotlenków
NH
2
SO
3
H + H
2
O
→ NH
4
+
+ H
+
+
SO
4
2-
kwas amidosulfonowy strącanie siarczanów
(C
2
H
5
)
3
PO
4
+ H
2
O
→ 3 C
2
H
5
OH +
H
3
PO
4
fosforan trietylowy
strącanie fosforanów

Odczynniki do strącania osadów analitycznych
z roztworów jednorodnych (homogenicznych)
Zalety strącania osadów analitycznych
z roztworów jednorodnych (homogenicznych)
¾
równomierne wytwarzanie odczynnika
strącającego w całej objętości roztworu;
¾
wyeliminowanie lokalnych przesyceń;
¾
uboczne produkty reakcji lotne lub termicznie
lotne.
EFEKT
Osad analityczny otrzymujemy w postaci
dużych i czystych kryształów

Przemywanie
¾
odpowiedni sączek (wielkość i twardość)
¾
wytworzenie słupa cieczy
¾
dekantacja
¾
przelewać roztwór po bagietce
¾
w przypadku osadów koloidalnych pierwszą
porcję zawrócić
¾
nie zostawiać na sączku nie przemytego osadu
¾
kilka razy małymi porcjami
¾
wykorzystać efekt wspólnego jonu

Prażenie
¾
suszenie (odparowanie wody)
¾
zwęglanie sączka
¾
prażenie do stałej masy
BaSO
4
+4 C = BaS + 4 CO
BaSO
4
= BaO + SO
3

Przykładowe rozwiązanie problemu w
Chemii Analitycznej
1. Cel oznaczenia - oznaczyć grawimetrycznie w
roztworze Fe
3+
i SO
4
2-
2. Zadanie do wykonania: metodą strącania osadów
rozdzielić i kolejno oznaczyć oba składniki
3. Problemy do rozwiązania:
- za pomocą jakich odczynników strącać wymienione
składniki
- w jakiej kolejności strącać wybrane osady obu
składników
- jakie są optymalne warunki strącania tych osadów
Założenia :
a/ stężenia obu składników są ekwiwalentne
GRAWIMETRIA
SO
4
2-
Fe
3+
Wniosek
BaCl
2
BaSO
4
↓
nie str
ąca się
mo
żna rozdzielić
NH
4
OH
nie str
ąca się
Fe(OH)
3
·3 H
2
O
↓ można rozdzielić
K
SO
(20
o
C) ~10
-10
~10
-38
wpływ siły jonowej z=2
z=3 (bardziej wpływa)
Cechy osadu drobnokrystaliczny
koloidalny z
okluduje tendencją do peptyzacji
nadmiar BaCl
2
i adsorpcji
6
5
1
1
10
10
10
1
1
10
)
1
(
−
−
−
>
=
⋅
=
=
f
R
os
6
10
4
3
1
38
10
10
3
1
10
)
1
(
−
−
−
<<
≈
⋅
=
=
f
R
os

Wnioski końcowe
1.
Strącamy w pierwszej kolejności Fe
3+
za pomocą
NH
4
OH wobec NH
4
NO
3
, aby zapewnić koagulację
(nie NH
4
Cl bo FeCl
3
lotne w trakcie prażenia)
2. Strącamy Fe(OH)
3
i sączymy na gorąco w celu
zmniejszenia adsorpcji (R
os
i tak bardzo małe)
3. Stosujemy podwójne strącanie Fe(OH)
3
i łączymy
przesącze, aby odzyskać zaadsorbowane SO
4
2-
i
oczyścić osad

Wnioski końcowe
4. Z połączonych przesączy za pomocą BaCl
2
strącamy
SO
4
2-
z gorącego roztworu (mniejsze kryształy,
mniejsza okluzja)
5. Stosujemy nadmiar odczynnika strącającego (efekt
wspólnego jonu)
6. Osad BaSO
4
poddajemy starzeniu celem otrzymania
bardziej grubokrystalicznego, a więc czystego i
łatwego do sączenia.
7. W trakcie prażenia unikamy warunków
redukcyjnych (redukcja BaSO
4
do BaS lub Fe
2
O
3
do
Fe
3
O
4
) i zbyt wysokich temperatur (rozkład osadu).

GRAWIMETRIA - z
akres przydatności
1. Oznaczanie pojedynczego składnika
2. Oznaczanie kilku składników obok
siebie (selektywne strącanie)
3. Oznaczanie wilgoci higroskopijnej
(suszenie)
4. Oznaczanie suchej pozostałości
(odparowywanie)

GRAWIMETRIA - z
akres przydatności
5. Oznaczanie popiołu po mineralizacji
6. Elektrograwimetria (redoks)
7. Analiza elementarna związków
organicznych
8. Oznaczanie składników gazów (CO
2
,
H
2
O, X)
9. Analiza termograwimetryczna.

GRAWIMETRIA -ocena
Zalety
1. Dokładność standardowa 0,1 %, można
obniżyć do 0,01 %
2. Dobra precyzja
3. Metoda bezwzględna, brak potrzeby
kalibracji
4. Niski nakład kosztów
5. Dobra selektywność, a nawet specyficzność

GRAWIMETRIA -ocena
6. Przeznaczona szczególnie do składników
głównych, ewent. ubocznych
7. Skala makro, półmikro a nawet mikro
Wady
1. Czaso- i pracochłonne (koszty robocizny)

Źródła błędów
1.
Niewłaściwe naczynia (kalibracja, ważenie)
2.
Nieprzestrzeganie warunków strącania.
3.
Niedostateczne ostudzenie przed ważeniem
4.
Niewłaściwe płukanie (za dużo lub za mało,
możliwość płukania kanałowego)
5.
Nieodpowiednio dobrane sączki
6.
Zanieczyszczone odczynniki i naczynia

Jodograwimetria wodoru
1.
Oznaczanie zawartości śladowych
wody bądź wodoru w suchych lub
starannie osuszonych gazach
obojętnych
2.
Oznaczanie wodoru zawartego w
związkach organicznych
3.
Oznaczanie zawartości śladowych
wody bądź wodoru w gazach
obojętnych.

Jodograwimetria wodoru
Możliwość multiplikacji
H
2
O + MgCl
2
→ MgO + 2 HCl
2 HCl + Ag
2
OI
2
→ 2 AgCl + I
2
+ H
2
O
I
2
(pary) + 2 Ag →2AgI

TERMOGRAWIMETRIA
Źródłem informacji analitycznej jest pomiar zmiany masy
badanej próbki w funkcji zmiany jej temperatury
(zazwyczaj pomiar prowadzi się przy stałym wzroście
temperatury w czasie).
I. Termograwimetria (bezpośrednia) TG - ∆ m = f(T) = f(t)
II. Termograwimetria różniczkowa - DTG –dm/dT = f(T)
Pozwala na bardziej precyzyjne uchwycenie punktów
zmiany masy, ściśle punktów przegięcia na krzywej TG,
inaczej DTG - rejestracja szybkości zmiany masy w
funkcji temperatury.

TERMOGRAWIMETRIA
chromian srebra
temp ≈100
0
C suszenie
temp ≈ 812
0
C – 945
0
C
2 Ag
2
CrO
4
→1/2 O
2
+ 2 Ag + Ag
2
Cr
2
O
7
szczawian wapnia
temp ≈ 100
0
C suszenie
temp ≈ 398
0
C – 420
0
C
Ca C
2
O
4
→ CaCO
3
+ CO
temp 660
0
C – 838
0
C
CaCO
3
→ CaO + CO
2

Przykłady zastosowań
1. Oznaczanie zawartości wody w próbkach
2.
Rozróżnienie wilgotności higroskopijnej
(zaadsorbowanej) od związanej
(konstytucyjnej)
3.
Badanie stabilności termicznej materiałów
4.
Wyznaczanie optymalnych temperatur suszenia
i prażenia osadów
5.
Badanie procesów termolizy (lotnych produktów
rozkładu)
6.
Równoczesna analiza termiczna (TA) lub
termiczna analiza różniczkowa
7.
(DTA)

Termiczna analiza różnicowa (DTA)
Źródłem informacji analitycznej jest zmiana
temperatury próbki (lub innej wielkości
fizycznej) w funkcji temperatury.
TA (Thermal analysis) - analiza termiczna
Tp = f(T)
dTA (Derivative thermal analysis) - różniczkowa
analiza termiczna dT/d(t)=f(t)
DTA (Differential thermal analysis) - różnicowa
analiza termiczna ∆ T =f(T) ≡ f( t)
Mierzy się różnicę temperatur pomiędzy próbką
badaną, a substancją odniesienia w funkcji
temperatury (automatycznie programowanej).
Document Outline
- GRAWIMETRIA
- GRAWIMETRIA
- GRAWIMETRIA
- GRAWIMETRIA
- Osad trudnorozpuszczalny
- Osad trudnorozpuszczalny
- Rozpuszczalność osadu
- GRAWIMETRIA
- GRAWIMETRIA
- GRAWIMETRIA
- GRAWIMETRIA
- GRAWIMETRIA
- GRAWIMETRIA
- GRAWIMETRIA
- GRAWIMETRIA
- GRAWIMETRIA
- GRAWIMETRIA
- Wpływ siły jonowej roztworu na rozpuszczalność osadów
- Wpływ siły jonowej roztworu na rozpuszczalność osadów
- Wpływ siły jonowej roztworu na rozpuszczalność osadów
- Wpływ jonu wspólnego z osadem (SO42- ) oraz wpływ siły jonowej roztworu na rozpuszczalność PbSO4
- Wpływ jonu wspólnego z osadem (SO42- ) oraz wpływ siły jonowej roztworu na rozpuszczalność PbSO4
- Wpływ pH na rozpuszczalność osadów
- Wpływ pH na rozpuszczalność osadów
- GRAWIMETRIA
- Czystość osadu oraz łatwość jego sączenia
- GRAWIMETRIA
- GRAWIMETRIA
- GRAWIMETRIA
- Starzenie osadów (dynamiczna równowaga)
- GRAWIMETRIA
- GRAWIMETRIA
- Optymalne warunki strącania osadów w analizie wagowej
- Optymalne warunki strącania osadów w analizie wagowej
- Odczynniki do strącania osadów analitycznych z roztworów jednorodnych (homogenicznych)
- Odczynniki do strącania osadów analitycznych z roztworów jednorodnych (homogenicznych)
- Odczynniki do strącania osadów analitycznych z roztworów jednorodnych (homogenicznych)
- Przemywanie
- Prażenie
- Przykładowe rozwiązanie problemu w Chemii Analitycznej
- GRAWIMETRIA
- Wnioski końcowe
- Wnioski końcowe
- GRAWIMETRIA - zakres przydatności
- GRAWIMETRIA - zakres przydatności
- GRAWIMETRIA -ocena
- GRAWIMETRIA -ocena
- Źródła błędów
- Jodograwimetria wodoru
- Jodograwimetria wodoru
- TERMOGRAWIMETRIA
- TERMOGRAWIMETRIA
- Przykłady zastosowań
- Termiczna analiza różnicowa (DTA)
Wyszukiwarka
Podobne podstrony:
grawimetria1 wnioski
grawimetria3
GRAWIMETRIA
Grawimetria Kolos 1, Geodezja PW, Stare dzieje, Geod fiz + graw, Ćwiczenia
grawim i magn(1)
chemia, oznaczenie wagowe, Oznaczenie wagowe (grawimetryczne) ilościowego składu analizowanej substa
chemia, oznaczenia osady, Oznaczenie wagowe (grawimetryczne) ilościowego składu analizowanej substan
Pomiary grawimetryczne
Grawimetria
5 Grawimetria, magnetometria (5 05 2011)
Badanie grawimetru
Grawimetria
Redukcje grawimetryczne
gr2a pomiary grawimetrem
grawimetria2 wnioski id 195603 Nieznany
gw3 grawimetria
02 Grawimetria 2id 3908 ppt
GRAWIMETRIA CW1 grupa 1a, gik, semestr 8, sem 8, Grawimetria, kolokwium 1, Cwiczenia wszystkich grup
Korelacja anomalii grawimetrycznych
więcej podobnych podstron