
Politechnika Wrocławska
Wydział Inżynierii Środowiska
Studia stacjonarne drugiego stopnia we Wrocławiu
ANALIZA CHEMICZNA
I JAKOŚCIOWA OCENA WYNIKÓW
Instrukcja laboratoryjna nr 5
Analiza ilościowa wybranego anionu metodą
elektrochemiczną. Ocena wyniku pomiaru
Wrocław, 2013

Instrukcja laboratoryjna Analiza chemiczna i jakościowa ocena wyników
ZAGADNIENIA TEORETYCZNE
zasada metody, równanie Nernsta, rodzaje, budowa, właściwości najczęściej stosowanych elektrod
odniesienia i elektrod pomiarowych ze szczególnym uwzględnieniem elektrod jonoselektywnych,
potencjometria bezpośrednia i miareczkowanie potencjometryczne, zakres stosowalności metody,
wady metody, zalety metody, metoda regresji liniowej, przedział ufności wyniku
Zadanie 1. Oznaczanie anionu elektrodą jonoselektywną
Materiały i odczynniki:
- pH-metr, elektroda fluorkowa i elektroda odniesienia,
- kolby miarowe o pojemności 50 cm
3
(10 szt.), 200 cm
3
(1 szt.),
- zlewki 50 cm
3
, pipety szklane 2 cm
3
, 5 cm
3
, 10 cm
3
(2 szt.), 25 (1szt),
- tryskawki z wodą destylowaną,
- roztwór wzorcowy podstawowy o stężeniu 1 mg F
-
w 1 cm
3
roztworu,
- roztwór do analizy,
- bufor mocy jonowej,
- mieszadło magnetyczne, mieszadełka
Wykonanie:
1.
W kolbie o pojemności 200 cm
3
przygotować roztwór wzorcowy roboczy o stężeniu 0,01
mg F
-
w 1 cm
3
roztworu z roztworu wzorcowego podstawowego o stężeniu 1000 mg/dm
3
.
2.
Przygotować skalę wzorców z roztworu wzorcowego roboczego (o stężeniu 0,01 mg F
-
w 1 cm
3
roztworu) o stężeniach:
•
1 mg/dm
3
,
•
2 mg/dm
3
,
•
5 mg/dm
3
,
•
10 mg/dm
3
.
Obliczyć i odmierzyć odpowiednie objętości roztworu wzorcowego roboczego do kolbek
miarowych o pojemności 50 cm
3
i uzupełnić wodą destylowaną do kreski.
3.
Przygotować próbę ślepą: odmierzyć w kolbie miarowej 50 cm
3
wody destylowanej.
4.
Przygotowane roztwory przelać do zlewek i dodać do każdego 10 cm
3
buforu.
5.
Włożyć mieszadełko, włączyć mieszadło magnetyczne (wyregulować obroty mieszadła)
i zanurzyć elektrody fluorkową i odniesienia (łącznie) w wodzie destylowanej.
6.
Przystąpić do wykonania pomiarów dla przygotowanych roztworów, rozpoczynając od
ś
lepej próby „0” a następnie podstawiać wzorce, rozpoczynając od najniższego do
najwyższego stężenia jonów fluorkowych.
7.
Przed wykonaniem oznaczenia zawartości fluorków w badanej próbce, elektrody pomiarowe
należy powtórnie wstawić do wody destylowanej w celu ich wypłukania.
8.
Wstawić elektrody do próbki ślepej „0” i odczekać aż wartość wskazania SEM będzie
porównywalna z wartością uzyskaną dla tejże próbki ślepej przed oznaczeniami wzorców.
9.
W sześciu kolbkach o pojemności 50 cm
3
wykonać rozcieńczenie próbki do analizy (we
wszystkich kolbkach powinno być jednakowe stężenie analitu). Po przelaniu roztworów do
zlewek postępować analogicznie jak z wzorcami. Zanotować pomiary wartości potencjału
SEM w mV dla każdej próbki z analizą.
10.
Po skończonej analizie elektrody należy dokładnie przemyć wodą destylowaną.
11.
Na podstawie otrzymanych wyników wykreślić krzywą wzorcową SEM = f(logC) na
papierze milimetrowym lub w programie Excel – wartość stężenia fluorków należy
logarytmować. Odczytać z krzywej wzorcowej stężenie analizowanej próbki w mg/dm
3
dla
każdego powtórzenia (6-krotnie).
12.
Korzystając z metody regresji liniowej wyznaczyć równanie krzywej kalibracyjnej (obliczyć
parametr a i b) a następnie wyliczyć stężenie jonów fluorkowych w analizowanej próbce dla
kolejnych 6-ciu powtórzeń.

Instrukcja laboratoryjna Analiza chemiczna i jakościowa ocena wyników
Zadanie 2. Ocena jakości wyniku
1.
Proszę wykonać obliczenia zgodnie z wytycznymi podanymi w raporcie.
2.
Wszystkie etapy obliczeń umieścić w raporcie.
3.
Uzyskane wyniki wpisać do odpowiednich tabel.
4.
Wpisać wnioski.
Instrukcja laboratoryjna Analiza chemiczna i jakościowa ocena wyników
Imię i nazwisko: …………………………………………
Data:…………………….
Nr albumy:……………….. Grupa:…………………….
Raport Nr 4
Analiza ilościowa wybranego anionu metodą elektrochemiczną.
Ocena wyniku pomiaru
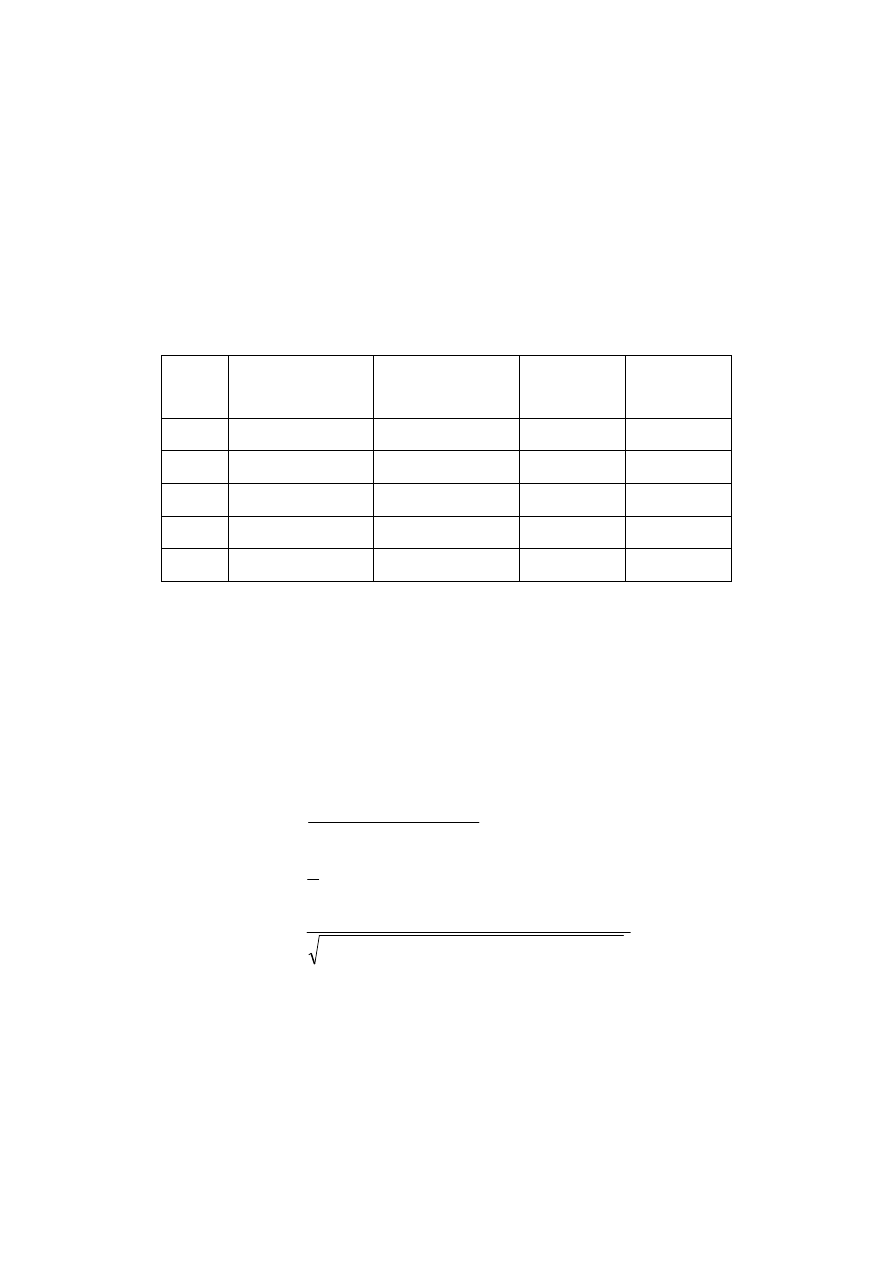
1. Sporządzenie krzywej wzorcowej
Lp.
(n)
V roztworu
wzorcowego
roboczego [cm
3
]
C [mg/dm
3
]
log C
(x
i
)
SEM [mV]
(y
i
)
-
0 „ślepa próbka”
0
-
1.
1
2.
2
3.
5
4.
10
1.1. Przedstawić tok postępowania obliczeniowego przy wyznaczaniu kolejnych stężeń wzorców.
1.2. Sporządzić i załączyć wykres krzywej kalibracyjnej elektrody jonoselektywnej w układzie
współrzędnych SEM = f(logC).
1.3. Korzystając z metody regresji liniowej wyznaczyć równanie krzywej kalibracyjnej poprzez
wyliczenie parametrów a i b oraz współczynnik korelacji (dopasowania krzywej) r -
przedstawić postępowanie obliczeniowe.
]
)
(
[
]
)
(
[
)
(
1
)
(
2
2
2
2
2
2
∑
∑
∑
∑
∑
∑
∑
∑
∑
∑
∑
∑
∑
∑
−
⋅
⋅
−
⋅
⋅
−
⋅
=
⋅
−
⋅
=
−
⋅
⋅
−
⋅
=
+
=
i
i
i
i
i
i
i
i
i
i
i
i
i
i
i
i
y
y
n
x
x
n
y
x
y
x
n
r
x
a
y
n
b
x
x
n
y
x
y
x
n
a
b
ax
y
Obliczenia:

Instrukcja laboratoryjna Analiza chemiczna i jakościowa ocena wyników
1.4. Ocenić jakość stosowanej elektrody jonoselektywnej, wyznaczając nachylenie krzywej
kalibracji.
2. Ocena jakości wyniku
2.1. Odczytać z wykresu krzywej kalibracyjnej stężenie jonów fluorkowych dla analizowanej
próbki w każdym z 6-ciu powtórzeń.
2.2. Z wyznaczonego równania krzywej kalibracyjnej wyliczyć stężenie jonów fluorkowych
w analizowanej próbce dla kolejnych 6-ciu powtórzeń.
2.3.Odrzucanie wyniku obarczonego błędem grubym z zastosowanie testu Q-Dixona.
a) uszeregować wyniki w ciąg niemalejący od wartości najmniejszej (x
1
) do największej (x
n
)
b) obliczyć wartość rozstępu R zgodnie ze wzorem:
1
x
x
R
n
−
=
gdzie
x
n
– wartość największa
x
1
– wartość najmniejsza
c) obliczyć parametry Q
1
i Q
n
według wzorów:
R
x
x
Q
R
x
x
Q
n
n
n
1
1
2
1
−
−
=
−
=
d) porównać otrzymane wartości Q
1
i Q
n
z wartością Q
kr
odczytaną z tablic rozkładu Q-Dixona
dla przyjętego poziomu ufności 95% (poziom istotności
α
=0,05).
Jeśli któryś z obliczonych parametrów Q
1
lub Q
n
przekracza wartość Q
kr
to wynik na
podstawie którego został obliczony Q
n
lub Q
1
należy odrzucić jako obarczony błędem
grubym.
Dalsze obliczenia wartości średniej x
ś
r
i odchylenia standardowego s należy wykonać dla
serii wyników z pominięciem wyniku obarczonego błędem grubym.

Instrukcja laboratoryjna Analiza chemiczna i jakościowa ocena wyników
Test Q-Dixona - wartości krytyczne (Q
kr
)
αααα
n
0,05
0,01
3
0,941
0,988
4
0,765
0,889
5
0,642
0,78
6
0,56
0,689
7
0,507
0,637
8
0,554
0,683
9
0,512
0,635
10
0,477
0,597
Obliczenia:
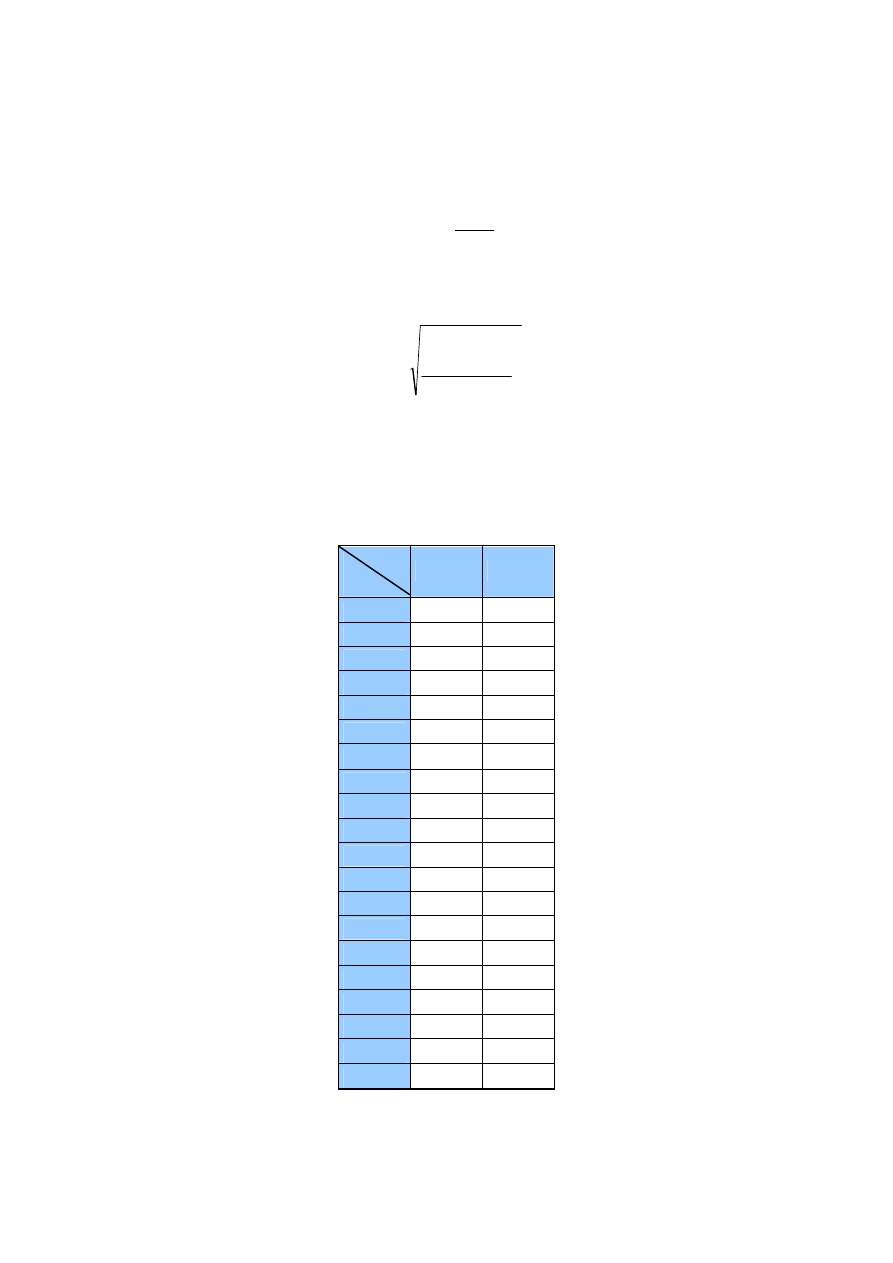
Instrukcja laboratoryjna Analiza chemiczna i jakościowa ocena wyników
2.4. Wyznaczanie przedziału ufności wyniku (test t-Studenta)
Obliczyć wartość średnią (x
ś
r
) i wartość odchylenia standardowego (s) dla serii wyników z
pominięciem wyniku obarczonego błędem grubym według wzoru:
gdzie:
n – liczba powtarzanych oznaczeń,
x
i
– wyniki poszczególnych pomiarów.
n-1 – liczba stopni swobody,
Przyjąć wartość krytyczną t
kr
z tablic rozkładu t-Studenta dla przyjętego poziomu ufności 95%
(poziom istotności
α
=0,05) i wyliczyć przedział ufności wyniku.
Test t-Studenta - wartości krytyczne (t
kr
)
αααα
n
0,05
0,01
1
12,706
63,656
2
4,303
9,925
3
3,182
5,841
4
2,776
4,604
5
2,571
4,032
6
2,447
3,707
7
2,365
3,499
8
2,306
3,355
9
2,262
3,250
10
2,226
3,169
11
2,201
3,106
12
2,179
3,055
13
2,160
3,012
14
2,145
2,977
15
2,131
2,947
16
2,120
2,921
17
2,110
2,898
18
2,101
2,878
19
2,093
2,861
20
2,086
2,845
(
)
2
1
1
−
−
=
∑
=
n
x
x
s
ś
r
n
i
i
n
x
x
n
i
i
ś
r
∑
=
=
1

Instrukcja laboratoryjna Analiza chemiczna i jakościowa ocena wyników
Obliczenia
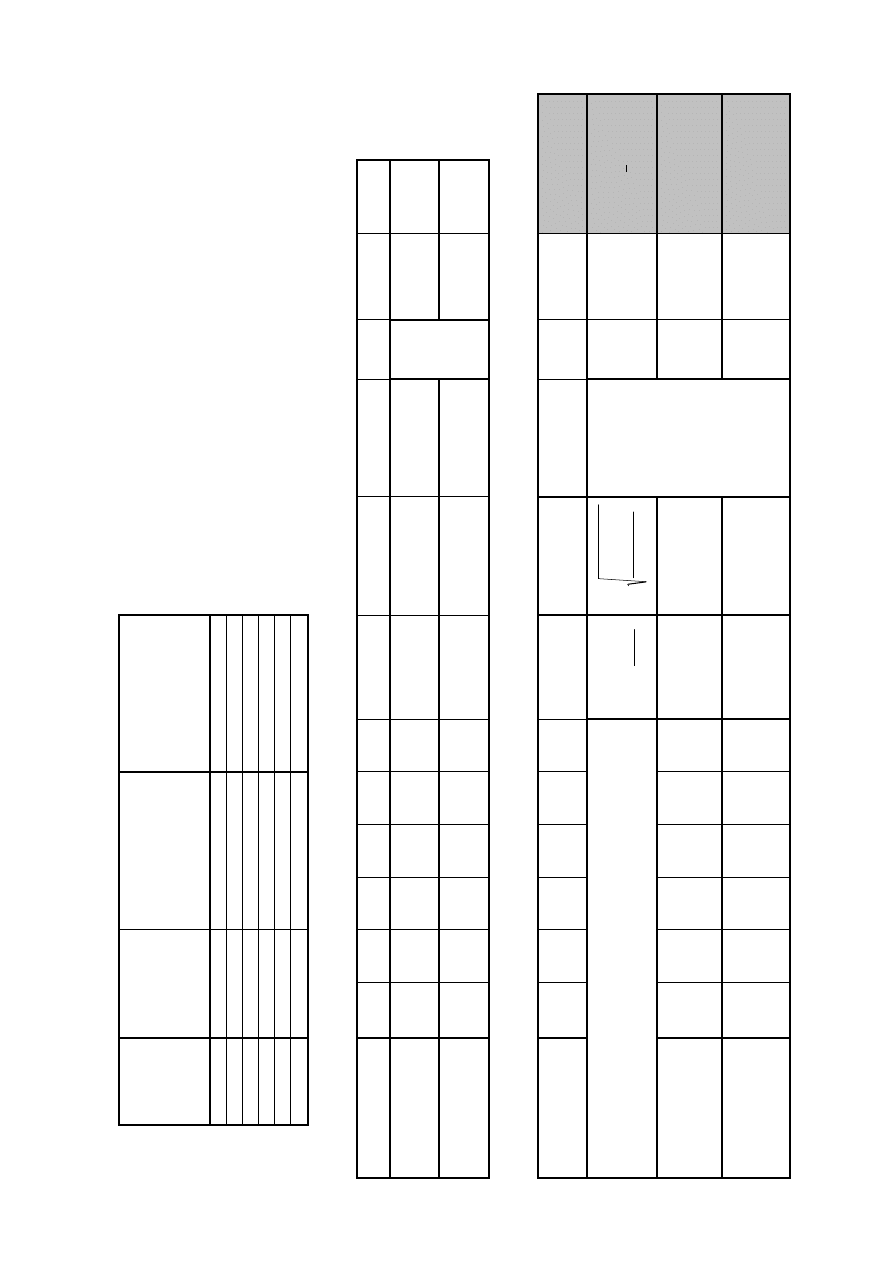
S
tęż
en
ie
j
o
n
ó
w
f
lu
o
rk
o
w
y
ch
w
a
n
a
li
zo
w
a
n
ej
p
ró
b
ce
W
y
n
ik
i
p
o
m
ia
ró
w
A
n
a
li
za
(p
o
w
tó
rz
en
ie
)
x
1
x
2
x
3
x
4
x
5
x
6
O
d
rz
u
ca
n
ie
w
y
n
ik
u
w
ą
tp
li
w
eg
o
(
te
st
Q
-D
ix
o
n
a
)
x
1
x
2
x
3
x
4
x
5
x
6
R
Q
1
Q
n
p
rz
ed
zi
a
ł
u
fn
o
śc
i
n
Q
k
r
W
y
zn
a
cz
a
n
ie
p
rz
ed
zi
a
łu
u
fn
o
śc
i
(t
es
t
t-
S
tu
d
en
ta
)
x
1
x
2
x
3
x
4
x
5
x
6
Ś
re
d
n
ia
a
ry
tm
et
y
cz
n
a
O
d
ch
y
le
n
ie
st
a
n
d
a
rd
o
w
e
P
ra
w
d
o
p
o
d
o
b
ie
n
tw
o
(p
rz
ed
zi
a
ł
u
fn
o
śc
i)
L
ic
zb
a
st
o
p
n
i
sw
o
b
o
d
y
W
sp
ó
łc
zy
n
n
ik
t-
S
tu
d
en
ta
K
=
n
-1
t
k
r
5
2
.5
7
1
5
2
.5
7
1
O
p
is
s
y
m
b
o
li
w
f
o
rm
u
ła
ch
m
at
em
at
y
cz
n
y
ch
:
•
n
l
ic
zb
a
p
o
w
ta
rz
an
y
ch
o
zn
ac
ze
ń
,
A
n
a
li
za
(w
a
rt
o
śc
i
o
d
cz
y
ta
n
e
z
w
y
k
re
su
k
rz
y
w
ej
k
a
li
b
ra
cy
jn
ej
)
C
F
-
[m
g
/d
m
3
]
(w
a
rt
o
śc
i
w
y
li
cz
o
n
e
z
ró
w
n
a
n
ia
k
rz
y
w
ej
k
a
li
b
ra
cy
jn
ej
)
9
5
%
C
F
-
[
m
g
/d
m
3
]
A
n
a
li
za
(w
a
rt
o
śc
i
w
y
li
cz
o
n
e
z
ró
w
n
a
n
ia
k
rz
y
w
ej
k
a
li
b
ra
cy
jn
ej
)
S
er
ie
p
o
m
ia
ro
w
e
S
E
M
[m
V
]
C
F
-
[m
g
/d
m
3
]
(w
a
rt
o
śc
i
o
d
cz
y
ta
n
e
z
w
y
k
re
su
k
rz
y
w
ej
k
a
li
b
ra
cy
jn
ej
)
W
y
n
ik
z
p
rz
ed
zi
a
łe
m
u
fn
o
śc
i
x
śr
+
t
k
r
*
s
S
er
ie
p
o
m
ia
ro
w
e
(c
ią
g
n
ie
m
a
le
ją
cy
)
C
F
-
[m
g
/d
m
3
]
(w
a
rt
o
śc
i
o
d
cz
y
ta
n
e
z
k
rz
y
w
ej
)
C
F
-
[m
g
/d
m
3
]
(w
a
rt
o
śc
i
w
y
li
cz
o
n
e
z
k
rz
y
w
ej
)
9
5
%
n
x
x
n
i
i
śr
∑
=
=
1
(
)
2
1
1
−
−
=
∑
=
n
x
x
s
śr
n
i
i

•
n
-1
li
cz
b
a
st
o
p
n
i
sw
o
b
o
d
y
•
x
i
w
y
n
ik
i
p
o
sz
cz
eg
ó
ln
y
ch
p
o
m
ia
ró
w
Wyszukiwarka
Podobne podstrony:
pwsz ioś kalisz Ćw. 6 POLARYMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza
pwsz ioś kalisz Ćw 4 Spektrofotometria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, ana
,Analiza chemicznych zanieczyszczeń środowiska , Zasada powstawania widma mas
analiza chemiczna 2
pwsz ioś kalisz moje sprawozdanie PEHAMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz io
pwsz ioś kalisz Analiza-Pehametria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza
pwsz ioś kalisz polarymetria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza chemi
analiza chemiczna kobiety, zabawne
Analiza chemiczna spoiw
,Analiza chemicznych zanieczyszczeń środowiska , Chromatografia
Chemia związków wanadu Synteza i analiza chemiczna otrzymanych izopoliwanadów
,Analiza chemicznych zanieczyszczeń środowiska , specjacja
,Analiza chemicznych zanieczyszczeń środowiska , chemometria
Analiza chemiczna 1
PN EN 1744 1 2000 Badania chemicznych wlasciwosci kruszyw Analiza chemiczna
Analiza chemiczna 6
Instrumentalne metody analizy chemicznej egzamin
pwsz ioś kalisz Tabela Ćw.4, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza chemic
Oznaczenie twardości ogólnej metodą werenianową, inżynieria ochrony środowiska kalisz, Analiza Chemi
więcej podobnych podstron