
Postępy
w technologii
solenia i marynowania ryb
Prof. dr hab. Edward Kołakowski
Katedra Technologii Żywności
Prof. dr hab. Anna Kołakowska
Katedra Towaroznawstwa i Oceny Jakości
Wydział Nauk o Żywności i Rybactwa
Akademia Rolnicza w Szczecinie


3
Spis treści
1. Wstęp ............................................................................................................................................... 3
2. Postępy w technologii solenia i marynowania ryb .................................................................... 4
2.1. Wprowadzenie ....................................................................................................................... 4
2.2. Najważniejsze czynniki technologiczne wpływające na jakość i trwałość ryb
solonych i marynat rybnych ............................................................................................... 7
2.2.1. Obróbka wstępna ryb ........................................................................................................ 7
2.2.2. Zawartość tłuszczu w mięsie ryb ..................................................................................... 7
2.3. Rola soli i cukru w technologii ryb solonych i zimnych marynat rybnych ................... 8
2.3.1. Odmiany soli i wymagania jakościowe ........................................................................... 8
2.3.2. Rozpuszczalność soli ......................................................................................................... 9
2.3.3. Funkcje technologiczne soli kuchennej .......................................................................... 9
2.4. Rola kwasów spożywczych w technologii marynat i ryb solonych ................................ 12
2.5. Ważniejsze kierunki doskonalenia i rozwoju technologii ryb solonych
i marynat rybnych ............................................................................................................... 15
2.5.1. Rozmrażanie filetów rybnych ........................................................................................... 15
2.5.2. Mieszanie rozmrożonych filetów rybnych z solanką zalewową lub kąpielą
marynującą ......................................................................................................................... 15
2.5.3. Wykorzystanie cukru ......................................................................................................... 16
2.5.4. Wykorzystanie przypraw naturalnych ............................................................................. 16
2.5.5. Wykorzystanie dozwolonych substancji dodatkowych ................................................. 17
2.5.6. Stosowanie „dojrzewaczy” ................................................................................................ 20
2.5.7. Stosowanie preparatów enzymatycznych ........................................................................ 21
2.6. Przykłady mniej znanych technologii solenia i marynowania ryb ................................. 22
2.6.1. Produkty solone „Gravad” ................................................................................................ 22
2.6.2. Marynowanie z dwuetapowym dojrzewaniem .............................................................. 25
2.7. Podsumowanie ...................................................................................................................... 26
3. Wpływ solenia i marynowania na właściwości żywieniowe lipidów rybnych ....................... 27
3.1. Właściwości żywieniowe lipidów rybnych ........................................................................ 27
3.2. Wpływ solenia na właściwości żywieniowe lipidów ........................................................ 28
3.3. Wpływ marynowania na właściwości żywieniowe lipidów rybnych ............................. 30
3.4. Literatura uzupełniająca ...................................................................................................... 31

4

5
1. Wstęp
Niniejszy poradnik jest wynikiem pracy ekspertów z Akademii Rolniczej w Szcze-
cinie, realizujących projekt „Transfer wiedzy z zakresu innowacyjnych technik hodowli
i technologii przetwórstwa ryb z uczelni wyższej do sektora rybołówstwa”, finansowany
w ramach Sektorowego Programu Operacyjnego „Rybołówstwo i Przetwórstwo Ryb
2004-2006”.
Informacje w nim zawarte były prezentowane podczas szkolenia dla przetwórców
ryb „Postępy w technologii solenia i marynowania ryb” (30.08.-31.08.2007 r.), organi-
zowanego przez Akademię Rolniczą w Szczecinie.
Celem projektu, oprócz szkoleń dla przetwórców ryb i hodowców ryb z zakresu
technologii przetwórstwa i technik chowu i hodowli ryb, jest również świadczenie
bezpłatnych konsultacji i auditów technologicznych.
Mamy nadzieję, iż dzięki tym działaniom zarówno przetwórcy ryb jak również ho-
dowcy będą mieli łatwiejszy dostęp do najnowszych informacji na temat procesów
produkcyjnych i hodowli ryb oraz nawiążą trwałą współpracę z naszą uczelnią, która
jako jedyna szkoła wyższa w Polsce specjalizuje się w technologii surowców rybnych.

6

7
2. Postępy w technologii solenia i marynowania ryb
- prof. dr hab. Edward Kołakowski
2.1. Wprowadzenie
Solenie i zakwaszanie należą do najstarszych metod utrwalania i przetwarza-
nia surowców rybnych. Polegają one na odciągnięciu pewnej ilości wody z tkanki
mięśniowej, przeniknięciu soli i/lub kwasu octowego do wnętrza tkanki i wytworzeniu
w niej roztworu hamującego rozwój drobnoustrojów patogennych i gnilnych oraz
stymulującego aktywność enzymów endogennych. Dotyczy to zwłaszcza roztworów
o wyższym stężeniu soli i/lub kwasu, które ponadto powodują denaturację białek
mięśniowych i nadają mięsu cechy bezpośredniej przydatności do spożycia. Przy
stosowaniu niższych stężeń soli lub kwasu produkt wymaga dodatkowej konserwacji
przy pomocy chłodzenia.
Zarówno w procesie solenia jak i marynowania można wyróżnić dwa podstawowe
zjawiska:
1. wysycanie surowca solą i/lub kwasem z równoczesną utratą pewnej ilości wody i
tłuszczu oraz substancji białkowych i mineralnych. Straty te stanowią poważny problem
dla producentów marynat i ryb solonych, gdyż obok obniżenia wydajności końcowego
produktu, generują ścieki trudne do utylizacji i oczyszczania.
2. dojrzewanie – polegające na złożonych reakcjach enzymatycznych, chemicznych
i fizycznych, a po części także mikrobiologicznych, doprowadzających do nadania
produktom charakterystycznego smaku i aromatu oraz zmian tekstury mięsa, wskutek
czego staje się ono zdatne do spożycia bez dalszych zabiegów kulinarnych.
Szybkość zmian zachodzących w obydwu tych zjawiskach zależy od:
- sposobu solenia lub marynowania,
- stężenia soli i/lub kwasu oraz innych substancji w solance lub kąpieli
marynującej,
- zawartości tłuszczu w surowcu rybnym,
- aktywności endogennych enzymów,
- sposobu obróbki wstępnej ryb,
- stanu świeżości ryb,
- sposobu utrwalenia surowca rybnego,
- sposobu rozmrażania (jeżeli surowiec jest mrożony),
- innych parametrów technologicznych, jak temperatura, pH, stosowanie dozwolo-
nych substancji
dodatkowych i inne.
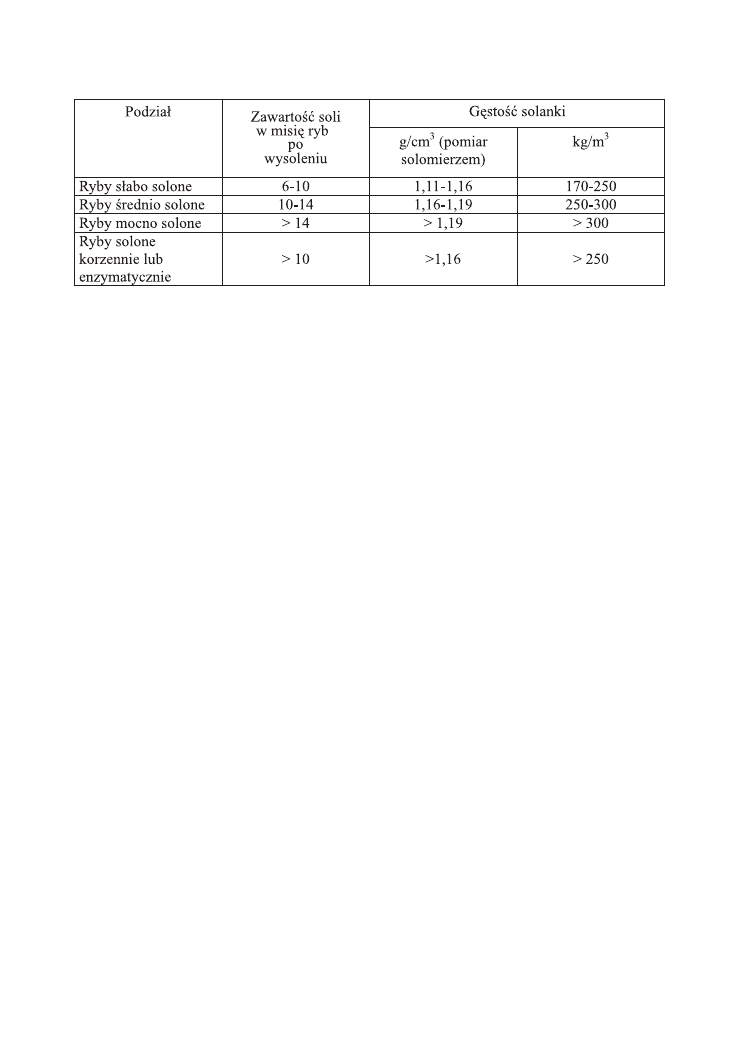
Polskie normy rozróżniają solenie słabe, średnie i mocne, na podstawie zawartości
soli w mięsie i gęstości solanki (Tabela 1).
8
Tabela 1. Podział ryb solonych według zawartości soli w mięsie i gęstości solanki.
Ponadto wyróżnia się solenie korzenne i enzymatyczne, które pod względem
zawartości soli w mięsie odpowiadają soleniu średniemu, natomiast różnią się od niego
stosowaniem oprócz soli dodatkowych substancji wspomagających, tj. odpowiednio:
cukru, przypraw korzennych lub preparatów enzymatycznych.
Pod względem sposobu nasalania ryb rozróżnia się:
- solenie suche – solenie sypką solą bez odpływu tworzącej się solanki sokowej,
- solenie mokre – solenie w wodnym roztworze soli o odpowiednim stężeniu z
ewentualnym dodatkiem niewielkiej ilości octu spirytusowego.
- solenie mieszane – ryby otoczone suchą solą i zalane roztworem soli lub solanką
o odpowiednim stężeniu.
Marynaty rybne są bardziej zróżnicowaną grupą pod względem stosowanej obróbki
technologicznej surowca i dzielą się na:
- zimne – z ryb świeżych i mrożonych poddanych dojrzewaniu w kąpieli marynującej
o odpowiednim stężeniu soli (6-8%) i kwasu octowego (4-5%). Ze względu na
znaczne stężenie kwasu octowego w kąpieli proces ten nazywa się marynowaniem.
Marynaty zimne są więc najbardziej typowymi (prawdziwymi) marynatami. Można
je również wytwarzać z ryb solonych. Po dojrzewaniu w kąpieli marynującej, otrzy-
many półprodukt, pakuje się wraz z marynowanymi warzywami do opakowań jed-
nostkowych, które dopełnia się zalewą w celu otrzymania gotowego wyrobu (Tab.
2). Typową zalewę dla marynat zimnych stanowi wodny roztwór octu spirytusowe-
go i soli, wzbogacony wywarem z przypraw i ewentualnie cukrem oraz dozwolony-
mi substancjami dodatkowymi. Oprócz zalewy octowej mogą być stosowane także
inne zalewy, jak: majonezowa, pomidorowa, olej aromatyzowany;
- gotowane – z ryb świeżych lub mrożonych, poddanych gotowaniu lub parowaniu
i dojrzewających bezpośrednio w zalewie (z pominięciem operacji wstępnego
dojrzewania ryb w kąpieli marynującej), którą zwykle stanowi roztwór octu spi-
rytusowego, soli i żelatyny. Żelatyna rozpuszczona na gorąco w zalewie zastyga w
galaretę podczas schładzania, stąd marynaty te potocznie nazywane są „galaretami
rybnymi”;
- smażone – z ryb świeżych i mrożonych poddanych panierowaniu i łagodnemu
smażeniu oraz dojrzewaniu w zalewie. Typową zalewę marynat smażonych stanowi
sos pomidorowy, często wzbogacony w przecier z innych warzyw.

9
Pod względem technologicznym ryby solone „na mokro” i zimne marynaty rybne
produkowane w Polsce coraz bardziej upodabniają się do siebie, gdyż dominującym
surowcem do ich produkcji są mrożone filety rybne. Ta tendencja wynika głównie z:
- dążenia do wyeliminowania uciążliwej obróbki wstępnej ryb z zakładów
zajmujących się przetwórstwem, co znacznie poprawia organizację i warunki sani-
tarne produkcji,
- dostosowania produkcji do importowanych filetów mrożonych jako surowca o
wysokiej jakości, stosunkowo taniego i dostępnego przez cały rok,
- ograniczania się w wielu przypadkach do solenia mokrego (zalewowego), które
zapewnia większą równomierność i szybkość nasalania,
- skracania czasu wysalania, zakwaszania a także dojrzewania ryb poprzez
zwiększanie powierzchni surowca do jego masy,
- dążenia do zmniejszania stężenia soli w gotowych produktach solonych ze
względów zdrowotnych,
- coraz szerszego wykorzystywania oprócz soli i kwasu innych substancji
uszlachetniających w procesie solenia i zimnego marynowania, jak cukier,
przyprawy, enzymy, dozwolone substancje dodatkowe.
Powyższe podobieństwa nie zacierają istotnych różnic jakie występują w technologii
ryb solonych „na mokro” i zimnych marynat rybnych. Pozwala to jednak pewne op-
eracje i procesy traktować jako bardzo podobne i omawiać je wspólnie dla obu grup
przetworów. Do takich operacji można zaliczyć: rozmrażanie surowca, mieszanie z
solanką lub kąpielą marynującą, działanie soli, cukru, kwasów spożywczych i przypraw
jak również ich wzajemne współdziałanie w kształtowaniu jakości i zapewnieniu
bezpieczeństwa produktów. Bliższe poznanie tych zagadnień jest kluczem do doskon-
alenia istniejących i rozwoju nowych technologii ryb solonych i marynat rybnych.
2.2. Najważniejsze czynniki technologiczne wpływające na jakość i trwałość ryb
solonych i marynat rybnych
2.2.1. Obróbka wstępna ryb
We wszystkich przypadkach surowcem do solenia są ryby świeże lub mrożone
(czyli surowe) poddane jednemu z następujących sposobów oprawienia: odgardlanie,
odgardlanie z odgławianiem, patroszenie, patroszenie z odgławianiem, filetowanie.
Sposób wstępnej obróbki ryb ma istotne znaczenie dla dojrzewania ryb solonych. Po-
zostawienie wyrostków pylorycznych w jamie ciała pozwala osiągać pełną dojrzałość
ryb podczas solenia w środowisku bez dodatku kwasu spożywczego. Natomiast przy
soleniu tusz lub filetów rybnych wymagany jest dodatek kwasu. Te różnice wynikają ze
specyfiki enzymów biorących udział w procesie dojrzewania ryb.
Surowcem do produkcji marynat są przeważnie filety pojedyncze i podwójne oraz
tusze. Stosunkowo wysokie stężenie kwasu octowego w kąpieli marynującej (4-5%)
gwarantuje obniżenie pH mięsa ryb podczas marynowania do poziomu 4,0-4,5 co jest
wystarczające dla uaktywnienia mięśniowych katepsyn, szczególnie katepsyny D.
2.2.2. Zawartość tłuszczu w mięsie ryb
Pomiędzy zawartością tłuszczu i zawartością kolagenu w mięsie ryb istnieje odwrot-

10
nie proporcjonalna zależność. Z tego powodu, surowce o wysokiej zawartości tłuszczu
charakteryzują się delikatną, wysoce pożądaną teksturą mięsa lecz równocześnie są
bardzo podatne na wszelkie urazy mechaniczne. Ich struktura może być łatwo dezinte-
growana także pod wpływem wysokich stężeń soli. Ryby tłuste poddaje się przeważnie
soleniu słabemu, celem zmniejszenia strat tłuszczu w czasie wysalania i uzyskania
produktu mniej słonego. Produkt solony o wysokich walorach smakowych otrzymuje
się ze śledzi dalekomorskich pełnotłustych, słabo solonych i składowanych w niższej
temperaturze. Najbardziej wartościowy produkt otrzymuje się ze śledzi dziewiczych,
o nierozwiniętych gonadach, charakteryzujących się wysoką zawartością tłuszczu i
nadzwyczaj delikatnym mięsem. Produkt taki jest jednak mniej trwały. Produkt trwal-
szy otrzymuje się z surowca mniej tłustego, przy zastosowaniu mocnego solenia. Ogóln-
ie można więc przyjąć, że uzyskanie pełnowartościowego produktu stoi w sprzeczności
z jego trwałością.
Odnośnie śledzi bałtyckich panuje niesłuszna opinia, że posiadają one ograniczoną
przydatność do solenia z powodu słabego dojrzewania. Wydaje się jednak, że na tę
ocenę bardziej wpływa stosunkowo mała wielkość ryb i nierytmiczność ich dostaw niż
względy technologiczne.
2.3. Rola soli i cukru w technologii ryb solonych i zimnych marynat rybnych
2.3.1. Odmiany soli i wymagania jakościowe
W handlu spotyka się kilka odmian i gatunków soli kuchennej, a mianowicie: warzoną,
kamienną białą (czysta, drobnoziarnista), kamienną szarą (gruboziarnista) i jadalną
jodowaną. Sól kamienna jest grubsza i nieco ciemniejsza, ale za to mniej higroskopijna
i może zawierać korzystne dla zdrowia mikroelementy. Jakość soli warzonej zależy w
dużym stopniu od metody jej krystalizacji. Im wolniej przeprowadza się ten proces,
tym tworzą się kryształy większe i trudniej rozpuszczalne. Sól kamienną krystaliczną
– wydobywa się ze złóż o wysokim stopniu czystości, systemem suchym w postaci brył,
które segreguje się i rozdrabnia. Sól kamienna nadaje się z reguły bezpośrednio do
celów spożywczych. W Polsce produkowana jest w czterech gatunkach: KK I – kami-
enna „Kłodawa” I, KK II – kamienna „Kłodawa” II, KW I – kamienna „Wapno” I, KW
II – kamienna „Wapno” II.
W przetwórstwie rybnym, a szczególnie soleniu ryb, najczęściej stosowana jest sól
KW I i KW II.
Do sporządzania zalew najodpowiedniejsza jest sól drobnokrystaliczna (0,1-1mm),
dobrze rozpuszczalna, a do solenia suchego lub mieszanego ryb, korzystniejsze są duże,
wolno rozpuszczające się kryształy soli. Struktura ziarnistości soli jest najczęściej uz-
gadniana między producentem i zamawiającym. To samo dotyczy pH soli, które może
się wahać od 5,5 do 8,5, podczas gdy dla przemysłu rybnego nie powinno przekraczać
7,5 w soli kamiennej i pH 7,0 w soli warzonej.
Gwarancją dobrej jakości soli jest odpowiednio wysoka zawartość chlorku sod-
owego i jak najmniejsza ilość niepożądanych zanieczyszczeń. Wg wymagań UE,
łączna zawartość substancji obcych, jak zawiesiny unoszące się w roztworze wod-
nym, substancje nierozpuszczalne (zanieczyszczenia mineralne soli wapnia i siarc-

11
zanów) i dodatki modyfikujące nie powinna przekraczać 2%. Zawartość zielonego
cytrynianu żelazowo-amonowego, stosowanego jako modyfikator kryształów i czyn-
nik przeciwzbrylający nie powinna przekraczać 25 mg/kg, a zawartość żelazocyjanku
sodowego (Na
4
Fe(CN)
6
) nie więcej niż 1,3 mg/kg. Sól powinna być sypka, wolna od ob-
cego zapachu, słona bez obcego posmaku, zwłaszcza gorzkiego. Na pogorszenie smaku
soli szczególnie niekorzystnie wpływają zanieczyszczenia związkami potasu, magnezu
i żelaza oraz siarczany.
Sól powinna być składowana w odpowiednich opakowaniach, w suchych i przew-
iewnych pomieszczeniach o niskiej wilgotności względnej (poniżej 75%). Przy wyższej
wilgotności względnej sól traci właściwości sypkie i zaczyna się zbrylać. Podatność soli
na zbrylanie zwiększa się wraz ze wzrostem domieszek niektórych związków hygrosko-
pijnych (np. MgCl
2
).
2.3.2. Rozpuszczalność soli
Chlorek sodu (M.cz. 58,44; T.t. 801
o
C) rozpuszcza się stosunkowo łatwo w wodzie,
przy czym wpływ temperatury na jego rozpuszczalność jest stosunkowo niewielki.
Do rozpuszczenia 1 kg soli potrzeba 2,7 litra wody o temperaturze 100
o
C i 2,8 litra
wody o temperaturze 25
o
C. Nasycony roztwór soli w temperaturze 0
o
C zawiera 26,6%
NaCl, a w temperaturze 100
o
C – 28,9% NaCl. Praktyczna rozpuszczalność soli kuchen-
nej zależy więc nie tyle od temperatury wody, ile od wielkości kryształów i obecności
zanieczyszczeń mineralnych (np. gips), które wyraźnie ją obniżają. Roztwór odpow-
iednio czystej soli powinien być klarowny. Sól kuchenna nie rozpuszcza się w tłuszczach,
natomiast bardzo dobrym jej rozpuszczalnikiem jest gliceryna.
2.3.3. Funkcje technologiczne soli kuchennej
W technologii solenia i marynowania ryb sól kuchenna spełnia szereg funkcji, z
których do najważniejszych należy zaliczyć:
1. Kształtowanie smaku,
2. Utrwalanie poprzez hamowanie rozwoju mikroorganizmów,
3. Stymulowanie aktywności enzymów,
4. Pęcznienie, rozpuszczanie i denaturację białek,
5. Autooksydację lipidów
Ad. 1.
Sól jako dodatek smakowy jest powszechnie stosowana do przyrządzania
potraw oraz przetworów rybnych. Dla uzyskania lekko słonego smaku wystarcza do-
datek rzędu 1-1,5%, a przy dawce 2-3% odczuwa się ten smak bardzo wyraźnie. Maksy-
malne stężenie soli w zalewach smakowych nie powinno przekraczać 3%. Takie stężenie
soli w produkcie nie jest wystarczające dla zahamowania rozwoju mikroorganizmów.
Ad. 2.
Wpływ soli kuchennej na hamowanie rozwoju mikroorgani-
zmów. Konserwujący wpływ soli, podobnie jak i cukru, na żywność zwią-
zany jest głównie ze wzrostem ciśnienia osmotycznego wewnątrz
komórek drobnoustrojów. Wielkość ciśnienia osmotycznego π zależy od masy czą-
steczkowej danego związku chemicznego, co można opisać następującym równaniem:

12
gdzie: c – stężenie, g/100 cm
3
; R – stała gazowa (8,3143+0,000045)10
7
, erg/K . mol;
T – temperatura, K; M
cz
– liczbowo średnia masa cząsteczkowa; A
2
i A
3
– drugi i trzeci
współczynnik wirialny.
Z przedstawionego wzoru wynika, że wartość ciśnienia osmotycznego rośnie ze
spadkiem masy cząsteczkowej danego związku. Np. masa cząsteczkowa NaCl jest ponad
5,5 razy mniejsza niż sacharozy (odpowiednio: 58,44; 342,30) dlatego ciśnienie osmo-
tyczne soli kuchennej jest dużo większe niż cukru. Np. 1-procentowy roztwór chlorku
sodu daje ciśnienie osmotyczne 0,6 MPa, a sacharozy tylko 0,07 MPa. Dla uzyskania
odpowiedniego zabezpieczenia ryb niezbędne jest dużo większe stężenie sacharozy niż
chlorku sodu. W wartościach procentowych stosunek stężeń wynosi w przybliżeniu
10:1. Oznacza to, że sól kuchenna jest znacznie lepszym konserwantem niż cukier.
Niektóre bakterie z grupy Coli-Aerogenes oraz bakterie gnilne z rodzaju Proteus nie
mogą rozwijać się przy stężeniu 1-2% soli, podczas gdy np. paciorkowce mlekowe są
pobudzane do rozwoju jeszcze przez 3% roztwór soli. Częściowe hamowanie powsta-
wania histaminy w mięsie ryb tłustych składowanych w temperaturze pokojowej
następuje przy stężeniu 4% NaCl, a całkowite zahamowanie następuje przy tym samym
stężeniu lecz w temperaturze ≥ 5
o
C. Indol przestaje być produkowany w rybach solo-
nych przy stężeniu soli w mięsie 8%, a trimetylamina (TMA) dopiero przy stężeniu
16%. Wyraźne hamowane większości mikroorganizmów następuje przy stężeniu 5-10%
soli. Ze względu na zapotrzebowanie życiowe bakterii na chlorek sodu dzielimy je na:
halofilne, halotolerancyjne i halofobne. Drobnoustroje patogenne giną przeważnie w
środowisku o stężeniu 10% NaCl, lecz Staphylococcus spp. może wykazywać wzrost przy
stężeniu powyżej 15%, a Listeria monocygogenses może przeżyć przez 10 dni w temper-
aturze 22
o
C nawet przy stężeniu soli 20-30%, lub przez 100 dni w temp. 4
o
C w solance
o stężeniu 10-30%. Bakterie z grupy Lactobacillus z trudnością tolerują 10-procentowe
stężenie soli. Z kolei Halobacterium i Halococcus (bakterie halofilne) wymagają do roz-
woju stężenia 10-15% NaCl, lecz mogą przeżyć przez jakiś czas w środowisku o stężeniu
zbliżonym do nasyconego roztworu soli (26%) (Shapton i Shapton, 1991). Największą
trwałość osiągają produkty, gdy stężenie soli w mięsie wynosi 9-11%, a zawartość wody
50-55%, czyli wówczas gdy stężenie soli w fazie wodnej produktu jest bliskie nasycenia.
W przybliżeniu odpowiada to rybom solono-suszonym. Aktywność wody (A
w
) nasy-
conego roztworu soli wynosi 0,75. Także mięso rybne będące w równowadze z nasy-
conym roztworem soli wykazuje Aw = 0,75. Niższe A
w
nie jest możliwe do osiągnięcia
poprzez działanie samej soli. Ażeby wyeliminować wszystkie mikroorganizmy A
w
musi
zostać obniżona do 0,6. Jednak tak utrwalone ryby są podatne na wchłanianie wilgoci z
atmosfery, co w konsekwencji może prowadzić do ich psucia się pod wpływem mikro-
flory sololubnej (halofilnej).
Dlatego najlepsze wyniki daje solenie w połączeniu z innymi metodami
utrwalającymi, jak chłodzenie, zakwaszanie, wędzenie, suszenie, próżniowe pakowanie
albo dodatek innych soli. Generalnie przyjmuje się, że inhibitujący wpływ soli na drob-

13
noustroje wzrasta ze spadkiem temperatury, a wpływ cukru odwrotnie. Drobnoustroje
odporne na sól zwykle są mało odporne na kwas, a odporne na kwas słabo odporne
na sól. Przy próżniowym pakowaniu, bakterie z grupy Lactobacillus sp. wytwarzają
kwas i wzmagają konserwujące działanie soli. Dodatek innych soli niż NaCl wzmaga
konserwujące działanie solenia. Np. halofilny ziarniak Micrococcus halodenitrificus
może rozwijać się w bulionie przy stężeniu od 2,2% do 12% NaCl, podczas gdy stężenie
1-2% jakiejkolwiek innej soli mineralnej uniemożliwia rozwój tej bakterii. Przy zal-
ewowym soleniu dopiero przy stężeniu 14-16% NaCl w solance uzyskuje się pełniejsze
zakonserwowanie ryb, przy czym dla bezpieczeństwa proces dojrzewania prowad-
zi się w obniżonej temperaturze, zwykle 4-8
o
C. Synergetyczne działanie soli, cukru,
pH, i azotynów a także bakteriostatycznych substancji przypraw jest wykorzystywane
między innymi podczas korzennego solenia ryb w słono-słodkiej lub słono-kwaśnej
zalewie. Niezbędna, skuteczna dawka azotynu (100-50 mg/kg), zapobiegająca przed
rozwojem Clostridium botulinum, ulega zmniejszeniu ze wzrostem stężenia soli i spad-
kiem pH. Produkty utrwalone solą, kwasem spożywczym i azotynem sodu nadają się
do próżniowego pakowania.
Ad. 3. Stymulowanie aktywności enzymów.
Nadmierna aktywność endogennych enzymów ryb może prowadzić do ich psu-
cia się, bezpośrednio (np. autoliza płatów brzusznych ryb, pękanie brzuszków) lub
pośrednio (przygotowanie pożywki dla rozwoju drobnoustrojów), równocześnie
jednak te same enzymy są wykorzystywane w procesie dojrzewania ryb solonych i
marynat rybnych. W zależności od potrzeby sól może być wykorzystana jako czynnik
stymulujący aktywność enzymatyczną. W procesie utrwalania przeważnie spotykamy
się ze zjawiskiem nadmiernej inaktywacji enzymów pod wpływem soli.
Enzymy proteolityczne wnętrzności ryb są z reguły mniej wrażliwe na inhibitujące
działanie chlorku sodu niż enzymy tkanki mięśniowej. W wyrostkach pylorycznych
sardynki występują co najmniej trzy proteinazy zasadowe (I, II, III), z których protein-
aza I jest zaliczana do unikalnych, a II i III wykazują właściwości zbliżone odpowiednio
do α–chymotrypsyny i trypsyny.
Zasadowa proteinaza I zachowuje stabilność tylko do stężenia 5% NaCl, po czym
szybko traci na swojej aktywności. Proteinaza chymotrypsyno-podobna (II) szybko
zmniejsza swoją aktywność po przekroczeniu stężenia 20% NaCl. Najbardziej odporna
na inaktywujące działanie soli jest proteinaza trypsyno-podobna (III), która wytrzy-
muje stężenie powyżej 20% NaCl, lecz zauważalnej, choć powolnej utracie aktywności
ulega już po przekroczeniu stężenia 10% NaCl. Oznacza to, że większość enzymów
wyrostków wykazuje stosunkową dobrą stabilność w środowisku o stężeniu soli do
20%. Należy jednak pamiętać, że inaktywujący wpływ soli na enzymy zależy nie tylko
od jej stężenia lecz również czasu działania. Przy długim czasie mocnego solenia ryb,
wszystkie enzymy wyrostków pylorycznych ulegają wyraźnej inaktywacji. Niemniej
jednak pełnią one główną rolę w dojrzewaniu średnio i mocno solonych ryb nie poz-

14
bawionych wyrostków pylorycznych.
Z proteinaz kwaśnych wyizolowanych z żołądka i wątroby sardynki bardziej
wrażliwa na wysokie stężenie soli okazała się proteinaza katepsyno D-podobna (I) niż
pepsyno-podobna (II). Objawy częściowej inaktywacji katepsyny D z wątroby można
zaobserwować już po przekroczeniu stężenia 5% NaCl. Katepsyna D tkanki mięśniowej
ryb jest jeszcze bardziej wrażliwa na stężenie soli niż katepsyna D z wątroby ryb.
Szczegółowa charakterystyka poszczególnych enzymów proteolitycznych została
przedstawiona w opublikowanej pracy zbiorowej – Enzymatyczna modyfikacja
składników żywności, wydanej pod redakcją Edwarda Kołakowskiego, Włodzimierza
Bednarskiego i Stanisława Bieleckiego, w 2005 roku, przez Wydawnictwo AR w Szcze-
cinie.
2.4. Rola kwasów spożywczych w technologii marynat i ryb solonych
Spośród kwasów spożywczych stosowanych w technologii marynat i ryb solo-
nych należy wymienić przede wszystkim kwas octowy, kwas cytrynowy i kwas
askorbinowy.
Kwas octowy syntetyczny w postaci esencji (15-25%, lub 80%) jest szkodliwy
dla organizmu i może być dopuszczony warunkowo, tylko do sporządzania kąpieli
marynujących, natomiast do zalew przeznaczonych do bezpośredniego spożycia, należy
stosować tylko ocet fermentacyjny: spirytusowy lub winny. W celu uniknięcia prob-
lemów toksykologicznych, także do dojrzewania półproduktu w kąpieli marynującej
stosuje się 10% ocet fermentacyjny. Kwas octowy, jako surowiec pomocniczy spełnia
trzy podstawowe funkcje technologiczne:
1. kształtowanie smakowitości,
2. zakwaszanie dla pobudzenia aktywności katepsyn mięśniowych,
3. działanie konserwujące.
Ad. 1. Kwas octowy, a szczególnie ocet fermentacyjny, nadaje specyficzną
smakowitość produktom rybnym, ponieważ już przy niskim stężeniu wykazuje sto-
sunkowo ostry smak i lekko drażniący, przyjemny zapach. Jest znany jako stymulator
apetytu, środek poprawiający trawienie i przyswajalność wapnia, a nawet obniżający
ciśnienie krwi. Przy małym stężeniu w kąpieli marynującej (do 3%), kwas octowy
łagodzi wyczuwalność słonego smaku, a przy wyższych stężeniach (powyżej 5%) może
wzmagać smak gorzko-słony.
Ad. 2. W procesie dojrzewania zimnych marynat rybnych bierze udział głównie
katepsyna D. Jest ona zaliczana do najbardziej aktywnych enzymów proteolitycznych.
Jej pH optymalne mieści się w granicach 3,8-4,0. Prowadzenie dojrzewania ryb w takim
zakresie pH dawałoby półprodukt zbyt kwaśny i powodowałoby nadmierną proteolizę
białka oraz duże straty substancji odżywczych. Dlatego marynowanie prowadzi się
jakby na zboczu wierzchołka aktywności katepsyny D, tzn. w obszarze pH 4,2-4,5.
Stężenie 4-5% kwasu octowego w kąpieli marynującej, przy stosunku wagowym surow-
ca do kąpieli 1:1, zapewnia optymalne warunki dojrzewania. Nadmierną aktywność
15
katepsyny D, tłumi z kolei chlorek sodu, gdyż enzym ten jest wrażliwy na inhibitujące
działanie soli. Nadmiar chlorku sodu w kąpieli marynującej (np. powyżej 10%) może
doprowadzić do takiego stłumienia aktywności katepsynowej, że nawet w odpowiednio
zakwaszonym środowisku marynaty te nie dojrzeją. Można to poznać po zbyt twardej,
spoistej i „suchawej” teksturze mięsa.
Optymalne pH dla dojrzewania ryb solonych w solance o stężeniu 14-16% NaCl
powinno mieścić się w zakresie 5,4-6,0. Stężenie kwasu w solance zalewowej nie powin-
no przekraczać 1% tak, aby ryby te nie przypominały marynat pod względem smaku,
a równocześnie dobrze dojrzewały. To dojrzewanie zapewniają katepsyny A, B, C i L,
których optimum aktywności mieści się w zakresie pH 5,2-5,6. Udział katepsyny D w
dojrzewaniu ryb solonych w zakwaszonej solance jest stosunkowo niewielki, natomiast
obok katepsyn w dojrzewaniu tym uczestniczą kalpainy. Z tych powodów wskazany
jest niewielki dodatek jonów wapnia do solanki (np. w postaci chlorku lub glukonianu
wapnia), które pełnią funkcję aktywatora kalpain. Dokładne warunki dojrzewania tusz
i filetów rybnych w zakwaszonej solance z dodatkiem jonów Ca
2+
zostały opisane w
patencie P 356686 (17.02.2002) Akademii Rolniczej w Szczecinie, który zainteresowa-
nym firmom może być udostępniony na uzgodnionych zasadach, wraz z innymi infor-
macjami szczegółowymi.
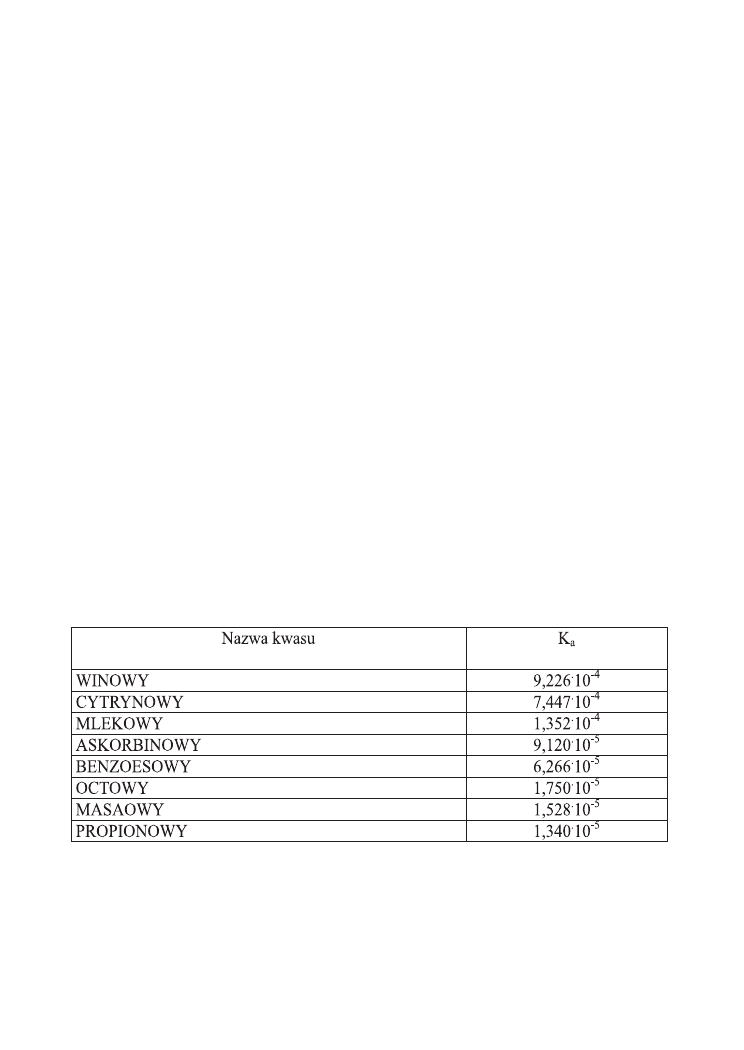
Ad. 3. Konserwująca aktywność kwasów organicznych jest odwrotnie proporc-
jonalna do stałej ich dysocjacji. Z danych przedstawionych w Tabeli 2 łatwo można
zauważyć, że stała dysocjacji kwasu octowego jest dużo niższa niż innych kwasów or-
ganicznych.
Tabela 2. Stałe dysocjacji najważniejszych kwasów organicznych
Wypływają z tego bardzo praktyczne wnioski. Np. nie da się zastąpić kwasu octowego
np. kwasem mlekowym przy tym samym pH, a nawet niższym. Z badań przeprowad-
zonych w Katedrze Technologii Żywności AR w Szczecinie wynika, że marynaty ze
śledzia bałtyckiego, dojrzewające w kąpieli marynującej z udziałem kwasu mlekowego
ulegały zepsuciu z powodu porastania pleśni nawet przy pH 3,8, podczas gdy marynaty

16
z udziałem kwasu octowego nie wykazywały oznak zepsucia nawet przy pH 4,8. W
środowisku dojrzewających marynat rybnych (pH 4,0-4,5) kwas octowy działa bakte-
riobójczo na bakterie, szczególnie z grupy: Salmonella, Staphylococcus, Bacillus, nato-
miast bakteriostatycznie na pleśnie i drożdże.
Do cennych właściwości octu fermentacyjnego (szczególnie winnego), należy zaliczyć
jego aktywność przeciwutleniającą związaną z występowaniem związków fenolowych,
takich jak kwas galusowy, furfural, tyrozol, kwas kofeinowy i inne.
Kwas cytrynowy, jako kwas dwukarboksylowy, wykazuje dużą podatność do reagow-
ania z jonem miedzi występującym w centrum aktywnym oksydazy polifenolowej. En-
zym ten jest odpowiedzialny za enzymatyczne brunatnienie surowych warzyw. Dlatego
podczas marynowania warzyw (np. plasterkowanej cebuli), obok kwasu octowego, do-
daje się niewielką ilość (ok. 0,25%) kwasu cytrynowego do kąpieli marynującej jako
inhibitora enzymatycznego brunatnienia.
Kwas askorbinowy i jego sole często występują w tzw. „dojrzewaczach” do ryb
solonych, gdzie spełniają funkcję zapobiegającą autooksydacji lipidów rybnych. Jego
działanie jest jednak stosunkowo ograniczone, gdyż sam kwas stosunkowo łatwo ulega
utlenieniu przechodząc w nieaktywny kwas dehydroaskorbinowy. Kwas askorbinowy
lepiej działa jako synergent w obecności polifenoli, np. pochodzących z dodanych
przypraw.
2.5. Ważniejsze kierunki doskonalenia i rozwoju technologii ryb solonych i mary-
nat rybnych
2.5.1. Rozmrażanie filetów rybnych
Najnowsze metody przemysłowego utrwalania filetów z ryb tłustych polegają na
zalewaniu ich wodą (ewentualnie wodnymi roztworami substancji stabilizujących) i
zamrażaniu we wgłębnie wytłaczanych opakowaniach z laminatów z tworzyw sztuc-
znych, także z użyciem podciśnienia. Ten sposób, stosowany do utrwalania bardzo
świeżych ryb, we wczesnym okresie „post-mortem”, przynosi bardzo dobre rezultaty
pod względem hamowania autooksydacji lipidów. Jednocześnie nastręcza problemy
podczas rozmrażania filetów. Pozostająca w opakowaniu woda rozmiękcza rozmrożony
surowiec i katalizuje aktywność wielu enzymów, w tym proteolitycznych i lipolityc-
znych. Szczególnie jest to zauważalne podczas parowego rozmrażania filetów w tem-
peraturze powyżej 30
o
C. Ustępujące gwałtownie stężenie pośmiertne prowadzi do de-
formacji filetów. Enzymy proteolityczne nadtrawiają połączenia mięśni i miomerów,
co w konsekwencji prowadzi do ich rozwarstwiania się. Proces wypłukiwania sub-
stancji białkowych, lipidowych i nukleotydowych jest wzmożony. Szybkie rozmrażanie
potęguje te niekorzystne zjawiska. Co więc radzić w tej sytuacji? Odpowiedź jest trud-
na, jeżeli głównym założeniem jest osiągnięcie jak największej wydajności przy po-
siadanych urządzeniach do rozmrażania. Jeżeli zaś nie, to najprościej będzie obniżyć
temperaturę pary w komorze przynajmniej do 15-20
o
C. Rozmrożona woda powinna
być jak najszybciej i najdokładniej usunięta z opakowania. Wskazane jest usunięcie
opakowania przed rozpoczęciem rozmrażania. Innym rozwiązaniem jest przejście na

17
rozmrażanie powolne w temperaturze otoczenia lub w komorze chłodniczej. Najlep-
szym rozwiązaniem byłoby zastosowanie rozmrażania dielektrycznego, przy użyciu
fal wysokiej częstotliwości, które mogłoby dostarczać rozmrożone filety w sposób
ciągły, na bieżąco. Wykorzystując specyficzne właściwości grzejnictwa dielektryc-
znego (rozmrażanie od środka bloku lub od wody wypełniającej opakowanie) można
zastosować rozmrażanie niepełne, np. do osiągnięcia temperatury –2
o
C w środku fi-
leta i taki surowiec pobrać do mieszania z solanką zalewową lub kąpielą marynującą o
odpowiednio dobranej temperaturze.
2.5.2. Mieszanie rozmrożonych filetów rybnych z solanką zalewową lub kąpielą
marynującą
Mieszanie rozmrożonych filetów z solanką lub kąpielą marynującą to kolejny ne-
wralgiczny punkt w procesie produkcji. Zupełnie zapomina się przy tym, że roztwór
soli o stężeniu 5-7% jest bardzo dobrym rozpuszczalnikiem białek miofibrylarnych.
Mieszając „starannie” dokonujemy ekstrakcji tych białek. Przejdą one w znacznym
stopniu do roztworu i po pewnym czasie, w miarę dalszego odwadniania ich przez sól,
ulegną straceniu tworząc tak niepożądaną zawiesinę w zbiornikach (basenach). Np.
typowy przepis na mieszanie przewiduje: 3-5-krotne mieszanie ryb solonych zalewowo
w pojemnikach (basenach) podczas pierwszej doby wysalania. Czas każdego mieszania
trwa ok. 15 minut. Natomiast korzystniej byłoby raczej ryby te pozostawić w spokoju
w ciągu pierwszej doby tak, aby część białek uległa denaturacji pod wpływem soli i
kwasu i w ten sposób straciła zdolność do przedostawania się do solanki lub kąpieli.
Z przeprowadzonych przez nas badań wynika, że podczas mieszania filetów ze śledzia
dalekomorskiego z 14% roztworem soli z dodatkiem niewielkiej ilości kwasu octowego,
najszybciej (potęgowo z czasem mieszania) wzrasta ilość zawiesiny stałej, a wolniej (w
postępie zbliżonym do prostoliniowego) ilość białka rozpuszczonego w solance.
W dobie powszechnego stosowania tworzyw sztucznych, w tym wygodnych po-
jemników do solenia lub marynowania ryb, paradoksem może się wydać powrót do
tradycyjnych beczek lub innych pojemników przystosowanych do przetaczania. A
jednak po ich napełnieniu do pełna, przetaczanie zapewniłoby wystarczające miesza-
nie i radykalnie obniżyłoby uszkodzenia mechaniczne i ubytki masy filetów podczas
dojrzewania. Zapraszam do współpracy nad opracowaniem specjalnego pojemnika do
dojrzewania ryb solonych lub marynowanych, przystosowanego także do szybkiego
opróżniania.
2.5.3. Wykorzystanie cukru
Cukier był dotychczas wykorzystywany głównie jako składnik smakowy, dodawany
do zalew oraz do ryb solonych korzennie. Wynikało to głównie z ceny i niedostate-
cznej dostępności tego produktu na rynku. W przetwarzaniu wysokowartościowych
surowców rybnych (np. łosoś, pstrąg tęczowy) istnieje możliwość wykorzystania
cukru jako środka hamującego nadmierną denaturację białek mięśniowych podczas
solenia lub marynowania, na etapie dojrzewania półproduktu. Dzięki temu można
będzie otrzymać półprodukt o soczystej i miękkiej, pożądanej teksturze mięsa. Aby nie
doprowadzić do nadmiernego wzrostu kosztów, należy zwiększyć stosunek wagowy
surowca do zalewy (np. 2:1 i wyżej) i wykorzystać zabieg „prasowania” ryb w basenie.
18
2.5.4. Wykorzystanie przypraw naturalnych
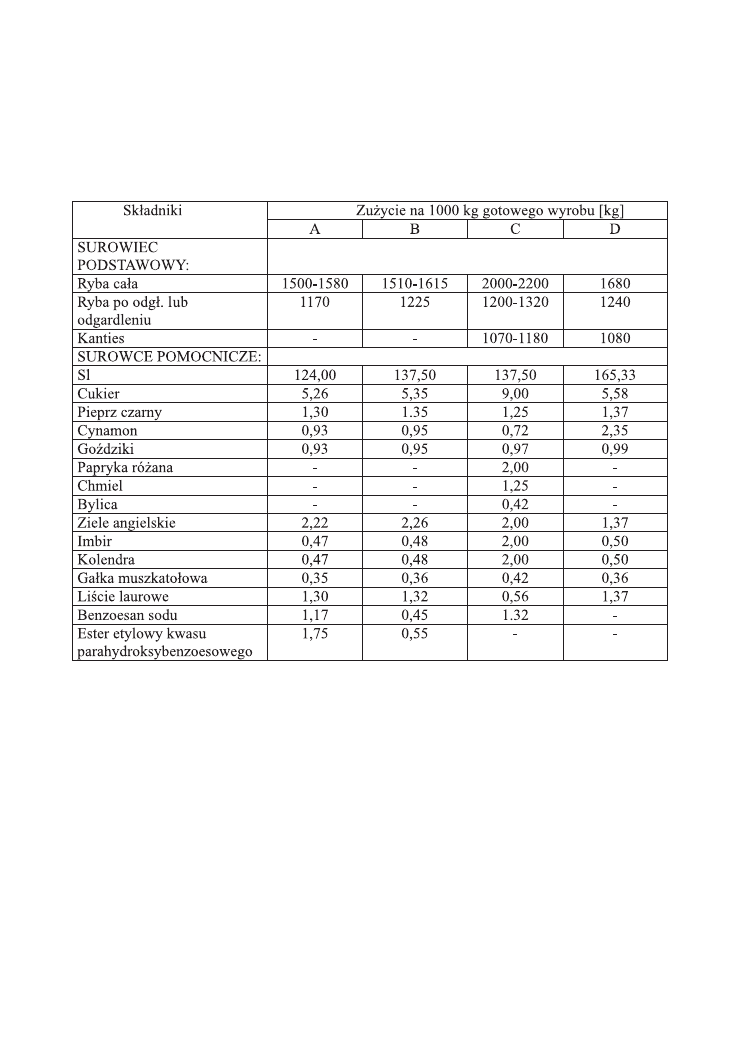
Przyprawy naturalne są najszerzej stosowane w technologii ryb solonych korzennie
(Tabela 3), którym nadają specyficzny, korzenno - słony bukiet smakowo-zapachowy.
Tabela 3. Zużycie surowców do produkcji ryb solonych korzennie na przykładzie
wybranych asortymentów.
A – Śledzie bałtyckie solone korzennie (z surowca świeżego),
B – Śledzie dalekomorskie solone korzennie (z surowca mrożonego),
C – Sardynka solona po skandynawsku (z kantiesa),
D – Makrela solona korzennie (z kantiesa)
Najszerzej są stosowane: pieprz czarny, ziele angielskie, liść laurowy, cynamon i
goździki. Równocześnie rzadko się stosuje gorczycę, koper, rozmaryn. Dobór przypraw
do ryb solonych opiera się prawie wyłącznie na ocenie sensorycznej, natomiast za
mało uwzględniany jest ich skład chemiczny oraz aktywność antymikrobiologiczna
i przeciwutleniająca. Te badania, wymagające stosowania skomplikowanych metod
analitycznych, z uwzględnieniem specyfiki surowca, zaczynają się dopiero rozwijać.
19
2.5.5. Wykorzystanie dozwolonych substancji dodatkowych
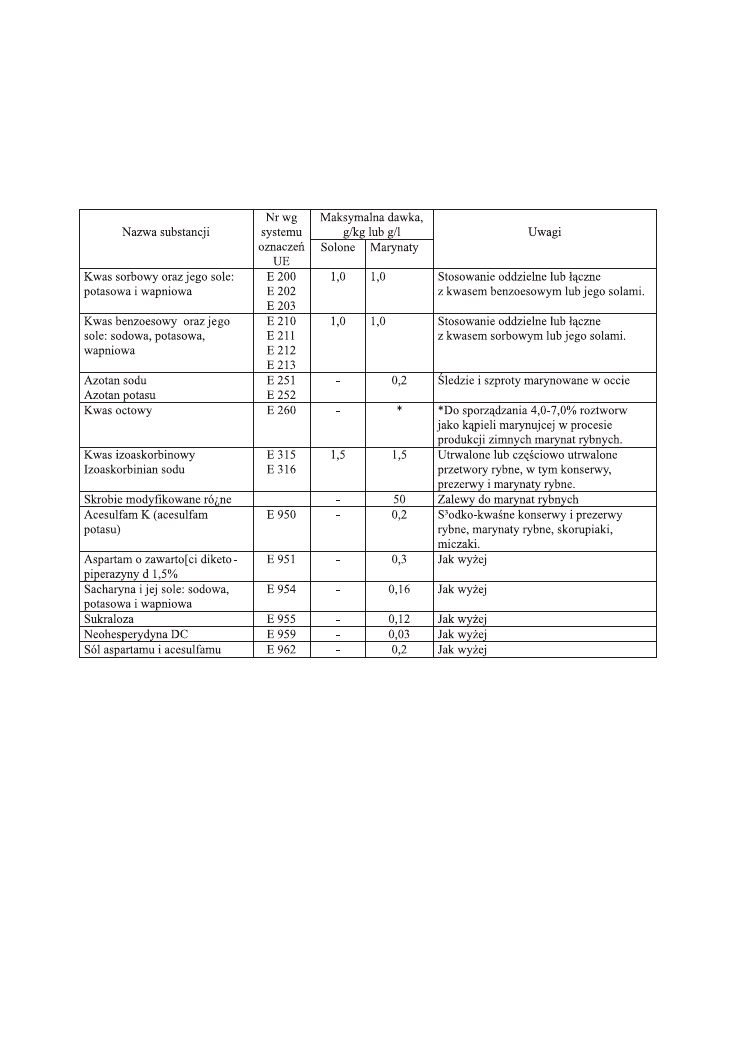
Wykaz dozwolonych substancji dodatkowych iobowiązujące dawki maksymalne
przedstawiono w Tabeli 4.
Tabela 4. Dozwolone substancje dodatkowe dopuszczone do produktów solonych i
marynowanych z ryb.
Uwagi:
- maksymalne dawki soli oblicza się w przeliczeniu na kwas danej substancji
Należy zaznaczyć, że zgodnie z obowiązującymi przepisami, nie dopuszcza się
użycia esencji kwasu octowego do zalew, lecz tylko ocet. Kwas octowy może być nato-
miast użyty do sporządzania kąpieli marynującej. Kwas sorbowy oraz jego sole i kwas
benzoesowy oraz jego sole mogą być stosowane pojedynczo lub łącznie. Przy łącznym
stosowaniu obu tych konserwantów maksymalna dawka wynosi 2 g/kg i odnosi się
do „częściowo utrwalonych przetworów rybnych łącznie z produktami ikry rybnej, w
tym prezerw rybnych i marynat”. Dla ryb solono-suszonych dawka ta jest dużo niższa
i wynosi 0,2 g/kg. W Kodeksie Żywnościowym STAN 192-1995 nie przewidziano
stosowania kwasu sorbowego i jego soli potasowej jako dodatku do ryb solonych i

20
marynat rybnych pomimo, że substancje te są zalecane do innych sześciu kategorii
żywności, w dawce od 1 do 3 g/kg. Pominięcie kwasu sorbowego nie wynika jednak z
jego szkodliwości toksykologicznej, gdyż należy on do substancji o najwyższym ADI
(Acceptable Daily Intake – dopuszczalne dzienne pobranie, wynosi 0-25 mg/kg masy
ciała), lecz prawdopodobnie z obawy, że środowisko ryb solonych nie zapewni odpow-
iednio niskiego pH dla aktywności tego konserwantu. Wiadomo, że bakteriostatyczne
i bakteriobójcze działanie konserwantu maleje wraz ze stopniem jego zdysocjowania,
co zależy od pH żywności. Prawie całkowita dysocjacja kwasu sorbowego następuje
przy pH powyżej 6,0, natomiast przy pH 5,5 ponad 20% kwasu pozostaje w formie
niezdysocjowanej. Kwas sorbowy jest najbardziej skuteczny przeciwko pleśniom. Ich
rozwój nawet w bardzo słabo kwaśnym środowisku jest całkowicie hamowany już przy
stężeniu 0,07-0,1%. Skuteczne działanie na drożdże wymaga niższego pH (ok. 4,5),
natomiast działanie na bakterie ogranicza się do organizmów katalazo-pozytywnych.
Kwas sorbowy nie działa natomiast na bakterie kwasu mlekowego i octowego oraz
na Clostridium, a rodzaje Pseudomonas, Staphylococcus, Aeromonas są stosunkowo
odporne na ten konserwant.
Kwas benzoesowy jest jeszcze bardziej podatny na dysocjację w zależności od pH
środowiska. W środowisku o pH 5,0 w formie niezdysocjowanej pozostaje zaledwie 13%
tego związku, natomiast obniżenie pH do 4,5 lub 4,0 zwiększa tę wartość do odpow-
iednio: 33% i 61%. W środowisku o pH 3,0 w formie niezdysocjowanej występuje aż 94%
kwasu benzoesowego. Świadczy to, że skuteczne działanie kwasu benzoesowego jako
konserwantu ma miejsce w środowisku o pH 3,0-4,5, co predystynowałoby go bardziej
do marynat niż do ryb solonych. Jednak zastosowanie kwasu benzoesowego i jego soli
do utrwalania ryb solonych wynika głównie z profilu jego działania na drobnoustroje.
Jest on silnym środkiem bakteriostatycznym w stosunku do bakterii (szczególnie kul-
tur powodujących powstawanie kwasu masłowego) i w stosunku do drożdży, natomiast
słabo działa na pleśnie i bakterie kwasu mlekowego. Udokumentowane jest skuteczne
działanie benzoesanu sodu w stosunku do patogennej bakterii Listeria monocytogenes.
W roztworze soli (5-10% NaCl) i benzoesanu sodu (0,1-0,2%) zwiększa się antylisteri-
alne działanie niektórych bakteriocyn wytwarzanych prze bakterie kwasu mlekowego,
np. diwercyny. Benzoesan sodu jest skuteczny także w eliminowaniu typowej wady
ryb solonych do jakiej zalicza się powstawanie czerwonych przebarwień pochodzenia
mikrobiologicznego, bowiem już przy stężeniu 0,1% działa letalnie na halofile.
Zaletą kwasu benzoesowego i sorbowego jako konserwantów jest ich szybka dy-
fuzja z frakcji ciekłej do mięsa rybiego. Pod koniec okresu dojrzewania ich zawartość
w mięsie jest zwykle kilka razy większa niż w solance lub w kąpieli marynującej. Prze-
mieszczanie to zachodzi szczególnie szybko podczas marynowania lub solenia ryb
tłustych.

21
Do 2004 roku obowiązywały w Polsce przepisy dopuszczające stosowanie estrów
(etylowego lub propylowego) kwasu p-hydroksybenzoesowego oraz ich soli sodowych
(„Parabeny”) w ilości do 0,2 g/kg. Konserwanty te mają długą tradycję stosowania w
technologii ryb solonych gdzie znane były pod nazwami odpowiednio: Nipagina A i
Nipagina P lub Aseptyna. W rozporządzeniu Ministra Zdrowia z dnia 23 kwietnia 2004
roku pozwolenie to wycofano, wzorując się na regulacjach UE.
W poprzednich przepisach nie przewidywano stosowania azotanów, natomiast
w najnowszych dopuszczono je tylko do marynat rybnych. Ryby solone pominięto,
chociaż jak wiadomo, taka potrzeba występuje tam jeszcze bardziej niż w marynatach,
szczególnie przy rybach słabo solonych.
Z grupy przeciwutleniaczy polskie regulacje prawne dopuszczają tylko synergen-
ty, tj. kwas askorbinowy i jego sól sodową lub wapniową oraz kwas izoaskorbinowy i
izoaskorbinian sodu (Tab. 4). Nie dopuszczają jak na razie stosowania typowych przeci-
wutleniaczy tj. butylohydroksyanizolu (BHT) i butylohydroksytoluenu (BHT), które
zgodnie z zaleceniami Kodeksu Żywnościowego STAN 192-1995 można stosować jako
dodatki do ryb solonych, w dawce maksymalnej 0,2 g/kg. Ponadto, zarówno do ryb
solonych jak i do marynat, przepisy Kodeksu zalecają następujące barwniki: kosze-
nila (E 120) – kwas karminowy o barwie pomarańczowo-czerwonej, beta-karoten (E
160a(ii)), zieleń trwałą
(E 143) – barwnik trifenylometanowy o brązowo-fioletowej barwie, tlenek żelaza (E
173(iii)) i sól sodową 5’-fosforanu riboflawiny (E 101(ii)). Należy więc sądzić, że proces
dostosowania unijnych przepisów do Kodeksu Żywnościowego, w zakresie dozwolo-
nych substancji dodatkowych nie jest jeszcze zakończony. Na przykład, dokładniejszego
sprecyzowania wymaga pozwolenie na stosowanie konserwantów w rybach solonych i
prezerwach z ryb solonych, bowiem dla tych ostatnich liczba dozwolonych substancji
dodatkowych jest przynajmniej tak duża jak dla marynat (Tab. 4).
Do dyspozycji technologa zajmującego się produkcją ryb solonych lub marynat
rybnych pozostaje ponadto wiele substancji, które ze względu na małą szkodliwość
można stosować zgodnie z zasadą quantum satis (ile trzeba). Są to między innymi;
kwas askorbinowy (E 300) i jego sole (sodowa - E 301; wapniowa E 302), kwas mlekowy
(E 270) i jego sole (E 325, E 326, E 327), kwas cytrynowy (E 330) i jego sole (E 331, E
332, E 333), chlorek wapnia (E 509), kwas glukonowy (E 574) i jego sole (E 576, E 577,
E 578).
2.5.6. Stosowanie „dojrzewaczy”
Wiele oferowanych „dojrzewaczy” ma niewiele wspólnego ze stymulowaniem
właściwego procesu dojrzewania, a występujące w ich składzie substancje są często do-
bierane na zasadzie zwiększania wydajności półproduktu, lub masy dojrzewacza. To
prowadzi niekiedy do nadużyć i kolizji z prawem żywnościowym tak, że do gotowego

22
produktu przedostają się również te substancje, które nie są dopuszczone do ryb solo-
nych lub marynowanych. Przykładem może być użycie fosforanów w „dojrzewaczu”
ryb solonych, podczas gdy są one dopuszczone tylko do mrożonych filetów rybnych.
Niektóre substancje występujące w „dojrzewaczach” działają wręcz hamująco na
proces dojrzewania ryb solonych. Np. kwas cytrynowy (E 330) i jego sól jednosod-
owa (E 331) hamują aktywność niektórych metaloproteinaz biorących udział w proce-
sie dojrzewania solonych ryb, ponieważ mają zdolność chelatowania jonów metali
dwuwartościowych, w tym kobaltu i cynku. Pogarszają nie tylko smakowitość wyrobu
lecz również teksturę mięsa.
Efekty regulatorów kwasowości można często z powodzeniem zastąpić odpowiednio
dobranym stężeniem octu w zalewie solankowej, unikając tym samym niepotrzebnego
stosowania niektórych chemikaliów. Należy pamiętać, że przy stosowaniu nawet doz-
wolonych substancji syntetycznych zawsze istnieje pewna obawa przed przedostaniem
się do żywności różnego rodzaju związków towarzyszących, stosowanych w technologii
chemicznej danego dodatku. Oczywiście, w „dojrzewaczach” spotyka się także sub-
stancje, które można uznać za niezbędne. Do takich można zaliczyć np. glutaminian
sodu (E 621), który wzmacnia aromat i smak mięsa ryb solonych lub marynat rybnych
w szerokim zakresie pH 3,5-8,0. Najlepsze efekty daje przy pH 5,5 co ponownie prze-
mawia za dodatkiem kwasu octowego (octu) do dojrzewających ryb solonych.
Wybiegając w przyszłość wydaje się, że technologia „dojrzewaczy” rozwinie się w
kierunku większego wykorzystania naturalnych koncentratów i ekstraktów przypraw
roślinnych na zasadzie „bioutrwalania” żywności. Ich funkcja przesunie się bardziej w
kierunku aktywności antymikrobiologicznej, przeciwutleniającej i kształtowania spe-
cyficznego (firmowego) smaku danego produktu.
2.5.7. Stosowanie preparatów enzymatycznych
Udokumentowanie wiodącej roli enzymów endogennych w procesie dojrzewania
ryb solonych i marynat rybnych nasunęło wniosek wykorzystania preparatów prote-
olitycznych dla stymulacji tego procesu. W latach siedemdziesiątych i osiemdziesiątych
prowadzono bardzo intensywne badania w tym zakresie w wielu krajach, szczególnie w
Holandii, W. Brytanii, Norwegii, ZSRR i w Polsce. Powstało kilkadziesiąt różnego rod-
zaju patentów i uzyskane wyniki wydawały się początkowo bardzo obiecujące, przyna-
jmniej w skali laboratoryjnej i ćwierćtechnicznej. Dotyczyły one głównie zastosowania:
wysuszonych i częściowo oczyszczonych wyrostków pylorycznych z ryb, mieszanki
enzymów wyizolowanych z solanek rybnych, dodawania preparatów proteolitycznych
pochodzenia zwierzęcego (głównie trypsyna), roślinnego (papaina, bromelaina, fi-
cyna) lub mikrobiologicznego (głównie ze szczepów Aspergillus i Bacillus). W Polsce
do produkcji enzymatycznie solonych ryb został dopuszczony preparat proteolityczny
typu Proteopol BP-S (Pektowin, Jasło), otrzymywany w procesie biosyntezy z wyko-

23
rzystaniem szczepu bakterii Bacillus subtilis, na bazie naturalnych podłoży pochodze-
nia roślinnego. Enzymy zawarte w preparacie hydrolizują białka do polipeptydów,
peptydów i aminokwasów w środowisku o odczynie zbliżonym do obojętnego (pH
6-8). Preparat ten, jak również inne enzymy, był przedmiotem naszych badań podc-
zas dojrzewania ryb solonych. Zauważono, że enzymy te są bardzo efektywne, lecz ich
działanie ogranicza się głównie do powierzchniowych warstw mięsa, które po pewnym
czasie staje się papkowate, podczas gdy zmiękczenie tkanki wewnątrz fileta lub tuszy
jest niedostateczne. Wiąże się to z utrudnioną dyfuzją enzymów jako makromolekuł
w głąb mięsa. Przy nastrzykiwaniu filetów solanką z dodatkiem enzymu wyniki są ko-
rzystniejsze. Jednak żaden z dotychczas przebadanych preparatów enzymatycznych
nie gwarantował uzyskania typowego, w pełni dojrzałego produktu solonego, tak pod
względem smakowo-zapachowym jak i tekstury. Zauważono również, że proteazy po-
chodzenia roślinnego (np. papaina) są zbyt aktywne i powodują szybkie upłynnianie
mięsa oraz, że obecność domieszki lipaz w preparacie proteolitycznym pogarsza jego
przydatność technologiczną. Stosowanie odpowiednio oczyszczonych enzymów łączy
się ze sprawą kosztów i obowiązkiem ich inaktywacji w gotowym produkcie.
2.6. Przykłady mniej znanych technologii solenia i marynowania ryb
2.6.1. Produkty solone „Gravad”
Produkty rybne „Gravad” są tradycyjnie wytwarzane w krajach skandynawskich
gdzie, w przeciwieństwie do innych krajów europejskich, są bardzo popularne. Do ich
produkcji najczęściej jest wykorzystywany świeży łosoś (nazwa produktu „Gravad Lax”)
i świeży śledź bałtycki („Gravad Sild”), chociaż inne gatunki ryb, jak: troć, pstrąg, siel-
awa i dorsz bałtycki też mogą być stosowane. Charakterystyczną cechą tych wyrobów
jest krótkotrwałe dojrzewanie (ok. 2 doby) filetów rybnych w środowisku soli, cukru i
przypraw, o stosunkowo niskim stężeniu NaCl (3-6%, najczęściej 3,5-4%), przy pH ≥
5,0, co wymaga bezwzględnego przestrzegania łańcucha chłodniczego.
Typowy proces technologiczny przemysłowej produkcji „Gravad” przedstawiono na
Rys. 1. Surowcem do produkcji „Gravad” są filety bez skóry lub filety ze skórą. Pierwszy
rodzaj surowca umożliwia szybsze jego nasycenie solą co ma istotne znaczenie dla
jakości i trwałości tych produktów.
Sposób nasalania filetów zależy od ich rozmiarów. Przy filetach dużych, o masie
powyżej 500 g, stosuje się podwójne nasalanie: najpierw nastrzykiwanie solanką (21%
NaCl i 1,5% cukru) pod ciśnieniem 0,9-1,1 bara, a następnie mieszanie nastrzykniętych
filetów z suchą solą w ilości 1% w stosunku do masy surowca. Stężenie soli w gotowym
półprodukcie powinno wynosić co najmniej 3,5%. Nasolone filety układa się pojedync-
zo na metalowych regałach, przykrywa folią i pozostawia przez noc w temperaturze
0oC. W tym czasie filety podlegają pierwszemu etapowi dojrzewania, równomiernemu

24
wysyceniu solą i cukrem oraz schłodzeniu. Następnie filety kroi się na plastry o masie
15-25 g, obsypuje przyprawami, porcjuje do opakowań wgłębnie formowanych z folii
PA/PE i zamyka próżniowo. Przed wysyłką do sprzedaży opakowania są składowane
przez 24 godziny w temperaturze 0
o
C.
Rys. 1. Schemat technologiczny procesu produkcji wyrobów „Gravad” z dużego pstrąga
tęczowego według technologii fińskiej (z uwzględnieniem stosowanych urządzeń).
Podczas tego składowania filety całkowicie dojrzewają i wysycają się składnikami
przypraw. Przy filetach małych, proces nasalania, słodzenia i przyprawiania przebiega
równolegle po bezpośrednim ich wymieszaniu z mieszanką drobnokrystalicznej soli,
cukru i przypraw.
Najczęściej stosowanymi przyprawami są: koper, pieprz biały i indyjska przyprawa
do potraw („allspice”). Niekiedy, w celu poprawienia trwałości wyrobu i nadania
mu specyficznych cech smakowych, stosowany jest dodatek dżinu lub koniaku (Tab.
6). Trwałość próżniowo pakowanych wyrobów „Gravad” nie przekracza 18 dni przy
składowaniu w temperaturze ≤ 3
o
C.
Wyroby „Gravad” są przygotowywane również w warunkach restauracyjnych i
domowych w postaci potraw przeznaczonych do bezpośredniego spożycia. Poniżej
podano sposób ich przygotowania z łososia. W warunkach polskich zamiast łososia

25
mógłby być z powodzeniem stosowany pstrąg.
Rybę oprawić do filetów ze skórą. Usunąć ości. Rozdrobnić pieprz w moździerzu i
utrzeć z solą i cukrem. Filety wymieszać z mieszanką i sprasować tak, aby przylegała
ona mocno do ich powierzchni. Na dno szklanego lub porcelanowego naczynia włożyć
pęczek koperku, ułożyć jeden z filetów skórą do dołu i drugi filet skórą na zewnątrz.
Grubszą część jednego fileta ułożyć naprzeciw cieńszej części drugiego. Filety owinąć
w folię z tworzywa sztucznego (nie aluminiową!), ułożyć na płaskiej powierzchni i
docisnąć je do siebie przez lekkie obciążenie masą równoważną puszce z piwem. Tak
przygotowany pakunek włożyć do lodówki i składować przez 1-2 dni w zależności od
grubości filetów. W czasie składowania pakunek należy przewrócić 1-2 razy spodnią
stroną do góry. Po zakończeniu dojrzewania usunąć solankę z powierzchni filetów przez
wytarcie ściereczką; w przeciwnym razie będą one zbyt słone. Osuszone filety mogą być
przechowywane w lodówce przez 1 tydzień jako półprodukt do przygotowania potrawy.
Filety pokroić w poprzek lub wzdłuż na plastry i podawać z sosem oraz posmarowa-
nym chlebem razowym jako przystawkę lub z młodymi ziemniakami gotowanymi jako
drugie danie. Sos przygotować przez zmieszanie gruborozdrobnionej gorczycy z solą,
cukrem, pieprzem i octem, dodanie oleju (stopniowo, kroplami, postępując podobnie
jak przy robieniu majonezu) oraz pociętego koperku. Po ok. 10-minutowym odstaniu
sos jest gotowy do użycia.
Tabela 5. Receptury mieszanek utrwalająco-dojrzewających i sosu do przygotowania
„Gravad Lax” (surowiec: łosoś cały o masie ok. 1 kg; wydajność filetów ok. 45%)
W czasie solenia ryby podlegają stałej kontroli, której zadaniem jest zapewnienie
równomiernego i prawidłowego ich dojrzewania. Dojrzały półprodukt jest sortowany,
ewentualnie dodatkowo oprawiany i pakowany do beczek, baryłek, puszek, słojów
lub opakowań jednostkowych z folii z tworzyw sztucznych. Jeżeli ryby pakowane są
próżniowo, np. na zamykarce typu „Multivac” można nie stosować dodatku solanki.
Jeżeli zaś są pakowane zwykłym sposobem, napełnione półproduktem opakowania
dopełnia się solanką zalewową lub naturalną w celu wyeliminowania dostępu powi-

26
etrza, szczelnie zamyka i przechowuje przed wysyłką w komorze chłodniczej, której
temperatura nie przekracza +3
o
C.
2.6.2. Marynowanie z dwuetapowym dojrzewaniem
Głównym celem tego sposobu marynowania jest zmniejszenie ubytków białka pod-
czas początkowego okresu dojrzewania ryb (filety). Dlatego do surowca najpierw do-
daje się kąpiel o wysokim stężeniu soli i kwasu octowego (odpowiednio: 15% i 7%),
miesza i przetrzymuje przykryte pojemniki przez 1-2 doby w temperaturze 5
o
C. Filety
wyjmuje się z kąpieli marynującej i pozostawia przez ok. 10 min do odcieknięcia, po
czym poddaje odskórzaniu i oczyszczeniu oraz zalewa ponownie kąpielą marynującą
o zmniejszonym stężeniu kwasu octowego (ok. 1,5%), z dodatkiem cukru (30-50%) i
przypraw. Czas drugiego dojrzewania wynosi od 1 tygodnia do kilku miesięcy w tem-
peraturze 0-5
o
C, w zależności od zapotrzebowania na marynaty. Dojrzały półprodukt
pakuje się do opakowań jednostkowych i dodaje zalewę składającą się z cukru (35%),
kwasu octowego (1,5%), rumu (5%) i ekstraktu przypraw (1%) zwracając uwagę by
całkowicie przykryła ona filety. Można stosować także inne zalewy i dodatek marynow-
anych owoców lub warzyw.
2.7. Podsumowanie
Technologie solenia i marynowania ryb należą do klasycznych, toteż wiele elementów
postępu technologicznego polega na doskonaleniu istniejących rozwiązań, podpatry-
waniu doświadczeń krajów z dużą tradycją technologiczną, eliminowaniu substancji
stanowiących zagrożenie dla zdrowia i wprowadzaniu nowych, dobrze rozpoznanych
dodatków, szczególnie pochodzenia naturalnego. Postęp techniczny przyniósł wiele
ułatwień w operacjach mechanicznych, opakowaniach i transporcie wewnętrznym
oraz znacznie zwiększył przepustowość linii produkcyjnych. Często jednak odbyło
się to kosztem jakości gotowego produktu i wzrostu ubytków masy podczas solenia
lub marynowania. Dbałość o wysoką jakość ryb solonych i marynat rybnych nakazuje
dokonać przeglądu punktów krytycznych i kontrolnych (CCP i CP) w procesie produk-
cyjnym, wyeliminować błędy wynikające z niewłaściwego podejścia do niektórych
operacji technologicznych (np. rozmrażanie mrożonych filetów, mieszanie z solanką
zalewową lub kąpielą marynującą, stosowanie substancji niedozwolonych lub nieefek-
tywnych), a następnie sięgnąć do technologii bardziej wyrafinowanych, gwarantujących
uzyskanie produktów bardziej szlachetnych lub nowej generacji.

27
3. Wpływ solenia i marynowania na właściwości żywieniowe
lipidów rybnych
- prof. dr hab. Anna Kołakowska
3.1. Właściwości żywieniowe lipidów rybnych
Ryby od dawna traktowane są jako żywność, która powinna być stałym składnikiem
diety, ze względu na wysoką wartość odżywczą białka, zawartość witamin i składników
mineralnych, w tym tak unikalnych jak jod i selen. W ostatnich latach wartość ryb
jako żywności wzrosła ze względu na ich lipidy (tłuszcze), które charakteryzują się
wyjątkowym składem: obecnością długołańcuchowych polienowych (wielonienasyco-
nych) kwasów tłuszczowych z rodziny n-3 (LC n-3 PUFA) (long chain polyunsaturated
fatty acids) (inaczej omega 3), niezbędnych dla prawidłowego rozwoju i funkcjonow-
ania organizmu człowieka. Należą do nich obecne we wszystkich organizmach wodnych
kwasy 20:5 eikozapentaenowy (EPA), 22:6 dokozaheksaenowy (DHA) i występujący w
niewielkich ilościach 22:5 dokozapentaenowy (DPA). Kwasów tych nie można w pełni
zastąpić obecnymi w niektórych olejach roślinnych (lnianym, kukurydzianym) kwasa-
mi z rodziny n-3, ale o krótszych (18:3) łańcuchach. Oprócz poznanego już dobrze ko-
rzystnego działania lipidów rybich w zapobieganiu i leczeniu niedokrwiennej choroby
serca, miażdżycy, obniżaniu poziomu cholesterolu i triacylogliceroli w surowicy krwi,
zapobieganiu zawałom, coraz liczniejsze są prace o działaniu przeciwnowotworowym,
korzystnym wpływie na system immunologiczny (alergie, astma), łuszczycy, osteoporo-
zie oraz aktywności w układzie nerwowym. N-3 PUFA są niezbędne do prawidłowego
rozwoju mózgu, systemu nerwowego i narządu wzroku płodu oraz funkcjonowania
ich po urodzeniu: wpływają na zdolność postrzegania, uczenia się, odporność na stres.
Udowodniono skuteczność tych kwasów w leczeniu depresji. Ostatnio wykazano, że
jest to nie tylko wpływ bezpośredni (źródło aktywnych biologicznie eikozanoidów),
ale że LC n-3 PUFA także regulują (pośrednio lub bezpośrednio) ekspresję różnych
genów.
Ryby solone i marynowane mogą być rozważane jako potencjalne źródło cennych
LC n-3 PUFA, ponieważ do ich produkcji wykorzystywane są głównie tłuste ryby mor-
skie. Równocześnie jednak wartość żywieniową lipidów zawartych w tych przetworach
trzeba rozpatrywać z uwzględnieniem niekorzystnych zmian, jakie mogą zachodzić
w lipidach podczas procesu przetwarzania i przechowywania surowców i gotowych
produktów. Dotyczy to głównie procesu utleniania lipidów. Produkty utleniania lip-
idów nie tylko zmieniają zapach i smak oraz barwę (interakcja z grupami aminowymi
substancji białkowych), ale są związkami toksycznymi o działaniu kancerogennym, mu-
tagennym, obniżają wartość odżywczą produktu (wartość odżywczą białka, strawność)

28
powodują degradację witamin i niwelują korzystne działanie niezbędnych nienasyco-
nych kwasów tłuszczowych (n-3 i n-6 PUFA).
3.2. Wpływ solenia na właściwości żywieniowe lipidów
Chlorek sodu ma wpływ zarówno na proces hydrolizy jak i utleniania lipidów za-
wartych w rybie. Proces hydrolizy bezpośrednio nie ma niekorzystnego wpływu na
wartość żywieniową lipidów, zachodzi przecież także podczas ich trawienia w prze-
wodzie pokarmowym. Uwolnione w procesie hydrolizy kwasy tłuszczowe mogą nato-
miast wpływać na przebieg procesu utleniania lipidów.
Hydroliza lipidów zachodzi przy niższych stężeniach soli, wysokie hamują aktywność
lipaz. Wolne kwasy tłuszczowe nagromadzają się dopiero po kilku dniach od naso-
lenia, chyba, że nastąpiło to już w surowcu wskutek uprzedniego przechowywania
chłodniczego lub zamrażalniczego, zwłaszcza np. śledzia poławianego w okresie zerow-
ania, kiedy lipazy wykazują maksymalną aktywność w cyklu rocznym. Podczas solenia
kwasy tłuszczowe uwalniają się w pierwszej kolejności z fosfolipidów, triacyloglicerole
wolniej ulegają hydrolizie. Ponieważ fosfolipidy są bogatsze w n-3 PUFA niż pozostałe
lipidy, uwolnione preferencjalnie wielonienasycone kwasy tłuszczowe są narażone na
szybsze utlenianie. W fosfolipidach solonych śledzi bałtyckich n-3 PUFA były prakty-
cznie nieobecne.
Lipidy śledzi solonych bałtyckich i dalekomorskich są uboższe w n-3 PUFA niż li-
pidy surowca, średnio o kilka do kilkanastu %. Największe straty dotyczą kwasu DHA
(około 20%). Straty PUFA podczas solenia sardynek wynosiły około 30%. Dobrym
wskaźnikiem niekorzystnych zmian w składzie kwasów tłuszczowych jest obniżenie
się stosunku n-3/n-6 w rybach solonych w porównaniu z surowcem.
Pomimo wykazania tych ewidentnych strat długołańcuchowych n-3 PUFA, przet-
wory solone ze śledzia, w porównaniu z surowcem nie są uboższe w n-3 PUFA. 100
g m.m solonego śledzia, tylko w jednym przypadku (na kilkanaście badanych przez
nas partii) zawierało ich mniej niż 100 g surowca, na ogół było ich więcej. Wyniki te
spowodowane są ubytkami wody w czasie solenia ale także tym, że fosfolipidy których
przede wszystkim dotyczą straty PUFA, stanowią w rybach tłustych tylko kilkanaście
% ogółu lipidów. Większe znaczenie może mieć to w przypadku solenia ryb chudych, w
których lipidy mięśniowe ograniczone są głównie do frakcji fosfolipidów (w stosunku
do tkanki zawartość fosfolipidów jest mniej więcej taka sama we wszystkich rybach).
Rynkowe matiasy w 100 g zawierały od 1,69 do 2,67 g n-3 PUFA, czyli dużo, biorąc
pod uwagę, że skuteczna zalecana dzienna dawka EPA + DHA wynosi od 0,5-1g. Te
znaczne ilości w solonych matiasach wynikają przede wszystkim z dużej zawartości
lipidów w śledziach dlkm.
Solenie ryb wiąże się ze wzrostem utlenienia lipidów. Jest to najważniejszy problem
jakościowy, zwłaszcza w przypadku ryb solonych-suszonych. Sól kuchenna katalizuje

29
proces utleniania lipidów, ten efekt rośnie ze wzrostem stężenia NaCl. Mechanizm po-
lega prawdopodobnie na wzmaganiu prooksydacyjnego wpływu jonów żelaza a także
miedzi, co ma miejsce zwłaszcza w mięśniach ciemnych i zależy także od stopnia za-
nieczyszczenia solanki jonami metali. Dorsze szczególnie wrażliwe na prooksydacyjne
działanie Cu były w okresie pośmiertnego obniżenia pH. Utlenianie lipidów w rybach
solonych jest głównie autooksydacją, ale uczestniczą w nim także lipooksygenazy
(LOX). Szczególnie aktywne LOX stwierdzono w skrzelach i skórze ryb. Poprzez katali-
zowanie utleniania LC n-3 PUFA LOX generują związki karbonylowe odpowiedzialne
za zapach świeżych ryb, ale uczestniczą także w rozwoju jełkiego zapachu. Ze wzrostem
ilości nadtlenków, następuje hamowanie aktywności LOX.
Proces utleniania uwidacznia się po około 14- 20 dniach od nasolenia śledzi (20%
NaCl, temp. 10
0
C) i powoduje istotną destrukcję lipidów, nawet, gdy nie jest wyczuwalny
sensorycznie. Równocześnie jednak podczas autolizy, w procesie dojrzewania ryb solo-
nych uwolnione aminokwasy w większości działają jako antyoksydanty, działanie takie
ma także benzoesan sodu, dodatek dopuszczony do ryb solonych. Dlatego też śledząc
przebieg utleniania lipidów w rybach solonych obserwuje się wahania zawartości i
składu produktów utlenienia lipidów. Na taki obraz zmian oksydacyjnych mają także
wpływ interakcje produktów utlenienia, zwłaszcza związków karbonylowych z produk-
tami proteolizy. Skutkiem tych interakcji są przebarwienia (pobrązowienia i pożółcenia)
oraz zmiany profilu lotnych związków zapachowych.
Praktycznie prawie wszystkie badane przez nas przetwory solone charakteryzowały
się wysokim stopniem utlenienia. Ponadto w lipidach solonych śledzi obserwowano
tworzenie się izomerów trans. Oprócz obniżenia wartości odżywczej lipidów do-
datkowym efektem utleniania lipidów w rybach solonych są straty tokoferoli, tiaminy
i dostępnej lizyny.
Straty wartości odżywczej mogą mieć miejsce zwłaszcza przy produkcji ryb solo-
nych z surowca mrożonego, przechowywanego uprzednio przez szereg miesięcy. Doty-
czy to zwłaszcza filetów i tuszek śledzi, w których procesy utleniania zachodzą szybciej
niż gdy ryby są przechowywane w postaci całych, nie patroszonych. Zaawansowany
już w surowcu proces utleniania lipidów, zostaje katalizowany dodatkiem NaCl (so-
lenie na sucho) i dostępem tlenu powietrza. Zagrożenie to można nieco zmniejszyć
stosując zamiast soli przemysłowej sól oczyszczoną: mniejsze są wtedy straty PUFA,
mniej produktów utlenienia lipidów a także najgroźniejszych z nich – produktów ut-
lenienia cholesterolu. Działania zapobiegawcze w procesie solenia muszą uwzględniać
ograniczenie dostępu światła (promieniowanie UV) i tlenu ponieważ autooksydac-
ja jest reakcją łańcuchową trudną do zahamowania. Także opakowania i warunki
przechowywania wyrobów gotowych powinny eliminować wpływ tych niekorzystnych
czynników zewnętrznych.

30
Na szybkość procesu utleniania w rybach solonych, oprócz procesu technologiczne-
go, ma istotny wpływ rodzaj surowca: gatunek i okres połowu. Szczególnie podatne na
proces utleniania są śledzie w okresie tarła (wytarte), wykazują w tym czasie również
najniższą aktywność lipolityczną.
Z powyższych względów oznakowanie przetworów solonych wartością odżywczą nie
może się odbyć w oparciu o tablice składu chemicznego surowców, ale musi dotyczyć
konkretnej grupy produktów z uwzględnieniem różnic technologicznych i zmienności
sezonowej surowca.
Reasumując, ryby solone pod względem zawartości LC n-3 PUFA mogą być
bogatym ich źródłem w diecie. Zagrożeniem nie uwzględnianym najprawdopodob-
niej w żadnym planie HACCP jest utrata (obniżenie) tych cennych wartości poprzez
wniesienie do organizmu oprócz szkodliwego NaCl, produktów utlenienia lipidów i
izomerów trans.
Działania zapobiegawcze powinny polegać na utrzymaniu odpowiednich para-
metrów podczas produkcji i przechowywania przetworów solonych.
3.3. Wpływ marynowania na właściwości żywieniowe lipidów rybnych
Ryby zawierają aktywne lipazy mięśniowe a zwłaszcza te, które znajdują się w wyro-
stkach pylorycznych i we wnętrznościach. Aktywne są zarówno lipazy jak i fosfolipazy
(A
1
i A
2
). Optimum enzymów lipolitycznych leży w pH zasadowym (8 - 9) ale wyka-
zano także aktywności lipaz i fosfolipaz lizosomalnych z optimum przy pH 4,5. Nato-
miast optimum pH LOX jest zasadowe, w pH 3 są całkowicie inaktywowane.
Najważniejsze zmiany zachodzące w lipidach podczas marynowania ryb polegają
na hydrolizie lipidów, co w konsekwencji może prowadzić do niewielkiego obniżenia
ich zawartości w produkcie wskutek wypłukiwania wolnych kwasów tłuszczowych.
Marynowanie mimo obecności NaCl działa hamująco na proces utleniania lipidów.
Zawartość produktów utlenienia w początkowych dniach marynowania jest przeważnie
niższa niż w surowcu, okresowo podczas przechowywania marynat może wzrosnąć, ale
generalnie w produktach marynowanych jest ich mniej niż w innych produktach
rybnych. Ta stabilność oksydatywna lipidów powoduje, że zasadniczo w marynatach
nie obserwuje się strat LC
n-3PUFA w stosunku do surowca. Straty EPA+DHA w 100 g produktu miały
miejsce tylko w partii śledzi bałtyckich złowionych w kwietniu i będących w okresie
tarła, straty te wynosiły 22%. W śledziach z marca ilość EPA+DHA była z kolei o 18%
wyższa niż w surowcu a w partii z października ilość EPA+DHA średnio w maryna-
tach i surowcu nie różniła się istotnie. Po dłuższym okresie przechowywania marynat
wykazywały one nawet wyższą zawartość n-3 PUFA niż świeższe marynaty, co może
być związane z wymianą masy między kąpielą i rybą zachodzącą podczas dojrzewania
i przechowywania marynat. Po 22 dniach przebywania w kąpieli marynującej ubytki

31
masy ryby dochodziły nawet do 20% a ponieważ łatwiej z ryby ługowane są triacy-
loglicerole uboższe w LC n-3PUFA, nie zubaża to pozostałych w mięsie lipidów.
Marynaty rynkowe zimne 4 różnych asortymentów (jedna z partii wyprodukowana
z ryb solonych) zawierały w 100 g ryby około 3 g n-3 PUFA, czyli mimo znacznych
różnic technologicznych ilość ta była na zbliżonym poziomie. W przypadku marynaty
z olejem, stwierdzono znaczne ilości n-3 PUFA także w oleju, świadczące o wymywaniu
ich z ryby przez zalewę, dlatego ten asortyment miał (w rybie marynowanej) zawartość
n-3 PUFA, najniższą spośród badanych marynat rynkowych.
Reasumując, nie ma podstaw do wnioskowania, że marynowanie mogłoby obniżać
wartość ryb jako źródła n-3 PUFA, zwłaszcza, że procesowi marynowania nie to-
warzyszy zwiększenie ilości produktów utlenienia.
3.4. Literatura uzupełniająca
Kołakowska A., Olley J. And Dunstan G. A. Fish Lipids. In: Chemical an Functional
Properties of Food Lipids. Z.E. Sikorski, A. Kołakowska (Eds), CRC Press, Boca Raton,
London, New York, 2003, pp. 221-264.
Kołakowska A., Domiszewski Z., and Bienkiewicz G. Effects of Biological and Tech-
nological Factors on the Utility of Fish as a Source of n-3 PUFA. In: Omega 3 Fatty
Acid Research. M.C. Teale (Ed) , Nova Science Publishers, Inc., New York, 2005, pp.
83-108.

32
Notatki
Wyszukiwarka
Podobne podstrony:
Postęp technologiczny w kontekście teorii ewolucji społecznej
Marynowanie ryb
Dozwolony użytek prywatny a postęp technologiczny
77 Postęp technologiczny i jego uwarunkowania
William V Bandoch Jr , Walter Block Czy postęp technologiczny kreuje bezrobocie
Postęp technologiczy doprowadzi do powstania superludzi
Marynowanie ryb (1948) Walerian Cięglewicz
Rozwój nauki i postęp technologiczny jako czynnik lokalizacji przemysłu
Instrukcja technologiczna postępowania z jajami
technologia ryb - zagadnienia, Nauka, Informacje o rybach, Konserwy rybne
Technologia prezerw z ryb solonych korzennie
1.3 Wykorzystanie ryb w technologii gastronomicznej
1.3 Wykorzystanie ryb w technologii gastronomicznej
podział ryb, Studia - materiały, semestr 6, Technologia rybna
więcej podobnych podstron