
Bioaktywne składniki żywności funkcjonalnej
Ćwiczenie 1
część teoretyczna
___________________________________________________________________________
__________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
F
ERMENTACJI I
M
IKROBIOLOGII
T
ECHNICZNEJ
http://www.ar.krakow.pl/tz/ktfimt/
1
W
PŁYW CZYNNIKÓW FIZYKO
-
CHEMICZNYCH ORAZ
WARUNKÓW PRZECHOWYWANIA NA WŁAŚCIWOŚCI
PRZECIWUTLENIAJĄCE WYBRANYCH PRODUKTÓW
ŻYWNOŚCIOWYCH
Metody oznaczania przeciwutleniaczy
W ciągu ostatnich kilkunastu lat ukazały się setki publikacji na temat
przeciwutleniających właściwości owoców, warzyw, napojów. Olbrzymie zróżnicowanie w
budowie, funkcji i pochodzeniu tak utleniaczy, jak i reaktywnych form tlenu, wymusiło
powstanie licznych metod badawczych. Nie jest bowiem możliwe analizowanie tym samym
sposobem tak różnych związków jak enzymy, duże białka, niskocząsteczkowe
przeciwutleniacze czy hormony. Z drugiej strony te rozmaite antyoksydanty mogą
oddziaływać w odmienny sposób, w zależności od rodnika czy utleniacza, środowiska reakcji
i obecności lub braku innych substancji. Przeciwutleniacz „wyspecjalizowany” w zmiataniu
tlenu singletowego może nie działać na rodniki peroksylowe i odwrotnie. Właśnie z powodu
tak licznych i różnorodnych mechanizmów, jak również zróżnicowania środowiska reakcji nie
ma możliwości, by jedna metoda mogła dokładnie opisywać wszystkie źródła rodników i/lub
przeciwutleniaczy.
W czerwcu 2004 roku, w Orlando, odbył się I Międzynarodowy Kongres na temat
metod oceny przeciwutleniaczy. Jego głównym zadaniem było zaproponowanie kilku metod
analitycznych, które mogłyby zostać wystandaryzowane w celu rutynowej oceny pojemności
antyoksydacyjnej w żywności.
Jak dotąd nie ma jednej, pełnej klasyfikacji stosowanych technik pomiarowych.
Większość
badań
opiera
się
na
ocenie
aktywności
czy
tzw. pojemności antyoksydacyjnej, będącej sumą właściwości poszczególnych związków
zawartych w badanym materiale. Inne metody oceniają przeciwutleniacze ilościowo i
jakościowo, nie uwzględniając ich aktywności.
Wszystkie metody służące do oceny przeciwutleniaczy, zarówno ich ilości, jak
i aktywności, można podzielić na:
chromatograficzne
- na płaszczyznach - chromatografia bibułowa i cienkowarstwowa (TLC),
- na kolumnach - chromatografia cieczowa (HPLC) i gazowa (GC),
spektrofotometryczne,
kolorymetryczne,
elektrochemiczne:
- woltamperometria cykliczna (CV),
- spektroelektrochemia,
elektronowy rezonans paramagnetyczny (EPR).
Antyoksydanty mogą inaktywować wolne rodniki na dwa sposoby, przez transfer
atomu
wodoru
(HAT)
lub
pojedynczego
elektronu
(SET).
W
związku

Bioaktywne składniki żywności funkcjonalnej
Ćwiczenie 1
część teoretyczna
___________________________________________________________________________
__________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
F
ERMENTACJI I
M
IKROBIOLOGII
T
ECHNICZNEJ
http://www.ar.krakow.pl/tz/ktfimt/
2
z tym metody określające pojemność antyoksydacyjną można też podzielić na odpowiednie
dwie grupy.
1) Metody oparte o mechanizm HAT (np. ORAC, TRAP) mierzą zdolność
przeciwutleniacza (AH) do wygaszania rodników poprzez oddanie wodoru:
XH
A
X
AH
(1)
Tego typu reakcje zachodzą szybko i zależą od pH, rozpuszczalnika oraz obecności
innych substancji redukujących, np. metali, które mogą zawyżać wynik.
2) Metody oparte o mechanizm SET (np. FRAP, CUPRAC) wykrywają zdolność
antyoksydanta do przeniesienia
e i zredukowania rodnika czy jonów metali:
AH
X
AH
X
(2)
O
H
A
AH
O
H
3
2
(3)
O
H
XH
O
H
X
2
3
(4)
II
Me
AH
AH
III
Me
(5)
Są to reakcje zachodzące powoli, zależne od pH i obecności jonów metali.
Istnieją jednak metody, których nie można jednoznacznie zakwalifikować do żadnej z
powyższych grup (TEAC, DPPH, metoda Folina-Ciocalteu).
Niezależnie od przyjętego podziału najczęściej wykorzystywane są metody
chromatograficzne i spektrofotometryczne. Szerokie zastosowanie w badaniach glikozydów
flawonoidowych znalazła chromatografia (gr. chróma, -atos ‘kolor’ + gráphein ‘pisać’). Jest
to metoda analizy chemicznej polegająca na określeniu składu mieszaniny przez rozdzielenie
jej na składniki lub frakcje, dzięki ich różnemu zachowaniu w dwufazowym układzie
złożonym z fazy nieruchomej (stacjonarnej) oraz ruchomej, która w określonym kierunku
zmienia swoje położenie względem tej pierwszej. Chromatografia pozwala nie tylko na
stwierdzenie obecności związku w próbce, lecz także na wnioskowanie o jego ilości.
Stosunkowo dobre zróżnicowanie glikozydów flawonoidowych ze względu na rodzaj i liczbę
cząsteczek cukru oraz ich lokalizację, otrzymuje się używając w chromatografii
cienkowarstwowej jako adsorbentu: poliamidu, żelu krzemionkowego G lub tlenku glinu.
Najczęściej stosuje się gotowe płytki chromatograficzne.
Zasadnicze znaczenie dla dobrego rozdziału ma dobór odpowiedniej fazy ruchomej i
adsorbenta. W skład fazy ruchomej wchodzą najczęściej następujące rozpuszczalniki: woda,
kwas octowy, n-butanol, octan etylu, kwas mrówkowy, benzen, keton metyloetylowy,
chloroform, aceton. Rozdzielanie substancji na cienkich warstwach wykonuje się niekiedy
wielokrotnie, rozwijając chromatogram w tej samej lub różnych fazach ruchomych. W celu
rozpoznania związków stosuje się wzorzec o znanej wartości czasu retencji (R
f
). Po
dokonaniu rozdziału na cienkiej warstwie, można zlokalizowaną substancję wyeluować
odpowiednim rozpuszczalnikiem i oznaczyć ilościowo.
W wysokosprawnej chromatografii cieczowej (HPLC) fazą ruchomą jest ciecz,
przepływająca
pod
wysokim
ciśnieniem
poprzez
warstwę
złoża
w kolumnie. Identyfikację i oznaczanie składników umożliwiają detektory reagujące na
zmiany zachodzące w składzie fazy ruchomej podczas wymywania z kolumny składników
mieszanin. Dobór rozpuszczalników zależy od właściwości badanego flawonoidu i
stosowanego układu detekcyjnego, niekiedy stosuje się fazę ruchomą, o składzie

Bioaktywne składniki żywności funkcjonalnej
Ćwiczenie 1
część teoretyczna
___________________________________________________________________________
__________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
F
ERMENTACJI I
M
IKROBIOLOGII
T
ECHNICZNEJ
http://www.ar.krakow.pl/tz/ktfimt/
3
zmieniającym się podczas procesu chromatograficznego (elucja gradientowa). Fazy ruchome
w chromatografii cieczowej, w odróżnieniu od gazowej, są ważnym elementem zmiennym,
dostarczającym wielu możliwości doboru najkorzystniejszych warunków rozdziału. Sposób
postępowania podczas identyfikacji jest zbliżony w obu przypadkach, ale przy objętościach
próbek większych niż 10 mm
3
nie jest konieczne stosowanie wzorców wewnętrznych, gdyż
technika ich wprowadzania na kolumnę pozwala na uzyskanie dostatecznej powtarzalności.
Chromatografia
cieczowa
znalazła
zastosowanie
w
analizie
jakościowej
i ilościowej flawonoidów. Techniką HPLC można identyfikować monomery, dimery i
trimery, natomiast oligomery nadal stanowią wyzwanie dla analityków, ze względu na
trudności ze znalezieniem odpowiednich parametrów rozdziału [Schulz, Albroscheit, 1988].
W chromatografii gazowej (GC) fazą ruchomą jest gaz. Badania jakościowe prowadzi
się na podstawie porównania czasu retencji substancji badanej i wzorcowej. Do oznaczania
zawartości stosuje się najczęściej metodę wzorca wewnętrznego, która eliminuje błędy przy
wprowadzaniu próbki na kolumnę.
Do ilościowego oznaczania związków flawonoidowych najczęściej wykorzystuje się
techniki spektrofotometryczne i kolorymetryczne.
Metody spektrofotometryczne są przydatne do oznaczania czystych substancji, natomiast
metodami kolorymetrycznymi można oceniać zawartość lub aktywność flawonoidów w
ekstraktach po wstępnym oczyszczeniu. Do tej grupy należą m.in. metody:
Christa-Műllera, w której zawartość flawonoidów oznacza się poprzez pomiar
natężenia
zabarwienia
powstałego w
wyniku
reakcji
flawonoidu
z trójchlorkiem antymonu, tlenochlorkiem cyrkonu, octanem uranylowym, azotanem berylu,
kwasem borowym lub chlorkiem glinowym,
Folina-Ciocalteu,
gdzie
flawonoidy
tworzą
barwny
kompleks
z odczynnikiem Folina-Ciocalteu (mieszanina wolframianu sodowego, molibdenianu
sodowego
i
siarczanu
litu
w
środowisku
kwasu
fosforowego
i solnego) dając zielono-niebieską barwę; po utlenieniu kompleks oznacza się
spektrofotometrycznie przy długości fali 750 nm lub 784 nm,
opierające się na reakcjach wygaszania syntetycznych wolnych rodników (ABTS,
DPPH, DMPD); barwny aktywny rodnik ulega redukcji przez antyoksydanty, obecne w
badanej próbce, do bezbarwnych związków, co ilościowo mierzy się spektrofotometrem przy
długości fali 734, 515 i 505 nm odpowiednio dla w/w rodników,
FRAP, polegająca na pomiarze zdolności do redukcji jonu żelazowego 2,4,6-
tripirydylo-s-triazyny
(TPTZ);
związek
żelaza(III)
w
reakcji
z antyoksydantem daje barwny produktu, który oznacza się przy długości fali 593 nm,
TRAP, w której przeciwutleniacz redukuje rodnik ABAP.
CUPRAC, w której jony miedzi(II) ulegają pod wpływem antyoksydantów redukcji do
jonów miedzi(I); analizę spektrofotometryczną wykonuje się przy długości fali 450 nm,
ORAC, oceniająca zdolność antyutleniacza do opóźniania fluorescencji
R-fikoerytryny,
indukowanej
przez
AAPH,
długość
fali
wzbudzającej
to
540 nm, a emisji 570 nm.
Do oceny aktywności przeciwutleniającej służą także metody elektrochemiczne.
Wykorzystują one prąd jaki powstaje w czasie elektrochemicznej reakcji tlenu na elektrodzie.
Przeciwutleniacze, reagując z tlenem i jego pochodnymi, zmniejszają natężenie tego prądu.
Istnieje kilka wariantów elektrochemicznego pomiaru aktywności antyoksydacyjnej.
Najważniejsze z nich, cykliczna woltametria (CV) i różnicowa woltametria pulsowa (DPV),
pozwalają na pomiar siły działania przeciwutleniaczy zawartych w badanych próbkach za

Bioaktywne składniki żywności funkcjonalnej
Ćwiczenie 1
część teoretyczna
___________________________________________________________________________
__________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
F
ERMENTACJI I
M
IKROBIOLOGII
T
ECHNICZNEJ
http://www.ar.krakow.pl/tz/ktfimt/
4
pomocą specjalnej szklanej elektrody węglowej. Zróżnicowanie pH pozwala na selektywną
ocenę samych flawonoidów (pH=7,5) lub flawonoidów i kwasów fenolowych (pH=2,0).
Zaletą tych metod jest to, że nie wymagają żadnych dodatkowych odczynników.
Szklana elektroda węglowa jest najlepszą do tych celów, gdyż antyoksydanty fenolowe
utleniają się na niej przy podobnych potencjałach jak na elektrodach metalicznych (400-450),
jednak bez zakłóceń interferencyjnych związanych z utlenianiem etanolu.
Do technik oceniających zawartość związków przeciwutleniających należy zaliczyć
również wszystkie oznaczenia poszczególnych antyoksydantów, a więc metody analizy
witaminy C, tokoferoli, antocyjanie itd. Ze względu na ograniczony zakres tej pracy nie będą
one omawiane szerzej.
Wyżej wymienione metody służą do analizy ilościowej lub jakościowej
przeciwutleniaczy oraz oceny ich aktywności. Odmienne podejście do problemu reprezentuje
następna technika.
Spektroskopia elektronowego rezonansu paramagnetycznego (EPR) pozwala na wykrycie
związków posiadających niesparowane elektrony (paramagnetyków), czyli będących
wolnymi rodnikami. Zjawisko pochłaniania energii promieniowania mikrofalowego o
odpowiedniej częstotliwości po raz pierwszy zaobserwował w 1944 roku Zawojski. Badanie
polega na wprowadzeniu próbki w zmienne pole magnetyczne, po czym niesparowane
elektrony orientują się równolegle lub antyrównolegle względem kierunku pola
(rozszczepienie poziomów energetycznych to tzw. efekt Zeemana) i następuje absorpcja
doprowadzonego promieniowania o częstości pasującej do różnicy energii tych orientacji.
Warunki pomiaru można zmienić poprzez zmianę indukcji pola magnetycznego, natomiast
jego częstotliwość pozostaje stała. Badania przeprowadza się zazwyczaj w temp. ciekłego
azotu 77
o
K, gdyż przedłuża to czas życia wolnych rodników. Pochłonięcie energii może
zostać zmienione, odpowiednio przekształcone przez układ odbiorczy spektrometru
elektronowego rezonansu paramagnetycznego i wyświetlone na ekranie, bądź zapisane przez
układ rejestrujący. Otrzymywane widma są porównywane ze wzorcem zewnętrznym, którym
najczęściej jest DPPH i analizowane przez programy komputerowe.
Metoda EPR posiada szereg zalet wobec innych spektroskopii promieniowania
elektromagnetycznego:
jest to metoda specyficzna dla wolnych rodników, inne substancje nie mają żadnego
udziału w rejestrowanym sygnale,
energia stosowanych do napromieniania próbki mikrofal jest niewielka, zatem i
możliwość powstania uszkodzeń analizowanej próbki przez sam pomiar jest znikoma,
objętość badanej próbki to zaledwie – około 200 µl,
możliwe są pomiary próbek nieprzezroczystych,
sygnał wolnych rodników w tle jest znikomy, pozwala to w sposób niezaburzony
obserwować upatrzone substancje wolnorodnikowe.
Poważnym utrudnieniem obserwacji bezpośredniej wolnych rodników może być ich bardzo
krótki
czas
życia.
Aby
ominąć
ten
problem
stosowane
są
tzw. pułapki spinowe (T). Są to związki diamagnetyczne, które dzięki obecności wiązań typu
O
N
, z łatwością wchodzą w reakcję z nietrwałym rodnikiem tworząc trwałe addukty
spinowe:
T
R
T
R
(25)
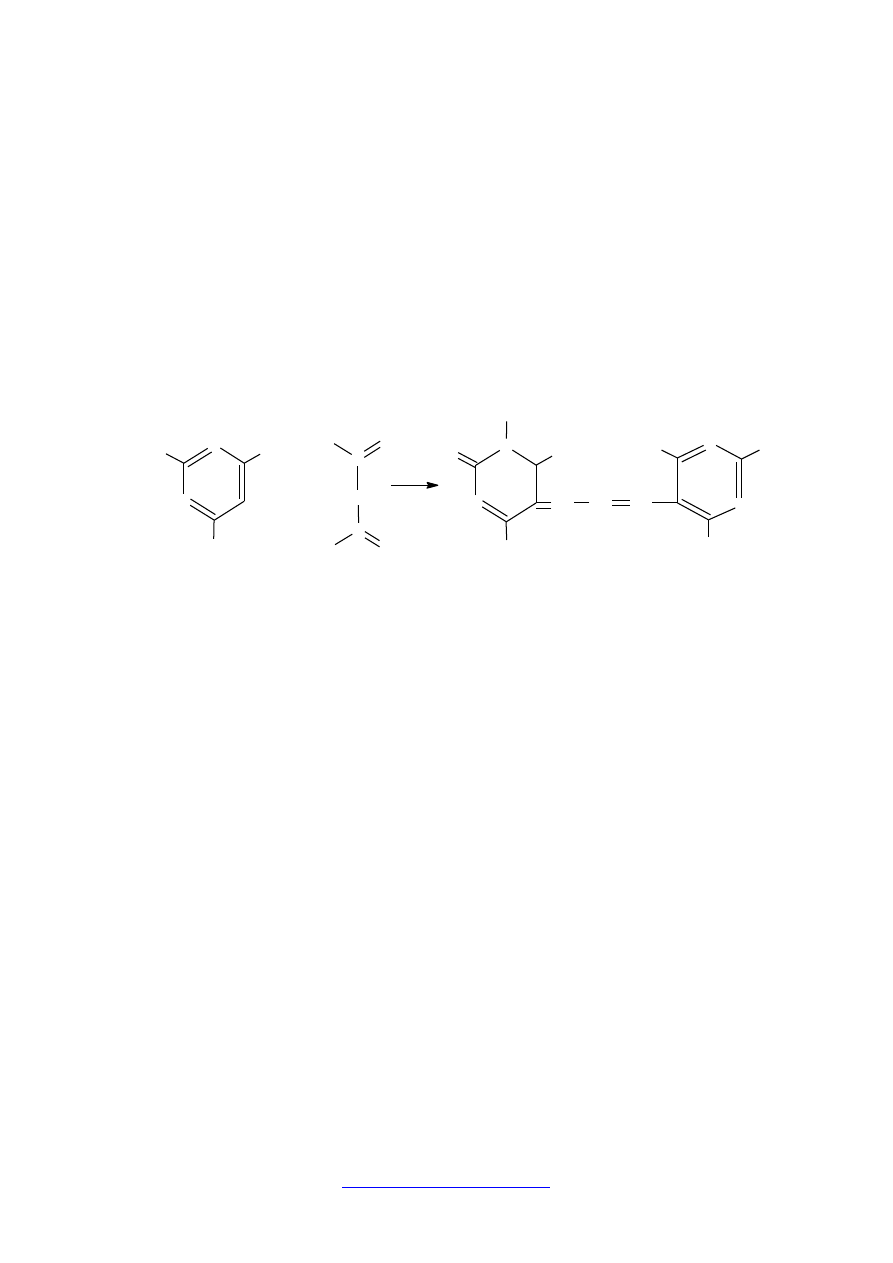
Bioaktywne składniki żywności funkcjonalnej
Ćwiczenie 1
część teoretyczna
___________________________________________________________________________
__________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
F
ERMENTACJI I
M
IKROBIOLOGII
T
ECHNICZNEJ
http://www.ar.krakow.pl/tz/ktfimt/
5
Funkcje pułapek spinowych mogą spełniać duże połączenia organiczne typu nitrozozwiązków
lub nitronów, np. 2,4,6-tri-tert-butylonitrobenzen, a także kompleksy nieorganiczne
(Fe
2+
(DETC)
2
).
Oprócz wyżej wymienionych metod istnieje jeszcze mnóstwo innych, ale zwykle nie
są one wykorzystywane do badań żywności. Do pomiaru zdolności zmiatania wolnych
rodników czystych związków chemicznych lub do oceny pojemności antyoksydacyjnej
osocza czy innych płynów ustrojowych służy między innymi badanie peroksydacji lipidów.
Ocenia się wydajność hamowania tego procesu przez antyutleniacze. Istnieje wiele wariantów
tej metody, najczęściej stosuje się reakcję aldehydu malonowego (MDA) z kwasem
tiobarbiturowym.
Produkt
tej
reakcji
(rys.1.)
to
addukt
o charakterystycznym różowym zabarwieniu, który oznacza się spektrofotometrycznie.
N
N
OH
HS
O
H
+
C
H
O
H
2
C
C
H
O
2
N
N
OH
S
OH
H
CH
CH
CH
N
N
O
H
SH
OH
Rys.1. Reakcja powstawania barwnego adduktu kwasu tiobarbiturowego i MDA
Mimo powszechnego stosowania tej metody nie można jej uznać za najlepszą. Jest bardzo
czuła, ale wysoce niespecyficzna. Z kwasem tiobarbiturowym addukty tworzą bilirubina,
kwas sjalowy, produkty degradacji cukrowców i inne aldehydy.
Poza oznaczaniem zahamowania peroksydacji lipidów przez przeciwutleniacze ocenia się
także produkty utleniania białek i nukleotydów oraz uszkodzenia kwasów nukleinowych
prowadzące do mutacji.
Metody te jednak nie mają praktycznie żadnego zastosowania w badaniach właściwości
antyoksydacyjnych produktów żywnościowych.
Czynniki wpływające na zafałszowania wyników
Jak dotąd nie ma jednej uniwersalnej i idealnej metody oznaczania aktywności
przeciwutleniajacej. Pomimo tego, że większość z nich jest prosta, interpretacja wyników
bywa skomplikowana, np. kiedy analizowane próbki mają pokrywające się widma. DPPH ma
stosunkowo mały zasięg liniowy, ponadto istnieje wiele antyoksydantów reagujących szybko
z rodnikami propylowymi, ale wolno bądź wcale z DPPH. Przy jego użyciu można oznaczyć
tylko związki hydrofobowe w przeciwieństwie do metody z zastosowaniem rodnika ABTS,
która oznacza zarówno hydrofobowe, jak i hydrofilowe.
W metodzie Folina-Ciocalteu czynnikiem, który najbardziej wpływa na zafałszowania
jest mieszanie się substancji, szczególnie cukrów, aromatycznych amin, dwutlenku siarki,
kwasu askorbinowego i kwasów organicznych. Dlatego należy wprowadzać korekty.
Dodatkowo niefenolowe substancje organiczne (adenina, adenozyna, alanina, anilina, kwas
aminobenzoesowy, kwas askorbinowy, benzaldehyd, kreatynina, cysteina, cytozyna,
dimetyloalanina, EDTA, fruktoza, guanina, glicyna, histamina, histydyna, uracyl, kwas

Bioaktywne składniki żywności funkcjonalnej
Ćwiczenie 1
część teoretyczna
___________________________________________________________________________
__________________________________________________________________________________________
K
ATEDRA
T
ECHNOLOGII
F
ERMENTACJI I
M
IKROBIOLOGII
T
ECHNICZNEJ
http://www.ar.krakow.pl/tz/ktfimt/
6
olejowy, tryptofan, białka, sacharoza), jak i nieorganiczne (hydrazyna, siarczan amonu,
siarczan
manganu,
fosforan
sodu) reagujące
z
odczynnikiem
Folina
dają
w efekcie zawyżony wynik końcowy aktywności przeciwutleniającej.
Niektóre metody opierają się na założeniu, że reakcje redoks przebiegają tak szybko,
że wszystkie kompletne reakcje zachodzą w przeciągu 4 do 6 minut. W rzeczywistości to nie
zawsze jest prawda. Szybko reagujące fenole, które wiążą żelazo i rozbijają niższe związki
najlepiej analizować w krótkim czasie (ok. 4 min). Jednakże, niektóre polifenole reagują
nieco wolniej i potrzebują dłuższego czasu reakcji dla wykrycia (ok. 30 min.). Źle dobrany
czas reakcji również powoduje, że wyniki są obarczone błędem.
Nie wszystkimi metodami można oznaczyć te same przeciwutleniacze. Metoda FRAP
nie mierzy np. glutationu. Wykrywa się go za pomocą oznaczenia TRAP, opierającego się na
fazie opóźnienia, zakładając, że wszystkie przeciwutleniacze ją wykazują i że jej długość jest
proporcjonalna do aktywności przeciwutleniającej. Jednakże, nie wszystkie antyoksydanty
posiadają oczywistą fazę opóźnienia. Ponadto wartość otrzymana na podstawie samej fazy
obniża rzeczywisty wynik.
Wyszukiwarka
Podobne podstrony:
cwiczenie 3 teoria id 125339 Nieznany
Fizjologia Cwiczenia 11 id 1743 Nieznany
Biologia Cwiczenia 11 id 87709 Nieznany (2)
cwiczenie 14 id 125164 Nieznany
8 Cwiczenia rozne id 46861 Nieznany
cwiczenia wzrost id 155915 Nieznany
cwiczenie III id 101092 Nieznany
Cwiczenie 5B id 99609 Nieznany
Cwiczenie nr 8 id 99953 Nieznany
cwiczenie 05 id 125057 Nieznany
F Cwiczenia, cz 3 id 167023 Nieznany
cwiczenie 52 id 41325 Nieznany
Cwiczenie 01 id 98935 Nieznany
Cwiczenie 12 id 99084 Nieznany
CWICZENIE 3 temat id 99386 Nieznany
CwiczenieArcGIS 02 id 125937 Nieznany
cwiczenia 09 id 124345 Nieznany
Cwiczenia czytania id 98475 Nieznany
więcej podobnych podstron