Podwyższoną ekspresję K6 i K16 obserwuje się
w uszkodzeniach skóry z hiperprloliferacją, jak
np. pęcherzyca albo łuszczyca. Ekspresja tych ke-
ratyn ułatwia migrację keratynocytów w obrębie
zranienia.
Filamenty pośrednie odrywają także pewną rolę
w niektórych chorobach nowotworowych. Komórki
Reed-Sternberga (cytologiczny marker chłoniaka
Hodgkina) dokonują nadekspresji restyny, podczas
gdy rozwój raka jelita grubego jest związany z mu-
tacją MCC (mutated in colorectal carcinoma). Nie-
które przypadki stwardnienia zanikowego bocznego
(amyotrophic lateral sclerosis) mogą być spowodo-
wane mutacjami dotyczącymi neurofilamentów.
Aktyna jest białkiem
mikrofilamentarnym wykazującym
aktywność ATPazową
Mikrofilamenty aktynowe są najlepiej znane jako
tworzywo cienkich miofilamentów. W rzeczywisto-
ści białko to występuje powszechnie. Spolimeryzo-
wane makromolekuły aktynowe tworzą około
10-20% białek. Większość ważnych molekuł odpo-
wiedzialnych za kształtowanie architektury komó-
rek jest wiązana przez aktynę, co sprawia, że ta osta-
tnia jest niezwykle ważna w kontekście determinacji
morfologii komórkowej (ryc. 10.4). Produkt genu
beta aktyny ze względu na jego wszechobecną eks-
presję traktowany jest jako tzw. gen odnośnikowy
w trakcie wykonywania eksperymentów genetycz-
nych. Tak jak tubulina jest główną białkową
składową rzęski, aktyna stanowi kluczowy ele-
ment budulcowy kosmków jelitowych. Niemniej
jednak obydwa typy białek różnią się znacznie
pod wieloma względami. Po pierwsze – stabiliza-
cja filamentów aktynowych jest zależna raczej od
ATP, a nie GTP. Po drugie – mikrofilamenty ist-
nieją jako gmatwanina krzyżowo powiązanych
białek, a nie dyskretna struktura tubularna. Poli-
meryzacja aktyny odbywa się w dwóch etapach:
pierwszy to nukleacja (etap limitujący szybkość
procesu polimeryzacji), kolejny to elongacja – ten
etap prowadzi do zaangażowania w polimeryzację
rozmaitych izoform aktyny.
Część II
·
OD GENETYKI MOLEKULARNEJ DO BIOCHEMII CZŁOWIEKA
·
250
Ryc. 10.4.
Koordynacja zdarzeń wewnątrzkomórkowych prowa-
dzona przez białka cytoszkieletu.
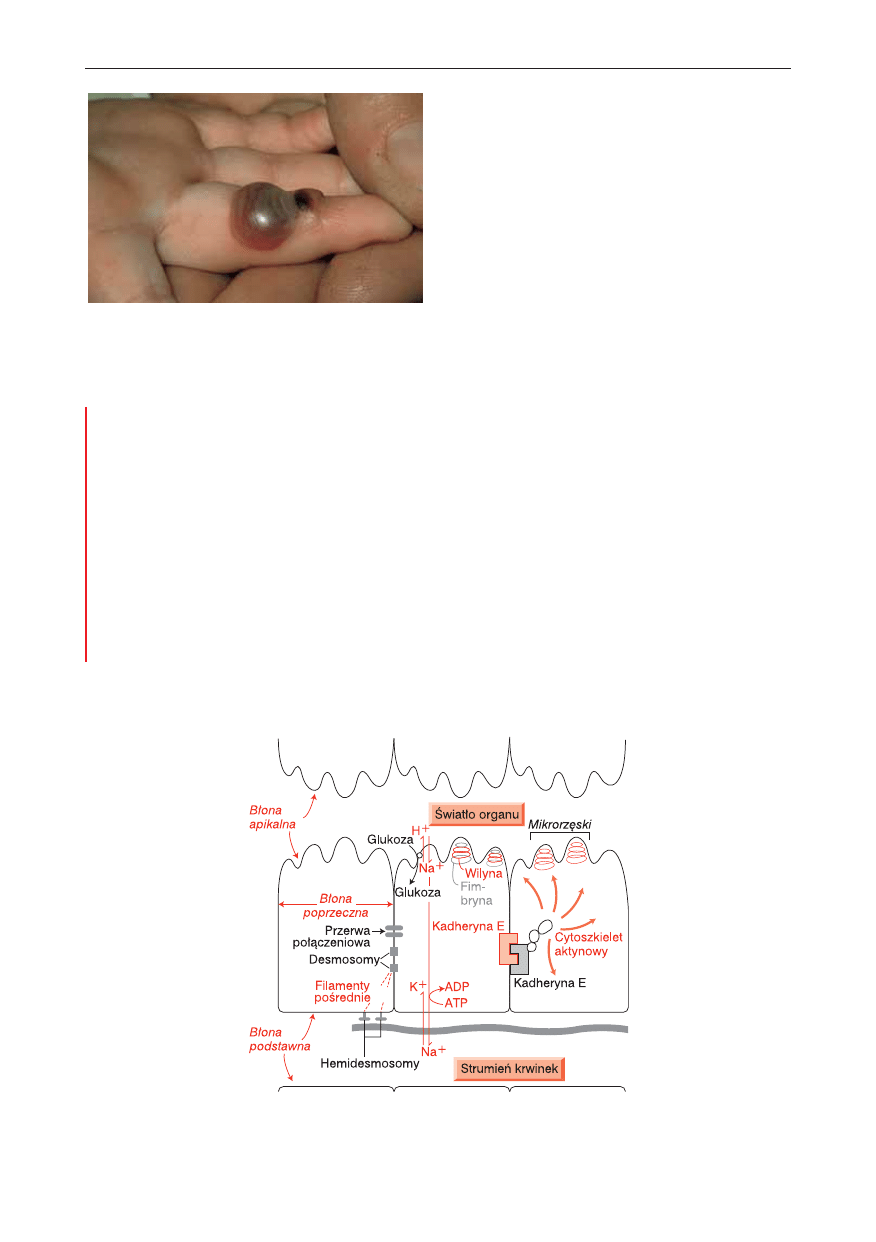
Ryc. 10.3.
Wrodzona erytrodermia z rybią łuską spowodo-
wana mutacją keratyny. (Dzięki uprzejmości Wellcome
Medical Photographic Library, nr N0004663C).
1. Nukleacja rozpoczyna się jako zależna od wyso
-
kiego stężenia soli zmiana konfiguracji (konfor-
macji) globularnej (monomerycznej) formy
G-aktyny. Ta odmiana aktyny to około 50% ak
-
tyny komórkowej.
2. W drugim etapie aktyna G jest konwertowana do
spolimeryzowanej formy aktyny.
Istnieje przynajmniej 6 izoform aktyny kodowa-
nych przez odrębne geny. Polimery mikrofilamen-
tów aktyny F są stabilizowane przez jony wapnia i
ADP, podczas gdy forma niespolimeryzowana jest
stabilizowana przez jony magnezu i ATP. Stopień
konwersji zależny jest od aktywności ATPazowej
molekuł aktynowych, występujących wokół i w obrę-
bie określonego mikrofilamentu. W związku z tym,
że aktyna połączona z ATP wykazuje wyższe powino-
wactwo do zakończeń filamentów, elongacja poli-
merów aktyny jest ATP-zależna (ryc. 10.5). W niektó-
rych systemach eksperymentalnych deformacja ko-
mórkowa jest związana z defosforylacją tyrozyn wy-
stępujących w obrębie aktyn.
Zachowania aktyny są regulowane przez białka
wiążące aktynę. Monomeryczne formy G aktyny są
wiązane poprzez małe białko o masie cząsteczko-
wej około 15 kDa, nazywane profiliną. Profilina sta-
bilizuje aktynę w formie monomerycznej. Spolime-
ryzowane filamenty aktynowe ulegają rozdziałowi
pod wpływem żelzoliny. Inne białko wiążące się
z aktyną to wilina, która uczestniczy zarówno w ka-
talizowaniu polimeryzacji F-aktyny, jak i rozrywa-
niu polimerów aktyny, przyczyniając się w ten spo-
sób do utrzymania dynamicznej architektury mi-
krokosmków w komórkach jelit. W niemięśniowych
typach komórek aktyna jest rozdzielona pod wpły-
wem żelzoliny i wiliny, i wpływa na relaksacyjną
zmianę kształtu komórki, umożliwiając w ten sposób
fagocytozę i mobilność komórki. Wpływ żelzoliny wy-
nika przede wszystkim z możliwości tzw. czapeczkowa-
nia (capping) – wiązania tego białka do tzw. rosnącego
końca filemantu aktynowego, czemu towarzyszy termi-
nacja polimeryzacji. Tymozyna beta 4 to inne biało
wiążące aktynę. Tymozyna porządkuje komórkowe za-
soby monomerów aktynowych w sposób precyzyjny,
zapobiegając spontanicznej polimeryzacji aktyny.
ASPEKTY KLINICZNE
Aktyna w chorobach człowieka
Aktyna jest produktem tzw. genu metabolizmu
podstawowego (housekeeping gene) a jej udział za-
obserwowano w kilku chorobach człowieka.
1. W wyniku masywnych uszkodzeń tkanek do
-
chodzi do uwolnienia dużych ilości aktyny F i
aktyny G do krążenia, co prowadzi do induko-
wanych mikrofilamentami zatorów naczynio-
wych. Zatory te mogą prowadzić nawet do sta-
nów zagrożenia życia w przypadku szoku sep-
tycznego, malarii, piorunującej martwicy
wątroby.
2. Powstanie krążących autoprzeciwciał w przy
-
padku przewlekłego zapalenia wątroby (prze-
ciwciała przeciwko mięśniom gładkim) lub ze-
społu pourazowego serca (przeciwciała prze
-
ciwko komórkom mięśnia sercowego) może
być związane z uwolnieniem do krążenia du-
żych ilości aktyny występującym po uszkodze-
niu tkanek.
3. Nieprawidłowe rozrywanie filamentów akty-
nowych w związku z mutacją punktową żelzo-
liny występuje w przypadku rodzinnej amyloi-
dozy typu fińskiego.
4. Zdolność żelzoliny do rozrywania filamentów
aktynowych może mieć znaczenie terapeuty-
czne w mukowiscydozie, gdzie wysoki poziom
filamentów aktynowych wydzielanych w tra-
kcie trawienia powoduje niewydolność trzu-
stki.
Zależny od aktyny ruch komórkowy jest zazwy-
czaj osiągnięty w wyniku formowania kolca (spike,
równoległe filamenty, filopodia) albo kartki (orto-
gonalne filamenty: lamelliopodia). Wydłużanie la-
meliopodiów jest przyśpieszane za pośrednictwem
tymozyny beta 4 (patrz powyżej), przez co dochodzi
do ułatwienia migracji komórkowej. W odniesieniu
do tego aspektu, nadekspresja tymozyny beta 4 jest
związana z metastazą komórek nowotworowych.
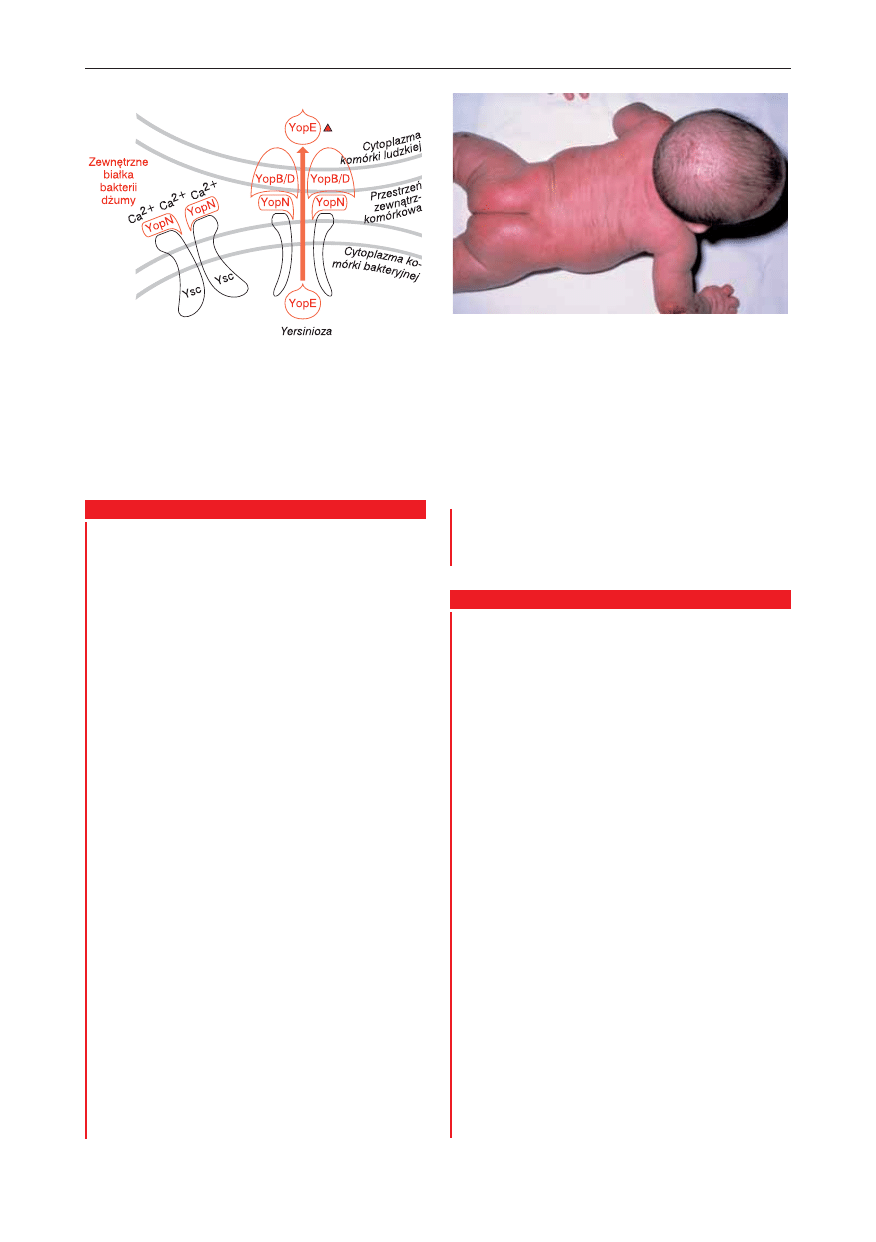
W przypadku bakterii Yersinia pestis – czynnika
zakaźnego dżumy, zdolność do kolonizowania na-
rządów układu odpornościowego jest osiągana w
wyniku wyrzutu zewnątrzkomórkowych białek Yop
bakterii Yersinia, w tym białka YopE, będącego cyto-
toskyną depolimeryzującą mikrofilamenty aktyno-
we. Białko YopE ulega nadekspresji w wyniku kon-
taktu bakterii z komórkami gospodarza (ryc. 10.6).
Wrodzone zaburzenia w rozwoju układu ner-
wowego określone mianem zespołu Williamsa po-
wstają wielokrotnie w konsekwencji niedoboru
enzymu powodującego fosforylację kofiliny (patrz
poniżej).
Rozdział 10
·
BIAŁKA CYTOSZKIELETU I MOTORY MOLEKULARNE
·
251
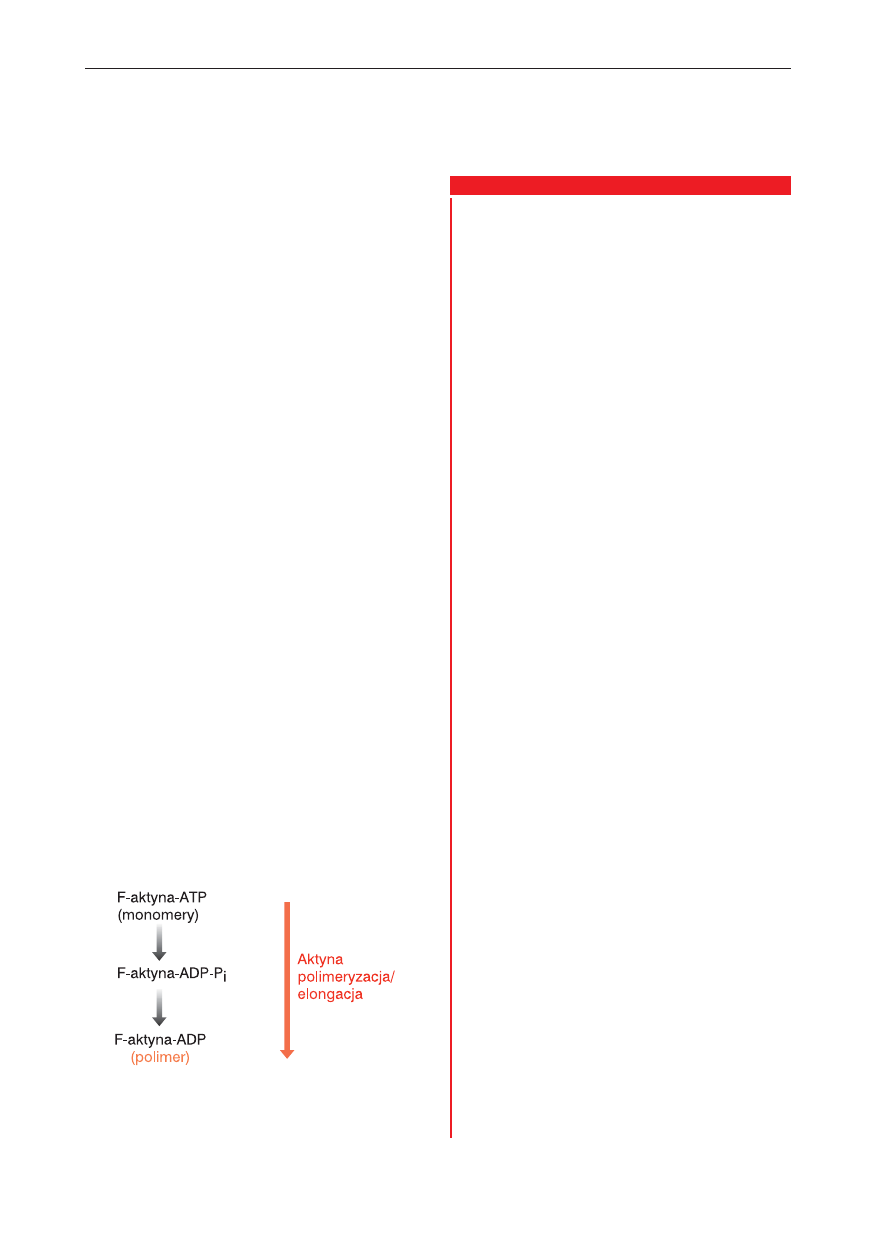
Ryc. 10.5.
Transformowanie aktyny w wyniku fosforyla-
cji i polimeryzacji. Katalizowana przez ATPazę hydroliza
ATP inicjuje polimeryzację monomerycznej formy akty-
ny (aktyny F).
ASPEKTY MOLEKULARNE
WASP
Autosomalny recesywny zespół Wiskotta-Aldri-
cha (WAS; ryc. 10.7) jest spowodowany poprzez
mutacje utraty funkcji (loss of function) dotyczące
białka WASP, które ulega selektywnej ekspresji w
komórkach linii hematopoetycznych. WASP jest
białkiem wiążącym aktynę i indukującym tworze-
nie ognisk adhezyjnych w makrofagach, limfocy-
tach i płytkach krwi. W przypadku komórek wyka-
zujących zdolności chemotaktyczne to działanie
białka WASP związane jest ze stymulacją komple-
ksu aktyno-pokrewnego białka Arp2/3. Komórki
zdolne do ekspresji białka WASP syntetyzują pod-
osomosomy w odpowiedzi na bakteryjne chemoa-
traktanty. Te struktury adhezyjne nie występują u
pacjentów z WAS, powodując defekty w chemota-
ksji, a co za tym idzie – uogólniony niedobór im-
munologiczny.
W komórkach neuronalnych kombinacja PIP
2
(fosfatydyloinozytolobisfosforan) i małego białka G
Cdc42 indukuje formowanie wypustek w konsek-
wencji wiązania do N-WASP, czyli białka wiążącego
profilinę i będącego homologiem białka WASP, wy-
stępującego głównie w komórkach układu nerwo-
wego. Po związaniu do Cdc42, N-WASP indukuje
depolimeryzację – odkrywając wolne, rosnące koń-
ce mikrofilamentu, co w końcowym efekcie umożli-
wia utworzenie długich aktynowych mikrokolców
(microspikes).
Inna fosfoproteina, kofilina, mediuje błonowe
marszczenie (rufflling) i lamoliopodialne efekty
małego białka G Rac. Zmiany te umożliwiają wy-
tworzenie kompleksu ze spokrewnionym z WASP
białkiem WAVE. [Ruffling umożliwia tworzenie
zmarszczek (ruffles) kompartmentów błony komór-
kowej, umożliwiających tworzenie kompleksów białek
adhezyjnych w obrębie lameliopodiów – przyp. red.].
ASPEKTY KLINICZNE
VASP i listerioza
Zjadliwość wewnątrzkomórkowej bakterii Li-
steria monocytogenes jest zależna od jej zdolności
do inwazji tkanek. Listeria porusza się wewnątrz
komórek, osiągając prędkość około 5 mikrome-
trów (jest to połowa średnicy komórki bakteryjnej)
na minutę. Ruch bakterii odbywa się dzięki akty-
nowemu „ogonowi rakietowemu” (rocket tail) na-
pędzanemu przez białka gospodarza. W momen-
cie kiedy bakteria dociera do błony komórkowej,
formowane są filopodia.
W jaki sposób Listeria podporządkowuje sobie ma-
szynerię gospodarza? Białko wiążące aktynę, profili-
na, ulega koncentracji w tych częściach komórki,
gdzie filamenty aktynowe ulegają rekrutacji do boga-
tego w prolinę białka wiążącego profilinę VASP (vaso-
dilator-stimulated phosphoprotein). Kluczowe dla zjad-
liwości bekterii Listeria jest białko ActA, wiążące VASP
i ulegające ekspresji na tych częściach powierzchni
bakteryjnej, gdzie formułowany jest aktynowy ogon.
Poprzez wiązanie do VASP profilina ulega rekrutacji
do tej części ściany bakterii, które zawiera ActA. To z
kolei umożliwia rozpoczęcie formowania siedliska
dla aktynowego ogona. Odpowiednie domeny białka
ActA są homologiczne do WASP, a inne do białek
cytoszkieletu zyksyny i winkuliny. To tłumaczy wiąza-
nie ActA do kompleksu sygnalizacyjnego Arp2/3 (któ-
ry włącza demontaż aktynowego filamentu) i VASP
(ryc. 10.8).
Część II
·
OD GENETYKI MOLEKULARNEJ DO BIOCHEMII CZŁOWIEKA
·
252
Ryc. 10.7.
W zespole Wiskotta-Aldricha obserwuje się
częste infekcje spowodowane defektami adhezji i che-
motaksji komórek układu odpornościowego. (Dzięki
uprzejmości wellcome Medical Photographic Library,
nr N0005090C).
Ryc. 10.6.
Uszkodzenie cytoszkieletu aktynowego wywo-
łane przez zewnątrzkomórkowe białka Yop bakterii dżu-
my. Białko to jest wprowadzane do komórek gospodarza
za pomocą białka transmembranowego Ysc.
Wyszukiwarka
Podobne podstrony:
molek - egzamin, Biotechnologia PWR, Semestr 5, Biologia Molekularna - Wykład, egzamin - stare pytan
1Ochr srod Wyklad 1 BIOLOGIA dla studid 19101 ppt
Biologiczne uwarunkowania ADHD
ANALIZA KOSZTU BIOLOGICZNEGO WYKONYWANEJ PRACY
Przykłady roli biologicznej białek
03 RYTMY BIOLOGICZNE CZŁOWIEKAid 4197 ppt
Szkol Biologiczne w środowisku pracy
KOROZJA BIOLOGICZNA II
Budowa, wystepowanie i znaczenie biologiczne disacharydow
Biologia misz masz
rytmy biologiczne
Doświadczenia biologiczne(1)
CZYNNIKI BIOLOGICZNE
Biologiczne podstawy zachowania 2, bmz06
więcej podobnych podstron