
ZESZYTY PROBLEMOWE POSTĘPÓW NAUK ROLNICZYCH 2009 z. 534: 151-161
WYKORZYSTANIE METODY in vitro
W GENERATYWNYM I WEGETATYWNYM
ROZMNAśANIU DERENIA JADALNEGO (Cornus mas L.)
Włodzimierz
Lech
, Ewa
Dziedzic
, Monika
Bieniasz
, Roman
Rduch
Katedra Sadownictwa i Pszczelnictwa, Uniwersytet Rolniczy im. H. Kołłątaja w Krakowie
Wstęp
W grupie mniej znanych gatunków roślin, które cieszą się obecnie zwiększonym
zainteresowaniem jest dereń jadalny
[K
AWECKI
,
B
IENIEK
2005].
Gatunek ten znany jest od
dawna, wg źródeł archeologicznych ślady derenia sprzed 10 000 lat p.n.e. znaleziono w
pobliżu Urfy, na południu Turcji. W stanie naturalnym występuje w środkowej i
południowej Europie, na Kaukazie oraz w zachodniej Azji
[S
ENETA
1973].
Dereń jest dobrze przystosowany do niekorzystnych warunków środowiska
i jednocześnie mało podatny na choroby i szkodniki. Odporny na niskie temperatury,
polecany jest na wilgotne, żyzne gleby, stanowiska słoneczne. Nadaje się na szpalery i
ż
ywopłoty, jest miododajną rośliną, a drewno jest wykorzystywane w tokarstwie.
Owoce derenia jadalnego mogą być czerwone, różowe lub żółte, okrągłego lub
wydłużonego kształtu. Średnia masa owocu waha się od 5-8 gramów. Pestka stanowi od
7,5 do 11,0% całkowitej masy owocu
[S
ENETA
1973]
. Owoce odznaczają się wysokimi
właściwościami leczniczymi i dietetycznymi
[G
ÜLÇIN
i in. 2005].
Zawartość cukrów
wynosi od 8,0 do 1,0%, kwasów organicznych od 1,3 do 1,9%, witaminy C waha się od
101 to 193 mg%. W skórce owoców zawartość antocyjanów wynosi od 670 do 850
mg%, podczas gdy w miąższu od 36 do 121 mg%. Wśród antocyjanów przeważa
cyjanidino-3-glukozyd, którego zawartość wynosi 223 mg w 100 g św.m. owocu
[P
ANTELIDIS
i in. 2007].
Owoce nadają się na różnego typu przetwory, dżemy, nalewki.
Znany także w medycynie ludowej dereń stosowany jest w celu obniżenia gorączki, a
ostatnie badania wykazały również jego aktywność antybiotyczną w odniesieniu do
bakterii: Staphylococcus aureus, Pseudomonas aeruginosa, Proteus vulgaris,
Micrococcus luteus
[D
ULGER
,
D
ONUZ
2004]
. Obecnie w wielu ośrodkach na świecie
prowadzone są systematyczne prace nad tworzeniem kolekcji, odbudową zasobów
genowych i selekcją wielkoowocowych odmian tego gatunku
[K
LIMIENKO
2004; E
RCÝSLÝ
2004; G
ÜLERYÜZ
i in. 1998].
Rozmnażanie generatywne derenia, podobnie jak innych gatunków drzew
i krzewów owocowych, napotyka na duże trudności. Kiełkowanie nasion derenia po
samoistnym wysianiu następuje po 2 lub 3 latach, a otrzymane w ten sposób rośliny
zaczynają owocować dopiero po 20 latach. Przyczyną niekiełkowania nasion wielu
gatunków roślin zaraz po zbiorze są czynniki fizyczne i fizjologiczne. Łupina nasienna
może być stwardniała i nie przepuszczać wody i gazów, może też zawierać inhibitory,
które hamują kiełkowanie nasion. Nasiona mogą cechować się fizjologicznym
bezwzględnym spoczynkiem wewnętrznym (płytkim, pośrednim lub głębokim). Ten
rodzaj spoczynku jest regulowany przez zarodek lub łupiny nasienne. Istnieją też

W. Lech i inni
152
nasiona o podwójnym spoczynku, powodowanym zarówno przez łupiny nasienne, jak i
zarodek. Chcąc zmusić nasiona do kiełkowania przeprowadza się odpowiednie zabiegi,
które przyspieszają kiełkowanie
[R
EJMAN
, M
AKOSZ
1995]
. Najczęściej jest to stratyfikacja
ciepło-zimna. Stosuje się również skaryfikację, traktowanie nasion gorącą wodą,
działanie środkami chemicznymi (gibereliny, cytokininy, etylen, azotan potasu,
tiomocznik). Traktowanie stężonym kwasem siarkowym (5 min) nasion Cornus
capitata zwiększyło procent kiełkujących nasion i znacznie skróciło czas kiełkowania
[A
IRI
i in. 2005].
W przypadku rozmnażania wegetatywnego derenia dobre efekty można uzyskać
przy wykorzystaniu sadzonek półzdrewniałych, wykonanych w drugiej połowie
czerwca, z zastosowaniem ukorzeniacza Rhizopon AA 1% lub 2% w podłożu z
mieszaniny torfu wysokiego i perlitu w stosunku objętościowym 1:1, pH w H
2
O - 5,0
[K
ORSZUN
,
K
OLASIŃSKI
2002].
Możliwa jest też okulizacja na siewkach derenia oczkami z
już owocujących drzew. Metoda ta często jest stosowana przy rozmnażaniu
szlachetnych odmian derenia.
Podejmowane są też próby zastosowania kultur sterylnych w rozmnażaniu
derenia. Metoda otrzymywania siewek derenia w krótkim czasie, dzięki przełamaniu
spoczynku nasion w warunkach in vitro mogłaby znaleźć zastosowanie w produkcji
szkółkarskiej. Prowadzone dotychczas badania wskazują, że warunki in vitro
umożliwiają przełamanie spoczynku i kiełkowanie nasion wielu gatunków roślin.
Głęboki spoczynek zarodkowy nasion jabłoni został przełamany i stymulacja
kiełkowania izolowanych zarodków następowała w wyniku krótkotrwałego traktowania
ich cyjanowodorem (1 mM, 6 godz.)
[B
OGATEK
i in. 1991].
Ostatnio stwierdzono, że w
regulacji kiełkowania nasion różnych gatunków roślin bierze udział tlenek azotu.
Zastosowanie donorów tlenku azotu (S-nitrozo-N-acetylopenicyloaminy oraz
nitroprusydku sodu) wywołuje efekt podobny jak użycie cyjanowodoru
[G
NIAZDOWSKA
,
B
OGATEK
2007].
Szczegółowo opisana technologia rozmnażania w warunkach in vitro może
znaleźć zastosowanie do otrzymywania wielkoowocowych odmian derenia, co
przyczyniłoby się do popularyzacji uprawy tego gatunku. Opracowano już metodykę
regeneracji całych roślin z pąków bocznych w kulturze siewek Cornus florida L.
[K
AVERIAPPA
i in. 1997]
, jak również somatyczną embriogenezę i kiełkowanie zarodków
somatycznych
[T
RIGIANO
i in. 1989]
. Przykładem odmiany derenia jadalnego, dla której
została opracowana metodyka rozmnażania z wykorzystaniem kultur tkankowych, jest
odmiana ‘Macrocarpa’
[Ď
URKOVIČ
2008].
Materiał i metody
Kiełkowanie nasion derenia jadalnego na pożywkach w warunkach in vitro
Z dojrzałych owoców derenia typu lokalnego wydobywano pestki, z których
usunięto resztki miąższu. Bardzo twardy endokarp przecinano w poprzek ostrym
narzędziem, a następnie wydobywano ostrożnie nasiona. Nasiona poddano dezynfekcji
w 1% roztworze podchlorynu wapnia przez 5 min i kolejno kilkakrotnie przepłukano
wodą sterylną. Tak przygotowane nasiona wykładano na pożywki w celu pobudzenia
ich do kiełkowania. Zastosowano pożywki wykonane według składu mineralnego
pożywki
M
URASHIGE
i
S
KOOG
[1962].
Zestalone 0,6% agarem pożywki zawierały 3,0%
sacharozy oraz substancje wzrostowe o podanych kombinacjach i stężeniach (tab. 1).
Odczyn pożywki ustalono na poziomie pH=5,7.
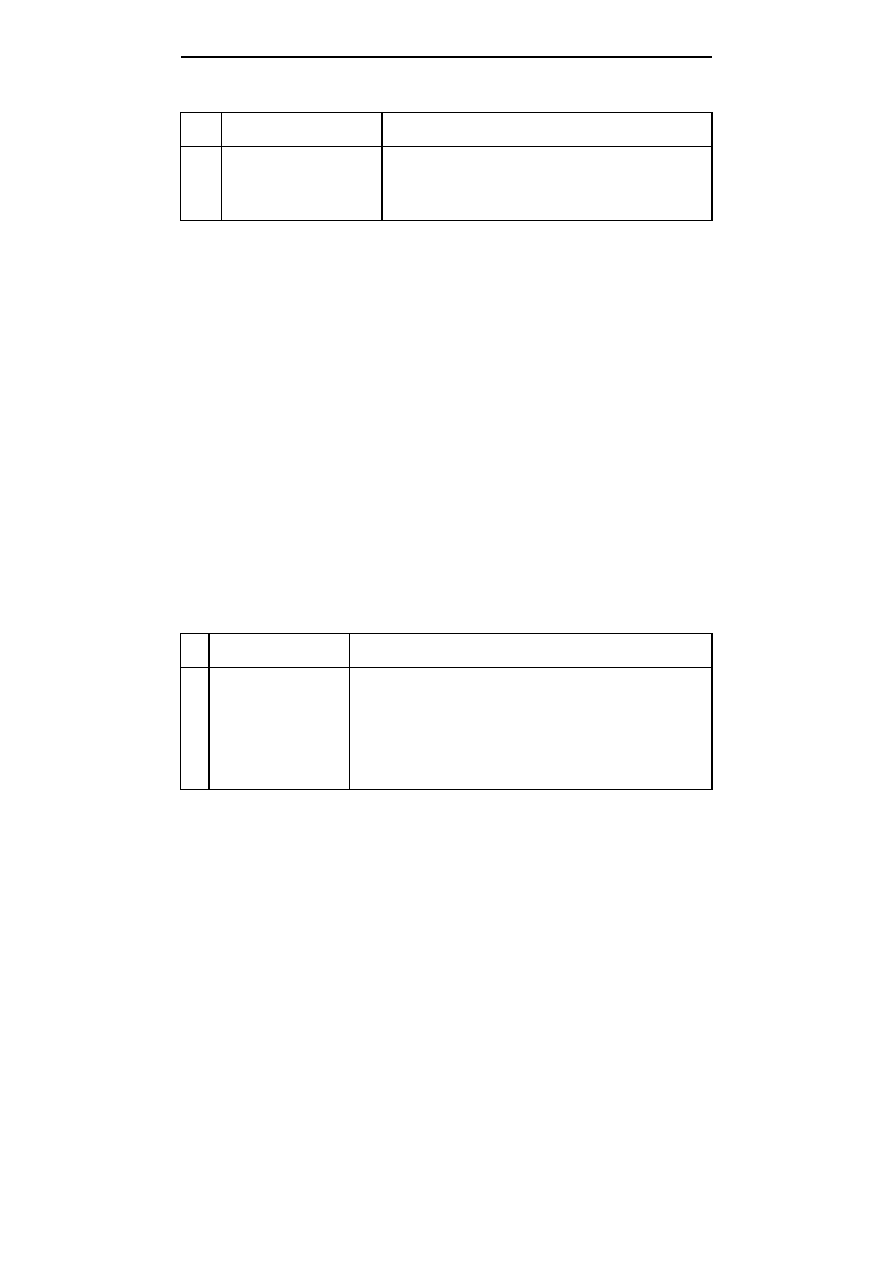
Tabela 1; Table 1
WYKORZYSTANIE METODY in vitro ...
153
Skład pożywek do kiełkowania nasion derenia
Media composition for germination of cornelian cherry seeds
Lp.
No.
Pożywka
Media
Rodzaj i stężenie substancji wzrostowych
Type and concentration of hormonal substances
1
Murashige i Skoog (1962)
Murashige and Skoog (1962)
0,2 mg
⋅
dm
-3
BA
2
0,2 mg
⋅
dm
-3
BA+0,5 mg
⋅
dm
-3
GA
3
3
0,2 mg
⋅
dm
-3
BA+5,0 mg
⋅
dm
-3
GA
3
Przy wykładaniu na pożywki zastosowano dwa sposoby traktowania nasion.
Część nasion wykładano z nietkniętą łupiną nasienną, a u części delikatnie łupinę
nacinano. Doświadczenie założono w czterech powtórzeniach, jedno powtórzenie
stanowiła jedna kolba, zawierająca cztery nasiona. Kolby z nasionami umieszczono w
fitotronie, w warunkach 16-godzinnego fotoperiodu przy oświetleniu 92,8
µ
mol
⋅
m
-2
⋅
s
-1
oraz w temperaturze 23 ±1
°
C. Obserwacje i pomiary prowadzone były po 7, 14, 21, 36
oraz 66 dniach od wyłożenia nasion na pożywki.
Kultura pąków derenia w warunkach in vitro
Kultury dwóch odmian derenia jadalnego ‘Devin‘ oraz ‘Titus’ założono
z pobranych jesienią oraz wiosną pąków kątowych. Po zdjęciu brązowych okryw pąki
poddano dezynfekcji, którą przeprowadzono według schematu: 70% alkohol - 1 min,
12% podchloryn wapnia - 10 min 3-krotne przemycie wodą sterylną, a następnie
krótkotrwałe przepłukanie 1% roztworem podchlorynu wapnia. Po dezynfekcji pąki
wyłożono na inicjującą pożywkę
M
URASHIGE
i S
KOOG
[1962]
z dodatkiem IBA w stężeniu
0,1 mg
⋅
dm
-3
oraz BA w stężeniu 1,0 mg dm
-3
. Po uzyskaniu stabilnej kultury założono
doświadczenie, mające na celu znalezienie właściwej pożywki namnażającej dla pędów
derenia. Na tym etapie doświadczenia wykorzystano pożywki sporządzone w oparciu o
skład pożywki
L
LOYD
i
M
C
C
OWN
[1980].
Skład badanych pożywek podano w tab. 2.
Tabela 2; Table 2
Skład pożywek do namnożenia pędów derenia jadalnego
Media composition for multiplication of cornelian cherry shoots
Lp.
No.
Pożywka
Media
Rodzaj i stężenie substancji wzrostowych
Type and concentration of hormonal substances
1
Lloyd i McCown (1980)
Lloyd and McCown (1980)
0,6 mg
⋅
dm
-3
BA+2% sacharozy; 0.6 mg
⋅
dm
-3
BA+2% saccharose
2
0,6 mg
⋅
dm
-3
BA+2% glukozy; 0.6 mg
⋅
dm
-3
BA+2% glucose
3
0,6 mg
⋅
dm
-3
BA+0,05 mg
⋅
dm
-3
IBA+2% sacharozy
0.6 mg
⋅
dm
-3
BA+0.05 mg
⋅
dm
-3
IBA+2% saccharose
4
0,6 mg
⋅
dm
-3
BA+0,05 mg
⋅
dm
-3
IBA+2% glukozy
0.6 mg
⋅
dm
-3
BA+0.05 mg
⋅
dm
-3
IBA+2% glucose
Odczyn pożywek ustalono na poziomie pH=5,7; pożywki zestalono 0,6% agarem.
Kolby z pędami utrzymywano w warunkach fotoperiodu 16 h/8 h, dzień/noc przy
oświetleniu 92,8
µ
mol
⋅
m
-2
⋅
s
-1
oraz w temperaturze 23 ±1
°
C. Obserwacje i pomiary
przeprowadzono pod koniec każdego z czterech pasaży, wykonywanych w
czterotygodniowych odstępach. Doświadczenie założono w pięciu powtórzeniach
(kolbach), w kolbie wysadzano pięć sztuk pędów.
Wyniki uzyskane w kolejnych etapach doświadczenia poddane zostały obli-
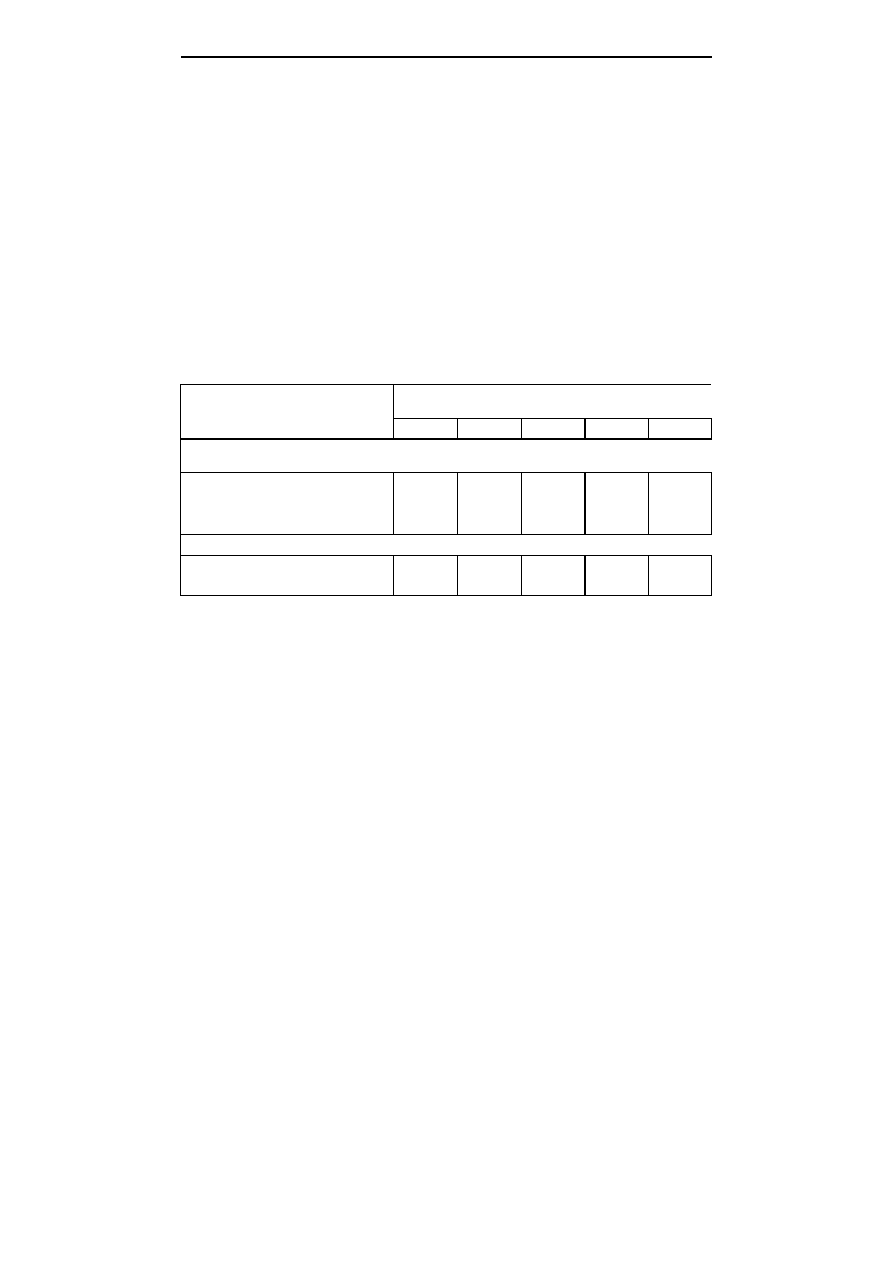
W. Lech i inni
154
czeniom statystycznym w oparciu o analizę wariancji, z uwzględnieniem wielokrotnego
testu Duncana przy poziomie prawdopodobieństwa
α
=0,05.
Wyniki i dyskusja
Kiełkowanie nasion derenia jadalnego na pożywkach w warunkach in vitro
Ś
rednie wymiary nasion wykładanych na pożywki wynosiły 1,06 cm
×
0,3 cm.
Stwierdzono, że w zależności od wielkości pestki znajdowało się w niej 1-3 nasion. Po
siedmiu dniach od wyłożenia nasion na pożywki zaobserwowano różnice w tempie
kiełkowania zarodków, w zależności od rodzaju pożywki oraz sposobu traktowania
nasion (tab. 3).
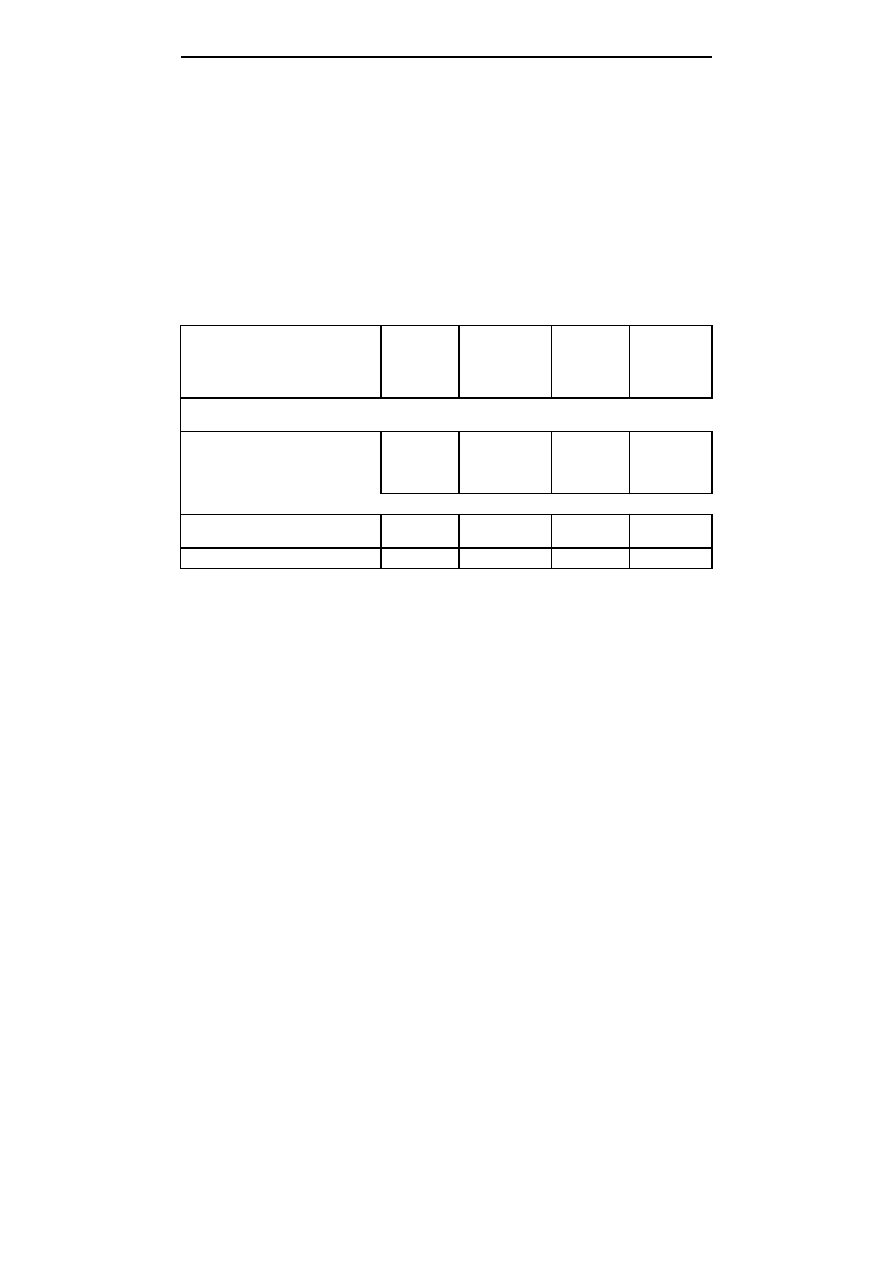
Tabela 3; Table 3
Procent kiełkujących nasion derenia jadalnego z naciętą i nienaciętą okrywą nasienną
po 7, 14, 21, 36 oraz 66 dniach od wyłożenia na pożywki
Percent of germinating cornelian cherry seeds with cut and non-cut coat 7, 14, 21, 36, 66 days
after placing on the media
Obiekt
Object
Dni od wyłożenia nasion na pożywki
Days after placing of seeds on the media
7
14
21
36
66
Rodzaj i stężenie substancji wzrostowych w pożywce
Type and concentration of hormonal substances
0,2 mg
⋅
dm
-3
BA
14,6 b
14,6 a
19,6 a
22,2 a
28,8 a
0,2 mg
⋅
dm
-3
BA+0,5 mg
⋅
dm
-3
GA
3
12,4 b
14,6 a
37,1 a
59,8 b
60,0 b
0,2 mg
⋅
dm
-3
BA+5,0 mg
⋅
dm
-3
GA
3
0,4 a
22,2 a
30,9 a
77,8 b
80,0 b
Sposób traktowania nasion; Method od seed treatment
Okrywa nienacięta; Non-cut seed coat
0,2 a
0,8 a
10,3 a
21,3 a
28,8 a
Okrywa nacięta; Cut seed coat
23,1 b
47,8 b
52,2 b
75,8 b
82,0 b
ś
rednie oznaczone tymi samymi literami nie różnią się statystycznie przy
α
=0,05; means followed by the
same letters do not differ at
α
=0.05
Nacięcie łupiny nasiennej spowodowało szybsze kiełkowanie zarodków na
pożywce z mniejszą zawartością gibereliny oraz na pożywce bez tego hormonu. Na
pożywce z dodatkiem gibereliny w stężeniu 5,0 mg
⋅
dm
-3
kiełkowanie zarodków z
nasion z naciętą łupiną zaobserwowano po dalszych siedmiu dniach kultury. Po trzech
tygodniach od założenia doświadczenia odnotowano kiełkowanie zarodków na
wszystkich pożywkach dla obydwu sposobów traktowania nasion, z tym, że w
przypadku nasion z naciętą łupiną procent kiełkujących nasion był istotnie wyższy
(52,2%) w porównaniu do nasion z łupiną nienaciętą (10,3%). Po przeszło dwóch
miesiącach trwania doświadczenia stwierdzono, że zarówno nacięcie łupiny, jak i
dodatek gibereliny do pożywki przyczyniło się do statystycznie większej liczby
kiełkujących zarodków. Nasiona, które zostały położone bez nacinania łupiny na
pożywkę pozbawioną gibereliny po dwóch miesiącach doświadczenia zamarły. W
efekcie stwierdzono, że dodatek gibereliny do pożywek istotnie wpłynął na procent
kiełkujących nasion, niezależnie od zastosowanego stężenia gibereliny.
Spostrzeżenia dokonane w przeprowadzonym doświadczeniu, a dotyczące
korzystnego wpływu gibereliny na kiełkowanie zarodka, są zgodne z sugestiami
WYKORZYSTANIE METODY in vitro ...
155
B
EWLEY
’
A
[1997]
, który szeroko omawia znaczenie i rolę, jaką odgrywają gibereliny w
przełamywaniu spoczynku nasion. Wydaje się, że gibereliny nie są samodzielnie
zaangażowane w kontrolę spoczynku nasion, ale odgrywają ważną rolę w podtrzymaniu
kiełkowania i działają w chwili, gdy spoczynek nasion powodowany przez ABA zostaje
przełamany. Współdziałanie ABA oraz giberelin może być wzajemnie powiązane, o
czym świadczy fakt, że w mutantach Arabidopsis aba oraz do2, obniżonemu
spoczynkowi nasion towarzyszy niższe zapotrzebowanie na gibereliny do kiełkowania
[L
ÉON
-K
LOOSTERZIEL
i in.
1996]
.
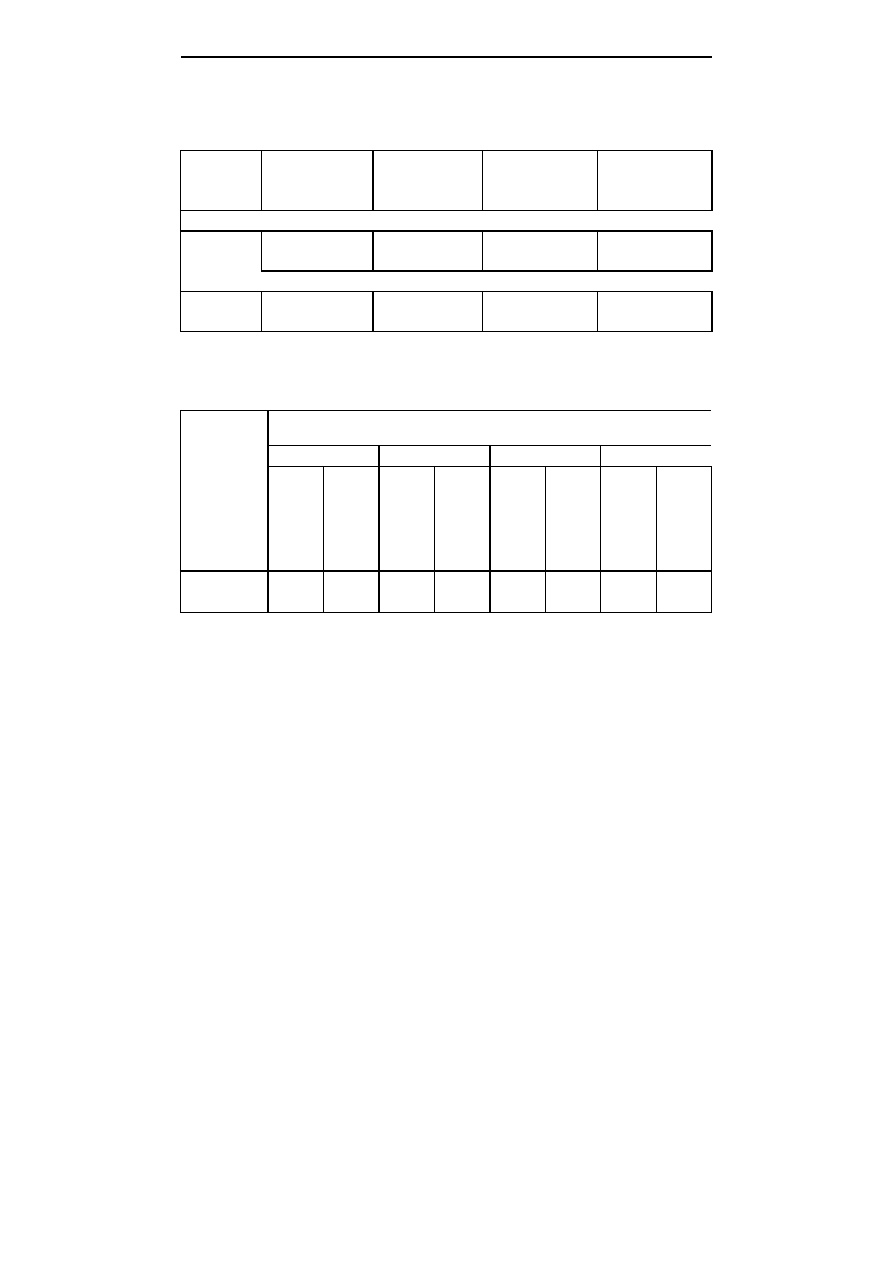
Tabela 4; Table 4
Cechy morfologiczne siewek derenia jadalnego uzyskanych po 66 dniach od wyłożenia nasion na
pożywki w warunkach in vitro
Morphological features of cornelian cherry seedlings obtained 66 days after placing
the seeds on the media in in vitro conditions
Obiekt
Object
Wysokość
siewek (cm)
Height of
seedling (cm)
Długość korzenia
siewek (cm)
Length of seed-
ling root (cm)
Szerokość
liścia siewek
(cm); Width
of seedling
leaf (cm)
Długość liścia
siewek (cm)
Length of seed-
ling leaf (cm)
Rodzaj i stężenie substancji wzrostowych w pożywce
Type and concentration of hormonal substances
0,2 mg
⋅
dm
-3
BA
2,4 a
0,3 a
0,6 n.s.
2,8 a
0,2 mg
⋅
dm
-3
BA+0,5 mg
⋅
dm
-3
GA
3
5,8 b
0,5 a
1,1 n.s.
5,4 ab
0,2 mg
⋅
dm
-3
BA+5,0 mg
⋅
dm
-3
GA
3
6,9 b
3,0 b
1,5 n.s.
7,9 b
Sposób traktowania nasion; Methods of seed treatment
Okrywa nienacięta
Non-cut seed coat
2,5 a
0,7 a
0,9 n.s.
4,2 a
Okrywa nacięta; Cut seed coat
7,7 b
1,9 b
1,2 n.s.
6,5 a
n.s.
zróżnicowanie nieistotne przy
α
=0,05; differentiation non-significant at
α
=0.05
ś
rednie oznaczone tymi samymi literami nie różnią się statystycznie przy
α
=0,05; means followed by the
same letters do not differ at
α
=0.05
Stwierdzono istotne zróżnicowanie w wysokości siewek uzyskanych z nasion z
nienaciętą i naciętą łupiną nasienną (tab. 4). Średnia wysokość siewek otrzymanych z
tych ostatnich nasion wynosiła 7,7 cm, podczas gdy średnia wysokość siewek z nasion,
na których łupina nie została nacięta - 2,5 cm. Na pożywkach zawierających giberelinę
uzyskane siewki cechowały się istotnie większą wysokością w porównaniu do siewek z
nasion wyłożonych na pożywkę bez gibereliny.
Również w długości korzeni siewek stwierdzono istotne zróżnicowanie na
korzyść siewek z nasion z naciętą łupiną (średnia długość korzenia wynosiła 1,9 cm)
oraz pożywki, zawierającej giberelinę w stężeniu 5,0 mg
⋅
dm
-3
(średnia długość korzenia
wynosiła 3,0 cm). Po dwóch miesiącach kultury siewki wytworzyły średnio 5-6 liści.
Liście siewek z pożywek zawierających giberelinę odznaczały się statystycznie większą
długością, ale nie różniły się pod względem szerokości (tab. 4).
Kultury pąków derenia w warunkach in vitro
Wyniki dotyczące skuteczności zabiegu dezynfekcji pąków kątowych dwóch
odmian derenia jadalnego ‘Devin’ i ‘Titus’ zamieszczono w tabeli 5.
W. Lech i inni
156
Tabela 5; Table 5
Efektywność zabiegu odkażania pąków kątowych derenia jadalnego
Effectiveness of cornelian cherry axial buds sterilization
Obiekt
Object
Liczba pąków
poddanych odka-
ż
aniu; Number of
sterilized buds
Procent pąków
zakażonych
Percent of infected
buds
Procent pąków
zamarłych
Percent of dead buds
Procent pąków
ż
ywych
Percent of survived
buds
Termin pobrania pąków - jesień; Time of bud collecting - Autumn
Devin
24
41,7
41,6
16,7
Titus
33
6,1
84,8
9,1
Termin pobrania pąków - wiosna; Time of bud collecting - Spring
Devin
43
0
79,1
20,9
Titus
44
0
79,5
20,5
Tabela 6; Table 6
Liczba oraz długość pędu dwóch odmian derenia jadalnego
Number and length of two cultivars cornelian cherry shoots
Obiekt
Object
Pożywki wg tabeli 2; Media according to Table 2.
1
2
3
4
ś
rednia
liczba
pędów
mean
number
of shoots
ś
rednia
długość
pędu
mean
length of
shoot
(cm)
ś
rednia
liczba
pędów
mean
number
of shoots
ś
rednia
długość
pędu
mean
length of
shoot
(cm)
ś
rednia
liczba
pędów
mean
number
of shoots
ś
rednia
długość
pędu
mean
length of
shoot
(cm)
ś
rednia
liczba
pędów
mean
number
of shoots
ś
rednia
długość
pędu
mean
length of
shoot
(cm)
Devin
3,8 a
2,6 a
4,0 a
2,6 a
4,3 ab
2,8 ab
4,8 b
3,1 b
Titus
4,6 b
2,8 a
4,7 b
2,7 a
4,3 ab
2,9 ab
3,8 a
2,7 a
ś
rednie oznaczone tymi samymi literami nie różnią się statystycznie przy
α
=0,05; means followed by the
same letters do not differ at
α
=0.05
Spośród dwóch terminów pobierania pąków i zakładania kultury derenia,
korzystniejszym okazał się termin wiosenny, ze względu na większy procent uzys-
kanych żywych i zdrowych pąków odmiany ‘Devin’ (20,9%) oraz odmiany ‘Titus’
(20,5%), (tab. 5).
W etapie namnażania odmiany różniły się współczynnikiem namnożenia pędów
oraz reakcją na składy pożywek (tab. 6).
Odmiana ‘Titus’ cechowała się wyższym współczynnikiem namnażania pędów
na pożywkach nr 1 i 2, w porównaniu do odmiany ’Devin’. Współczynniki namnożenia
pędów odmiany ‘Titus’ wynosiły 1:4,6 na pożywce nr 1 oraz 1:4,7 na pożywce nr 2
(tab. 6). Na pożywce nr 3 współczynniki namnożenia obu odmian były jednakowe,
natomiast na pożywce nr 4 odmiana ‘Devin’ cechowała się istotnie większą liczbą
wytworzonych pędów. Uzyskane wyniki wskazują, że brak w pożywce auksyny
wywiera korzystny wpływ na zdolność pobudzania pąków kątowych odmiany ‘Titus’
do wybijania w nowe pędy, natomiast dla odmiany ‘Devin’ dodatek do pożywek
auksyny był korzystny.
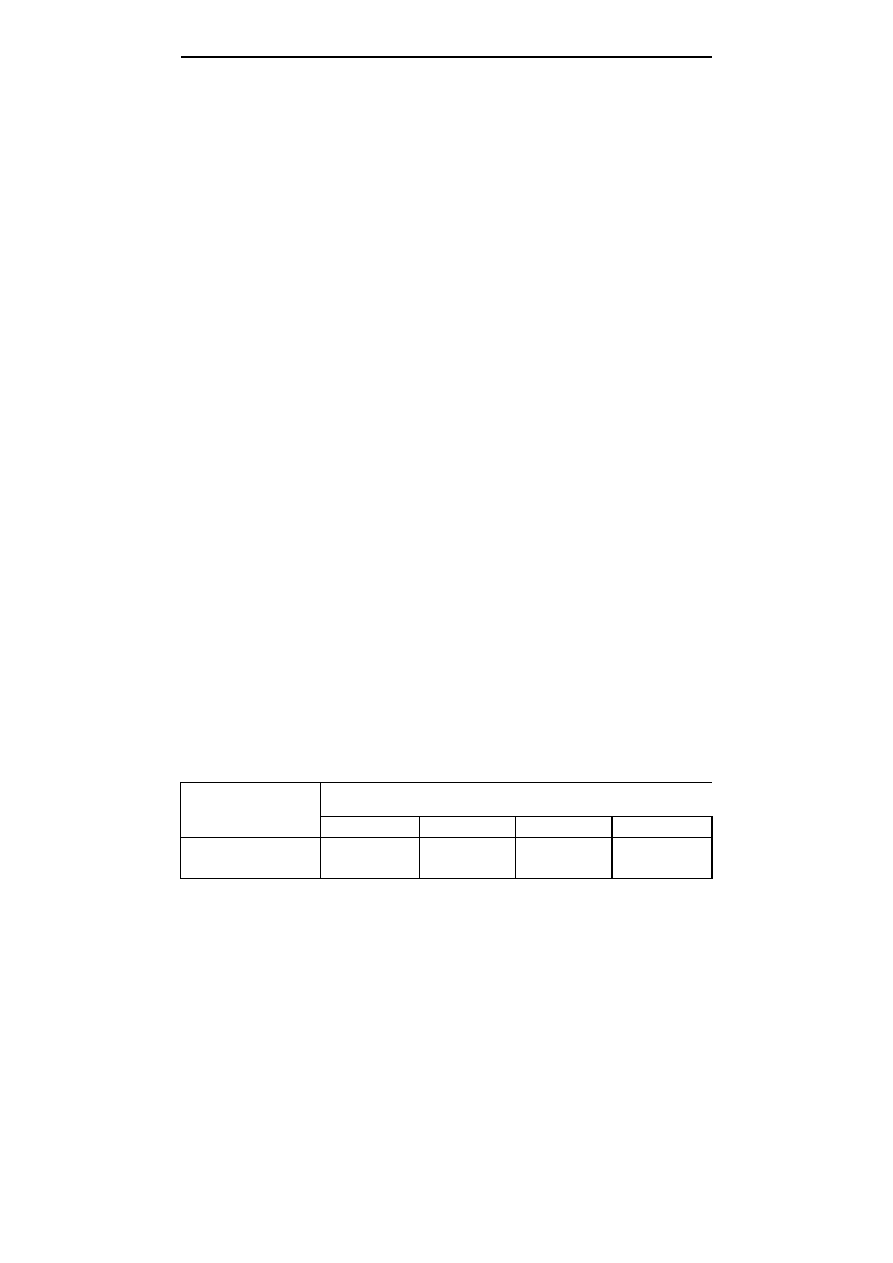
WYKORZYSTANIE METODY in vitro ...
157
W badaniach
Ď
URKOVIČ
[2008]
dotyczących derenia jadalnego odmiany
‘Macrocarpa’ za najbardziej przydatną uznano pożywkę
L
LOYD
i
M
C
C
OWN
[1980]
.
Kombinacja cytokininy BA w stężeniu 0,7 mg
⋅
dm
-3
oraz auksyny NAA w stężeniu 0,05
mg
⋅
dm
-3
okazała się najkorzystniejszą biorąc pod uwagę wysoki współczynnik
namnażania pędów wynoszący 1: 6,2, przy średniej długości pędów 1,55 cm. Tak
wysoki współczynnik namnożenia jest zadowalający i z punktu widzenia opłacalności
produkcji uzasadnia celowość tego rodzaju badań.
E
DSON
i in.
[1994]
przy namnażaniu
derenia ‘Ascona’
(Cornus nuttallii Audubon)
na pożywce
L
LOYD
i
M
C
C
OWN
[1980]
uzyskał współczynnik namnożenia pędów 3,1 w
obecności w pożywce cytokininy BA w stężeniu 1,0 mg
⋅
dm
-3
. W namnażaniu Cornus
florida spośród stosowanych siedmiu pożywek o różnym składzie mineralnym
najkorzystniejszą okazała się pożywka
L
LOYD
i M
C
C
OWN
[1980]
z dodatkiem BA w
stężeniu 0,5 mg
⋅
dm
-3
oraz IBA w stężeniu 1,0 mg
⋅
dm
-3
[D
ECLERCK
, K
ORBAN
1994].
W
innych badaniach dotyczących tego gatunku wysoki współczynnik namnożenia pędów
wynoszący od 1:5,5 do 1:6,0 został osiągnięty po zastosowaniu cytokininy BA w
stężeniu 1,0 mg
⋅
dm
-3
[K
AVERIAPPA
i in. 1997].
W przeprowadzonych badaniach rodzaj zastosowanego cukru (sacharoza,
glukoza) nie wywarł znaczącego wpływu na współczynnik namnożenia ani na długość
pędów (tab. 6).
Obserwacje te są zgodne z wynikami innych autorów
[B
ORKOWSKA
i in. 1994]
,
którzy wykazali dla wiśni odmiany ‘Łutówka’ podobny wzrost kultur pędowych na
pożywce z sacharozą lub glukozą. Ci sami autorzy wykazali, że 2% stężenie cukru w
pożywce, niezależnie od rodzaju tego cukru, zabezpiecza zapotrzebowanie tkanek
roślinnych na źródło energii i tworzenie biomasy. Dodatkowa jednoprocentowa
zawartość cukru (w przypadku najczęściej stosowanego 3% stężenia cukru w pożywce)
jest zużytkowywana na regulację ciśnienia osmotycznego. Również dla kilku odmian
ż
urawiny i brusznicy wykazano korzystny wpływ 2% stężenia sacharozy w pożywce, ze
względu na efektywność namnażania pędów
[D
EBNATH
2005].
Wyniki dotyczące długości pędów były porównywalne dla obydwu odmian
derenia na pożywkach nr 1, 2 oraz 3 i jedynie na pożywce nr 4 pędy odmiany ‘Devin’
były statystycznie dłuższe (3,1 cm) w porównaniu do odmiany ‘Titus’ (2,7 cm), (tab. 6).
W prezentowanych badaniach duży problem stanowiło występowanie objawów
„szklistości pędów” (tab. 7).
W najniższym nasileniu to zaburzenie fizjologiczne odnotowano na pożywce nr 1
dla obydwu odmian (43,1% szklistych pędów odmiany ’Devin’ i 49,0% szklistych
pędów odmiany ‘Titus’) oraz na pożywce nr 4 dla odmiany ‘Devin’ (44,0% szklistych
pędów), (tab. 7).
Tabela 7; Table 7
Procent pędów szklistych dwóch odmian derenia jadalnego
Percent of cornelian cherry vitrified shoots
Obiekt
Object
Pożywki wg tabeli 2
Media according to Table 2
1
2
3
4
Devin
43,1
80,0
67,4
44,0
Titus
49,0
68,2
66,7
62,1
Prawdopodobną przyczyną tego zjawiska mógł być zbyt niski odczyn pożywki

W. Lech i inni
158
wynoszący pH=5,7-5,8.
Ď
URKOVIČ
[2008]
w swoich badaniach nad odmianą
‘Macrocarpa’ uzyskał bardzo korzystny współczynnik namnożenia pędów wynoszący
1:6,6 po podniesieniu odczynu pożywki do poziomu pH=6,2. Autor ten nie podaje
ż
adnych informacji o występowaniu szklistości pędów.
Tabela 8; Table 8
Procent i wielkość kalusa u podstawy pędów derenia
Percent and size of callus at the base of cornelian cherry shoots
Obiekt
Object
Pożywki wg tabeli 2
Media according to Table 2
1
2
3
4
a
b
c
a
b
c
a
b
c
a
b
c
Devin
69,5
26,3
4,2
85,0
15,0
0
75,8
22,1
2,1
78,9
20,0
1,1
Titus
67,8
23,4
8,8
60,0
34,2
5,8
71,6
23,1
5,3
67,4
24,2
8,4
Wielkość tkanki kalusa według skali, gdzie: a=
∅
1-2 mm, b=
∅
3-5 mm, c=
∅
6 mm i więcej; Size of callus
according to scale, where: a=
∅
1-2 mm, b=
∅
3-5 mm, c=
∅
6 mm and more
W trakcie namnażania obserwowano dużą skłonność odmiany ‘Titus’ do
tworzenia na wszystkich pożywkach u podstawy pędów dużej masy kalusa (tab. 8).
Obecność obfitej tkanki kalusa często jest przyczyną pojawiania się pędów
przybyszowych z niezorganizowanej tkanki kalusa lub z liści, które mają bezpośredni
kontakt z pożywką. O tym ostatnim zjawisku donosi w swojej pracy
Ď
URKOVIČ
[2008].
Zagadnienie powstawania pędów przybyszowych oraz konsekwencje tego zjawiska w
przypadku borówki wysokiej zostały szeroko i dogłębnie omówione przez
L
ITWIŃCZUKA
[2007].
Autor wskazuje, jak przebiega indukowanie tego typu niepożądanych pędów
oraz jakie związki hormonalne dodawane do pożywek stymulują ten proces. Podkreśla
znaczenie prawidłowo przeprowadzanej analizy i eliminacji pędów przybyszowych w
trakcie procesu namnażania, aby uniknąć wprowadzania ich do dalszych etapów
produkcji roślin.
Wnioski
1.
Nacięcie łupiny nasiennej oraz dodanie gibereliny w stężeniu 0,5 lub 5,0 mg
⋅
dm
-3
przełamuje spoczynek bezwzględny nasion derenia jadalnego i ułatwia
kiełkowanie.
2.
Pożywka Lloyd i McCown (1980) z dodatkiem BA w stężeniu 0,6 mg
⋅
dm
-3
indukuje namnażanie pędów derenia jadalnego w zadowalającym stopniu.
Literatura
A
IRI
S.,
R
AWAL
R.S.,
D
HAR
U. 2005.
Presowing treatment effects on germination of Cor-
nus capitata seeds. Seed Sci. and Technol. 33(1): 77-86.
B
EWLEY
J.D. 1997.
Seed germination and dormancy. The Plant Cell 9: 1055-1066.
B
OGATEK
R.,
D
ZIEWANOWSKA
K.,
L
EWAK
S. 1991.
Hydrogen cyanide and embryonal dor-
mancy in apple seeds. Physiol. Plant. 83: 417-421.

WYKORZYSTANIE METODY in vitro ...
159
B
ORKOWSKA
B.,
S
ZCZERBA
J.,
K
UBIK
M. 1994.
Gospodarka cukrami w kulturach pędowych
wiśni odm. Łutówka. I Ogólnopolska Konferencja „Zastosowanie kultur in vitro w
fizjologii roślin”. Kraków, 15-17 XII 1994: 11-17.
D
EBNATH
S.C. 2005.
Effect of carbon source and concentration on development of
lingonberry (Vaccinium vitis-idea L.) shoots cultivated in vitro from nodal explants. In
Vitro Cell. and Develop. Biol. Plant 41(2): 145-150.
D
ECLERCK
V.,
K
ORBAN
S.S. 1994.
Effects of source of macronutrients and plant growth
regulator concentrations on shoot proliferation of Cornus florida. Plant Cell, Tiss. and
Organ Cult. 38: 57-60.
D
ULGER
B.,
D
ONUZ
A. 2004.
Antimicrobial activity of some Turkish medicinal plants.
Pakistan J. of Biol. Sci. 7(9): 1559-1562.
Ď
URKOVIČ
J. 2008.
Micropropagation of mature Cornus mas ‘Macrocarpa’. Trees 22:
597-602.
E
DSON
J.L.,
W
ENNY
D.L.,
L
EEGE
-B
RUVEN
A.
1994.
Micropropagation of Pacific dogwood
Hort Science 29(11): 1231-1246.
E
RCÝSLÝ
S. 2004.
Cornelian cherry germplasm resources of Turkey. J. Fruit Ornam.
Plant Res. 92 Special ed. vol. 12: 87-92.
G
NIAZDOWSKA
A.,
B
OGATEK
R. 2007.
Regulacyjna rola tlenku azotu w kiełkowaniu na-
sion. Post. Biol. Kom. 34(3): 431-443.
G
ÜLÇIN
I.,
B
EYDEMIR
S.,
Ş
AT
G.,
K
ÜFREVIO
_
LU
Ö.I. 2005.
.
Evaluation of antioxidant activity
of cornelian cherry (Cornus mas L.). Acta Alimentaria 34: 193-202.
G
ÜLERYÜZ
M.,
B
OLAT
I.,
P
IRLAK
L. 1998.
Selection of table cornelian cherry (Cornus mas
L.) types in Çoruhv Valley. Tr. J. of Agriculture and Forestry 22: 357-364.
K
AVERIAPPA
K.M.,
P
HILLIPS
L.M.,
T
RIGIANO
R.N.
1997.
Micropropagation of flowering
dogwood (Comus florida) from seedlings. Plant Cell Reports 16: 485-489.
K
AWECKI
Z.,
B
IENIEK
A.
2005.
Cornelian cherry (Cornus mas L.) as a perspective or-
chard and ornamental plant. Zesz. Probl. Post. Nauk Rol. 507: 263-267.
K
LIMIENKO
S. 2004.
The cornelian cherry (Cornus mas L.): collection, preservation and
utilization of genetic resources. J. Fruit Ornam. Plant Res. 98 Special ed. 12: 93-98.
K
ORSZUN
S.,
K
OLASIŃSKI
M. 2002.
Alternatywna technologia rozmnażania derenia ja-
dalnego (Cornus mas L). Biulet. Ogrod. Botan. 11: 51-56.
L
ÉON
-K
LOOSTERZIEL
K.M.,
V
AN DE
B
UNT
G.A.,
Z
EEVAART
J.A.D.,
K
OORNNEEF
M. 1996.
Arabidopsis mutants with reduced seed dormancy. Plant Physiol. 110: 233-240.
L
ITWIŃCZUK
W. 2007.
Rozmnażanie borówki wysokiej (Vaccinium corymbosum L.)
w kulturach in vitro. Wpływ mikrorozmnażania na wzrost i owocowanie krzewów.
Wydaw. Uniw. Rzeszowskiego, Rzeszów 2007. ISBN 978-83-7338-294-4.
L
LOYD
G.,
M
C
C
OWN
B. 1980.
Commercially feasible micropropagation of mountain
laurel Kalmia latifolia, by use of shoot-tip culture. Proc. Int. Plant. Prop. Soc. 30:
421-427.
M
URASHIGE
T.,
S
KOOG
F. 1962.
A revised medium for rapid growth and bioassays with
tobacco tissue cultures. Physiol. Plant. 15: 473-497.
P
ANTELIDIS
G.E.,
V
ASILAKAKIS
M.,
M
ANGANARIS
G.A,
D
IAMANTIDIS
G
R
. 2007.
Antioxidant
capacity, phenol, anthocyanin and ascorbic acid contents in raspberries, blackberries,
red currants, gooseberries and cornelian cherries. Food Chemistry 102(3): 777-783.
R
EJMAN
A.,
M
AKOSZ
E.
1995.
Szkółkarstwo roślin sadowniczych. Plantpress, Kraków:
89-92.

W. Lech i inni
160
S
ENETA
W. 1973.
Dendrologia. PWN, Warszawa: 431-436.
T
RIGIANO
R.N.,
B
EATY
R.M.,
D
IETRICH
J.T. 1989.
Somatic embryogenesis and plantlet
regeneration in Cornus florida. Plant Cell Rep. 8: 270-273.
Słowa kluczowe:
giberelina, kultury in vitro, skaryfikacja, spoczynek nasion,
współczynnik namnożenia
Streszczenie
Metodę kultur tkankowych wykorzystano w generatywnym i wegetatywnym
namnażaniu derenia jadalnego. Poprzez wyłożenie nasion na pożywki i zastosowanie
nacięcia łupiny nasiennej oraz dodanie gibereliny w stężeniu 0,5 lub 5,0 mg
⋅
dm
-3
do
pożywek przełamano spoczynek bezwzględny nasion. Po okresie dwóch miesięcy
uzyskano prawidłowo wykształcone siewki derenia. Na podstawie założonej kultury
odmian derenia ‘Devin’ oraz ‘Titus’ oceniono możliwość namnażania pędów derenia w
warunkach sterylnych. Uzyskano zadowalający współczynnik namnażania pędów,
wynoszący od 1:3,8 do 1:4,8; średnia długość pędu wahała się od 2,6 do 3,1 cm w
zależności od odmiany i pożywki.
APPLYING OF in vitro METHOD IN GENERATIVE
AND VEGETATIVE PROPAGATION
OF CORNELIAN CHERRY (Cornus mas L.)
Włodzimierz Lech, Ewa Dziedzic, Monika Bieniasz, Roman Rduch
Department of Pomology and Apiculture, Agricultural University, Kraków
Key words:
seed dormancy, in vitro culture, index of multiplication, ‘Devin’,
‘Titus’
Summary
In vitro method was applyed in generative and vegetative propagation of
cornelian cherry. Breaking of the seed dormancy was achieved after a gentle cut of seed
coat and the addition of GA
3
at the concentration of 0.5 lub 5.0 mg
⋅
dm
-3
into the me-
dium. After two months of culture the regular developed seedlings were obtained. The
shoot culture of two cornelian cherry cultivars ‘Devin’ and ‘Titus’ was established in in
vitro conditions. The multiplication index ranged from 1:3.8 to 1:4.8; mean length of
shoots ranged from 2.6 to 3.1 cm depending on the cultivar and medium.
Dr inż. Ewa Dziedzic
Katedra Sadownictwa i Pszczelnictwa
Wydział Ogrodniczy
Uniwersytet Rolniczy im. H. Kołłątaja
al. A. Mickiewicza 21
31-120 KRAKÓW
e-mail: ewa@ogr.ar.krakow.pl
Wyszukiwarka
Podobne podstrony:
In vitro truskawka id 212540 Nieznany
In vitro truskawka id 212540 Nieznany
Instytut In id 217912 Nieznany
In N13 id 212524 Nieznany
736 Home in the woods id 35845 Nieznany (2)
NLP in 10 minutes id 320418 Nieznany
Senator PO z Podhala in vitro t Nieznany
outdoor ed in Norway id 342686 Nieznany
cw 1 in ster id 121450 Nieznany
men masculinity in Iran id 2931 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
więcej podobnych podstron